过渡金属cu_肉桂酸盐的合成及应用
肉桂酸合成方法研究进展

肉桂酸合成方法研究进展I. 引言- 被广泛应用于医药、食品、香料等领域的肉桂酸- 简要介绍肉桂酸的化学性质和应用价值- 引出肉桂酸的合成方法研究的重要性和意义II. 常见合成方法- 总体介绍肉桂酸的合成方法- 分别列举阐述酰基化反应、热解反应、氧化反应等常见肉桂酸合成方法的原理和步骤- 总结常见合成方法的优缺点和局限性III. 新型合成方法- 介绍近年来发展出的新型肉桂酸合成方法- 包括微波辐射法、溶胶-凝胶法、电化学法等- 详细阐述新型方法的原理、实验流程和优点IV. 研究进展- 针对前述合成方法提供了相关实验结果的文献进行有针对性的分析和比较- 分析目前肉桂酸合成方法的主要研究方向和趋势- 对未来肉桂酸合成方法研究方向的展望V. 结论- 通过对肉桂酸合成方法的介绍和分析,对目前研究现状进行归纳总结- 此外,对肉桂酸合成方法研究的未来和应用前景进行探讨- 最后,强调肉桂酸合成方法研究在医药、食品、香料等领域的重要性并提出未来研究的重点和建议。
肉桂酸是一种重要的天然香料和具有重要生物学活性的的有机分子,广泛应用于医药、食品、日化、化妆品等领域。
它在食品、香水、肥皂、抖音抖一抖等多种领域都有广泛的应用。
对于肉桂酸合成方法研究的开展,不仅可以提高人们对这种化合物的了解,同时也可以推进相关领域的发展和前进,为人类的健康和福祉提供保障。
目前,肉桂酸的合成已经成为人们研究的重要方向。
常见的合成方法包括:酰基化反应、热解反应、氧化反应等。
酰基化反应是一种常见的肉桂酸合成方法。
它基于苯甲酸和丙烯醛或丙烯酸酯的反应,利用Lewis酸来催化酯化反应,得到肉桂酸。
虽然这个方法操作简单,但是在收率方面普遍不高,且催化剂的毒性也让人担忧。
热解反应的误差在使用时,往往需要进行多次液-液和液-固分离等步骤,施工时间长且极易受到条件的限制。
氧化反应通过对苯丙辅酮并通过酸催化完成酮异构反应而得到. 肉桂酸,这个方法不仅高产,而且操作也相对简单,但是毒性较高不能用于生产生活中。
有机化学 16第16章_过渡金属π络合物及其在有机合成中的应用

催化活性:提高100 倍。
第十六章 过渡金属π配合 物及其在有机合成中的应用
(Theπcomplex of transition metal and its application in organic synthesis)
第一节 过渡金属元素的价电子层构型和成键特征 一、过渡金属元素价电子层构型 二、过渡金属配合物 第二节 过渡金属与不饱和烃形成的π 配合物 一、蔡塞盐 [PtCl3•CH2=CH2]二、其他不饱和烃π 配合物 第三节 夹心结构π 配合物 一、二茂铁 二、其他夹心结构的π 配合物 第四节 过渡金属π 配合物在有机合成中的应用 一、乙烯的催化氢化 二、乙烯氧化合成乙醛 三、丙烯的羰基化反应
总目录
3. 二茂铁的芳香性
总目录
二、其他夹心结构的π配合物
参与形成这类π 配合物的对称环状体系,原则 上只要符合休克尔规则(4n+2)的芳香环均可:
总目录
第四节 过渡金属π配合物在有机合成 中的应用
一、乙烯的催化氢化
H2与RhCl(PPh3)3进行加成,生成六配位的二氢 化物,然后它与乙烯配位而形成π 配合物,进而 重排,H转移到配位的乙烯上,变为乙基-铑配体, 随后发生还原-消除反应,另一个H迅速转移到乙 基上,得氢化产物CH3CH3,并再生RhCl(PPh3)3 配合物。
总目录
第二节 过渡金属与不饱和烃形成的 π 配合物
一、蔡塞盐
[PtCl3•CH2=CH2]-
Pt原子同三个Cl原子处在同 一平面,该平面与乙烯分子 的轴线相垂直; Pt与整个双键相连接,Pt与 双键的两个C原子之间的距 离相等,为0.214 nm。
总目录
乙烯π成键轨道和Pt的 dsp2杂化轨道(空)重叠 形成σ三中心配位键 Pt填充的dp杂化轨道与 对称性匹配的乙烯π*反 键轨道重叠形成π三中心 配位键(反馈键)
有机化学实验实验十一 肉桂酸的制备

羟醛缩合的作用,生成α, β-不饱和芳香酸的反应。
主反应:
CHO O CH3 C O CH3 C O
+
CHCHCOOH
+ CH3COOH
反应机理:
CO2 + H2O (CH3CO)2O + K2CO3
+ K CH2CO2COCH3 + H2CO3
O C6H5 C H OH OH
五、注意事项
1.控制火焰的大小至刚好回流,以防产生的泡沫冲至 冷能管,严重时发生凶险。
2 .实验后要洗净仪器,圆底烧瓶用热水洗净 , 因碳酸 钾(碱)对玻璃有腐蚀性。
六、成功关键
1.所用仪器、药品均需无水干燥,否则产率降低。
2.加料迅速,防止醋酸酐吸潮,加热回流时分解。
3. 重结晶时,活性碳用量0.15克左右,太多吸附产品。
三、物理常数
Name PhCHO (CH3CO)2O
M 106 102
d204 1.046 1.082
m.p.(℃) -26 -73
b.p. (℃) 179 139
SH2O 微溶 分解
PhCH=CHCO2H
148
1.245
133
300
热水溶,冷水 不溶
四、实验装置
反应装置
简易水蒸气蒸馏装置
也可采用这种简易水蒸气蒸馏装置
七、课后习题
1、若用苯甲醛与丙酸酐发生 Perkin 反应,其产物 是什么? 2、在实验中,如果原料苯甲醛中含有少量的苯甲酸, 这对实验结果会产生什么影响?应采取什么样的 措施? 3、水蒸气蒸馏的目的是为了除去什么组分?
4.本实验反应回流为什么用空气冷凝管?
实验十 肉桂酸的制备 (6学时)
肉桂酸的制备

肉桂酸的制备肉桂酸,化学式C9H8O2,是一种有机化合物,属于有机酸。
它具有香甜的香味,常用于食品调味和药物制剂中。
肉桂酸能够通过不同的方法进行制备,下面将介绍几种常见的制备方法。
1. 肉桂醛氧化法肉桂醛是肉桂酸的前体,可以通过氧化反应得到肉桂酸。
反应中一般使用氧化剂氧气或过氧化苯甲酰来氧化肉桂醛。
具体步骤如下:(1)将肉桂醛溶于适量的无水乙醇;(2)逐渐加入氧气或过氧化苯甲酰,控制反应温度在80-100℃,反应时间为数小时;(3)反应结束后,用冷水冷却反应液,产生沉淀;(4)过滤沉淀,并用乙醇洗涤几次,最后用醚提取;(5)用水减压蒸馏,得到肉桂酸的无色液体。
2. 石英光解法肉桂酸也可以通过石英光解法进行制备。
具体步骤如下:(1)将肉桂醇溶解于干燥的醋酸中;(2)将溶液置于石英反应器内,通过真空脱气,去除氧气;(3)将石英反应器置于紫外线光源下,照射数小时;(4)反应结束后,用乙醚提取产物;(5)用纯水洗涤乙醚层,然后用无水氯化钠干燥;(6)用减压蒸馏,得到肉桂酸的无色液体。
3. 纳米铁催化法最近研究发现,纳米铁在催化反应中能够将芳香酮还原得到肉桂醛,并最终形成肉桂酸。
具体步骤如下:(1)将纳米铁与乙酸混合搅拌,并在反应室中进行超声处理;(2)加入未稳定的芳香酮溶液,反应温度一般控制在室温下;(3)反应结束后,用橡胶头滴管分离上层有机相;(4)用洗涤液进行水相的清洗,并用无水氯化钠干燥;(5)用减压蒸馏,得到肉桂酸的无色液体。
肉桂酸的制备方法有多种,上述所列举的只是其中几种常见的方法。
研究人员也在不断探索新的制备方法,如酶法、电化学法等。
通过不同的制备方法,可以得到高纯度的肉桂酸,以满足不同领域的需求。
实验十五:肉桂酸的制备

残余液 冷却后加活性炭 煮沸数分钟 趁热过滤 滤液 搅拌下滴加浓盐酸 至pH=3,大量固体析出
取下烧瓶,趁热加入饱和碳酸钠 水溶液至pH=8-9 80 mL水 蒸馏,至馏出液无油珠
醋酐必须在实验前进行重新蒸馏。
思考题:
¾
若用苯甲醛与丙酸酐发生 Perkin 反应,其产物 是什么?
答:苯甲醛和丙酸酐在无水丙酸钾的催化下,相互 作用后得到2-甲基-3-苯基-2-丙烯酸。
CHO +
O
CH3CH2C O
O
CH3CH2C
CH3CH2COOK
CH=C—COOH CH3
思考题: z 在实验中,如果原料苯甲醛中含有少量的苯甲酸,这对实 验结果会产生什么影响?应采取什么样的措施? 答:苯甲醛放久了,由于自动氧化而生成较多量的苯甲酸, 这不但影响反应的进行,而且苯甲酸混在产品中不易除干 净,将影响产品的质量。故本反应所需的苯甲醛要事先蒸 馏,截取170-180°C馏分供使用。 z 水蒸气蒸馏的目的是为了除去什么组分? 答:主要除去未反应的苯甲醛。
冷却,抽滤,少量水洗
产物烘干,称量,测熔点
产物熔点:135.6 ℃
注意事项
¾干燥管内装无水氯化钙固体,使用前后应放置在干燥器内。 ¾注意观察反应过程及加入碳酸钠溶液后的现象。 ¾明确水蒸气蒸馏应用于分离和纯化时其分离对象的适用范
围,保证水蒸气蒸馏顺利完成。
¾加浓盐酸酸化前即可能有大量固体析出,但仍需酸化到位 ¾乙酸酐放久了因吸潮和水解将转变为乙酸,故本实验所需的
加浓盐酸酸化前即可能有大量固体析出但仍需酸化到位乙酸酐放久了因吸潮和水解将转变为乙酸故本实验所需的醋酐必须在实验前进行重新蒸馏
有机化学肉桂酸的制备实验报告

实验三:实验名称肉桂酸的制备一实验目的和要求1 . 通过肉桂酸的制备学习并掌握Perkin 反应及其基本操作。
2. 巩固掌握固体有机化合物的提纯方法:脱色、重结晶。
3. 掌握回流、热过滤、重结晶质操作。
4. 掌握水蒸汽蒸馏的原理及应用。
二反应式(或实验原理)1.用苯甲醛和乙酸酐作原料,发生Perkin反应,反应式为:2.反应机理如下:乙酸肝在弱碱作用下打掉一个H,形成CH3COOCOCH2-,然后三主要物料及产物的物理常数:四主要物料用量及计算:五实验装置图六实验步骤流程1.在100 mL 三口烧瓶中加入3 g 研细的无水碳酸钾,5 mL 新蒸馏的苯甲醛,7.5 mL 乙酸酐,振荡使其混合均匀。
2.三口烧瓶中间口接上回流冷凝管,侧口其一装上温度计,另一个用塞子塞上。
用电热套低电压加热使其回流,反应液始终保持在150~170 ℃,使回流反应进行1h。
3.取下三口烧瓶,向其中加入少量沸水,5-7.5 g 碳酸钠,摇动烧瓶使固体溶解,使溶液呈碱性。
4.然后进行水蒸气蒸馏。
用三口烧瓶作为水蒸气发生器,用电热套加热。
注意不能用电热套直接加热烧瓶,采用空气浴加热。
5.要尽可能的使蒸汽产生速度快。
水蒸气蒸馏蒸到蒸出液中无油珠为止。
卸下水蒸气蒸馏装置,向三口烧瓶中加入1.0 g 活性炭,加热沸腾2~3 min。
6.然后进行热过滤。
将滤液转移至干净的200 mL 烧杯中,慢慢的用浓盐酸进行酸化至明显的酸性(大约用25 mL 浓盐酸)。
7.进行冷却至肉桂酸充分结晶,之后进行减压过滤。
晶体用少量冷水洗涤。
减压抽滤,要把水分彻底抽干,在100 ℃下干燥。
8.可在热水或3:1 稀乙醇中进行重结晶,称重,计算产率,理论产量为7.4 g(0.05 mol)。
七实验记录实验日期八产率计算理论产量:0.05*148.17=7.41g实际产量:6.56g产率:6.56/7.41*100%=88.53%九讨论1. 所用仪器必须是干燥的。
肉桂酸的制备

肉桂酸的制备绿药1501 陈宁婷201530360103一、实验目的1、学习肉桂酸的制备原理和方法。
2、学习水蒸气蒸馄的原理及其应用,掌握水蒸气蒸馄的装置及操作方法。
二、基本原理芳香醛与具有也-H的脂肪酸酊在相应的无水脂肪酸钾盐和钠盐(也可以用碳酸钾或叔胺的催化剂)共热的作用下,可以发生类似羟醛缩合的反应,生成a,。
-不饱和酸。
此反应称为Perkin反应。
肉桂酸,又名。
一苯丙烯酸、3一苯基一2一丙烯酸.是从肉桂皮或安息香分离出的有机酸.肉桂酸是生产冠心病药物“心可安”的重要中间体。
其酯类衍生物是配制香精和食品香料的重要原料。
它在农用塑料和感光树脂等精细化工产品的生产中也有着广泛的应用,是一种重要的精细化工合成中间体[5-6],被广泛应用于医药、香料、塑料、感光树脂、食品添加剂等精细化学品的制备。
肉桂酸的合成方法较多,主要有Perkin法、苯乙烯-四氯化碳法、苯甲醛-丙二酸法、苯甲醛-乙烯酮法、肉桂醛氧化法、氯代芳炷-丙烯酸及其衍生物法等。
本实验制备肉桂酸采用Perkin反应。
[2-4]该工艺反应时间较长,产率大约为55%-66% [1]反应式如下:Perkin反应简介:芳香醛与酸酊在碱性催化剂(强碱弱酸盐)作用下,可以发生类似羟醛缩合作用,生成a , 3 -不饱和芳香酸。
Perkin反应的催化剂通常是相应酸酊的短酸钾或钠盐,有时也可用碳酸钾或叔胺代替。
反应时,可能是酸酊受醋酸钾(钠)的作用,生成一个酸酊的负离子,负离子和醛发生亲核加成,生成中间物。
一羟基酸酊,然后再发生失水和水解作用而得到不饱和酸。
反应机理如下:三、主要试剂和仪器1. 试剂:苯甲醛3.0 mL (0.03mol ),乙酸酊5.5 mL (0.06mol),无水醋酸钾3.0g(0.03mol ),饱和碳酸钠溶液,浓盐酸,活性炭。
2. 仪器:150mL三口烧瓶,空气冷凝管,250mL圆底烧瓶,75°弯管,直形冷凝管,支管接引管,锥形瓶,量筒,烧杯,布氏漏斗,吸滤瓶,表面皿,红外灯。
肉桂酸制备

纯 PhCH=CHCOOH
思考题
1. 苯甲醛和丙酸酐在无水碳酸钾的存在下相互作
用后得到什么产物?
2. 用酸酸化时,能否用浓硫酸?
3. 具有何种结构的醛能进行Perkin反应? 4. 用水蒸汽蒸馏除去什么?为什么能用水蒸汽蒸 馏法纯化产品?
醋酸酐
肉桂酸
102.09ຫໍສະໝຸດ 148无色液体无色针状晶体
1.082
1.245
1.3904
-73.1
133
140
300
混溶
不溶
混溶
混溶
混溶
混溶
所用试剂规格及用量
名称 苯甲醛 纯度 新蒸 用量 ml 1.5 g 理论 0.015 摩尔数 实际 0.015
醋酸酐
无水碳酸钾 氢氧化钠
新蒸
无水 10%
4
2.2 10
水蒸气蒸馏 馏出液 残留液
H2 O
PhCHO H2O
PhCH=CHCOOH CH3COOH CH3COOK H2O
10% NaOH 抽滤
滤渣
滤液
PhCH=CHCOONa CH3COONa NaOH H2O
浓HCl 抽滤 沉淀 滤液
粗 PhCH=CHCOOH
重结晶(水-乙醇)
CH3COOH H2O NaCl
② 醋酐放久了,由于吸潮和水解将转变为乙酸,故本
实验所需的醋酐必须在实验前进行重新蒸馏。
③ K2CO3空气中易吸潮,需在红外灯下干燥,研细、 称量后迅速装入反应瓶。
PhCH=CHCOOK PhCHO CH3COOK (CH3CO)2O K2CO3
粗 产 物 纯 化 流 程
H 2O
PhCH=CHCOOH PhCHO CH3COOH CH3COOK
肉桂酸的制备一.实验目的1.学习肉桂酸的制备原理和方法。2.学习水

肉桂酸的制备一.实验目的1.学习肉桂酸的制备原理和方法。
2.学习水蒸气蒸馏的原理及其应用,掌握水蒸气蒸馏的装置及操作方法。
二.实验原理1、 Perkin 反应制备肉桂酸芳香醛与具有α-H 原子的脂肪酸酐在相应的无水脂肪酸钾盐或钠盐的催化下共热发生缩合反应,生成芳基取代的α ,β-不饱和酸,此反应称为Perkin 反应。
2.水蒸气蒸馏的基本原理及实验操作(1) 水蒸气蒸馏定义将水蒸气通入不溶或难溶于水但有一定挥发性的有机物质中,使该有机物在低于100℃的温度下,随着水蒸气一起蒸馏出来。
(2)用水蒸气蒸馏提纯的有机物必须具备的条件:不溶(几乎不溶)于水沸腾下不与水发生化学反应在100℃左右必须有一定的蒸气压(一般不小于1333.2Pa) 水蒸气蒸馏1、安全管的位置:插入距离烧瓶底1~2mm处。
操作前,仔细检查整套装置的严密性。
2、T形管的作用:去除冷凝水、调节系统的压力。
3、操作注意:(1)、水蒸气发生器中的水量(1/2~1/3V瓶)、产品量(<1/3V瓶)(2)、开始:螺旋夹应先开启,待水沸腾夹紧,水蒸气导入,T形管通入三颈烧瓶底。
(3) 过程控制馏出液的流出速度,以2~3滴/秒为宜随时注意安全管的水位,若有异常现象,先打开止水夹,再移开热源,检查、排除故障后方可继续蒸馏。
判断有机物是否蒸干净?(4)、结束:先打开螺旋夹,再停止加热,否则会倒吸。
三.物理常数溶解度化合物名称分子量性状比重(d )熔点(℃)沸点(℃)折光率(n) 水乙醇乙醚苯甲醛105.12无色液体1.046 -26 179.1 1.5456 0.3 溶溶乙酸酐102.09无色液体1.081 -73 140.0 1.3910 水解水解溶碳酸钾138.21 白色易潮解粉末2.29 891 分解105.50溶于醇不溶于纯的醇肉桂酸148.15单斜晶棱柱体1.245 133 300 溶热水2420易溶四.注意点1. 无水醋酸钾的粉未可吸收空气中水分,故每次称完药品后,应立刻盖上盛放醋酸钾的试剂瓶盖,2.控制温度150-170℃,温度太高,乙酸酐被蒸出,产率降低.温度高于200℃,产物将脱羧成苯乙烯,进而生成苯乙烯低聚物。
化学实验报告——肉桂酸的合成
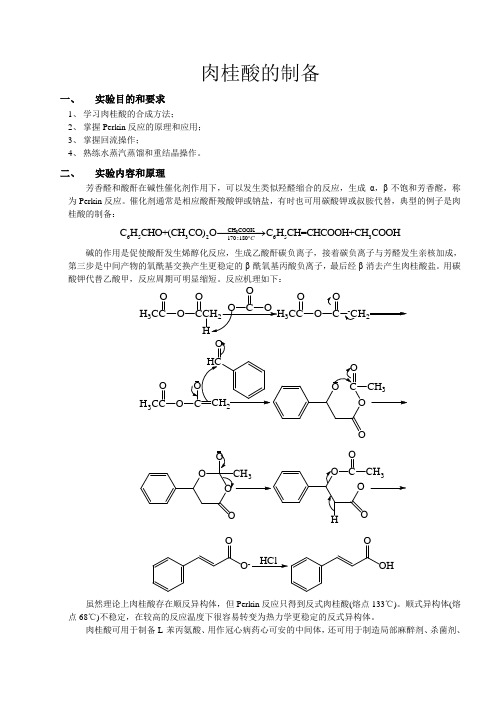
肉桂酸的制备一、 实验目的和要求1、 学习肉桂酸的合成方法;2、 掌握Perkin 反应的原理和应用;3、 掌握回流操作;4、 熟练水蒸汽蒸馏和重结晶操作。
二、 实验内容和原理芳香醛和酸酐在碱性催化剂作用下,可以发生类似羟醛缩合的反应,生成α,β-不饱和芳香醛,称为Perkin 反应。
催化剂通常是相应酸酐羧酸钾或钠盐,有时也可用碳酸钾或叔胺代替,典型的例子是肉桂酸的制备:3CH COOK6532653170180C H CHO+(CH CO)O C H CH=CHCOOH+CH COOH C︒−−−−→ 碱的作用是促使酸酐发生烯醇化反应,生成乙酸酐碳负离子,接着碳负离子与芳醛发生亲核加成,第三步是中间产物的氧酰基交换产生更稳定的β-酰氧基丙酸负离子,最后经β-消去产生肉桂酸盐。
用碳酸钾代替乙酸甲,反应周期可明显缩短。
反应机理如下:H 3CCO CCH O O O COO 3CCO CO O 2HH 3CCOCH 2OC O CH 3OO C O3OO -HClOOH虽然理论上肉桂酸存在顺反异构体,但Perkin 反应只得到反式肉桂酸(熔点133℃)。
顺式异构体(熔点68℃)不稳定,在较高的反应温度下很容易转变为热力学更稳定的反式异构体。
肉桂酸可用于制备L-苯丙氨酸、用作冠心病药心可安的中间体,还可用于制造局部麻醉剂、杀菌剂、止血药等;在香料工业用于制取苯基丙烯酸甲酯、乙酯和苯酯,用作食品、化妆品香料,有较好保香作用;用于农药工业生长促进剂、长效杀菌剂、果品蔬菜的防腐剂等;还用于生产感光树脂的主要原料乙烯基肉桂酸。
肉桂酸是测定铀、钒及分离钍的试剂。
三、主要物料及产物的物理常数四、主要仪器设备仪器磁力搅拌器;球形冷凝管;回流装置;水蒸气蒸馏装置;抽滤装置;水循环真空泵;热水漏斗。
试剂苯甲醛(新蒸);乙酸酐(新蒸);无水碳酸钾;氢氧化钠;浓盐酸;乙醇。
五、操作方法和实验步骤实验装置图:加热回流装置 保温过滤装置水蒸气蒸馏装置六、 实验结果与分析实验合成肉桂酸粗产品(未干燥)共9.38g ,呈微黄色粉末状固体,很像奶粉。
肉桂酸的制备_实验报告

一、实验目的1. 了解肉桂酸的制备原理和方法。
2. 掌握Perkin反应的基本操作。
3. 巩固掌握固体有机化合物的提纯方法:脱色、重结晶。
4. 掌握回流、热过滤、重结晶等基本操作。
二、实验原理肉桂酸是一种重要的有机化合物,广泛应用于香料、医药、农药等领域。
本实验采用Perkin反应制备肉桂酸,反应原理如下:苯甲醛与乙酸酐在无水碳酸钾的催化下,发生Perkin反应,生成肉桂酸。
反应式如下:C6H5CHO + (CH3CO)2O → C6H5CH=CHCOOH + H2O反应过程中,无水碳酸钾作为催化剂,提供CH3COO-负离子,使乙酸酐生成负碳离子,进而与苯甲醛发生亲核加成反应,形成中间体。
最后,中间体在酸性条件下水解,得到肉桂酸。
三、实验材料与仪器1. 实验材料:- 苯甲醛(C6H5CHO)- 乙酸酐((CH3CO)2O)- 无水碳酸钾(K2CO3)- 活性炭- 盐酸(1:1)2. 实验仪器:- 150ml三口烧瓶- 500ml烧杯- 玻璃棒- 量筒- 200温度计- 直形冷凝管- 电磁炉- 球形冷凝管- 表面皿- 滤纸- 布氏漏斗- 吸滤瓶- 锥形瓶四、实验步骤1. 准备反应物:将苯甲醛、乙酸酐和无水碳酸钾按照一定比例称量,放入150ml 三口烧瓶中。
2. 加热回流:在电磁炉上加热,控制温度在150~170℃,回流反应约2小时。
3. 停止加热:待回流反应结束后,停止加热,将反应混合物倒入500ml烧杯中。
4. 脱色:向反应混合物中加入适量的活性炭,搅拌脱色约10分钟。
5. 过滤:用布氏漏斗和滤纸进行过滤,去除活性炭。
6. 重结晶:将滤液倒入锥形瓶中,加入适量的盐酸,使肉桂酸沉淀。
7. 过滤:用布氏漏斗和滤纸进行过滤,收集肉桂酸固体。
8. 干燥:将肉桂酸固体放入干燥器中,干燥至恒重。
五、实验结果与分析1. 实验结果:制备得到的肉桂酸固体呈淡黄色,熔点为130~132℃。
2. 产率:理论产量为0.05148g,实际产量为6.56g,产率为88.53%。
过渡金属cu(Ⅱ)肉桂酸盐的合成及应用

化学 工 程 与 装 备
C e i a n i e r n & E u p e t hm c lE g n e ig q im n 2 9
过渡金属 c ( )J 酸盐 的合成及应用 uI  ̄桂 I
查汝华,张 敏 ,董雄伟
( 汉纺 织 大学 化学工程 学 院,湖 北 武汉 4 0 7 ) 武 303
C1 8H∞ Cl 2Cu08
F z k期啦 omu
T・ 瑚 啊t 啊 Wa ee h v l ̄
C巧,tl rt sa 譬眦
・
,
487 9. 8
『 2 K 8 ) c 0" 0 3A .1 7 /
-
M om)l ̄ ci
S 埘 蛩l p 1 p Uzt l ∞Ⅱdm啪, i i 璐
P' I 2 № ( t-l . o ‘ A 3辱4 l
5. 5O O度 范 围 内的 行 射数 据 ,得 到 一 定 数 目的 独 立衍射 点, 亍
同时 可 得 到 I20) 衍 射 点 的数 目。 >o 时 ( )单 品结 构 解 析 2
生物活性受到众多化学家的关注 . 成为配位化学重要研究课 题。因此 ,合成 研究含氮含氧配体的、结构新颖的过渡金属
配 合物 。 其 是 合 成 过 渡 金 属 肉 桂 酸 盐 更 是 有 广泛 的应 用前 尤 景 ,其 具 体 表 现 在 如 医药 、香 料 工 业 、 保 鲜 剂等 方 面 。 I 实验 部分 11实 验 试 剂 . 硝 酸 铜 ( . . 国药 集 团化 学 试 剂 有 限 公 司) - 肉 AR, ;2氯 桂 酸 ( … 上 海 晶 纯 试 剂 有 限 公 司 ) AR :N, 二 甲基 甲酰 胺 N.
化学实验报告——肉桂酸的合成

化学实验报告——肉桂酸的合成
一、实验目的
本实验旨在合成肉桂酸,并通过TLC色谱检查急性,结合实验数据进行讨论。
二、实验原理
肉桂酸的生成反应可以分解为基本单元\'甲苯树脂\',这反应分为三个步骤:(1)甲苯氨化反应,将甲苯与尿素反应生成甲苯胺;(2)甲苯胺水解反应,将甲苯胺以水解法制备肉桂酮(3)肉桂酮水解反应,将肉桂酮与稀硫酸反应,最终得到肉桂酸。
三、实验准备
用于本实验的试剂有硝酸、氨水、甲苯、硫酸、石油醚。
四、实验步骤
(1)将甲苯5ml,尿素5ml,硝酸15ml混合,加热反应1h,然后放入冰上浓缩,冻干后收集沸石。
(2)将冻干的沸石与稀硫酸混合,加热反应1h,然后把反应液放在浸泡在石油醚和氨水中的水槽中,从液相中抽滤可溶物质,然后压干,收集最终产物肉桂酸。
五、实验数据
(1)反应前后TLC色谱测定:甲苯组分带有峰值,四十度沸点,反应前后峰值位置基本没变;肉桂酸没有反应前的峰值,反应后出现了峰值,四十度沸点。
(2)理论收率:肉桂酸的收率为几乎70%,甲苯的收率为几乎86%。
六、实验结论
本实验结果表明,合成肉桂酸的实验操作过程正确,理论收率高,实验效果良好。
肉桂酸合成方法

精细石油化工进展第14卷第2期A D V A N C E S I N FI N E P ET R O C H E M I C A LS肉桂酸合成方法研究进展蒋卫华,崔爱军(常卅l大学石油化工学院,常州213264)[摘要]以合成肉桂酸的原料为分类依据,综述了肉桂酸合成方法研究进展,重点介绍了以苯甲醛、苯乙烯、肉桂醛为反应原料的合成方法,包括Per ki n法、苯乙烯一四氯化碳法等,并对各合成工艺的优缺点进行了评述。
【关键词]肉桂酸苯甲醛苯乙烯肉桂醛合成进展肉桂酸是一种微有桂皮味的香料¨J。
在医药行业中肉桂酸可用于局部麻醉剂、抗炎、止痛、抗传染、抗癌、血管扩张剂、抗溃疡剂和低血糖等药物的制备心’3J。
农业上肉桂酸可用作长效杀菌剂、植物生长促进剂和除草剂、果蔬食品保鲜防腐剂等,最新研究还发现肉桂酸对铜绿微囊藻和斜生栅藻具有抑制作用,这为水华的生物治理找到一条安全有效的途径H J。
此外,肉桂酸还可用作测定铀和钒的试剂、分离钍的试剂、镀锌的缓蚀剂、聚氯乙烯的热稳定剂、聚氨基甲酸酯的交联剂、聚己内酰胺的阻燃剂、表面活性剂及负片型感光树脂的合成原料。
肉桂酸及其衍生物的广泛应用使其具有广阔的市场前景”。
7』。
合成肉桂酸的方法有多种,如P er ki n法、K noevenagel法、苯甲醛一丙酮法、苯甲醛一乙烯酮法、苯甲醛一醋酸法、苯乙烯一四氯化碳法、苯乙烯一一氧化碳法、苯乙烯一二氧化碳法、苯基氯甲烷一无水醋酸钠法、卤代苯一丙烯酸法、肉桂醛氧化法等。
以上方法大部分因能耗大、污染重、成本高、产率低等因素而没有实际工业应用价值,或已经被淘汰。
目前工业上生产肉桂酸的方法主要是Per ki n法和苯乙烯一四氯化碳法。
笔者以反应原料为分类依据,对肉桂酸的合成进展进行综述和评价。
1以苯甲醛为原料1.1Pe r ki n法Pe r ki n法是工业和实验室中普遍采用的合成肉桂酸的一种方法,即以苯甲醛和醋酐为原料,在弱碱的作用下醛作为受体,乙酸酐的O/一H被夺去后以负离子的形式作为给予体,进行亲核加成,最后生成肉桂酸。
肉桂酸的合成并利用紫外吸收光谱进行表征(II)

肉桂酸的合成并利用紫外吸收光谱进行表征(II)一、什么是紫外-可见分光光度法?答:它是利用物质的分子对紫外和可见光的吸收作用,对物质进行定性分析、定量分析及结构分析,所依据的光谱是不同分子吸收入射光中特定波长的光而产生的吸收光谱。
称为紫外-可见分光光度法。
二、主要应用:利用紫外吸收光谱研究有机化合物,尤其是共轭体系很有用。
当不同分子含有相同的发色团,它们的吸收光谱的形状就大致相似,所以该法的应用有一定的局限性。
但紫外吸收光谱对共轭体系的研究,如根据分子中共轭程度来确定未知物的结构骨架有其独特的优点,所以紫外吸收光谱是对有机化合物进行定性鉴定和结构分析的一种重要辅助手段。
三、仪器结构:光源→单色器→吸收池→检测器可见光区:如钨灯;紫外光区:如氘灯。
色散元件常用棱镜和光栅。
吸收池又称比色皿,按材料可分为玻璃吸收池和石英吸收池,前者不能用于紫外区。
检测器的作用是检测光信号,并将光信号转变为电信号。
现今使用的分光光度计大多采用光电管或光电倍增管作为检测器。
四、仪器操作(1)打开主机电源,预热15min;(2)进入UV8500操作软件,仪器自检,显示主机状态;(3)进入操作对话框,选择波长扫描;荧光分光光度法测定维生素C一、什么是荧光分光光度法:答:多数分子在常温下处在基态最低振动能级,当荧光物质的分子吸收了特征频率的光能后,由基态跃迁至较高能级的激发态的任一振动能级。
处于激发态的分子,与溶剂分子发生碰撞,以热的形式损失部分能量后,而回到第一电子激发态的最低振动能级(无辐射跃迁),通过无辐射去活,将多余的能量转移给其它分子或激发态分子内振动或转动能级后,回到第一激发态的最低振动能级,然后再以光辐射的形式去活化,跃迁回到基态各振动能级,发射出荧光。
二、为什么要用荧光进行分析呢?答:与吸收光谱不同,并不是所有物质都能产生荧光,所以选择性好,干扰少。
三、分析应用:维生素C(抗坏血酸)具有较强的还原性,在合适的氧化剂存在下,维生素C被氧化成脱氢抗坏血酸,脱氢抗坏血酸与邻苯二胺反应生成有荧光的化合物——喹喔啉。
肉桂酸的合成及其二聚反应的研究

第36卷第2期2008年4月浙江工业大学学报JO U RN A L OF ZHEJIA N G U N IV ERSIT Y OF T ECH N OL O GY V ol.36N o.2A pr.2008收稿日期:2007-07-14作者简介:戚晶云(1986)),男,浙江湖州人.通讯联系人:强根荣,E -mail:qgr@.肉桂酸的合成及其二聚反应的研究戚晶云,王 红,陈洪峰,贺 攀,强根荣(浙江工业大学化学工程与材料学院,浙江杭州310032)摘要:利用Knoevenagel 反应合成肉桂酸,研究了吡啶和六氢吡啶的用量、阻聚剂及反应时间对产率的影响,确定了最佳的反应条件,苯甲醛、丙二酸、吡啶、六氢吡啶的摩尔比为5B 6B 12B 0.167,在95e 下回流反应2h,肉桂酸的产率可达到83.7%.该方法工艺简单,产率高,反应无污染,产物易分离纯化.同时利用光化学反应合成了天然提取物古柯间二酸,为肉桂酸的进一步开发利用提供了途径.关键词:Knoevenag el 反应;肉桂酸;古柯间二酸;二聚反应中图分类号:O621.3 文献标识码:A 文章编号:1006-4303(2008)02-0155-03Study on synthesis of cinnamic acid and its dimeric reactionQI Jing -y un,WANG H ong,CH EN H o ng -feng,H E Pan,QIANG Gen -rong(College of Chemical Engineering and M aterials S cien ce,Zhejiang University of Techn ology,H an gzhou 310032,Ch ina)Abstract:Cinnamic acid w as synthesized by the Knoev enagel reactio n.In this paper ,the im po r -tant effects on the reactio n,such as the molar ratio of pyridine and hex ahydro py ridine,the add-i tion of ant-i polym er iztion reagent and the reaction tim e w ere discussed.The results indicated thatthe hig hest y ieid (83.7%)can be obtained w hen the ratio o f benzaldehyde,malonic acid,pyridine and hex ahy dro py ridine w as 5B 6B 12B 0.167,the reactio n temperature w as 95e and the reac -tion time w as abo ut 2hours.T his m ethod has m any advantag es,such as hig h yield,easy o pera -tion and purification.In the m eantim e,the natural pr oduct truxillic acid w as synthesized by the photochemistr y r eaction,w hich gives a new applicatio n of cinnam ic acid.Key words:Knoevenagel reaction;cinnamic acid;trux illic acid;dimeric reactio n0 引 言肉桂酸是一种重要的精细化工中间体,广泛应用于医药、香料、塑料、感光材料、缓蚀剂和交联剂[1]等产品的生产中,此外肉桂酸对紫外线还有一定的阻隔作用,因而肉桂酸也是高级防晒霜中重要成份之一[2].目前,肉桂酸的国内需求量极大,市场前景十分看好.但由于我国肉桂酸生产还不成型,生产方法普遍陈旧[3],因此,改进已有的肉桂酸传统合成工艺,开发新的合成方法有着十分重要的意义.肉桂酸的二聚产物古柯间二酸(2,4-二苯环环丁烷二羧酸),它是白花蛇舌草的主要成分,其药理作用有抗肿瘤、抗诱变活性、抗感染[4]等.目前,工业上主要是利用Perkin 反应来合成肉桂酸,其不足是乙酐活性低、反应温度高、时间长、产率低(38%~45%)等[5].为了提高产率,优化反应条件,人们研究了用催化活性较高的无水K 2CO 3来替代无水醋酸钠作催化剂的方法,但发现由于K 2CO 3碱性较强,反应过程中会生成大量的树脂状的苯甲醛的聚合物,消耗了原料苯甲醛,影响了产物收率.另外,合成肉桂酸的方法还有苯甲醛)乙烯酮法、苯乙烯)四氯化碳法、苯甲醛一醋酸法、苄叉二氯一无水醋酸钠法[6]等等.这些方法,由于催化剂制备困难、工艺条件苛刻,都不利于工业化生产.和其它方法相比,利用Knoevenagel 反应合成肉桂酸有着十分显著的优点,主要是原料简单易得,产率较高,产物分离纯化容易,操作方便.本文在人们研究的基础上,对该反应作了进一步的研究,试图通过改变催化剂吡啶和哌啶的用量、改变反应时间、添加阻聚剂等方法,来寻找最佳的反应条件,提高产品的收率,效果良好.同时,我们还利用光化学反应[7],对肉桂酸的二聚产物古柯间二酸的合成进行了初步研究.1 实验部分1.1 主要仪器与试剂磁力搅拌器、熔点测定仪丙二酸、苯甲醛、吡啶、六氢吡啶、无水乙醇、氢氧化钠、盐酸和四氢呋喃1.2 合成原理肉桂酸合成反应式:1.3 合成步骤1.3.1 肉桂酸的合成在250mL 装有干燥管、冷凝管和搅拌器的三口烧瓶中依次加入丙二酸6.24g (0.06mo l)、苯甲醛5.06mL(0.05mo l)(苯甲醛与丙二酸的摩尔比为1.0B 1.2)、一定量的干燥的吡啶和六氢吡啶,将混合物加热回流.待反应结束后,将反应混合物冷却,加入冷的盐酸溶液.将反应物在冰水中冷却一段时间后,过滤得到粗产品,用冰水洗涤,用25%的乙醇溶液重结晶,干燥得到产品,熔点为133.0~133.5e .1.3.2 古柯间二酸的合成取1.5g 纯肉桂酸置于125m L 锥形瓶中,加大约2mL 四氢呋喃,将混合物微热,使肉桂酸溶解.从热源上移开锥形瓶,边冷却,边慢慢旋转锥形瓶,使肉桂酸晶体均匀覆盖在锥形瓶内壁.待其充分干燥后,夹住锥形瓶上端倒置,直至排尽溶剂.塞住瓶口倒置在大烧杯中,把大烧杯放在日光下照射两周.一周后,调换锥形瓶的方向,照射另一面.光照结束后,加入15mL 甲苯,混合物加热到40e ,使未反应的肉桂酸溶解.过滤分离出不溶固体,再用10m L 甲苯洗涤,真空干燥,得到白色晶体0.96g,收率64%,熔点为285.0~286.0e .2 结果与讨论2.1 吡啶用量对反应的影响吡啶具有碱性,在实验中,它作为一种催化剂,同时既是溶剂,又是缩合剂,故其用量对产率的影响很大.为了考察吡啶的用量对反应的影响,我们将苯甲醛与丙二酸的摩尔配比保持在1.0B 1.2,取苯甲醛5.06mL(0.05mo l),丙二酸6.24g(0.06mol)和六氢吡啶0.14g (1.67@10-3m ol),在此混合液中分别加入不同量的吡啶,将反应混合物加热回流2h,实验结果如表1所示.表1 吡啶用量对产率的影响Table 1 Eff ects of the am ount of Pyridine on yield 吡啶用量/mo l产量/g 产率/%0.11 2.4232.40.12 4.9166.10.134.5360.7从表1可以看出,吡啶的用量较少时,对反应的催化效果不明显,增大吡啶的用量,当吡啶的用量为0.12mo l,约占苯甲醛和丙二酸总量的83%时,产率最高为66.12%,进一步增大吡啶的用量,肉桂酸的产率反而降低.2.2 六氢吡啶用量对反应的影响六氢吡啶具有较强的碱性,实验中,它作为一种碱性增强剂.为了考察六氢吡啶的用量对反应的影响,我们将苯甲醛与丙二酸的摩尔配比保持在1.0B 1.2,取苯甲醛5.31g(0.05mo l),丙二酸6.24g (0.06mol)和吡啶9.5g(0.12mo l),在此混合液中分别加入不同量的六氢吡啶,将反应混合物加热回流2h,实验结果如表2所示.从表2可以看出,在苯甲醛、丙二酸、吡啶的量及反应条件不变的情况下,加入六氢吡啶的量对反应有重要的影响.这可能是因为六氢吡啶的加入增强了反应体系的碱性,使得丙二酸中的A -H 更易脱去,有利于下一步反应的进行,从而提高了肉桂酸的#156#浙江工业大学学报第36卷产率,但六氢吡啶的加入量太多,会使反应体系的碱性太强,原料苯甲醛的氧化、歧化反应趋势增强,从而使产率降低.表2 六氢吡啶用量对产率的影响T able 2 Effects of the amount of Hexahydropyridine on yield 六氢吡啶用量/mol,@10-3产量/g 产率/%0.84 4.9266.11.25 4.9466.21.67 6.2483.72.125.2270.22.3 阻聚剂对反应的影响在利用Perkin 反应合成肉桂酸的许多报道[8][9]中,加入阻聚剂来提高肉桂酸的产率,也是一个常用的方法.笔者在研究过程中,也试图通过加入阻聚剂4-叔丁基邻苯二酚来进一步提高了肉桂酸的产率.取两份由苯甲醛5.06m L(0.05mol)、丙二酸6.24g(0.06mol)、六氢吡啶0.14g(1.67@10-3mol)和吡啶9.49g (0.12mo l)组成的混合液,其中一份加入阻聚剂4-叔丁基邻苯二酚0.01mo l(1.7g),另一份不加阻聚剂,将反应混合物分别加热回流2h,实验结果如表3所示.表3 阻聚剂加入对产率的影响Table 3 Ef fects of inhibitor on yield 阻聚剂加入情况产量/g 产率/%不加入阻聚剂 6.1282.3加入阻聚剂4.0554.0由表3可知,在相同的原料比和反应条件下,阻聚剂的加入反而会使产率降低.在实验过程中,我们发现当反应加热回流1h 左右时,加阻聚剂的反应瓶中会有浅黑色的物质生成,即使不加阻聚剂,在反应过程中也没有观察到苯甲醛发生明显的聚合,因此,在用Knoevenagel 反应制备肉桂酸时可能不必添加阻聚剂.2.4 反应时间对反应的影响取苯甲醛5.06mL(0.05mo l),丙二酸6.24g (0.06m ol)、六氢吡啶0.14g (1.67@10-3mo l)和吡啶9.49g(0.12m ol),将反应混合物加热回流不同的时间,实验结果见表4.表4 反应时间对产率的影响Table 4 Ef fects of reaction time on yield 反应时间/h产量/g 产率/%1.0 3.9252.61.5 4.3158.12.0 6.2283.4实验结果表明,反应时间增长,产率会有一定的提高.但是随着回流时间的延长,混合物颜色也随之不断变黄,副产物增多,反而会使产率降低,一般最佳的反应时间为2h.2.5 肉桂酸的二聚反应肉桂酸及其衍生物可以发生光化学反应.反式肉桂酸晶体以三种晶型存在,其中A -型分子在晶格中为头-尾排列,其晶格分子距为38nm ,易发生光化学反应,而其他晶形由于晶格分子间距较大,不易发生光化学反应,因此,当我们把合成得到的反式肉桂酸在光照的条件下放置两周后,同样得到了单一的A -古柯间二酸,其氢核磁数据与标准样完全吻合.3 结 论通过研究吡啶、六氢吡啶的用量,阻聚剂以及反应时间对实验的影响,我们得到了用Kno ev enagel 反应来合成肉桂酸的最佳反应条件.当苯甲醛B 丙二酸B 吡啶B 六氢吡啶的摩尔比为5B 6B 12B 01167时,加热反应回流2h,可以得到比较高的产率.在反应过程中不需要加入阻聚剂.肉桂酸可以通过光照反应生成A -古柯间二酸,该法简单,且无污染,为肉桂酸的进一步开发利用提供了途径.该操作突出了很多绿色化学理念,因为此环加成反应在固体状态下进行,不使用溶剂,另外起始原料(肉桂酸)的每个原子都被并入到产物中,具有很高的原子经济性.参考文献:[1] 徐克勤.精细有机化工原料及中间体手册[M ].北京:化学工业出版社.1986.[2] 张海军.Perkin 反应合成肉桂酸[J ].香料香精化妆品,2006,(5):17-23.[3] 姚立红.呋喃丙烯酸酯类香料的合成及性能研究[J ].精细化工,1998,15(4):14-17.[4] 马超,朴惠善.白花蛇舌草的研究进展[J ].时珍国医国药,2006,4(2).269-270[5] 韩广甸.有机制备化学手册(中卷)[M ].北京:化学工业出版社,1985.[6] 倪宏志,邓润华.肉桂酸的制备和应用[J ].化学世界,1996,(8):399-400.[7] 胡秀贞.芳烃光环加成反应[J ].化学通报,1990,(10):12-13.[8] 吴赛苏.Perkin 反应合成肉桂酸工艺的改进[J].化学世界,2002,43(11):599-600.[9] 张海军,施磊,陈建村.Perkin 法合成肉桂酸的研究[J].精细石油化工进展,2006,7(4):6-7.(责任编辑:翁爱湘)#157#第2期戚晶云,等:肉桂酸的合成及其二聚反应的研究。
肉桂酸的制备和熔点测定

(b)混合物中含有焦油状物质,采用通常的蒸馏、萃取等方法非常困难。 (c)在常压下蒸馏高沸点有机物质会发生分解。 被提纯物质必须具备以下几个条件: (a)不溶或难溶于水。 (b)在沸腾下与水不发生化学反应。 (c)在100℃左右必须具有一定的蒸气压(一般不小于10mmHg)。 (2)水蒸气蒸馏的实验操作 水蒸气蒸馏装置如图2 所示。用500 mL 圆底烧瓶作水蒸气发生器,内盛水约占其容量的 1/2~2/3,以长玻璃管作为安全管,管的下端接近瓶底,根据管中水柱的高低,可以估计 水蒸气压力的大小。水蒸气导管末端应接近蒸馏烧瓶底部,以使水蒸气和被蒸馏物质充分 接触并起搅拌作用。发生器的水蒸气导出管与一个T 形管相连,T 形管的支管套一个短橡 皮管,橡皮管上用螺旋夹夹住,T形管的另一端与蒸馏部分的导管相连,T 形管用来除去水 蒸气中冷凝下来的水分。在操作中,如果发生不正常现象,应立刻打开螺旋夹,使之与大 气相通。 将反应装置按图2 连接好,打开T 形管上的螺旋夹,把水蒸气发生器里的水加热到沸腾, 当有水蒸气从T 形管的支管冲出时,再旋紧螺旋夹,让水蒸气通入烧瓶中,这时可以看到 烧瓶中的混合物翻腾不息,不久在冷凝管中就会出现有机物质和水的混合物。调节加热温 度,使瓶内的混合物不致飞溅得太厉害,并控制馏出液的速度约为每秒种2~3 滴。为了使 水蒸气不致于在烧瓶内过多地冷凝,在进行水蒸气蒸馏时通常也可用小火将蒸馏烧瓶加热。 在操作时,要随时注意安全管中的水柱是否发生不正常的上升现象,以及蒸馏烧瓶中的液 体是否发生倒吸现象,一旦发生这种现象,应立刻打开螺旋夹,移去热源,找出发生故障 的原因。必须把故障排除后,方可继续蒸馏。当馏出液澄清透明,不再含有油滴时,一般 即可停止蒸馏,这时应首先打开螺旋夹,然后移去热源,以免发生倒吸现象。
四、主要试剂与产品的物理常数
肉桂酸的制备实验报告
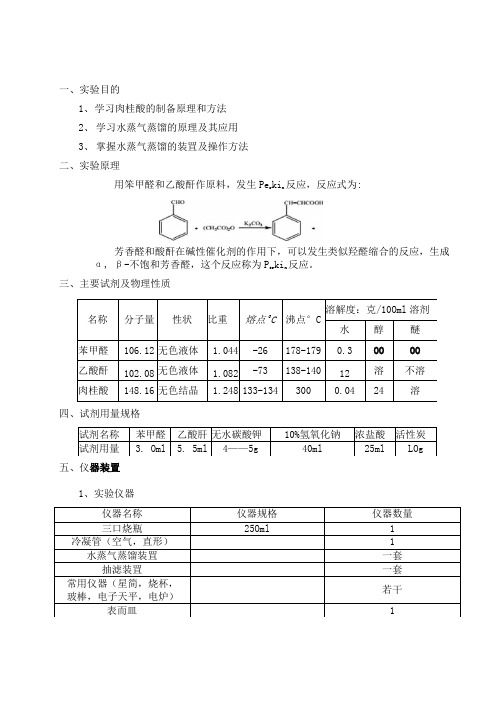
一、实验目的1、学习肉桂酸的制备原理和方法2、学习水蒸气蒸馏的原理及其应用3、掌握水蒸气蒸馏的装罝及操作方法二、实验原理用笨甲醛和乙酸酐作原料,发生Per kin反应,反应式为:芳香醛和酸酐在碱性催化剂的作用下,可以发生类似羟醛缩合的反应,生成α, β-不饱和芳香醛,这个反应称为Per kin反应。
三、主要试剂及物理性质名称分子量性状比重熔点O C沸点°C 溶解度:克/10Oml溶剂水醇醚苯甲醛106.12 无色液体 1.044 -26 178-179 0.3 OO OO 乙酸酐102.08 无色液体 1.082 -73 138-140 12 溶不溶肉桂酸148.16 无色结晶 1.248 133-134 300 0.04 24 溶四、试剂用量规格试剂名称苯甲醛乙酸肝无水碳酸钾10%氢氧化钠浓盐酸活性炭试剂用量 3. Oml 5. 5ml 4——5g 40ml 25ml LOg五、仪器装置1、实验仪器仪器名称仪器规格仪器数量三口烧瓶25Oml 1 冷凝管(空气,直形) 1 水蒸气蒸馏装罝一套抽滤装罝一套常用仪器(星简,烧杯,玻棒,电子天平,电炉)若干表而皿 12、仪器装置图回流装置水蒸气蒸馏装六、实验步骤及现象时间步骤现象13:30—13:40 将3. Oml笨甲醛、5. 5InI乙酸酐和4. OOg无水碳酸钟依次加入250Inl三口烧瓶中摇匀烧瓶底部有白色颗粒状固体,上部液体无色透明,反应剧烈,有白烟冒出13:40—14:42 搭好回流装罝,开始加热回流(约1小时,温度控制在 170 —18O e C)加热后有气泡产生,白色颗粒状固体逐渐溶解,由奶黄色逐渐变为淡黄色,并出现一定的浅黄色泡沫,随着加热泡沫逐渐变为红棕色液体,表而有一层油状物14:42—14:50 加入40ml 10%的氢氧化钠水溶液和20ml水,将装罝改力水蒸气蒸馏装罝,开始加热蒸馏14: 50—15:10 对蒸气发生器进行加热,待蒸气稳定后在通入烧瓶中液而下开始蒸气蒸馏:待检测馏出物中无油滴后停止蒸馏溶液由橘红色变为浅黄色15:10—15:15 加入LOg活性炭脱色,热过滤加入活性炭后液体变为黑色15:15—15:20 加入25ml浓盐酸,冰水浴烧杯中有白色颗粒出现15:20—15:25 抽滤(用冰水洗涤)抽滤后为白色固体15:25—15:30 烘箱干燥,称量称重得m=0. 33g七、实验结果理论产量:0.03* 148.17=4.45g实际产量:O.33g产率:理论产量/实际产量*100%=0.33∕4.45*100%=7.42%八、实验讨论1. 实验结果分析:肉桂酸率很低可能的原因有:a Per kin反应是缩合反应,缩合产物在髙温下易发生脱羧反应,因而温度过髙副产物增多,从而影响产率b实验过程中在冰水中冷却时间不够,所以粗产物较少2. 魏雌注意祕a.所用仪器必须是干燥的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
29
过渡金属cu(II)肉桂酸盐的合成及应用
查汝华,张 敏,董雄伟
(武汉纺织大学 化学工程学院,湖北 武汉 430073)
摘 要:以过渡金属cu(II)为配合物的中心原子,合成了新型的过渡金属肉桂酸盐,在此基础上研究了它在医药方面、香料工业、保鲜剂等多方面的应用前景。
关键词:配合物;过渡金属肉桂酸盐;应用
前言
近年来,含氮含氧配体的过渡金属有机配合物的合成、结构及性质研究是金属有机化学和配位化学中一个非常活跃的领域。
这些配体形成的化合物以其多样的结构和独特的生物活性受到众多化学家的关注,成为配位化学重要研究课题。
因此,合成研究含氮含氧配体的、结构新颖的过渡金属配合物。
尤其是合成过渡金属肉桂酸盐更是有广泛的应用前景,其具体表现在如医药、香料工业、保鲜剂等方面。
1 实验部分 1.1 实验试剂
硝酸铜(A.R.,国药集团化学试剂有限公司);2-氯肉桂酸(A.R.,上海晶纯试剂有限公司);N,N-二甲基甲酰胺(A.R.,天津市天河化学试剂厂);氨水(A.R.,信阳市化学试剂厂);其他试剂均为分析纯或化学纯。
1.2 实验步骤
取2-氯肉桂酸溶于氨水中得澄清溶液,取硝酸铜溶于氨水,将两溶液慢慢混合,向所得澄清溶液中加入N,N-二甲基甲酰胺,搅拌均匀,最后过滤,将清液静置,数天后得到棕红色层状的晶体。
产物经水洗涤并于真空干燥箱中自然干燥。
产率:86%。
1.3 实验仪器及检测方法 1.3.1 元素分析
C ,H ,N 含量在美国PE-2400(Ⅱ)型元素分析仪上测得 1.3.2 X-
射线衍射实验和单晶结构解析
(1)X-射线衍射实验
选取合适大小的单晶体用于X-射线衍射实验,实验温度为293(2) K ,在Bruker APEX 1000 SMART CCD 面探衍射仪上收集强度数据,利用石墨单色器单色化了的Mo-K α射线(λ = 0.71073 Å),采用ω-2θ扫描方式,收集2θ在2.62~55.00度范围内的衍射数据,得到一定数目的独立衍射点,同时可得到I ≥2σ(I)时衍射点的数目。
(2)单晶结构解析
配合物的衍射数据用SAINT 程序进行还原处理,用SADABS 程序进行数据校正,其中一些配合物还进行了ψ吸收校正。
结构分析过程中使用的最小二乘函数、偏离因子、权重偏离因子等数据表达式如下:
最小二乘函数:Ls =∑w (|F c |-|F o |)2
偏离因子:R 1 = ∑||F o |-|F c ||/∑|F o |
权重偏离因子:wR 2 = [∑w (F o 2-F c 2)2/∑w (F o 2)2]1/2
权重因子:w = 1/[σ2(F o 2)+(a·P )2+b·P ],[P = 1/3max(0, F o 2)+2/3F c 2] 2 结果与讨论 2.1 晶体结构的分析
合成的晶体结构图
2010年 第6期 2010年6月
化学工程与装备
Chemical Engineering & Equipment
30 查汝华:过渡金属cu(II)肉桂酸盐的合成及应用 该配合物是单核单斜晶体,它的空间群为P2(1)/c ,a=
18.4401(6) Å,b = 7.7193(3) Å,c = 7.3259(2) Å,α= 90° 。
β= 98.5770(10)° 。
γ= 90°。
U =1031.14(6) Å3 , z = 2, Dx=1.606 Mg/m3。
该配合物含有一个4配位的铜离子。
与铜
离子相连的其中两个氧原子分别来自两个2-氯肉桂酸中的羧基氧原子。
此外铜离子还与两个氧原子形成配位键。
2.2 晶体的堆积图及参数如下
3 结论
上述实验,我们还可以做其它过渡金属如Fe 、Co 、Ni 等作为配位体中心原子,合成一系列新型肉桂酸盐配合物。
我们合成后的新物质经过论证,广泛运用到食品添加剂、医药等领域中。
参考文献
[1] Hai-Liang ZHU. Syntheses and Crystal Structures of Ten
Transition Metal Complexes with Di-Schiff Base and
Mono-Schiff Base Derived from Salicylaldehyde and ,2-Diaminepropane.J. JOURNAL OF WUHAN UNIVERSITY OF SCIENCE AND ENGINEERING ,2008,21(8):64-69.
[2] ZHENG Yun-f ei, CHEN Wen-na, LI De-chang, REN
Hai-jin. Appl ication and Research Developmen t of Sch iff Bases and their Complexes. J. Techno logy &Developmen t of Chem ical Indu st ry, 2004, 33(4): 26-28。
