2012年CTD培训资料内部交流版
2012年CTD培训资料的解读和分享

原料药生产工艺资料要求
格式和内容详略程度举例:
某药物生产需要经过5步反应,工艺描述如下:
步骤1:××的烃基化反应(或××的制备)
成份
用量
SM1
75kg(**mol)
溴乙酸叔丁酯
60L(**mol)
ZnCl2 二氯甲烷
1kg 200L
500L反应釜(重要设备需要说明材质和型号)中加入200L二氯甲烷,搅拌条
1
原料药生产工艺资料要求
续上一页
起始原料的内控标准
所设置的质控项目要有针对性
如手性起始原料,要设置光学纯度考察
质控限度的确定要有充分的依据
三批SM的含量实测结果皆在98%以上,标准定95%??
某SM中有10%的杂质A,但研究显示其存在对后续反应无影响,终
产品中无杂质A以及大于0.1%的杂质存在,标准中定为小于10% (√)
1
原料药生产工艺资料要求
2.3.S.2.5 工艺验证和评价 工艺验证(Process Validation)--系统论证药品生产步骤、过程、设备、原料、 人员等因素,保证生产工艺能达到预订的结果,并保持药品生产的一致性和连续 性所进行的研究工作。 目的和意义: 确保批准的生产工艺在生产线上能够连续的生产出质量一致的样品,实现 生产过程的最优化 根据研究结果确定的各关键工艺参数在实际生产时的控制范围 关注要点: 验证方案是否包括了对所有关键工艺的控制要求:验证中是否对所有关键 工艺参数进行了控制和检测 工艺参数是否与申报资料中描述一致 验证结果是否证明质量符合标准,杂质谱是否和历史数据有可比性或更优 1
1
原料药生产工艺资料要求
关键步骤如何来界定: 方法二:依据前期(小试、中试)研究的结果 方法三:依据惯例 越靠近终产品的步骤,对终产品质量的影响越大 终产品的精制、纯化工艺步骤:直接影响有关物质、残留溶剂、晶型、溶 剂化物 粉碎步骤、粉碎模式、粉碎时间等对原料药粒度的影响 方法四:经验方法 例如:前期试验与统计学方法的结合
CTD文件介绍ppt课件

进行审评。
问题三:CTD的主要内容
化学药品CTD格式研究汇总及申报资料撰写要求
CTD格式申报主要研究信息汇总表(原料药) CTD格式申报主要研究信息汇总表(制剂) CTD格式申报资料撰写要求(原料药) CTD格式申报资料撰写要求(制剂)
提供原料药的结构式、分子式、分子量,如有立体结构和多晶型现象应 特别说明。
3.2.S.1.3 理化性质
提供原料药的物理和化学性质(一般来源于药典和默克索引等),具体 包括如下信息:性状(如外观,颜色,物理状态);熔点或沸点;比旋度,溶 解性,溶液pH, 分配系数,解离常数,将用于制剂生产的物理形态(如多晶 型、溶剂化物、或水合物),粒度等。
申报资料正文及撰写要求——3.2.S.4 原料药的质量控制
3.2.S.4.1质量标准
按下表方式提供质量标准,如放行标准和货架期标准的方法、限度不同,应分别进行说明。
检查项目 外观 溶液的颜色与澄清度 溶液的pH 鉴别 有关物质 残留溶剂 水分 重金属 硫酸盐 炽灼残渣 粒度分布 晶型 其他 含量
方法(列明方法的编号)
国家局对有关事项的通知——国食药监注[2010]387号
化药注册分类3、4、5和6的生产注册申请的药学部分申报资料 ,可参照CTD格式提交,同时提交电子版。
化药注册分类1和2的药学资料,暂不按CTD格式提交资料。 为鼓励CTD格式提交,并稳步推进: 按《药品注册管理办法》附件2申报资料要求提交的生产注册
表或在各地区被建议使用的标签,其内容和格式可 以由每个地区的相关注册机构来指定。
CTD文件——模块2
模块2:CTD文件概述 本模块是对药物质量,非临床和临床实验方面
CTD格式化申报资料培训

PPT文档演模板
CTD格式化申报资料培训
(2)工艺描述
返工(Reprocessing)
工艺过程中对不符合质量标准的中间体/终产物采用相同的生产工艺进 的重复操作 关注: 如大部分批均需返工,则应将其列入标准生产工艺 如将未反应的物料重新投料反应,则需先进行仔细评估以确保中间体/ 产物的质量不受影响 返工操作应在申报资料中予以描述
n 原申报格式主要围绕终产品的质量标准控制 提供相关的研究资料,对生产过程和系统研 发的全过程控制不够重视
n CTD格式秉承质量源于设计的理念,不仅限 于终产品的质量标准控制,更重视对影响产 品质量的整个研发过程与生产过程的控制。
PPT文档演模板
CTD格式化申报资料培训
二、名词解释
PPT文档演模板
➢ 工艺过程中有重大影响的步骤,比如原料药的精制、纯化,固体制剂的 混合、制粒等
➢ 关键工艺参数(Critical Process Parameter,CPP)
➢ 参数的改变影响到产品的关键质量属性,工艺过程中应当被严格监测或 控制,进而保证生产出合格的产品,如温CT度D格、式化湿申度报资、料压培训力、搅拌速度等
二、名词解释
PPT文档演模板
➢ 工艺验证(Process Validition,PV) ➢ 系统论证药品的生产步骤、过程、设备、原材料、人员等因素 ➢ 保证生产工艺能够达到预定的结果 ➢ 保持药品生产的一致性和连续性所进行的研究过程
➢ 返工(Reprocess) ➢ 工艺过程中对不符合质量标准/内控标准的中间体/终产物采用相 工艺进行的重复操作 ➢ 适用于中间体/终产品
我国药品行业发展的现状 药品质量控制理念递进的要求
PPT文档演模板
CTD格式化申报资料培训
CTD培训深圳讲课文档

• 一般原则:
• 常规通用检测项目,用药典附录收藏的通用方法。 如:水分、 干燥失重、重金…
• 分析方法应尽量简便、快捷、先进.
第10页,共51页。
方法选用注意
• UV法作鉴别少用单一峰作依据,要用多峰或特定波 用的吸光度比,专属性强些。
• 杂质检测选用专属性强的GC或HPLC,少用TLC。
件下的检测方法要验证,如含量和有关物 质… • 没订入标准方法要进行验证。
第14页,共51页。
方法验证技求要求
• 提供方法建立研究 • 方法来源,建立历程,修定过程(国内外权威方法
比较,效能和优势,如灵敏度,准确度,专属性, 杂质检测的针对性,如要对文献或药典方法修定 , 说明理由,提供数据和图谱) • 提供验证样品批号批量 试制日期 试制地点列表
对放行标准有差异的和要特别说明的作简要说明,并附CHP标准(架期标准)。
第6页,共51页。
分析方法编号
• Eze-Mth-S01 • Eze-Mth-P01
• Eze-Mth-P51
原料药 制剂
多种制剂型
• 编号只与申报有关,便于审评人员确认使用方法及方 法验证情况,便于资料中的方法引用。
第7页,共51页。
原料药含量,标准物质法,或与建立确度的另一方法比较推定 和加样回收率(多组分原料)。
制剂含量:回收率或加样回收率或用建立确度的另一方法 比较。
杂质:可向原料药或制剂中加入已知量杂质进行测定。如果不能 得到杂质或降解产物,可用本法测定结果与另一成熟的方法进行比较 (外标),可以使用原料的响应值。
第22页,共51页。
• 关注限度的合理性,权威标准,可控,文 献,实际工艺或处方
第4页,共51页。
企业内训内部学习资料

企业内训内部学习资料一、培训的理念:培训不是消耗而是投资人力资本需要培训才能增值,离开了培训只能是不断折旧、贬值。
不仅普通员工如此,企业的管理者更是这样。
很多企业亏损的一个重要原因其实是经营者素质的欠缺,他们认识不到自身的人力资本正在不断退化贬值,只是一味在产权问题上转圈圈。
于是陷入了这样一个恶性循环:不重视培训→素质低、人力资本贬值→只拼物质资本竞争(最典型的是彩电价格战)→ 亏损→ 忙着扭亏、培训成了被遗忘的角落(培训的资金更紧张)→ 员工士气低落、人力资本继续贬值→……“亏损”与“缺乏学习培训”成了“先有鸡还是先有蛋”这样一个说不清楚的问题。
其实,培训并不是说一定需要很多资金投入,关键看领导是否重视,企业首先在培训的观念上要创新,把培训当作一件投资回报率最大的投资来抓。
与此相对比的是,在过去50年间,西方组织和企业的培训费用一直在稳定增加。
美国企业每年在培训上的花费约300亿美元,约占雇员平均工资收入的5%。
目前,已有1200多家美国跨国公司包括麦当劳都开办了管理学院,摩托罗拉则建有自己的大学。
培训费用的巨额增长说明外企管理思想的变化。
通曼哈顿银行就规定:“凡无正当理由且多次拒绝参加培训者,银行予以解雇”。
韦尔奇任GE总裁以后,对几乎所有部门削减成本,却对它的培训中心——克罗顿投资4500万美元,改善教学设备。
二、如何转变企业对培训认识我们看到许多企业在员工培训方面的认识与实施大大滞后于发达地区。
许多老总和经理人甚至对员工培训持有消极态度。
但是,企业忽视员工培训,必然使企业发展缺乏后劲,市场竞争力更难以提升。
因此,我们首先要转变他们对培训的错误认识。
“没时间培训”似乎是企业老总们的无奈。
但是没有经过相应培训的公司往往工作效率低下,员工整天忙忙碌碌,但是工作绩效却难尽人意。
老总们为此苦恼,出台了很多奖勤罚懒的制度和措施,但是收效甚微。
员工的素质良莠不齐,对企业的认同和理解不尽相同,因此,团队无法发挥合力,制度不好贯彻实施,意识不好完全统一,工作效率不高也就在所难免。
内部审核培训教材珍藏版实战素材内审员必看

第一单元内部审核说明1定义:独立并系统化之查验,以决定其活动与相关结果是否符合规划之准则,以确保品质/环境管理系统执行之有效性,适切性,符合性。
2目的:2.1、评估品质/环境系统是否符合规定要求;2.2、评估品质/环境系统是否符合品质目标;2.3、提升受审核单位品质改善及矫正措施,确保品质/环境管理系统之有效性,适切性;2.4、以客观的方法,取得品质/环境管理绩效的事实信息,不在查受审者之绩效,查错误,责任归属,调查问题,内部审核重点在取得证据。
3范围对象:内部品质/环境管理系统或流程、产品或服务,但不含<供货商>:3.1、组织结构;3.2、行政及作业程序;3.3、人员、设备及物料资源;3.4、作业场所,作业步骤及制程工序;3.5、正在生产的项目(以了解相关要求被执行的程度);3.6、文书档案、报告、记录之保存。
4执行之频率:可自行决定,通常视如下情况考量:2.1、法律法规的要求;2.2、显著变化:组织、管理、政策、技朮、品质/环境系统(改变);2.3、近期审核的结果(情况不好时);2.4、计划性定期举行。
5相关文件:ISO19011:2002品质和环境体系审核指南。
第二单元内部审核组织要素1、审核小组之成员:审核召集人、主任审核员(审核组长)、审核员2、成员资格:2.1、已接受内部审核之教育训练;2.2、ISO9001/ISO14001之认知与能力;2.3、具专业知识。
3、内审员应具备的条件:3.1、胸襟开阔,慎思熟虑;3.2、具良好的判断力,分析技巧;3.3、具良好人际关系及沟通能力;3.4、能控制审核过程,遭遇问题时,运用适当的外交手段;3.5、具备良好的ISO9001/ISO14001条文理解力与公司程序文件之熟悉了解;3.6、保持独立,公平、公正、公开之原则。
4、审核人员之独立性:审核人员应由与受审单位无直接责任之人员担任,但以与该单位在工作上合作之相关人员从事1为佳。
5、 审核之形式:5.1、 内部审核(Internal Audit/First Party Assessment )<第一审核方>内部审核是由组织或部门内针对运行体系,规范,人员及设备的一种自我管理审核;5.2、 外部审核(Exterior Audit /Second Party Assessment )<第二审核方>外部审核是由组织针对其外包商或供货商的运行体系,规范、人员及设备的一种管理审核;5.3、 认正审核(Third Part Assessment )<第三审核方>认证审核是由某一组织以付费方式向发证机械申请之审核,其目的在于通过某一国家或国际的品质/环境系统要求。
全球药讯-DrugInformationAssociation

全球药讯Global Pharmaceutical Forum 中国药学会Chinese Pharmaceutical Association22012年第2期(总第7期)内部资料 免费交流Internal Newsletter“十二五”大幅提高药品标准和药品质量——国家食品药品监督管理局局长尹力解读《国家药品安全“十二五”规划》艾滋病疫苗的研究进展疫苗批签发的概况生物仿制药走向全球年会议和培训项目会议咨询,请联系DIA中国办公室电话: +86-10-5923-1222; 5923-1288 | 传真: +86-10-5923-1180 | 电子邮件:****************人物专访“十二五”大幅提高药品标准和药品质量——国家食品药品监督管理局局长尹力解读《国家药品安全“十二五”规划》.........................2-3专栏艾滋病疫苗的研究进展 ............................................................4-5疫苗批签发的概况 ....................................................................6-8特别报道生物仿制药走向全球 (9)美国生物仿制药管理概述.....................................................10-11美国对生物仿制药及可互换生物药的要求............................12-14关于建立美国生物仿制药和可互换生物制品批准途径的思考....15-16单克隆抗体仿制药的黎明 .....................................................17-18研发技术兼顾生产者和消费者风险的批签发多阶段抽样程序..............19-20热点追踪心律失常调节的新靶点—microRNA的研究进展与应用前景...21-23药政快讯FDA批准首个脐带血生物制品 (14)FDA批准儿童罕见血液病治疗药物Soliris (18)白血病治疗药达沙替尼或存在肺动脉高压风险 (23)会讯快报CTD格式申报——要求与实践培训班报道 (20)第四届DIA中国年会5月上海召开 (24)国家(成都)生物医药产业创新孵化基地与药物信息协会签订战略合作意向协议 (24)人物专访2Global Pharmaceutical Forum 《全球药讯》国务院日前正式印发《国家药品安全“十二五”规划》(以下简称“规划”),从药品标准、生产、流通、使用、监管等方面提出了未来5年药品安全保障工作的具体指标和任务。
CTD_培训答疑笔记总结(范文大全)

CTD_培训答疑笔记总结(范文大全)第一篇:CTD_培训答疑笔记总结2011年6月10日 CTD济南培训答疑部分笔记第一部分:答题卡问题解答1.Q:CTD是否需要参照附件2对各个模块分别独立装订?A:1)没有要求,可以根据模块资料的厚度定,允许内容少的多个模块装订在一起;2)封面格式目前没有要求;3)附件应装订在各模块下,在相应模块部分需要进行说明。
2.Q:进口药注册(3-6类)是否允许采用CTD申报上市? A:可以。
3.Q:工艺验证中的报告、方案、批记录如何提供,是否可采用附件提供,是否可不提供电子版?A:1)可以采用附件形式提供,需要在相应模块部分进行说明;2)电子提交目前只要求信息汇总表,其余部分现在不要求。
4.Q:参考文献是否需要提供,是否可以采用附件形式?A:1)需要提供;2)可以采用附件形式,需要在相应模块部分进行说明。
5.Q:批检验报告(3.2.S.4.4)部分提供的数据汇总部分是否需要提供图谱?A:可以不附,但是企业内部必须有,现场核查时会看。
6.Q:SFDA批准的标准是CTD格式的还是CP(中国药典)格式的?A:1)批准的标准为CP格式的,申报时需要提交CP格式的注册标准;2)申报时的标准为货架期标准。
7.Q:口服固体制剂放大时一般不超过10倍,那么液体如口服溶液呢? A:和生产设备,如配液罐有关,需要对此进行关注。
8.Q:已按附件2要求申请临床,现在申请上市时,如何准备CTD?A:1)这类临床很多是06年批准的,当时要求低,现在需要结合具体情况具体分析,来确定是否需要继续做部分工作,尤其是工艺放大部分的;2)相对于临床申报时没有发生改变的,可以采用当初申报临床时的资料。
9.Q:和原研药对比,如不同释放介质中的释放行为比较信息,如何提供?A:1)这部分工作在处方筛选部分已经进行,可以放在产品开发这部分;2)杂质谱的对比,不必完全放在3.2.P.5.6部分,可以放在产品开发这块;3)可以在对应小结部分,引用这部分内容的模块。
2012年CTD培训资料的解读和分享

物料控制信息表
物料名称
质量标准
生产商
使用步骤
A
USP31****步 Nhomakorabea1B
CP2010
****
步骤2
C
企业标准
***
步骤2
1
原料药生产工艺资料要求
2.3.S.2.3 物料控制 起始原料(SM):GMP监管的起点 起始原料的质量对终产品有重要影响,例如:
其中的杂质会影响后续反应的正常进行和收率 后续反应的投料比例不符合要求,导致杂质增加 反应异常或无法进行,如催化剂中毒等 终产品中的杂质超标,晶型、结晶水不符合要求 起始原料的要求 SM固定的来源和生产工艺 建立严格的内控标准,保证不同批次起始原料的质量一致性 密切关注起始原料中的杂质去向以及对终产品的影响
从SM到终产品,如果申报的合成步骤较短、SM的结构复杂,监管机构可
能要求申办人:
提供起始原料的合成工艺
结合其合成工艺制定针对性的内控标准,重点关注杂质情况
提供对起始原料厂家的审计报告,并对生产厂进行延伸检查
1
原料药生产工艺资料要求
2.3.S.2.4 关键步骤和中间体的控制 关键(Critical):必须被控制在预先确定的标准范围内的工艺步骤、工艺条
件和参数----ICH Q7A 关键工艺参数:对终产品质量有重要影响,微小的改变即可对后续反应和产
品质量产生明显影响 关键步骤如何来界定:
方法一:依据经验 “平顶型”反应和“尖顶型”反应 尖顶型反应,参数的控制范围较窄,对环境、条件要求严格,可能为关键
步骤,需要重点考察其反应参数、规模放大对参数的影响 例如:格式反应 有催化剂的反应
原料药生产工艺资料要求
CTD燃烧器培训记录
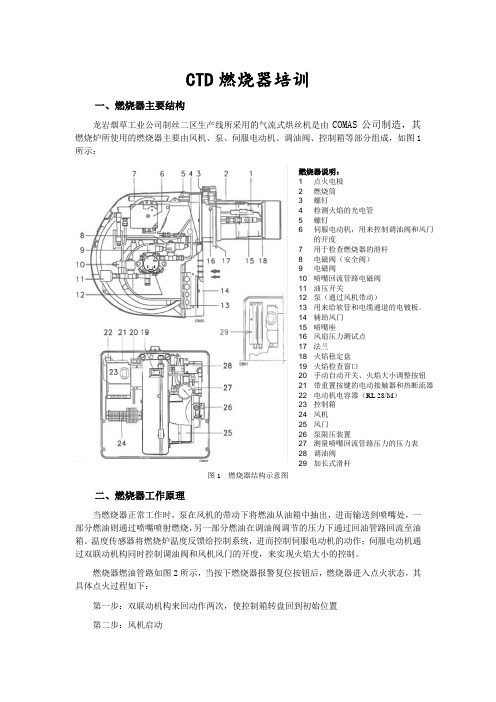
CTD 燃烧器培训一、燃烧器主要结构龙岩烟草工业公司制丝二区生产线所采用的气流式烘丝机是由COMAS 公司制造,其燃烧炉所使用的燃烧器主要由风机、泵、伺服电动机、调油阀、控制箱等部分组成,如图1所示:图1 燃烧器结构示意图二、燃烧器工作原理当燃烧器正常工作时,泵在风机的带动下将燃油从油箱中抽出,进而输送到喷嘴处,一部分燃油则通过喷嘴喷射燃烧,另一部分燃油在调油阀调节的压力下通过回油管路回流至油箱。
温度传感器将燃烧炉温度反馈给控制系统,进而控制伺服电动机的动作;伺服电动机通过双联动机构同时控制调油阀和风机风门的开度,来实现火焰大小的控制。
燃烧器燃油管路如图2所示,当按下燃烧器报警复位按钮后,燃烧器进入点火状态,其具体点火过程如下:第一步:双联动机构来回动作两次,使控制箱转盘回到初始位置第二步:风机启动燃烧器说明:1 点火电极2 燃烧筒3 螺钉4 检测火焰的光电管5 螺钉6 伺服电动机,用来控制调油阀和风门的开度7 用于检查燃烧器的滑杆8 电磁阀(安全阀)9 电磁阀10 喷嘴回流管路电磁阀11 油压开关12 泵(通过风机带动)13 用来给软管和电缆通道的电镀板。
14 辅助风门15 喷嘴座16 风扇压力测试点17 法兰18 火焰稳定盘19 火焰检查窗口20 手动自动开关、火焰大小调整按钮21 带重置按键的电动接触器和热断流器22 电动机电容器(RL 28/M )23 控制箱24 风机25 风门26 泵限压装置27 测量喷嘴回流管路压力的压力表28 调油阀 29 加长式滑杆通过管道1)和过滤器2),泵3)从油箱中抽出燃油,并在压力的作用下将其泵送。
此时,电磁阀8)、15)、16)处于关闭状态,泵限压弹簧4)被顶起,燃油通过管道5)—7)回流至油箱。
螺钉6)关闭通向吸入管路的旁路,断开的电磁阀8)、15)、16)关闭通往喷嘴的通道。
第三步:伺服电动机启动,向右旋转90°,直至接触到凸轮Ⅰ),风机风门设置为最大输出量,此时为空气输出量最大时的预净化阶段,吹扫燃烧筒,大约25S左右第四步:伺服电动机启动,向左旋转75°,直至接触到凸轮Ⅲ),风门和压力调节器(调油阀)都设置为最小输出值。
CTD格式内容详解ppt课件

➢ (b)开发过程中生产工艺的主要变化 ➢ 工艺开发过程中,小试批规模约500g,反应主要在20L的圆底烧瓶中
进行;中试批规模约5kg,主要设备为500L的反应釜;工艺验证批规 模约10kg,主要设备为1000L的反应釜。在工艺放大过程中,除搅拌 速度外,其他工艺参数无大的变化,工艺路线没有改变。
➢ 值得注意的是,尽管非无菌原料药在该项下有两种选择,但在此强烈建议
向无菌原料药看齐,向无菌原料药学习
➢ 貌似在重庆会上,专家也表达了类似的意思
最新课件
15
三、 CTD式(Drug Substance,S)
原料药主要研究信息汇总表
➢ 2.3.S.2.6 生产工艺的开发
➢ (a)工艺路线的选择依据 ➢ 头孢和稀泥是全新的化合物,专利CN201166666.6给出了一种合成方
来源 东东市宇宙化工厂 东东市宇宙化工厂 东东市宇宙化工厂 东东市宇宙化工厂 西西市化学试剂厂 西西市化学试剂厂 西西市化学试剂厂 西西市化学试剂厂
质量标准 企业标准 企业标准 企业标准 企业标准 工业用标准 工业用标准 工业用标准 工业用标准
最新课件
13
三、 CTD式(Drug Substance,S)
➢ 单独按序审评,逐步埋葬附件二格式
最新课件
8
三、 CTD式(Drug Substance,S)
原料药主要研究信息汇总表
➢ 2.3.S.1 基本信息(以一类新药头孢和稀泥为例,下同)
➢ 2.3.S.1.1 药品名称 ➢ 中文通用名:头孢和稀泥 ➢ 英文通用名:Cefohocini ➢ 化学名:(6R,7R)-7-[(R)-α羟基对甲苯乙酰胺]-8-氧代-3-[[[1-
质量管理体系内部审核员提高教材(2012版)

一、对质量管理体系标准的理解
2 质量管理体系基础
(5) 质量方针和质量目标
建立质量方针和质量目标为组织提供了关注的焦点。两者确定了预
期的结果,并帮助组织利用其资源达到这些结果。
质量方针为建立和评审质量目标提供了框架。 质量目标需要与质量方针和持续改进的承诺相一致,其实现需是可 测量的。 质量目标的实现对产品质量、运行有效性和财务业绩都有积极影响
一、对质量管理体系标准的理解
1
(3)
ISO9000族质量管理体系标准
GB/T50430规范与ISO9001标准的关系 GB/T50430规范的由来 全称 《工程建设施工企业质量管理规范》(GB/T50430-2007) 2007年10月23日
发布机构 实施日期 住房和城乡建设部 国家质量监督检验检疫总局
一、对质量管理体系标准的理解
1 ISO9000族质量管理体系标准
(1) ISO9000族质量管理体系标准的起源
ISO9000管理标准体系,就像一台昂贵的先进生 产设备,如果实实在在地使用,就能达到高效生产 的目的;如果放着不用,不单生产效率和效益相对 较低,也同时产生设备生锈和折旧等浪费。
例如,我们吊装汽包,使用手摇卷扬机也可以,使用塔吊、 圆筒吊也可以,而且使用塔吊、圆筒吊远远比手摇卷扬机要昂贵 得多,但是,为什么现在我们还是要选择使用塔吊、圆筒吊呢? 因为,使用塔吊、圆筒吊虽然昂贵,但远比手摇卷扬机有效率且 效益更高!
一、对质量管理体系标准的理解
2 质量管理体系基础
(7) 文件 决定文件的因素 每个组织确定其所需文件的多少和详略程度及使用的媒体。这取决于下列 因素: a)组织的类型和规模; b)过程的复杂性和相互作用; c)产品的复杂性; d)顾客要求、适用的法规要求; e)经证实的人员能力; f)满足质量管理体系要求所需证实的程度。
内部培训资料

内部培训资料〔工艺技术方面〕版本:初级版状态:受控编辑:技术中心董金奎赵有兵李春平刘太保兴和县木子炭素有限责任公司自2021年7月26日起试行编辑说明本资料主要以入门培训为主,属专业知识的普及性资料,目的是使大家在短时间内迅速掌握碳石墨行业的特点及我公司产品的相关知识,便于迅速进入角色,展开工作。
故相关专业知识的表述不一定严谨和科学,只求能够迅速理解和掌握,故此有些概念的表述采用了形象化和本地化的语言。
此资料适用于营销人员、非生产管理人员、生产系统及其他管理岗位新进厂人员。
在此资料编辑的整个过程中,得到了各位领导和同事的大力支持和热情关注,在此一并表示感谢。
因时间仓促和水平所限,资料的缺乏之处敬请不吝批评指正,我们会在下次修订过程中予以完善。
本资料只供内部使用,因渉及企业技术及商业秘密,故不得将其原件或复印件转给他厂人员使用。
编者:王建新目录一、碳石墨行业的历史、现状及开展前景1.碳石墨行业的历史和现状2.碳石墨行业的开展前景二、碳石墨材料的结构、性能、理化指标、分类及用途1.碳石墨材料的微观结构2.碳石墨材料的性能3.碳石墨材料的理化指标4.碳石墨材料的分类及用途三、碳石墨产品制造的一般工艺过程四、我公司生产产品的历史、种类、性能、理化指标的概述五、炭素材料在国民经济各部门的应用情况概略六、附录第一章、碳石墨行业的历史、现状及开展前景1.碳石墨行业的历史和现状自古以来,炭素材料就与人类的生活息息相关。
根据宇宙大爆炸学说,在约一五0亿年前,由巨大的能量块生成了根本粒子,根本粒子又生成了氢和氦,三个氦原子结合就生成了碳。
人类大量使用火是在约2万年前,用于取暖的木材或植物燃烧后的剩余物、烹调食物时的动植物焦化物等都是人类随处可见的炭。
而在公元前16世纪的巴比伦、公元前10世纪的殷墟的甲骨文中,煤炱已用作墨水使用。
木炭、煤炭、煤炱、石墨等在我们的生活中被用作燃料、颜料和冶炼金属的复原剂等,在一八世纪的工业革命以前,炭的利用都没有太大的变化。
CTD手册——精选推荐

卓越少年成长计划之Center for Talent Development 2013 西北大学天才培养中心Handbook目录项目综览 (3)学院介绍 (4)课程设置 (4)日程按排 (5)营地费用 (5)营地管理 (5)申请资格 (5)项目流程 (5)Q&A (5)项目综览西北大学“天才培养中心”(Center for Talent Development),简称CTD,始建于1982年,是美国最富盛名的三大天才青少年培养项目之一,与CTY, TIP齐名,致力于通过先进的教学手段,高强度的课程内容,培养和锻炼天才学生。
通过在CTD的学习,天才学生不仅将得到智力能力和学习知识方面的提高,更将磨炼取得卓越成就所需的品格和能力,如创造力、自我激励、毅力等。
CTD开设的暑期项提供英语写作、人文、数学、科技等方向的荣誉或AP水平的课程,课程设置是高强度、高难度、高标准。
由经验丰富的高中或大学教师进行授课。
学生任选一门课进行为期三周的深入学习,每门课程相当于大学一个或两个学期的学习内容,75个小时的授课时间,学习结束后可以获得美国高中学分。
暑期课程将最大程度地开发学生在某个学科上的潜能,培养学生自我认识、自我主导的学习能力和批评性思维能力,为挑战AP课程和大学课程做好准备,同时也帮助学生更好的理解和设计自己未来兴趣专业,为今后升学指导方向。
CTD针对全球招生,只有各国前5%的学生才有可能进入项目,学生和来自全球的精英同台竞技,建立国际友谊。
学生在项目期间,食宿全部都是在西北大学学校内部,深入体验名校大学生活。
通过丰富的课外活动感知美式教育的精髓,与国际精英建立友谊。
学院介绍美国西北大学成立于1851年,由1位物理学家、2位商人、3位检察官及3位牧师为了让西北区域的人民受教育所创办。
西北大学建立150多年来,已经拥有超过16万位校友,许多人事业有成,声誉卓著,其中包括诺贝尔文学奖获得者贝娄(Saul Bellow),托尼奖获得者海德里(Heather Headley)和齐默曼(Mary Zimmerman),卡夫食品CEO霍尔顿(Betsy Holden),美国最高法院大法官斯蒂文斯(John Paul Stevens),以及美国航空航天局前局长维勒(Edward J Weiler)和著名影星辛迪克劳芙(Cindy Crawford)等等。
TCL内部培训教材

TCL内部培训教材山东世盛成长研发中间吴金河【破冰活动】治理小品心得分享◎分组与团队建立‧小组定名:‧精力标语:◎「治理小品」梅瑞特饭铺心得分享思虑偏向……1.从客户关系治理及变革角度看本个案您的领会有些什么?2.依您工作岗亭近况是否也有类似体会可供分享?※【治理小品】─梅瑞特饭铺1989年11月的某天晚上,伊丽莎白‧莫瑞斯正在《梅瑞特饭铺》的客房办事组值班。
傍晚时,伊丽莎白接到一通住在饭铺内,一位到城里来出差的女佃农德律风。
她因为不想到餐厅用膳,因此打德律风来点餐。
伊丽莎白依言挂号下来,然后交待处理。
过了几分钟,这位女佃农又打内线德律风进来了。
此次是要撤消订餐。
一样说来,客户撤消订餐是专门常见的工作,然则这一次,伊丽莎白总认为有什么工作不太对劲。
《梅瑞特饭铺》多年来一向致力于文化的改革,重要目标确实是为了鼓舞职员在面对问题时,能够或许独当一面,以客为尊。
因为受过这种专业的练习,因此在接到这通德律风后,伊丽莎白推敲的不仅是贸易上的不雅点,她甚至担忧背后是不是还另有隐情。
因此她急速连络办事生工头来代她的班,然后亲自去拜望这位女佃农。
敲开门后,她简短地介绍本身,以及来那个地点的目标,然后倾听佃农的答复。
成果才发明,本来这位佃农在点餐完后打德律风回家,得知她母亲患了宿疾住在病院,生怕熬只是今晚。
在与机场连络过后,沮丧地得知,她已赶不及最后一班飞机回家了。
因为伊丽莎白的机警,及时从佃农来电撤消订餐,听出那份忧?的语气。
她急速掌控全局,除了立时拨德律风到机场,以《梅瑞特饭铺集团》的名义包袱班机延滞费而延下班机之外,同时还召来办事生,帮这位女佃农整顿行李,请门房召来出租车,直奔机场。
因为伊丽莎白的机警,让客户顺利赶赴母亲自旁,临终前见她最后一面。
※有效推动与拥抱变革◎3C时代•Customer 客户核心•Competition 竞争•Change 诡谲多变◎跳出思虑陷阱,立异思虑•往常体会陷阱•成功的陷阱•空间的陷阱•核心/背景的陷阱•改变的省思◎Lewin变革三步调解冻→推动→再结冻(unfreezing) (movement) (refreezing)◎变革时期模式否定抗拒回收投入※客户知足行销不雅念的演进◎客户知足时代演进§60年代•寻求数量•味觉触觉•产品时代•理性•临盆技巧•寻求品德•嗅觉听觉•定位时代•理性+感性•品德晋升§80年代•寻求形象•视觉知足•VI/CI时代•感性•塑造形象§90年代•寻求心灵•心灵知足•CS时代•互动•客户知足◎客户知足办事三时期STEP1:•欢乐(客户导向的情势别处论)…被动/保持近况…未顾及“沉默的不知足者”STEP2:•觉悟(客户导向的主动积极论)…具主动关怀意识…强调“客户核心”、“客户敏锐度“献身(客户导向的策略伙伴论)…客户是公司〝策略性资产〞、“策略性伙伴”…TCI(Total Customer Integration)◎客户办事好处演进时期※顾客关系治理(CRM)的定义与趋势◎顾客关系治理(Customer Relationship Management)—是一种企业藉由积极深化与客户之间的关系,以操纵客户的讯息,同时应用此些客户信息,裁身定制不合的贸易模式及策略应用,以知足个别客户的需求。
CTD资料合成部分 ppt课件

3.2.S.2.6 生产工艺的开发 提供工艺路线的选择依据(包括文献依据 和/或理论依据)。 提供详细的研究资料(包括研究方法、研 究结果和研究结论)以说明关键步骤确定 的合理性以及工艺参数控制范围的合理性。
提供详细的工艺研究资料(包括实验数据及图谱), 说明在开发阶段对哪些工艺步骤以何质量指标进行 了工艺条件的优选与放大研究。该资料应能充分证 明申报的工艺有充足的研究与放大的数据支持,保 证现有的申报工艺的规模、物料控制、操作流程及 主要设备均已基本与大生产一致,已生产的批数与 各批产品的质量均能反映出工艺具备一定的重现性, 进而证明该申报工艺的合理性与大生产的可行性。
PPT课件
6
工艺描述:以目前生产的最大批量为例, 按工艺流程详细描述各步工艺操作。列明 各反应的设备、物料的投料量(重量、摩 尔比)、反应条件(温度、时间等)、反 应进程控制方法与指标、后处理方式、分 离纯化的详细过程、各中间体的重量与收 率。
PPT课件
7
(3)生产设备:提供主要和特殊设备的型 号及技术参数(如型号、材质、操作原 理)、正常的批量范围、生产厂、用于的 反应步骤等。并说明与现有最大的生产批 量的匹配性。如现有最大的生产批量所用 主要生产设备与实际生产线的不一致,应 提供相应的放大研究的试验和文献依据, 以证明在实际生产线上能按照空白的批生 产记录上的工艺稳定地生产出合格的原料 药。
PPT课件 26
应提供对本品的降解途径与降解产物进行 系统研究的详细的试验资料和充分的文献 资料,明确本品可能的降解途径与降解产 物。 结合起始原料和本品的制备工艺,详细提 供对原料药可能存在的基因毒性杂质所进 行的分析、研究和控制的资料,并参考ICH M7指导原则的要求,制定合理的控制策略, 必要时订入本品的质量标准中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1
原料药生产工艺资料要求 2.3.S.2.6 生产工艺的开发 工艺的主要变化,示例如下:
1
原料药生产工艺资料要求 2.3.S.2.6 生产工艺的开发 提供工艺研究数据汇总表,示例如下:
样品质量 批号 试制日期 批量 收率 试制目的/样品 用途 含量 杂质 性状等
1
原料药生产工艺资料要求
1
汇报内容
1
原料药生产工艺资料要求 2.3.S.2.4 关键步骤和中间体的控制 关键(Critical):必须被控制在预先确定的标准范围内的工艺步骤、工艺条 件和参数----ICH Q7A 关键工艺参数:对终产品质量有重要影响,微小的改变即可对后续反应和产 品质量产生明显影响
关键步骤如何来界定:
方法一:依据经验 “平顶型”反应和“尖顶型”反应
1
关键工艺参数的确定方法--辉瑞
1
原料药生产工艺资料要求 2.3.S.2.4 关键步骤和中间体的控制 2.3.S.2.4 .2中间体控制 列出已经分离中间体的质量控制标准、包括项目、方法和限度,并提供必要的 方法学验证资料
意义:
及时纠偏,保证生产过程的一致性 质控前移,保证终产品的质量一致性
质控限度的确定要有充分的依据
三批SM的含量实测结果皆在98%以上,标准定95%?? 某SM中有10%的杂质A,但研究显示其存在对后续反应无影响,终
产品中无杂质A以及大于0.1%的杂质存在,标准中定为小于10% (√)
从SM到终产品,如果申报的合成步骤较短、SM的结构复杂,监管机构可 能要求申办人: 提供起始原料的合成工艺 结合其合成工艺制定针对性的内控标准,重点关注杂质情况 提供对起始原料厂家的审计报告,并对生产厂进行延伸检查
杂质研究的思路
1
杂质研究
2.3.S.3. 特性鉴定
2.3.S.3.1 结构和理化性质
(1)结构确证 列出结构确证研究的主要方法(例如元素分析、IR、UV、NMR、MS等)和结果。 详细信息参见申报资料3.2.S.3.1(注明页码)。 说明结构确证用样品的精制方法、纯度,对照品的来源及纯度。 (2)理化性质 详细信息参见申报资料3.2.S.3.1(注明页码)。
1
原料药生产工艺资料要求 2.3.S.2.2. 3生产设备 列表给出主要和特殊设备的型号以及技术参数 关注点:需要与生产现场核查所用的工艺信息表中的信息一致 2.3.S.2.2. 4批量范围 说明大生产的拟定批量范围 关注:注册批和拟定大生产批之间的批量差距
1
原料药生产工艺资料要求 2.3.S.2.3 物料控制 按照工艺流程图中的工序,列表给出生产中用到的所有物料(如起始原料、反
1
原料药生产工艺资料要求
2.3.S.2.2 生产工艺和过程控制
2.3.S.2.2.1工艺流程图 应提供如下信息: 各个关键步骤 各起始原料、中间体、终产品的化学名称和代号 化学结构式和分子式 各步骤的操作参数(如温度、时间、压力、PH值) 各关键工序的控制手段,标出过程控制点
1
原料药生产工艺资料要求
1
原料药生产工艺资料要求 2.3.S.2.2.2工艺描述 以注册批为代表,列明各步反应的物料投料量,工艺参数以及各步收率范围。 明确关键生产步骤、关键工艺参数以及中间体的质控指标 关注点: 详细描述加入物料的量、工艺控制点(范围)、设备的容量、收率的范围 工艺描述中给出的工艺应与生产现场检查的工艺一致,并与生产工艺规程 和批生产记录样稿一致。 关键步骤的界定、过程控制的设置是否有工艺研发数据
根据研究结果确定的各关键工艺参数在实际生产时的控制范围
关注要点: 验证方案是否包括了对所有关键工艺的控制要求:验证中是否对所有关键 工艺参数进行了控制和检测 工艺参数是否与申报资料中描述一致 验证结果是否证明质量符合标准,杂质谱是否和历史数据有可比性或更优 1
原料药生产工艺资料要求 2.3.S.2.6 生产工艺的开发 提供工艺路线的选择依据(文献依据、理论依据),提供详细的研究资料以说 明关键步骤的合理性以及工艺参数控制范围的合理性。详细说明在工艺开发过程 中工艺的主要变化(包括批量、设备、工艺参数以及工艺路线的变化)以及相关 的支持性验证研究资料。 逻辑性:从小试-中试-大生产的规模以及规模带来的参数变化,参数发生变 化一定要详细说明,并说明变更理由 合理性:每个关键工艺参数都要进行规模相关的研究,最终确定的参数应有充 分的依据
多晶型的研究方法和结果:
溶剂化物/或水合物的研究方法和结果: 粒度检查方法和控制要求:
1
杂质情况分析
杂质研究
2.3.S.3.2 杂质 以列表的方式列明产品中可能含有的杂质,分析杂质来源,并提供控制限度,对于
已知杂质需要提供详细的结构确证资料
杂质名称 杂质结构 杂质来源 控制限度 是否定入标准
1
杂质情况分析
关注点:
中间体质控标准中,项目的限度确定应有依据 关注各中间体的杂质溯源和杂质去向
1
原料药生产工艺资料要求 2.3.S.2.4 关键步骤和中间体的控制-- 评价要点一: 关键步骤是否已经界定,是否提供了支持性依据,是否合理 是否制定了各中间体和粗品的质量标准,标准是否合适 所有关键参数、过程检测、质控要求是否描述清晰 关键步骤的控制是否和相关批(如工艺验证批等)的批生产记录一致 评价要点二: 关键工艺的变更不得擅自修改和变更 上市后,关键工艺参数的变更应进行相关的验证性研究,并进行补充申请 的申报和审批,获得批准后方可进行变更
1
原料药生产工艺资料要求 2.3.S.2.5 工艺验证和评价 工艺验证(Process Validation)--系统论证药品生产步骤、过程、设备、原料、 人员等因素,保证生产工艺能达到预订的结果,并保持药品生产的一致性和连续 性所进行的研究工作。
目的和意义:
确保批准的生产工艺在生产线上能够连续的生产出质量一致的样品,实现 生产过程的最优化
杂质研究
对于药品来说哪些是杂质,杂质的概念是什么? 杂质谱的概念是??
1
杂质情况分析
杂质研究
1
杂质情况分析
杂质研究
1
杂质情况分析
杂质研究
1
杂质情况分析
杂质研究
1
杂质情况分析
杂质研究
1
杂质情况分析
杂质研究
1
杂质情况分析
杂质研究
1
杂质情况分析
杂质研究
1
杂质情况分析
杂质研究
1
杂质情况分析
提升研发水平:正视薄弱环节,切实提高研发水平 重视工艺全过程的控制与规模化生产的可行性:过程控制、关键 步骤和中间体的控制、工艺验证和规模化生产 杂质的控制:杂质的定性与溯源、分析方法的可行性和验证、杂 质控制的全面性和限度
包材的选择与相容性:包材的质量、迁移和吸附实验
1
汇报内容
原料药生产工艺资料要求
2012年CTD培训资料的解读和分享
CTD简介
CTD(Common Technical Document)是人用药品注册技术要求协调会 (ICH)为协调统一ICH地区注册申报资料的格式而起草的通用技术文件 2003年7月,欧盟和日本把CTD格式作为提交新药注册申请资料的强制 格式 FDA强烈推荐采用CTD格式提交NDAS资料 非ICH成员国例如加拿大、澳大利亚等均接收CTD格式的申报资料 2011年9月,世界卫生组织强制实施CTD格式
1
原料药生产工艺资料要求
2.3.S.2.1 生产商
生产商的名称(一定要写全称)、地址以及生产场所的地址。 关注:生产场所与生产许可证上的地址要一致,并与生产现场检查地址一致 地址为生产活动的实施场所,而非公司总部地址 延伸检查:如起始原料为外购中间体,则必要时要对其供应商进行延伸检 查,需明确其供应商地址
原料药质量控制体系
物料/包 材控制
生产过 程控制
终产品 控制
工艺 参数
环境 控制
过程 控制
中间体控 制和检测
1
CTD对药品研发的影响
转变研发理念
念
CTD格式申报资料不仅仅是格式上的改变,实质是研发理念的转变
由孤立、机械、僵化走向系统 质量源于设计的过程控制和终点控制相结合的、全面系统的药品研发理
检验控制质量
药品质量是通过 检验来控制的 药品质量是通过 生产过程控制来实现
强调对质量 标准的审评
生产控制质量
Hale Waihona Puke 重视质量标准, 同时也重视工艺
对产品和工艺有更全 面了解,拓展监管灵 活度(发展方向)
质量源于设计
Quality by Design ,QbD
药品质量是通过良好 的设计而生产出来的
1
CTD简介
终产品中的杂质超标,晶型、结晶水不符合要求
起始原料的要求 SM固定的来源和生产工艺
建立严格的内控标准,保证不同批次起始原料的质量一致性
密切关注起始原料中的杂质去向以及对终产品的影响
1
原料药生产工艺资料要求 续上一页 起始原料的内控标准 所设置的质控项目要有针对性 如手性起始原料,要设置光学纯度考察
1
原料药生产工艺资料要求 2.3.S.2 生产信息 2.3.S.2.1 生产商 2.3.S.2.2 生产工艺和过程控制 (1)工艺流程图 (2)工艺描述
(3)生产设备
(4)大生产的拟定批量 2.3.S.2.3 物料控制
2.3.S.2.4 关键步骤和中间体的控制
2.3.S.2.5 工艺验证和评价 2.3.S.2.6 生产工艺的开发
尖顶型反应,参数的控制范围较窄,对环境、条件要求严格,可能为关键
步骤,需要重点考察其反应参数、规模放大对参数的影响 例如:格式反应 有催化剂的反应
1
原料药生产工艺资料要求 关键步骤如何来界定: 方法二:依据前期(小试、中试)研究的结果 方法三:依据惯例 越靠近终产品的步骤,对终产品质量的影响越大 终产品的精制、纯化工艺步骤:直接影响有关物质、残留溶剂、晶型、溶 剂化物
