用包埋脱水法冰冻保存小新月菱形藻
藻种保存方法

藻种保存方法藻类是地球上最早出现的植物之一,在海洋和淡水生态系统中扮演着重要的角色。
它们是浮游植物的主要组成部分,为海洋生物提供食物和氧气。
藻类还具有很高的营养价值,被广泛用作食品和饲料。
由于藻类在生态系统和人类生活中的重要性,对其种质资源的保存十分重要。
藻种保存是指运用适当的方法将藻类种质资源保存起来,以备将来研究和利用。
藻种保存的方法有很多种,根据藻类的类型和保存时间,可以分为以下几种:1. 低温保存低温保存是将藻类细胞或藻种库保存在低温条件下,以抑制细胞的代谢活动,从而延长其寿命。
低温保存藻类的常用方法有冷藏保存、冰冻保存和液氮保存。
冷藏保存:将藻类细胞或藻种库保存在4℃左右的冰箱中,可以保存1-2个月。
冰冻保存:将藻类细胞或藻种库保存在-20℃左右的冰柜中,可以保存1-2年。
液氮保存:将藻类细胞或藻种库保存在-196℃的液氮中,可以保存数十年甚至数百年。
2. 干燥保存干燥保存是指将藻类细胞或藻种库干燥到水分含量很低的状态,以抑制细胞的代谢活动,从而延长其寿命。
干燥保存藻类的常用方法有风干保存、微波干燥保存和喷雾干燥保存。
风干保存:将藻类细胞或藻种库置于通风良好的地方,自然晾干。
微波干燥保存:将藻类细胞或藻种库置于微波炉中干燥。
喷雾干燥保存:将藻类细胞或藻种库喷雾成细小的液滴,然后用热空气干燥。
3. 化学保存化学保存是指将藻类细胞或藻种库浸泡在化学溶液中,以抑制细胞的代谢活动,从而延长其寿命。
化学保存藻类的常用方法有福尔马林保存、甘油保存和DMSO 保存。
福尔马林保存:将藻类细胞或藻种库浸泡在10%的福尔马林溶液中,可以保存1-2年。
甘油保存:将藻类细胞或藻种库浸泡在50%的甘油溶液中,可以保存1-2年。
DMSO保存:将藻类细胞或藻种库浸泡在10%的DMSO溶液中,可以保存数十年甚至数百年。
4. 培养保存培养保存是指将藻类细胞或藻种库接种到培养基中,并在适宜的条件下培养,以维持其存活和生长。
小新月菱形藻的生产性培养技术

的营养需求及摄食 习性 ,研制 出适 口性 、营养性 、消 化性 、稳定性和诱食性 良好 的系列 高效环保 型配 合饲 料 ,以推进河蟹养殖 的集约化 、规模化和产业化 ,确 保河蟹健康养殖的持续发展 。
表 2 两种 饲 料具体 收 益对 比 雌 蟹 雄蟹 虾 囱 5. 15 52 .
海 参 的 良好生物 饵 料 ,能促进 幼体 和 亲体 的生 长发
此介绍一些培养技术要点供参考 。
~、培养设施 来自1 藻种 的培 养 .
藻种的培养应在专用的光照培养
箱或保种室 内进行 ,为避免夏冬季温差的影响,应在 保种 室 内配 置空 调 。保 种用容 器可用 i0 0 毫升 、2 0 5
具体投 入明细 见表 1 :
表 1 两种 饲 料具体 投 入明细 元 项目 塘租 料 隆 鱼苗 苗 电费及其 他 饵 虾 水 合计 全 程投 喂配 合饲料 0 2 4 5 0 0 3 6 0 1 2 6 3 。 0 l0 7 2 1 64 全 程投 喂天 然饵 料 0 9 0 5 0 3 3 60 5 6 0 0 1O 7 24 3(
I 衄 旦 i 旦 塑旦 豆 拦 夔
小 新 月菱形 藻 ( ts h a c o tr u m n — 胧 z c i l s e im i u ts i a 是 新 月 菱 形 藻 的 一 个 类 型 ,俗 称 “ 硅 i sm ) 小 藻” 。在 分类上 属于硅藻 门,羽纹纲 ,双菱 形 目,菱 形藻 科 ,菱形 藻属 。细 胞似 月牙 形 ,体积 小 、耐低 温、繁殖速度快且对环境有较强的适应力 。小新 月菱 形藻细胞 内富含蛋 白质、脂肪酸 ,特别是不饱和脂肪 酸 (P ) 量较高 ,是水产经 济动物鱼 、虾 、贝类和 EA含
【国家自然科学基金】_小新月菱形藻_基金支持热词逐年推荐_【万方软件创新助手】_20140802
推荐指数 2 2 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1
2011年 序号 1 2 3 4 5 6 7 8 9 10 11 12
2011年 科研热词 近缘种 菱形藻 群落结构 碳酸酐酶活性 盐度 浮游微藻 比较研究 小新月菱形藻 叶绿素a荧光参数 分类 凡纳滨对虾 优势种 推荐指数 1 1 1 1 1 1 1 1 1 1 1 1
2012年 序号 1 2 3 4 5 6 7 8 9 10 11
科研热词 饵料 船舶压载水 致死 羟基自由基 盐度 温度 海洋微藻 桡足类 摄食率 排粪率 强电场放电
推荐指数 1 1 1 1 1 1 1 1 1 1 1
2013年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20
推荐指数 1 1 1 1 1 1 1 1 1 1 1 1
2010年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
科研热词 摄食率 小新月菱形藻 食物选择性 西藏拟溞 褶皱臂尾轮虫 致死机制 羟基自由基 磷 碳酸酐酶 盐度 滤水率 温度 氮 无机碳利用 摄食节律 摄食生态 摄食 压载水
2014年 科研热词 微藻胞外分泌物 光解 no-3 no-2 2,4-d 推荐指数 1 1 铁 选食 质量浓度 褶皱臂尾轮虫幼虫 藻种纯化 营养盐浓度 菌株a18 群落演替 磷 氮 毒性评价 敏感性 摄食 抗生素 动力学 农药 丙烯酰胺
推荐指数 2 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1
2014年 序号 1 2 3 4 5
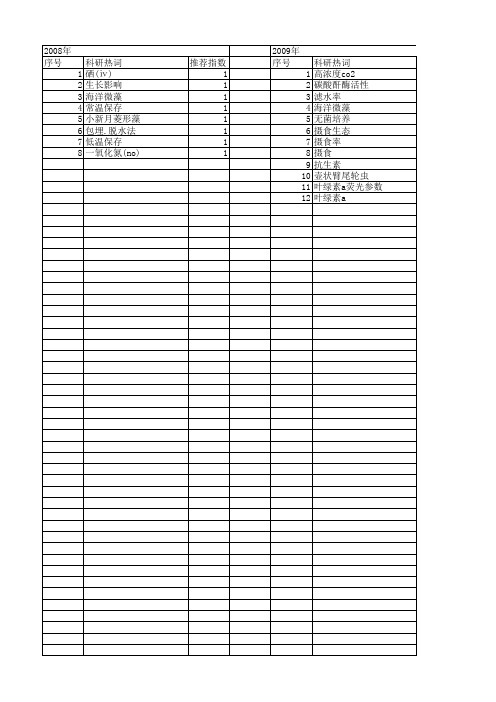
2008年 序号 1 2 3 4 5 6 7 8
科研热词 硒(ⅳ) 生长影响 海洋微藻 常温保存 小新月菱形藻 包埋.脱水法 低温保存 一氧化氮(no)
【国家自然科学基金】_新月菱形藻_基金支持热词逐年推荐_【万方软件创新助手】_20140731
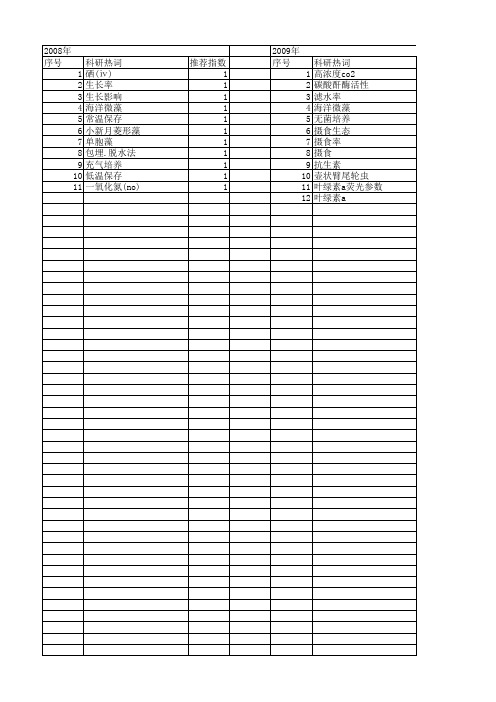
2013年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25
科研热词 微藻 饵料微藻 降解率 铁 选食 质量浓度 褶皱臂尾轮虫幼虫 藻种纯化 营养盐浓度 菌株a18 群落演替 细胞内结合态铝 磷 硅藻 甲藻 溶解态铝 清除机制 氮 毒性评价 敏感性 摄食 抗生素 动力学 农药 丙烯酰胺
科研热词 高浓度co2 碳酸酐酶活性 滤水率 海洋微藻 无菌培养 摄食生态 摄食率 摄食 抗生素 壶状臂尾轮虫 叶绿素a荧 1 1 1 1 1 1
2010年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27
2008年 序号 1 2 3 4 5 6 7 8 9 10 11
科研热词 硒(ⅳ) 生长率 生长影响 海洋微藻 常温保存 小新月菱形藻 单胞藻 包埋.脱水法 充气培养 低温保存 一氧化氮(no)
推荐指数 1 1 1 1 1 1 1 1 1 1 1
2009年 序号 1 2 3 4 5 6 7 8 9 10 11 12
2012年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19
科研热词 饵料 防污涂料 金属盐 船舶压载水 致死 羟基自由基 絮凝 盐度 环境友好 温度 海洋微藻 桡足类 有机膨润土 摄食率 排粪率 强电场放电 壳聚糖 压载水 入侵生物
推荐指数 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1
2011年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17
用包埋脱水法冰冻保存海洋饵料金藻 王起华李 贺=张恩栋高艳萍李大鹏

海洋与湖沼
OCEANOLOGIA ET LIMNOLOGIA SINICA
Vol . 36,No . 2 Mar. ,2 0 0 5
用包埋脱水法冰冻保存海洋饵料金藻*
王起华 李 贺= 张恩栋 高艳萍 李大鹏==1)
(辽宁师范大学生命科学学院 大连 116029) (= 大连民族学院生物工程系 大连 116600) =(= 中国科学院海洋研究所 青岛 266071)
脱水法研究了脱水速率、胶球含水量和化冻后恢 复方法对绿色巴夫藻( Pavlova viridis)、湛江等鞭 金 藻( Isochrysis zhanjiangensis )和 球 等 鞭 金 藻 ( Isochrysis galbana 3011)等几种海洋饵料金藻超低 温保存的影响。
1 材料与方法
每 10 个胶球为一组放入 2ml 的冻存管内,密 封后从室温下直接投入液氮中保存。24h 后取出 冻存 管 迅 速 放 入 40℃ 恒 温 水 浴 里 快 速 化 冻 约 3min,此操作参照王起华等(2000b)。 1.4 化冻后的恢复、再培养和存活率的测定 1.4.1 恢复 化冻后的胶球采用下述三种方 法恢复:(1)将 胶 球 移 入 f / 2 培 养 基 中,分 别 在 22℃ 和 4℃下暗放置。(2)将胶球移入直径 3cm 的培养皿中,将培养皿置于含有过饱和 NaCl 溶液 的密 闭 玻 璃 罐 的 上 部 气 相 中( 相 对 湿 度,RH 75 % )22 ℃ 下 暗 放 置。(3)将 胶 球 保 留 在 密 封 的 冻存管中,在 22℃下分别放置于暗中或光下。 1.4.2 再培养和存活率的测定 恢复过程完 成后,将胶球移入含 20ml f / 2 培养基的 50ml 三角 烧瓶中再培养,培养条件与前述材料培养条件相 同。5 天后,用丙酮提取胶球中的叶绿素,分别在 666nm 和 730nm 波长下测定提取液的光吸收度, 按照 Jense(n 1978)公式计算样品中的叶绿素 a 含 量。以未脱水未冰冻的样品作为对照,以未脱水 样品经过反复 3 次冰冻-化冻处理(每次冰冻保存 1h,其他同 1.3)后作为空白,根据叶绿素 a 含量 计算存活率。计算方法参见李莹等(2003)。
藻种保存方法

藻种保存方法藻类资源在生物学、食品加工、能源开发等领域具有重要应用价值,因此藻种保存方法对于藻类资源的研究和开发具有关键意义。
藻种保存方法多样,主要分为冷冻保存、干燥保存、液氮保存、低温保存等多种方式。
接下来将详细介绍这些藻种保存方法的原理、操作步骤和适用范围。
一、冷冻保存冷冻保存是一种常见的藻种保存方法,其原理是利用低温减缓细胞代谢,延缓细胞老化和腐败。
将培养基中的藻株与冷冻保护剂混合,然后放入冷冻管中,逐步降温至-80℃或更低温度保存。
冷冻方式适用于大多数藻类,保存时间可长达数年。
二、干燥保存干燥保存是将藻株或藻细胞在无水或极少水的条件下保存,通过将细胞中的水分蒸发掉,减缓细胞代谢和微生物的繁殖,达到保存的目的。
常见的干燥方法包括真空干燥、喷雾干燥和冷冻干燥等。
干燥保存适用于一些脆弱的藻类,保存时间相对较长。
三、液氮保存液氮保存是将藻株或藻细胞浸泡在液氮中保存,原理是利用液氮的低温和无氧环境,减缓细胞内代谢过程,从而达到保存的目的。
操作时,将藻株直接浸泡在液氮中,然后放入液氮罐中保存。
液氮保存适用于保存对低温要求较高的藻类,保存时间较长。
四、低温保存低温保存是将藻株或藻细胞存放在4℃以下的低温环境下保存。
这种保存方法简单易行,适用范围广泛,常用于一般藻类的保存。
在低温保存过程中,需要定期检查培养基的PH值和杂菌情况,确保藻株的保存状态。
在进行藻种保存的过程中,需要注意以下几点:确认藻株的种属和株系信息,并做好详细的记录。
使用无菌操作,保持培养基的无菌状态。
选择合适的保存方法,根据藻类的特性和要求选择最佳的保存方式。
保存后需定期检查保存状态,确保藻株的保存质量。
藻种保存方法的选择应根据实际需要和藻类特性进行科学合理的选择,以保证藻株的保存质量和长期保存的稳定性。
通过合理选择藻种保存方法,可以为藻类资源的研究和应用提供可靠的保障,促进藻类产业的发展。
2种培养方式对小新月菱形藻生长及菌群结构的影响研究

2种培养方式对小新月菱形藻生长及菌群结构的影响研究唐亚鹏; 王瑞旋; 黄建华; 杨丽诗; 江世贵; 林黑着; 王国福【期刊名称】《《南方水产科学》》【年(卷),期】2019(015)005【总页数】8页(P55-62)【关键词】小新月菱形藻; 培养方式; pH; 溶解氧; 菌落结构; 负压光生物反应器【作者】唐亚鹏; 王瑞旋; 黄建华; 杨丽诗; 江世贵; 林黑着; 王国福【作者单位】中国水产科学研究院南海水产研究所农业农村部南海渔业资源开发利用重点实验室广东广州510300; 天津农学院水产学院天津300384; 中国水产科学研究院南海水产研究所深圳试验基地广东深圳518121; 海南省海洋与渔业科学院海南海口571126【正文语种】中文【中图分类】S963.21+3小新月菱形藻(Nitzschia closterium f. minutissima)属于硅藻门、羽纹纲、双菱形目、菱形藻科、菱形藻属,其体积小、繁殖速度快,对环境有较强的适应力,细胞内富含多不饱和脂肪酸,是水产经济动物良好的生物饵料,拥有庞大的市场需求[1]。
小新月菱形藻的规模化培养是其开发和应用的关键,常见的微藻培养系统可分为开放式和封闭式。
传统饵料微藻培养主要采用开放式培养,这种培养方式构建简单、成本低廉且操作简便,但存在易受污染、培养条件不稳定、水分蒸发较快等缺点。
封闭式培养具有条件容易控制、不易污染、光能和二氧化碳(CO2)利用率较高等突出优点,利于进行微藻高密度培养,主要可分为管道式、平板式、柱式、搅拌式及浮式薄膜袋等[2-4]。
微藻大规模培养的藻种都是采用一级或二级培养的藻液,在微藻培养环境中会有大量细菌存在,这些细菌参与藻际环境中的物质循环,促进有机物质转化,改善藻类培养水环境[5-6],同时细菌也会对藻类生长及物质积累产生影响,进而影响藻类培养效果[7-10]。
管式光反应器培养系统具有光照表面积大,结构可调节性强以及CO2 吸收路径长等特点,广泛应用于微藻产率和光合效率的提高,以及生物活性物质的积累等方面[11-15],但在微藻培养过程中对藻际菌落的变化关注较少。
藻类冷冻干燥技术

藻类冷冻干燥技术藻类冷冻干燥技术是一种将藻类生物体在真空条件下从冻结状态直接升华脱水,从而得到干燥藻类粉末的方法。
这种技术能够在较低的温度下进行,最大限度地保留藻类中的活性成分和营养成分,同时保持其结构完整性。
在食品、医药、农业等领域有着广泛的应用前景。
以下是藻类冷冻干燥技术的详细介绍。
1. 藻类冷冻干燥的原理:藻类冷冻干燥技术基于升华原理,即将藻类生物体在低温下冻结,然后在真空环境中使冰晶直接从固态升华成为气态,从而使藻类中的水分得以脱除。
升华过程中,藻类生物体的温度保持在冰点以下,避免了高温对活性成分的破坏。
2. 藻类冷冻干燥的步骤:(1)藻类预处理:选择新鲜、纯净的藻类原料,进行清洗、去除杂质等预处理操作。
(2)冻结:将预处理后的藻类均匀铺设在低温冻结设备中,使藻类生物体温度降至冰点以下,形成固态冰晶。
(3)真空干燥:将冻结的藻类转移至真空干燥设备中,开启真空泵,使干燥室内压力降至一定真空度。
在真空条件下,藻类中的冰晶直接升华,水分得以脱除。
(4)干燥后处理:干燥完成后,关闭真空泵,取出干燥的藻类粉末,进行筛分、研磨等后处理操作,得到所需的干燥藻类产品。
3. 藻类冷冻干燥技术的优点:(1)活性成分保留:藻类冷冻干燥技术能够在较低温度下进行,避免高温对藻类中活性成分的破坏,最大限度地保留藻类的营养成分和生物活性。
(2)结构完整性:冷冻干燥过程中,藻类生物体的结构得以保持,有利于其在复水后的恢复和利用。
(3)水分活度低:冷冻干燥得到的藻类粉末水分含量较低,水分活度小,有利于产品的储存和运输。
(4)绿色环保:藻类冷冻干燥技术不涉及化学添加剂,是一种绿色、环保的干燥方法。
4. 藻类冷冻干燥技术的应用:(1)食品工业:干燥后的藻类粉末可作为食品添加剂,广泛应用于烘焙、饮料、调味品等领域,提供丰富的营养成分和独特的口感。
(2)医药领域:藻类冷冻干燥技术可用于制备药物活性成分,如藻类多糖、藻类蛋白等,具有显著的生物活性。
小新月菱形藻藻种培养

小新月菱形藻藻种培养1.藻种培养设施:藻种的培养要在保种室中进行,保种室要求通风条件好,光线条件好,温度可控性好,保种室要配有空调、冰箱、具有人工光源的培养架等。
培养中常用培养仪器有显微镜、解剖镜等,容器有三角烧瓶、广口玻璃瓶等。
保种室要严格消毒,防止病菌的侵入。
2.容器、工具的消毒:进行单细胞藻类的纯培养,容器、工具、培养基都要进行严格灭菌,但一般生产性的单种培养,则只须达到消毒目的就可以了。
常用的消毒方法有高温消毒法和化学药品消毒法。
高温消毒法是利用高温杀死微生物的方法。
不耐高温的容器接种环、镊子等金属小工具,试管口、瓶口等可以直接在酒精灯火焰上短暂灼烧消毒。
载玻片、小刀等则最好先蘸酒精,然后在酒精灯火焰上点燃,等器具上的酒精烧完,也就完成了灭菌操作。
b、煮沸消毒把容器、工具放入锅中,加水煮沸消毒,一般煮沸10-20 分钟。
大型锥形瓶消毒,可在瓶形瓶内加少量淡水,置电炉上加热煮沸5-10 分钟,可使整个瓶壁消毒。
消毒完毕即用消毒的纸或消毒的纱布包扎瓶口。
如塑料和橡胶制品等不能利用高温法消毒。
a、直接灼烧消毒此法适合消毒小型的容器工具。
C、烘箱干燥消毒将玻璃容器、金属工具用清水洗干净后,放入烘箱。
关闭烘箱门,打开通气孔,接通电源加热。
当温度上升到 120 C 时,关闭通 气孔,停止加热。
如果进行纯培养,容器必须灭菌,当温度上升到105 C 时,关闭通气孔,继续加热至 160 C,保持温 度,恒温 2 小时,然后停止加热。
必须要等到温度下降到 60C 不能超过180 C,以免烘焦。
化学药品消毒主要用于生产性大量培养中, 大型容器、 工具、 水泥池等常用化学药剂消毒。
a 、漂白粉消毒 工业用漂白粉般含有效氯 25%~35% ,消毒时按万分之 1-3 的含量配成水 溶液,把容器、工具在溶液中浸泡半小时,再用消毒水冲洗3~4 次即可。
b 、 酒精消毒 酒精消毒常用于中小形容器和 工具,方法是用纱布蘸 70%酒精在容器、工具的表面涂抹即可。
包埋玻璃化法冷冻保存两种饵料金藻的研究的开题报告

包埋玻璃化法冷冻保存两种饵料金藻的研究的开题报告一、研究背景和意义随着水产养殖业的发展,饵料的研究也越来越受到重视。
金藻是一种优良的饵料,具有高蛋白、高营养、易于消化吸收等特点,被广泛应用于水产养殖中。
然而,金藻的生长速度快,易受外界环境的影响,导致存储和使用上存在一定的挑战。
因此,研究金藻的长期保存方法,对保障水产养殖业的健康发展具有重要意义。
目前,常见的金藻保存方法有干燥法和冷冻保存法等。
而在冷冻保存方面,包埋玻璃化法是一种较为先进的方法。
该方法通过将金藻包埋在玻璃化物中,达到金藻细胞的抗冻效果,并且可以长期保存。
因此,对于金藻的长期保存,包埋玻璃化法的应用具有良好的前景。
二、研究内容和方法本研究将采用两种方法对金藻进行长期保存,分别是包埋玻璃化法和冷冻保存法。
研究首先将从自然水体中采集到的金藻,经过预处理后,按照一定的浓度分别进行两种保存处理,然后分别进行存储。
在存储过程中,需要对保存条件和存储时间进行控制。
对于包埋玻璃化法,需要进行干燥和包埋等工艺处理,并且控制温度和湿度等条件。
对于冷冻保存法,则需要将金藻样品放入冷冻保存器中,对温度和时间等条件进行控制。
研究采用多种方法进行数据统计和分析,包括金藻长期保存效果的比较、存储期间的生长情况、蛋白质含量、细胞形态等方面,以评估两种保存方法的优劣和适用范围。
三、研究预期结果通过本研究,预期可以得到以下结果:1. 比较包埋玻璃化法和冷冻保存法的金藻长期保存效果;2. 探究两种方法保存期间对金藻生长和细胞形态等方面的影响;3. 评估两种方法应用在不同情况下的适用范围;4. 提供有关金藻长期保存方法的实验数据和参考信息,为水产养殖饲料研究提供科学依据。
四、研究进程和时间安排本研究的进程和时间安排如下:1. 选择研究对象、文献调研和制定研究方案:1月;2. 采集金藻样品并进行预处理准备:2月-3月;3. 进行包埋玻璃化法和冷冻保存法实验:4月-5月;4. 按照预定方案进行数据统计和分析:6月;5. 撰写研究报告并进行总结:7月。
一种保藏微藻藻种的方法

一种保藏微藻藻种的方法微藻是一类微小的单细胞或多细胞藻类,具有广泛的应用前景,包括食品、饲料、能源和环境保护等领域。
为了保证微藻的保存和繁殖,我们需要采取一种有效的方法来保藏微藻藻种。
下面将介绍一种常用的方法——冷冻保存法。
冷冻保存法是将微藻藻种在低温条件下保存,以延长其保存时间和保持其生物学特性。
它是一种简单易行且成本较低的方法。
准备保存容器。
我们可以选择使用冷冻管或玻璃瓶作为保存容器,确保容器干燥且无污染。
准备保存液体。
一般而言,我们可以选择添加复方抗生素(如青霉素和链霉素)的液体培养基作为保存液体,以防止微生物污染。
然后,将微藻藻种培养液转移到保存容器中。
在转移过程中,应避免将空气带入容器,以免影响微藻的保存效果。
同时,应尽量减少保存容器的容积,以减少冷冻和解冻的时间。
接下来,将保存容器密封。
使用密封膜或橡胶塞密封保存容器,以防止保存液体的蒸发和外界污染的进入。
然后,将保存容器置于低温环境中。
一般而言,我们可以选择将保存容器放置在低温冰箱或液氮罐中进行保存。
在保存过程中,应避免保存容器受到震动和光照等外界因素的影响。
进行冷冻保存的时间。
根据具体的微藻种类和保存需求,我们可以选择适当的保存时间。
通常情况下,微藻藻种的冷冻保存时间可以达到数年之久。
在使用保存的微藻藻种时,我们需要先将保存容器从低温环境中取出,并迅速解冻。
为了保持微藻的活力和生物学特性,我们可以选择将保存容器放置在恒温培养箱中进行解冻。
在解冻过程中,应避免保存液体的蒸发和外界污染的进入。
冷冻保存法是一种常用且有效的微藻藻种保藏方法。
通过合理选择保存容器、保存液体和保存时间,我们可以成功地保存微藻藻种,并在需要时使用它们。
这种方法不仅简单易行,成本较低,而且能够保持微藻的生物学特性和活力。
希望通过这种方法,能够为微藻的研究和应用提供一定的帮助。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
海洋科学/ 2006 年/ 第 30 卷/ 第 4 期
51
图 2 胶球含水量对小新月菱形藻存活率的影响 Fig. 2 The effect of t he water content of beads on t he
viabilit y of N . closteri um mi nutissi ma
收稿日期 :2004202225 ;修回日期 :2004208210 基金项目 :国家自然科学基金资助项目 (30170099 ,30470184) ; 辽宁省教育厅科研基金资助项目(20041015) 作者简介 :王起华 (19432) ,男 ,辽宁北宁人 ,教授 ,主要从事 藻类生理和生物技术研究 , E2mail : qihua _ mail @163. co m ; 李大鹏 ,通讯作者 , E2mail :dpli @ms. qdio . ac. cn
2 结果与讨论
ห้องสมุดไป่ตู้
2. 1 藻细胞年龄对小新月菱形藻存活率的 影响
分别取指数期 (6 d) 和静止期 (10 d) 的材料用于 冰冻保存 。其结果如表 1 所示 ,指数期的小新月菱形 藻的冰冻保存存活率为 8. 3 %。而静止期的材料存 活率显著升高 ,达到 18. 3 %。这与王起华等[5] 采用 两步法冰冻保存该藻的结果基本一致 。Morris[14] 指 出 ,静止期的细胞由于受许多营养条件及物理因子 的限制 ,生理状态发生了很大变化 ,因而导致抗冻性 的增强 。但对某些藻类的研究结果表明 ,藻细胞年龄 对抗冻性的影响与藻类种类有关[4] 。
将上述胶球放置在 22 ℃暗室中 ,用硅胶吸湿法 脱水 。除特殊说明外 ,以每小时含水量减少 0. 9 %的 脱水速率脱水至 40 %含水量后测定胶球的含水量 , 方法参照李莹等[13 ] 。
1. 3 冰冻和化冻
胶球脱水后立即采用一步冰冻法快速冰冻 ,保存 24 h 后采用快速化冻法化冻 ,方法参照王起华等[12] 。
图 1 脱水速率对小新月菱形藻存活率的影响 Fig. 1 The effect of dehydration rate on t he viabilit y of
N . closteri um mi nutissi m a
2. 3 含水量对小新月菱形藻存活率的影响
胶球含水量对存活率的影响如图 2 所示 ,当含水 量高于 30 %时 , 冰冻前藻细胞的存活率随含水量减 小而缓慢 下 降 ; 当 含 水 量 为 30 %时 , 存 活 率 仍 在 80 %以上 ; 当含水量低于 30 %后 ,存活率随含水量的 减少而迅速下降 ;到含水量为 15 %时存活率已为零 。 对冰冻后的材料 , 当含水量为 40 %时存活率最高 , 约为 18. 3 % ,增大或减小含水量都会使存活率下降 。 上述结果与 Hirata[10 ] 和李莹[13 ] 用其他微藻得到的 结果相似 。本实验结果进一步表明 ,确定最适含水量 是提高冰冻存活率的重要因素之一 。样品保存前的 最适含水量因植物种类和材料类型的不同而不同 。 对高等植物来说 ,最适含水量变化范围很大 ,如体胚 或小孢子胚一般为 13 %~20 % ,而茎尖和分生组织 多为 20 %~40 %[8] 。已报道的藻类的最适含水量一 般为 40 %[10 ,11 ,13] 。但也发现有例外 ,作者在保存坛 紫菜丝状体时曾观察到 ,当含水量在 20 %~40 %范 围内 ,样品冰冻后的存活率几乎不受含水量的影响 , 都在 65 %左右[12 ] 。
图 4 为恢复方法对牟氏角刺藻存活率的影响。 各种恢复处理都在 12 h 达到最高存活率 ,这与小新 月菱形藻的情况相似 。不同的是 ,牟氏角刺藻在含过 饱和 NaCl 溶液的密闭气相 ( R H75 %) 中恢复时 ,存 活率最高 ,达 35. 1 %。在冻存管中恢复存活率较高 , 为 32. 5 %。而 在 培 养 基 中 恢 复 存 活 率 较 低 , 为 25. 1 %。
2. 4 化冻后恢复方法对存活率的影响
图 3 为恢复方法对小新月菱形藻存活率的影响 。 由图可知 ,各种恢复处理都在 12 h 达到最高存活率 , 在冻存管中恢复时存活率最高 ,达 18. 3 %。在含过 饱和 NaCl 溶液的密闭气相 ( R H75 %) 中恢复时 ,存 活率较高 ,为 17. 1 %。而在培养基中恢复存活率最 低 ,仅为 10. 9 %。
1 材料和方法
1. 1 材料及其培养
小新 月 菱 形 藻 ( N itzschi a closteri um mi nutis2 si m a) 由大连水产研究所提供 ,并由辽宁师范大学藻 类生理研究室纯化为单种 。藻种的培养条件为 18 ℃ ±2 ℃; 冷 荧 光 , 光 强 2 500 lx ±200 lx , 光 照 周 期 12 ∶12 。实验材料的培养光强为 2 900 lx ±200 lx , 其他条件同前 。牟氏角刺藻 ( Chaetoceros m uel leri ) 的培养条件见文献[ 13 ] 。除特殊说明外 ,取培养 10 d 的材料 (静止期) 用于冰冻保存 。
冰冻后
8. 3 ±1. 8
18. 3 ±2. 8
2. 2 脱水速率对小新月菱形藻存活率的影 响
如图 1 所示 ,脱水速率对冰冻前包埋材料的存活 率影响很小 ,存活率都在 80 %左右 。然而 ,脱水速率 对冰冻后材料的存活率有显著的影响 ,当脱水速率 在含水量每小时减少 0. 9 %时 ,可获得最大存活率 , 为 18. 3 %。这一结果与 Hirata 等[10] 对杜氏藻的研
用包埋脱水法冰冻保存小新月菱形藻
王起华1 , 李 莹2 , 刘艳萍1 , 李大鹏3
(1. 辽宁师范大学 生命科学学院 , 辽宁 大连 116029 ;2. 辽阳职业技术学院 师范分院 ,辽宁 辽阳 111000 ; 3. 中国科学院 海洋研究所 ,山东 青岛 266071)
摘要 :采用包埋脱水法研究了小新月菱形藻 ( N itzschi a closteri um mi nutissi m a) 的超低温保 存 ,探讨了影响存活率的内 、外因素 :藻细胞年龄 、脱水速率 、胶球含水量和化冻后的恢复方 法等 。结果表明 ,将处于静止初期的藻细胞包埋在含有 0. 5 mol/ L 蔗糖的 3 %褐藻酸钙胶球 中 ,以含水量每小时减少 0. 9 %的平均速率脱水至胶球含水量为 40 % ,化冻后在冻存管中室 温下暗恢复 12 h 的条件下冰冻存活率较高 ,可达到 18. 3 %左右 。与常规的两步法冰冻保存 相比 ,包埋脱水法可大大简化操作程序 ,是保存小新月菱形藻的一种有潜力的方法 。
图 3 化冻后恢复方法对小新月菱形藻存活率的影响 Fig. 3 The effect of recovery met hod after t hawing
on t he viabilit y of N . closteri um mi nutissi m a
图 4 化冻后恢复方法对牟氏角刺藻存活率的影响 Fig. 4 The effect of recovery met hod after t hawing on
t he viabilit y of Chatoceros m uelleri
在包埋脱水法中 ,对经历了脱水2冰冻2化冻过程 的胶球 ,在再培养之初 ,还要经历一个“复水”的过程 , 即恢复到正常含水量的过程 。在本实验所采用的 3 种恢复方法中 ,第一种方法是将含藻细胞的胶球直接 移入培养基中恢复 ,在恢复开始 ,藻细胞会经历一个 快速的复水过程 ;第二种方法是将含藻细胞的胶球移 入含有过饱和盐类的密闭气相中恢复 ,藻细胞在修复 损伤过程的同时 ,会经历一个相对慢速的复水过程 , 其复水速率与过饱和盐类的相对湿度有关 ;第三种方 法是将含藻细胞的胶球保持在密封的冻存管中 ,使胶 球含水量保持在脱水后的状态 ,细胞在恢复过程中并 不经历复水过程 ,需等到再培养开始 (胶球移入培养 基) 时 ,才完成复水过程 。本实验结果表明 ,第三种方 法适合于小新月菱形藻细胞的恢复 ,而第二种方法中 含过饱和 NaCl 溶液的密闭气相 ( R H75 %) 适合于牟 氏角刺藻的恢复 。关于恢复方法对藻类冰冻保存的 影响的研究至今尚无公开报道[7 ,15] ,许多问题仍有待 更进一步的研究 。
50
Marine Sciences/ Vol . 30 ,No . 4/ 2006
1. 4 化冻后的恢复
化冻后的胶球采用下述 3 种方法恢复 : (1) 将胶 球移入 f/ 2 培养基中 ; (2) 将胶球移入直径 3 cm 的培 养皿中 ,将培养皿分别置于含有过饱和盐 ( KNO3 、 NaCl 和 NaNO2 ) 溶液的密闭玻璃罐的上部气相中 , 其相对湿度 ( R H) 分别为 KNO3 , 92 % ; NaCl , 75 % ; NaNO2 , 64 % ; (3) 将胶球保留在密封的冻存管中 。 上述处理都是在 22 ℃暗中进行 ,除特殊说明外 ,恢复 时间都是 12 h 。
1. 2 包埋和脱水
1. 2. 1 包埋 取上述培 养 材 料 , 离 心 除 去 培 养 液 , 用 含 0. 5
mol/ L 蔗糖的消毒海水再悬浮至适当密度 ,与含 0. 5 mol/ L 的蔗糖和 30 ‰NaCl 的 6 %褐藻酸钠 ( SIGMA C H EMICAL Co . ) 溶液等体积混匀 ,移入具 6 号针头 的 10 mL 注射器中 ,将藻液滴入含相同浓度的蔗糖 和 NaCl 的 0. 1 mol/ L CaCl2 溶 液 中 , 轻 轻 摇 动 , 60 min 后完成包埋过程 。控制条件可制成直径为 2. 5 mm ,藻密度为 200 ×104 个/ 球的胶球 。此方法参照 文献[ 13 ] 。 1. 2. 2 脱水及含水量的测定
1. 5 存活率的测定
上述实验均以未脱水且未冰冻的包埋材料作为 对照样品 , 将对照样品和冰冻前后的包埋2脱水样品 分别再培养 5 d ,培养条件与前述实验材料的培养条 件相同 。用 90 %丙酮提取叶绿素后计算其含量 ,并 根据叶绿素含量计算存活率[13] 。
