第7章 气体动理论基础习题
第7章气体动理论习题解答

第7章 气体动理论7.1基本要求1.理解平衡态、物态参量、温度等概念,掌握理想气体物态方程的物理意义及应用。
2.了解气体分子热运动的统计规律性,理解理想气体的压强公式和温度公式的统计意义及微观本质,并能熟练应用。
3.理解自由度和内能的概念,掌握能量按自由度均分定理。
掌握理想气体的内能公式并能熟练应用。
4.理解麦克斯韦气体分子速率分布律、速率分布函数及分子速率分布曲线的物理意义,掌握气体分子热运动的平均速率、方均根速率和最概然速率的求法和意义。
5.了解气体分子平均碰撞频率及平均自由程的物理意义和计算公式。
7.2基本概念1 平衡态系统在不受外界的影响下,宏观性质不随时间变化的状态。
2 物态参量描述一定质量的理想气体在平衡态时的宏观性质的物理量,包括压强p 、体积V 和温度T 3 温度宏观上反映物体的冷热程度,微观上反映气体分子无规则热运动的剧烈程度。
4 自由度确定一个物体在空间的位置所需要的独立坐标数目,用字母i 表示。
5 内能理想气体的内能就是气体内所有分子的动能之和,即2iE RT ν= 6 最概然速率速率分布函数取极大值时所对应的速率,用p υ表示,p υ==≈其物理意义为在一定温度下,分布在速率p υ附近的单位速率区间内的分子在总分子数中所占的百分比最大。
7 平均速率各个分子速率的统计平均值,用υ表示,υ==≈8 方均根速率各个分子速率的平方平均值的算术平方根,用rms υ表示,rms υ==≈ 9 平均碰撞频率和平均自由程平均碰撞频率Z 是指单位时间内一个分子和其他分子平均碰撞的次数;平均自由程λ是每两次碰撞之间一个分子自由运动的平均路程,两者的关系式为:Zυλ==或λ=7.3基本规律1 理想气体的物态方程pV RT ν=或'm pV RT M=pV NkT =或p nkT =2 理想气体的压强公式23k p n ε=3 理想气体的温度公式21322k m kT ευ==4 能量按自由度均分定理在温度为T 的平衡态下,气体分子任何一个自由度的平均动能都相等,均为12kT 5 麦克斯韦气体分子速率分布律 (1)速率分布函数()dNf Nd υυ=表示在速率υ附近单位速率区间内的分子数占总分子数的百分比或任一单个分子在速率υ附近单位速率区间内出现的概率,又称为概率密度。
2022大学物理B-第7章气态动理论答案

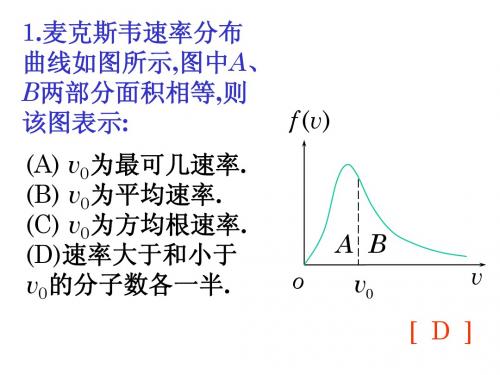
第7章 气体动理论练习题一、选择题1、若理想气体的体积为V ,压强为p ,温度为T ,一个分子的质量为m ,R 是摩尔气体常量,k 称为玻耳兹曼常量,则该理想气体的分子数为[ B ](A) pV/m. (B) pV/(kT).(C) pV/(RT). (D) pV/(mT).2、下列各式中哪一式表示气体分子的平均平动动能?(式中M 为气体的质量,m 为气体分子质量,N 为气体分子总数目,n 为气体分子数密度,mol M 为摩尔质量,A N 为阿伏加得罗常量)[ A ] (A)pV M m 23. (B) pV M M mol 23. (C) npV 23. (D) pV N MM A 23mol . 3、根据经典的能量按自由度均分原理,每个自由度的平均能量为[ C ](A) kT /4. (B)kT /3.(C) kT /2. (D)kT.4、在20℃时,单原子理想气体的内能为[ D ](A)部分势能和部分动能. (B)全部势能. (C)全部转动动能.(D)全部平动动能. (E)全部振动动能.5、如果氢气和氦气的温度相同,摩尔数也相同,则[ B ](A)这两种气体的平均动能相同. (B)这两种气体的平均平动动能相同.(C)这两种气体的内能相等. (D)这两种气体的势能相等.6、在一密闭容器中,储有A 、B 、C 三种理想气体,处于平衡状态.A 种气体的分子数密度为n 1,它产生的压强为p 1,B 种气体的分子数密度为2n 1,C 种气体的分子数密度为3 n 1,则混合气体的压强p 为[D ](A) 3 p 1. (B) 4 p 1.(C) 5 p 1. (D) 6 p 1.7、在容积V =4×10-3 m 3的容器中,装有压强P =5×102 Pa 的理想气体,则容器中气体分子的平动动能总和为[B ](A) 2 J . (B) 3 J .(C) 5 J . (D) 9 J .8、若室内生起炉子后温度从15℃升高到27℃,而室内气压不变,则此时室内的分子数减少了[B ](A) 0.500. (B) 400.(B) 900. (D) 2100.9、麦克斯韦速率分布曲线如图所示,图中A 、B 两部分面积相等,则该图表示[ D ](A) 0v 为最概然速率.(B) 0v 为平均速率.(C) 0v 为方均根速率.(D) 速率大于和小于0v 的分子数各占一半.0 v二、填空题 1、有一个电子管,其真空度(即电子管内气体压强)为1.0×10-5 mmHg ,则27 ℃ 时管内单位体积的分子数为_________________ .(玻尔兹曼常量k =1.38×10-23 J/K , 1 atm=1.013×105 Pa =76 cmHg )解:nkT p =故3001038.176010013.1100.12355⨯⨯⨯⨯⨯⨯==--kT p n =3.2×1017 /m 32、图示曲线为处于同一温度T 时氦(原子量4)、氖(原子量20)和氩(原子量40)三种气体分子的速率分布曲线。
物理学教程(第二版)上册课后答案7

物理学教程(第二版)上册课后答案7第七章 气体动理论7 -1 处于平衡状态的一瓶氦气和一瓶氮气的分子数密度相同,分子的平均平动动能也相同,则它们( )(A) 温度,压强均不相同 (B) 温度相同,但氦气压强大于氮气的压强(C) 温度,压强都相同 (D) 温度相同,但氦气压强小于氮气的压强分析与解 理想气体分子的平均平动动能23k /kT =ε,仅与温度有关.因此当氦气和氮气的平均平动动能相同时,温度也相同.又由物态方程nkT p =,当两者分子数密度n 相同时,它们压强也相同.故选(C).7-2 三个容器A 、B 、C 中装有同种理想气体,其分子数密度n 相同,方均根速率之比()()()4:2:1::2/12C 2/12B 2/12A =v v v ,则其压强之比C B A ::p p p 为( )(A) 1∶2∶4 (B) 1∶4∶8(C) 1∶4∶16 (D) 4∶2∶1 分析与解 分子的方均根速率为M RT /3=2v ,因此对同种理想气体有3212C 2B 2A ::::T T T =v v v ,又由物态方程nkT ρ,当三个容器中分子数密度n 相同时,得16:4:1::::321321==T T T p p p .故选(C).7 -3 在一个体积不变的容器中,储有一定量的某种理想气体,温度为0T 时,气体分子的平均速率为0v ,分子平均碰撞次数为0Z ,平均自由程为0λ ,当气体温度升高为04T 时,气体分子的平均速率v 、平均碰撞频率Z 和平均自由程λ分别为( ) (A)04,4,4λλZ Z ===0v v (B) 0022λλ===,,Z Z 0v v (C) 00422λλ===,,Z Z 0v v (D) 00,2,4λλ===Z Z 0v v 分析与解 理想气体分子的平均速率M RT π/8=v ,温度由0T 升至04T ,则平均速率变为0v 2;又平均碰撞频率v n d Z 2π2=,由于容器体积不变,即分子数密度n 不变,则平均碰撞频率变为0Z 2;而平均自由程n d 2π21=λ,n 不变,则λ也不变.因此正确答案为(B).7 -5 有一个体积为35m 1001⨯.的空气泡由水面下m050.深的湖底处(温度为C 0.4o )升到湖面上来.若湖面的温度为C 017o .,求气泡到达湖面的体积.(取大气压强为Pa 10013150⨯=.p )分析 将气泡看成是一定量的理想气体,它位于湖底和上升至湖面代表两个不同的平衡状态.利用理想气体物态方程即可求解本题.位于湖底时,气泡内的压强可用公式gh pp ρ+=0求出, 其中ρ为水的密度( 常取33m kg 100.1-⋅⨯=ρ).解 设气泡在湖底和湖面的状态参量分别为(p 1 ,V 1 ,T 1 )和(p 2 ,V 2 ,T 2 ).由分析知湖底处压强为gh ρp gh ρp p+=+=021,利用理想气体的物态方程222111T V p T V p =可得空气泡到达湖面的体积为()3510120121212m 1011.6-⨯=+==T p V T gh p T p V T p V ρ 7 -6 一容器内储有氧气,其压强为Pa 100115⨯.,温度为27 ℃,求:(1)气体分子的数密度;(2) 氧气的密度;(3) 分子的平均平动动能;(4) 分子间的平均距离.(设分子间均匀等距排列)分析 在题中压强和温度的条件下,氧气可视为理想气体.因此,可由理想气体的物态方程、密度的定义以及分子的平均平动动能与温度的关系等求解.又因可将分子看成是均匀等距排列的,故每个分子占有的体积为30d V=,由数密度的含意可知n V /10=,d 即可求出.解 (1) 单位体积分子数325m 1044.2⨯==kTp n (2) 氧气的密度3-m kg 30.1/⋅===RTpM V m ρ (3) 氧气分子的平均平动动能J 102162321k -⨯==./kT ε(4) 氧气分子的平均距离m 10453193-⨯==./n d通过对本题的求解,我们可以对通常状态下理想气体的分子数密度、平均平动动能、分子间平均距离等物理量的数量级有所了解.7-7 2.0×10-2 kg 氢气装在4.0×10-3 m 3 的容器内,当容器内的压强为3.90×105Pa 时,氢气分子的平均平动动能为多大?分析 理想气体的温度是由分子的平均平动动能决定的,即23k /kT =ε.因此,根据题中给出的条件,通过物态方程pV =Mm 'RT ,求出容器内氢气的温度即可得kε. 解 由分析知氢气的温度mRMpV T =,则氢气分子的平均平动动能为J 1089.3232322k -⨯='==Rm pVMk kT ε7 -8 某些恒星的温度可达到约1.0 ×108K ,这是发生聚变反应(也称热核反应)所需的温度.通常在此温度下恒星可视为由质子组成.求:(1) 质子的平均动能是多少? (2) 质子的方均根速率为多大?分析 将组成恒星的大量质子视为理想气体,质子可作为质点,其自由度 i =3,因此,质子的平均动能就等于平均平动动能.此外,由平均平动动能与温度的关系2/32/2kT m =v,可得方均根速率2v .解 (1) 由分析可得质子的平均动能为 J 1007.22/32/152k-⨯===kT m v ε (2) 质子的方均根速率为1-62s m 1058.13⋅⨯==mkT v 7 -9 日冕的温度为2.0 ×106K ,所喷出的电子气可视为理想气体.试求其中电子的方均根速率和热运动平均动能.解 方均根速率16e 2s m 105.93-⋅⨯==m kT v 平均动能J 10142317k -⨯==./kT ε7-10 在容积为2.0 ×10-3 m 3 的容器中,有内能为6.75 ×102J 的刚性双原子分子某理想气体.(1)求气体的压强;(2) 设分子总数为5.4×1022个,求分子的平均平动动能及气体的温度.分析 (1) 一定量理想气体的内能RT i M m E 2=,对刚性双原子分子而言,i =5.由上述内能公式和理想气体物态方程pV =νRT 可解出气体的压强.(2)求得压强后,再依据题给数据可求得分子数密度,则由公式p =nkT 可求气体温度.气体分子的平均平动动能可由23k /kT ε=求出.解 (1) 由RT i E 2ν=和pV =νRT 可得气体压强 Pa 1035.125⨯==iVE p (2) 分子数密度n =N/V ,则该气体的温度()()K 1062.3//2⨯===nk pV nk p T 气体分子的平均平动动能为J104972321k -⨯==./kT ε 7 -11 当温度为0C 时,可将气体分子视为刚性分子,求在此温度下:(1)氧分子的平均动能和平均转动动能;(2)kg 100.43-⨯氧气的内能;(3)kg 100.43-⨯氦气的内能.分析 (1)由题意,氧分子为刚性双原子分子,则其共有5个自由度,其中包括3个平动自由度和2个转动自由度.根据能量均分定理,平均平动动能kT 23kt =ε,平均转动动能kT kT ==22kr ε.(2)对一定量理想气体,其内能为RT i M mE 2'=,它是温度的单值函数.其中i 为分子自由度,这里氧气i =5、氦气i =3.而m '为气体质量,M 为气体摩尔质量,其中氧气13mol kg 1032--⋅⨯=M ;氦气13mol kg 100.4--⋅⨯=M .代入数据即可求解它们的内能.解 根据分析当气体温度为T=273 K 时,可得(1)氧分子的平均平动动能为J 107.52321kt -⨯==kT ε 氧分子的平均转动动能为J 108.32221kr -⨯==kT ε (2)氧气的内能为J 10 7.1J 27331.8251032100.42233⨯=⨯⨯⨯⨯⨯='=--RT i M m E (3)氦气的内能为J 10 3.4J 27331.823100.4100.42333⨯=⨯⨯⨯⨯⨯='=--RT i M m E 7 -12 已知质点离开地球引力作用所需的逃逸速率为gr v 2=,其中r 为地球半径.(1) 若使氢气分子和氧气分子的平均速率分别与逃逸速率相等,它们各自应有多高的温度;(2) 说明大气层中为什么氢气比氧气要少.(取r =6.40 ×106 m) 分析 气体分子热运动的平均速率M RTπ8=v ,对于摩尔质量M 不同的气体分子,为使v 等于逃逸速率v ,所需的温度是不同的;如果环境温度相同,则摩尔质量M 较小的就容易达到逃逸速率. 解 (1) 由题意逃逸速率gr 2=v ,而分子热运动的平均速率M RTπ8=v .当v v = 时,有RMrg T 4π= 由于氢气的摩尔质量13H mol kg 10022--⋅⨯=.M,氧气的摩尔质量12O mol kg 10232--⋅⨯=.M ,则它们达到逃逸速率时所需的温度分别为 K10891K,101815O 4H 22⨯=⨯=..T T (2) 根据上述分析,当温度相同时,氢气的平均速率比氧气的要大(约为4倍),因此达到逃逸速率的氢气分子比氧气分子多.按大爆炸理论,宇宙在形成过程中经历了一个极高温过程.在地球形成的初期,虽然温度已大大降低,但温度值还是很高.因而,在气体分子产生过程中就开始有分子逃逸地球,其中氢气分子比氧气分子更易逃逸.另外,虽然目前的大气层温度不可能达到上述计算结果中逃逸速率所需的温度,但由麦克斯韦分子速率分布曲线可知,在任一温度下,总有一些气体分子的运动速率大于逃逸速率.从分布曲线也可知道在相同温度下氢气分子能达到逃逸速率的可能性大于氧气分子.故大气层中氢气比氧气要少.7-13 容积为1 m 3 的容器储有1 mol 氧气,以v =10-1s m ⋅的速度运动,设容器突然停止,其中氧气的80%的机械运动动能转化为气体分子热运动动能.试求气体的温度及压强各升高了多少. 分析 容器作匀速直线运动时,容器内分子除了相对容器作杂乱无章的热运动外,还和容器一起作定向运动.其定向运动动能(即机械能)为221mv .按照题意,当容器突然停止后,80%定向运动动能转为系统的内能.对一定量理想气体内能是温度的单值函数,则有关系式:T R M m v m E Δ25%8021Δ2'=⋅'=成立,从而可求ΔT .再利用理想气体物态方程,可求压强的增量.解 由分析知T R M m m E Δ2528.0Δ2⋅'='=v ,其中m '为容器内氧气质量.又氧气的摩尔质量为12m ol kg 1023--⋅⨯=.M ,解得ΔT =6.16 ×10-2 K当容器体积不变时,由pV =M mRT 得Pa 51.0ΔΔ==T VRM m p7-14 有N 个质量均为m 的同种气体分子,它们的速率分布如图所示.(1) 说明曲线与横坐标所包围的面积的含义;(2) 由N 和0v 求a 值;(3) 求在速率0v /2到30v /2 间隔内的分子数;(4) 求分子的平均平动动能.题 7-14 图分析 处理与气体分子速率分布曲线有关的问题时,关键要理解分布函数()v f 的物理意义.()υd d N Nf =v ,题中纵坐标()v v d /d N Nf =,即处于速率v 附近单位速率区间内的分子数.同时要掌握()v f 的归一化条件,即()1d 0=⎰∞v v f .在此基础上,根据分布函数并运用数学方法(如函数求平均值或极值等),即可求解本题.解 (1) 由于分子所允许的速率在0 到20v 的范围内,由归一化条件可知图中曲线下的面积()N Nf S v ==⎰v v d 020即曲线下面积表示系统分子总数N .(2 ) 从图中可知,在0 到0v 区间内,()0/v v v a Nf =;而在0 到20v 区间,()αNf =v .则利用归一化条件有vv v vv ⎰⎰+=0020d d v v a a N(3) 速率在0v /2到30v /2间隔内的分子数为12/7d d Δ2/3000N a a N =+=⎰⎰v v v v v v v(4) 分子速率平方的平均值按定义为()v v f v v v d /d 0222⎰⎰∞∞==N N故分子的平均平动动能为20220302k 3631d d 212100v v v v v v v v v v m N a N a m m =⎥⎦⎤⎢⎣⎡+==⎰⎰ε 7-15 一飞机在地面时,机舱中的压力计指示为Pa100115⨯.,到高空后压强降为Pa101184⨯..设大气的温度均为27.0℃.问此时飞机距地面的高度为多少?(设空气的摩尔质量为2.89 ×10-2kg·mol -1) 分析 当温度不变时,大气压强随高度的变化主要是因为分子数密度的改变而造成.气体分子在重力场中的分布满足玻耳兹曼分布.利用地球表面附近气压公式()kT mgh p p /ex p 0-=,即可求得飞机的高度h .式中p 0 是地面的大气压强. 解 飞机高度为()()m 1093.1/ln /ln 300⨯===p p MgRT p p mg kT h7 -16 目前实验室获得的极限真空约为1.33×10-11Pa ,这与距地球表面1.0×104km 处的压强大致相等.而电视机显像管的真空度为1.33×10-3Pa ,试求在27 ℃时这两种不同压强下单位体积中的分子数及分子的平均自由程.(设气体分子的有效直径d =3.0×10-8cm)解 理想气体分子数密度和平均自由程分别为n =k T p ;pd kT λ2π2=,压强为1.33×10-11Pa 时,-39m 1021.3/⨯==kT p nm 108.7π282⨯==pd kT λ 从λ的值可见分子几乎不发生碰撞.压强为1.33×10-3Pa 时,3-17m 1021.3⨯==kT p n ,m 8.7π22==pd kT λ此时分子的平均自由程变小,碰撞概率变大.但相对显像管的尺寸而言,碰撞仍很少发生. 7-17 在标准状况下,1 cm 3中有多少个氮分子?氮分子的平均速率为多大?平均碰撞次数为多少?平均自由程为多大?(已知氮分子的有效直径m 1076.310-⨯=d )分析 标准状况即为压强Pa 10013.15⨯=p ,温度K 273=T .则由理想气体物态方程nkT p =可求得气体分子数密度n ,即单位体积中氮分子的个数.而氮气分子的平均速率、平均碰撞次数和平均自由程可分别由公式MRTv π8=,n v d Z 2π2=和nd 2π21=λ直接求出.解 由分析可知,氮分子的分子数密度为325m 1069.2-⨯==kTpn 即3cm 1中约有191069.2⨯个.氮气的摩尔质量为M =28 ×10-3kg·mol -1,其平均速率为MRTv π8==454 1s m -⋅则平均碰撞次数为-192s 107.7π2⨯==n v d Z平均自由程为m 106π2182-⨯==nd λ 讨论 本题主要是对有关数量级有一个具体概念.在通常情况下,气体分子平均以每秒几百米的速率运动着,那么气体中进行的一切实际过程如扩散过程、热传导过程等好像都应在瞬间完成,而实际过程都进行得比较慢,这是因为分子间每秒钟上亿次的碰撞导致分子的自由程只有几十纳米,因此宏观上任何实际过程的完成都需要一段时间.7-18 在一定的压强下,温度为20℃时,氩气和氮气分子的平均自由程分别为9.9×10-8m 和27.5×10-8m.试求:(1) 氩气和氮气分子的有效直径之比;(2) 当温度不变且压强为原值的一半时,氮气分子的平均自由程和平均碰撞频率. 分析 ( 1 ) 气体分子热运动的平均自由程()p d kT nd 22π2/π21==λ,因此,温度、压强一定时,平均自由程2/1d λ∝.(2) 当温度不变时,平均自由程p λ/1∝.解 (1) 由分析可知67.1//r 22r A N N A ==λλd d(2) 由分析可知氮气分子的平均自由程在压强降为原值的一半时,有m 105.527N N22-⨯=='λλ而此时的分子平均碰撞频率22222N N N N N 2π/8λM RT λZ ='=v将T =293K ,M N2 =2.8×10-2kg·mol -1代入,可得-18N s 1056.82⨯=Z。
气体动理论练习题

气体动理论练习题练习1一、选择题1. 在一密闭容器中,储有A 、B 、C 三种理想气体,处于平衡状态。
A 种气体的分子数密度为n 1,它产生的压强为p 1,B 种气体的分子数密度为2n 1,C 种气体的分子数密度为3n 1,则混合气体的压强p 为 ( )A. 3p 1;B. 4p 1;C. 5p 1;D. 6p 1.2. 若理想气体的体积为V ,压强为p ,温度为T ,一个分子的质量为m ,k 为玻 尔兹曼常量,R 为普适气体常量,则该理想气体的分子数为 ( )A. pV m ⁄;B. pV kT ⁄;C. pV RT ⁄;D. pV mT ⁄。
3. 一定量某理想气体按pV 2=恒量的规律膨胀,则膨胀后理想气体的温度( )A. 将升高;B. 将降低;C. 不变;D. 升高还是降低,不能确定。
二、填空题1. 解释下列分子动理论与热力学名词:(1) 状态参量: ;(2) 微观量: ;(3) 宏观量: 。
2. 在推导理想气体压强公式中,体现统计意义的两条假设是:(1) ;(2) 。
练习2一、选择题1. 一个容器内贮有1摩尔氢气和1摩尔氦气,若两种气体各自对器壁产生的压强分别为p1和p2,则两者的大小关系是( )A. p1>p2; B. p1<p2; C. p1=p2; D. 不能确定。
2. 两瓶不同种类的理想气体,它们的温度和压强都相同,但体积不同,则单位体积内的气体分子数为n,单位体积内的气体分子的总平动动能为E kV⁄,单位体积内的气体质量为ρ,分别有如下关系( )A. n不同,E k V⁄不同,ρ不同;B. n不同,E k V⁄不同,ρ相同;C. n相同,E k V⁄相同,ρ不同;D. n相同,E k V⁄相同,ρ相同。
3. 有容积不同的A、B两个容器,A中装有刚体单原子分子理想气体,B中装有刚体双原子分子理想气体,若两种气体的压强相同,那么,这两种气体的单位体积的内能E A和E B的关系( )A. E A<E B;B. E A>E B;C. E A=E B;D.不能确定。
第七章 气体动理论答案

一.选择题1、(基础训练1)[ C ]温度、压强相同的氦气和氧气,它们分子的平均动能ε和平均平动动能w 有如下关系:(A) ε和w 都相等. (B) ε相等,而w 不相等.(C) w 相等,而ε不相等. (D) ε和w 都不相等. 【解】:分子的平均动能kT i2=ε,与分子的自由度及理想气体的温度有关,由于氦气为单原子分子,自由度为3;氧气为双原子分子,其自由度为5,所以温度、压强相同的氦气和氧气,它们分子的平均动能ε不相等;分子的平均平动动能kT w 23=,仅与温度有关,所以温度、压强相同的氦气和氧气,它们分子的平均平动动能w 相等。
2、(基础训练3)[ C ]三个容器A 、B 、C 中装有同种理想气体,其分子数密度n 相同,而方均根速率之比为()()()2/122/122/12::C B A v v v=1∶2∶4,则其压强之比A p ∶B p ∶C p 为:(A) 1∶2∶4. (B) 1∶4∶8. (C) 1∶4∶16. (D) 4∶2∶1.【解】:气体分子的方均根速率:MRTv 32=,同种理想气体,摩尔质量相同,因方均根速率之比为1∶2∶4,则温度之比应为:1:4:16,又因为理想气体压强nkT p =,分子数密度n 相同,则其压强之比等于温度之比,即:1:4:16。
3、(基础训练8)[ C ]设某种气体的分子速率分布函数为f (v ),则速率分布在v 1~v 2区间内的分子的平均速率为 (A)⎰21d )(v v v v v f . (B) 21()d v v v vf v v ⎰.(C)⎰21d )(v v v v v f /⎰21d )(v v v v f . (D)⎰21d )(v v v v v f /0()d f v v ∞⎰ .【解】:因为速率分布函数f (v )表示速率分布在v 附近单位速率间隔内的分子数占总分子数的百分率,所以⎰21d )(v v v v v f N 表示速率分布在v 1~v 2区间内的分子的速率总和,而21()d v v Nf v v ⎰表示速率分布在v 1~v 2区间内的分子数总和,因此⎰21d )(v v v v v f /⎰21d )(v v v v f 表示速率分布在v 1~v 2区间内的分子的平均速率。
气体动理论练习

气体动理论练习内容提要一、平衡态理想气体物态方程1.气体的物态参量气体的体积、压强和温度三个物理量称为气体的物态参量.在国际单位制中,体积的单位是立方米,符号为m。
压强的单位是帕[斯卡],符号为51atm1.01310Pa760mmHgPa,。
热力学温度的单位是开[尔文],符号为K,3Tt273.15。
2.理想气体物态方程:pVmRTM二、理想气体的压强公式温度的微观本质1.热动平衡的统计规律(1)分子按位置的分布是均匀的:ndNNdVV222(2)各方向运动概率均等:v某vyvz0;v某vyvz12v31222.理想气体压强的微观公式:pmnvnkt333.理想气体物态方程:pnkT4.理想气体分子的平均平动动能与温度的关系:kt三、能量均分定理和理想气体的内能1.刚性分子自由度分子种类单原子分子双原子分子多原子分子2.能量均分定理平动t333转动r02313m0v2kT22总自由度i356气体处于平衡态时,分子任何一个自由度的平均能量都相等,均为按自由度均分定理。
3.理想气体的内能:E1kT,这就是能量2miRTM21dNNdv94四、麦克斯韦气体速率分布定律1.麦氏分布函数:f(v)物理意义:气体在温度为T的平衡状态下,速率在v附近单位速率区间的分子数占总数的百分比。
2.三种统计速率(1)最概然速率:vp2kT2RTmM(2)平均速率:v8kT8RTπmπM2(3)方均根速率:v3kT3RTmM习题精选一、选择题1.对于一定质量的理想气体,以下说法正确的是()A、如果体积减小,气体分子在单位时间内作用于器壁单位面积的总冲量一定增大B、如果压强增大,气体分子在单位时间内作用于器壁单位面积的总冲量一定增大C、如果温度不变,气体分子在单位时间内作用于器壁单位面积的总冲量一定不变D、如果密度不变,气体分子在单位时间内作用于器壁单位面积的总冲量一定不变2.关于温度的意义,下列说法正确的是()(1)气体的温度是分子平均平动动能的量度(2)气体的温度是大量气体分子热运动的集体表现,具有统计意义(3)温度的高低反映物质内部分子运动剧烈程度的不同(4)从微观上看,气体的温度表示每个气体分子的冷热程度A、(1)、(2)、(4)B、(1)、(2)、(3)C、(2)、(3)、(4)D、(1)、(2)3.如图12-1所示,一气室被可以左右移动的隔板分成相等的两部分,一边装氧气,另一边装氢气,两种气体的质量相同、温度一样。
第七章 气体动理论(答案)

一、选择题[ C ]1、(基础训练2)两瓶不同种类的理想气体,它们的温度和压强都相同,但体积不同,则单位体积内的气体分子数n ,单位体积内的气体分子的总平动动能(E K /V ),单位体积内气体的质量ρ的关系为:(A) n 不同,(E K /V )不同,ρ 不同.(B) n 不同,(E K /V )不同,ρ 相同. (C) n 相同,(E K /V )相同,ρ 不同.(D) n 相同,(E K /V )相同,ρ 相同. 【提示】① ∵nkT p =,由题意,T ,p 相同,∴n 相同;② ∵kT n V kTNV E k 2323==,而n ,T 均相同,∴V E k 相同;③ RT M MpV mol=→RT pM V M mol ==ρ,T ,p 相同,而mol M 不同,∴ρ不同。
[ B ]2、(基础训练7)设图示的两条曲线分别表示在相同温度下氧气和氢气分子的速率分布曲线;令()2O p v 和()2H p v 分别表示氧气和氢气的最概然速率,则(A) 图中a 表示氧气分子的速率分布曲线;()2O p v /()2H p v = 4.(B) 图中a 表示氧气分子的速率分布曲线;()2O p v /()2H p v =1/4.(C) 图中b表示氧气分子的速率分布曲线;()2O p v /()2H p v =1/4.(D) 图中b表示氧气分子的速率分布曲线;()2O p v /()2H p v = 4.【提示】①最概然速率p v =p v 越小,故图中a 表示氧气分子的速率分布曲线;②23,3210(/)mol O M kg mol -=⨯, 23,210(/)mol H M kg mol -=⨯,得()()22Ov v p p H14=[ C ]3、(基础训练8)设某种气体的分子速率分布函数为f (v ),则速率分布在v 1~v 2区间内的分子的平均速率为(A)⎰21d )(v v v v v f . (B) 21()d v v v vf v v ⎰.(C)⎰21d )(v v v v v f /⎰21d )(v v v v f . (D)⎰21d )(v v v v v f /0()d f v v ∞⎰ .【提示】① f (v )d v ——表示速率分布在v 附近d v 区间内的分子数占总分子数的百分比;② ⎰21)(v v dv v Nf ——表示速率分布在v 1~v 2区间内的分子数总和;③21()v v vNf v dv ⎰表示速率分布在v 1~v 2区间内的分子的速率总和,因此速率分布在v 1~v 2区间内的分子的平均速率为22112211()()()()v v v v v v v v vNf v dv vf v dvNf v dvf v dv=⎰⎰⎰⎰[ B ]4、(基础训练9)一定量的理想气体,在温度不变的条件下,当体积增大时,分子的平均碰撞频率Z 和平均自由程λ的变化情况是:(A) Z 减小而λ不变. (B) Z 减小而λ增大. (C) Z 增大而λ减小. (D) Z 不变而λ增大.【提示】①2Z d n =,其中v =不变;N n V =,当V 增大时,n 减小; ∴Z 减小。
气体动理论习题解答

习题8—1 设想太阳是由氢原子组成的理想气体,其密度可当成是均匀的。
若此理想气体的压强为1。
35×1014 Pa.试估计太阳的温度。
(已知氢原子的质量m = 1.67×10—27 kg ,太阳半径R = 6。
96×108 m ,太阳质量M = 1。
99×1030 kg )解:mR MVm M mn 3π)3/4(===ρK 1015.1)3/4(73⨯===Mkm R nk p T π8—2 目前已可获得1。
013×10-10 Pa 的高真空,在此压强下温度为27℃的1cm 3体积内有多少个气体分子?解:3462310/cm 1045.2103001038.110013.1⨯=⨯⨯⨯⨯===---V kT p nV N 8—3 容积V =1 m 3的容器内混有N 1=1。
0×1023个氢气分子和N 2=4.0×1023个氧气分子,混合气体的温度为 400 K ,求: (1) 气体分子的平动动能总和;(2)混合气体的压强。
解:(1)J 1014.41054001038.123)(233232321⨯=⨯⨯⨯⨯⨯=+=-∑N N kT tε(2)Pa kT n p i323231076.21054001038.1⨯=⨯⨯⨯⨯==-∑8—4 储有1mol 氧气、容积为1 m 3的容器以v =10 m/s 的速率运动。
设容器突然停止,其中氧气的80%的机械运动动能转化为气体分子热运动动能。
问气体的温度及压强各升高多少?(将氧气分子视为刚性分子)解:1mol 氧气的质量kg 10323-⨯=M ,5=i由题意得T R Mv ∆=⋅ν25%80212K 102.62-⨯=∆⇒TT R V p RT pV ∆=⋅∆⇒=νν pa 52.0102.631.82=⨯⨯=∆=∆∴-VTR p 8—5 一个具有活塞的容器中盛有一定量的氧气,压强为1 atm 。
大学物理(气体动理论)习题答案

大学物理(气体动理论)习题答案8-1 目前可获得的极限真空为Pa 1033.111-⨯,,求此真空度下3cm 1体积内有多少个分子?(设温度为27℃)[解] 由理想气体状态方程nkT P =得 kT V NP =,kT PV N =故 323611102133001038110110331⨯=⨯⨯⨯⨯⨯=---...N (个)8-2 使一定质量的理想气体的状态按V p -图中的曲线沿箭头所示的方向发生变化,图线的BC 段是以横轴和纵轴为渐近线的双曲线。
(1)已知气体在状态A 时的温度是K 300=A T ,求气体在B 、C 、D 时的温度。
(2)将上述状态变化过程在 T V -图(T 为横轴)中画出来,并标出状态变化的方向。
[解] (1)由理想气体状态方程PV /T =恒量,可得:由A →B 这一等压过程中BBA A T V T V = 则 6003001020=⋅=⋅=A AB B T V V T (K) 因BC 段为等轴双曲线,所以B →C 为等温过程,则==B C T T 600 (K)C →D 为等压过程,则CCD D T V T V = 3006004020=⋅=⋅=C CD D T V V T (K) (2)8-3 有容积为V 的容器,中间用隔板分成体积相等的两部分,两部分分别装有质量为m 的分子1N 和2N 个, 它们的方均根速率都是0υ,求: (1)两部分的分子数密度和压强各是多少?(2)取出隔板平衡后最终的分子数密度和压强是多少?010203040[解] (1) 分子数密度 VNV N n VN V N n 2222111122====由压强公式:231V nm P =, 可得两部分气体的压强为 VV mN V m n P VV mN V m n P 3231323120220222012011====(2) 取出隔板达到平衡后,气体分子数密度为 VN N V N n 21+==混合后的气体,由于温度和摩尔质量不变,所以方均根速率不变,于是压强为:VV m N N V nm P 3)(31202120+==8-4 在容积为33m 105.2-⨯的容器中,储有15101⨯个氧分子,15104⨯个氮分子,g 103.37-⨯氢分子混合气体,试求混合气体在K 433时的压强。
气体分子动理论习题解

(v 2 )1/ 2 (v 2 2 )1/ 2 (v 21 )1/ 2 (3R / M mol )1/ 2 ( T2 T1 )
;
; .
13.有一瓶质量为M的氢气(视作刚性双原子分子的理想气体),温度为T,则氢 3 / 2kT 分子的平均平动动能为_________,氢分子的平均动能为_________,该 5 / 2kT 5MRT / 2M mol 瓶氢气的内能为____________________. 14.图示曲线为处于同一温度T时氦(原子量4)、氖(原子量20)和氩(原子量40) 三种气体分子的速率分布曲线。其中 f (v) 曲线(a)是 氩 气分子的速率分布曲线; 曲线(c)是 氦 气分子的速率分布曲线; 15. 图示的两条曲线分别表示氦、氧两种气体在相同温度T时 分子按速率的分布,其中 : (1) 曲线 I 表示 氧 气分子的速率分布曲线; 曲线 II表示 氩 气分子的速率分布曲线. (2) 画有阴影的小长条面积表示 f(v) 速率在 v v v 范围内的分子数占总分子数的百分比. (3) 分布曲线下所包围的面积表示 速率在
f(v) a b
(B) 图中a表示氧气分子的速率分布曲线;
O
v
(C) 图中b表示氧气分子的速率分布曲线; (D)图中b表示氧气分子的速率分布曲线;
[ B ]
7.已知一定量的某种理想气体,在温度为T1与T2时的分子最概然速率分别为 vp1和vp2,分子速率分布函数的最大值分别为f(vp1)和f(vp2).若T1>T2,则 (A) vp1 > vp2, f(vp1)> f(vp2). (B) vp1 > vp2, f(vp1)< f(vp2). (C) vp1 < vp2, f(vp1)> f(vp2). (D) vp1 < vp2, f(vp1)< f(vp2). [B]
气体动理论习题

气体动理论作业班级:_____________ 姓名:_____________ 学号:_____________ 日期:__________年_______月_______日 成绩:_____________ 一、选择题 1.一定量的理想气体贮于某一容器中,温度为T ,气体分子的质量为m .根据理想气体的分子模型和统计假设,分子速度在x 方向的分量平方的平均值(A) m kT x 32=v . (B) mkT x 3312=v . (C) m kT x /32=v . (D) m kT x /2=v .[ ] 2.温度、压强相同的氦气和氧气,它们分子的平均动能ε和平均平动动能w 有如下关系:(A) ε和w 都相等. (B) ε相等,而w 不相等. (C) w 相等,而ε不相等. (D) ε和w 都不相等. [ ] 3.下列各式中哪一式表示气体分子的平均平动动能?(式中M 为气体的质量,m 为气体分子质量,N 为气体分子总数目,n 为气体分子数密度,N A 为阿伏加得罗常量) (A)pV M m 23. (B) pV M Mmol23. (C)npV 23. (D) pV N MM A 23mol . [ ] 4.在标准状态下体积比为1∶2的氧气和氦气(均视为刚性分子理想气体)相混合,混合气体中氧气和氦气的内能之比为 (A) 1∶2. (B) 5∶6.(C) 5∶3. (D) 10∶3. [ ] 5.已知氢气与氧气的温度相同,请判断下列说法哪个正确?(A) 氧分子的质量比氢分子大,所以氧气的压强一定大于氢气的压强. (B) 氧分子的质量比氢分子大,所以氧气的密度一定大于氢气的密度. (C) 氧分子的质量比氢分子大,所以氢分子的速率一定比氧分子的速率大. (D) 氧分子的质量比氢分子大,所以氢分子的方均根速率一定比氧分子的方均根速率大. [ ] 6.关于温度的意义,有下列几种说法:(1) 气体的温度是分子平均平动动能的量度.(2) 气体的温度是大量气体分子热运动的集体表现,具有统计意义.(3) 温度的高低反映物质内部分子运动剧烈程度的不同. (4) 从微观上看,气体的温度表示每个气体分子的冷热程度. 这些说法中正确的是(A) (1)、(2) 、(4). (B) (1)、(2) 、(3). (C) (2)、(3) 、(4).(D) (1)、(3) 、(4). [ ] 7.一瓶氦气和一瓶氮气密度相同,分子平均平动动能相同,而且它们都处于平衡状态,则它们(A) 温度相同、压强相同. (B) 温度、压强都不相同. (C) 温度相同,但氦气的压强大于氮气的压强.(D) 温度相同,但氦气的压强小于氮气的压强. [ ] 8.假定氧气的热力学渭度提高一倍,氧分子全部离解为氧原子,则这些氧原子的平均速率是原来氧分子平均速率的(A) 4倍. (B) 2倍. (C)2倍.(D) 21倍. [ ]9.下列各图所示的速率分布曲线,哪一图中的两条曲线能是同一温度下氮气和氦气的分子速率分布曲线? [ ]v v10.在恒定不变的压强下,气体分子的平均碰撞频率Z 与气体的热力学温度T 的关系为 (A) Z 与T 无关. (B) Z 与T 成正比.(C) Z 与T 成反比. (D) Z 与T 成正比. [ ] 二、填空题11.分子热运动自由度为i的一定量刚性分子理想气体,当其体积为V、压强为p时,其内能E=______________________.12.有两瓶气体,一瓶是氦气,另一瓶是氢气(均视为刚性分子理想气体),若它们的压强、体积、温度均相同,则氢气的内能是氦气的________倍.13.在一个以匀速度u运动的容器中,盛有分子质量为m的某种单原子理想气体.若使容器突然停止运动,则气体状态达到平衡后,其温度的增量T∆=_________________.14.若某容器内温度为300 K的二氧化碳气体(视为刚性分子理想气体)的内能为3.74×103 J,则该容器内气体分子总数为___________________.(玻尔兹曼常量k=1.38×10-23 J·K-1,阿伏伽德罗常量N A=6.022×1023 mol-1) 15.一定量H2气(视为刚性分子的理想气体),若温度每升高1 K,其内能增加41.6 J,则该H2气的质量为________________.(普适气体常量R=8.31 J·mol-1·K-1)16.若气体分子的平均平动动能等于1.06×10-19 J,则该气体的温度T=_____________K.(玻尔兹曼常量k=1.38×10-23 J·K-1 )17.一铁球由10 m高处落到地面,回升到0.5 m高处.假定铁球与地面碰撞时损失的宏观机械能全部转变为铁球的内能,则铁球的温度将升高__________.(已知铁的比热c=501.6 J·kg-1·K-1)18.1 mol氮气,由状态A(p1,V)变到状态B(p2,V),气体内能的增量为__________.19.储有某种刚性双原子分子理想气体的容器以速度v=100 m/s运动,假设该容器突然停止,气体的全部定向运动动能都变为气体分子热运动的动能,此时容器中气体的温度上升 6.74K,由此可知容器中气体的摩尔质量M mol=__________. (普适气体常量R=8.31 J·mol-1·K-1)20.图示的两条f(v)~v曲线分别表示氢气和氧气在同一温度下的麦克斯韦速率分布曲线.由此可得Array氢气分子的最概然速率为________________;氧气分子的最概然速率为________________.)三、计算题21.容积为20.0 L(升)的瓶子以速率v=200 m·s-1匀速运动,瓶子中充有质量为100g的氦气.设瓶子突然停止,且气体的全部定向运动动能都变为气体分子热运动的动能,瓶子与外界没有热量交换,求热平衡后氦气的温度、压强、内能及氦气分子的平均动能各增加多少?(摩尔气体常量R=8.31 J·mol-1·K-1,玻尔兹曼常量k=1.38×10-23 J·K-1)22.一密封房间的体积为5×3×3 m3,室温为20 ℃,室内空气分子热运动的平均平动动能的总和是多少?如果气体的温度升高 1.0K,而体积不变,则气体的内能变化多少?气体分子的方均根速率增加多少?已知空气的密度ρ=1.29 kg/m3,摩尔质量M mol=29×10-3kg /mol,且空气分子可认为是刚性双原子分子.(普适气体常量R=8.31 J·mol-1·K-1)23.有2×10-3 m3刚性双原子分子理想气体,其内能为6.75×102 J.(1) 试求气体的压强;(2) 设分子总数为5.4×1022个,求分子的平均平动动能及气体的温度.(玻尔兹曼常量k=1.38×10-23 J·K-1)24.当氢气和氦气的压强、体积和温度都相等时,求它们的质量比() ()e HH2MM和内能比()()e HH2EE.(将氢气视为刚性双原子分子气体)参考答案1.D2.C3.A4.B5.D6.B7.C8.B9.B 10.C 11.ipV 213分 12.5 / 3 3分13.m u 2 / 3k3分14.3.01×1023个 3分15.4.0×10-3 kg 3分16.5.12×103 3分17.0.186 K 3分18.()1225p p V - 3分 19.28×10-3 kg / mol 3分20.2000 m ·s -1 1分 500 m ·s -1 2分三、计算题 21.解:定向运动动能221v Nm ,气体内能增量T ik N ∆21,i =3 .按能量守恒应有: 221v Nm =T ik N ∆21∴ A N T iR m /2∆=v 2分(1) ()()===∆iR M iR m N T A //2mol 2v v 6.42 K 2分 (2) ()V T R M M p //mol ∆=∆=6.67×10-4 Pa . 2分 (3) ()T iR M M E ∆=∆21/mol =2.00×103 J .2分(4)T ik ∆=∆21ε=1.33×10-22 J . 2分 22.解:根据kT m 23212=v , 可得 NkT m N 23212=v , 即 ()m N RTNm m N d /23212=v=()RT M M mol /23=()V M RT ρmol /23=7.31×106 . 4分 又 ()T iR M M E ∆=∆21/mol =()T iR M V ∆21/mol ρ=4.16×104 J . 3分及 ()()()2/1212/1222/12v v v-=∆= ()()122/1mol /3T TM R -=0.856 m/s . 3分23.解:(1) 设分子数为N .据 E = N (i / 2)kT 及 p = (N / V )kT得 p = 2E / (iV ) = 1.35×105 Pa4分(2) 由 kT N kT Ew2523=得 ()21105.75/3-⨯==N E w J3分又 kT N E 25=得 T = 2 E / (5Nk )=362k3分24.解: 由 pV =()()mol22H H M M RT 和pV =()()mol e H e H M M RT 2分得 ()()e H H 2M M =()()mol mol 2e H H M M =42=21. 2分由 E (H 2)= ()()mol 22H H M M 25RT 和RT M M E 23)He ()He ()He (mol = 4分得()()e 2H E H E =()()()()mol mol22e H /He 3H /H 5M M M M∵ ()()mol 22H M H M = ()()mole H M e H M (p 、V 、T 均相同), ∴()()e H E H E 2=35. 2分。
《大学物理学》气体的动理论部分练习题(马解答)

《大学物理学》气体的动理论学习材料可能用到的数据:8.31/R J mol =; 231.3810/k J K -=⨯; 236.0210/A N mol =⨯。
一、选择题12-1.处于平衡状态的一瓶氮气和一瓶氦气的分子数密度相同,分子的平均平动动能也相同,则它们( C )(A )温度,压强均不相同; (B )温度相同,但氦气的压强大于氮气的压强; (C )温度,压强都相同; (D )温度相同,但氦气的压强小于氮气的压强。
【分子的平均平动动能3/2kt kT ε=,仅与气体的温度有关,所以两瓶气体温度相同;又由公式P nkT =,n 为气体的分子数密度,知两瓶气体的压强也相同】2.容器中储有一定量的处于平衡状态的理想气体,温度为T ,分子质量为m ,则分子速度在x 方向的分量平均值为:(根据理想气体分子模型和统计假设讨论)( D )(A )x υB )x υC )x υ=m kT 23;(D )x υ=0。
【大量分子在做无规则的热运动,某一的分子的速度有任一可能的大小和方向,但对于大量分子在某一方向的平均值应为0】3.若理想气体的体积为V ,压强为P ,温度为T ,一个分子的质量为m ,k 为玻耳兹曼常量,R 为摩尔气体常量,则该理想气体的分子数为 ( B )(A )m PV /; (B ))/(kT PV ; (C ))/(RT PV ; (D ))/(mT PV 。
【由公式P nkT =判断,所以分子数密度为Pnk T=,而气体的分子数为N nV=】4.根据气体动理论,单原子理想气体的温度正比于( D ) (A )气体的体积; (B )气体分子的压强; (C )气体分子的平均动量;(D )气体分子的平均平动动能。
【见第1题提示】5.有两个容器,一个盛氢气,另一个盛氧气,如果两种气体分子的方均根速率相等,那么由此可以得出下列结论,正确的是( A )(A )氧气的温度比氢气的高;(B )氢气的温度比氧气的高; (C )两种气体的温度相同; (D )两种气体的压强相同。
气体动理论习题答案及解法(2010.12.15)

气体动理论习题、答案及解法一、 选择题1. 一定量氢气(视为刚性分子的理想气体),若温度每升高1K ,其内能增加20.8J ,则该氢气的质量为 【 B 】 (A )1.0⨯10kg 3- (B)2.0⨯10kg 3-(C)3.0⨯10kg 3- (D)4.0⨯10kg 3-参考答案:T R i M E ∆⎪⎭⎫⎝⎛=∆2μ 5=i 刚性双原子的自由度为 ()kg 100.2131.851028.202233--⨯=⨯⨯⨯⨯⨯=∆⋅∆=T iR E M μ2. 有一瓶质量为m 的氢气(是作刚性双原子分子的理想气体),温度为T ,则氢分子的平均动能 【 B 】 (A )kT 23(B )kT 25 (C ) RT 23 (D )RT 25参考答案:kT i2=ε 5=i 刚性双原子的自由度为 3. 有两瓶气体,一瓶是氦气,另一瓶是氢气(均视为刚性分子理想气体),若它们的压强、体积、温度均相同,则氢气的内能是氦气的 【 C 】 (A )21倍 (B )32倍 (C )35倍 (D )2倍参考答案:T R i M E ⎪⎭⎫ ⎝⎛=2μ RT MpV μ=3522222==⎪⎪⎭⎫⎝⎛⎪⎪⎭⎫⎝⎛=e e eH H H H H H i i T R i M T R i M E E μμ4. A 、B 、C3个容器中皆装有理想气体,它们的分子数密度之比为A n :Bn :C n =4:2:1,而分子的平均平动动能之比为4:2:1::=C B A εεε,则它们的压强之比C B A p p p :::为 【 A 】(A )1:1:1 (B)1:2;2 (C )1:2;3 (D )1:2;4参考答案:εn p 32=1:1:132:32:32:::==C C B B A A C B A n n n p p p εεε 5. 2g 氢气与2g 氦气分别装在两个容器相等的封闭容器内,温度也相同(氢气分子视为刚性双原子分子),氢气与氦气内能之比eH H E E 2为(A )31 (B )35 (C )310 (D)316 【 C 】参考答案:T R i M E ⎪⎭⎫⎝⎛=2μ31010231045223322222=⨯⨯⨯⨯==⎪⎪⎭⎫ ⎝⎛⎪⎪⎭⎫⎝⎛=--H H H H H H H H H H e e e e ei i T R i M T R i M E E μμμμ 6.1mol 的单原子分子理想气体,在1atm 的恒定压强下,从c 0︒加热到c 100︒,则气体的内能改变了 【 D 】(A )0.25J 103⨯ (B )J 105.03⨯ (C )J 100.13⨯ (D )J 1025.13⨯ 参考答案:T R i M E ∆⎪⎭⎫⎝⎛=∆2μ ()()J 1025.127337331.82323⨯=-⨯⨯=∆⎪⎭⎫ ⎝⎛=∆T R i M E μ7. 在容积为3210m -的容器中,装有质量g 100的气体,若气体分子的方均根速率为1200-⋅s m ,则气体的压强为 【B 】 (A )Pa 1067.05⨯ (B )Pa 1033.15⨯ (C )Pa 1066.25⨯ (D )Pa 1099.35⨯参考答案:μRTv 32=RT MpV μ= ()Pa 1033.131522⨯=⎪⎭⎫ ⎝⎛⨯=v V M p8. 如图1所示的两条()v ~v f 曲线分别表示氢气和氧气在同一温度下的麦克斯)(1s m -⋅v韦速率分布曲线。
气体动理论例题
8.一瓶氦气 He 和一瓶氮气 N2 密度相同, 分子平均平动动能相同,而且都处于平衡 状态,则它们: (A)温度相同、压强相同。 (B)温度、压强都不同。 (C)温度相同,但氦气的压强大于氮气的 压强。 (D)温度相同,但氦气的压强小于氮气的 压强。
V
对等温有: 1 V 2 P 2 V 1 , V 2 P 2 V 1 / P1 P i P 2 V 1 /(2 P1) Eb i P 2 V 2 / 2 2
2.25 107 ( J )
23.已知某种理想气体,其分子方均根速率 为 400m/s,当起压强为 1atm 时,求气体的 密度。
(A)vP1 > vP2 (B)vP1 < vP2 (C)vP1 > vP2 (D)vP1 < vP2 f(vP1)< f(vP2); f(vP1)< f(vP2); f(vP1)> f(vP2); f(vP1)> f(vP2). [ A ]
3.容器中储有定量理想气体,温度为 T ,分 子质量为 m ,则分子速度在 x 方向的分量 的平均值为:(根据理想气体分子模型和 统计假设讨论)
6.54 10 s
9
1
(4) v / Z 448 / 6.54 10 6.85 10 m
9 8
(5) k (3 / 2)kT
(3 / 2) 1.38 10 5.65 1021 ( J )
n 2.69 10 m
25 25
3
或n N 0 / V 0 6.02 1023 / 22.4 103 2.69 10 m
基础物理学上册习题解答和分析 第七章气体动理论题解和分析

习题七7-1 氧气瓶的容积为32,L 瓶内充满氧气时的压强为130atm 。
若每小时用的氧气在1atm 下体积为400L 。
设使用过程温度保持不变,当瓶内压强降到10atm 时,使用了几个小时? 分析 氧气的使用过程中,氧气瓶的容积不变,压强减小。
因此可由气体状态方程得到使用前后的氧气质量。
进而将总的消耗量和每小时的消耗量比较求解。
解 已知123130,10,1;P atm P atm P atm === ,3221L V V V ===L V 4003=。
质量分别为1m ,2m ,3m ,由题意可得: 11m PV R T M= ○1 22m P V R T M = ○2 233m P V R T M=○3 所以一瓶氧气能用小时数为: ()121233313010329.61.0400m m PV P V n m P V -⨯--====⨯小时7-2 一氦氖气体激光管,工作时管内温度为 27C ︒。
压强为2.4mmHg ,氦气与氖气得压强比是7:1.求管内氦气和氖气的分数密度.分析 先求得氦气和氖气各自得压强,再根据公式P nkT =求解氦气和氖气的分数密度。
解:依题意, =+氦氖, 52.4 1.01310760P P P P a =+=⨯⨯氦氖;:7:1P P =氦氖所以 552.10.31.01310,1.01310760760P P a P P a =⨯⨯=⨯⨯氦氖,根据 P nkT = 所以 ()5223232.1760 1.013106.76101.3810300P n mkT--⨯⨯===⨯⨯⨯氦氦2139.6610P n mkT-=⨯氖氖7-3 氢分子的质量为243.310-⨯克。
如果每秒有2310个氢分子沿着与墙面的法线成︒45角的方向以510厘米/秒的速率撞击在面积为22.0cm 的墙面上,如果撞击是完全弹性的,求这些氢分子作用在墙面上的压强.分析 压强即作用在单位面积上的平均作用力,而平均作用力由动量定理求得。
第7章气体动理论基础习题

第7章气体动理论基础习题第 7 章气体动理论基础习题一、选择题:1. 若理想气体的体积为V ,压强为p ,温度为T ,一个分子的质量为m ,k 为玻尔兹曼常量,R 为普适气体常量,则该理想气体的分子数为: (A) pV / m . (B) pV / (kT ).(C) pV / (RT ). (D) pV / (mT ).[]2. 一定量某理想气体按pV 2=恒量的规律膨胀,则膨胀后理想气体的温度(A) 将升高.(B) 将降低.(C) 不变. (D)升高还是降低,不能确定.[]3. 若室内生起炉子后温度从15℃升高到27℃,而室内气压不变,则此时室内的分子数减少了(A)00. (B) 400.(C) 900. (D) 2100.[]4. 已知氢气与氧气的温度相同,请判断下列说法哪个正确(A) 氧分子的质量比氢分子大,所以氧气的压强一定大于氢气的压强. (B) 氧分子的质量比氢分子大,所以氧气的密度一定大于氢气的密度.(C) 氧分子的质量比氢分子大,所以氢分子的速率一定比氧分子的速率大. (D) 氧分子的质量比氢分子大,所以氢分子的方均根速率一定比氧分子的方均根速率大.[]5. 关于温度的意义,有下列几种说法:(1) 气体的温度是分子平均平动动能的量度.(2) 气体的温度是大量气体分子热运动的集体表现,具有统计意义. (3) 温度的高低反映物质内部分子运动剧烈程度的不同. (4) 从微观上看,气体的温度表示每个气体分子的冷热程度.这些说法中正确的是(A) (1)、(2) 、(4). (B) (1)、(2) 、(3). (C) (2)、(3) 、(4).(D) (1)、(3) 、(4).[]6. 1 mol 刚性双原子分子理想气体,当温度为T 时,其内能为(A) RT 23. (B)kT 23. (C)RT 25. (D)kT 25.[](式中R 为普适气体常量,k 为玻尔兹曼常量)7. 压强为p 、体积为V 的氢气(视为刚性分子理想气体)的内能为:(A)25pV . (B) 23pV . (C) pV . (D) 21pV .[]8. 设v 代表气体分子运动的平均速率,p v 代表气体分子运动的最概然速率,2/12)(v 代表气体分子运动的方均根速率.处于平衡状态下理想气体,三种速率关系为(A) p v v v ==2/12)( (B) 2/12)(v v v <=p(C) 2/12)(v v v <>p [ ]9. 在一容积不变的封闭容器内理想气体分子的平均速率若提高为原来的2倍,则(A) 温度和压强都提高为原来的2倍. (B) 温度为原来的2倍,压强为原来的4倍. (C) 温度为原来的4倍,压强为原来的2倍.(D)温度和压强都为原来的4倍.[]10. 若f (v )为气体分子速率分布函数,N 为分子总数,m 为分子质量,则21d )(212v v v v v Nf m 的物理意义是(A) 速率为2v 的各分子的总平动动能与速率为1v 的各分子的总平动动能之差.(B) 速率为2v 的各分子的总平动动能与速率为1v 的各分子的总平动动能之和. (C) 速率处在速率间隔1v ~2v 之内的分子的平均平动动能.(D) 速率处在速率间隔1v ~2v 之内的分子平动动能之和.[]答案:; ; ; ; ; ; ; ; ; . 二、填空题:1. 下面给出理想气体的几种状态变化的关系,指出它们各表示什么过程.(1) p d V = (M / M mol )R d T 表示____________________过程.(2) V d p = (M / M mol )R d T 表示____________________过程.(3) p d V +V d p = 0 表示____________________过程.2. 一定量的理想气体贮于某一容器中,温度为T ,气体分子的质量为m .根据理想气体分子模型和统计假设,分子速度在x 方向的分量的下列平均值 x v =__________________, 2x v =__________________.3. 分子物理学是研究__________________________________________________________的学科.它应用的基本方法是_________________方法.4. 从分子动理论导出的压强公式来看, 气体作用在器壁上的压强, 决定于______________________和_______________________.5. 图所示的两条f (?)~?曲线分别表示氢气和氧气在同一温度下的麦克斯韦速率分布曲线.由此可得氢气分子的最概然速率为___________;氧气分子的最概然速率为___________.6.一定量的某种理想气体,当体积不变,温度升高时,则其平均自由程,平均碰撞频率Z 。
