化学药药学资料CTD格式电子文档标准(试行)
《化学药品注册分类改革工作方案》政策解读

化学药品注册分类改革工作方案解读2016年03月16日发布食品药品监管总局组织制定了化学药品注册分类改革工作方案(以下简称方案),已于2016年3月4日正式发布实施。
现就有关问题解读如下:一、方案的出台背景。
2015年8月9日,国务院发布《关于改革药品医疗器械审评审批制度的意见》,明确调整药品注册分类。
2015年11月4日,第十二届全国人民代表大会常务委员会第十七次会议审议通过《关于授权国务院在部分地方开展药品上市许可持有人制度试点和有关问题的决定》,同意国务院组织开展药品注册分类改革。
为落实上述政策要求,满足实际工作需要,食品药品监管总局制定发布了本方案。
二、方案的适用范围。
本方案仅针对化学药品注册分类进行了调整,适用于方案发布实施后新受理的化学药品注册申请(包括临床、生产、进口注册申请)。
三、新注册分类中,关于新药的含义是什么?新药指中国境内外均未上市的药品,分为创新药和改良型新药。
新注册分类1为创新药,强调含有新的结构明确的、具有药理作用的化合物;新注册分类2为改良型新药,在已知活性成份基础上进行优化,强调具有明显的临床优势。
四、创新药具体包括什么?创新药指含有新的结构明确、具有药理作用的化合物,且具有临床价值的药品,不包括改良型新药中2.1类的药品。
五、新注册分类中,关于仿制药的含义是什么?仿制药是指仿制已上市原研药品的药品,分为两类,一是仿制境外已上市境内未上市原研药品,二是仿制境内已上市原研药品。
仿制药要求与原研药品质量和疗效一致。
如果已上市药品的原研药品无法追溯或者原研药品已经撤市的,建议不再申请仿制;如坚持提出仿制药申请,原则上不能以仿制药的技术要求予以批准,应按照新药的要求开展相关研究。
六、新注册分类中,关于第5类药品的含义是什么?第5类药品是指境外上市的药品申请在中国境内上市,分为原研药品和非原研药品两类。
对应原化学药品注册分类中的进口药品类别。
七、含有未知活性成份的新复方制剂按什么申报?含有新的结构明确的、具有药理作用的化合物的新复方制剂,应按照新注册分类1进行申报。
ctd格式电子文档标准

ctd格式电子文档标准CTD格式电子文档标准。
CTD格式是一种用于电子文档的标准格式,它可以帮助用户更好地管理和组织文档内容,提高文档的可读性和可维护性。
本文将介绍CTD格式的基本规范和使用方法,希望能够帮助大家更好地利用这一标准格式。
一、CTD格式的基本规范。
1. 文件命名,CTD格式的文件应该使用有意义的名称,能够准确地反映文档的内容和用途。
文件名应该简洁明了,避免使用过长或含糊不清的名称。
2. 文件结构,CTD格式要求文档具有清晰的结构,包括标题、目录、正文和附录等部分。
每个部分的内容应该明确,便于读者快速定位所需信息。
3. 字体格式,CTD格式规定了文档中文字的字号、字体、颜色等格式要求,以保证文档的统一风格和美观性。
4. 图表规范,在CTD格式中,图表的插入和排版也有一定的规范要求,包括图表的编号、标题、注释等内容,以便读者更好地理解图表信息。
5. 参考文献,对于引用的外部资料,CTD格式要求文档中应有清晰的参考文献标注和引用格式,以便读者查证资料来源。
二、CTD格式的使用方法。
1. 创建新文档,在使用CTD格式时,首先需要根据规范创建一个新的文档模板,包括标题样式、段落样式、图表样式等,以便后续的文档编写和排版。
2. 编写文档内容,在编写文档内容时,应严格按照CTD格式的要求进行,包括标题的设置、目录的生成、正文的排版等,确保文档的整体风格和格式统一。
3. 插入图表和参考文献,在文档中插入图表时,应按照CTD格式的规范进行编号和标题的设置,同时对引用的外部资料进行清晰的标注和引用格式。
4. 审查和修改,在文档编写完成后,应进行审查和修改,确保文档内容准确、清晰,符合CTD格式的要求。
三、CTD格式的优势和应用价值。
1. 提高文档质量,CTD格式的规范要求能够帮助用户更好地组织和管理文档内容,提高文档的质量和可读性。
2. 便于维护和更新,采用CTD格式的文档结构清晰,便于维护和更新,有利于长期保存和管理文档。
CTD格式申报资料提交要求(药学部分原料药)

附件1格式申报资料提交要求(药学部分:原料药)目录3.2 原料药3.2.1 基本信息3.2.1.1 药品名称3.2.1.2 结构3.2.1.3 理化性质3.2.2 生产信息3.2.2.1 生产商3.2.2.2 生产工艺和过程控制3.2.2.3 物料控制3.2.2.4 关键步骤和中间体的控制3.2.2.5 工艺验证和评价3.2.2.6 生产工艺的开发3.2.3 特性鉴定3.2.3.1 结构和理化性质3.2.3.2 杂质3.2.4 原料药的质量控制3.2.4.1 质量标准3.2.4.2 分析方法3.2.4.3 分析方法的验证3.2.4.4 批检验报告3.2.4.5 质量标准制定依据3.2.5 对照品3.2.6 包装材料和容器3.2.7 稳定性3.2.7.1 稳定性总结3.2.7.2上市后稳定性承诺和稳定性方案3.2.7.3 稳定性数据申报资料正文及撰写要求3.2.1 基本信息3.2.1.1药品名称提供原料药的中英文通用名、化学名,化学文摘()号以及其它名称(包括国外药典收载的名称)3.2.1.2 结构提供原料药的结构式、分子式、分子量,如有立体结构和多晶型现象应特别说明。
3.2.1.3 理化性质提供原料药的物理和化学性质(一般来源于药典和默克索引等),具体包括如下信息:性状(如外观,颜色,物理状态);熔点或沸点;比旋度,溶解性,溶液, 分配系数,解离常数,将用于制剂生产的物理形态(如多晶型、溶剂化物、或水合物),粒度等。
3.2.2 生产信息3.2.2.1生产商生产商的名称(一定要写全称)、地址、电话、传真以及生产场所的地址、电话、传真等。
3.2.2.2 生产工艺和过程控制(1)工艺流程图:按合成步骤提供工艺流程图,标明工艺参数和所用溶剂。
如为化学合成的原料药,还应提供其化学反应式,其中应包括起始原料、中间体、所用反应试剂的分子式、分子量、化学结构式。
(2)工艺描述:按工艺流程来描述工艺操作,以注册批为代表,列明各反应物料的投料量及各步收率范围,明确关键生产步骤、关键工艺参数以及中间体的质控指标。
中国-CTD与ICH-CTD的内容比较

➢ 2011年6月27日,SFDA发布《关于印发化学药药学资料CTD格式电子文 档标准(试行)和药品注册申报资料的体例与整理规范的通知 》(食 药监办注[2011]98号),以推进CTD格式电子文档的提交。
4
h
5
概述_中国-CTD沿革
国食药监注[2010]387号:
一、《药品注册管理办法》附件2化学药品注册分类3、4、5和6的生产注册申请的 药学部分申报资料,可参照印发的CTD格式整理提交,同时提交电子版。申请临 床试验阶段的药学资料,暂不按CTD格式提交资料。
5
h
6
h
7
h
8
概述_中国-CTD与ICH-CTD文件适用范围比较
CTD文件适用范围
中国-CTD
ICH-CTD
《药品注册管理办法》附件2化学 药品注册分类3、4、5和6的生产注 册申请的药学部分申报资料,可参 照印发的CTD格式整理提交,同时 提交电子版。申请临床试验阶段的 药学资料,暂不按CTD格式提交资 料。
二、《药品注册管理办法》附件2化药注册分类1和2的临床试验申请和生产注册申 请的药学资料,暂不按CTD格式提交资料。
三、为鼓励CTD格式提交申报资料,并稳步推进该项工作,目前拟采取以下方式: (一)按《药品注册管理办法》附件2申报资料要求提交的生产注册申请申报资 料仍予接收。 (二)技术审评部门将对提交CTD格式申报资料的注册申请单独按序进行审评。
CTD格式申报资料撰写要求

国食药监注〔2010〕 387 号附件:化学药品CTD格式申报资料撰写要求CTD格式申报主要研究信息汇总表(原料药)2.3.S.1 基本信息2.3.S.1.1 药品名称原料药的中英文通用名、化学名2.3.S.1.2 结构原料药的结构式、分子式、分子量2.3.S.1.3 理化性质原料药的主要物理和化学性质:性状(如外观,颜色,物理状态);熔点或沸点;比旋度,溶解性,溶液pH, 分配系数,解离常数,将用于制剂生产的物理形态(如多晶型、溶剂化物、或水合物),生物学活性等。
2.3.S.2 生产信息2.3.S.2.1 生产商生产商的名称(一定要写全称)、地址以及生产场所的地址。
2.3.S.2.2 生产工艺和过程控制(1)工艺流程图:参见申报资料3.2.S.2.2(注明页码)。
(2)工艺描述:按反应路线简述各步反应的反应类型(氧化、还原、取代、缩合、烃化、酰化等),各步反应的原料、试剂、溶剂和产物的名称,终产物的精制方法和粒度控制等;特殊的反应条件(如高温、高压、深冷等)应说明。
详细内容参见申报资料3.2.S.2.2(注明页码)。
(3)生产设备:参见申报资料3.2.S.2.2(注明页码)。
(4)大生产的拟定批量:kg(g)/批。
2.3.S.2.3 物料控制生产用物料(如起始物料、反应试剂、溶剂、催化剂等)的质量控制信息(包括来源、质量标准等),参见申报资料3.2.S.2.3(注明页码)。
2.3.S.2.4 关键步骤和中间体的控制列出所有关键步骤及其工艺参数控制范围。
关键步骤确定依据参见申报资料3.2.S.2.4或3.2.S.2.6(注明页码)。
中间体的质量控制参见申报资料3.2.S.2.4(注明页码)。
2.3.S.2.5 工艺验证和评价无菌原料药:工艺验证方案(编号:--,版本号:--)和验证报告(编号:--,版本号:--)参见申报资料3.2.S.2.5(注明页码)。
其他原料药:工艺验证方案(编号:--,版本号:--)和验证报告(编号:--,版本号:--)参见申报资料3.2.S.2.5(注明页码);或者,工艺验证方案(编号:--,版本号:--)和批生产记录(编号:--,版本号:--)样稿参见申报资料3.2.S.2.5(注明页码),验证承诺书参见申报资料3.2.S.2.5(注明页码)。
药品注册受理常见问题解析
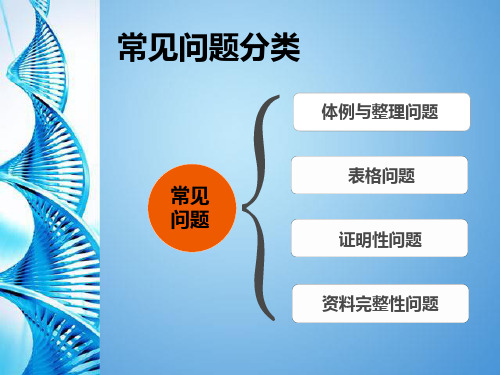
四、资料完整性问题
(八)非临床研究资料
安全性试验单位不是通过GLP认证机构; 药代动力学和毒代动力学检测报告信息不全,缺少方法学 研究资料,提供的图谱不全; 治疗类生物制品缺少组织交叉反应研究资料(抗体、人源 化制品)。
四、资料完整性问题
(九)临床试验资料
分中心小结表不齐全。 试验方案与最终总结报告不一致,如参加机构、方案编号 等。 知情同意书样稿版本不全;历次伦理批件或组长快速伦理 审查报告不全;缺少科学委员会审查报告。 临床试验总结(32号)报告封面盖章不全,缺少统计单 位签字盖章。 BE试验未提供全套生物样本检测图谱。
二、表格问题
(一)申请表
二、表格问题
(一)申请表
二、表格问题
(一)申请表
二、表格问题
(一)申请表
二、表格问题
(二)研制情况申报表
二、表格问题
(二)研制情况申报表
二、表格问题
(二)研制情况申报表
二、表格问题
(三)生产现场检查申请表
二、表格问题
(三)生产现场检查申请表
三、证明性问题
• 法规依据
色谱数据输出图谱规范要求: 标明使用的色谱数据工作站,并保色谱图谱头信息,包括:实验者、试验内容、进样时间、运行 时间等,进样时间(指injection time)精确到秒,对于软件本身使用 “acquired time”、“作样时 间”、“试验时间”等含糊表述的,需说明是否就是进样时间;应带有存盘路径的数据文件名;色谱 峰参数应有保留时间(保留到小数点后三位)、峰高、峰面积、定量结果、积分标记线、理论板数等。
关于印发<药品注册形式审查一般要求 >(试行)和<药品注册现场核查及抽样程序 与要求>(试行)的通知(国食药监注 [2005]385号)
国家食品药品监督管理局发布《化学药品CTD格式申报资料撰写要求》

国家食品药品监督管理局发布《化学药品CTD格式申报资料撰写要求》2010年09月30日发布为提高我国药物研发的质量和水平,逐步实现与国际接轨,在研究人用药品注册技术要求国际协调会(ICH)通用技术文件(Common Technical Document,简称CTD)的基础上,结合我国药物研发的实际情况,国家食品药品监督管理局组织制定了《化学药品CTD格式申报资料撰写要求》,现予以发布,并将有关事宜作出明确。
关于按CTD格式撰写化学药品注册申报资料有关事项的通知国食药监注[2010]387号2010年09月25日发布各省、自治区、直辖市食品药品监督管理局(药品监督管理局):为提高我国药物研发的质量和水平,逐步实现与国际接轨,国家食品药品监督管理局在研究人用药品注册技术要求国际协调会(ICH)通用技术文件(Common Technical Docume nt,简称CTD)的基础上,结合我国药物研发的实际情况,组织制定了《化学药品CTD格式申报资料撰写要求》,现予以发布,并将有关事宜通知如下:一、《药品注册管理办法》附件2化学药品注册分类3、4、5和6的生产注册申请的药学部分申报资料,可参照印发的CTD格式整理提交,同时提交电子版。
申请临床试验阶段的药学资料,暂不按CTD格式提交资料。
二、《药品注册管理办法》附件2化学药品注册分类1和2的临床试验申请和生产注册申请的药学资料,暂不按CTD格式提交资料。
三、为鼓励CTD格式提交申报资料,并稳步推进该项工作,目前拟采取以下方式。
(一)按《药品注册管理办法》附件2申报资料要求提交的生产注册申请申报资料仍予接收。
(二)技术审评部门将对提交CTD格式申报资料的注册申请单独按序进行审评。
附件:化学药品CTD格式申报资料撰写要求国家食品药品监督管理局二○一○年九月二十五日。
化学药药学资料CTD格式电子文档标准(试行)

化学药药学资料CTD格式电子文档标准(试行)本标准用于规范按CTD格式申报的化学药药学资料的电子文档。
包括药学研究主要信息汇总表和申报资料。
1. 编辑软件版本使用Microsoft Office Word 2003版或更高版本。
2. 字体、字号、行间距和字体颜色2.1 字体中文字体推荐使用宋体;英文字体推荐使用Times New Roman(化学结构式中的英文字体除外)。
2.2 字号字号通常要求使用小四号字。
叙述性文字推荐使用小四号字,表格推荐使用五号字,避免使用更小号字。
在选择表格的字号时需考虑如下两方面:在同一张页面上显示相对完整的信息;保证字迹清晰、容易阅读。
脚注推荐使用五号字体。
2.3 行间距行间距通常为单倍行距。
2.4 字体颜色推荐使用黑色字体,超文本链接建议使用蓝色。
3. 页面方向适当的页面方向可以方便审评专家阅读,文档应设臵适于阅读和打印的页面方向。
纵向页面能够正常显示时,页面应设臵为纵向方向;纵向页面无法完整显示时,应设臵为横向显示。
不应设臵旋转页面。
4. 页面大小4.1 纸张大小页面设臵纸张大小为A4。
4.2 页边距纵向页面:左边距至少为2.5cm,以避免在打印和装订过程中遮盖信息。
上边距至少为2cm,其他边距设臵为至少1cm。
横向页面:上边距至少为2.5cm,右边距至少为2cm,其他边距设臵为至少1cm。
页眉和页脚的信息应在上述页边距内显示,保证文本在打印或装订中不丢失信息。
5. 文档结构目录必须要构建文档结构目录和正文目录,应根据CTD结构标出所有文本标题层级。
文档结构目录显示的标题层级关系应和2正文目录一致,正文目录应标示各层级标题页码。
目录中列出的项目可以包括表格、数字、出版物、其他参考文献和附件,可以设臵超文本链接或书签进行导航。
6. 图表图表在文档中能够正常显示,可直接插入在文档中;也可采取添加附件以超文本链接方式查阅图表。
7. 文档中的超文本链接为保证超文本链接的效果,请使用相对路径创建超文本链接,应避免用绝对路径链接的方式。
CTD详细模版

######片申报资料(药学部分)目录3.2.P.1 剂型及产品组成 (2)3.2.P.2 产品开发 (3)3.2.P.2.1 处方组成 (3)3.2.P.2.1.1 原料药 (3)3.2.P.2.1.2 辅料 (4)3.2.P.2.2 制剂 (4)3.2.P.2.2.1 处方开发过程 (4)3.2.P.2.2.2 制剂相关特性 (13)3.2.P.2.3 生产工艺的开发 (19)3.2.P.2.4 包装材料/容器 (22)3.2.P.2.5 相容性 (22)3.2.P.3 生产 (22)3.2.P.3.1 生产商 (22)3.2.P.3.2 批处方 (22)3.2.P.3.3 生产工艺和工艺控制 (23)3.2.P.3.4 关键步骤和中间体的控制 (24)3.2.P.3.5 工艺验证和评价 (25)3.2.P.4 原辅料的控制 (30)3.2.P.5 制剂的质量控制 (30)3.2.P.5.1 质量标准 (30)3.2.P.5.2 分析方法 (30)3.2.P.5.3 分析方法的验证 (33)3.2.P.5.4 批检验报告 (90)3.2.P.5.5 杂质分析 (93)3.2.P.5.6 质量标准制定依据 (94)3.2.P.6 对照品 (96)3.2.P.7 稳定性 (97)3.2.P.7.1 稳定性总结 (97)3.2.P.7.2 上市后的稳定性研究方案及承诺 (98)3.2.P.7.3 稳定性数据 (98)附件 (112)申报资料正文3.2.P.1 剂型及产品组成######片是一种独特的具有高度血管选择性的长效二氢吡啶类钙离子拮抗剂,是心血管治疗药物中比较理想的长效降压药,也是近几年来世界处方量最大的高血压和心绞痛治疗药物。
######最早由美国##公司研制开发成功,1990年在英国和爱尔兰首先投放市场。
1992年7月获得美国FDA 批准在美国上市,后在许多国家上市,目前已在全世界几十个国家和地区上市销售。
CTD格式申报资料范本

药品注册分类:化学药品六类注册申请分类:仿制药品注册申请药品名称:苯磺酸氨氯地平片(XX g、XX g)资料项目名称:药学研究CTD格式申报资料研究机构名称:XXX制药有限公司研究机构地址:XXXXXXXXX研究机构主要研究者:XXX研究机构电话:XXX注册申请联系人姓名:XXX原始资料的保存地点:XXX制药有限公司注册申请机构联系电话:XXXXXXXXX药品注册申请人:XXX制药有限公司苯磺酸氨氯地平片申报资料(药学部分)目录3.2.P.1 剂型及产品组成 (3)3.2.P.2 产品开发 (4)3.2.P.2.1 处方组成 (4)3.2.P.2.1.1 原料药 (4)3.2.P.2.1.2 辅料 (5)3.2.P.2.2 制剂研究 (5)3.2.P.2.2.1 处方开发过程 (5)3.2.P.2.3 生产工艺的开发 (20)3.2.P.2.4 包装材料/容器 (23)2.3.P.2.5 相容性 (23)3.2.P.3 生产 (23)3.2.P.3.1生产商 (23)3.2.P.3.2批处方 (23)3.2.P.3.3 生产工艺和工艺控制 (24)3.2.P.3.4 关键步骤和中间体的控制 (25)3.2.P.3.5 工艺验证和评价 (26)3.2.P.4 原辅料的控制 (31)3.2.P.5 制剂的质量控制 (31)3.2.P.5.1质量标准 (31)3.2.P.5.2 分析方法 (31)3.2.P.5.3 分析方法的验证 (34)3.2.P.5.4 批检验报告 (93)3.2.P.5.5 杂质分析 (97)3.2.P.6 对照品 (100)3.2.P.7 稳定性 (101)3.2.P.7.1稳定性总结 (101)3.2.P.7.2上市后的稳定性承诺和稳定性方案 (102)3.2.P.7.3 稳定性数据 (102)申报资料正文3.2.P.1 剂型及产品组成苯磺酸氨氯地平片是一种独特的具有高度血管选择性的长效二氢吡啶类钙离子拮抗剂,是心血管治疗药物中比较理想的长效降压药,也是近几年来世界处方量最大的高血压和心绞痛治疗药物。
化学药品CTD格式申报资料撰写要求

国食药监注〔2010〕387 号附件:化学药品CTD格式申报资料撰写要求CTD格式申报主要研究信息汇总表(原料药)2.3.S.1 基本信息2.3.S.1.1 药品名称原料药的中英文通用名、化学名2.3.S.1.2 结构原料药的结构式、分子式、分子量2.3.S.1.3 理化性质原料药的主要物理和化学性质:性状(如外观,颜色,物理状态);熔点或沸点;比旋度,溶解性,溶液pH, 分配系数,解离常数,将用于制剂生产的物理形态(如多晶型、溶剂化物、或水合物),生物学活性等。
2.3.S.2 生产信息2.3.S.2.1 生产商生产商的名称(一定要写全称)、地址以及生产场所的地址。
2.3.S.2.2 生产工艺和过程控制(1)工艺流程图:参见申报资料3.2.S.2.2(注明页码)。
(2)工艺描述:按反应路线简述各步反应的反应类型(氧化、还原、取代、缩合、烃化、酰化等),各步反应的原料、试剂、溶剂和产物的名称,终产物的精制方法和粒度控制等;特殊的反应条件(如高温、高压、深冷等)应说明。
详细内容参见申报资料3.2.S.2.2(注明页码)。
(3)生产设备:参见申报资料3.2.S.2.2(注明页码)。
(4)大生产的拟定批量:kg(g)/批。
— 1 —2.3.S.2.3 物料控制生产用物料(如起始物料、反应试剂、溶剂、催化剂等)的质量控制信息(包括来源、质量标准等),参见申报资料3.2.S.2.3(注明页码)。
2.3.S.2.4 关键步骤和中间体的控制列出所有关键步骤及其工艺参数控制范围。
关键步骤确定依据参见申报资料3.2.S.2.4或3.2.S.2.6(注明页码)。
中间体的质量控制参见申报资料3.2.S.2.4(注明页码)。
2.3.S.2.5 工艺验证和评价无菌原料药:工艺验证方案(编号:--,版本号:--)和验证报告(编号:--,版本号:--)参见申报资料3.2.S.2.5(注明页码)。
其他原料药:工艺验证方案(编号:--,版本号:--)和验证报告(编号:--,版本号:--)参见申报资料3.2.S.2.5(注明页码);或者,工艺验证方案(编号:--,版本号:--)和批生产记录(编号:--,版本号:--)样稿参见申报资料3.2.S.2.5(注明页码),验证承诺书参见申报资料3.2.S.2.5(注明页码)。
8 关于印发化学药药学资料CTD格式电子文档标准(试行)和药品注册申报资料的体例与整理规范的通知

关于印发化学药药学资料CTD格式电子文档标准(试行)和药品注册申报
资料的体例与整理规范的通知
食药监办注[2011]98号
2011年06月27日
发布
各省、自治区、直辖市食品药品监督管理局(药品监督管理局),总后勤部卫生部药品监督管理局:为推进通用技术文件(Common Technical Document,简称CTD)格式电子文档的提交,国家食品药品监督管理局组织制定了《化学药药学资料CTD格式电子文档标准(试行)》和《药品注册申报资料的体例与整理规范》,现予印发,请遵照执行。
附件:1.化学药药学资料CTD格式电子文档标准(试行)
2.药品注册申报资料的体例与整理规范。
CTD格式要求

CTD格式要求国食药监注〔2010〕 387 号附件:化学药品CTD格式申报资料撰写要求CTD格式申报主要研究信息汇总表(原料药)2.3.S.1 基本信息2.3.S.1.1 药品名称原料药的中英文通用名、化学名2.3.S.1.2 结构原料药的结构式、分子式、分子量2.3.S.1.3 理化性质原料药的主要物理和化学性质:性状(如外观,颜色,物理状态);熔点或沸点;比旋度,溶解性,溶液pH, 分配系数,解离常数,将用于制剂生产的物理形态(如多晶型、溶剂化物、或水合物),生物学活性等。
2.3.S.2 生产信息2.3.S.2.1 生产商生产商的名称(一定要写全称)、地址以及生产场所的地址。
2.3.S.2.2 生产工艺和过程控制(1)工艺流程图:参见申报资料3.2.S.2.2(注明页码)。
(2)工艺描述:按反应路线简述各步反应的反应类型(氧化、还原、取代、缩合、烃化、酰化等),各步反应的原料、试剂、溶剂和产物的名称,终产物的精制方法和粒度控制等;特殊的反应条件(如高温、高压、深冷等)应说明。
详细内容参见申报资料3.2.S.2.2(注明页码)。
(3)生产设备:参见申报资料3.2.S.2.2(注明页码)。
(4)大生产的拟定批量:kg(g)/批。
2.3.S.2.3 物料控制生产用物料(如起始物料、反应试剂、溶剂、催化剂等)的质量控制信息(包括来源、质量标准等),参见申报资料3.2.S.2.3(注明页码)。
2.3.S.2.4 关键步骤和中间体的控制列出所有关键步骤及其工艺参数控制范围。
关键步骤确定依据参见申报资料3.2.S.2.4或3.2.S.2.6(注明页码)。
中间体的质量控制参见申报资料3.2.S.2.4(注明页码)。
2.3.S.2.5 工艺验证和评价无菌原料药:工艺验证方案(编号:--,版本号:--)和验证报告(编号:--,版本号:--)参见申报资料3.2.S.2.5(注明页码)。
其他原料药:工艺验证方案(编号:--,版本号:--)和验证报告(编号:--,版本号:--)参见申报资料3.2.S.2.5(注明页码);或者,工艺验证方案(编号:--,版本号:--)和批生产记录(编号:--,版本号:--)样稿参见申报资料3.2.S.2.5(注明页码),验证承诺书参见申报资料3.2.S.2.5(注明页码)。
CTD格式申报资料目录、化学药品申报资料项目(附件二格式)

附件:原料药CTD格式申报资料目录管理信息资料:审查意见表/受理通知书(进口申请);药品注册现场核查报告;药品注册现场检查报告;药品注册检验报告申请表;药品研制情况申报表;药品注册现场检查申请表综述资料(文件夹名)1.药品名称。
2.证明性文件。
3.立题目的与依据。
4.对主要研究结果的总结及评价。
5.药品说明书、起草说明及相关参考文献。
6.包装、标签设计样稿。
信息汇总表(文件夹名)信息汇总表资料药学资料(文件夹名)1.基本信息(3.2.S.1)2 生产信息(3.2.S.2)3.特性鉴定(3.2.S.3 )4.原料药的质量控制(3.2.S.4)5.对照品(3.2.S.5)6.包装材料和容器(3.2.S.6)7.稳定性(3.2.S.7)药理毒理研究资料(文件夹名)16.药理毒理研究资料综述。
17.主要药效学试验资料及文献资料。
18.一般药理学的试验资料及文献资料。
19.急性毒性试验资料及文献资料。
20.长期毒性试验资料及文献资料。
21.过敏性(局部、全身和光敏毒性)、溶血性和局部(血管、皮肤、粘膜、肌肉等)刺激性等特殊安全性试验资料和文献资料。
22.复方制剂中多种成份药效、毒性、药代动力学相互影响的试验资料及文献资料。
23.致突变试验资料及文献资料。
24.生殖毒性试验资料及文献资料。
25.致癌试验资料及文献资料。
26.依赖性试验资料及文献资料。
27.非临床药代动力学试验资料及文献资料。
临床试验资料(文件夹名)28.国内外相关的临床试验资料综述。
29.临床试验计划及研究方案。
30.临床研究者手册。
31.知情同意书样稿、伦理委员会批准件。
32.临床试验报告。
二、制剂CTD格式申报资料电子提交目录管理信息资料:审查意见表/受理通知书(进口申请);药品注册现场核查报告;药品注册现场检查报告;药品注册检验报告申请表;药品研制情况申报表;药品注册现场检查申请表综述资料(文件夹名)1.药品名称。
2.证明性文件。
3.立题目的与依据。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
附件1:
化学药药学资料CTD格式电子文档标准(试行)
本标准用于规范按CTD格式申报的化学药药学资料的电子文档。
包括药学研究主要信息汇总表和申报资料。
1. 编辑软件版本
使用Microsoft Office Word 2003版或更高版本。
2. 字体、字号、行间距和字体颜色
2.1 字体
中文字体推荐使用宋体;
英文字体推荐使用Times New Roman(化学结构式中的英文字体除外)。
2.2 字号
字号通常要求使用小四号字。
叙述性文字推荐使用小四号字,表格推荐使用五号字,避免使用更小号字。
在选择表格的字号时需考虑如下两方面:在同一张页面上显示相对完整的信息;保证字迹清晰、容易阅读。
脚注推荐使用五号字体。
2.3 行间距
行间距通常为单倍行距。
2.4 字体颜色
推荐使用黑色字体,超文本链接建议使用蓝色。
3. 页面方向
适当的页面方向可以方便审评专家阅读,文档应设置适于阅读和打印的页面方向。
纵向页面能够正常显示时,页面应设置为纵向方向;纵向页面无法完整显示时,应设置为横向显示。
不应设置旋转页面。
4. 页面大小
4.1 纸张大小
页面设置纸张大小为A4。
4.2 页边距
纵向页面:左边距至少为2.5cm,以避免在打印和装订过程中遮盖信息。
上边距至少为2cm,其他边距设置为至少1cm。
横向页面:上边距至少为2.5cm,右边距至少为2cm,其他边距设置为至少1cm。
页眉和页脚的信息应在上述页边距内显示,保证文本在打印或装订中不丢失信息。
5. 文档结构目录
必须要构建文档结构目录和正文目录,应根据CTD结构标2
出所有文本标题层级。
文档结构目录显示的标题层级关系应和正文目录一致,正文目录应标示各层级标题页码。
目录中列出的项目可以包括表格、数字、出版物、其他参考文献和附件,可以设置超文本链接或书签进行导航。
6. 图表
图表在文档中能够正常显示,可直接插入在文档中;也可采取添加附件以超文本链接方式查阅图表。
7. 文档中的超文本链接
为保证超文本链接的效果,请使用相对路径创建超文本链接,应避免用绝对路径链接的方式。
文档中的超文本链接显示为带下划线的蓝色字体。
8. 页码
通常情况下,Word文档从封面页开始连续编码。
9. Word文档命名
文档应按“受理号+文档内容”的方式命名(受理号不包含省的简称),如:CXHS1000000药学研究主要信息汇总表.doc 文档。
除连字符(中划线)外避免使用特殊字符,特殊字符包含标点符号、下划线、空格或其他非文字符号(如\ / : * ? < >
3
| “ % # +) 。
4。
