大学化学试卷
大学有机化学试题1..
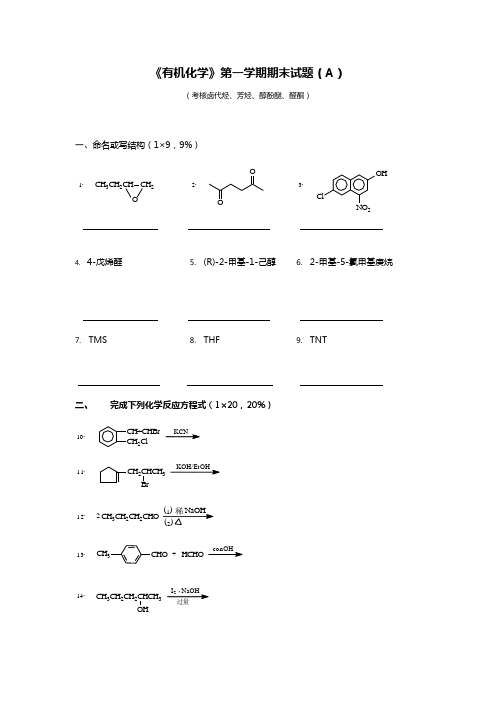
《有机化学》第一学期期末试题(A )(考核卤代烃、芳烃、醇酚醚、醛酮)一、命名或写结构(1×9,9%)CH 3CH 2CH CH 2O1.OO2.ClNO 2OH3.4. 4-戊烯醛5. (R)-2-甲基-1-己醇6. 2-甲基-5-氯甲基庚烷7. TMS8. THF9. TNT二、完成下列化学反应方程式(1×20,20%)CH=CHBr CH 2ClKCN10.CH 2CHCH 3BrKOH/EtOH11.CH 3CH 2CH 2CHO212.CHOCH 3HCHOconOH-+13.CH 3CH 2CH 2CHCH 3OHI 2 NaOH 过量14.(CH 3)2CHOHPBr 315.CH 3(CH 2)3Cl+16.AlCl 3OH OHH+17.CH 3MgBr18.HCHO 乙醚,H 3O+OPh 3P=CH 2+20.CH 3CH 2CH 2CHO21.+NaHSO 3(饱和O CO22.(CH 3)2CHMgBr23.O(1)醚(2)2+OCH 2CH=CHREt Me200C。
24.OHH 2SO 4HNO 325.HCHOHCl26.++ZnCl 2无水CH 3CH=CHCH 2CH 2CHOAg(NH 3)2+OH-27.C CH 3H 3C OHCHON H++H+28.2C 2H 5OH Odry HCl29.+三、有机理论部分(5×5,25%)30按沸点从大到小排列成序,并简要说明理由。
CH 2CH CH 2OH OH OHCH 3CH 2CH 2OH CH 3CH 2CH 2OCH 3CH 2CH CH 2OH OH OCH 3(a)(b)(c)(d)31.按羰基的活性从大到小排列成序,并简要说明理由。
CH 3CH O CH 3CCHOO CH 3CCH 2CH 3O (CH 3)3CCC(CH 3)3O(a)(b)(c)(d)32.解释:为什么化合物无论是进行S N 1还是进行S N 2反应都十分困难?33.写出反应机理CH 2CH 2ClClCH CH 3+(过量)AlCl 3无水34.写出反应机理OO四、有机结构分析部分(4×4,16%)35.用化学方法鉴别化合物C2H5Br CH3O CH2Br C2H5OHA B C36.用化学方法鉴别化合物O OH OHOHA B C D37.根据所给化学式、IR、NMR主要数据,推测化合物的结构C4H8O IR/cm-1: 2970, 2878, 2825, 2718, 1724; NMR: δH: 9.5(三重峰,1H)38.化合物A的分子式为C8H14O。
大学有机化学期末考试题含三套试卷和参考答案大全

有机化学测试卷(A )一.命名下列各化合物或写出结构式(每题1分,共10分) 1.2.3-乙基-6-溴-2-己烯-1-醇 3. 4. 5.邻羟基苯甲醛 6.苯乙酰胺 7. 8.对氨基苯磺酸9. 10.甲基叔丁基醚二. 试填入主要原料,试剂或产物(必要时,指出立体结构),完成下列各反应式。
(每空2分,共48分)1. 2.3. 4. 5. 6. 7. 8.3+H 2OOH -SN 1历程+9.10. 11. 12. 三. 选择题。
(每题2分,共14分)1. 与NaOH 水溶液的反应活性最强的是( )2. 对CH 3Br 进行亲核取代时,以下离子亲核性最强的是:( )3. 下列化合物中酸性最强的是( )(A) CH 3CCH (B) H 2O (C) CH 3CH 2OH (D) p-O 2NC 6H 4OH(E) C 6H 5OH (F) p-CH 3C 6H 4OH 4. 下列化合物具有旋光活性得是:( ) C, (2R, 3S, 4S)-2,4-二氯-3-戊醇CH = C H 2HBr Mg5. 下列化合物不发生碘仿反应的是( )A、C6H5COCH3B、C2H5OHC、 CH3CH2COCH2CH3D、CH3COCH2CH36. 与HNO2作用没有N2生成的是( )A、H2NCONH2B、CH3CH(NH2)COOHC、C6H5NHCH3D、C6H5NH27. 能与托伦试剂反应产生银镜的是( )A、CCl3COOH B、CH3COOHC、 CH2ClCOOH D、HCOOH四. 鉴别下列化合物(共6分)苯胺、苄胺、苄醇和苄溴五. 从指定的原料合成下列化合物。
(任选2题,每题7分,共14分)1. 由溴代环己烷及不超过四个碳原子的化合物和必要试剂合成:2.由指定原料及不超过四个碳原子的化合物和必要的试剂合成:3.由指定原料及不超过四个碳原子的化合物和必要的试剂合成:4. 由苯、丙酮和不超过4个碳原子的化合物及必要的试剂合成:5. 由指定的原料及必要的有机试剂合成:六. 推断结构。
完整版)大学分析化学试题和答案

完整版)大学分析化学试题和答案分析化学试卷一一。
填空(每空1分,共35分)1.写出下列各体系的质子条件式:1) NH4H2PO4: [H+]+[H3PO4]=[OH-]+[NH3]+[HPO42-]+2[PO43-]2) NaAc-H3BO3: [H+]+[HAc]=[H2BO3-]+[OH-]2.符合朗伯-比尔定律的有色溶液,当有色物质的浓度增大时,其最大吸收波长不变,透射比减小。
3.检验两组结果是否存在显著性差异采用t检验法,检验两组数据的精密度是否存在显著性差异采用F检验法。
4.二元弱酸H2B,已知pH=1.92时,[H2B]=[HB-];pH=6.22时[HB-]=[B2-],则H2B的pKa1=1.92,pKa2=6.22.5.已知Φ(Fe3+/Fe2+)=0.68V,Φ(Ce4+/Ce3+)=1.44V,则在1mol/L H2SO4溶液中用0.1000 XXX滴定0.1000 mol/L Fe2+,当滴定分数为0.5时的电位为0.68V,化学计量点电位为1.06V,电位突跃范围是0.86-1.26V。
6.以二甲酚橙(XO)为指示剂在六亚甲基四胺缓冲溶液中用Zn2+滴定EDTA,终点时溶液颜色由黄色变为红色。
7.某溶液含Fe3+10mg,用等体积的有机溶剂萃取一次后,该溶液中剩余0.1mg,则Fe3+在两相中的分配比为99:1.8.容量分析法中滴定方式有直接滴定,反滴定,置换滴定和间接滴定。
9.I2与Na2S2O3的反应式为I2+2S2O32-=2I-+S4O62-。
10.以波长为横坐标,吸光度为纵坐标,测量某物质对不同波长光的吸收程度,所获得的曲线称为吸收光谱曲线;光吸收最大处的波长叫做最大吸收波长,可用符号λmax表示。
11.紫外可见分光光度计主要由光源、单色器、吸收池、检测部分四部分组成。
12.XXX灵敏度以符号S表示,等于M/ε;XXX灵敏度与溶液浓度有关,与波长无关。
13.在纸色谱分离中,水是固定相。
济南大学有机化学试卷及答案

有机化学期末考试一、命名下列化合物或写出下列化合物结构简式(有异构现象者注明或画出构型)(每题2分,共28分)1. α-甲基四氢吡咯2. N -乙基环己胺3. 苹果酸4. 2-苯基-1-氯乙烷的优势构象5.(4S , 2E )-4-甲基-2-己烯6. 3-硝基-苯磺酸钠7.苄基-β- D-核糖苷8.CHCH 3C(CH 3)3OH 9.CH 3-C C-CH 2-CH 2Br10.CH 3CH 2OCH 2CH 2Cl 11.OHCH 312.CO13.(CH 3)2C=CHCHO14.二、完成下列反应(写出主产物或填写反应条件)(共21分)?1.+ClAlClH 3CC(CH 3)32.KMnO 4H 2SO 4?OHNaOH?2?3.4. OHCH 3?H 2SO 44???CHO5.CH 2ClOMe Cl3水?4H+?HI 加热?6.水??C ONH 2227.8.NHCOCH 3HNO 3H 2SO 4C 8H 7N 3O 5?2?稀碱Cu 2CN 2KCN?N 3H NO 2SO 3NaHOH 2C(CH3)3HOOC ?OPt??NaCN H+水?9.碘化氢三、用指定原料合成下列化合物(无机试剂任用)(每题4分,共12分)1.CH 3CH 2OOCCH 2COOCH 2CH 3CH 3H 3C2.H 3CNHCH 2C OCH 3CH 3C CH 3CH 2CONH 23.四、推导化学结构式(4分)化合物A 的分子式为C 6H 15N ,能溶于稀盐酸,与亚硝酸在室温时作用放出氮气并得到化合物B ,B 能进行碘仿反应生成C 和碘仿。
B 与浓硫酸共热得到D ,D 能使高锰酸钾酸性溶液褪色,并氧化分解为乙酸和2-甲基丙酸。
请写出A 、B 、C 、D 的结构式。
五、用化学方法分离下列化合物(4分)苯甲酸、苯酚、苯甲醛、苯甲醚的混合物六、设计乙酸正丁酯的实验方案,其中包括合成原料、反应方程式、最佳反应条件、反应装置、提高合成收率的方法及产物的纯化(6分)。
2023年9月化学四级真题及参考答案

2023年9月化学四级真题及参考答案第一部分选择题1. 以下物质中,能够与稀盐酸发生反应的是()A. H2SO4B. CH3COOHC. NaClD. HNO3答案:A2. 下列哪种氨基酸不是人体必需氨基酸?A. 赖氨酸B. 苯丙氨酸C. 组氨酸D. 色氨酸答案:D3. 下图是某有机化合物的^1H-NMR图,推测这个有机物的分子式为()(图片略)A. C2H6OB. C3H8OC. C4H8OD. C5H12O答案:C第二部分填空题1. 食盐的摩尔质量为()。
答案:58.44 g/mol2. 丙二酰辅酶A在Krebs循环中使用的反应中,将丙二酰辅酶A转化为柠檬酸所需的化合物是()。
答案:草酸第三部分简答题1. 海水中盐浓度过大,可能对生物造成危害。
请提出一种去除海水中盐分的方法,并简要说明其原理。
(20分)答:可以通过蒸馏法来去除海水中盐分。
因为在蒸馏过程中,海水中的水分蒸发出来后,因为盐分不挥发,所以留在蒸馏器的是纯净水。
2. 化学反应速率会受哪些因素的影响?请举例说明。
(20分)答:化学反应速率受温度、浓度、催化剂、表面积等因素的影响。
比如水和铁的反应,当温度升高时反应速率会变快;浓度越大,反应速率越快。
第四部分论述题1. 对于一元醇CH3CH2OH和二元醇HOCH2CH2OH,它们之间的物理性质和化学性质的差别是什么?(40分)答:一元醇分子中仅含有一个羟基(-OH),而二元醇分子中含有两个羟基。
导致两者物理性质和化学性质的不同。
一元醇在水中的溶解度小,不利于在水中进行水含量较大的化学反应,而二元醇可以在水中形成氢键结构,更容易在水中进行水含量较大的化学反应。
此外,二元醇在物理性质和化学性质上与一元醇相比具有更强的活性。
例如,与金属反应的速度更快,对水的吸收能力更强等。
大学有机化学题库 选择题

0774
在DNA分子中,正确的碱基配对是:
(A) A-T(B) U-A(C) C-A(D) G-A
69. 2分(0775)
0775
必需氨基酸:
(A)可在人体内由糖转变而来
(B)能在人体内由其他氨基酸转化而来
(C)不能在人体内合成,必需从食物获得
(D)可在人体内由有机酸转化而来
(A)脱氨酸(B)丙氨酸(C)甘氨酸(D)组氨酸
44. 2分(0749)
0749
某氨基酸溶液在电场作用下不发生迁移,这时溶液的pH叫做:
(A)低共熔点(B)中和点(C)流动点(D)等电点
45. 2分(0750)
0750
用茚三酮试验时,下列氨基酸的哪一个不产生紫色反应?
(A)脯氨酸(B)色氨酸(C)丙氨酸(D)甘氨酸
0718
下列杂环化合物中偶极矩方向错误的是:
16. 2分(0719)
0719
下列化合物中沸点最高的是:
(A)吡咯(B)咪唑(C)噻唑(D)吡唑
17. 2分(0720)
0720
苯胺(a)、吡啶(b)、六氢吡啶(c)、吡咯(d)碱性强弱次序是:
(A) a>b>c>d(B) b>a>c>d(C) c>b>a>d(D) d>c>a>b
23. 2分(0726)
0726
血红蛋白中含有血红素,它的主要生物功能是:
(A)输送O2(B)储存O2(C)输送Fe(D)储存Fe
24. 2分(0727)
0727
苯(a)、吡咯(b)、呋喃(c)、噻吩(d)的芳香性强弱次序是:
(A) a>b>c>d(B) d>c>b>a(C) a>d>b>c(D) c>d>b>a
大学有机化学试题和答案

试卷一一、命名下列各化合物或写出结构式(每题1分,共10分) 1.C C H C(CH 3)3(H 3C)2HCH(Z )-或顺-2,2,5-三甲基-3-己烯2.3-乙基-6-溴-2-己烯-1-醇 3.OCH 3(S)-环氧丙烷4.CHO3,3-二甲基环己基甲醛5.邻羟基苯甲醛OHCHO6.苯乙酰胺 7.OHα-萘酚8.对氨基苯磺酸9.COOH4-环丙基苯甲酸10.甲基叔丁基醚二. 试填入主要原料,试剂或产物(必要时,指出立体结构),完成下列各反应式。
(每空2分,共48分) 1.CH CH 2ClCHBrKCN/EtOH答BrCN2.OHCCHCH 2CH 2CH 2CHOC1C1;答 3. 答 4.+CO 2CH 3答CO 2CH35.1, B 2H 62, H 2O 2, OH -1, Hg(OAc)2,H 2O-THF 2, NaBH 4答OH OH(上面)(下面)6.OOOOO答 NH 2NH 2, NaOH,(HOCH 2CH 2)2O7. CH 2ClClNaOH H 2OCH 2OHCl8.ClCH 3+H 2OOH -SN 1历程答CH 3OH+CH 3OH9.答OO CH 3CH 2CH 2C CH 3OOCH 3O10.BrBrZnEtOH答11.CH = C H 2CH 3COCH 3H 2O ①②HBrMg 醚H+C O CH 3+Cl 2H +答CO CH 2Cl12.三. 选择题。
(每题2分,共14分)1、与NaOH 水溶液的反应活性最强的是( A )2. 对CH 3Br 进行亲核取代时,以下离子亲核性最强的是:( B )3. 下列化合物中酸性最强的是( D )(A) CH 3CCH (B) H 2O (C) CH 3CH 2OH (D) p-O 2NC 6H 4OH(E) C 6H 5OH (F) p-CH 3C 6H 4OH 4. 下列化合物具有旋光活性得是:( A ) C, (2R, 3S, 4S)-2,4-二氯-3-戊醇5. 下列化合物不发生碘仿反应的是( C ) C 6H 5COCH 3 B 、C 2H 5OHC 、 CH 3CH 2COCH 2CH 3D 、CH 3COCH 2CH 3 6. 与HNO 2作用没有N 2生成的是( C )A 、H 2NCONH 2B 、CH 3CH (NH 2)COOHC 、C 6H 5NHCH 3D 、C 6H 5NH 2 7. 能与托伦试剂反应产生银镜的是( D ) CCl 3COOH B 、CH 3COOH C 、 CH 2ClCOOH D 、HCOOH 四、鉴别下列化合物(共6分) 苯胺、苄胺、苄醇和苄溴五、从指定的原料合成下列化合物。
吉林大学普通化学期末试题

吉林大学09—10学年第一学期普通化学A 试卷一、每小题只有一个选项符合题意,请将答案的代码填入题末的括号内。
(每小题1分, 共10分)1、干冰升华吸收能量以克服…………………………………..………… ( ) A 、 键能 B 、 取向力 C 、 色散力 D 、 诱导力2、金属表面因氧气分布不均匀而被腐蚀,称为差异充气腐蚀,此时金属溶解处是( )A 、在氧气浓度较大的部位;B 、在氧气浓度较小的部位;C 、在凡有氧气的部位;D 、以上均不正确。
3、下列各组量子数中不合理的是…………………………………………………. ( )A 、2,1,0,+21B 、2,2,0,+21C 、2,0,0, -21D 、1,0,0,+21 4、酸雨是指雨水的pH 小于……………………………………………………………( ) A 、6.5; B 、6.0; C 、5.6; D 、7.05、通常线性非晶态高聚物中,适宜作塑料且加工性能较好的是…………………...( ) A 、T g 值和T f 值均高; B 、T g 值和T f 值均低; C 、T g 值低,T f 值高; D 、T g 值高,T f 值低。
6、AgCl 在下列物质中溶解度最大的是……………………………………………….( )A 、纯水;B 、6 mol·kg –1 NH 3·H 2O ;C 、0.1 mol·kg –1NaCl 溶液;D 、0.1 mol·kg –1BaCl 2溶液。
7、下列物质中 不等于零的是:..………………………………………….( )A 、I 2(g );B 、C (石墨); C 、Fe (s );D 、Cl 2(g )8、稀土金属通常保存在………………………………………………………………( )A 、汽油中;B 、柴油中;C 、煤油中;D 、酒精中。
9、下列离子属于9 ~17电子构型的是……………………………………………….( )A 、Br - ;B 、Sc 3+; C 、Zn 2+; D 、Fe 2+10、下列分子中,偶极矩不为零的是…………………………………………………( )A 、NCl 3;B 、BF 3 ;C 、CCl 4 ;D 、CS 2二、每小题有一个或两个选项符合题意,请将答案的代码填入题末的括号内。
吉林大学化学期中考试

三、简答题 (共12分)
1、请用动力学理论解释,在其他条件一定时,为什 么升高温度化学平衡会向吸热反应方向移动?
T2 T1 当 一定时,k2/k1与Ea成正比。 T1T2 k2 (吸) 对可逆反应,Ea(吸)>Ea(放),所以
k2 Ea T2 T1 ln k1 R T1T2
8. 下列方程式中,能正确表示AgCl (s)的ΔfHmӨ的是 ( B ) A Ag (s)+1/2Cl2( l )→ AgCl (s) B Ag (s)+1/2Cl2 (g)→AgCl (s) C 2Ag (s)+Cl2 (g)→ 2AgCl (s) D Ag+(aq)+Cl-(aq)→ AgCl (s) 9. 在300℃时反应CH3CHO → CH4+CO的活化能为190 kJ· -1。 mol 当加入催化剂后,反应的活化能降低为136.0 kJ· -1。问加 mol 入催化剂后的反应速率是原来的几倍 ( C ) A 2.53×109倍 B 2.53×108倍 C 8.35×104倍 D 8.35×106倍 10. 增加反应物浓度,化学反应速率加快的原因是( B ) A 反应物的活化分子百分数增加 B 反应物活化分子的数目增加 C 活化能降低 D 化学反应的速率常数增加
5. 已知298.15K时,Zn + 2H+( a mol· -1)→ Zn2+ (1.0 L mol· -1) +H2 ( 1.00×105Pa ),组成原电池,测得其电 L 动势E为 0.46 V,已知 E Ө (Zn2+/Zn)=-0.76V,则氢电 极溶液中pH为 ( D ) A 10.2 B 2.5 C 3.0 D 5.1 6. 电极电势与pH无关的电对是 ( D ) A H2O2/H2O B IO3-/I C MnO2/Mn2+ D MnO4-/MnO427. 下列过程中,ΔG = 0的是 ( B ) A 理想气体向真空膨胀 B 氨在水中解离达平衡 C 炸药爆炸 D乙醇溶于水
《大学化学基础》课程试卷(6)全解

11.在标准条件下,下列反应均向正方向进行
Cr2O72-+ 6Fe2++ 14H+= 2Cr3++ 6Fe3++ 7H2O
2Fe3++ Sn2+= 2Fe2++ Sn4+
它们中间最强的氧化剂和最强的还原剂是()
A.Sn2+和6Fe3+B.Cr2O72-和Sn2+C.Cr2+和Sn4+D.Cr2O72-和Fe3+
4.在公式lnKθ=nFEθ/RT中,下列有关描述正确的是( )
A.Kθ是标准状态的标准平衡常数B.Eθ是标准状态的电动势
C.Eθ是任意状态的电动势D.Kθ是298K时的标准平衡常数
5.下列电对中,当H+浓度增大时,电极电势不变的是()
A.Cl2/Cl-B.Cr2O72-/Cr3+C.MnO4-/Mn2+D. AsO43-/AsO33-
得
分
五、计算题(共25分)
1. (本小题7分)
计算反应2Fe2O3(s)+3C(s)→4Fe(s)+3CO2(g)自发进行的温度条件。[已知:Fe2O3(s)、CO2(g)在298K的标准摩尔生成热(焓)△fHmθ分别为–824.2、–393.50 kJ·mol-1;Fe2O3(s)、C(s)、Fe(s)、CO2(g)在298K的标准熵Smθ分别为87.4、5.74、27.28、213.64J·mol-1·K-1,可忽略温度对标准摩尔生成焓及标准熵的影响]。
3.(本小题5分)
用杂化轨道理论说明BF3分子共价键的形成,并指出其空间构型、键角及每一杂化轨道所含的s成份和p成份多少。
南昌大学有机化学-期末试卷

4、画出1,3,5-己三烯在基态时的HOMO 和LUMO 轨道图。
5、指出下列反应协同反应的类型A.HHB.OO OOO OC.OH O OOHD.Me MeMeMe6、比较下列化合物的酸性顺序( )A. B.C. D.SHSHOH SO 3H7、指出下列化合物的类别,并写出名称。
A.B. C. D.SS SH S CH 3OCH 3CH 3H 2NSO 2NH C NH 2NHDsfa8、在有机合成中保护羰基的常用试剂是( ) 实打实的、大苏打、9、在合成多肽时,保护氨基的试剂是( )A. B. C. PCl 5D. HCl OC Cl CH 3OPhCH 2O C Cl10、有机合成中常利用官能团的性质差异合成目标分子。
写出下列反应的目标产物。
A.B.ClClNaCN OEtO O Ph 3P +-CH 3CHCH 3C.OEtO O RoNaICH 2CH 2CH 2Cl11、在有机合成中常利用分子的对称性,使合成问题简化。
下列化合物应怎样拆分并合成。
A.CH 3OC C 2H 5H C C 2H 5H O CH 3B.PhC CPhOH CH 3OHCH 3二、完成反应1.N1) KMmO 42) H +―H 2O2.NH NO 3H 2SO 4NaNH 2NH 2甘油, 浓H 2SO 4硝基苯LiAlH 43.4.CH 3CH BrCH 3Ph 3Pn ―BuLi5.NaOHSHC 2H 5Br6.C C H 2SH H 2SH OC CH 2CH 3CH 3H 2兰尼镍7.S S H C 2H 51) n ―BuLi 2) Br(CH 2)4BrH 3O +Hg ++8.1) KMnO 42) H +CH 3SO 2ClNH 39.hvCH 3CH310.LiAlH 4CH 2CH COOEt11.HO CH 2C CHO 干燥 HCl1) Na2) CH 3CH 2CH 2Cl12.1) O 32) Zn/H 2OPh OHH 3PO 413.1) NaOH, H 2O 2) H + ,HCNCH 3C CH 2COOHCH3OC CH 314.2OO15. HCOOC 2H 51) CH 3CH 2CH 2CH 2MgBr 2) H 3O +CrO 3吡啶三、合成1、从n —BuOH 及必要试剂合成CH 3C CH 3OH( CH 2)5CH 3― 2、从C 2H 5Br 及必要试剂合成C 2H 5C OH C 2H 5C 2H 53、从丙醛合成CH 3CH 2CHCH CHO CH 34、从O及必要试剂合成HOOC(CH 2)4C CH 3O5、用切断法合成COOHCHO6、从乙炔及必要试剂合成(meso)—3,4—己二琼7、用切断法合成O 8、用必要试剂合成N N NCH3N NCH3NCH3CH3CH3 CH39、OHOOC OH10、HOCHOO O11、CH3OC CH3OC CH2CH2CH C CH3OCH3南昌大学2004-2005学年第二学期期末考试试卷(B)课程名称:有机化学题号一二三四五总分标准分20 30 6 20 24 100实得分阅卷人一、命名或写出结构式1.β-D-甲基吡喃葡萄糖苷稳定构象式2.2,3,4,6-四-O-甲基-D-吡喃葡萄糖3.谷氨酸4.甘氨酰丙氨酸5.三软脂酸甘油脂6.(+)-纤维二糖7.(+)-蔗糖 8.-果糖9.(Z 、Z )-9,12-十八碳二烯酸(亚油酸) 10.(Z 、E 、E )-9。
大学-无机化学试卷绝密

r r r (aq) r b 无机化学考试试题一、选择题(每题只有一个正确答案,在 a 、b 、c 、d 下打√,每题 1 分, 共 30 分)1、当一个反响以 ln k ~1/T 作图时,直接影响直线斜率的因素是 a 、反响的焓 b 、反响的吉布斯函数变c 、热力学能d 、反响的活化能2、催化剂可以增大化学反响速率,主要是由于反响的a 、△ G θm 降低b 、△ H θm 上升c 、△ S θm 上升d 、E a 降低3、以下哪一物种的△f G θm 等于零 a 、Br 2(g) b 、Br – c 、Br 2(l) d 、Br 2(aq)4、在等温等压条件下,某反响的△ G θ m.298= 10 kJ ⋅mol -1,说明该反响 a 、在标准态下,298K 时能自发进展b 、在标准态下,298K 时不能自发进展c 、在非标准态下,肯定能自发进展d 、在非标准态下,肯定不能自发进展5、298K ,H 2O (l) = H 2O (g)到达平衡时,体系的水蒸气压为 3.13kPa ,则 K θ 为以下数值中的哪一个a 、100b 、0.0313c 、3.13d 、16、依据酸碱电子理论,通常的中和反响是生成a 、一种协作物的反响b 、另一种较稳定协作物的反响c 、两种协作物的反响d 、中性分子酸和碱的反响7、HAc 的标准解离常数 K θa ,NaAc 的标准水解离数是a 、(K θa K θw )1/2b 、K θa / K θwc 、K θw / K θad 、(K θw / K θa )1/28、将 10g0.1mol ⋅L -1MgCl 2 和 10g0.01mol ⋅L -1 氨水相混合后,将消灭以下哪 一种状况[K θsp [Mg(OH)2]=1.2×10-11,K θ (NH 3)=1.8×10-5]a 、Q < K θspb 、Q = K θspc 、Q > K θspd 、Q ≤ K θsp9、假定 Sb 2S 3 的溶解度为 x ,则 Sb 2S 3 的溶度积应为a 、K θsp =x 5 b 、 K θsp =6xc 、K θsp =x 2d 、K θsp =108x 5班 级姓 名 考试成绩 课 程 无机化学 考试时间 年 月 日r 10、△ G θm 是一个氧化复原反响的标准吉布斯函数变,K θ是标准平衡常数, E θ是标准电动势,以下哪组所表示的△ G θ r m 、K θ、E θ关系是全都的 a 、△ G θ >0 E θ<0 K θ<1 b 、△ G θ >0 E θ>0 K θ>1 r m r m c 、△ G θ >0 E θ<0 K θ>1 d 、△ G θ <0 E θ<0 K θ>1 r m r m11、以下电对中,E θ值最大者是a 、E θ(AgI/Ag)b 、E θ(AgCl/Ag)c 、E θ[Ag(NH 3)2+/Ag]d 、E θ(Ag +/Ag)12、以下氧化剂中,随氢离子浓度增加而氧化性增加的是a 、Cl 2b 、FeCl 2c 、AgCld 、K 2Cr 2O 7 13、AgBr 沉淀易溶于哪一种水溶液中a 、H 2SO 4b 、AgNO 3c 、NaOHd 、Na 2S 2O 314、己知[Cu(edta)2-]和[Cu(en)2]2+的标准稳定常数分别为 6.3×1018 和 4.0 ×1019,试推断两者稳定性大小应符合以下哪种状况a 、前者大于后者b 、前者与后者差不多c 、前者小于后者d 、不肯定15、以下哪项用量子数描述的电子亚层可以容纳最多的电子数a 、n=3,l =2b 、n=4,l =3c 、n=5,l =0d 、n=5,l =3,m= +116、IB 族元素的原子半径比相应的 VIII 族元素的原子半径大,缘由是a 、d 电子越多,半径越大b 、IB 族的金属性比 VIII 族的强c 、最外层电子受屏蔽效应大d 、测定的试验方法不同17、在 PCl 3 分子中含有a 、1 个 sp 3-p σ键b 、2 个 sp 3-p σ键c 、3 个 sp 3-p σ键d 、5 个 sp 3-p σ键18、用杂化轨道理论推想以下分子的空间构型为直线形的是a 、SbH 3b 、CeH 4c 、CS 2d 、H 2Te19、依据分子轨道理论,O 2+中的键级是a 、0.5b 、1c 、1.5d 、2.520、以下化合物中,有分子内氢键的是a 、H 3BO 3b 、C 2H 6c 、N 2H 4d 、HNO 321、在协作物[Pt(NH 3)6] [PtCl 4]中,两个中心离子铂的氧化态是a 、都是+8b 、都是+6c 、都是+4d 、都是+222、依据晶体场理论,高自旋协作物的理论判据是a 、分裂能>成对能b 、电离能>成对能c 、分裂能>成键能d 、分裂能<成对能23、在八面体场中,既能形成低自旋又能形成高自旋协作物的过渡元素的d 电子数应为a、1~3 个b、2~5 个c、4~6 个d、6~9 个24、电子构型一样的离子,其极化力最强的是a、高电荷和半径大的离子b、高电荷和半径小的离子c、低电荷和半径大的离子d、低电荷和半径小的离子25、金属锂应保存在以下哪种物质之中a、汽油b、煤油c、枯燥空气d、液体石蜡26、以下有关硼烷的说法不正确的选项是a、BH 是最简洁的硼烷3b、乙硼烷中,2 个硼原子间靠氢桥键结合c、乙硼烷是最简洁的硼烷d、乙硼烷遇水发生水解,产物有氢气27、以下排列挨次中,符合氢卤酸的酸性递增挨次的是a、HI、HBr、HCl、HFb、HF、HCl、HBr、HIc、HBr、HCl、HF、HId、HCl、HF、HI、HBr28、以下离子中,哪一个由于d 亚层的电子到达半布满而特别稳定a、Fe3+b、Cu2+c、Co2+d、Cr3+29、以下元素中,其化合物较多呈现颜色的是a、碱金属b、碱土金属c、过渡元素d、卤素30、通常用什么试剂鉴定镍离子a、N-亚硝基( )苯胲胺b、丁二酮肟c、硝基苯偶氮间苯二酚d、二苯基联苯胺二、简答题(简要答复以下各问题,每题8分,共32分)1、通过计算比较,以下两组元素的原子作用在最外层电子上的有效核电荷大小,并依据计算结果说明,主、副族元素变化规律有何差异?(1)V Cr Mn (2)Na Si Cl2、己知[Fe(CN)6]4-和[Fe(NH3)6]2+的磁矩分别为0 和5.2B.M.。
《大学化学基础》课程试卷(8)

《大学化学基础》试卷(8)学院 专业 班级学号 姓名题 号 一 二 三 四 五 总分 阅卷教师得 分………………………………………………………………………………………………………………一、选择题(每题只有一个正确的答案,将你选择的答案填入下表中)(每小题1分,共20分) 题号 1 2 3 4 5 6 7 8 9 10 答案 题号 11 12 13 14 15 16 17 18 19 20 答案1. SiH 4分子的空间构型是:A. 平面三角形B. 三角锥形C. 正四面体形D. 直线形 2. 相同摩尔浓度的HCl 和HAc 溶液,则HCl 溶液与HAc 溶液的pH 值大小对比:A. HAc 的pH 值大B. HCl 的pH 值大C. 二者pH 值相等D. 不确定 3. 某电子在原子核外的运动状态是主量子数4,副(角)量子数2,则其原子轨道是:A. 3pB. 4dC. 4pD. 4s 4. 下列说法正确的是: A. 放热反应均为自发反应 B. △r S m 为正的反应均为自发反应 C. △r S m 为正、△r H m 为负的反应均为自发反应 得 分5. 下列各物质中不存在氢键的分子是:A. NH3B. CH4C. 邻硝基苯酚D. HNO36.已知:(1)CoO(s)+CO(g)= Co(s)+CO2(g),K(2)CO2(g)+H2(g) = CO(g)+H2O(l),K(3)H2O(l) = H2O(g),K则反应CoO(s)+H2(g)=Co(s)+H2O(g)的平衡常数为:A. K K/KB. K K KC. K K/KD. K/K K7. BaCO3能溶于盐酸的最合理解释是:A. BaCO3的K spθ较大;B. BaCO3在水中的溶解度较大;C. 能反应生成CO2气体离开系统,使溶解平衡发生移动;D. BaCO3的K spθ较小;8. 根据分子轨道理论下列物质中不可能存在的是:A. Li2B. B2C. C2D. He29. 下列各项条件改变中,能引起化学反应的标准平衡常数数值改变的是:A. 压力改变;B. 催化剂更换;C. 温度改变;D. 容器的体积改变;10.下列氧化剂中,当其溶液的H+浓度增大时,氧化性增强的是:A. KClO3B. Br2C. FeCl3D. F211. 按配合物的价键理论,配合物中中心原子与配体之间的结合力为A. 离子键B. 配位键C. 氢键D. 正常共价键12. 下列物理量值的大小与化学反应方程式的写法无关的是:A. △r H mB. △r S mC. E(电池电动势)D. △r G m13.下列电对中,Eθ值最小的是:A. H+/H2B. H2O/H2C. HOAc/H2D. HF/H214、欲使AgCl溶解,可加入:A. NH3·H2OB. HClC. NaOHD. NaCl15.具有下列各组量子数的电子能量最高的是:A. 4,2,0,-1/2B. 4,3,1,+ 1/2C. 3,2,1,-1/2D. 3,2,0,+1/2A. K a/2B.KaC 21 C.2/KaC D. C/217. 下列描述中正确的是:A. 因为电对Ni 2++2eNi 的ϕӨ为–0.23 V ,所以2Ni 2++4e2Ni 的ϕӨ为–0.46 VB. 在氧化还原反应中,若两个电对的E θ值相差越大,则反应进行得越快C. 含氧酸根的氧化能力通常随溶液的pH 值减小而增强D. 由于E θ(Fe 2+/Fe)=-0.440V , E θ(Fe 3+/Fe 2+)=0.771V , 故Fe 3+与Fe 2+能发生氧化还原反应18.往1dm 3浓度为0.10 mol·dm -3HAc 溶液中加入一些NaAc 晶体并使之溶解,会发生的情况是:A. HAc 的K a 值增大B. HAc 的K a 值减小C. 溶液的pH 值增大D. 溶液的pH 值减小 19.关于铜、锌和稀硫酸构成的原电池,叙述错误的是:A. 锌是负极B. 铜是正极C. 电子由锌片经导线流入铜片D. 电子由锌片经硫酸溶液流入铜片 20. 某容器中加入相同物质的量的HCl 和O 2,在一定温度下发生反应: 4HCl(g)+O 2(g)2Cl 2(g)+2H 2O(g),平衡时,下列关系正确的是:A. p (HCl)>p (O 2)B. p (HCl)<p (O 2)C. p (HCl)=p (O 2)D. p (HCl)=p (Cl 2)二、是非判断题(判断下列叙述是否正确,正确的画√,错误的画×,请将答案填入下表中) (每小题1分,共10分) 题号 1 2 3 4 5 6 7 8 9 10 答案1. 凡含有极性键的分子都是极性分子。
《大学化学基础》课程试卷(6)

《大学化学基础》试卷(6)学院 专业 班级学号 姓名题号 一 二 三 四 五 总 分阅卷 教师得分………………………………………………………………………………………………………………一、选择题(每小题只有一个正确答案,每小题1分,共20分) 题号 1 2 3 4 5 6 7 8 9 10 答案 题号11121314151617181920答案1. H 2S 的第二级电离HS -H ++S 2-,其平衡常数K a2=[H +]·[S 2-]/[HS -],则式中[H +]为( )A. 第二级电离产生的H +浓度B. 第一级电离产生的H +浓度C. 电离达到平衡时溶液中总的H +浓度D. [H +]= K a22. 已知△f H m θ(CO, g )= a kJ·mol -1,△f H m θ(Fe 2O 3, s )=b kJ·mol -1,△f H m θ(CO 2, g )= d kJ·mol -1,则反应:3CO(g)+ Fe 2O 3(s)=2Fe(s)+3 CO 2(g)的△r H m θ应为 ( )A. (3d-3a-b) kJ·mol -1B. (3a+b-3d) kJ·mol -1C. (d-a-b) kJ·mol -1D. (a+b-d) kJ·mol -1 3. φθ(Cu 2+/Cu +)=0.158V ,φθ(Cu +/Cu)=0.522V ,则反应 2 Cu +Cu 2+ + Cu 的K θ为.( )A. 6.93×10-7B. 1.98×1012C. 1.4×106D. 4.8×10-13 4. 在公式ln K θ=nFE θ/RT 中,下列有关描述正确的是 ( ) A. K θ是标准状态的标准平衡常数 B. E θ是标准状态的电动势 C. E θ是任意状态的电动势 D. K θ是298K 时的标准平衡常数 5. 下列电对中,当H +浓度增大时,电极电势不变的是( )A.Cl 2/Cl -B.Cr 2O 72-/Cr 3+C.MnO 4-/Mn 2+D. AsO 43-/AsO 33- 6. 下列成套量子数中不能描述电子运动状态的是( )A. n=3, l =1, m=1, m s =+1/2B. n=2, l =1, m=1, m s =-1/2得分______________,其[H +]为______________。
(完整版)大学有机化学期末考试题(含三套试卷和参考答案)(2)

一 . 命名以下各化合物或写出结构式(每题 1 分,共 10 分)1.(H3C)2HCC(CH 3)3C CH H2.3-乙基-6-溴-2-己烯-1-醇3.O 4.5.CH 3 CHO邻羟基苯甲醛6.苯乙酰胺7.OH8.对氨基苯磺酸9.COOH10.甲基叔丁基醚二. 试填入主要原料,试剂或产物(必需时,指出立体结构),达成以下各反响式。
(每空 2 分,共 48 分)1.CH CHBrKCN/EtOHCH2Cl2.高温 、高压①O3+ C12② H 2O Zn 粉3.HBrMgCH = CH 2醚CH 3COC14.+CO 2CH 35.1, B 2H 62, H 2O 2, OH -1, Hg(OAc) 2 ,H 2 O-THF 2, NaBH 46.OOOOO7.CH 2ClNaOH H 2OCl8.CH 3+ H 2O OH-SN1 历程Cl+9.OCH 3 O C 2 H 5 ONa+ CH 2=CH C 2 H 5 ONaC CH 3O10.① CH 3COCH 3② H 2O H +BrBrZnEtOH11.OH+C CH 3 + Cl 212.CH 3HNO 3Fe,HCl(CH 3CO) 2O( 2)H 2SO 4Br 2NaOHNaNO 2 H 3 PO 2H 2SO 4三 . 选择题。
(每题 2 分,共 14 分)1. 与 NaOH 水溶液的反响活性最强的是()(A). CH 3CH 2COCH 2Br (B). CH 3CH 2CHCH 2Br (C). (CH 3 )3CH 2Br (D). CH 3(CH 2)2CH 2BrCH 32. 对 CH 3Br 进行亲核代替时,以下离子亲核性最强的是: ( )(A). CH 3COO - (B). CH 3CH 2O - (C). C 6H 5O - (D). OH -3. 以下化合物中酸性最强的是()(A) CH 3CCH(B) H 2O(C) CH 3CH 2OH (D) p-O 2NC 6H 4OH(E)CHOH(F) p-CH C H OH6 53 6 44. 以下化合物拥有旋光活性得是:()COOHA,HOHCH 3B, HCOOHOHCH 3C,(2R, 3S, 4S)-2,4- 二氯 -3- 戊醇5. 以下化合物不发生碘仿反响的是 ( ) A 、 C 65 3、2 5H COCH3B CHOHC 、 CH 3 22D 、 32 3CHCOCHCH CHCOCHCH6. 与 HNO 2作用没有 2 生成的是()A 、H 22NB3 2 NCONH、CHCH ( NH )COOHC 、C 6 53D6 52H NHCH、CHNH7. 能与托伦试剂反响产生银镜的是 ( )A 、 CCl 3COOHB、 3C 、 CH CHCOOHClCOOHD、 HCOOH2四 . 鉴识以下化合物(共 6 分)苯胺、苄胺、苄醇和苄溴五 . 从指定的原料合成以下化合物。
(完整版)大学有机化学期末考试题(含三套试卷和参考答案).doc

一 . 命名下列各化合物或写出结构式(每题 1 分,共 10 分)1.(H3C)2HCC(CH 3 )3C CH H2.3-乙基-6-溴-2-己烯-1-醇3.O 4.5. CH 3 CHO邻羟基苯甲醛6.苯乙酰胺7.OH8.对氨基苯磺酸9.COOH10.甲基叔丁基醚二. 试填入主要原料,试剂或产物(必要时,指出立体结构),完成下列各反应式。
(每空 2 分,共 48 分)1.CH CHBrKCN/EtOHCH2Cl2.高温 、高压①O3+ C12② H 2O Zn 粉3.HBrMgCH = C H 2醚CH 3COC14.+CO 2CH 35.1, B 2H 62, H 2O 2, OH -1, Hg(OAc) 2 ,H 2 O-THF 2, NaBH 46.OOOOO7.CH 2ClNaOH H 2O Cl8.CH 3+ H 2 O OH -SN1 历程Cl+9.OCH 3 O C 2 H 5 ONa+ CH 2=CH C 2 H 5 ONaC CH 3O10.① CH 3COCH 3② H 2O H +BrBrZnEtOH11.OH+C CH 3 + Cl 212.CH 3HNO 3Fe,HCl(CH 3CO) 2O( 2)H 2SO 4Br 2NaOHNaNO 2 H 3 PO 2H 2SO 4三 . 选择题。
(每题 2 分,共 14 分)1. 与 NaOH 水溶液的反应活性最强的是()(A). CH 3CH 2COCH 2Br (B). CH 3CH 2CHCH 2Br (C). (CH 3 )3CH 2Br (D). CH 3(CH 2)2CH 2BrCH 32. 对 CH 3Br 进行亲核取代时,以下离子亲核性最强的是: ( )(A). CH 3COO - (B). CH 3CH 2O - (C). C 6H 5O - (D). OH -3. 下列化合物中酸性最强的是()(A) CH 3CCH(B) H 2O (C) CH 3CH 2OH (D) p-O 2NC 6H 4OH(E) C H OH(F) p-CH C H OH6 53 6 44. 下列化合物具有旋光活性得是: ()COOHA,HOHCH 3B, HCOOHOHCH 3C, (2R, 3S, 4S)-2,4- 二氯 -3- 戊醇5. 下列化合物不发生碘仿反应的是 ( ) A 、 C 6 5 3、2 5H COCH3B C H OHC 、 CH 3 22D 、 32 3CHCOCHCH CHCOCHCH6. 与 HNO 2作用没有 2 生成的是( )A 、H 22 NB 3 2NCONH、CHCH ( NH )COOHC 、C 6 53 D6 52H NHCH、C H NH7. 能与托伦试剂反应产生银镜的是 ( )A 、 CCl 3COOH B、 3C 、 CH CHCOOHClCOOHD、 HCOOH2四 . 鉴别下列化合物(共 6 分)苯胺、苄胺、苄醇和苄溴五 . 从指定的原料合成下列化合物。
大学本科有机化学试卷4套

第一套一.命名下列各化合物或写出结构式(每题1分,共10分)1.C C(CH3)3(H3C)2HCH2.3-乙基-6-溴-2-己烯-1-醇3.OCH34.CHO5.邻羟基苯甲醛6.苯乙酰胺7.OH8.对氨基苯磺酸9.COOH10.甲基叔丁基醚二. 试填入主要原料,试剂或产物(必要时,指出立体结构),完成下列各反应式。
(每空2分,共48分)1.CH CH2ClCHBrKCN/EtOH 2.3.4.+CO2CH35.46.OOOOO 7.CH2ClCl8.3+H2O OH-SN1历程+ 9.+C12高温高压、CH = C H2HBrMgCH3COC1C 2H 5ONaOCH 3O+ CH 2=CHC CH 3O10.BrBrZn EtOH11.C O CH 3+Cl 2H +12.Fe,HClH 2SO 43CH 3(CHCO)OBrNaOH24NaNO H PO (2)三. 选择题。
(每题2分,共14分)1. 与NaOH 水溶液的反应活性最强的是( )(A). CH 3CH 2COCH 2Br (B). CH 3CH 2CHCH 2Br (C). (CH 3)3CH 2Br (D). CH 3(CH 2)2CH 2BrCH 32. 对CH 3Br 进行亲核取代时,以下离子亲核性最强的是:( )(A). CH 3COO - (B). CH 3CH 2O - (C). C 6H 5O - (D). OH -3. 下列化合物中酸性最强的是( )(A) CH 3CCH (B) H 2O (C) CH 3CH 2OH (D) p-O 2NC 6H 4OH(E) C 6H 5OH (F) p-CH 3C 6H 4OH4. 下列化合物具有旋光活性得是:( )A,CH 3CH 3B,C, (2R, 3S, 4S)-2,4-二氯-3-戊醇5. 下列化合物不发生碘仿反应的是( )A、C6H5COCH3B、C2H5OHC、 CH3CH2COCH2CH3D、CH3COCH2CH36. 与HNO2作用没有N2生成的是( )A、H2NCONH2B、CH3CH(NH2)COOHC、C6H5NHCH3D、C6H5NH27. 能与托伦试剂反应产生银镜的是( )A、CCl3COOHB、CH3COOHC、 CH2ClCOOHD、HCOOH四.鉴别下列化合物(共6分)苯胺、苄胺、苄醇和苄溴五.从指定的原料合成下列化合物。
中国农业大学《普通化学》试卷

中国农业大学《普通化学》试卷生物学院、生命科学实验班用班级_____________ 学号_____________ 姓名_____________ 成绩___________一、选择题1. 证实电子具有波动性的实验依据是:A. 电子衍射实验;B. 光电效应;C. α粒子散射实验;D. 氢原子光谱实验。
2. 下列物质的性质,可以用轨道杂化理论来解释的是:A. NaF的熔点(993℃)比NaCl的熔点(801℃)高;B. O2分子中有单电子,具有顺磁性;C. H2O分子中H-O键夹角为104º45ˊ,呈“V”字形结构;D. 邻位和对位硝基苯酚在水中的溶解度之比为0.39:1,而在苯中溶解度之比为1.93:1。
3. 化学科学与生命科学交叉的一个活跃领域是:A. 生物无机化学;B. 环境化学;C. 核化学与放射化学;D. 食品化学。
4. 指示剂甲基橙是弱一元碱,p K b为10.6,其酸型体呈红色,碱型体呈黄色。
向纯水中滴加甲基橙后,水溶液呈:A. 红色;B. 黄色;C. 橙色;D. 无色。
5. 欲测定某蛋白质的摩尔质量,可选用的实验测定方法是:A. 测定一定浓度的该蛋白质水溶液的pH值;B. 测定一定浓度的该蛋白质水溶液的渗透压;C. 测定它的等电点;D. 测定它在水中的溶解度。
6. 在元素周期表中,从ⅣB族开始,同一副族第三过渡系列元素的第一电离能比第二过渡系列元素的第一电离能大,原因是:A. 镧系收缩;B. 钻穿效应;C. 保利不相容原理;D. 测不准原理。
7. 下列说法正确的是:A. 离子键有方向性和饱和性;B. 共价键有方向性和饱和性;C. 色散力有方向性和饱和性;D. 诱导力与分子变形性无关。
8.已知CuCl、CuBr、CuI的溶度积顺序减小。
下列电极的标准电极电势最高的为:A. Cu2+/Cu+ ;B. Cu2+/CuCl;C. Cu2+/CuBr;D. Cu2+/CuI。
9.水溶液中能大量共存的一对物质为:A. Cr2O72-和Cr(OH)4- ;B. MnO4-和Mn2+ ;C. Fe3+和Sn2+ ;D. Ag+和Cr2O72-。
大学有机化学期末考试题(含三套试卷和参考答案)
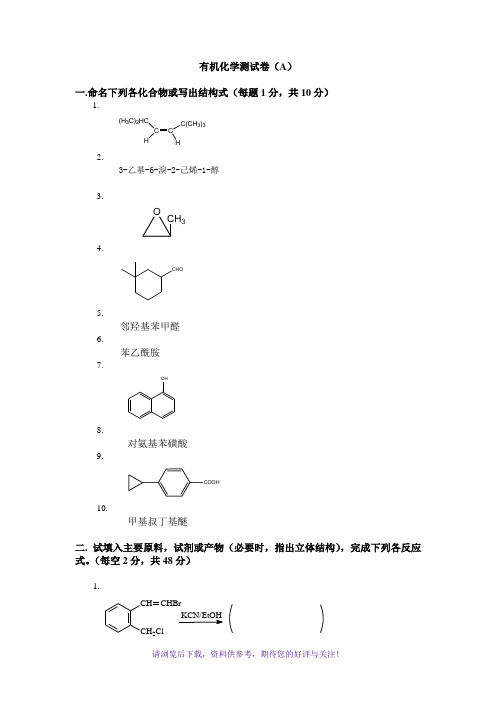
有机化学测试卷(A)一.命名下列各化合物或写出结构式(每题1分,共10分)1.C CH C(CH3)3(H3C)2HCH2.3-乙基-6-溴-2-己烯-1-醇3.OCH34.CHO5.邻羟基苯甲醛6.苯乙酰胺7.OH8.对氨基苯磺酸9.COOH10.甲基叔丁基醚二. 试填入主要原料,试剂或产物(必要时,指出立体结构),完成下列各反应式。
(每空2分,共48分)1.CH CH2ClCHBrKCN/EtOH2.3.4.+CO2CH35.46.OOOO 7.CH2ClCl8.3+H2O-SN1历程+ 9.C2H5ONaOCH3O+ CH2=CH C CH3O10.+C12高温高压、CH = C H2HBrMgCH3COC1BrBrZn EtOH11.C O CH 3+Cl 2H +12.Fe,HClH 2SO 43CH 3(CH3CO)2O2NaOH24NaNO H PO (2)三. 选择题。
(每题2分,共14分)1. 与NaOH 水溶液的反应活性最强的是( )(A). CH 3CH 2COCH 2Br (B). CH 3CH 2CHCH 2Br (C). (CH 3)3CH 2Br (D). CH 3(CH 2)2CH 2Br32. 对CH 3Br 进行亲核取代时,以下离子亲核性最强的是:( )(A). CH 3COO - (B). CH 3CH 2O - (C). C 6H 5O - (D). OH -3. 下列化合物中酸性最强的是( )(A) CH 3CCH (B) H 2O (C) CH 3CH 2OH (D) p-O 2NC 6H 4OH(E) C 6H 5OH (F) p-CH 3C 6H 4OH4. 下列化合物具有旋光活性得是:( )A,CH 3CH 3B,C, (2R, 3S, 4S)-2,4-二氯-3-戊醇5. 下列化合物不发生碘仿反应的是( )A 、 C 6H 5COCH 3B 、C 2H 5OH C 、 CH 3CH 2COCH 2CH 3D 、CH 3COCH 2CH 36. 与HNO2作用没有N2生成的是( )A、H2NCONH2B、CH3CH(NH2)COOHC、C6H5NHCH3D、C6H5NH27. 能与托伦试剂反应产生银镜的是( )A、CCl3COOHB、CH3COOHC、 CH2ClCOOHD、HCOOH四.鉴别下列化合物(共6分)苯胺、苄胺、苄醇和苄溴五.从指定的原料合成下列化合物。
大学化学期末试卷及答案

大学化学考试试题一.判断题(对的在括号内填√, 认为不对的填×)(10分)1.等温、等压条件下化学反应的热效应等于反应的焓变(×)。
2.非晶态有机高分子化合物具有玻璃态、高弹态和粘流态等三种状态(×)。
3.反应 aA + fF = gG + dD 的ΔrGm<0,则该反应在标态下也一定可以自发进行(×)。
4. 加正催化剂不仅可以加快正反应速率(√), 也可以加快逆反应速率(√), 还可以提高反应的产率(×)。
5.如果一个分子只有一个旋转轴而没有其他对称元素,则它必然是极性分子(√), 但没有旋光性(×)。
6.化学反应进度可以度量化学反应进行的程度(√), 所谓1mol反应是指产生的各生成物都是1mol的反应(×).7.原电池是利用氧化还原反应将化学能转换成电能的装置(×)。
8.镧系收缩的结果,使5,6周期的同一副族的原子半径相近(√),性质也相似(√)。
9. 自由基产生速率等于其消耗速率的链反应为直链反应(√),爆炸反应即属于此类反应(×), 自由基产生速率大于其消耗速率的链反应为支链反应(√)。
10.原子轨道就是原子核外电子出现概率最大的区域(×)。
11.因为两个电子分布在同一轨道中要克服成对能(√), 因此在同一能级的轨道中, 电子尽先占据不同轨道(√)。
12.下列两个反应:2Fe3+(aq ) + 2I-(aq ) = 2Fe2+(aq )+ I2(s )与Fe 3+(aq ) + I -(aq ) = Fe 2+(aq )+ 21I 2(s )的K 数值相等(×)。
二. 填充题(将正确的结果填在横线上)(20分)1.人体中某种酶反应的活化能为50kJ ·mol-1,正常人体温是37℃,则当人发烧达40℃时,该反应速率增加百分之 20 。
2. 由标准镍电极(做负极)和标准铜电极组成原电池, 测得其电动势为0.57V, 则该原电池的反应方向为Ni+Cu2+→Ni2++Cu, 如已知标准镍电极的标准电极电势为-0.23V, 则标准铜电极的电极电势为0.34V, 当c (Ni2+)降到0.01mol ·L-1时, 原电池电动势将升高。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中国民航大学 大学化学期末试题
一. 选择题(15小题,每小题2分,共30分)
1、质量作用定律只适用于(
)
A 、非基元反应
B 、复杂反应
C 、基元反应
D 、多步反应 2、下列物质的标准摩尔生成吉布斯自由能不为零是( )
A 、氮气
B 、液溴
C 、溴水
D 、氧气
3、有关化学反应处于平衡状态时的描述,不正确的是( )
A 、当正反应速率与逆反应速率相等时的状态
B 、当正反应速率与逆反应速率均为零时的状态
C 、当反应物与生成物浓度不再改变时的状态
D 、当某反应物的浓度瞬时减少量与生成物浓度瞬时增加量相等时的状态
4、已知某化学反应的θ
m r S ∆>0,那么下列说法不正确的是( )
A 、该反应一定自发
B 、该反应体系的混乱度增大
C 、该反应不一定自发
D 、若该反应同时满足θ
m r H ∆<0,则反应一定自发
5、下列溶液的凝固点最低的是( )
院名___________系名___________专业___________ 姓名___________学号___________
---------------------------------------------------装------------------------订------------------------线-----------------------------------------
A 、0.01 mol ﹒dm -3的HAc 溶液
B 、0.01 mol ﹒dm -3的NaCl 溶液
C 、0.01 mol ﹒dm -3的葡萄糖溶液
D 、0.01 mol ﹒dm -3的蔗糖 溶液 6、已知NH 3的K a =1.76×10-5,则0.10mol·dm -3的 NH 4Cl 水溶液的pH 值为
( )。
A 、12.45
B 、4.76
C 、5.13
D 、8.87
7、已知难溶电解质 Pb(OH)2的Ksp θ= 1.42 ×10-20,则其溶解度为( )
A 、7.1 ×10-10
B 、1.53 ×10-7
C 、1.19 ×10-10
D 、3.55 ×10-7
8、决定多电子原子的轨道能量高低的因素是( ) A 、n,l B 、 n,l,m C 、n,m D 、l,m,
9、某元素的最高氧化数为 +7 ,在同族元素中的它的原子半径最小,该元素是( )
A 、Cl
B 、Mn
C 、Cr
D 、Cu
10、H 2O 的沸点是100℃,H 2Se 的沸点是-42℃, 这可用下述哪种概念解释?
( )
A 、范德华力
B 、共价键
C 、分子量
D 、氢键
11、有反应 Fe (s) + 2Ag + (aq) = Fe 2+ (aq) + 2Ag (s) 组成原电池。
若仅将Ag + 的
浓度减小到原来的1/10,则电池电动势会( )
A 、增大0.059 v
B 、减小0.059 v
C 、减小0.118v
D 、增大0.118v 12、已知θ
-
Cl Cl
E /2
=1.36v ,+-327
2
/Cr O Cr E =1.33v ,则在标准态下,反应:
K 2Cr 2O 7 + 14HCl = 2CrCl 3 + 3Cl 2 + 2KCl 的方向为( ) A 、正反应自发 B 、逆反应自发 C 、平衡状态 D 、无法确定 13、在电解过程中,在阳极首先放电的是( )。
A.电极电势代数值最小的氧化态物质。
B.电极电势代数值最大的还原态物质。
C.电极电势代数值最小的还原态物质。
D.电极电势代数值最大的氧化态物质。
14、某温度,反应H2(g)+Br2(g)=2HBr(g)的标准平衡常
数=4×10-2,
1/2H2(g)+1/2Br2(g) =HBr(g)的标准平衡常数为()
A、25;
B、5;
C、4×10-2
D、2×10-1
15、把一滴含有酚酞指示剂的NaCl溶液滴在磨光的锌片表面上,一定时间后,
可看到液滴边缘变成红色,这表明()。
A、边缘部位的ϕ值大,为阴极。
B、产生了差异充气腐蚀。
C、边缘部位的ϕ值小,为正极。
D、液滴内部的ϕ值小,为阳极。
二. 是非题(请在各题括号中,用“√”、“×”分别表示题文中叙
述是否正确)(共10小题,每小题1分,共10分)
()1.对不同类型的难溶电解质,不能认为溶度积大的溶解度也一定大。
()2.凡含氢和氧的化合物分子间都有氢键。
()3. 键的极性越强,分子的极性也越强。
()4. φ值越大,则电对中氧化型物质的氧化能力越强。
()5. 当反应A2+B2→2AB的速率方程为v=k[A2][B2]时,则此反应一定是基元反应。
()6. N2分子键级为3,且具有顺磁性。
()7. 磁量子数m=1的原子轨道必定都是p轨道。
()8. 标准状态下,元素稳定单质S mΘ=0。
()9. 系统经一系列变化又回到初态,此过程中系统的一切状态函数的变化量为0。
()10. 知道了化学反应方程式,就知道了化学反应级数。
三. 填空题(8小题,共20分)
1、已知在标准状态下,下述反应的标准反应热分别为:
MnO2(s)=MnO(s)+1/2O2(g) △r HΘ1
MnO2(s)+Mn(s)=2MnO(s) △r HΘ2
则MnO2的标准生成热△f HΘ= 。
(本题2分) 2. HCO3-是两性物质,它的共轭酸为,共轭碱为。
(本题2分) 3. 已知电极反应Cu2++2e = Cu的φΘ为0.347V,则电极反应2Cu =2Cu2+ +4e的φΘ值为:。
(本题2分) 4. 若N2(g)+3H2(g)=2NH3(g)为基元反应,当H2浓度增大一倍,反应速率变为
原来的倍,当N2浓度增大一倍,反应速率变为原来的倍。
(本题2分) 5. 聚丙烯的单体是,链节是。
(本题2分) 6. 体系从环境吸收250kJ,而环境又对体系做100kJ功,问内能的变化值
是。
(本题1分) 7. H2O分子间作用力包括。
(本题3分)
8. 写出下列分子或离子的轨道杂化方式和其空间构型:
(A) H3O+;轨道杂化方式;空间构型
(B)NH4+;轨道杂化方式;空间构型
(C )BCl3;轨道杂化方式;空间构型。
(本题6分)
四.简答题(3小题,共10分)
1、试解释在电解质溶液中,含有杂质铜的金属锌比含有铅的金属锌腐蚀更严重
的原因。
(本题3分)
2、硅原子的两个p电子在三个能量相同的3p轨道上如何分布?(本题3分)
3、人体长期缺Ca、Zn会引起何种疾病?能否长期过量补充呢?为什么?
(本题4分)
五.计算题(3小题,共30分)
1、 (本题
8
分)已知:反应 AB 2(s) = A(s) + B 2(g) 的
)298(0
K H m r ∆=180.0KJ.mol -1
、)298(0K S m r ∆=160.0 J ﹒mol -1
﹒K -1
,求:
(1)在100 kPa ,298K 下,此反应能否自发进行? (4分) (2)该反应在1000℃时达到平衡时的平衡常数K 0值。
(4分)
2、(本题10分) 已知K bθ=1.8×10-5;K sp[Mg (OH)2]θ=1.8×10-12,计算在0.20L 的
0.50mol · L-1 MgCl2溶液中,
(1)加入等体积的0.10 mol · L-1的氨水溶液,有无Mg (OH)2沉淀生成?
(4分) (2)为了不使Mg (OH)2沉淀析出,至少应加入多少克NH4Cl (s) ?(设加入NH4Cl (s) 后体积不变) (6分)
3、(本题10分)
已知:电池反应Fe2++ Ag+= Fe3+ + Ag,其中Fe2+、Ag+、Fe3+的浓
度均为标准浓度,
2
3
+
+
F e
F e
ϕ
= 0.770V,
A g
A g+
ϕ
= 0.7996V
(1)写出原电池的符号表达式。
(2分)
(2)计算原电池的电动势。
(2分)
(3)当Fe2+的浓度降低到0.01 mol﹒L-1其它离子浓度不变时,求反应的吉布斯函数变。
该反应的方向如何?(4分)
(4)求该原电池反应达平衡时的平衡常数。
(2分)。
