2.6 相图和相图化学(2)
第六章 相平衡与相图 2

在硅酸盐系统中,经常用氧化物作为系统的组分,
如:Al2O3-SiO2为二元系统,组分数=2;
硅酸盐物质的化学式表达方式之一即氧化物形式表达,如:钾 长石K2O· Al2O3· 6SiO2为单元系统,仅表示一种物质,组分数=1。
(2)独立组分数——表示构成平衡系统中各相组成所需要的最 少组分数,用“c”表示。
冰点:是一个大气压下被空气饱和的水和冰的平 衡共存温度;
三相点O:是在它自己的蒸汽压力(0.611KPa)下 的凝固点(0.01℃)。是一个单组分系统。 3、水型物质和硫型物质
解释界线的斜率:
由克劳修斯-克拉普隆方程
p
S
c
L a
临界点
dp H dT T V
C' b
O g
T
由图6-1,冰的熔点曲线斜率为负,说明压力增大,冰的熔点下 降。这是由于冰熔化时体积收缩所致。 象冰熔融时体积收缩的物质称为水型物质,如:铋、镓、锗等 少数物质。
β-鳞石英 117℃
γ-鳞石英
β-方石英
说明:介稳态的出现不一定都是不利的。由于某些介稳态具有
所需要的性质,因而创造条件(快速冷却或掺加杂质) 有意把它保存下来。 如:水泥中的β -C2S,陶瓷中介稳的四方氧化锆 ; 耐火材料硅砖中的鳞石英以及所有的玻璃材料。 但由于转变速度慢,实际可长期存在。
二、相
无机材料科学基础
第六章 相平衡与相图
孙学勤 烟台大学 环境与材料工程学院
§6-1凝聚态系统相平衡特 点 一、热力学平衡态和非平衡态
1. 平衡态 相图即平衡相图,反应的是体系所处的热力学平衡状态, 即仅指出在一定条件下体系所处的平衡态 (其中所包含的相数,各相的状态、数量和组成), 与达平衡所需的时间无关。
相图基本知识简介

第二章 二 元 合 金 相 图纯金属在工业上有一定的应用,通常强度不高,难以满足许多机器零件和工程结构件对力学性能提出的各种要求;尤其是在特殊环境中服役的零件,有许多特殊的性能要求,例如要求耐热、耐蚀、导磁、低膨胀等,纯金属更无法胜任,因此工业生产中广泛应用的金属材料是合金。
合金的组织要比纯金属复杂,为了研究合金组织与性能之间的关系,就必须了解合金中各种组织的形成及变化规律。
合金相图正是研究这些规律的有效工具。
一种金属元素同另一种或几种其它元素,通过熔化或其它方法结合在一起所形成的具有金属特性的物质叫做合金。
其中组成合金的独立的、最基本的单元叫做组元。
组元可以是金属、非金属元素或稳定化合物。
由两个组元组成的合金称为二元合金,例如工程上常用的铁碳合金、铜镍合金、铝铜合金等。
二元以上的合金称多元合金。
合金的强度、硬度、耐磨性等机械性能比纯金属高许多,这正是合金的应用比纯金属广泛得多的原因。
合金相图是用图解的方法表示合金系中合金状态、温度和成分之间的关系。
利用相图可以知道各种成分的合金在不同温度下有哪些相,各相的相对含量、成分以及温度变化时所可能发生的变化。
掌握相图的分析和使用方法,有助于了解合金的组织状态和预测合金的性能,也可按要求来研究新的合金。
在生产中,合金相图可作为制订铸造、锻造、焊接及热处理工艺的重要依据。
本章先介绍二元相图的一般知识,然后结合匀晶、共晶和包晶三种基本相图,讨论合金的凝固过程及得到的组织,使我们对合金的成分、组织与性能之间的关系有较系统的认识。
2.1 合金中的相及相图的建立在金属或合金中,凡化学成分相同、晶体结构相同并有界面与其它部分分开的均匀组成部分叫做相。
液态物质为液相,固态物质为固相。
相与相之间的转变称为相变。
在固态下,物质可以是单相的,也可以是由多相组成的。
由数量、形态、大小和分布方式不同的各种相组成合金的组织。
组织是指用肉眼或显微镜所观察到的材料的微观形貌。
由不同组织构成的材料具有不同的性能。
材料科学基础第四张相平衡与相图(2)
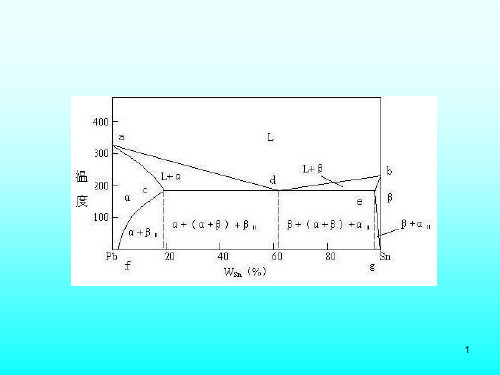
以含Ni=30%的Cu-Ni合金为例: 以含Ni=30%的Cu-Ni合金为例: Ni=30% 合金为例 t1以上:单相的L, 冷却时只 t 以上:单相的L, 是降温不发生状态的变化. 是降温不发生状态的变化. 是降温不发生状态的变化
冷到t1:发生匀晶转变,凝固 冷到t 发生匀晶转变, 冷到 出固溶体α1 (含高熔点组元 出固溶体α 出固溶体 Ni较多),而液相的成分为L1 Ni较多),而液相的成分为 Ni较多),而液相的成分为L 与合金的成分相同. 与合金的成分相同. 与合金的成分相同 t1温度下相的相平衡关系为 t L1→α1 . 运用杠杆定律得出的α1量很少, 运用杠杆定律得出的α 运用杠杆定律得出的 量很少, 几乎为另,此时结晶刚刚开始. 几乎为另, 几乎为另 此时结晶刚刚开始.
固溶体平衡凝固时液,固两相相对量 固溶体平衡凝固时液, 固溶体平衡凝固时液 的变化:可以用杠杆定律确定. 的变化: 的变化 可以用杠杆定律确定.
固溶体合金平衡凝固示意图
⑶ 有极值的匀晶相图
具有极小点或极大点的匀晶 具有极小点或极大点的匀晶 相图. 相图. 相图 对应极点处液固两相的成分 对应极点处液固两相的成分 相同,其凝固过程为等温反应. 相同, 相同 其凝固过程为等温反应. 应用相律时要予以修正,因为 应用相律时要予以修正, 应用相律时要予以修正 该处的化学成分不变,所以确 该处的化学成分不变, 该处的化学成分不变 定系统状态的变数就减少一个, 定系统状态的变数就减少一个, 定系统状态的变数就减少一个 即 f=2-2=0. 极大点的匀晶相图比较少见. 极大点的匀晶相图比较少见. 极大点的匀晶相图比较少见
⑵平衡凝固 平衡凝固:凝固过程是在极其缓慢冷 平衡凝固: 却条件下凝固. 却条件下凝固. 平衡组织:在极其缓慢冷却条件下凝 平衡组织: 固所得到的组织. 固所得到的组织. 因速度十分缓慢, 因速度十分缓慢,原子能够进行充分扩 散,在凝固过程的每一时刻都能达到完 全的相平衡. 全的相平衡. 以含Ni=30% Cu-Ni合金为例 Ni=30%的 合金为例, 以含Ni=30%的Cu-Ni合金为例,来分析单 相固溶体合金的平衡凝固过程. 相固溶体合金的平衡凝固过程.
相图与相图化学

综述:
1、在SiO2的多晶转变中,
同级转变:-石英 -鳞石英-方石英
转变很慢,要加 快转变,必须加入矿化剂。
同类转变:-、-和 -型晶体,转变速度非常快。
2、SiO2的多晶转变的体积效应
结论:同级转变V大,-石英 -鳞石英的
VMAX=16% 同类转变V小,鳞石英V最小,为0.2%;
方石英V最大,为2.8%。 同类转变速度快,因而同类转变的危害大。
相数 P—系统中具有物理性质和化学性质完全相同的均匀 部分。
自由度数F —维持系统相数不变的情况下,可以独立改变 的变量(温度、压力、组成等)
6
2、凝聚系统:不含气相或气相可以忽略的系统。 F = C–P + 1(T)
说明:单元凝聚系统F=C-P+2(设P 为变量)
7
ቤተ መጻሕፍቲ ባይዱ
2.3.2 相图分析
一、单元系统 (C=1) 相律: F = C-P+2 = 3-P (平衡共存相最多3;系统最大自由度2) 1、水的相图:P-T图
有一个可独立改变,两者关系符合克拉佩龙方程。
三个单相区(双变量系统):
在冰、水、水蒸气三个单
相区内,P=1,F=2,温
度和压力独立地有限度地变化 不会引起系统相态的改变。
学会判断单相区的相态。
一个三相点(无变量系统):
O点 :三相点,气-液-固
三相共存,P 3, F ,0
三相点温度和压力皆定。
SiO2相图
在573℃以下的低温,SiO2的稳定晶型为-石英,加热至573℃转变为高温 型的-石英,这种转变较快;冷却时在同一温度下以同样的速度发生逆转变;
加热速度过快,则-石英过热而在1600℃时熔融为过冷的SiO2熔体; 如果加热速度很慢,则在870℃转变为-鳞石英。
4 第四章 相图(二元)

配制合金系中几种不同成分合金 熔化后,测试其冷却曲线 根据曲线上的转折点,确定各合金的凝固温度 将上述数据引入以温度为纵轴,成分为横轴的坐标
平面中 连接意义相同的点,作出相应的曲线 曲线将图面分成若干区域----相区。经过金相组织分 析,测出各相区所含的相,将相的名称标注其中, 相图工作就完成
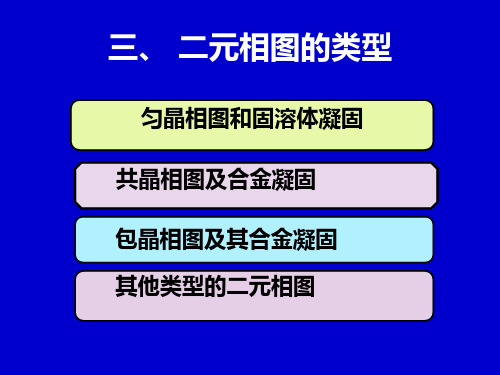
4,过共晶合金
★ E点以右,D点以左,为过共晶合金,与亚 共晶合金类似,白色卵形为初晶β,黑色为共 晶体(α+β)。 ★α,β,αⅡ,βⅡ,(α+β)称组织组成物 ★α,αⅡ为一个相。(α+β)两相混合物,称共晶 体。 ★求组织组成物的相对量,同样可用杠杆定理 标明各区的组织---组织分区图
四、共晶组织和初晶形貌 1,共晶组织的形貌
测试时要求合金的成分准确,纯度高,冷却
速度要慢0.5~1.5℃/min
下面是Ni-Cu合金相图,是最简单的相图之一
Ni 1500 1400 1300 1200 1100 1000 900 20% 40% Cu Cu
80% Cu 60% Cu
Cu
Ni 20 40 60 80 Cu Cu%
2.2. 使用二元合金相图的基本方法
2 > 2 ;此时 2 -2 <0
dG<0
当α相与β相彼此平衡时,在dG=0, 同理 :------------------------------
= =
1
2
2
1
1.3. 相律
相律是分析和使用相图的重要依据。凝集态
受压力影响很小,在恒压下:相平衡条件的 数学表达式:f=c-p+1 (在物理化学中也指出) 式中C为组元数,P为共存的平衡相数,f为自 由度数。 单元系(纯金属) f=1-2+1=0,自由度为1,表 明恒温下平衡熔化或凝固。 二元系C=2,当f=0,p=3,在恒定温度下处于三 相平衡;两相共存时,自由度数目为1,表明 平衡凝固或熔化就在一定温度范围
物理化学第5章相律与相图

第五章相律与相图5.1 相平衡相平衡是热力学在化学领域中的重要应用,也是化学热力学的主要内容之一。
在第三章中已经应用热力学原理研究了纯物质系统的两相平衡;在第四章中研究了多组分系统的两相平衡,其结果是用热力学公式表达相平衡的规律。
而本章则是应用热力学原理采用图解的方法来表达相平衡规律,特别是对多相系统的相平衡规律的研究,用图解的方法更显得方便和实用。
研究多相系统的相平衡状态随组成、温度、压力等变量的改变而发生变化,并用图形来表示系统相平衡状态的变化,这种图称为相图,相图形象而直观地表达出相平衡时系统的状态与温度、压力、组成的关系。
相律为多相平衡系统的研究建立了热力学基础,是物理化学中最具有普遍性的规律之一,它讨论平衡系统中相数、独立组分数与描述该平衡系统的变数之间的关系,并揭示了多相平衡系统中外界条件(温度、压力、组成等)对相变的影响。
虽然相律不能直接给出相平衡的具体数据,但它能帮助我们从实验数据正确地画出相图,可以帮助我们正确地阅读和应用相图。
本章首先介绍相律,然后介绍单组分、二组分和三组分系统的最基本的几种相图,其中着重介绍二组分气-液相图和液-固相图,介绍相图的制法和各种相图的意义以及它们和分离提纯方法之间的关系。
应用:a、水泥熟料的烧成过程,系统中有C3S(硅酸三钙)、C2S(硅酸二钙)、C3A(铝酸三钙)、C4AF(铁铝酸四钙)————固相,还有一定的液相,是一个多相的系统。
随着温度升高,这个多相系统中那些相能继续存在?那些相会消失?有没有新的相生成?各相组成如何?各相含量为多少?b、在化工生产中对原料和产品都要求有一定的纯度,因此常常对原料和产品进行分离和提纯。
常用的分离提纯的方法是结晶、蒸馏、萃取和吸收等等,这些过程的理论基础就是相平衡。
相图:根据多相平衡的实验结果,可以绘制成几何图形用来描述这些在平衡状态下的变化关系,这种图相成为相图。
现实意义:水泥、玻璃、陶瓷等形成过程均在多相系统中实现,都是将一定配比的原料经过锻烧而形成的,并且要经历多次相变过程。
相图和相图化学(五)

固相线 以下相区为固溶体
14
相图由两条曲线将相图分为三个区。左右两端 点分别为组元的熔点。上面的一条曲线称为液相线, 液相线之上为液相的单相区,常用L表示;下面的一 条曲线称为固相线,固相线之下为固溶体的单相区, 常用α表示;两条曲线之间是双相区,标记L+α表示。 L1、a1点分别为平衡的液体和固体的成分。
19
TAC和TBD为两固相线;CF 和DG为固溶体α、β的 溶解度随温度变化线; CED水平线是组成为Q点 的α相,组成为I的β相 和熔融液的三相平衡共 存线。称为共晶线。将 相图分成三个单相区L、 α、β;三个双相区L+ α、L+β、α+β。成 分位于共晶点E以左,C 点以右的合金称为亚共 晶合金;成分位于共晶 点E点以右、D点以左的 合金称为过共晶合金。
2.6 相图及相图化学
1
相:物质所处的特定状态。 不同相之间有明显的界面分开,该界面称为相界 面。在一定的外界条件下,物质的某种状态能量最低, 它就是热力学平衡相。有时,两个或两个以上的相可 以同时共存,把平衡相的界限用图表示出来,这就是 相图。相图通常是以组分、温度和压力为变量绘制的。 相图是研究一个多组分(或单组分)多相体系的平衡 状态随温度、压力、组分浓度等变化而改变的规律。
4
组分:系统中能被单独分离并能独立存在的化学 均匀物质。(盐水溶液:NaCl、H2O组分,Na+、Cl-、 H+、OH-不是组分)。 独立组分数:确定一个平衡体系中的各相成分所 需的最少组分数。 组分数和独立组分数只有在特定的条件下,其 含义才相同。系统中不发生化学反应,则独立组分 数=组分数,系统中如果发生化学反应,独立组元数 =组元数-化学反应数 如:CaCO3加热分解,CaCO3 = CaO + CO2,组分 数=3,独立组分数=2。
二元合金相图2
LL
c α
d β Le
f α α
βⅡ
(β f α g
Ⅱ Ⅱ α β
5
2.5
共析相图与含有稳定化合物的相图(发生共析反应的合金的结晶)
2.5.1
共析相图
图中的下半部为共析相图, 其形状与共晶相图类似,d 点成分(共析成分)的合金从液相经过 匀晶反应生成 γ 相后, 继续冷却到d 点温度(共析温度)时, 在此恒温下发生共析反应:
3
合金Ⅱ的结晶过程
合金的结晶过程如图所示。液态合金冷却到1点温度以下时结晶出 α 相,在
1-2点冷却过程中α 相成分沿ac线变化、L成分沿ad线变化,刚到2点温度时合金由d点成分的液相
L和c点成分的α 相组成,两相在2点温度发生包晶反应,生成β 固溶体。与合金 Ⅰ不同,合金Ⅱ 在包晶反应结束后,仍剩余部分α 固溶体。在随后的冷却过程中,α 相成分沿线变化、β 相成分 沿线变化,α 和β 中将分别析出β
10 合金的铸造性能与相图的关系示意图
2.6.3
相图的局限性
首先,相图只给出平衡状态的情况,而平衡状态只有极端缓慢冷却和加热,或者 在给定温度长时间保温时才能保温时才能满足,而实际生产条件下合金很少能达到平 衡状态。因此用相图分析合金的相和组织时,必须注意合金在非平衡结晶条件下可能 出现的相和组织,以及与相图反映的相和组织状况的差异。 此外相图只能给出合金在平衡条件下存在的相、相的成分和其相对量,并不能反 映相的形状、大小和分布。即不能给出合金的组织形貌。 二元相图只反映二元系合金的相平衡关系,实际使用的金属往往不只限于两个组 元,必须注意其他元素的加入对相图的影响,尤其是其他元素含量较高时,二元合金
)。最后室温
)。其组成相和组织组成物的成分和质量分数可根据杠杆定律来确定。
材料科学基础 第四章 相图(2)

28
第 四
第八节 铸锭组织及其控制
章 1 铸锭组织 相 图 (2)组织控制 受浇铸温度、冷却速度、 受浇铸温度、冷却速度、 第 八 节 铸 锭 组 织 及 其 控 制 化学成分、变质处理、 化学成分、变质处理、 机械振动与搅拌等因素 影响。 影响。
Smith W F. Foundations of Materials Science and Engineering. McGRAW.HILL.3/E
22
第 四
第六节 铁碳合金相图
章
5 含碳量对平衡组织和性能的影响
相 图
(2)对力学性能的影响
第 六
提高, 随C%提高 提高 强度、硬度升高, 强度、硬度升高,
节
塑韧性下降。 塑韧性下降。
铁 碳 相 图
23
第 四
第六节 铁碳合金相图
章
5 含碳量对平衡组织和性能的影响
相 图
(3)对工艺性能的影响
第 六
(1)典型合金(7种)的平衡结晶过程、组织变化、室 典型合金( 的平衡结晶过程、组织变化、 温组织及其相对量计算。 温组织及其相对量计算。
第 五 节 相 图 分 析
2h-10h,由学生分析七种合金 的结晶过程,下次课重点分析。 布置课下列表计算相组成物和 组织组成物的相对含量。
12
第 四
第六节 铁碳合金相图
第 五
铁-渗碳体相图:Fe-Fe3C。 渗碳体相图:Fe(2)相:L, δ, A(γ),
节
F(α), Fe3C(K)。 C(K)。
相 图 分 析
(其定义) 其定义)
7
第 四
第六节 铁碳合金相图
章
2 相图分析
相 14个 点:14个。 图 两条磁性转变线;三条等温转变线;其余三条线: 线:两条磁性转变线;三条等温转变线;其余三条线: GS,ES,PQ。 GS,ES,PQ。 第 个单相区, 个两相区, 个三相区。 区:5个单相区,7个两相区,3个三相区。 五 相图标注:相组成物标注的相图; 组织组成物标注的相图。 相图标注:相组成物标注的相图; 组织组成物标注的相图。 节 相 图 分 析
《无机材料物理化学》(2)

《⽆机材料物理化学》(2)第六章相平衡 P167§6-1 硅酸盐系统相平衡特点⼀、热⼒学平衡态与⾮平衡态(⼀)平衡态的特征与条件1.平衡态的特征2.条件——要达到平衡,在研究中(⼆)硅酸盐系统的特点(三)相图的指导意义⼆、硅酸盐系统中的组分、相及相律1.相律2.⾃由度数(F)3.相(P)4.凝聚系统的相律§6-2 单元系统⼀、⽔型物质与硫型物质(⼀)单元相图回顾(⼆)⽔型物质与硫型物质相图特征⼆、具有多晶转变的单元相图1.相区——4个;2.界线——5条(BF—晶转线)3.点——2个;(B点—晶转点)三、SiO2系统(⼀)相图简介1.各点、线、⾯的含义2.晶型转变点(⼆)SiO2多晶转变特点(三)多晶转变对⽣产的影响1.各种转变产⽣的体积效应2.体积效应对⽣产的影响(四)SiO2相图应⽤意义四、ZrO2系统 P173(⼀)最简单⼆元相图1.相图特征2.各点线⾯的含义3.析晶路程分析4.杠杆规则及应⽤(⼆)⽣成化合物的⼆元相图1.⽣成⼀个⼀致熔化合物的⼆元相图2.⽣成⼀个不⼀致熔化合物的⼆元相图3.⽣成⼀个固态分解化合物的⼆元相图(三)具有多晶转变的⼆元相图(四)⽣成固溶体的⼆元相图1.形成连续固溶体的⼆元相图2.形成有限固溶体的⼆元相图(五)形成⼆液分层的相图1.相图特征: P182图6-17 2.析晶路程: P182⼆、实际⼆元相图举例(⼀)分析⼆元相图的⼀般⽅法(⼆)Al2O3-SiO2相图1.相图特征 P184图6-202.相图应⽤及意义(三)MgO-SiO2相图1.相图介绍 P186图6-212.相图应⽤及意义三、凝聚系统相图测定⽅法 P186§6-4 三元系统 P188⼀、三元相图概述(⼀)组成表⽰法1.浓度三⾓形2.读数⽅法(⼆)浓度三⾓形中组成变化的规则1.等含量规则2.定⽐例规则3.背向性规则(四)重⼼原理1.重⼼位规则2.交叉位规则3.共轭位规则(五)最简单三元系统⽴体图与投影图1.⽴体图 P192图6-302.平⾯投影图3.温度表⽰法4.析晶路程分析 P192图6-30(C)(1)在初晶区内的析晶(2)在界线上的析晶(3)在三元⽆变点上的析晶(4)各相量的计算⼆、三元相图的基本类型(⼀)⽣成⼀个⼀致熔⼆元化合物的三元相图1.相图特征 P194图6-322.相图分析(⼆)⽣成⼀个不⼀致熔⼆元化合物的三元相图1.相图特征2.分析三元相图的⼏个重要规则(1)连线规则(2)切线规则(3)重⼼原理(4)三⾓形规则(5)划分副三⾓形的原则与⽅法3.析晶路程分析4.熔融(加热)过程分析(1)加热过程分析的⽬的(2)分析⽅法(三)⽣成⼀个固态分解的⼆元化合物的三元相图 P200图6-35 1.相图特征2.过渡点(R)的特性(四)⽣成⼀个⼀致熔三元化合物三元相图 P200图6-361.相图特征(五)⽣成⼀个不⼀致熔三元化合物的三元相图1.具有双升点(单转熔点)的类型2.具有双降点(双转熔点)的类型(六)其他类型简介1.具有多晶转变的相图 P202图6-392.形成⼀个⼆元连续固溶体的相图(1)相图特点(2)析晶路程分析⽰例3.具有液相分层的相图 P202图6-41(七)分析三元相图⽅法与步骤归纳1.怎样判读三元相图2.⾛析晶路程的⽅法归纳3.分析熔融路程的⽅法三、三元实际相图举例(⼀)K2O-Al2O3-SiO2相图1.相图介绍2.相图应⽤举例(⼆)MgO- Al2O3-SiO2相图1.相图介绍2.相图应⽤[18]补充条件:结合 P208图6-45中配料点12进⾏分析。
相图的类型名词解释

相图的类型名词解释相图是指用来描述物质在不同温度、压力、组分等条件下的相态行为的图表或图像。
通过相图,可以直观地了解物质在各种环境条件下的相变规律、相互作用和共存情况。
在材料科学、地球科学、化学工程等领域,相图是非常重要的工具,有助于实现材料设计、地质勘探和化工过程的优化等。
相图主要有以下几个常见的类型:1. 二元相图二元相图是描述两个组分物质在不同温度和组分条件下的相态行为。
常见的二元相图有二元平衡相图和二元不平衡相图。
二元平衡相图反映了物质在平衡状态下的相变和相互作用规律,如共晶现象、共熔现象等。
二元不平衡相图则对应于非平衡条件下的相变行为,如快速淬火等。
2. 三元相图三元相图描述了三个组分物质在不同温度和组分条件下的相态行为。
三元相图常用于合金材料的研究和制备。
通过分析三元相图,可以了解合金中各种相的形成、变化和相互作用规律,从而指导材料设计和工艺控制。
三元相图通常比二元相图更加复杂,因为存在更多的组分之间的相互作用。
3. 非平衡相图非平衡相图描述了物质在非平衡条件下的相变行为。
这些条件可能包括快速冷却、快速加热、强烈的外界场等。
非平衡相图可以帮助我们了解物质在非平衡状态下的相变机制和相互作用规律,这对于材料加工、矿物学研究和能源领域的应用具有重要意义。
4. 反常相图反常相图是指在某些特殊条件下,物质的相态行为不符合通常的相图规律。
在反常相图中,可能存在异常的相变行为,如某一相的化学组成、稳定性等随温度的变化呈非线性关系。
反常相图常见于某些特殊组分比例的合金材料或某些非均匀性体系。
总结起来,相图通过图表或图像形式展示了物质在不同条件下的相变行为和相互作用规律。
不同类型的相图适用于不同领域的研究和应用。
正确理解和分析相图可以帮助我们深入了解物质的相态行为,为材料设计、工艺优化和科学研究提供依据。
在未来的研究和应用中,相图将继续扮演重要角色,推动科学技术的发展。
相图基本知识详解

2.3 三元相图有关表示方法和规则 .
2.3.1 三元系浓度三角形 . .
为了表示三元系的组成,常用罗策布浓度三角形表示。
罗策布浓度三角形也是一等边三角形,所根据的定理是:由等边三角形内任意一点, 分别向三条边作平行线,按顺时针方向或逆时针方向读取平行线在各边所截取之三条线段, 三条线段之和等于该等边三角形任一边之长,即为常数。这样,只要把三角形的每一条边 分为 100 等分,每一等分即代表 1%浓度,每个顶点其组元浓度为 100%,即纯组元。
从冷却过程看,相变反应可分为两种基本类型: (1) 分解类型 共晶反应:由液相分解为两个固相。固相可能是纯组元,也可能是固溶体或化合物。 共析反应:由固溶体或固体化合物分解成两个固相的反应。 单晶反应:即由一液相分解成一个固相和另一组成的液相。 (2) 化合类型 包晶反应:即液相与固相化合成为另一固相; 包析反应:由两个固相化合成另一固相。
第二章 相图基础
冶金反应多发生在不同的相组成的复杂体系中,对这种复杂体系的分子与研究需借助 于相平衡、相律和相图的基础知识。
2.1 相律初步 .
一、 相律中的几个基本概念
一个相是指体系中性质和成份均匀一致的一部分物质。体系中具有同一性质,但彼 相 此分开的均匀部分,仍然被认为是相同的相。随温度和成份的变化,一个相可能转化为另 一个相。 组元 任一给定的体系中所包含的一系列不同的元素或稳定的化合物称为组元或组分。可 独立变化而不影响体系其它性质的组元称为独立组元。 自由度 为了完全确定体系所必须的独立变量数称为自由度数。换句话说,所谓自由度数 是指在不改变体系中相的数目的条件下,可在一定范围内独立改变的影响系统状态的内部 和外部因素(如温度、压力、成份等)的数目,即每一给自由度对应一个变量(影响系统 状态的因素) ,且与其它变量无关,在改变其数值时不改变体系中存在的相的数目。
相平衡和相图
30
第六章 相平衡和相图
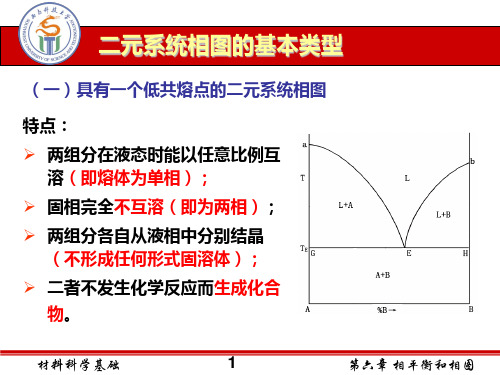
C 例:根据下列相图 (1) 用连线规则划分副三角形。 (2) 用箭头标出界线上温度变化方向及界线性质。 C (3) 判断S、S1、S2化合物的性质。 (4) 写出各无变量点的性质及反应式。 (5)在相图下侧画出A-B二元系统相图。 u v (6) 分析熔体M1、M2的析晶路程。 S (M1在SO连线上)
第六章 相平衡和相图
13
3、背向线规则
在浓度三角形中,一个三元系统的组成点愈靠近某个顶点,
该顶点所代表的组分的含量就愈高;反之,愈少。
C 若熔体在冷却时析出某一
顶点所代表的组元,则液
相中组成点必定沿着该顶 点与熔体组成点的连线向 背离该顶点的方向 A
材料科学基础
D
B
第六章 相平衡和相图
14
4、杠杆规则
C C
b L .2 N
a
e2
K
1
.
B
x B
z y
熔体1
L LB 1[B,(B)] a[B,B+(A)] f=3 f=2
L B+N f=1
L B+A K[x,B+A+(N)] f=1
e1
L+AB+N f=0
K[y(A消失),N+B]
LN+B+C L[z,N+B+(C)] f=0
L(液相消失)[1,N+B+C]
所谓一致熔融化合物是一种稳定 的化合物。它与正常的纯物质一 样具有固定的熔点,融化时,所
产生的液相与固相的化合物组成 相同,故称一致熔融
材料科学基础
2
第六章 相平衡和相图
2、不一致熔融化合物: 一种不稳定的化合物,加热这种 化合物到某一温度便发生分解, 分解产物是一种液相和一种晶相, 二者组成与原来化合物组成完全 不同。 点:纯物质熔点;低共熔点; 转熔点等 线:液相线(3条)固相线等;
物理化学课件二组分体系相图

指一个体系中相的数目。
相平衡的热力学基础
01
02
03
热力学基本定律
热力学第一定律、热力学 第二定律和热力学第三定 律是相平衡研究的理论基 础。
热力学函数
如内能、熵、焓等,用于 描述体系的热力学状态和 性质。
相平衡条件
根据热力学基本定律,当 两个或多个相在某一温度 和压力下达到平衡时,它 们的热力学函数值相等。
高分子聚合反应
聚合机理
高分子聚合反应通常需要在一定的温 度和压力条件下进行,相图可以提供 反应过程中物质的状态和相变信息, 有助于了解聚合机理和反应动力学。
产物性能
聚合产物的性能与反应条件密切相关 ,利用相图可以预测在不同组成和温 度下聚合产物的性能表现,如熔点、 粘度、结晶度等,有助于优化聚合反 应条件和产物性能。
液态部分互溶气态完全不互溶体系
总结词
该体系中,液态组分部分互溶,气态组分完全不互溶,相图较为复杂。
详细描述
在液态部分互溶气态完全不互溶体系中,液态的两个组分只能部分混合,会形成明显的相界,而气态 的两个组分则完全不互溶。这种体系的相图相对复杂,因为液态的部分互溶性和气态的不互溶性使得 体系在相变时可能发生双向变化,即可能出现固相的析出和气相的生成。
相图绘制方法
实验测定
通过实验测定不同温度和 压力下的物理性质(如密 度、蒸气压等),以绘制 相图。
计算相图
基于热力学模型和方程, 通过计算得出各相的热力 学函数值,从而绘制相图 。
计算机模拟
利用计算机模拟技术,模 拟不同温度和压力下的体 系行为,预测相图。
Part
02
二组分体系相图
液态完全互溶气态完全不互溶体系
混合物分离与提纯
2.6 相图和相图化学(2)

(e) 二元系中三相平 衡时,3个相都必须 有确定的成分。图中 液相L的成分散布在 某一个范围,这是错 误的。
(f) 二元系中不可能 有四相平衡,违反 了“相律”。
2.7 固态相变
本节仅了解固态相变的主要类型和基 本特点。
固态相变:固态物质在温度、压力、电场、磁
场改变时,从一种组织结构转变成另一种组织
二元相图总论263中间相或称金属间化合物合金组元间相互作用所形成的一种晶格类型及性能均不同于任一组元的合金由于它们在二元相图上的位置总是位于中间故通常把这些相称为中间相
2.6 相图和相图化学
相律与相图 固溶体及其相图 中间相及其相图 二元相图总论
2.6.3 中间相
或称金属间化合物,合金组元间相互作用所形成 的一种晶格类型及性能均不同于任一组元的合金 固相。 由于它们在二元相图上的位置总是位于中间, 故通常把这些相称为中间相。 具有高熔点、高硬度和较大的脆性,是合金中的 强化相。可提高合金的强度、硬度和耐磨性,但降 低塑、韧性。
中间相的分类
(控制因素不同
p94-p95)
a、正常价化合物(电化学化合物):一些金属 与电负性较强的一些元素按照化学上的原子价规 律所形成的化合物。这类化合物成份固定,服从 原子价规律,电负性因素起主要作用。如: Mg2Si, Mg2Sn, Mg2Pb 等。 正常价化合物的稳定性与组元间电负性差有 关。电负性差愈小,化合物愈不稳定,愈趋于金 属键结合;电负性差愈大,化合物愈稳定,愈趋 于离子键结合。
置换固溶体与间隙固溶体;无限固溶体与有限固溶体; 电子化合物与正常价化合物;
3、画出三种最基本的二元相图类型并进行简单分 析。
液相区 L
TB
相图基本知识简介

第二章 二 元 合 金 相 图纯金属在工业上有一定的应用,通常强度不高,难以满足许多机器零件和工程结构件对力学性能提出的各种要求;尤其是在特殊环境中服役的零件,有许多特殊的性能要求,例如要求耐热、耐蚀、导磁、低膨胀等,纯金属更无法胜任,因此工业生产中广泛应用的金属材料是合金。
合金的组织要比纯金属复杂,为了研究合金组织与性能之间的关系,就必须了解合金中各种组织的形成及变化规律。
合金相图正是研究这些规律的有效工具。
一种金属元素同另一种或几种其它元素,通过熔化或其它方法结合在一起所形成的具有金属特性的物质叫做合金。
其中组成合金的独立的、最基本的单元叫做组元。
组元可以是金属、非金属元素或稳定化合物。
由两个组元组成的合金称为二元合金,例如工程上常用的铁碳合金、铜镍合金、铝铜合金等。
二元以上的合金称多元合金。
合金的强度、硬度、耐磨性等机械性能比纯金属高许多,这正是合金的应用比纯金属广泛得多的原因。
合金相图是用图解的方法表示合金系中合金状态、温度和成分之间的关系。
利用相图可以知道各种成分的合金在不同温度下有哪些相,各相的相对含量、成分以及温度变化时所可能发生的变化。
掌握相图的分析和使用方法,有助于了解合金的组织状态和预测合金的性能,也可按要求来研究新的合金。
在生产中,合金相图可作为制订铸造、锻造、焊接及热处理工艺的重要依据。
本章先介绍二元相图的一般知识,然后结合匀晶、共晶和包晶三种基本相图,讨论合金的凝固过程及得到的组织,使我们对合金的成分、组织与性能之间的关系有较系统的认识。
2.1 合金中的相及相图的建立在金属或合金中,凡化学成分相同、晶体结构相同并有界面与其它部分分开的均匀组成部分叫做相。
液态物质为液相,固态物质为固相。
相与相之间的转变称为相变。
在固态下,物质可以是单相的,也可以是由多相组成的。
由数量、形态、大小和分布方式不同的各种相组成合金的组织。
组织是指用肉眼或显微镜所观察到的材料的微观形貌。
由不同组织构成的材料具有不同的性能。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3 、惯习现象 * 新相沿特定的晶向在母相特定晶面上形成。
母相中惯于析出新相的这种特定晶面称为“惯 习面”。 原因:沿应变能最小的方向和界面能最低的界 面发展。
4 、母相晶体缺陷促进相变 缺陷类型:点、线、面 原因:晶格畸变、自由能高,促进形核及相变。
(e) 二元系中三相平 衡时,3个相都必须 有确定的成分。图中 液相L的成分散布在 某一个范围,这是错 误的。
(f) 二元系中不可能 有四相平衡,违反 了“相律”。
2.7 固态相变
本节仅了解固态相变的主要类型和基 本特点。
固态相变:固态物质在温度、压力、电场、磁
场改变时,从一种组织结构转变成另一种组织
判断下图所示相图中错误之处
(a)匀晶相图中某一 温度下,只能是确定 成分的液相与确定成 分的固相相平衡。不 可能在某一温度下, 有两种不同成分的液 相(或固相)平衡。
(b)纯组元A在某 一温度范围内结 晶,这是违反相 律的。
(c)包晶水平线以 下,α固熔线走势 错误。
(d)γ与α相区间应 有两相区。即相图中 违反了“相接触法 则”。
体。
相图 分析
L L+β β α+β
L+α
α
α:B原子溶入A基体中形成的固溶体 β:A原子溶入B基体中形成的固溶体 固溶线:反映不同温度时的溶解度变化。
E点——共晶点,所对应的温度是共晶温度。
共晶转化:
LE C D
F = C – P + 1 = 2-3+1 = 0
根据相律,三相平衡时有 因此三个平衡相的成分及反应温度都是确定的,共晶 转化在冷却曲线中会出现一个平台。在相图上表示为 一个水平线——三相等温线。
结构。
固态相变中的变化:晶体结构,化学成分,有
序程度 固态相变驱动力:新相与母相的自由能差
一、相Βιβλιοθήκη 的类型1、按照热力学的观点分类,可分为:
(1)一阶相变:相变时两相的化学势相等(µ = µ ), 1 2 但化学势对温度及压力的一阶偏微分(S、V)不等。
S1 S2
V1 V2
故一级相变时, 熵及体积会发生 不连续的变化, 即有相变潜热和 体积的改变。
置换固溶体与间隙固溶体;无限固溶体与有限固溶体; 电子化合物与正常价化合物;
3、画出三种最基本的二元相图类型并进行简单分 析。
位移型相变 :原子仅作微小的位移。不需要断开 和重建化学键,仅发生键角的扭曲和晶格的畸变 。
硅氧四面体的结合方式:(a)α–方石英,(b)α–鳞石英, (c)β–石英
α-方石英和低温型β-石英的不同仅在于Si-O-Si键角的不同。 若要使α–方石英转变为α–鳞石英,必须使α–方石英中的 Β-石英的Si-O-Si键角为2π/3,如果把它拉直,则与α-方石 [SiO4]绕着对称轴相对于另一个四面体旋转一个π的角度, 英的键角相同。不需要断开和重建化学键,仅发生键角的扭 涉及到键的断开和生成,发生重构型相变。 曲和晶格的畸变,属于位移式转变。
二元相图的分析方法
分清组元、单相区、固溶体、中间相,温度和成分区间。 根据相区接触法则,检查所有双相区是否填写完全并正 确无误。 找出所有的水平线,有水平线就意味着存在三相反应, 该水平线同时表明平衡状态下发生该反应的温度。 在各水平线上找出三个特殊点,即水平线的两个端点和 靠近水平线中部的第三个点(共晶点、包晶点等)。确 定中部点上方与下方的相,并分析其反应的类型,平衡 相若在中部点之上,则该反应是该相分解为另外两相; 若平衡相在中部点的下面,则该相是反应生成相。
2.6 相图和相图化学
相律与相图 固溶体及其相图 中间相及其相图 二元相图总论
2.6.3 中间相
或称金属间化合物,合金组元间相互作用所形成 的一种晶格类型及性能均不同于任一组元的合金 固相。 由于它们在二元相图上的位置总是位于中间, 故通常把这些相称为中间相。 具有高熔点、高硬度和较大的脆性,是合金中的 强化相。可提高合金的强度、硬度和耐磨性,但降 低塑、韧性。
a 为等压压缩系数
二级相变时,没有相变潜热和体积改变,只有比热 容、压缩系数、膨胀系数变化。 磁性转变、有序-无序转变、超导转变等属于此类。
2、从动力学的观点(原子迁移),可分为: 重建型相变:原子重新形成点阵,相变前后化学 键的类型或配位数发生变化。 如石墨转变为金刚石,C由原来3配位的六边形平 面层结构,转变为4配位的三维网络 。
E点以左为亚共晶合金,E L 点以右为过共晶合金,E点 III I II 合金为共晶合金
TA TB
L+α
α
C E
L+β
D
β
A
f
α+ β
亚共晶合金 共晶合金 过共晶合金
g
B
实例:Pb-Sn相图
3、二元包晶相图
• 组成包晶相图的两组元,在液态可无限互溶,而 固态只能部分互溶。 • 在二元相图中,包晶转变就是已结晶的固相与剩 余液相反应形成另一固相的恒温转变。L •由于新相β 是包围着初生相α 生长故称包晶转化。 •属于此类相图的合金系有:Pt-Ag, Ag-Sn, Al-Pt, Sn-Sb, Cu-Zn, Cu-Sn 等。
液相区 L
TB
TA
固相区α
A
wB, %
B
有极值的匀晶相图
具有最高点
具有最低点
2、二元共晶相图
共晶转变 :一个液相同时析出两个固相的转变。用 反应式表达为:L=α+β
组成共晶相图的两组元,在液态可无限互溶,
而固态只能部分互溶,甚至完全不溶。
合金的熔点比各纯组元低,液相线从两端纯组
元向中间凹下,两条液相线的交点所对应的温度 称为共晶温度(低共熔温度)。 在共晶温度下,液相通过共晶凝固同时结晶出两 个固相,这样两相的混合物称为共晶组织或共晶
中间相的分类
(控制因素不同
p94-p95)
a、正常价化合物(电化学化合物):一些金属 与电负性较强的一些元素按照化学上的原子价规 律所形成的化合物。这类化合物成份固定,服从 原子价规律,电负性因素起主要作用。如: Mg2Si, Mg2Sn, Mg2Pb 等。 正常价化合物的稳定性与组元间电负性差有 关。电负性差愈小,化合物愈不稳定,愈趋于金 属键结合;电负性差愈大,化合物愈稳定,愈趋 于离子键结合。
5、易出现过渡相
•固态相变阻力大,直接转变困难,出现协调性中间 产物(过渡相)
母相——较不稳定的过渡相——较稳定的过渡相——稳定相 例如LiIO3的 α→γ→β 相变系列里,γ是过渡相。
下次课内容:
2.8 聚合物的结构特征(了解)
作业:
1、解释下列名词:相,相律,合金,固溶体,
中间相
2、指出下列名词的主要区别:
a
LD C E L CED三相等温线
(包晶反应线)
E为包晶点:
液相线
L+α
C
E
D
L+β
b
固相线
α
α +β β
Pt
f
Pt-Ag 合金相图
g
Ag
实例:Pt-Ag相图
二元相图的一些基本规律(p98)
1. 相区接触法则:在二元相图中,相邻相区的相数差为 1,点接触除外。例如,两个单相区之间必有一个双 相区,三相平衡水平线只能与两相区相邻,而不能与 单相区有线接触。 2. 在二元相图中,三相平衡一定是一条水平线,该线一 定与三个单相区有点接触,其中两点在水平线的两端, 另一点在水平线中间某处,三点对应于三个平衡相的 成分。此外,该线一定与三个两相区相邻。 3. 两相区的边界线的延长线应进入连接三相等温线的两 相区内,而不能进入单相区。
(2)二阶相变:相变时两相的化学位相等(µ = µ ), 1 2 化学位的一阶偏微分也相等(S1=S2 ,V1=V2) ,但二 阶偏微分不相等(Cp1≠Cp2,K1≠K2,a1≠a2) 。
已知 ( ) P S T
( )T V P
2 S 1 H CP ( 2 ) P ( ) P ( )P (CP为热容) T T T T T 2 V ( 2 )T ( )T V K (K为等温压缩系数) P P 2 V ( ) ( )P V a TP T
几种最基本的二元相图
匀晶转变和匀晶相图
共晶转变和共晶相图
包晶转变和包晶相图
1、二元匀晶相图
匀晶转变:由液相中直接结晶出单一固溶体的转变,
属于非恒温转变。反应表达式为:L==α。 表示匀晶转变的相图称为匀晶相图 ——形成连续固溶体的相图
一定成分的合金
液相区
液-固两相区
固相区
二元匀晶相图
2条相线: 液相线、固相线 2个单相区: 固相区、液相区 c=2,p=1,f=2 合金在此相区范围内,可独 立改变温度和成分而保持 原状态。 1个两相区: c=2,p=2,f=1 温度和成分中只有一个独 立变量,即在此相区内任意 改变温度,则成分随之而变, 反之亦然。
b、电子化合物 这类化合物的特点是电子密度是决定晶体结构 的主要因素。凡具有相同的电子密度,则相的晶体 结构类型相同。电子密度用化合物中每个原子平均 所占有的价电子数(e/n)来表示。电子化合物虽然 可用化学分子式表示,但不符合化合价规律,而且 实际上其成分是在一定范围内变化。
C、尺寸因素化合物 一些化合物类型与组成元素的原子尺寸差别有关。 如:原子半径较小的非金属元素如C,H,N,B 等可与金属元素(主要是过渡族金属)形成间隙化 合物。
二、固态相变的特点
1、相变阻力大,固态相变困难
