蛋白肽的测定方法
重量法结合氨基酸分析法测定婴幼儿配方乳粉中小分子蛋白肽含量

基金项目:广州市场监督管理局科技项目(编号:2020kj47)作者简介:黄伟乾(1986—),男,广州检验检测认证集团有限公司,中级质量工程师。
E mail:494333067@qq.com收稿日期:2022 04 03 改回日期:2022 10 09犇犗犐:10.13652/犼.狊狆犼狓.1003.5788.2022.80143[文章编号]1003 5788(2023)03 0044 05重量法结合氨基酸分析法测定婴幼儿配方乳粉中小分子蛋白肽含量Determinationofsmallmolecularpeptidesininfantformulamilkpowderbygravimetricmethodcombinedwithaminoacidanalysis黄伟乾犎犝犃犖犌犠犲犻 狇犻犪狀 霍玟希犎犝犗犠犲狀 狓犻 许丽珠犡犝犔犻 狕犺狌 何敏恒犎犈犕犻狀 犺犲狀犵吴俊发犠犝犑狌狀 犳犪 郑学殷犣犎犈犖犌犡狌犲 狔犻狀 罗 浩犔犝犗犎犪狅(广州检验检测认证集团有限公司,广东广州 511447)(犌狌犪狀犵狕犺狅狌犜狉狌狊狋犲犱犜犲狊狋犻狀犵牔犆犲狉狋犻犳犻犮犪狋犻狅狀犆狅.,犔狋犱.,犌狌犪狀犵狕犺狅狌,犌狌犪狀犵犱狅狀犵511447,犆犺犻狀犪)摘要:目的:建立婴幼儿配方乳粉中小分子肽含量的定量分析方法。
方法:分别采用凯氏定氮法、重量法、离子交换色谱等方法测定婴幼儿配方乳粉中总蛋白、高分子蛋白和游离氨基酸含量,通过计算求得小分子蛋白肽含量。
结果:高分子蛋白检测精密度RSD(狀=6)为0.74%;17种氨基酸回收率为91.0%~103.2%,检测结果的相对偏差为0.6%~2.5%;小分子蛋白肽添加回收率为95.2%~98.2%。
结论:所建方法精密度和回收率良好,可用于婴幼儿配方乳粉中小分子肽含量的测定。
关键词:高分子蛋白;小分子蛋白肽;氨基酸;总蛋白;婴幼儿配方乳粉犃犫狊狋狉犪犮狋:犗犫犼犲犮狋犻狏犲:Combinedwiththedeterminationofmacromolecularprotein,aminoacidandtotalprotein,aquantitativeanalysismethodforthecontentofsmallmolecularpeptidesininfantformulamilkpowderwasestablished.犕犲狋犺狅犱狊:Thecontentsoftotalprotein,polymerproteinandfreeaminoacidininfantformulamilkpowderweredeterminedbyKjeldahlnitrogendeterminationmethod,gravimetricmethodandionexchangechromatography,andthenthecontentsofsmallmolecularproteinpeptidewerecalculated.犚犲狊狌犾狋狊:TheprecisionRSDofthemacromolecularproteindetection(狀=6)was0.74%;Therecoveryratesofthe17kindsofaminoacidswere91.0%~103.2%,andtherelativedeviationsofthedetectionresultswere0.6%~2.5%.Therecoveryratesofsmallmolecularweightpeptideswere95.2%~98.2%.犆狅狀犮犾狌狊犻狅狀:Theestablishedmethodhasbeenvalidatedbymethodology,withgoodprecisionandrecoveryrate,andcanbeusedforthedeterminationofsmallmolecularpeptidesininfantformulamilkpowder.犓犲狔狑狅狉犱狊:highmolecularweightprotein;smallmolecularweightpeptide;aminoacid;totalprotein;infantformulamilkpowder乳蛋白是重要的优质蛋白之一,其中婴幼儿配方食品是母乳的主要替代品之一[1]。
胶原蛋白肽实验报告

一、实验目的1. 学习胶原蛋白肽的提取方法;2. 探究胶原蛋白肽的理化性质;3. 分析胶原蛋白肽的生物学活性。
二、实验材料与仪器1. 实验材料:- 牛皮- 酶制剂(胶原蛋白酶)- 盐酸- 乙醚- 乙醇- 水浴锅- 离心机- 超声波清洗器- 恒温干燥箱- 分光光度计- 荧光显微镜2. 实验试剂:- 生理盐水- 1mol/L盐酸- 0.1mol/L氢氧化钠- 0.1mol/L碳酸钠- 1mol/L氯化钠- 0.1mol/L氯化钾- 0.1mol/L钙镁离子溶液三、实验方法1. 胶原蛋白的提取(1)将牛皮剪成小块,用生理盐水清洗后,浸泡于1mol/L盐酸溶液中,于4℃下浸泡过夜;(2)取出牛皮,用流水冲洗至中性;(3)将牛皮放入酶解罐中,加入适量的胶原蛋白酶,于37℃下酶解6小时;(4)酶解完成后,用离心机分离固体沉淀,收集上清液;(5)将上清液用乙醇沉淀,离心收集沉淀;(6)将沉淀用无水乙醇洗涤,干燥,得到胶原蛋白。
2. 胶原蛋白肽的制备(1)将干燥的胶原蛋白加入适量的生理盐水,溶解;(2)用超声波清洗器处理30分钟,使胶原蛋白充分溶解;(3)将溶解后的胶原蛋白溶液用盐酸调pH至4.5;(4)加入适量的乙醚,搅拌,使蛋白质沉淀;(5)离心分离沉淀,收集上清液;(6)将上清液用乙醇沉淀,离心收集沉淀;(7)将沉淀用无水乙醇洗涤,干燥,得到胶原蛋白肽。
3. 胶原蛋白肽的性质研究(1)蛋白质含量测定:采用双缩脲法测定胶原蛋白肽的蛋白质含量;(2)氨基酸组成分析:采用高效液相色谱法测定胶原蛋白肽的氨基酸组成;(3)紫外吸收光谱分析:测定胶原蛋白肽的紫外吸收光谱,分析其结构;(4)分子量测定:采用凝胶渗透色谱法测定胶原蛋白肽的分子量;(5)溶解度测定:测定胶原蛋白肽在不同溶剂中的溶解度;(6)生物学活性测定:采用细胞培养法测定胶原蛋白肽的促细胞增殖活性。
四、实验结果与分析1. 胶原蛋白肽的蛋白质含量:胶原蛋白肽的蛋白质含量为85.6%;2. 氨基酸组成分析:胶原蛋白肽中含有17种氨基酸,其中甘氨酸、丙氨酸、谷氨酸、天冬氨酸等含量较高;3. 紫外吸收光谱分析:胶原蛋白肽的紫外吸收光谱显示其具有典型的蛋白质特征;4. 分子量测定:胶原蛋白肽的分子量分布在500-1000Da之间;5. 溶解度测定:胶原蛋白肽在水中溶解度较高,在乙醇、乙醚中溶解度较低;6. 生物学活性测定:胶原蛋白肽对细胞具有显著的促增殖活性。
食品安全国家标准胶原蛋白肽征求意见稿

百度文库- 让每个人平等地提升自我食品安全国家标准胶原蛋白肽(征求意见稿)xxxx-xx-xx发布xxxx-xx-xx实施食品安全国家标准胶原蛋白肽1 范围本标准适用于以富含胶原蛋白的动物组织为原料,经过提取、适度水解生产的胶原蛋白肽产品。
2 术语和定义胶原蛋白肽以富含胶原蛋白的新鲜动物组织(包括皮、骨、筋、腱、鳞等)为原料,经过提取、水解、精制生产的,相对分子质量低于10000的粉末状或颗粒状的胶原蛋白肽产品。
3 技术要求原料要求原料应符合GB 6783中对原料要求的规定。
感官要求感官要求应符合表1 的规定。
项目要求检验方法色泽白色或淡黄色取2g试样置于洁净的烧杯中,用200mL温开水配置成1%溶液,在自然光下观察色泽和有无沉淀。
闻其气味,用气味、滋味具有产品应有的气味和滋味,无异味温开水漱口,品其滋味粉末状或颗粒状,无结块,无正常视力可见的状态外来异物理化指标理化指标应符合表2的规定。
表2 理化指标污染物限量污染物限量应符合表3的规定项 目限量 检验方法 铅(以Pd 计)/(mg/kg ) GB 镉(以Cd 计)/(mg/kg ) GB 总砷(以As 计)/(mg/kg ) GB 铬(以Cr 计)/(mg/kg ) GB 总汞(以Hg 计)/(mg/kg )GB/ T微生物限量微生物限量应符合表4的规定。
项 目采样方案a 及限量检验方法nc m M 菌落总数/(CFU/g) 5 2 104 105 GB 大肠菌群/(CFU/g)5210102GB a 样品的采样及处理按GB 执行。
食品工业用加工助剂食品工业用加工助剂的使用应符合GB 2760的规定。
项 目指 标检验方法 相对分子质量小于10000的胶原蛋白肽所占比例/(%) ≥ 附录 A 羟脯氨酸(以干基计)/(g/100g) ≥ GB/T 总氮(以干基计)/(g/100g) ≥ GB 灰分/(g/100g) ≤ GB 水分/(g/100g) ≤GB附录A相对分子质量小于10000的胶原蛋白肽所占比例的检测方法(高效体积排阻色谱法)A.1 方法提要采用高效体积排阻色谱法测定。
质谱测肽段

质谱测肽段
质谱测肽段是通过质谱技术对肽段进行分析鉴定的过程。
肽段指多肽或蛋白质经酶消化后得到的较短的肽链。
质谱测肽段的方法主要有两种:
1. 单一来源的肽段:如果其来源的多肽或蛋白质为已知基因序列、cDNA序列或蛋白质序列的,可以采用肽质量指纹图谱PMF对肽段进行分析鉴定。
PMF技术相对于传统方法具有速度快、高通量的优点。
2. 来源不同的肽段混合物:则需要利用串联质谱(MS/MS)对其进行分析鉴定。
MS/MS通过一级质谱测定可以得到肽段的质量,通过二级质谱对肽段进行解离,产生较小的肽段碎片离子,碎片离子经由检测器分析得到肽段的氨基酸序列信息,从而实现肽段的鉴定。
质谱测肽段在蛋白质分离纯化、蛋白质鉴定和遗传学分析等方面具有广泛的应用。
拓展资料
肽段是由氨基酸组成的短链蛋白质,通过质谱技术可以确定肽段的序列和分子量,以及探索其在生物学、药学和医学中的功能和作用。
大豆蛋白肽的测定方法

大豆蛋白肽的测定方法
大豆蛋白肽是一种重要的蛋白质来源,因其具有高营养价值和广泛的应用前景而备受关注。
为了保证大豆蛋白肽的质量和安全性,需要对其进行测定和分析。
目前,常用的大豆蛋白肽测定方法包括光学方法、生物学方法、物化方法和分子生物学方法等。
光学方法主要是指利用紫外-可见光谱法、荧光光谱法、旋光度测定法等技术来测定大豆蛋白肽的含量和质量。
这些方法可以对大豆蛋白肽的结构、组成和活性进行准确的测定和分析,具有灵敏度高、选择性好、操作简便等优点。
生物学方法主要是指利用酶法、生物传感器等技术来测定大豆蛋白肽的含量和活性。
酶法是一种常用的测定方法,其原理是利用特定的酶对大豆蛋白肽进行水解反应,然后测定产生的反应产物的含量来确定大豆蛋白肽的含量。
生物传感器则是一种新兴的测定方法,通过生物分子与电子器件的结合实现对大豆蛋白肽的灵敏检测。
物化方法主要是指利用电泳、色谱等技术对大豆蛋白肽进行分离和纯化,并对其进行定量测定和质量分析。
其中,凝胶电泳和高效液相色谱是常用的方法,可以实现对大豆蛋白肽的分离和纯化,并对其在不同环境下的结构和功能进行研究。
分子生物学方法主要是指利用PCR、实时荧光定量PCR等技术对大豆蛋白肽的基因进行检测和测定。
这些方法可以对大豆蛋白肽的基因序列、表达水平和遗传变异等进行分析,为大豆蛋白肽的生产和应用提供有力的支持。
综上所述,大豆蛋白肽的测定方法多种多样,选择合适的方法可以有效保证大豆蛋白肽的质量和安全性。
大豆蛋白肽的测定方法

大豆蛋白肽的测定方法李小东,陈朝晖,寇裕民,宋金璞,张俊华,薛 蕊(哈尔滨三乐源生物工程集团股份有限公司,哈尔滨 150080)摘 要:本文介绍一种测定大豆蛋白肽(分子量MW ≤2300)的方法,采用单宁进行沉淀区分,通过测定滤液蛋白含量和游离氨基酸的含量,从而得到肽的含量。
滤液经过质谱检测,分子量为MW2300道尔顿以下。
关键词:大豆蛋白肽;游离氨基酸;测定方法 中图分类号:TS 565116212 文献标识码:B 文章编号:1009-2765(2004)01-0025-01 大豆蛋白肽是极具开发潜力的生物活性肽,受到广大科研工作者的重视。
在国外已经广泛应用于乳品、饮料和酒类等食品中,国内从上世纪末也积极开发此类产品。
但是,肽含量的测定一直没有一个统一的标准。
我们经过五年的研究开发和检测应用,总结出一套化学法测定肽含量的比较稳定的方法。
经质谱检测,该肽段分子量≤2300道尔顿。
1 原理大豆蛋白肽是一类有较高生理活性的中小分子量(分子量MW ≤2300)蛋白质。
高分子蛋白质(分子量MW ≥2300)易为单宁在酸性条件下沉淀。
因此,将肽液经酸化后,加单宁使高分子物质沉淀,按G B/T 500915—85测定滤液中蛋白质含量(a ),称为BC 区的蛋白质含量(根据隆丁区分法,采用单宁沉淀可将蛋白质区分为A 区,BC 区),再按G B12143.2—89测定滤液中游离氨基酸的总量(b ),BC 区的蛋白质含量减去氨基酸含量即为BC 区肽含量。
则:THP =a -b (式1)…………………………………THP —三乐源牌大豆蛋白肽,%;a —BC 区蛋白质含量,%;b —游离氨基酸的总量,%。
BC 区蛋白质经质谱分析,分子量均在2300以下。
2 试剂比重1.4硫酸:浓硫酸100m L 加入92g 水中;16%单宁溶液:单宁16g 溶成100m L 水溶液;硫酸铜;硫酸钾;硫酸;2%硼酸溶液;混合指示剂:1份0.1%甲基红乙醇溶液与5份0.1%溴甲酚绿乙醇溶液临用时混用;40%氢氧化钠溶液;0.05N 硫酸标准溶液;0.1m oL/L 氢氧化钠标准溶液:按G B601配制与标定;0.05m oL/L 氢氧化钠标准滴定溶液:用0.1m oL/L 氢氧化钠标准溶液当天稀释;中性甲醛溶液(pH =8.1):量取200m L 甲醛溶液(G B685)于500m L 烧杯中,置于电磁搅拌器上,边搅拌边用0.05m oL/L 氢氧化钠溶液调至pH8.1;30%过氧化氢(HG 3—1082);pH6.8缓冲溶液:按G B604中“缓冲溶液的制备“配制。
肽含量的测定---双缩脲法比色法测定蛋白质浓度

双缩脲法双缩脲法是一个用于鉴定蛋白质的分析方法。
双缩脲试剂是一个碱性的含铜试液,呈蓝色,由1%氢氧化钾、几滴1%硫酸铜和酒石酸钾钠配制。
当底物中含有肽键时(多肽),试液中的铜与多肽配位,配合物呈紫色。
可通过比色法分析浓度,在紫外可见光谱中的波长为540nm。
鉴定反应的灵敏度为5-160mg/ml。
双缩脲反应双缩脲反应产生的紫色络合物颜色的深浅与蛋白质浓度成正比,而与蛋白质分子量及氨基酸成分无关,故可用来测定蛋白质含量。
双缩脲试剂中真正起作用的是硫酸铜,而氢氧化钾仅仅是为了提供碱性环境,因此它可被其他碱,如氢氧化钠所代替。
向试剂中加入碘化钾,可延长试剂的使用寿命。
(一)实验原理双缩脲(NH3CONHCONH3)是两个分子脲经180℃左右加热,放出一个分子氨后得到的产物。
在强碱性溶液中,双缩脲与CuSO4形成紫色络合物,称为双缩脲反应。
凡具有两个酰胺基或两个直接连接的肽键,或能过一个中间碳原子相连的肽键,这类化合物都有双缩脲反应。
紫色络合物颜色的深浅与蛋白质浓度成正比,而与蛋白质分子量及氨基酸成分无关,故可用来测定蛋白质含量。
测定范围为1~10mg蛋白质。
干扰这一测定的物质主要有:硫酸铵、Tris缓冲液和某些氨基酸等。
此法的优点是较快速,不同的蛋白质产生颜色的深浅相近,以及干扰物质少。
主要的缺点是灵敏度差。
因此双缩脲法常用于需要快速,但并不需要十分精确的蛋白质测定。
(二)试剂与器材1. 试剂:(1)标准蛋白质溶液:用标准的结晶牛血清清蛋白(BSA)或标准酪蛋白,配制成10mg/ml的标准蛋白溶液,可用BSA浓度1mg/ml的A280为0.66来校正其纯度。
如有需要,标准蛋白质还可预先用微量凯氏定氮法测定蛋白氮含量,计算出其纯度,再根据其纯度,称量配制成标准蛋白质溶液。
牛血清清蛋白用H2O 或0.9%NaCl配制,酪蛋白用0.05N NaOH配制。
(2)双缩脲试剂:称以1.50克硫酸铜(CuSO4·5H2O)和6.0克酒石酸钾钠(KNaC4H4O6·4H2O),用500毫升水溶解,在搅拌下加入300毫升10% NaOH溶液,用水稀释到1升,贮存于塑料瓶中(或内壁涂以石蜡的瓶中)。
测定蛋白质肽链的N端的方法

测定蛋白质肽链的N端的方法蛋白质是生物体内重要的生物大分子,具有多种功能。
蛋白质的功能与其结构密切相关,而蛋白质的结构往往由其氨基酸序列决定。
因此,了解蛋白质的N端结构对于研究其功能和相互作用非常重要。
测定蛋白质肽链的N端方法有多种,以下将介绍其中几种常用的方法。
1. 衍生化法在测定蛋白质的N端时,常常使用衍生化法。
衍生化法可以通过在氨基酸的N 端引入化学反应活性团,以便于进一步的分析和测定。
其中最常用的方法是使用二酰氯衍生剂,如二甲基氯甲酰基氯化物(DMFCl)或伯胺(TNBS)。
这些试剂能够与肽链的N端反应,形成具有吸收性质的衍生物,以便通过紫外-可见吸收光谱进行定量分析。
此外,还可以通过其他化学反应引入荧光团或质谱标记团,以便于通过荧光或质谱仪器进行测定。
2. 质谱法质谱法已经成为测定蛋白质肽链的N端的重要方法之一。
质谱法包括通过质谱仪器对肽链进行离子化和分析。
最常用的质谱方法是质谱(MS)和液相色谱-质谱(LC-MS)。
质谱法能够通过检测生成的离子谱图来确定蛋白质肽链的氨基酸序列。
其中,氨基酸序列中的N端可以通过质谱仪器的离子源引入质子(H+),从而形成完整的质谱图,并确定N端的位置。
3. 组学方法随着生物学研究的发展,组学方法也被应用于测定蛋白质肽链的N端。
例如,蛋白质组学技术,如质谱图谱计算机分析、肽质光学纤维、基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)和电泳方法,也被用来测量蛋白质肽链的N端。
这些方法能够通过分析蛋白质的结构和功能来研究蛋白质的N端。
以上介绍的是一些常用的蛋白质肽链N端的测定方法,每种方法都有其特定的优势和应用范围。
在实际应用中,可以结合多种方法来获取更加准确的结果。
通过这些方法,我们可以更全面地了解蛋白质的结构和功能,为蛋白质研究提供了重要的工具。
肽分子量分布测定及肽含量检测案例
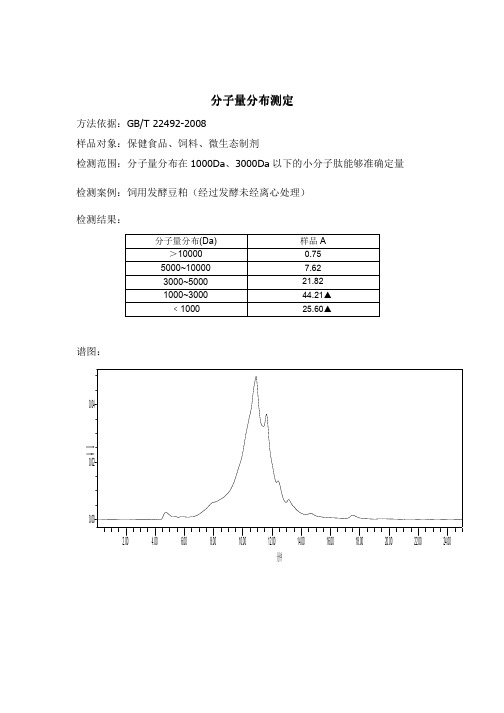
分子量分布测定
方法依据:GB/T 22492-2008
样品对象:保健食品、饲料、微生态制剂
检测范围:分子量分布在1000Da、3000Da以下的小分子肽能够准确定量检测案例:饲用发酵豆粕(经过发酵未经离心处理)
检测结果:
分子量分布(Da) 样品A
>10000 0.75
5000~10000 7.62
3000~5000 21.82
1000~3000 44.21▲
﹤1000 25.60▲
谱图:
肽含量的检测
检测依据:GB/T 22492-2008
样品对象:保健食品、饲料、微生态制剂
检测范围:分子量范围小于10000道尔顿
检测原理:高分子蛋白在酸性条件下给沉淀,小分子蛋白和氨基酸溶解于酸溶液,样品酸化后,滤液中酸溶性蛋白含量减去氨基酸含量即为肽含量。
蛋白水解产物 肽分子量测定

蛋白水解产物肽分子量测定一、引言蛋白质是生物体内的一种重要大分子,具有多种生物学功能。
蛋白质的水解产物包括肽和氨基酸,其中肽具有多种生物活性。
因此,肽分子量的测定对于理解蛋白质的功能和作用机制具有重要意义。
随着生物技术的不断发展,肽分子量的测定方法也在不断改进和完善。
本文将就肽分子量测定的方法及应用进行综述。
二、肽分子量测定的方法1.化学法化学法是最早用于测定肽分子量的方法,包括氨基酸分析仪法和凝胶电泳法。
氨基酸分析仪法是通过将肽链水解为单个氨基酸,然后根据其组成和浓度计算肽分子量。
该方法具有较高的准确度,但操作繁琐,需要较长时间。
凝胶电泳法是将肽混合物在凝胶电泳中分离,根据迁移率和标准分子量进行比较,从而计算出肽分子量。
该方法操作简便,但准确度较低。
2.物理法物理法包括质谱法和核磁共振波谱法。
质谱法是通过将肽分子置于质谱仪中,测量其离子质量和丰度,从而计算出肽分子量。
该方法具有高精度和快速的特点,是当前常用的测定方法之一。
核磁共振波谱法是通过测量肽分子中氢原子核的自旋磁矩,从而推算出分子量。
该方法需要特殊的仪器和复杂的样品处理过程,应用较少。
3.酶法酶法是通过特定的酶将肽链水解为单个氨基酸,然后利用氨基酸分析仪法或质谱法测定肽分子量。
该方法具有高精度和操作简便的特点,但需要特定的酶和仪器设备。
三、肽分子量测定的应用1.蛋白质组学研究蛋白质组学是研究蛋白质表达、功能和调控的学科。
在蛋白质组学研究中,肽分子量的测定对于蛋白质的鉴定和注释具有重要意义。
通过将肽分子量与数据库中的蛋白质序列进行比对,可以确定蛋白质的组成和结构,为进一步研究蛋白质的功能和作用机制提供基础。
2.药物研发药物研发中,肽分子常被用作药物候选物或药物载体。
通过肽分子量的测定,可以了解药物的结构和性质,为药物的设计和优化提供依据。
此外,肽分子量的测定还可以用于药物质量控制和生产过程中的监控,保证药物的安全性和有效性。
3.生物标记物检测生物标记物是指在生物体内表达异常的物质,常用于疾病的诊断和治疗监测。
Q-TOF肽图分析步骤

Q-TOF肽图分析步骤
Q-TOF(Quadrupole-Time of Flight)质谱仪是一种集四极杆和飞行时间质谱(TOF)两种技术于一身的质谱装置。
其结合了四极杆质谱的选择性离子传输和飞
行时间质谱的高分辨率、高精度测量能力,常用于肽的质谱分析,尤其是蛋白质鉴定和蛋白质组学研究中。
Q-TOF质谱对肽段的测定具有高质量精度和高解析度的特点。
图1。
Q-TOF肽图分析的基本步骤大致如下:
1、样品准备:
蛋白质提取:从生物样品中提取蛋白质。
蛋白质消化:使用酶(如胰蛋白酶)将蛋白质消化成肽段。
2、肽段分离:
HPLC:选择合适的色谱柱和梯度条件,通过高效液相色谱(HPLC)来分离混合肽段。
3、质谱分析:
肽段电离:在Q-TOF离子源中,肽段被电离并转化为气态离子。
母离子选择:四极杆选择特定的母离子进入碰撞单元。
碰撞诱导解离:母离子在碰撞单元被加能并解离生成子离子。
飞行时间分析:通过TOF分析器测量子离子的m/z值。
4、数据处理与分析:
肽段鉴定:通过配对肽段的碎片离子谱和预测的或数据库中的谱来鉴定肽段序列。
蛋白质鉴定:通过关联鉴定到的肽段来鉴定对应的蛋白质。
定量分析:如果进行定量实验,需要比较不同样本或条件下肽段的丰度变化。
生物信息学分析:深入挖掘蛋白质和修饰的生物学含义。
5、结果验证:
(1)核对鉴定出的蛋白质是否与实验背景和目的相符。
(2)对重要的蛋白质或肽段进行进一步的验证实验,如再次进行质谱分析或其他生物化学实验。
胶原蛋白肽 分子量

胶原蛋白肽分子量摘要:1.胶原蛋白肽的概念与作用2.胶原蛋白肽与分子量的关系3.胶原蛋白肽分子量的测定方法4.不同分子量胶原蛋白肽的应用领域5.选择合适分子量胶原蛋白肽的注意事项正文:胶原蛋白肽是胶原蛋白经过酶解或酸碱处理后,形成的具有生物活性的小分子多肽。
它在人体内有多种重要作用,如促进皮肤弹性、维持关节健康、促进骨骼生长等。
胶原蛋白肽的分子量分布广泛,不同分子量的胶原蛋白肽具有不同的生理活性和应用领域。
胶原蛋白肽的分子量与它的生物活性密切相关。
一般来说,分子量在1000道尔顿以下的胶原蛋白肽具有较好的溶解性和生物利用度,更易被人体吸收。
分子量在1000-5000道尔顿的胶原蛋白肽具有较强的抗氧化、抗炎、抗肿瘤等活性。
而分子量大于5000道尔顿的胶原蛋白肽,其生物活性相对较低,但具有较强的修复和补充作用。
测定胶原蛋白肽的分子量有多种方法,如高效液相色谱法、激光光散射法、凝胶过滤法等。
这些方法可以帮助研究人员和生产厂家精确地了解产品的分子量分布,从而优化生产工艺和产品性能。
在实际应用中,不同分子量的胶原蛋白肽有着不同的作用领域。
例如,用于美容护肤产品时,分子量在1000道尔顿以下的胶原蛋白肽更容易渗透皮肤,提高皮肤弹性;而在骨关节疾病治疗中,分子量大于5000道尔顿的胶原蛋白肽更具修复和补充作用。
在面对市面上众多胶原蛋白肽产品时,如何选择合适的分子量成为消费者关心的问题。
以下几点注意事项可供参考:1.了解自己的需求:根据自己的身体状况和需求,选择具有相应功能的胶原蛋白肽产品。
2.关注产品分子量:购买时注意产品的分子量分布,确保其符合自身需求。
3.产品质量:选择正规厂家生产的产品,并查看产品的生产日期、保质期等信息。
4.价格合理性:了解市场价格,对比同类产品,避免盲目追求低价。
5.口碑评价:查阅网络评价和用户反馈,了解产品的实际效果。
总之,胶原蛋白肽作为一种具有广泛生物活性的小分子多肽,其分子量对其生理活性和应用领域具有重要影响。
胶原蛋白肽含量检测方法

胶原蛋白肽含量检测方法胶原蛋白是人体中最为丰富的一种蛋白质,它存在于皮肤、骨骼、韧带、肌肉、血管等许多组织中,具有保湿、抗氧化、增强皮肤弹性等多种功效。
随着年龄的增长,人体内胶原蛋白含量逐渐下降,因此,许多人开始关注胶原蛋白的补充。
而胶原蛋白肽作为一种较为常见的补充方式,其含量的检测也变得愈加重要。
胶原蛋白肽含量检测方法有多种,下面将介绍其中的几种常用方法。
一、高效液相色谱法(HPLC)高效液相色谱法是目前最为常用的胶原蛋白肽含量检测方法之一。
其原理是通过将胶原蛋白肽溶液经过一定的处理后,利用高效液相色谱仪对其进行分析,从而得出胶原蛋白肽的含量。
这种方法具有分离效果好、准确度高、灵敏度高等优点,但需要专业的仪器和操作技能。
二、紫外光谱法紫外光谱法也是一种常用的胶原蛋白肽含量检测方法。
其原理是利用胶原蛋白肽在紫外线下的吸收特性,通过测量吸收光谱来确定其含量。
这种方法操作简单、灵敏度高,但对样品的纯度要求较高。
三、酶联免疫吸附法(ELISA)酶联免疫吸附法是一种利用抗体与抗原结合的原理进行检测的方法。
其原理是将胶原蛋白肽与特异性抗体结合,再用酶标记的二抗或底物来检测胶原蛋白肽的含量。
这种方法具有高度的特异性和准确性,但需要较长的检测时间和专业的实验条件。
四、质谱法质谱法是一种高级的胶原蛋白肽含量检测方法,其原理是通过将样品分离成质量/电荷比相同的分子离子,再通过检测分子离子的相对丰度来确定胶原蛋白肽的含量。
这种方法具有高度的分辨率和准确性,但需要专业的仪器和操作技能。
总的来说,不同的胶原蛋白肽含量检测方法各有优缺点,选择合适的方法需要根据实际情况和需求来决定。
此外,为了确保检测结果的准确性,还需要注意样品的保存和处理方式,避免样品的变性和污染。
胶原蛋白肽含量的检测在胶原蛋白补充领域中具有重要的意义,其准确性和可靠性直接影响到补充效果的评估和判断。
因此,需要选择合适的检测方法,并在操作过程中严格遵守相关规范和操作流程,以确保检测结果的准确性和可靠性。
蛋白质肽谱图测定

蛋白质肽谱图测定MALDI-TOF 分析肽混合物时,能耐受适量的缓冲剂、盐,而且各个肽片段几乎都只产生单电荷离子,因此MALDI-TOF MS成为理想的质量肽谱图分析工具。
当您需要对蛋白质(多肽)样品的理论序列通过MALDI TOF进行确证。
首先我们会对拿到的样品通过进行酶切,再通过MALDI MS进行肽指纹图谱的确证,再通过MS/MS 对峰图进行验证,然后通过与您提供的理论序列进行比对得到肽覆盖图谱。
百泰派克公司应用现有的质谱技术平台,开发出以MALDI TOF MS为基础的的质量肽谱图分析。
肽谱图分析MALDI TOF 用于质量肽谱分析的优缺点:优点:是蛋白质鉴定的经典方法,算法简单,速度快,在串联质谱鉴定出现之前应用广泛。
缺点: 质量相近的多肽增加匹配难度,并且无法实现混合蛋白的鉴定,不太适合数据库不完整的物种的蛋白质鉴定,不能分析到翻译后修饰位点,不易与液相色谱连接。
中/英文项目报告在技术报告中,百泰派克会为您提供详细的中英文双语版技术报告,报告包括:1. 实验步骤(中英文)2. 相关的质谱参数(中英文)3. 质谱图片4. 原始数据5. 肽谱图信息MALDI-TOF 蛋白质肽谱图测定一站式服务您只需下单-寄送样品百泰派克一站式服务完成:样品处理-上机分析-数据分析-项目报告How to order?关于百泰派克北京百泰派克生物科技有限公司(Beijing Bio-Tech Pack Technology Company Ltd. 简称BTP)成立于2015年,是国家级高新技术企业,业务范围主要围绕蛋白和小分子代谢物检测两大板块,从事蛋白质和小分子代谢物的理化性质分析及结构解析等相关技术服务,为客户提供高性价比、高效率的技术服务。
深耕蛋白鉴定、定量蛋白组(iTRAQ/TMT、label free、DIA/SWATCH)、PRM靶蛋白定量、蛋白和抗体测序、蛋白修饰(二硫键、糖基化、磷酸化、乙酰化、泛素化等)、靶向和非靶向代谢物检测。
肽段定量试剂盒原理

肽段定量试剂盒原理
肽段定量试剂盒原理是一种用于测定蛋白质样本中特定肽段含量的分
析方法。
该方法基于酶联免疫吸附试验(ELISA)技术,包括三个主要步骤:样品制备、捕获和检测。
首先,需要将蛋白质样本水解为肽段。
这可以通过使用胰蛋白酶或其
他酶来实现。
肽段的产生使其能够更轻松地在样品中进行测定。
然后,需要使用捕获抗体将肽段从样品中固定在试剂盒板上。
接下来,使用检测抗体对捕获的肽段进行检测。
检测抗体标记有酶,
例如辣根过氧化物酶(HRP),这使得检测到的肽段可以与底物反应
并发出颜色信号。
使用带有底物的反应液溶液加入到试剂盒板中。
当
该溶液与标记有酶的检测抗体结合后,氧化底物产生颜色,颜色的强
度与肽段的量成正比。
通过比较标准曲线中已知肽段浓度和样品中检
测到的颜色强度之间的比较可以得出肽段的含量。
此外,肽段定量试剂盒通常使用多孔板或磁性微珠作为试剂盒平台,
以便将肽段捕获和检测整个过程自动化。
总之,肽段定量试剂盒原理是一种使用捕获和检测抗体测定肽段浓度
的方法。
该方法在许多应用程序中都得到了广泛的应用,包括蛋白质组学和药物研发等领域。
多肽蛋白质QE鉴定

百泰派克生物科技
多肽蛋白质QE鉴定
QE即Q Exactive,是美国赛默飞公司生产的一种具有快速扫描和多重检测能力的
质谱仪。
多肽蛋白质QE鉴定就是利用高分辨率QE质谱仪对多肽和蛋白质进行鉴定。
质谱分析法作为当前蛋白质组学研究以及生物大分子研究领域中强有力的分析技术,可以实现高通量的、高分辨率的、高要求的以及复杂的蛋白质以及多肽样品鉴定,包括定性定量分析、分子质量分析、氨基酸组成分析、一级结构鉴定以及翻译后修饰情况鉴定等。
质谱技术实现以上多种鉴定都是以其可以鉴定分子质量为基础而实现的,比如对于翻译后修饰的蛋白质/多肽来说,其发生修饰的氨基酸残基的分子
质量会增加相应修饰基团的分子量值,而质谱能检测到这种分子质量变化,因而可以用于验证或鉴定蛋白质或多肽是否含有翻译后修饰以及发生了何种修饰。
百泰派克生物科技采用Thermo Fisher的Q ExactiveHF质谱平台,结合Nano-LC
纳升色谱,提供高效精准的多肽蛋白质QE鉴定服务技术包裹,可对各种多肽和蛋
白质样品如蛋白质/多肽提取物、SDS-PAGE蛋白条带、2D蛋白胶点、pull-down及Co-IP等样品中的蛋白质进行鉴定,包括分子量、含量、序列以及翻译后修饰等,
欢迎免费咨询。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
式中:
X—样品中可溶性蛋白质含量,% ;
V1—样品消耗硫酸或盐酸标准溶液体积,ml ;
V2—试剂空白消耗硫酸或盐酸标准溶液体积,ml ;
N—硫酸或盐酸标准溶液当量浓度 ;
0.014—1N硫酸或盐酸标准溶液1ml相当于氮克数 ;
6.25—氮换算为蛋白质的系数。
大豆肽检测办法
1 2007-11-30 11:47:38
对营养性小肽或寡肽产品:
可以通过检测其氮溶解指数来初步判定小肽或寡肽含量。
NSI(%)=(N1/N0)*100
N0=总氮
N1=可溶性氮(用三氯乙酸――可溶性氮测定法)
三氯乙酸(TCA)是一种蛋白质沉淀剂,它可以沉淀蛋白质和较长的肽段。可以被三氯乙酸沉淀的肽段所含的最少氨基酸残基数与底物的种类有关,就特定的底物而言,三氯乙酸氮溶解指数可以定性反映蛋白质的分解情况,溶解指数越高,表明较短肽段含量越高。
蛋白肽的测定方法
1、原理
测定样品经三氯醋酸处理后上清液中蛋白质含量,既为样品中大豆蛋白肽的含量,也就是可溶性蛋白质(TCA)的含量。
2、试剂
所用试剂均用不含氨的蒸馏水配制。
2.1 10%三氯醋酸
其它试剂与《食品中蛋白质的测定方法》中2.1—2.6相同
3、仪器
定氮蒸馏装置
4、操作方法
三氯乙酸氮溶指数(TCA-NSI)测定方法:
将20ml 10% 三氯乙酸(TCA)溶液添加到20ml待测混合液(混合液浓度为10%),混合液震荡,静置10分钟,在4000转/分下离心20分钟,取上清液用凯氏氮法测定总氮
4.1.2样品:(如发酵液)经离心机1万转离5分钟吸取上清液10ml注入比色管中再加10ml 10%三氯醋酸,静止沉降30分钟后,过滤(或用离心机1万转离5分钟)取滤液(或上清液)5ml注入干燥凯氏瓶中,加2g催化剂及25ml混合酸进行消化。
4.2 蒸馏方法与蛋白质的测定方法相同。
4.3 计算
4.1样品处理
4.1.1固体样品:精密称取2g左右固体样品用小烧杯溶解,并用玻璃棒搅拌,定容至100ml容量瓶中,取10ml注入比色管中,再加作入10ml 10%三氯醋酸,静止沉降30分钟后,过滤(或用离心机1万转离5分钟)取滤液(或上清液)5ml注入干燥的凯氏瓶中,加入2g催化剂及25ml混合酸,消化方法同蛋白质的测定方法相同
