螯合物和螯合剂的概念
螯合物的定义

螯合物的定义螯合物是一种具有一定稳定性的化合物,能将可溶或不可溶性金属离子、络合阴离子、络合阳离子等包括在分子内部而形成复杂的分子螯合体。
螯合物是目前发展最快、应用范围较广泛的络合剂之一,它被誉为“绿色”、“天然”、“安全”的稀土元素络合剂,在国防、航空航天、医疗卫生等领域均得到了极其重要的应用。
因此对其进行研究就显得尤为必要了。
在众多对镧系元素络合物的研究中,螯合剂的应用占据了相当大的比例。
因此螯合剂在镧系金属络合物的研究与开发上扮演着举足轻重的角色。
随着螯合理论研究和应用水平的不断提高,我们发现镧系元素络合物在络合物结构、电子结构、配位数及电荷数量等方面存在着较大差异,从而导致了镧系元素络合物的多样性,这也给研究者带来了新的挑战。
对于镧系元素络合物,已经做过许多研究工作。
然而由于对镧系元素的认识还只停留在实验阶段,故而没有任何关于镧系元素络合物的计算机模拟程序。
近年来有些学者运用各种数值计算软件进行了镧系元素络合物的数值计算。
这些研究使得大家认识到科学技术飞速发展所带来的巨大影响力,但是它们都是通过经验公式建立起来的,缺乏对实际计算结果的检验,同时又难免会受到实验条件的限制。
螯合剂的出现使得镧系金属络合物的结构和性质逐渐清晰明朗起来,并且随着镧系金属络合物的分析测试手段的不断完善和精密,研究者能够直接获取实验数据进行分析,从而为相关研究打开一扇大门。
近年来研究者在镧系元素络合物的研究上取得了许多突破,如控制加热温度可以增强络合反应的速率;控制反应时间则可以减小络合物中间态浓度;而控制螯合剂的摩尔组成和螯合物中所含阴离子则可以调整络合物的分解温度等。
在最近的研究中人们意外地发现铕- EDTA 络合物的稳定性超越了大多数 EDTA 络合物,不仅能长期稳定存在,而且在其后可以再次与镧系元素发生络合反应。
而且还发现在与钙、镁、铝三种镧系元素络合物的实验研究中,发现与钙络合物的稳定性更好。
此外,镧系金属络合物在液体中的保存期限也比传统的络合剂长。
螯合剂知识

在水中很稳定不易解离。但由于乙二胺四乙酸价格昂贵, 目前只用在不停车清洗等特殊蝴垢清洗中而且常用在水中溶解度较其大的二钠盐或四钠盐。二钠盐水溶液的pH值为4.4,四钠盐水溶液pH值为10.8。应当注意在碱性条件下有些金属离子会形成氢氧化物沉淀从-豕期析出而不被螯合,例如Fe3+在pH>8的水溶液中会形成Fe(OH)3沉淀而不能用EDTA去赣合Fe3+。所以尽管氨基酸的螯合能力受pH值影响,在pH值较高的范围内整合能力较蛾猫如果金属离子在:pH值较高条件下生成氢氧化物则不能被螯合,在实用中要注意。
2. 通过加入食物中餐服,NTA三钠单水合盐可诱导雄性兔子造血肿瘤,雌性兔子泌尿系统良性和恶性肿瘤。当加入饮水中,可诱导雄性兔子肾腺癌。
3. 腹腔注射导致雌雄性小鼠和雄性兔子肾腺癌。
4. 通过口服,NTA三钠盐对亚硝胺诱导尿道腺癌有促进作用。
5. 氮基三乙酸(NTA)及其三钠盐只有在高剂量下才致畸,致诱变作用。
(2)羟基羧酸类 用作螯合剂的这类羧酸主要是柠檬酸(CA)、酒石酸(TA)和葡萄耀I酸(GA)。由于这些螯合剂在酸性条件下整合性能较弱,在洗涤剂配方中通常采用它们的澜作助洗剂。其中葡萄糖酸钠是一种良好的全能螯合剂,对多种金属离子都有很好的螯合能捌而酒石酸钠、柠檬酸钠也能螯合大多数二价和三价金属离子。
由于柠檬酸螯合剂适用pH值范围比其他几种羟基羧酸广,使它成为工业生产中使用裁多的羟基羧酸整合剂。
(3)羟氨基羧酸类 这类酸用作螯合剂的典型代表是羟乙基乙二胺三乙酸(HEDTA)秘二羟乙基甘氨酸(DEG)。
它们在pH=9的弱碱性条件下可螯合铁离子,但对其他离子螯合能力较差,如二羟乙攀甘氨酸不能用螯合钙、镁离子,所以一般可用它们去除铁锈垢而不用它们去除碳酸钙等水垢羧酸类螯合剂大多有易于生物降解不污染环境,无毒害作用的优点。
螯合物知识点

螯合物知识点螯合物是指含有一个或多个配位基与中心金属离子形成稳定配位键的化合物。
螯合物在化学、环境科学和生物学等领域中具有重要应用。
本文将从基础概念、螯合物的形成与性质、应用以及未来发展等方面介绍螯合物的知识点。
1. 基础概念螯合物的概念最早由法国化学家阿尔弗雷德·文伯(Werner)于19世纪末提出。
螯合物由一个或多个配位基(通常是有机物分子或离子)与中心金属离子形成稳定的配位键,形成一个整体稳定的结构。
2. 螯合物的形成与性质螯合物的形成是通过配位键的形成而实现的。
配位基通常通过提供自由电子对与金属离子形成配位键。
螯合物具有以下几个特点:•稳定性:螯合物能够通过配位键的形成增加化合物的稳定性,使其在不同条件下保持稳定结构。
•水溶性:由于螯合物通常具有较大的极性,因此在水溶液中具有良好的溶解性。
•选择性:螯合物的形成可以导致与金属离子的高度选择性结合,从而实现对特定金属离子的识别和分离。
3. 螯合物的应用螯合物在许多领域中具有广泛的应用。
以下是几个重要的应用领域:3.1 化学分析螯合物可以用于分析化学中的金属离子的检测与定量。
通过选择合适的螯合剂,可以实现对特定金属离子的高度选择性识别和分离,从而实现对复杂样品中金属离子的分析。
3.2 医药领域螯合物在医药领域中有广泛应用。
例如,铁离子螯合物可以用作治疗贫血的药物,钙离子螯合物可以用于治疗骨质疏松症等。
3.3 环境科学螯合物在环境科学领域中也具有重要应用。
例如,螯合物可以用于处理废水中的金属离子,使其形成不溶性沉淀物,从而实现对金属离子的去除和废水的净化。
4. 螯合物的未来发展螯合物的研究和应用仍在不断发展。
随着对环境污染和资源稀缺的关注加大,对绿色和可持续发展的需求增加,螯合物的设计和合成也向着更高效、可再生和环境友好的方向发展。
总之,螯合物作为一种特殊的化合物,在化学、环境科学和生物学等领域中具有广泛的应用。
通过了解螯合物的基础概念、形成与性质、应用和未来发展,我们可以更好地理解和应用螯合物,为解决相关问题提供有效的解决方案。
螯合剂种类总结及其在不同pH下的对金属离子的螯合能力比较

螯合剂的种类及其在不同pH值条件下螯合剂的螯合常数一、螯合剂与螯合物具有可供配位孤电子对的分子、原子或离子的化合物能够与具有空轨道的金属离子形成配位键,该化合物称为络合物,如能与配位金属离子形成环状结构的化合物称为螯合剂,形成的络合物称为螯合物。
螯合剂中至少含有一对孤电子对,而金属离子必须有空的价电子轨道,孤电子对填充入金属离子空轨道,电子对属2个原子共享,形成配位键,中心金属离子空轨道杂化。
不同的提供孤电子对的配位体分别与不同金属离子形成正四面体、正六面体、正八面体的螯合物。
1.类型1.1无机类螯合剂聚磷酸盐螯合剂:主要是三聚磷酸钠(STPP)、六偏磷酸钠、焦磷酸钠为主,含磷酸基空间配位基团。
特点:高温下会发生水解而分解,使螯合能力减弱或丧失。
而且其螯合能力受pH值影响较大,一般只适合在碱性条件下作螯合剂。
1.2有机类螯合剂形态分析表明螯合剂提取的重金属主要来源于可交换态或酸溶态、还原态和氧化态。
1.21羧酸型(1)氨基羧酸类:含羧基和胺(氨基)配位基团,如乙二胺四乙酸(EDTA),氨基三乙酸(又称次氮基三乙酸NTA),二亚乙基三胺五乙酸(DTPA)及其盐等。
如:EDTA的4个酸和2个胺(—NRR′)的部分都可作为配体的齿,两个氮原子和四个氧原子可提供形成配位键的电子对。
特点:络合能力强,络合稳定常数大,耐碱性好,但分散力弱且不易被生物降解。
(2)羟基羧酸类含羟基、羧基配位基团这类羧酸主要是柠檬酸(CA)、酒石酸(TA)和葡萄糖酸(GA)。
特点:可生物降解,在酸性条件下羟基与羧基不会离解为氧负离子,因而络合能力很弱,不适宜在酸性介质中应用。
(3)羟氨基羧酸类这类酸用作螯合剂的典型代表是羟乙基乙二胺三乙酸(HEDTA)和二羟乙基甘氨酸(DEG)。
特点:大多易于生物降解,在pH=9的弱碱性条件下可螯合铁离子,但对其他离子螯合能力较差。
1.22有机多元膦酸羟基亚乙基-1,1-二膦酸(HEDP)、氨基三亚甲基膦酸(A TMP)、二乙烯三胺五亚甲基膦酸(HTPMP)、三乙烯四胺六亚甲(TETHMP)、双(1,6-亚己基)三胺五亚甲基膦酸(BNHMTPMP)、多氨基多醚基四亚甲基膦酸(PAPEMP)。
螯合剂知识

螯合剂知识一、螯合剂的概念由一个简单正离子(称为中心离子)和几个中性分子或离子(称为配位体)结合而成的复杂离子叫配离子(又称络离子),含有配离子的化合物叫配位化合物。
在配合物中中心离子与配位体通过配位键结合。
配位键是一种特殊的共价键,通常的共价键是由两个成键·原子绷出一个电子形成共同电子对的,而在配位键中是由一个原子提供电子对,另一原手提供攀删道形成的。
为了区别把共价键用“一”表示,如H·+·H =H:H(H—H),配位键奶删“←”表示,箭头指向提供空轨道的原子,如Cu+NH3=CuNH3(Cu←NH3)。
如果配位体中只有一个配位原子,则中心离子与配位体之间只能形成一个配位键。
而有些配位体分瑚中含有两个以上的配位原子而且这两个原子间相隔着两至三个其他非配位原子时,:这个硼体就可以与中心离子(或原子)同时形成两个以上的配位键,并形成一个包括两个配位剿五元或六元环的特殊结构,把这种配合物称为螯合物。
螯合物比一般配合物更稳定。
把能形成螯合物的配位体叫整合剂。
螯合剂包括无机和有机两类。
它们在清洗过程中蕉着重要用途。
二、无机金属离子螯合剂聚磷酸盐螯合剂的缺点是它们在高温下会发生水解而分解,使螯合能力减弱或丧失。
而且其螯合能力受pH值影响较大,兰般只适合在碱性条件下作螯合剂。
一般说来这些无机螯合剂对重金属离子特别是铁离子的螯合能力较差。
由于以上缺点,使无机螯合剂的用途受到限制,通常只用于对钙、镁离子螯合,所以常作为硬水软化剂。
三、有机金属离子螯合剂能与重金属离子起螯合作用的有机化合物很多,如羧酸型、有机多元膦酸等。
1.羧酸型在清洗剂中使用的羧酸型螯合剂主要有氨基羧酸类和羟基羧酸类等。
(1)氨基羧酸类氨基羧酸用作螯合剂的有乙二胺四乙酸(EDTA),氨基三乙酸(又称次氮基三乙酸NTA),二亚乙基三胺五乙酸及其盐等。
它们对钙、镁离子均有较强的螯合作用。
从单位质量的三种酸螯合钙离子的数量看,以NTA螯合最多,ZDTA其次,DTPA再次。
金属螯合物

金属螯合物金属螯合物是指由金属离子与螯合剂形成的化合物。
螯合剂也叫螯合因子,是一种能够与金属离子结合形成化合物的物质。
而金属螯合物则是由金属离子与螯合剂形成的化合物。
金属螯合物是一种常见的配体,它们在生物有机体内广泛存在,是许多生物功能的关键所在。
例如,蛋白质的结构和活性都受到金属离子的调控,同时,金属离子还可以促进药物的吸收和分布。
因此,金属螯合物的研究对于理解和控制生物过程具有重要意义。
金属螯合物的结构一般分为水溶性和非水溶性两大类。
水溶性金属螯合物通常是配位数为2-6的单核金属离子与螯合剂之间的化合物,例如,氯化铵、氯化钡和氯化钠等。
非水溶性金属螯合物通常是多核金属离子与螯合剂之间的化合物,例如,氢氧化钙、氢氧化镁和氢氧化锰等。
金属螯合物的特性主要取决于其结构、组成和性质,不同的金属螯合物具有不同的活性。
例如,有的金属螯合物具有腐蚀性,可以损害某些物质的表面,例如金属表面;有的金属螯合物具有抑制作用,可以抑制某些物质的反应,例如抑制氧气在溶液中的氧化作用;有的金属螯合物具有抑菌作用,可以杀灭微生物;有的金属螯合物具有抗氧化作用,可以抵抗氧化剂,例如抵抗自由基的氧化作用;有的金属螯合物具有缓冲作用,可以稳定pH值,例如稳定pH值的变化;有的金属螯合物具有载荷作用,可以吸附有机物,例如有机污染物;有的金属螯合物具有调节作用,可以控制反应速率,例如控制酶反应的速率等。
金属螯合物主要用于工业,它们可以用于各种化学反应,例如水解、氧化、缩合、加氢、烷基化等;金属螯合物还可以用于生物医药,用于制备药物、诊断试剂、抗生素和细胞因子等;金属螯合物还可以用于环境保护,用于净化水源、去除有害物质和污染物等。
总之,金属螯合物是一种常见的配体,它们的研究对于理解和控制生物过程具有重要意义,并且它们在工业、生物医药和环境保护方面都有着广泛的应用。
EDTA与螯合剂 ppt课件
ppt课件
10
溶液中螯合物的稳定性除决定于螯 合物稳定常数的大小外,还与溶液 的pH值有关。不同的金属离子与 EDTA生成的螯合物的稳定性不同, 滴定时所需溶液的pH值也不同。因 此,在两种以上金属离子的混合溶 液中,常可以通过调节溶液的pH值, 用EDTA进行选择滴定。
ppt课件
11
例如,在Mg2+离子和Zn2+离子的混合
测定水的总硬度时加NH3-NH4Cl缓 冲溶液调节pH ≈ 10,以铬黑T为指 示剂,用EDTA标准溶液滴定。溶液 中有关配合物的稳定性有如下顺序:
CaY2- > MgY2- >MgIn - > CaIn-
ppt课件
20
反应式如下:
加指示剂时:
Mg2+ + HIn2- ⇌ MgIn - + H+
蓝 紫红
ppt课件
18
可加入某种掩蔽剂(此试剂能与干 扰离子结合成更稳定的配合物,而 对被测离子无影响),把干扰离子 掩蔽起来,再滴定被测离子。例如 EDTA滴定Ca2+ Mg2+时,少量Fe3+, Al3+有干扰,可加入三乙醇胺消除 干扰。
ppt课件
19
(三)EDTA螯合滴定
示例-水的总硬度测定
水的总硬度是指水中Ca2 + , Mg2+ 的总硬度(以为mmol ·L-1单位)
12
(二)EDTA螯合滴定的基本原理
EDTA螯合滴定就是基于EDTA与
金属离子螯合反应的一种重要的滴定分 析方法,常用于测定溶液中金属离子的 含量。
EDTA螯合滴定的原理和基本过程:
滴定时使用的指示剂叫做金属指示剂。 它们是一类能与金属离子形成有色配合 物的水溶性有机染料。
(一)螯合物和螯合剂的概念PPT课件
-
6
CaY2-的结构
-
7
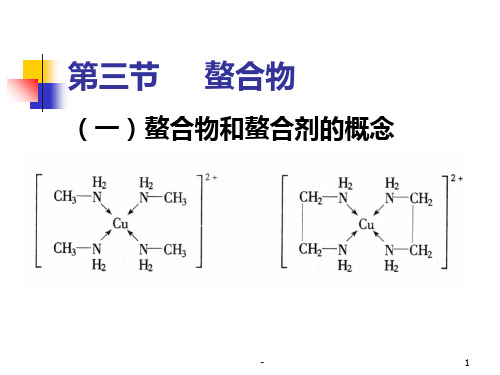
EDTA与金属离子的配合有以下特点:
1.螯合能力强 除碱金属以外,能与 几乎所有的金属离子形成稳定的螯 合物。
2.与金属离子形成的螯合物大多带 有电荷,因此易溶于水。
-
8
3.简单的螯合比 不论几价的金属离子, 它们与EDTA总是1:1螯合。例如:
M2++H2Y2--MY2 - +2H + M3++H2Y2--MY - +2H + M4++H2Y2--MY +2H +
-
12
(二)EDTA螯合滴定的基本原理
EDTA螯合滴定就是基于EDTA与
金属离子螯合反应的一种重要的滴定分 析方法,常用于测定溶液中金属离子的 含量。
EDTA螯合滴定的原理和基本过程:
滴定时使用的指示剂叫做金属指示剂。 它们是一类能与金属离子形成有色配合 物的水溶性有机染料。
-
13
作为金属指示剂必须具备以下条件: 1.与金属离子形成的配合物的颜色 与其本身(即未配合时)的颜色有 明显不同;
Ca2++H2Y2- ⇌ CaY2- +2H+ Mg2+ + H2Y2- ⇌MgY2- +2H+
滴定终点时:
MgIn-+ H2Y2- ⇌MgY2- +HIn- +H+
紫红
蓝
-
21பைடு நூலகம்
水的总硬度按下式计算:
总硬度= 式中:
CEDTVAEDTA V水样 1000
CEDTA: EDTA 标准溶液的浓度( mol ·L-1 ) VEDTA : 消耗EDTA标准溶液的体积(L) V: 滴定时水样的体积(L)
螯合肥概念

螯合肥料螯合物在化学上叫做络合物,它是由一个大分子配位体与一个中心金属原子连接所形成的环状结构。
能与金属离子起螯合作用的有机分子化合物称为螯合剂,或叫配体。
螯合剂在植物的细胞中能有选择地捕捉某些金属离子,又能在必要时适量释放出这种金属离子。
由于螯合剂具有对金属离子的“擒”(吞或捕捉)“纵”(吐或释放)的能力,让作物吸收营养更容易,更加充分合理。
所以,它在植物体内承担着指挥部的作用,平衡根、茎、叶、花、果实之间的营养供给,使植物茁壮生长。
所以说,螯合剂在肥料生产上的应用是农业生产上的又一次革命。
该肥料是以生态农业理论为研究依据,以微生物生命信息调节和缓释、控释技术为核心,经不同地区多年的田间实验,最新研制的一种既能增加农产品产量,又能改善农产品质量的生态肥料。
具有如下特点:1、集有机肥的特点和控释肥的高效于一体含有作物营养调味因子和植物生长促进因子,并添加了多种能改善植物根系微生态环境,增强土壤微生物生命活力的高活性增效物质。
对氮肥具有缓释、控释作用,对磷、钾元素具有活化功能,并能提高土壤中钙、镁、锌、锰等中、微量元素的有效性。
2、缓释控释,营养均衡肥料养分在土壤中能像有机肥那样,按照作物的需肥规律释放,可满足作物不同生育期对氮、磷、钾的需求;凡收获物为一次性采收的作物(如小麦、水稻、玉米、果树等),可将作物整个生育期所需的全部肥料,做底肥一次性施入土中,整个生育期内不用追肥;对于陆续采收果实的作物(如黄瓜、番茄等),可明显减少追肥次数,省工、省力,减轻劳动强度,降低生产成本。
3、提高植物对各种养分的吸收能力能促进农作物的光合作用和各种养分的互补、平衡及协调功能,促进根系发育,提高植物对各种养分的吸收能力。
氮、磷、钾综合利用率提高20%--35%,肥效期较普通肥料增加一倍以上。
在同等养分含量施肥条件下,可使大田作物增产15%---20%,经济作物增产15%--30%。
4、可调整和提高植物生理机能增强作物对干旱、高温、低温、盐碱的抗逆能力和抗倒伏能力。
[总论]螯合剂常识
![[总论]螯合剂常识](https://img.taocdn.com/s3/m/36e9ed7959fafab069dc5022aaea998fcd22405f.png)
螯合剂知识一、螯合剂的概念由一个简单正离子(称为中心离子)和几个中性分子或离子(称为配位体)结合而成的复杂离子叫配离子(又称络离子),含有配离子的化合物叫配位化合物。
在配合物中中心离子与配位体通过配位键结合。
配位键是一种特殊的共价键,通常的共价键是由两个成键·原子绷出一个电子形成共同电子对的,而在配位键中是由一个原子提供电子对,另一原手提供攀删道形成的。
为了区别把共价键用“一”表示,如H·+·H=H:H(H—H),配位键奶删“←”表示,箭头指向提供空轨道的原子,如Cu+NH3=CuNH3(Cu←NH3)。
如果配位体中只有一个配位原子,则中心离子与配位体之间只能形成一个配位键。
而有些配位体分瑚中含有两个以上的配位原子而且这两个原子间相隔着两至三个其他非配位原子时,:这个硼体就可以与中心离子(或原子)同时形成两个以上的配位键,并形成一个包括两个配位剿五元或六元环的特殊结构,把这种配合物称为螯合物。
螯合物比一般配合物更稳定。
把能形成螯合物的配位体叫整合剂。
螯合剂包括无机和有机两类。
它们在清洗过程中蕉着重要用途。
二、无机金属离子螯合剂聚磷酸盐螯合剂的缺点是它们在高温下会发生水解而分解,使螯合能力减弱或丧失。
而且其螯合能力受pH值影响较大,兰般只适合在碱性条件下作螯合剂。
一般说来这些无机螯合剂对重金属离子特别是铁离子的螯合能力较差。
由于以上缺点,使无机螯合剂的用途受到限制,通常只用于对钙、镁离子螯合,所以常作为硬水软化剂。
三、有机金属离子螯合剂能与重金属离子起螯合作用的有机化合物很多,如羧酸型、有机多元膦酸等。
1.羧酸型在清洗剂中使用的羧酸型螯合剂主要有氨基羧酸类和羟基羧酸类等。
(1)氨基羧酸类氨基羧酸用作螯合剂的有乙二胺四乙酸(EDTA),氨基三乙酸(又称次氮基三乙酸NTA),二亚乙基三胺五乙酸及其盐等。
它们对钙、镁离子均有较强的螯合作用。
从单位质量的三种酸螯合钙离子的数量看,以NTA螯合最多,ZDTA其次,DTPA再次。
螯合剂知识

有些金属离子会形成氢氧化物沉淀从-豕期析出而不被螯合,例如Fe3+在pH>8的水溶液中会形成Fe(OH)3沉淀而不能用EDTA去赣合Fe3+。所以尽管氨基酸的螯合能力受pH值影响,在pH值较高的范围内整合能力较蛾猫如果金属离子在:pH值较高条件下生成氢氧化物则不能被螯合,在实用中要注意。
乙二胺四乙酸二钠盐分子中含有两个氮原子和四个氧原子可提供形成配位键的电子对可与钙离子形成六个配位键组成的K元环如下:
在水中很稳定不易解离。但由于乙二胺四乙酸价格昂贵, 目前只用在不停车清洗等特殊蝴垢清洗中而且常用在水中溶解度较其大的二钠盐或四钠盐。二钠盐水溶液的pH值为4.4,四钠盐水溶液pH值为10.8。应当注意在碱性条件下
把能形成螯合物的配位体叫整合剂。螯合剂包括无机和有机两类。它们在清洗过程中蕉着重要用途。
二、无机金属离子螯合剂分解,使螯合能力减弱或丧失。而且其螯合能力受pH值影响较大,兰般只适合在碱性条件下作螯合剂。一般说来这些无机螯合剂对重金属离子特别是铁离子的螯合能力较差。由于以上缺点,使无机螯合剂的用途受到限制,通常只用于对钙、镁离子螯合,所以常作为硬水软化剂。
一、螯合剂的概念
由一个简单正离子(称为中心离子)和几个中性分子或离子(称为配位体)结合而成的复杂离子叫配离子(又称络离子),含有配离子的化合物叫配位化合物。在配合物中中心离子与配位体通过配位键结合。配位键是一种特殊的共价键,通常的共价键是由两个成键·原子绷出一个电子形成共同电子对的,而在配位键中是由一个原子提供电子对,另一原手提供攀删道形成的。为了区别把共价键用“一”表示,如H·+·H=H:H(H—H),配位键奶删“←”表示,箭头指向提供空轨道的原子,如Cu+NH3=CuNH3(Cu←NH3)。如果配位体中只有一个配位原子,则中心离子与配位体之间只能形成一个配位键。而有些配位体分瑚中含有两个以上的配位原子而且这两个原子间相隔着两至三个其他非配位原子时,:这个硼体就可以与中心离子(或原子)同时形成两个以上的配位键,并形成一个包括两个配位剿五元或六元环的特殊结构,把这种配合物称为螯合物。螯合物比一般配合物更稳定。
螯合剂作用原理

螯合剂的作用原理1. 螯合剂的定义和分类螯合剂是一类具有多个配位位点的化合物,能够与金属离子形成稳定的配合物。
螯合剂通常具有较高的亲和力,可以选择性地与特定金属离子结合。
根据其配位原子数目,螯合剂可以分为双齿螯合剂、多齿螯合剂和多环螯合剂等。
2. 配位键的形成螯合剂与金属离子之间的结合是通过配位键形成的。
配位键是由一个或多个配体中的一个或多个非共价电子对与金属离子中未被占据的轨道相互作用而形成的。
这种相互作用可以通过共价键、离子键或范德华力来实现。
3. 配位数和络合度一个金属离子与一个或多个配体形成络合物时,金属离子周围所存在的配位位置数目称为其配位数。
具有不同配位数的金属离子对应不同类型的络合物。
而一个金属离子与一个或多个薄弱结构化学键相连时,所形成的络合物称为其络合度。
4. 螯合剂的作用机制螯合剂通过与金属离子形成稳定的络合物,改变了金属离子的化学性质和生物活性。
下面将从以下几个方面详细解释螯合剂的作用机制。
4.1 形成稳定络合物螯合剂与金属离子形成稳定的络合物,可以通过多个配位位点与金属离子形成多个配位键,从而增强配位键的稳定性。
这种稳定性使得金属离子能够在更宽的pH范围内存在,并且不易被其他分子或离子取代。
4.2 改变金属离子的溶解度螯合剂可以与难溶于水的金属离子结合,形成溶解度较高的络合物。
这种络合物具有较好的水溶性,使得原本不易溶解于水中的金属离子能够更容易地被水分散和溶解。
4.3 提高药物活性和选择性螯合剂可以与药物分子结合,形成能够更有效地传递药物到目标组织或细胞的络合物。
螯合剂还可以通过与金属离子结合,改变药物分子的结构和性质,从而提高药物的活性和选择性。
4.4 促进催化反应螯合剂与金属离子形成络合物后,可以改变金属离子的电子结构和配位环境,从而影响催化反应的速率和选择性。
螯合剂可以作为辅助基团参与反应机理中的中间步骤,加速反应速率。
4.5 降低毒性某些金属离子在生物体内具有毒性,而螯合剂能够与这些金属离子形成稳定的络合物,降低其毒性。
螯合剂种类

螯合剂种类什么是螯合剂?螯合剂是一类能够与金属离子形成稳定配合物的化合物。
它们通过形成共价键或离子键与金属离子结合,从而阻止金属离子发生化学反应或沉淀。
螯合剂可以被广泛应用于许多领域,包括医药、环境保护、工业加工等。
不同种类的螯合剂具有不同的特性,因此在实际应用中需要根据具体情况选择合适的螯合剂。
有机螯合剂有机螯合剂是一类主要由有机化合物构成的螯合剂。
由于有机螯合剂具有良好的溶解性和可选择性,它们在药物设计和水处理领域得到了广泛应用。
α-胎盘素α-胎盘素是一种最常用的有机螯合剂之一。
它具有与许多金属离子结合的能力,包括铁、铝、钙等。
α-胎盘素可以在医药领域用于治疗铁缺乏性贫血,同时也被用作工业废水处理剂。
β-环糊精β-环糊精是另一种常用的有机螯合剂。
它是一种大环多糖,可以与一些金属离子如氢氧化铁结合形成稳定的配合物。
β-环糊精在环境污染治理中起到了重要的作用,可以用来去除废水中的重金属离子。
EDTAEDTA,即乙二胺四乙酸,是一种广泛使用的有机螯合剂。
它可以与多种金属离子形成稳定的配合物,并用于许多不同的应用领域,如医药、食品工业、水处理等。
EDTA在医药领域被广泛用于螯合金离子,从而增强药物的稳定性和生物利用度。
无机螯合剂无机螯合剂主要由无机化合物构成,它们具有较高的化学稳定性和选择性,因此在某些特定的应用中表现出较好的性能。
氨四乙酸氨四乙酸是一种常见的无机螯合剂,也称为乙二胺四乙酸。
它可以与多种金属离子形成稳定的四个配位键,并且具有较好的溶解性。
氨四乙酸广泛应用于工业生产过程中,可以用于除垢、阻垢剂以及金属离子的稳定剂。
硫酸钠硫酸钠是一种无机螯合剂,常用于纸浆和纸张工业中的漂白过程。
它可以与一些金属离子形成络合物,从而降低金属离子对纸张的影响。
硫酸钠在漂白工艺中具有较好的稳定性和选择性。
酒石酸酒石酸是一种天然无机螯合剂,广泛存在于葡萄酒和葡萄酒渣中。
酒石酸可以与一些金属离子结合形成络合物,从而影响葡萄酒的质量和稳定性。
(一)螯合物和螯合剂的概念
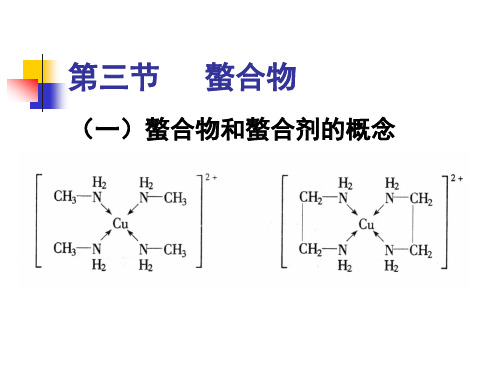
铬黑T能与许多金属离子如Ca2+ 铬黑 能与许多金属离子如 Mg2+ Zn2+Cd2+ 等形成红色的配合物。 形成红色的配合物。 显兰色, 在pH为7~11时,铬黑 显兰色,与 为 时 铬黑T显兰色 形成配合物的红色有明显区别, 形成配合物的红色有明显区别,则 终点时颜色变化明显。因此, 终点时颜色变化明显。因此,用铬 黑T作指示剂时最适宜的pH值为 作指示剂时最适宜的 值为
C
EDTAV EDTA V水样
×1000
9~10.5,一般用NH3-NH4Cl缓冲溶液 ,一般用 缓冲溶液 控制溶液pH值在 左右进行滴定。 值在10左右进行滴定 控制溶液 值在 左右进行滴定。
对于含有两种或两种以上金属离子 的混合溶液, 的混合溶液,可以通过调节溶液的
pH值,选择性地滴定其中某一离子。例 值 选择性地滴定其中某一离子。 离子和Zn 如,在Mg2+离子和 2+离子的混合溶液 可首先调节溶液pH ≈ 6.8,用铬黑 中,可首先调节溶液 , 离子, T作指示剂,用EDTA滴定Zn2+离子, 作指示剂, 作指示剂 此时Mg2+离子不干扰。然后再调节溶液 离子不干扰。 此时 pH ≈ 10,用EDTA滴定Mg2+离子。 离子。 ,
例如, 离子和Zn 例如,在Mg2+离子和 2+离子的混合 溶液中,调节溶液的pH ≈ 6.8, 这时 溶液中,调节溶液的 , EDTA仍可与 Zn2+离子完全螯合,而与 离子完全螯合, 仍可与 Mg2+离子则完全不螯合,即Mg2+离子 离子则完全不螯合, 的存在不会干扰EDTA 对Zn2+离子的螯 的存在不会干扰 合滴定。 合滴定。 由于滴定时不断有离子的生成, 由于滴定时不断有离子的生成,为了 保持合适的pH值 使反应进行完全, 保持合适的 值,使反应进行完全,滴 定前必须加入合适的缓冲溶液控制溶液 的pH值。 值
螯合物定义

螯合物定义全文共四篇示例,供读者参考第一篇示例:螯合物是一种由金属离子与配体通过配位键形成的化合物。
金属离子通常是过渡金属离子,配体则是一个或多个能够提供一个或多个孤对电子给金属离子的有机或无机化合物。
螯合物在化学领域中具有广泛的应用,包括生物化学、药物化学、环境化学等领域。
螯合物的形成通常是通过参与配位键的配体和金属离子之间的相互作用而实现的。
配位键是一种共价键,是指配体中的一个原子将其孤对电子提供给金属离子形成的化学键。
金属离子通常是具有一个或多个未成对电子的过渡金属元素,而配体可以是有机或无机分子,具有提供电子对的原子。
螯合物的形成可以改变金属离子的性质,使得金属离子与配体形成的螯合物具有不同的化学性质和物理性质。
螯合物一般比金属离子本身更加稳定,同时也具有更强的化学活性和生物活性。
螯合物在生物活性分子的设计和制备中具有重要的应用,可以用于设计和合成具有特定功能的生物活性分子。
螯合物还具有广泛的环境应用。
螯合物可以用于水污染治理中的重金属去除,可以通过配位键与金属离子形成的螯合物将金属离子从水中去除。
螯合物还可以用于工业废水处理中的金属去除、环境监测中的金属检测等领域。
螯合物在药物化学中也具有重要的应用。
许多药物分子本身就是螯合物,通过配位到金属离子实现其生物活性。
铁离子与血红蛋白结合形成的血红素就是一种重要的螯合物,它可以有效地将氧气输送到身体的各个组织和细胞中。
一些抗癌药物中也含有螯合物结构,通过与金属离子形成稳定的化合物来实现对癌细胞的攻击。
螯合物是一种重要的化学结构,具有广泛的应用领域和重要的科学意义。
通过研究螯合物的结构和性质,人们可以更好地理解金属离子与配体之间的相互作用,为生物化学、药物化学、环境化学等领域的研究提供新的思路和方法。
希望未来能够进一步深入研究螯合物的性质和应用,为人类社会的发展做出更大的贡献。
第二篇示例:螯合物是指由一个或多个配体与一个中心金属离子结合而形成的化合物。
EDTA与螯合剂

3.与金属离子形成配合物的稳定性 必须小于EDTA与金属离子形成螯合 物的稳定性。
常用的指示剂有铬黑T,钙指示 剂,二甲酚橙,PAN等。现以铬黑T 为例,说明金属指示剂的变色原理。 铬黑T为弱酸性偶氮染料,能随溶液 pH值变化而显示不同的颜色。如用 符号NaH2ln表示铬黑T。在溶液中 有下列平衡:
二、氨羧螯合剂及氨羧 螯合滴定
(一)氨羧螯合剂的结构和特点 氨羧螯合剂中最重要同时应用最
广的是乙二氨四乙酸(EDTA)及其 二钠盐 (EDTA-2Na),统称为 EDTA。结构如下:
EDTA在水中溶解度小,故配制 标准溶液时,常用它的二钠盐。 EDTA的分子或离子中含有2个氨基 氮和4个羧基氧可与金属离子配合, 生成具有5个五元环的稳定性很高的 螯合物。如下图:
4.由于EDTA与金属离子螯合可形成5个五 元环,故生成的螯合物十分稳定。常见 金属离子的EDTA螯合物的lgKs 见表5-2。 表5-2 EDTA与部分金属离子螯合物的稳 定常数对数值
溶液中螯合物的稳定性除决定于螯 合物稳定常数的大小外,还与溶液 的pH值有关。不同的金属离子与 EDTA生成的螯合物的稳定性不同, 滴定时所需溶液的pH值也不同。因 此,在两种以上金属离子的混合溶 液中,常可以通过调节溶液的pH值, 用EDTA进行选择滴定。
Ca2++H2Y2- ⇌ CaY2- +2H+ Mg2+ + H2Y2- ⇌MgY2- +2H+
滴定终点时:
MgIn-+ H2Y2- ⇌MgY2- +HIn- +H+
紫红
蓝
螯合物:由中心原子与多齿配体形
螯合剂种类总结及其在不同pH下的对金属离子的螯合能力比较

螯合剂的种类及其在不同pH值条件下螯合剂的螯合常数一、螯合剂与螯合物具有可供配位孤电子对的分子、原子或离子的化合物能够与具有空轨道的金属离子形成配位键,该化合物称为络合物,如能与配位金属离子形成环状结构的化合物称为螯合剂,形成的络合物称为螯合物。
螯合剂中至少含有一对孤电子对,而金属离子必须有空的价电子轨道,孤电子对填充入金属离子空轨道,电子对属2个原子共享,形成配位键,中心金属离子空轨道杂化。
不同的提供孤电子对的配位体分别与不同金属离子形成正四面体、正六面体、正八面体的螯合物。
1.类型1.1无机类螯合剂聚磷酸盐螯合剂:主要是三聚磷酸钠(STPP)、六偏磷酸钠、焦磷酸钠为主,含磷酸基空间配位基团。
特点:高温下会发生水解而分解,使螯合能力减弱或丧失。
而且其螯合能力受pH值影响较大,一般只适合在碱性条件下作螯合剂。
1.2有机类螯合剂形态分析表明螯合剂提取的重金属主要来源于可交换态或酸溶态、还原态和氧化态。
1.21羧酸型(1)氨基羧酸类:含羧基和胺(氨基)配位基团,如乙二胺四乙酸(EDTA),氨基三乙酸(又称次氮基三乙酸NTA),二亚乙基三胺五乙酸(DTPA)及其盐等。
如:EDTA的4个酸和2个胺(—NRR′)的部分都可作为配体的齿,两个氮原子和四个氧原子可提供形成配位键的电子对。
特点:络合能力强,络合稳定常数大,耐碱性好,但分散力弱且不易被生物降解。
(2)羟基羧酸类含羟基、羧基配位基团这类羧酸主要是柠檬酸(CA)、酒石酸(TA)和葡萄糖酸(GA)。
特点:可生物降解,在酸性条件下羟基与羧基不会离解为氧负离子,因而络合能力很弱,不适宜在酸性介质中应用。
(3)羟氨基羧酸类这类酸用作螯合剂的典型代表是羟乙基乙二胺三乙酸(HEDTA)和二羟乙基甘氨酸(DEG)。
特点:大多易于生物降解,在pH=9的弱碱性条件下可螯合铁离子,但对其他离子螯合能力较差。
1.22有机多元膦酸羟基亚乙基-1,1-二膦酸(HEDP)、氨基三亚甲基膦酸(A TMP)、二乙烯三胺五亚甲基膦酸(HTPMP)、三乙烯四胺六亚甲(TETHMP)、双(1,6-亚己基)三胺五亚甲基膦酸(BNHMTPMP)、多氨基多醚基四亚甲基膦酸(PAPEMP)。
EDTA与螯合剂ppt课件
最新版整理ppt
17
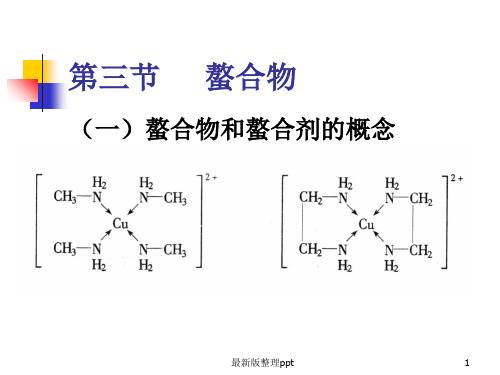
对于含有两种或两种以上金属离子 的混合溶液,可以通过调节溶液的
pH值,选择性地滴定其中某一离子。例 如,在Mg2+离子和Zn2+离子的混合溶液
中,可首先调节溶液pH ≈ 6.8,用铬黑
T作指示剂,用EDTA滴定Zn2+离子,
此时Mg2+离子不干扰。然后再调节溶液
pH ≈ 10,用EDTA滴定Mg2+离子。
M2++H2Y2--MY2 - +2H + M3++H2Y2--MY - +2H + M4++H2Y2--MY +2H +
最新版整理ppt
9
4.由于EDTA与金属离子螯合可形成5个五 元环,故生成的螯合物十分稳定。常见 金属离子的EDTA螯合物的lgKs 见表5-2。 表5-2 EDTA与部分金属离子螯合物的稳 定常数对数值
最新版整理ppt
18
可加入某种掩蔽剂(此试剂能与干 扰离子结合成更稳定的配合物,而 对被测离子无影响),把干扰离子 掩蔽起来,再滴定被测离子。例如 EDTA滴定Ca2+ Mg2+时,少量Fe3+, Al3+有干扰,可加入三乙醇胺消除 干扰。
最新版整理ppt
19
(三)EDTA螯合滴定
示例-水的总硬度测定
最新版整理ppt
15
最新版整理ppt
16
铬黑T能与许多金属离子如Ca2+ Mg2+ Zn2+Cd2+ 等形成红色的配合物。 在pH为7~11时,铬黑T显兰色,与 形成配合物的红色有明显区别,则 终点时颜色变化明显。因此,用铬 黑T作指示剂时最适宜的pH值为
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二、氨羧螯合剂及氨羧 螯合滴定
(一)氨羧螯合剂的结构和特点 氨羧螯合剂中最重要同时应用最
广的是乙二氨四乙酸(EDTA)及其 二钠盐 (EDTA-2Na),统称为 EDTA。结构如下:
EDTA在水中溶解度小,故配制 标准溶液时,常用它的二钠盐。 EDTA的分子或离子中含有2个氨基 氮和4个羧基氧可与金属离子配合, 生成具有5个五元环的稳定性很高的 螯合物。如下图:
Ca2++H2Y2- ⇌ CaY2- +2H+ Mg2+ + H2Y2- ⇌MgY2- +2H+
滴定终点时:
MgIn-+ H2Y2- ⇌MgY2- +HIn- +H+
紫红
蓝
水的总硬度按下式计算:
总硬度= 式中:
CEDTVAEDTA V水样 1000
CEDTA: EDTA 标准溶液的浓度( mol ·L-1 ) VEDTA : 消耗EDTA标准溶液的体积(L) V: 滴定时水样的体积(L)
可加入某种掩蔽剂(此试剂能与干 扰离子结合成更稳定的配合物,而 对被测离子无影响),把干扰离子 掩蔽起来,再滴定被测离子。例如 EDTA滴定Ca2+ Mg2+时,少量Fe3+, Al3+有干扰,可加入三乙醇胺消除 干扰。
(三)EDTA螯合滴定
示例-水的总硬度测定
水的总硬度是指水中Ca2 + , Mg2+ 的总硬度(以为mmol ·L-1单位)
4.由于EDTA与金属离子螯合可形成5个五 元环,故生成的螯合物十分稳定。常见 金属离子的EDTA螯合物的lgKs 见表5-2。 表5-2 EDTA与部分金属离子螯合物的稳 定常数对数值
溶液中螯合物的稳定性除决定于螯 合物稳定常数的大小外,还与溶液 的pH值有关。不同的金属离子与 EDTA生成的螯合物的稳定性不同, 滴定时所需溶液的pH值也不同。因 此,在两种以上金属离子的混合溶 液中,常可以通过调节溶液的pH值, 用EDTA进行选择滴定。
2.与金属离子形成的有色配合物具 有足够的稳定性;
3.与金属离子形成配合物的稳定性 必须小于EDTA与金属离子形成螯合 物的稳定性。
常用的指示剂有铬黑T,钙指示 剂,二甲酚橙,PAN等。现以铬黑T 为例,说明金属指示剂的变色原理。 铬黑T为弱酸性偶氮染料,能随溶液 pH值变化而显示不同的颜色。如用 符号NaH2ln表示铬黑T。在溶液中 有下列平衡:
CaY2-的结构
EDTA与金属离子的配合有以下特点: 1.螯合能力强 除碱金属以外,能与 几乎所有的金属离子形成稳定的螯 合物。
2.与金属离子形成的螯合物大多带 有电荷,因此易溶于水。
3.简单的螯合比 不论几价的金属离子, 它们与EDTA总是1:1螯合。例如:
M2++H2Y2--MY2 - +2H + M3++H2Y2--MY - +2H + M4++H2Y2--MY &A螯合滴定的基本原理
EDTA螯合滴定就是基于EDTA与
金属离子螯合反应的一种重要的滴定分 析方法,常用于测定溶液中金属离子的 含量。
EDTA螯合滴定的原理和基本过程:
滴定时使用的指示剂叫做金属指示剂。 它们是一类能与金属离子形成有色配合 物的水溶性有机染料。
作为金属指示剂必须具备以下条件: 1.与金属离子形成的配合物的颜色 与其本身(即未配合时)的颜色有 明显不同;
例如,在Mg2+离子和Zn2+离子的混合
溶液中,调节溶液的pH ≈ 6.8, 这时
EDTA仍可与 Zn2+离子完全螯合,而与 Mg2+离子则完全不螯合,即Mg2+离子 的存在不会干扰EDTA 对Zn2+离子的螯 合滴定。
由于滴定时不断有离子的生成,为了 保持合适的pH值,使反应进行完全,滴 定前必须加入合适的缓冲溶液控制溶液 的pH值。
测定水的总硬度时加NH3-NH4Cl缓 冲溶液调节pH ≈ 10,以铬黑T为指 示剂,用EDTA标准溶液滴定。溶液 中有关配合物的稳定性有如下顺序:
CaY2- > MgY2- >MgIn - > CaIn-
反应式如下:
加指示剂时:
Mg2+ + HIn2- ⇌ MgIn - + H+
蓝 紫红
滴定终点前:
第三节 螯合物
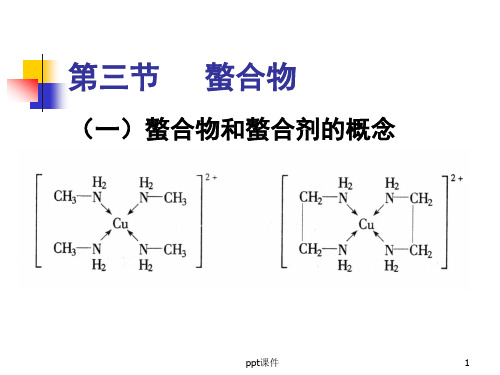
(一)螯合物和螯合剂的概念
螯合物:由中心原子与多齿配体形
成的环状配合物
螯合剂:能与中心原子形成螯和物 螯合效应:这种由于螯和物的生成 而使配合物的稳定性大大增加的作 用配合物中形成的鏊合环数目越多 其稳定性越强。
形成的螯合环以五元环和六元环 最稳定。常见的螯合剂大多是有机 化合物,特别是具有氨基N和羧基O 的一类氨羧螯合剂使用得更广。
对于含有两种或两种以上金属离子 的混合溶液,可以通过调节溶液的
pH值,选择性地滴定其中某一离子。例 如,在Mg2+离子和Zn2+离子的混合溶液
中,可首先调节溶液pH ≈ 6.8,用铬黑
T作指示剂,用EDTA滴定Zn2+离子,
此时Mg2+离子不干扰。然后再调节溶液
pH ≈ 10,用EDTA滴定Mg2+离子。
铬黑T能与许多金属离子如Ca2+ Mg2+ Zn2+Cd2+ 等形成红色的配合物。 在pH为7~11时,铬黑T显兰色,与 形成配合物的红色有明显区别,则 终点时颜色变化明显。因此,用铬 黑T作指示剂时最适宜的pH值为
9~10.5,一般用NH3-NH4Cl缓冲溶液 控制溶液pH值在10左右进行滴定。
