糖尿病肾组织TGF-β/Smads信号通路的活化和α-SMA上调表达
TGF-β1、TNF-α及α-SMA与肾间质纤维化

TGF-β1、TNF-α及α-SMA与肾间质纤维化王祥;高娜;黄燕萍【摘要】肾间质纤维化(RIF)是多种慢性肾病进展到终末期肾病的最终共同病理改变,其中促纤维化因子的释放在肾脏纤维化的形成中起着重要作用.该文通过对文献的梳理,就转化生长因子-β1(TGF-β1)、肿瘤坏死因子-α(TNF-α)及α-平滑肌肌动蛋白(α-SMA)在RIF形成中的作用进行了概括.【期刊名称】《中国妇幼健康研究》【年(卷),期】2015(026)006【总页数】3页(P1332-1334)【关键词】肾间质纤维化;转化生长因子-β1;肿瘤坏死因子-α;α-平滑肌肌动蛋白【作者】王祥;高娜;黄燕萍【作者单位】莱州市人民医院儿科,山东莱州261400;陕西省人民医院,陕西西安710068;西安交通大学第一附属医院,陕西西安710061【正文语种】中文【中图分类】R692肾间质纤维化(renal interstitial fibrosis,RIF)几乎是各种肾脏疾病进展到终末期肾衰竭的共同途径和主要病理基础。
以往认为儿童期发病的原发性肾脏疾病(如IgA肾病等)多数预后良好,近年发现约9%~50%的患者呈进行性发展,不可逆转地进展为终末期肾病,而肾间质纤维化是其主要的形态学特征。
因此,RIF的发生、发展机制已成为肾脏研究中备受关注的领域。
肾小管间质纤维化的发生机制十分复杂,其中,多种细胞因子与肾脏纤维化的关系越来越得到学者的关注。
肾脏间质细胞(包括成纤维细胞、肾小管上皮细胞、肌成纤维细胞等)能合成、分泌多种促纤维化因子,形成复杂的细胞因子网络。
在众多调节因子中,转化生长因子-β1(transforming growth factor-β,TGF-β1)及肿瘤坏死因子-α(tumor necrosi s factor-α,TNF-α)是两个关键的细胞因子,与肾小管上皮细胞转分化(tubular epithelial myofibroblast transdifferentiation,TEMT)及肌纤维细胞(myofibroblast,MF)增殖活化等密切相关,在RIF的发生中发挥了重要作用。
211232341_圣草酚通过抑制TGF-β1

doi:10.3969/j.issn.1000-484X.2023.04.004圣草酚通过抑制TGF-β1/Smad3信号通路改善糖尿病肾病大鼠肾纤维化①应勤丽黄月碧②杨秀翠郑琼飞陈焕梅③(重庆市黔江中心医院康复医学科,黔江 409000)中图分类号R285.5 文献标志码 A 文章编号1000-484X(2023)04-0693-05[摘要]目的:探讨圣草酚对糖尿病肾病(DN)肾纤维化的影响及其作用机制。
方法:采用多次小剂量注射链脲佐菌素建立DN大鼠模型,将建模成功的大鼠随机分为模型组、阳性药物组(二甲双胍,0.5 g/kg)及圣草酚低、中、高剂量组(5、10、20 mg/kg),另设置对照组,每组12只。
各给药组给予相应药物灌胃干预,对照组和模型组灌胃等体积生理盐水,1次/d,连续12周。
收集24 h尿液,检测24 h尿蛋白含量;腹主动脉取血,测定空腹血糖(FBG)、血肌酐(Scr)和血尿素氮(BUN)含量;HE染色观察肾脏组织病理学变化;Masson染色观察肾脏组织纤维化程度;qRT-PCR检测肾组织中TGF-β1、CollagenⅠ和Collagen Ⅲ mRNA表达水平;Western blot检测肾脏组织中TGF-β1、p-Smad3、Smad3、α-SMA蛋白表达水平。
结果:与对照组相比,模型组大鼠肾脏出现明显损伤及纤维化,FBG、BUN、Scr和24 h尿蛋白含量均显著升高(P<0.05),肾脏组织中TGF-β1、CollagenⅠ、Collagen Ⅲ 等mRNA表达水平及TGF-β1、p-Smad3和α-SMA等蛋白表达水平均显著提高(P<0.05);与模型组相比,圣草酚中、高剂量组和阳性药物组大鼠肾损伤明显改善,肾纤维化程度明显降低,FBG、BUN、Scr和24 h尿蛋白含量均显著降低(P< 0.05),肾脏组织中TGF-β1、CollagenⅠ、Collagen Ⅲ mRNA表达水平及TGF-β1、p-Smad3和α-SMA蛋白表达水平均显著降低(P<0.05),而圣草酚低剂量组大鼠以上各指标变化差异无统计学意义(P>0.05)。
TGF-β1介导的Smad和ERK信号通路在肾纤维化中的研究进展

中国免疫学杂志2022年第38卷TGF -β1介导的Smad 和ERK 信号通路在肾纤维化中的研究进展郭帅方敬陈志强(河北中医学院,石家庄050000)中图分类号R392.11文献标志码A文章编号1000-484X (2022)06-0766-05[摘要]肾纤维化的发生发展受到生长因子、细胞因子、趋化因子等多种因素的调控。
TGF -β1是目前已知的最重要的致纤维化因子。
TGF -β1/Smad 和TGF -β1/ERK 信号通路是传导TGF -β1的主要信号通路,在肾纤维化中发挥着重要作用。
因此,本文结合最新研究成果就TGF -β1/Smad 和TGF -β1/ERK 信号通路在肾纤维化中的作用及其二者之间的相互关系进行综述。
[关键词]肾纤维化;TGF -β1/Smad 信号通路;TGF -β1/ERK 信号通路;作用机制Research progress of Smad and ERK signaling pathway mediated by TGF -β1in renal fibrosisGUO Shuai ,FANG Jing ,CHEN Zhiqiang.Hebei University of Chinese Medicine ,Shijiazhuang 050000,China[Abstract ]The occurrence and development of renal fibrosis is regulated by growth factors ,cytokines ,chemokines and otherfactors.TGF -β1is the most important fibrogenic factor at present.TGF -β1/Smad and TGF -β1/ERK signaling pathways are the main signaling pathways of TGF -β1,which play an important role in renal fibrosis.Therefore ,combined with the latest research results ,thefunction of TGF -β1/Smad and TGF -β1/ERK signaling pathway in renal fibrosis and the relationship between them was reviewed in this paper.[Key words ]Renal fibrosis ;TGF -β1/Smad signaling pathway ;TGF -β1/ERK signaling pathway ;Mechanism肾纤维化是慢性肾脏疾病的最终共同途径,以细胞外基质(extracellular matrix ,ECM )的过度沉积为主要特征,与患者的长期预后密切相关。
tgf-β信号传导通路及其生物学功能

tgf-β信号传导通路及其生物学功能
TGFB(Transforming growth factor-beta)信号传导通路是一
种调节细胞增殖、分化、凋亡和细胞外基质的生长因子信号传导通路。
TGFB家族包括TGFB1、TGFB2、TGFB3、BMPs(骨形态发生蛋白)等多
种生长因子,它们可用于在发生炎症、受到外部刺激、治疗过程中起
到两种完全相反的作用:促进细胞的增殖和转化,或促进细胞的凋亡。
TGFB信号传导通过将信号从TGFB受体I和受体II上转导至内皮体中的Smad蛋白来实现。
受体I和受体II与TGFB1结合,从而形成
复合物。
复合物使受体II激酶催化受体I激酶的磷酸化,最终激活Smad蛋白。
活化的Smad蛋白进入细胞核并调节基因表达,从而参与细胞增殖、分化、凋亡等过程。
在生物学中,TGFB信号传导通路可参与一系列生物学过程。
例如,在胚胎发育中,它可调控神经元的分化和细胞迁移。
在免疫系统中,
它可调节T细胞的功能和表达、B细胞的分化和细胞因子的产生。
在皮肤组织再生中,它亦可以促进创面愈合。
总之,TGFB信号传导通路在细胞生理中扮演着至关重要的角色,并有望成为治疗和预防各种疾病的重要靶点。
TGF-βSmad 信号通路

TGF-β/Smad 信号通路图TGF-β(转化生长因子-β)信号通路在调控干细胞活性和器官形成中发挥着重要的作用,当TGF-β信号通路各成员活性未激活时,体内会自发性发生多种癌症,这表明TGF-β定向调节干细胞对癌症形成也具有不可或缺的功能。
TGF-β超家族包含接近30个生长和分化因子,其中有TGF-βs,活化素(activin),inhibins和骨形态发生蛋白(BMPs) 。
下游的跨膜TGF-β受体是多个SMAD蛋白,这些蛋白是TGF-β超家族信号传递的重要调控分子,并在不同层面上受多种多样精确的调控。
TGF-β与TGF-βII型受体(TGF-βRII)结合后,再激活募集TGF-β I型受体(TGF-β RI)组合后形成二聚体形式的受体复合物。
TGF-β RII磷酸化TGF-β RI的甘氨酸-丝氨酸富集区域(GS序列)并活化TGF-β RI的丝氨酸/苏氨酸活性。
活化的TGF-β RI反过来又磷酸化受体相关smad蛋白。
脊椎动物中目前发现的smad蛋白至少有9种,分别是:(a)受体调节的Smads (R-Smads):Smad 1, Smad 2, Smad 3, Smad 5, and Smad 8;(b)共调节Smads: Smad 4 and Smad 10;(c)抑制性Smads(I-Smads): Smad 6 and Smad 7。
Smad 2,和Smad 3参与TGF-β和活化素信号通路,而Smad 1、Smad 5和Smad 8调节BMP信号通路。
R-Smads和Smad 4 主要位于细胞质中,它们的活性主要受衔接蛋白调节,如Smad锚定受体激活蛋白(SARA)和ELF。
Smad 2和Smad 3直接被TGF-β RI磷酸化, 使得构象发生改变从而从受体复合物中释放出来。
Smad 4蛋白的MH2结构域识别R-Smads C端的磷酸丝氨酸从而形成异质二聚体复合物(R-Smad/C-Smad)。
TGFβSmad、p38MAPK及JNKSAPK信号通路在糖尿病肾病发生发展中作用机制的研究进展

糖尿病肾病( DKD) 是糖尿病最常见并发症,同 时也是导致终末期肾功能衰竭的重要原因。据流行 病学调 查 显 示,1 型 糖 尿 病 患 者 中 约 有 30% 出 现 DKD,2 型糖尿病患者有 30% ~ 40% 最终发展为肾 功能衰竭[1]。DKD 占我国透析患者原发病的第 2 位,且有逐年上升趋势。DKD 早期即可出现微量白 蛋白尿,随着病情进展逐渐出现肾小球滤过率下降 和肾小球硬化,最终进展为终末期肾脏病。DKD 的 发病机制十分复杂,至今仍尚未完全阐明。目前认 为,DKD 的发生可能与高血糖引起的代谢紊乱、肾 脏血流动力学障碍、多种细胞因子的参与、氧化应激 等多个因素作用有关。转化生长因子-β( TGF-β) 是 调控肾组织细胞外基质蛋白合成,导致肾小管间质 纤维化及肾小球硬化的关键因子。Lee 等[2]研究证 实,肾脏足细胞中 TGF-β 过度表达可能引起肾小球 基底膜增厚和系膜基质增多而促进肾脏疾病的发 展。Loeffler 等[3]研究发现,TGF-β 可激活细胞外信 号调节蛋白激酶( ERK) 、p38 和丝裂原活化蛋白激 酶( MAPK) ,活化的 p38 和 MAPK 可诱导肾脏足细 胞 凋 亡,从 而 加 快 DKD 进 展。 大 量 研 究 表 明, TGF-β在 DKD 发 展 中 发 挥 显 著 作 用,其 可 通 过 Smads 和 MAPKs 信号传导通路参与 DKD 的进展。 现对 TGF-β / Smad、p38MAPK、c-Jun 氨 基 末 端 激 酶 ( JNK) / SAPK 信号通路在 DKD 发生发展中的作用
摘要: 糖尿病肾病( DKD) 是糖尿病常见的微血管并发症,由细胞因子介导的相关信号传导通路在 DKD 损伤过 程中发挥显著作用,其中 TGF-β / Smad、p38MAPK、JNK / SAPK 是 DKD 发生发展过程中重要的信号分子。TGF-β / Smad 是诱导足细胞凋亡、损伤,介导肾小球硬化及肾间质纤维化的经典信号通路。p38MAPK、JNK / SAPK 信号通路 可以通过氧化应激、触发炎症因子及活化炎症途径等过程,参与足细损伤,导致肾脏功能性及器质性改变,引起蛋 白尿和肾小球硬化。
糖尿病肾组织TGF-β/Smads信号通路的活化和α-SMA上调表达

3 ae o zgu 5 B c eeslce n n o l iie t m dl ru (0mi ) n o t l ru c) 6m l h moy o s 7 U6mie r etda dr d m y vddi o o e op3 c a dc nr o pf mi . C w e a d n g e og 6 e
o- z SM A n dibe i d y tsuei m ie i a tcki ne is n c
Z HU h n ln ,C N  ̄e u, I S e ga g HE h iJANG Yig HE L , I ̄u o g HANG u ig n ,C N u L h n ,C Jpn
f 摘要1目的 : 讨 T F 1S d 信号 通路 在糖 尿病 小 鼠肾组织 中 的活化 及作 用 , 信 号转 导角度 探讨糖 尿病 肾病 。 探 G 一 /ma s 3 从 肾 纤 维化 的发病 机制 。方法 : 取雄 性 C 7 L6小 鼠 3 5B/ 6只 , 随机分 为模 型组 (0只 ) 3 和对 照组 ( 6只 ) 。模 型组 采用链 脲佐
(e at e to e ho g,N nh n A l td H s i lo u nd n dc o ee te Sxh H s i lo hnh n D p r n fN p rl y as a f i e opt fG ag o g Meia C l g , h it opt fS e ze m o i a a l l a
冲 图分类 号】 5 71 R8.
【 文献标 识码】A
【 章编 号1 6 3 7 1 ( 0 9)5( ) O 6 O 文 1 7 — 2 0 2 0 0 a 一 1 一 4
TGF-β 信号通路详解
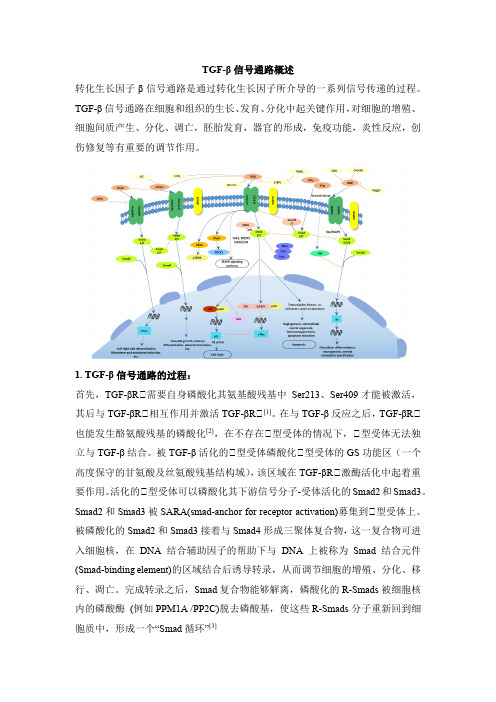
TGF-β信号通路概述转化生长因子β信号通路是通过转化生长因子所介导的一系列信号传递的过程。
TGF-β信号通路在细胞和组织的生长、发育、分化中起关键作用,对细胞的增殖、细胞间质产生、分化、调亡,胚胎发育,器官的形成,免疫功能,炎性反应,创伤修复等有重要的调节作用。
1. TGF-β信号通路的过程:首先,TGF-βRⅡ需要自身磷酸化其氨基酸残基中Ser213、Ser409才能被激活,其后与TGF-βRⅡ相互作用并激活TGF-βRⅡ[1]。
在与TGF-β反应之后,TGF-βRⅡ也能发生酪氨酸残基的磷酸化[2],在不存在Ⅱ型受体的情况下,Ⅱ型受体无法独立与TGF-β结合。
被TGF-β活化的Ⅱ型受体磷酸化Ⅱ型受体的GS功能区(一个高度保守的甘氨酸及丝氨酸残基结构域),该区域在TGF-βRⅡ激酶活化中起着重要作用。
活化的Ⅱ型受体可以磷酸化其下游信号分子-受体活化的Smad2和Smad3。
Smad2和Smad3被SARA(smad-anchor for receptor activation)募集到Ⅱ型受体上。
被磷酸化的Smad2和Smad3接着与Smad4形成三聚体复合物,这一复合物可进入细胞核,在DNA结合辅助因子的帮助下与DNA上被称为Smad结合元件(Smad-binding element)的区域结合后诱导转录,从而调节细胞的增殖、分化、移行、凋亡。
完成转录之后,Smad复合物能够解离,磷酸化的R-Smads被细胞核内的磷酸酶(例如PPM1A /PP2C)脱去磷酸基,使这些R-Smads分子重新回到细胞质中,形成一个“Smad循环”[3]2.TGF-β1/Smads信号通路的影响因子:在生物体中,TGF-β信号通路受多种因素控制,如微环境条件[4] [5]、激素[6]、细胞因子和生长因子[7]、microRNAs(MiRNAs) [8]、长的非编码RNA[9]、磷酸化和去磷酸化激酶[3],泛素连接酶和去泛素酶[10]以及其他因子。
TGF-β信号通路详解
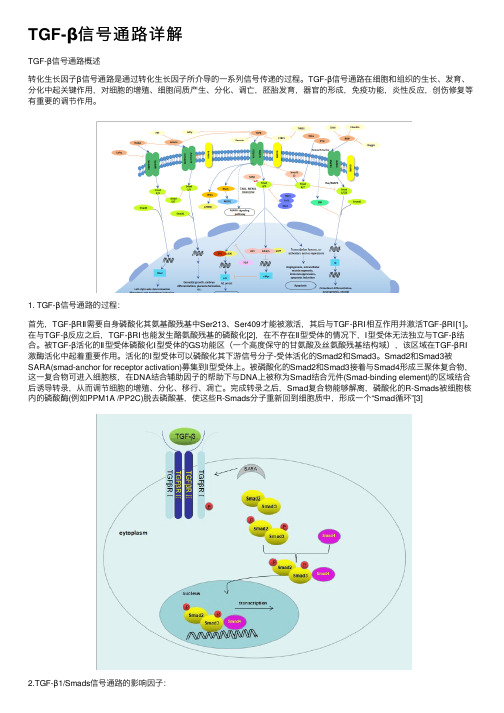
TGF-β信号通路详解TGF-β信号通路概述转化⽣长因⼦β信号通路是通过转化⽣长因⼦所介导的⼀系列信号传递的过程。
TGF-β信号通路在细胞和组织的⽣长、发育、分化中起关键作⽤,对细胞的增殖、细胞间质产⽣、分化、调亡,胚胎发育,器官的形成,免疫功能,炎性反应,创伤修复等有重要的调节作⽤。
1. TGF-β信号通路的过程:⾸先,TGF-βRⅡ需要⾃⾝磷酸化其氨基酸残基中Ser213、Ser409才能被激活,其后与TGF-βRⅠ相互作⽤并激活TGF-βRⅠ[1]。
在与TGF-β反应之后,TGF-βRⅠ也能发⽣酪氨酸残基的磷酸化[2],在不存在Ⅱ型受体的情况下,Ⅰ型受体⽆法独⽴与TGF-β结合。
被TGF-β活化的Ⅱ型受体磷酸化Ⅰ型受体的GS功能区(⼀个⾼度保守的⽢氨酸及丝氨酸残基结构域),该区域在TGF-βRⅠ激酶活化中起着重要作⽤。
活化的Ⅰ型受体可以磷酸化其下游信号分⼦-受体活化的Smad2和Smad3。
Smad2和Smad3被SARA(smad-anchor for receptor activation)募集到Ⅰ型受体上。
被磷酸化的Smad2和Smad3接着与Smad4形成三聚体复合物,这⼀复合物可进⼊细胞核,在DNA结合辅助因⼦的帮助下与DNA上被称为Smad结合元件(Smad-binding element)的区域结合后诱导转录,从⽽调节细胞的增殖、分化、移⾏、凋亡。
完成转录之后,Smad复合物能够解离,磷酸化的R-Smads被细胞核内的磷酸酶(例如PPM1A /PP2C)脱去磷酸基,使这些R-Smads分⼦重新回到细胞质中,形成⼀个“Smad循环”[3]2.TGF-β1/Smads信号通路的影响因⼦:在⽣物体中,TGF-β信号通路受多种因素控制,如微环境条件[4] [5]、激素[6]、细胞因⼦和⽣长因⼦[7]、microRNAs(MiRNAs) [8]、长的⾮编码RNA[9]、磷酸化和去磷酸化激酶[3],泛素连接酶和去泛素酶[10]以及其他因⼦。
miRNA-21在糖尿病肾脏病的作用机制及中药干预新进展

miRNA-21在糖尿病肾脏病的作用机制及中药干预新进展陈宇1,黄国东1△,覃婷2,张泽朝2,沈小楠1,许艺镡1,刘少芳1摘要:糖尿病肾脏病是糖尿病的并发症之一,可进展至终末期肾脏病。
近年研究发现,miRNA-21可通过调控转化生长因子-β1(TGF-β1)/Smads、磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(AKT)、Wnt/β-连环蛋白等信号通路影响糖尿病肾脏病的进展。
中药对miRNA-21表达具有调节作用,可以靶向miRNA-21调控TGF-β1/Smads、磷酸酶张力蛋白同源物/PI3K/AKT/哺乳动物雷帕霉素靶蛋白、过氧化物酶体增殖物激活受体等信号转导,引发信号级联反应,干预纤维化、炎症、氧化应激、自噬等病理过程。
就miRNA-21在糖尿病肾脏病中的作用机制及中药对其的干预作用进行综述。
关键词:糖尿病肾病;中药;miRNA-21;TGF-β1/Smads;PI3K/AKT中图分类号:R259.872文献标志码:A DOI:10.11958/20230945New progress of mechanism of action of miRNA-21in diabetic kidney disease and Chinesemedicine interventionCHEN Yu1,HUANG Guodong1△,QIN Ting2,ZHANG Zechao2,SHEN Xiaonan1,XU Yitan1,LIU Shaofang11Guangxi Internatonal Zhuang Medicine Hospital Affiliated to Guangxi University of Chinese Medicine,Nanning530000, China;2Ruikang Hospital Affiliated to Guangxi University of Chinese Medicine△Corresponding Author E-mail:****************Abstract:Diabetic kidney disease is one of the complications of diabetes,which can progress to end-stage renal disease.In recent years,it has been found that miRNAs have become a research hotspot,with miRNA-21regulating transforming growth factorβ1(TGF-β1)/Smads,phosphoinositide3-kinase(PI3K)/protein kinase B(AKT),Wnt/β-catenin and other signaling pathways to promote the progress of diabetic kidney disease.Studies have showed that traditional Chinese medicine has a regulatory effect on the expression of miRNA-21and can target miRNA-21to regulate TGF-β1/Smads, phosphatase and tensin homolog/PI3K/AKT/mammalian target of rapamycin(mTOR),peroxisome proliferator activated receptors and other signal transduction pathways to trigger signal cascade reactions,which intervene in pathological processes such as fibrosis,inflammation,oxidative stress and autophagy.In this article,the role of miRNA-21in diabetic kidney disease and the intervention of traditional Chinese medicine were summarized,in order to provide some reference for the treatment of diabetic kidney disease and the development of new drugs.Key words:diabetic nephropathies;Traditional Chinese Drugs;miRNA-21;TGF-β1/Smads;PI3K/AKT糖尿病肾脏病(diabetic kidney disease,DKD)是持续性高血糖所致的肾损害,病变可累及全肾,是糖尿病(diabetes mellitus,DM)严重且危险的并发症之一[1-2]。
TGF-β1-Smad信号通路蛋白、MMP-14与间充质干细胞在血管损伤中的表达及意义

TGF-β1-Smad信号通路蛋白、MMP-14与间充质干细胞在血管损伤中的表达及意义随着人类寿命的延长和生活方式的改变,慢性疾病的发病率逐渐增加,其中包括心脑血管疾病。
血管损伤是心脑血管疾病的主要病理基础之一,针对血管损伤的研究对于预防和治疗心脑血管疾病具有重要意义。
TGF-β1/Smad信号通路蛋白、MMP-14以及间充质干细胞作为研究对象,在血管损伤中的表达及其意义备受关注。
TGF-β1/Smad信号通路是一种重要的细胞信号传导途径,参与多种病理生理过程。
TGF-β1是一种细胞因子,在血管损伤中起着调控细胞增殖、细胞外基质合成以及细胞迁移等作用。
Smad蛋白是TGF-β1信号转导的关键分子,通过参与核转运和基因转录调控等机制,传递TGF-β1信号,并影响下游基因表达。
研究表明,在血管损伤模型中,TGF-β1/Smad信号通路蛋白的表达水平明显上调,促进血管平滑肌细胞的增殖和迁移,并参与血管重塑过程。
MMP-14即基质金属蛋白酶-14,是一种重要的基质金属蛋白酶家族成员。
MMP-14在组织重塑和细胞迁移中发挥重要作用。
研究发现,MMP-14的表达与血管损伤程度密切相关。
在血管损伤过程中,MMP-14能够降解胶原和纤维连接蛋白等细胞外基质成分,促进新生血管的生成和血管内皮细胞的迁移。
此外,MMP-14还与TGF-β1/Smad信号通路相互作用,通过调节Smad蛋白的磷酸化状态,增强TGF-β1在血管损伤中的调控作用。
间充质干细胞是一类具有自我更新和多向分化潜能的成体干细胞。
研究发现,间充质干细胞在血管损伤中发挥重要作用。
通过成为血管平滑肌细胞和内皮细胞等细胞类型,间充质干细胞参与血管再生和重塑过程。
同时,间充质干细胞能够分泌多种细胞因子,调节局部环境,促进血管损伤修复。
研究表明,TGF-β1/Smad信号通路蛋白和MMP-14可能参与间充质干细胞的分化和迁移,从而影响间充质干细胞在血管损伤中的功能。
miR-130b调控TGF-β1-Smads信号通路对糖尿病肾脏纤维化的作用和机制研究

miR-130b调控TGF-β1-Smads信号通路对糖尿病肾脏纤维化的作用和机制研究miR-130b调控TGF-β1/Smads信号通路对糖尿病肾脏纤维化的作用和机制研究糖尿病肾脏疾病是糖尿病的一个常见并发症,其主要特征是肾小球滤过率的逐渐下降和肾间质纤维化的形成。
研究发现,miR-130b在糖尿病肾脏纤维化中起到了重要的调控作用。
miR-130b是一种小分子RNA,能够通过与特定的靶基因mRNA结合并抑制其表达。
在糖尿病肾脏纤维化中,miR-130b的表达水平明显降低。
研究显示,miR-130b通过调节转化生长因子-β1(TGF-β1)/Smads信号通路的活化程度来发挥其调控作用。
TGF-β1是一个非常重要的细胞因子,能够促进炎症反应和纤维化的发生。
在糖尿病肾脏纤维化中,TGF-β1的表达水平明显升高,而miR-130b的降低则导致了此信号通路的过度活化。
miR-130b的低表达与糖尿病肾脏纤维化的发生和进展密切相关。
研究发现,提高miR-130b的表达水平可以有效抑制TGF-β1/Smads信号通路的活化,从而减少炎症反应和纤维化的程度。
进一步研究发现,miR-130b的表达受到多种因素的调控。
例如,一些转录因子能够直接调控miR-130b的转录,而一些环境因素则能够通过改变miR-130b的表达水平来影响其调控作用。
此外,其他一些microRNA也能够与miR-130b相互作用,共同调控TGF-β1/Smads信号通路的活化程度。
研究进一步揭示了miR-130b调控TGF-β1/Smads信号通路的机制。
miR-130b通过与Smad4 mRNA结合并抑制其表达,从而降低了TGF-β1/Smads信号通路的活化程度。
此外,miR-130b还能够调控其他与纤维化相关的基因表达,进一步影响纤维化的发生和进展。
综上所述,miR-130b在糖尿病肾脏纤维化中发挥重要作用。
通过调控TGF-β1/Smads信号通路,miR-130b能够抑制炎症反应和纤维化的发生。
TGF-β1诱导醛糖还原酶(AR)高表达的信号通路机制研究的开题报告

TGF-β1诱导醛糖还原酶(AR)高表达的信号通路机制研究的开题报告题目:TGF-β1诱导醛糖还原酶(AR)高表达的信号通路机制研究研究背景和意义:醛糖还原酶(AR)是一种广泛存在于多种细胞和组织中的酶,能够催化还原醛糖,使其转化为对应的糖醇。
AR与多种疾病的发生有关,如糖尿病、前列腺增生和神经系统疾病等。
TGF-β1是一种多功能的生长因子,广泛参与细胞增殖、分化、基质的合成和分解等过程。
近期的研究表明,TGF-β1可以通过多种信号通路调节细胞的生长和分化,其中包括调节AR的表达。
因此,研究TGF-β1诱导AR高表达的信号通路机制,对于深入了解AR的功能以及相关疾病的发生机制具有重要的意义。
研究目的和研究内容:本研究旨在探讨TGF-β1诱导AR高表达的信号通路机制。
具体的研究内容包括以下几个方面:1. 采用Western blotting和实时荧光定量PCR等技术,检测TGF-β1对AR的表达变化。
2. 采用生化方法和细胞学技术,研究TGF-β1通过哪些信号通路调节AR的表达,包括Smad信号通路、MAPK信号通路和PI3K/Akt信号通路等。
3. 通过启动子分析和荧光素酶报告基因分析等方法,探究TGF-β1调节AR的表达是否依赖于转录因子的参与。
研究方法和步骤:1. 细胞培养和处理:选择人类前列腺癌细胞株LNCaP细胞作为模型,进行TGF-β1处理,并采用Western blotting和实时荧光定量PCR技术,检测AR的表达变化。
2. 蛋白质提取和Western blotting检测:采用蛋白质提取液提取蛋白质,Western blotting检测AR、Smad、MAPK和Akt等信号通路相关蛋白的表达变化。
3. 荧光素酶报告基因分析:利用启动子分析和荧光素酶报告基因分析,探究TGF-β1调节AR的表达是否依赖于转录因子的参与。
预期结果和意义:通过本研究,我们期望能够揭示TGF-β1调节AR表达的信号通路机制,从而深入了解AR的功能以及相关疾病的发生机制,为临床治疗相关疾病提供新的思路和靶点。
小分子抑制剂、激动剂、拮抗剂--TGF-β-Smad

TGF-β/Smad
TGF-β (转化生长因子β) 是一种多效性、多向性的细胞因子,Smad蛋白是细胞内重要的TGF-β信号传导和调节分子,可将TGF-β信号由胞浆直接传导至细胞核。
TGF-β超家族信号转导途径在众多生物系统中对细胞增殖、分化及凋亡,细胞外机制的合成、免疫功能、创伤修复的调节发挥重要作用。
TGF-β/Smad信号通路与人类许多疾病相关,如糖尿病肾病、风湿性疾病、骨关节炎、脊柱关节病等。
TGF-β/Smad通路转导过程
TGF-β结合两种受体,TGF-βI型和II型受体(分别为TβRI和TβRII)形成信号通路。
TβRII通过磷酸化TβRI,激活TβRI
激酶活性。
TβRI再磷酸化Smad转录因子,传送胞内信号。
Smad蛋白主要有3类:1)受体调节的Smads(R-Smads):Smad 1,Smad 2,Smad 3,Smad 5,Smad 8。
Smad 2和Smad 3参与TGF-β和活化素信号通路,而Smad 1、Smad 5和Smad 8调节BMP信号通路;2)共调节Smads(Co-smad):Smad 4和Smad 10;3)抑制性Smads(I-Smads):Smad 6和Smad 7。
Smad 4和R-Smads在细质中形成异质复合物(R-Smad/Co-Smad),转运至细胞核,在转录共激活因子的作用下,调控基因的表达。
TGF-β/Smad信号通路图。
TGF—β/Smads信号通路对心肌纤维化进展的临床意义

TGF—β/Smads信号通路对心肌纤维化进展的临床意义心肌纤维化(MF)又称为心肌钙化,与心律失常、心功能障碍甚至心源性猝死密切相关,是目前多种常见心脏疾病发展到一定阶段的病理转归,也是心室重构的一种重要表现。
心肌纤维化是一个多因素相互制约与促进的过程。
其中,转化生长因子-β(TGF-β)在MF的发展进程中有着至关重要的作用,TGF-β/Smads 信号通路是转化生长因子-β发挥生物学作用的主要通路,现将在MF的发展进程中TGF-β的临床意义作如下综述。
标签:心肌纤维化;慢性心力衰竭;TGF-β/Sm ads信号通路;转化生长因子-β高血压病、心脏瓣膜病、风湿性心脏病、心肌梗死、心肌炎等均可致心肌收缩能力下降、心室重构、心肌细胞凋亡等病理生理改变,进而发展为慢性心力衰竭。
心肌纤维化是心力衰竭的病理基础。
大量研究表明,心肌纤维化是多种致病因子长期作用于心脏,引起细胞外基质(extracellu-lar matrix,ECM)异常增多及过度沉积,导致ECM合成和降解失衡、各类胶原比例失调、排列紊乱及心肌成纤维细胞大量增生,导致心室顺应性下降,影响心脏的正常舒缩功能,是一种慢性炎症逐渐病变的过程[1]。
Komamura K等提出,根据有无细胞缺失和坏死,心肌纤维化可分为反应性纤维化(reactive interstitial fibrosis)和修复性纤维化(reparative fibrosis)[2]。
反应性心肌纤维化发生在炎症的反应过程,是指心肌胶原纤维过度沉积在细胞间和心内血管周围,没有明显的心肌细胞缺失和坏死,并且通过一定的干预手段,反应性心肌纤维化可以得到有效改善甚至消除,是可逆的。
而修复性心肌纤维化一般由于心肌组织损伤而引发,是指心肌细胞死亡后,分泌的胶原纤维填充在其空腔内,替代心肌细胞的位置,这一病理过程是无法逆转的。
MF是胶原合成和降解代谢失衡的结果,是多种心脏疾病的终末期表现,它是心血管领域研究的重点、难点之一,是决定心血管疾病预后的关键性因素。
芪蛭降糖胶囊对2型糖尿病患者治疗的研究

芪蛭降糖胶囊对2型糖尿病患者治疗的研究目的观察芪蛭降糖胶囊对2型糖尿病患者的治疗效果,从而为临床的大规模推广提供支持依据。
方法选取100例糖尿病患者(根据中医证型辨证标准,符合气阴两虚兼瘀型),将患者随机分为两组,即实验组(50例)及对照组(50例)。
对照组患者给予正常西医治疗,实验组患者在此基础上给予芪蛭降糖胶囊治疗。
患者在干预8周后,评估治疗状况。
结果在临床疗效评分方面,实验组治疗有效人数及有效率均显著高于对照组(P<0.05);在中医症候方面,治疗后,实验组中医症候积分显著低于对照组(P<0.05),治疗有效人数及有效率均显著高于对照组(P<0.05);在血糖含量方面,治疗前,实验组和对照组在空腹血糖及餐后2 h血糖含量无明显差异(P>0.05),治疗后,实验组和对照组空腹血糖及餐后2 h血糖含量含量显著低于对照组(P<0.05)。
结论芪蛭降糖胶囊可明显改善糖尿病患者的临床症状,值得在临床广泛推广。
标签:芪蛭降糖胶囊;糖尿病;疗效评价糖尿病作为一种常见慢性疾病,以其较高的发病率以及极高的并发症成为影响居民健康的重要问题之一,成为摆在医护人员面前急需解决的问题[1]。
临床上常见的治疗糖尿病的药物存在多种副作用,如糖尿病肾病,糖尿病白内障,糖尿病足以及糖尿病心血管并发症等[2-3]。
在这种形势下,中成药以其独特的优势在临床上大放光彩,中成药联合西药治疗在糖尿病疾病中发挥着重要作用并取得了显著的疗效[4]。
该研究2014年2月—2015年12月间采用芪蛭降糖胶囊治疗2型糖尿病患者,探讨治疗效果,从而为临床的大规模推广提供支持依据,现报道如下。
1 资料与方法1.1 一般资料选取该院收治的糖尿病患者进行临床研究,共100例患者,其中男性40例,女性60例,年龄为40~78岁,平均(53.9±9.4)岁。
纳入标准:①参照《中药新药临床研究指导原则(试行)》,患者需符合气阴两虚兼瘀型;②入院3周前,未服用其他降糖药物;③患者需要有一定的视听说读写能力,且排除妊娠及哺乳期妇女,及严重心肝肾功能失调患者。
Smads信号转导通路的干预作用的开题报告

乌司他丁对大鼠肾间质纤维化中TGF-β/Smads信号转导通路的干预作用的开题报告
1. 研究背景和意义
肾间质纤维化是慢性肾脏病进展至肾衰竭的主要方式之一。
乌司他
丁是一种具有抗炎、抗纤维化、抗氧化等多种生物学效应的药物。
已有
研究发现乌司他丁可减缓肾间质纤维化并显著降低TGF-β/Smads信号转导通路的活性,但其具体作用机制需要进一步研究。
2. 研究目的
本研究旨在探究乌司他丁对大鼠肾间质纤维化中TGF-β/Smads信号转导通路的干预作用及其作用机制。
3. 研究内容
(1)建立肾间质纤维化大鼠模型,随机分为模型组和乌司他丁组;
(2)采用HE染色和Masson染色观察大鼠肾间质病变情况;
(3)Western blot法检测大鼠肾脏中相关蛋白表达,包括TGF-β1、Smad2、Smad3、Smad4等;
(4)Real-time PCR法检测大鼠肾脏中相关基因mRNA表达,包括
α-SMA、ColⅠ、ColⅢ等;
(5)ELISA法检测大鼠血清中TGF-β1水平;
(6)采用数据统计学方法进行数据分析。
4. 研究意义
本研究将探究乌司他丁干预TGF-β/Smads信号转导通路的作用机制,拓展其应用领域,并为慢性肾脏病治疗提供新思路和方法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
糖尿病肾组织TGF-β/Smads信号通路的活化和α-SMA上调表达作者:祝胜郎陈结慧蒋莹陈路李就鸿常巨平来源:《中国医药导报》2009年第13期[摘要] 目的:探讨TGF-β/Smads信号通路在糖尿病小鼠肾组织中的活化及作用,从信号转导角度探讨糖尿病肾病肾纤维化的发病机制。
方法:取雄性C57BL/6小鼠36只,随机分为模型组(30只)和对照组(6只)。
模型组采用链脲佐菌素[STZ,50 mg/(kg·d)]连续5 d腹腔注射诱导糖尿病模型,对照组用枸橼酸缓冲液腹腔注射。
血糖超过16.7 mmol/L为糖尿病诊断标准,观察16周,分别在造模后0、4、8、12、16周处死小鼠。
用免疫组化方法检测肾组织TGF-β、磷酸化Smad2/3和α-SMA的表达。
结果:对照组小鼠肾组织有基础的TGF-β和磷酸化Smad2/3的表达。
糖尿病形成后4周,TGF-β和磷酸化Smad2/3表达明显增加,第12周达高峰,第16周表达减少,但仍高于对照组。
对照组小鼠肾组织仅血管平滑肌有α-SMA表达,糖尿病形成后4周肾小球系膜区、肾小管-间质α-SMA的表达显著增加,并持续增加到12周,第16周表达下调,但仍高于对照组。
糖尿病肾组织TGF-β、磷酸化Smad2/3及α-SMA的表达时相一致且呈明显正相关。
结论:糖尿病小鼠肾组织TGF-β/Smads信号通路被高度活化,可能通过诱导α-SMA的上调表达参与糖尿病肾病肾纤维化的过程。
[关键词] 糖尿病肾病;Smad2/3;肾纤维化;TGF-β[中图分类号] R587.1[文献标识码]A [文章编号]1673-7210(2009)05(a)-016-04Activation of TGF-β/Smads signal pathway and upregulated expression of α-SMA in diabetic kidney tissue in miceZHU Shenglang, CHEN Jiehui, JIANG Ying, CHEN Lu, LI Jiuhong, CHANG Juping(Department of Nephrology, Nanshan Affiliated Hospital of Guangdong Medical College, the Sixth Hospital of Shenzhen City, Shenzhen 518052, China)[Abstract] Objective: To investigate the activation and effect of TGF-β/Smads signal pathway in diabetic kidney tissue in mice, and explore the pathogenesy of renal fibrosis of diabetic nephropathy in the aspect of signal transduction. Methods: 36 male homozygous C57BL/6 mice were selected and randomly divided into model group (30 mice) and control group (6 mice).Model group received 5 consecutive daily intraperitoneal (ip) injection of Streptozotocin [STZ, 50 mg/(kg·d)], and control group was intraperitoneally injected with citrate buffer. All mice were followed up for 16 weeks. Diabetes mellitus was confirmed by serum glucose level exceeding 16.7 mmol/L. Mice were killed at 0th, 4th, 8th, 12th and 16th week respectively after establishing models. The kidney tissue was usedfor histological and morphometric studies, and the expression of TGF-β, phosphorylated Smad2/3 and α-SMA were determined by immunohistochemical staining. Results: Fundamental expression of TGF-β and phosphorylated Smad2/3 were observed in control group. After preparing diabetes mellitus for 4 weeks, the expressions of TGF-β and phosphorylated Smad2/3 significantly increased, and reached its peak value at 12th week, and then began to decrease at 16th week, but still higher than that of control group. α-SMA were only detected in vascular smooth muscle cells in normal kidney tissue of control group. While the expression of α-SMA in mesangal area and tubuleinterstitium in both cortex and medulla after preparing diabetes mellitus was evident at 4th week and reached the peak by 12th week. An obvious positive correlation was shown among TGF-β, phosphorylated Smad2/3 and α-SMA in the diabetic kidney. Conclusion: TGF-β/Smads signal pathway in diabetic kidney tissue is highly activated, and it may play an important role in renal fibrosis through upregulating the expression of α-SMA.[Key words] Diabetic nephropathy; Smad2/3; Renal fibrosis; TGF-β肾脏纤维化几乎是所有慢性肾脏疾病进行性发展的共同通路。
近年发现,在肾脏病变过程中肾组织肌成纤维细胞分泌大量的细胞外基质,是肾纤维化发生、发展的重要环节。
多种细胞因子对这一过程起调节作用,其中研究最多、关系最密切的是TGF-β[1]。
研究显示,TGF-β在糖尿病肾病发展过程中表达明显上调[2],并在诱导肾小管上皮细胞向肌成纤维细胞转化的过程中发挥重要作用[3]。
Smad信号蛋白是近年来发现的TGF-β家族下游信号转导蛋白,TGF-β介导的纤维化均涉及Smad信号通路[4]。
体外研究发现,人系膜细胞中存在Smad2、Smad3与Smad4的基础表达,并且参与TGF-β诱导的Ⅰ型胶原的基因转录[5]。
外源性TGF-β可刺激肾小管上皮细胞,使Smad2发生磷酸化并转移入核,诱导肾小管上皮分泌Ⅰ、Ⅲ、Ⅳ型胶原,并表达α-SMA[6]。
本研究旨在观察糖尿病小鼠肾组织中TGF-β/Smads信号通路的活化及作用。
1 材料与方法1.1 主要试剂TGF-β多克隆抗体购自Santa Cruz公司,磷酸化Smad2/3多克隆抗体购自New Englang Biolabs公司,α-SMA购自Oncogene公司,LSABR+System、HRP(DAB)和EnVisionTM+System、HRP(DAB)试剂盒为DAKO公司产品。
1.2 实验动物糖尿病小鼠肾病模型制作方法[7]:2个月龄雄性C57BL/6小鼠36只,体重25~35 g,购自中山大学北校区实验动物中心。
所有小鼠随机分成模型组(30只)[腹腔注射STZ 50mg/(kg·d),连续5 d]和对照组(6只)(腹腔注射相同体积的枸橼酸缓冲液),观察16周。
以血糖≥16.7 mmol/L为糖尿病诊断标准。
实验组于实验第0、4、8、12、16周处死小鼠检查,肾组织以10%中性甲醛溶液固定,石蜡包埋。
1.3 观察指标及方法1.3.1 肾组织病变程度分析所有标本按常规方法固定,包埋,切片厚2 μm,HE和Masson 染色,光镜观察肾小球、肾小管-间质病理变化。
1.3.2 TGF-β和磷酸化Smad2/3免疫组织化学采用LASB法检测肾组织中TGF-β和磷酸化Smad2/3的表达。
取4 μm石蜡切片,常规处理后,滴加预阻断液室温30 min;分别滴加兔抗大鼠TGF-β多克隆抗体(1∶200)和兔抗大鼠磷酸化Smad2/3多克隆抗体,4℃孵育过夜;滴加生物素化抗兔抗体(原液),37℃孵育45 min,滴加辣根过氧化物酶标记的链酶亲和素(原液),37℃孵育45 min,最后加DAB-H2O2显色,显微镜下控制显色反应,苏木素复染,中性树胶封片,实验同时采用PBS代替一抗作为阴性对照。
TGF-β以肾实质及间质细胞浆内棕褐色颗粒为阳性,磷酸化Smad2/3以肾实质及间质细胞核内棕褐色颗粒为阳性。
1.3.3 肾组织α-SMA免疫组织化学染色采用Envision法检测肾组织α-SMA的表达。
取4 μm石蜡切片,常规处理后,滴加山羊血清封闭液室温30 min;滴加小鼠抗大鼠α-SMA(1∶50)单克隆抗体,4℃孵育过夜;滴加辣根过氧化物酶标记的抗小鼠Envision多聚物(原液),37℃孵育45 min,最后加DAB-H2O2显色,显微镜下控制显色反应,苏木素复染,中性树胶封片,实验同时采用PBS代替一抗作为阴性对照。
以肾间质棕褐色颗粒为阳性。
1.4 实验结果的定量TGF-β和α-SMA半定量分析:应用IBSA 2.5图像分析系统显微镜200倍下随机选取20个视野,按阳性信号所占百分比进行半定量评分后取均值;Smad2/3半定量分析:400倍镜下分别随机选取20个视野,计算每平方毫米肾组织阳性细胞个数后取均值。
