高中化学第2章化学反应速率和化学平衡第1节化学反应速率课件新人教版选修41
化学反应速率和化学平衡全部课件ppt

练习与思考
❖ 1、对于反应∶N2+O2
2NO,在密闭容器
中进行,下列条件能加快反应速率的是
❖ A、缩小体积使压强增大;B、体积不变充入 氮气使压强增大;C、体积不变充入惰性气 体;D、使总压强不变,充入惰性气体
▲理论解释影响因素
❖ 如加热、增大反应物浓度等我们前面已经从 能量、分子碰撞等方面进行了解释,希望同学 们再作理解,掌握影响化学反应速率的外界条 件的内容,了解其为什么产生这样影响的基本 原因
练习题1
❖ 1、对于在1个密闭容器中进行的可逆反应: ❖ C s + O2 = CO2 s ❖ 下列说法中错误的是 ❖ A将碳块粉碎成粉末可以加快化学反应速率 ❖ B增大氧气的量可以加快化学反应速率 ❖ C增大压强可以加快化学反应速率 ❖ D增加碳的量可以加快化学反应速率
例2.向1个容积为1L的密闭容器 中放入2molSO2和1molO2,在1定 的条件下,2s末测得容器内有 0.8molSO2,求2s内SO2、O2、SO3 的平均反应速率和反应速率比
化学反应速率之比=化学计量数之比
1.反应 N2 + 3 H2 2 NH3 ,在 2L的 密闭容器中发生,5min内NH3 的质 量增加了1.7克,求v NH3 、v H2 、 v
1.化学反应速率的表示方法: 用单位时间里反应物浓度的减少 或生成物浓度的增加来表示
2.数学表达式: vB=
3.单位:mol·L-1·s-1或mol·L-1·min1
4.关于化学反应速率的简单计算:
例1.在某1化学反应里,反应物 A的浓度在10 s内从4.0mol·L-1 变成1.0mol·L-1,在这10 s内A的 化学反应速率是多少
新教材高中化学第2章第1节第1课时化学反应速率课件新人教版选择性必修1ppt

A.v(A)=0.3 mol·L-1·min-1 B.v(B)=0.6 mol·L-1·min-1 C.v(C)=0.5 mol·L-1·min-1 D.v(A)=0.01 mol·L-1·s-1
()
错解:A、B
错因分析:部分同学看到选项中反应速率的数值最大,从而错选 B; 没有注意到选项中反应速率的单位的不同,从而错选 A。
起始/mol:6
5
0
0
转化/mol:3
1
2
2
平衡/mol:3
4
2
2
α(B)=51×100%=20%,B 正确;平衡时,c(A)=34mLol=0.75 mol/L,
1 mol
C 错误;v(B)=ΔcΔtB=
4L 5s
=0.05
mol/(L·s),D 错误。
任务二 比较化学反应速率大小的方法
核心素养
2.化学反应速率与化学计量数之间的关系
对一个化学反应:mA+nB===pY+qZ,用不同物质表示的反应速 率其关系是 v(A)∶v(B)∶v(Y)∶v(Z)=_m_∶__n_∶__p_∶__q__,或vmA=___v_n_B___ =vpY=___v_qZ____。
3.化学反应速率的测定 (1)测定原理。 任何一种与物质浓度有关的可观测量都可以加以利用。 (2)可测定的具体物理量。 气体体积、__体__系__压__强___、__颜___色__深__浅__、光的吸收、__导__电__能__力___ 等。
化学反应速率的比较
[深化理解]
对于同一化学反应速率用不同物质表示的数值可能不同,但比较反
应速率的大小不能只看数值的大小,而要进行一定的转化,具体比较方
法如下:
(1)归一法:将不同物质的化学反应速率转化成同一物质的化学反应 速率。
第二章第一节第1课时化学反应速率课件高二化学人教版选择性必修1

4mol/(L·min)
A.前12 B.
起始量(mol):
s内,A的平均反应速率为0.025
mol·L-1·s-1
起始量(mol):
12 s内,A和B反应放出的热量为0.
B.12 s后,A的消耗速率等于B的生成速率 000 2 mol·s-1
在溶液中,当反应物或生成物本身有较明显的颜色时,可利用
表示,已知3v(B)=2v(A)、2v(C)=3v(B),则此反应可表示为
A.2A+3B===2C
√C.3A+2B===3C
B.A+3B===2C D.A+B===C
解析 由 3v(B)=2v(A)、2v(C)=3v(B)可推出:vvAB=32,vvBC=23,即 v(A)∶v(B)∶v(C)=3∶2∶3,速率之比等于化学计量数之比。
②浓度的变化量Δc=c(某时刻)-c(初始)
所以一般Δc(反应物)为负值,Δc(生成物)为正值,
而v是标量,只有正值,所以在计算反应速率时,
Δc反应物 v(反应物)=- Δt
Δc生成物 v(生成物)= Δt 。
(2)运用同一反应中“速率之比等于化学计量数之比”的规律进行计算。 对于一个化学反应:mA+nB===pC+qD,v(A)=-ΔcΔAt ,v(B)=-ΔcΔtB, v(C)=ΔcΔtC,v(D)=ΔcΔDt ,且有:vmA=vnB=vpC=vqD。
b-nmx c+pmx
再利用化学反应速率的定义求算 v(A)=xt mol·L-1·s-1; v(B)=mnxt mol·L-1·s-1; v(C)=mpxt mol·L-1·s-1。 ②计算中注意以下量的关系: 对反应物:c(起始)-c(转化)=c(某时刻); 对生成物:c(起始)+c(转化)=c(某时刻);
人教版化学《化学反应速率》完美课件

[例1] 在2升的密闭容器中加入1molN2和3H2可发生下列可逆反应:
N2(g) + 3H2(g)
2NH3 (g) 。 5分钟时测得生成了1molNH3,
求:①5分钟末容器中各物质的浓度; (H2)V(NH3)各是多少?
人教版化学高中选修四第2章第1节_化 学反应 速率( 共24张P PT)
人教版化学高中选修四第2章第1节_化 学反应 速率( 共24张P PT)
[难点突破] 对于同一个反应,用不同物质来表示反应
速率时,数值是不一样的,所以应注明是由哪种物质
表示的。 例如:2SO2 + O2
V2O
5
500 ℃
2SO3
化学反应速率常用单位: mol/(L·s) 或 mol/(L·min)。
2.数学表达式:
△c V=
△t
或 V=
△n V(体积)△t
3.单位: mol/(L·s)、 mol/(L·min) 、mol/(L·h)。
4.注意事项:
①中学阶段的化学反应速率是指平均速率,只取正值, 不取负值。
②浓度只适用于溶液或气体,而不适用于固态和纯液态 物质,因这些物质的浓度为常数,它们的反应速率也视 为常数,不用这物质表示反应速率。如纯水、纯硫酸、 BaSO4固体等。
[计算规律]在同一个反应里,虽然用不同的物质表示的 化学反应速率不一定相同,但是它们表示的意义相同, 且各物质表示的速率比等于该反应方程式的系数比。 例如:对于反应:
mA+nB = pC+qD V(A)∶V(B)∶V(C)∶V(D)=m∶n∶p∶q =△ n(A):△ n(B):△ n(C):△ n(D) =△ C(A):△ C(B):△ C(C):△ C(D) = △ v(A):△ v(B):△ v(C):△ v(D) [重要结论]同样一个反应速率,用不同物质表示时,数 值可能相同,也可能不同,数值之比等于对应的化学方 程式中的________________________。
【人教版】高中化学选修4知识点总结:第二章化学反应速率和化学平衡

第二章化学反应速率和化学平衡一、化学反应速率课标要求1、掌握化学反应速率的含义及其计算2、了解测定化学反应速率的实验方法要点精讲1、化学反应速率(1)化学反应速率的概念化学反应速率是用来衡量化学反应进行的快慢程度的物理量。
(2)化学反应速率的表示方法对于反应体系体积不变的化学反应,通常用单位时间内反应物或生成物的物质的量浓度的变化值表示。
某一物质A的化学反应速率的表达式为:式中——某物质A的浓度变化,常用单位为mol·L-1。
——某段时间间隔,常用单位为s,min,h。
υ——物质A的反应速率,常用单位是mol·L-1·s-1,mol·L-1·s-1等。
(3)化学反应速率的计算规律①同一反应中不同物质的化学反应速率间的关系同一时间内,用不同的物质表示的同一反应的反应速率数值之比等于化学方程式中各物质的化学计量数之比。
②化学反应速率的计算规律同一化学反应,用不同物质的浓度变化表示的化学反应速率之比等于反应方程式中相应的物质的化学计量数之比,这是有关化学反应速率的计算或换算的依据。
(4)化学反应速率的特点①反应速率不取负值,用任何一种物质的变化来表示反应速率都不取负值。
②同一化学反应选用不同物质表示反应速率时,可能有不同的速率数值,但速率之比等于化学方程式中各物质的化学计量数之比。
③化学反应速率是指时间内的“平均”反应速率。
小贴士:①化学反应速率通常指的是某物质在某一段时间内化学反应的平均速率,而不是在某一时刻的瞬时速率。
②由于在反应中纯固体和纯液体的浓度是恒定不变的,因此对于有纯液体或纯固体参加的反应一般不用纯液体或纯固体来表示化学反应速率。
其化学反应速率与其表面积大小有关,而与其物质的量的多少无关。
通常是通过增大该物质的表面积(如粉碎成细小颗粒、充分搅拌、振荡等)来加快反应速率。
③对于同一化学反应,在相同的反应时间内,用不同的物质来表示其反应速率,其数值可能不同,但这些不同的数值表示的都是同一个反应的速率。
第二章《化学反应速率和化学平衡》归纳与整理课件-高二化学人教版选修4

(人教版选修4)第二章《化学反应速率和化学平衡》
2. (1)下列方法中可以证明2 HI (g)
H2 (g)+I2
(g)已达平衡状②态⑥的⑨是_________(填序号)
①单位时间内生成n mol H2的同时生成n mol HI;
②一个H—H键断裂的同时有两个H—I键断裂;③ (HI)=
(I2)时;④v反(H2应) v速(I2) 率 v(H2 I)
(人教版选修4)第二章《化学反应速率和化学平衡》
【知识点一】化学反应速率—化学反应的快慢
(人教版选修4)第二章《化学反应速率和化学平衡》
【对应训练】一定条件下,通过下列反应可实现燃煤烟
气中的硫的回收:SO2(g)+2CO(g) 2CO2(g)+S(l)
成Δ功H往往<偏0向。于有准一备的定人 温度下,在容积为2 L的恒容密闭容器中,1
任何温度都能自发
<0
<0 高温>0,低温<0 较低温度能自发
(人教版选修4)第二章《化学反应速率和化学平衡》
【对应训练】1.一定温度下,可逆反应aX(g)+bY(g) cZ(g)在一密闭容器内达到平衡后,t0时刻改变某一外
界变化,化学反应速率(v)随时间(t)的变化如图所示。则 下列说法正确的是( )
3.通过模型构建、证据推理,形成解决化学平衡问题的 基本思路和方法,提高分析问题和解决问题的能力。运用 化学视角观察生活、生产和社会中有关化学反应速率的问 题,培养严谨的学习态度和思维习惯。
(人教版选修4)第二章《化学反应速率和化学平衡》
【情景导入】通过前面新课的学习我们知道影响化学反应 速率(化学反应的快慢)的因素包括内因和外因。内因是 指反应物本身的性质;外因包括浓度、温度、压强、催化 剂、反应物颗粒大小等。同时,可逆反应在一定条件下反 应达到平衡状态(化学反应的限度)时,正、逆反应速率 相等,反应混合物中各组分含量保持不变。若改变这些外 界条件,平衡会发生移动,直至建立新的平衡状态。同时, 化学反应还有自发从高能量向低能量,从有序向无序(熵 增原理)反应的倾向,因此我们可以利用综合判据判断反 应进行的方向。那么这些知识的本质及联系是什么呢?我 们将通过本章的归纳与整理作进一步探究。
人教版高中化学选修4第二章《化学反应速率和化学平衡》知识点归纳
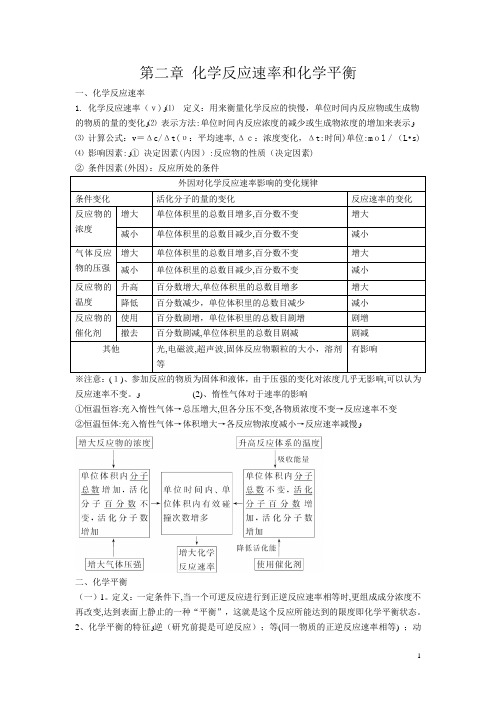
第二章化学反应速率和化学平衡一、化学反应速率1. 化学反应速率(v)ﻭ⑴定义:用来衡量化学反应的快慢,单位时间内反应物或生成物的物质的量的变化ﻭ⑵表示方法:单位时间内反应浓度的减少或生成物浓度的增加来表示ﻭ⑶计算公式:v=Δc/Δt(υ:平均速率,Δc:浓度变化,Δt:时间)单位:mol/(L•s)⑷影响因素:ﻭ①决定因素(内因):反应物的性质(决定因素)②条件因素(外因):反应所处的条件外因对化学反应速率影响的变化规律条件变化活化分子的量的变化反应速率的变化反应物的浓度增大单位体积里的总数目增多,百分数不变增大减小单位体积里的总数目减少,百分数不变减小气体反应物的压强增大单位体积里的总数目增多,百分数不变增大减小单位体积里的总数目减少,百分数不变减小反应物的温度升高百分数增大,单位体积里的总数目增多增大降低百分数减少,单位体积里的总数目减少减小反应物的催化剂使用百分数剧增,单位体积里的总数目剧增剧增撤去百分数剧减,单位体积里的总数目剧减剧减其他光,电磁波,超声波,固体反应物颗粒的大小,溶剂等有影响※注意:(1)、参加反应的物质为固体和液体,由于压强的变化对浓度几乎无影响,可以认为反应速率不变。
ﻭ(2)、惰性气体对于速率的影响①恒温恒容:充入惰性气体→总压增大,但各分压不变,各物质浓度不变→反应速率不变②恒温恒体:充入惰性气体→体积增大→各反应物浓度减小→反应速率减慢ﻭ二、化学平衡(一)1。
定义:一定条件下,当一个可逆反应进行到正逆反应速率相等时,更组成成分浓度不再改变,达到表面上静止的一种“平衡”,这就是这个反应所能达到的限度即化学平衡状态。
2、化学平衡的特征ﻭ逆(研究前提是可逆反应);等(同一物质的正逆反应速率相等) ;动(动态平衡)定(各物质的浓度与质量分数恒定);变(条件改变,平衡发生变化) 3、判断平衡的依据判断可逆反应达到平衡状态的方法和依据例举反应mA(g)+nB(g)C(g)+qD(g)混合物体系中各成分的含量①各物质的物质的量或各物质的物质的量的分数一定平衡②各物质的质量或各物质质量分数一定平衡③各气体的体积或体积分数一定平衡④总体积、总压力、总物质的量一定不一定平衡正、逆反应速率的关系①在单位时间内消耗了mmolA同时生成m molA,即V(正)=V(逆)平衡②在单位时间内消耗了nmolB同时消耗了p molC,则V(正)=V(逆)平衡③V(A):V(B):V(C):V(D)=m:n:p:q,V(正)不一定等于V(逆)不一定平衡④在单位时间内生成nmolB,同时消耗了q molD,因均指V(逆)不一定平衡压强①m+n≠p+q时,总压力一定(其他条件一定) 平衡②m+n=p+q时,总压力一定(其他条件一定) 不一定平衡混合气体平均相对分子质量Mr①Mr一定时,只有当m+n≠p+q时平衡②Mr一定时,但m+n=p+q时不一定平衡温度任何反应都伴随着能量变化,当体系温度一定时(其他不变)平衡体系的密度密度一定不一定平衡其他如体系颜色不再变化等平衡(二)影响化学平衡移动的因素1、浓度对化学平衡移动的影响(1)影响规律:在其他条件不变的情况下,增大反应物的浓度或减少生成物的浓度,都可以使平衡向正方向移动;增大生成物的浓度或减小反应物的浓度,都可以使平衡向逆方向移动(2)增加固体或纯液体的量,由于浓度不变,所以平衡不移动ﻭ(3)在溶液中进行的反应,如果稀释溶液,反应物浓度减小,生成物浓度也减小,V正减小,V逆也减小,但是减小的程度不同,总的结果是化学平衡向反应方程式中化学计量数之和大的方向移动。
新人教版化学选修4第二章《化学反应速率与化学平衡》复习课件

( L.min )、 mol/(L.s)
数学表达式: v= △C/△t ★★★三步骤法(或叫三段式)计算:
注意问题∶
• 不同物质的速率的比值一定等于化学方 程式中相应的化学计量数之比. • 化学反应速率一般不能用固体或纯液体 表示。
练习
1、合成氨的反应N2+3H22NH3在某温度下各物 质的浓度平衡是:[N2]=3mol· L-1, [H2]=9mol· L-1,[NH3] =4mol· L-1求该反应的平衡常 数和N2、H2的初始浓度。 2、已知CO+H2OH2+CO2;此反应在773K时平 衡常数K=9,如反应开始时 C(H2O)=C(CO)=0.020mol· L-1求CO的转化率。
二、影响化学反应速率的重要因素
1、浓度对反应速率的影响 内容:
其它条件不变,增加反应物浓度加快化学 反应速率。
原因:
反应物浓度增大 有效碰撞 次数增多
单位体积内活 化分子数增加 反应速率加快
2、压强对反应速率的影响
内容:
对于气体反应来说,增大压强相当于增大反 应物的浓度,反应速率加快.
原因:增大压强
高温度,会使化学平衡向着吸热反应的方向 移动;降低温度,会使化学平衡向着放热反 应的方向移动。
△压强∶在其它条件不变的情况下,
对于反应前后气体体积改变的反应 ,增
大压强,会使化学平衡向着气体体积缩
小的方向移动;减小压强,会使化学平
衡向着气体体积增大的方向移动。 △催化剂∶催化剂只能使正逆反应速 率等倍增大,改变反应到达平衡所需的时 间,不能使化学平衡移动。
总结论:向反应体系输入能量,都可 以改变化学反应速率 原因:反应体系内活化分子数或活化 分子百分数提高,有效碰撞次数增加, 从而加快化学反应速率。
人教版高中化学选择性必修第1册 第二章 化学反应速率与化学平衡 第一节 化学反应速率

5.在一密闭容器中充入1 mol I2和1 mol H2,压强为p,并在一定
温度下使其发生反应:H2(g)+I2(g)
2HI(g)。
(1)保持容器容积不变,向其中充入1 mol H2,反应速率
。
(2)升高温度,反应速率
。
(3)扩大容器容积,反应速率
。
答案:(1)增大 (2)增大 (3)减小
v(B)=0.60 mol·L-1·min-1,然后根据反应速率与对应物质化学
计量数之比的大小进行判断。由化学方程式
A(g)+3B(g)══2C(g)+2D(g)得出:
①
③
()
()
=0.15
()
-1
-1
mol·L ·min ② =0.20
=0.20 mol·L-1·min-1④
()
H2O
c/(mol·L-1)
V/mL
c/(mol·L-1)
V/mL
0.1
0.1
0.1
10
5
10
0.1
0.5
0.1
5
10
5
实验现象比较:实验1与2比较,温度相同条件下实验2中
c(H2SO4)大,先出现浑浊;实验1与3比较,溶液浓度相同条件下
③v(A)=v(C)=×0.40 mol·L-1·min-1=0.20 mol·L-1·min-1,
④v(A)=v(D)=×0.45 mol·L-1·min-1=0.225 mol·L-1·min-1,
故反应在不同情况下进行的快慢顺序为④>③=②>①。
解法二:首先将反应速率单位统一为mol·L-1·min-1,则②
新教材高中化学第2章化学反应速率与化学平衡本章总结课件新人教版选择性必修1ppt

(3)百分含量(或转化率)—压强(温度)—温度(压强)图像:
解题原则:“定一议二”。
在化学平衡图像中,包括纵坐标、横坐标和曲线所表示的三个变量, 分析方法是确定其中一个变量,讨论另外两个变量之间的关系。如图Ⅰ 中确定压强为105 Pa或107 Pa,则生成物C的百分含量随温度T的升高而 逐渐减小,说明正反应是放热反应;再确定温度T不变,作横坐标的垂 线,与压强线出现两个交点,分析生成物C的百分含量随压强p的变化 可以发现,压强增大,生成物C的百分含量增大,说明正反应是气体总 体积减小的反应。同理也可分析图像Ⅱ。
C.丁>乙>丙=甲
D.丁>丙>乙>甲
【答案】A
【解析】根据所给数据,甲、丙为等效平衡,则其中n(CO)相等。 乙相当于甲平衡后,再加入a mol CO2,平衡右移,n(CO)增大,丁把 CO、H2O折合成反应物相当于2a mol CO2、a mol H2,和乙等效,所以 乙=丁>丙=甲。
化学平衡常数的应用方向
3.等效平衡规律
对于可逆反应 aA(g)+bB(g) cC(g)+dD(g)
反应特点
a+b≠c+d
a+b=c+d
条件
等温等容
等温等压
等温等容 等温等压
换算为化学方 换算为化学方
程式同一边物 程式同一边物 换算为化学方程式同一边 起始投料
质,其“量” 质,其“量” 物质,其“量”成比例
相同
成比例
反应特点
在1.5 L的密闭容器中通入2 mol N2和3 mol H2,混合气体在一定 温度下发生反应。达到平衡时,容器内压强为反应开始时的0.8,则该
高二化学选修4课件:第2章 化学反应速率和化学平衡

高中化学第二章化学反应速率和化学平衡第一节化学反应速率课件新人教版选修

【解析】选D。
2A(g)+3B(g) xC(g)+D(g)
初始浓度(mol·L-1)
5
3
0
0
转化浓度(mol·L-1)
2 min浓度(mol·L-1) 4 1.5 0.5x 0.5
2 min末时,A和B的浓度之比为4∶1.5=8∶3,故A错误;C的反应速率 为 0.5x mo=l 0L.15 mol·L-1·min-1,解得x=2,故B错误;2 min末时,A的消耗浓度
【解析】选C。由图可知,反应为3B+4C 6A+2D,故A错误;反应进行到1 s时,
由速率之比等于化学计量数之比,可知v(A)=3v(D),故B错误;反应进行到6 s
1 m ol 0.4 m ol
时,B的平均反应速率为
2 L=0.05 mol·L-1·s-1,故C正确;反应进
6s
行到6 s时,达到平衡,同种物质的正逆反应速率相等,由化学计量数可知,各物
关键能力·合作学习
知识点一 化学反应速率的深度理解与计算 1.表示化学反应速率的注意事项 (1)在同一化学反应中,选用不同物质表示化学反应速率,其数值可能相同也可 能不相同,但它们表示的意义却是完全相同的。因此,表示化学反应速率时,必 须指明用哪种物质作标准。 (2)由于在反应中纯液体和固体的浓度是恒定不变的,因此一般不用纯液体或固 体来表示化学反应速率。
(3)在同一个化学反应中,无论选用反应物还是生成物来表示化学反应速率,其 值均为正值。 (4)化学反应速率通常是指某一段时间内的平均反应速率,而不是瞬时反应速率。
2.化学反应速率计算常用“3”方法 (1)定义式法:利用公式v= c n计算化学反应速率,也可以利用公式计算物质
t Vt
【课件】第2章化学反应速率与化学平衡+高二上学期化学人教版(2019)选择性必修1

实验步骤 变量为温度
1、用两支试管中,装入2mL5%的H2O2溶液; 2、分别滴入1~2滴1mol/LFeCl3溶液; 3、将一支试管放入40℃的热水中。
反应条件 实验现象 反应速率比较
热水中
产生大量气泡 快
常温
少量气泡 慢
得出结论
在其他条件不变情况下,温度升高 化学反应速率加快。
实验探究2:催化剂对化学反应速率的影响
笔记
影响化学反应速率的外界因素
1、内因(根本原因):由反应物的性质决定 2、外因:温度、催化剂、浓度、压强(气体)、表
面积等等
① 其它条件不变时,升高温度,可以增大反应速率;反之减小
② 催化剂能够改变化学反应速率
③ 其它条件不变时,增大反应物的浓度,化学反应速率增大 反之减小
④ 其它条件不变时,增大物质的表面积,反应速率增大;反 之减小
铁粉表面积比较大,所以比较快
外因
影响化学反应速率的外界因素:
探究1:探究温度对化学反应速率的影响
探究2:探究催化剂对化学反应速率的影响
控制变量法:保持一个或多个量不变,调整另一个或 多个量改变,来探究这些量之间的关系 单一变量法:保持多个变量不变,调整一个变量改变 ,来探究这个变量之间的关系。
实验探究1:温度对化学反应速率的影响
化学反应速率与化学平衡
课时目标
1、认识化学反应速率定义 2、学会用三段式计算化学反应速率 3、熟悉影响反应速率的因素以及规律
速率、平衡图像问题的解题思维
1.看图像 一看面:坐标的意义。 二看线:线的变化趋势 三看点:特殊点的意义。如起点、交点、拐点、终点
2.想规律 联想外界条件对化学反应速率和化学平衡的影响规律。
⑤ 其它条件不变时,增大压强,反应速率增大;反之减小 (有气体参与的反应)
人教版化学选修四第二章第一节化学反应速率最新课件PPT

c/mol·L-1
是
;
生成物是
;
8B 6A
(2)在2min内A、 4 C B、C三者的反应速 2
率值各是多少?该 O 反应的化学方程式
2 t/min
【化学反应速率的计算与比较】 例1:
在 2 L 密闭容器中,在一定条件下进行合
成氨的反应 3H2+N2
2NH3,先加入 H2 和
N2 各 2 mol,反应经 2 min 后,测得 N2 的物
3、溶液中,常利用颜色深浅和显色物质浓度 间的正比关系来跟踪反应的过程和测量反应速 率。
测量锌与硫酸反应的速率 [实验用品]:锥形瓶、双孔塞、分液漏斗、直角导气 管、50 mL注射器、铁架台、秒表、锌粒、1 mol·L-1 的硫酸、4 mol·L-1的硫酸 [实验步骤]:取两套装置,在 锥形瓶内各盛有 2 g 锌粒(颗 粒大小基本相同),分别加入 40 mL 1 mol·L-1和40 mL 4 mol·L-1的硫酸,测量收集10 mL H2所用的时间。
D
A、4/5v(NH3)=v(O2)
B、5/6v(O2)=v(H2O)
C、2/3v(NH3)=v(H2O)
D、 4/5v(O2)=v(NO)
3.在密闭容器中 A 与 B 反应生成 C,其
反应速率分别用v(A)、v(B)、v(C)表示。
已知v(A)、v(B)、v(C)之间有以下关系
2v(B)==3v(A),3v(C)==2v(B)。则此反应
结论: 同一反应各物质的反应速率之比等于其化学计量数 之比。
二、化学反应的速率是通过实验测定的。
(1)测定原理 利用化学反应中与某一种化学物质的浓度 (或质量)相关的性质进行测定
(2)测定方法有∶
