2019高考化学大一轮复习 第4章 非金属及其化合物 4-1 碳、硅及无机非金属材料练习
高考化学大一轮复习第4章非金属及其化合物4_1碳硅及无机非金属材料课件新人教版

板块一 主干层级突破
自然
考点 1 脂肪烃的结构和性质
考点 1 碳、硅单质及其氧化物的性质 1.碳单质的存在、性质和用途
2.硅单质的存在、质和制备 (1)结构及物理性质
(2)化学性质 硅的化学性质不活泼,常温下不能被浓硫酸、浓硝酸等 强氧化剂氧化,只能与 F2、氢氟酸、强碱溶液反应;在加热 条件下,能与 O2、Cl2 等少数非金属单质化合。 写出下列相关反应的化学方程式:
水玻璃 ,有黏性,水溶液显碱性。
②它能与较强的酸反应,如与盐酸反应:
Na2SiO3+2HCl===2NaCl+H2SiO3↓ ;与 CO2 水溶液反
应: Na2SiO3+CO2+H2O===H2SiO3↓+Na2CO3
。
③用途:黏合剂(矿物胶),耐火阻燃材料。
3.无机非金属材料 (1)传统无机非金属材料 如水泥、玻璃、陶瓷等硅酸盐材料。
B.Na2CO3、Na2SiO3 D.SiO2
解析 将足量 CO2 气体通入水玻璃中,发生反应:2CO2
+Na2SiO3+2H2O===H2SiO3↓+2NaHCO3;加热蒸干高温
灼烧时发生反应:H2SiO3==△===H2O+SiO2;2NaHCO3==△===
Na2CO3
+
CO2↑
+
H2O
;
SiO2
解析 二氧化硅能与氢氟酸反应,A 错误;光导纤维的 成分是 SiO2,是酸性氧化物,可与强碱溶液反应,C 错误; 二氧化硅中不存在分子,D 错误。
题组二 硅酸盐的结构和性质
3.将足量 CO2 气体通入水玻璃(Na2SiO3 溶液)中,然后 加热蒸干,再在高温下充分灼烧,最后得到的固体物质是
() A.Na2SiO3 C.Na2CO3、SiO2
2019届高考化学大一轮复习讲义:第4章 第1节 碳、硅及其化合物 Word版含解析

第四章非金属及其化合物第一节碳、硅及其化合物[基础知识整合]1.碳、硅单质的存在形式、物理性质和用途碳、硅在参与化学反应时,一般表现还原性。
[应用体验]1.从元素周期表的位置看,碳和硅均为ⅣA 族元素,自然界中有碳的多种单质存在,自然界中有硅的单质吗?为什么?[提示] 没有。
因为硅有很强的亲氧性,在地壳形成时硅与氧易结合,难分离,因而硅在自然界中主要以氧化物和硅酸盐的形式存在。
2.写出由SiO 2制备纯硅的化学方程式。
[提示] SiO 2+2C=====高温Si(粗)+2CO ↑, Si(粗)+2Cl 2=====△SiCl 4,SiCl 4+2H 2=====高温Si +4HCl 。
[考点多维探究]角度1 碳、硅的性质和应用1.科学家在不断深入的研究中,发现了一系列新的碳单质,对碳单质的研究已发展成一门独立的科学——碳科学。
下列关于碳单质的叙述正确的是( )A .碳的各种单质互称为碳的同素异形体B .碳元素的各种单质结构虽然不同,但性质差别不大C .碳元素的单质性质不同,其用途相同D .碳元素的单质只有金刚石与石墨A [碳的各种单质由于组成结构的不同,性质、应用也不一定相同。
]2.(2017·济南模拟)有些科学家提出硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用。
下列有关硅的说法中,不正确的是( )【导学号:95812062】A .高纯度的硅广泛用于制作计算机芯片B .硅可由二氧化硅还原制得C .低温时,硅与水、空气和酸不反应,但能与氢氟酸反应D .自然界中硅的储量丰富,自然界中存在大量的单质硅D [硅为亲氧元素,在自然界中不存在游离态的单质。
]3.下列说法正确的是( )A .单质――→+O 2氧化物――→+H 2O 酸或碱――→+NaOH 或HCl盐,碳或硅单质可以按上述关系进行转化B .若a 、b 、c 分别为Si 、SiO 2、H 2SiO 3,则可以通过一步反应实现转化:b c ―→aC .太阳能电池板中的硅在元素周期表中处于金属元素与非金属元素的交界位置D .单质硅常用于制造光导纤维C [A 项,SiO 2与H 2O 不反应;B 项,SiO 2不能一步生成H 2SiO 3;D 项,SiO 2制造光导纤维。
近年高考化学第4章(非金属及其化合物)第1节碳、硅及无机非金属材料考点(1)碳、硅及其氧化物讲与练

2019高考化学第4章(非金属及其化合物)第1节碳、硅及无机非金属材料考点(1)碳、硅及其氧化物讲与练(含解析)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2019高考化学第4章(非金属及其化合物)第1节碳、硅及无机非金属材料考点(1)碳、硅及其氧化物讲与练(含解析))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2019高考化学第4章(非金属及其化合物)第1节碳、硅及无机非金属材料考点(1)碳、硅及其氧化物讲与练(含解析)的全部内容。
错误!李仕才考点一碳、硅及其氧化物1.碳、硅单质的性质(1)单质的结构、存在形态、物理性质和用途(2)碳和硅的化学性质(3)硅的工业制法2.碳、硅的氧化物(1)一氧化碳①物理性质:无色气体,有毒,难溶于水。
②化学性质a.燃烧:2CO+O2错误!2CO2,淡蓝色火焰; b.还原CuO:CuO+CO错误!Cu+CO2(冶炼金属)。
(2)二氧化碳和二氧化硅的比较判断正误(正确的打“√",错误的打“×”)1.碳和硅两种元素共有两种单质。
( ×)2.12C、13C、14C是碳的三种同素异形体。
( ×)3.硅单质广泛存在于自然界中,天然存在的单质硅叫硅石.( ×)4.常温下,硅很稳定,不能跟酸、碱溶液反应。
( ×)5.硅的导电性介于导体和绝缘体之间,是良好的半导体材料.(√)6.C60属于原子晶体,熔点高,硬度大。
(×)7.将足量CO2通入含K+、SiO错误!、Cl-、NO错误!的溶液中,离子将不能大量共存.(√)8.常温下,SiO2既能与KOH溶液反应又能与稀盐酸反应。
2019年高考化学一轮精品复习讲义:第四章 非金属及其化合物
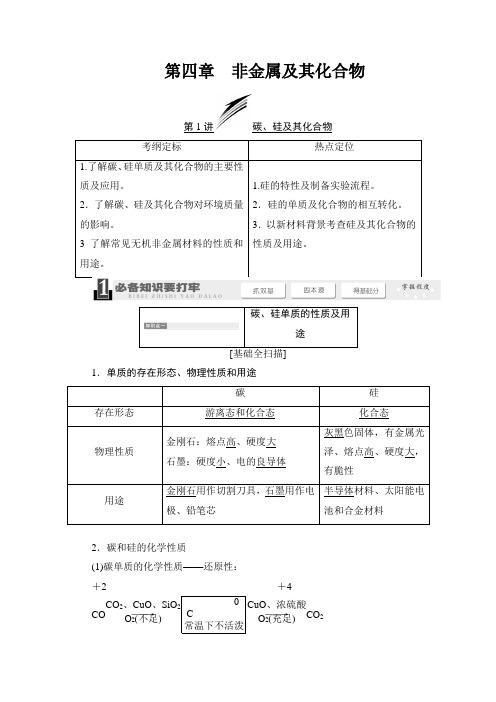
第四章 非金属及其化合物第1讲碳、硅及其化合物1.单质的存在形态、物理性质和用途2.碳和硅的化学性质(1)碳单质的化学性质——还原性:+2 +4CO ――→CO 2、CuO 、SiO 2O 2(不足) 0 C 常温下不活泼――→CuO 、浓硫酸O 2(充足)CO 2①与O 2反应:O 2不足:2C +O 2=====点燃2CO ;O 2充足:C +O 2=====点燃CO 2。
②与其他物质反应:a .与CuO 反应:2CuO +C=====△2Cu +CO 2(可用于某些金属的冶炼);b .与CO 2反应:CO 2+C=====高温2CO ;c .与水蒸气反应:C +H 2O(g)=====高温CO +H 2(制水煤气);d .与浓硫酸反应:C +2H 2SO 4(浓)=====△CO 2↑+2SO 2↑+2H 2O 。
(2)硅的化学性质——还原性:①与氢氟酸反应:Si +4HF===SiF 4↑+2H 2↑;②与NaOH 溶液反应:Si +2NaOH +H 2O===Na 2SiO 3+2H 2↑;③与O 2反应:Si +O 2=====△SiO 2。
[认知无盲区](1)碳单质的化学性质主要表现为还原性,能被氧化剂氧化为+2价或+4价的化合物。
(2)工业上制备硅的反应:①粗硅的制备:SiO 2+2C=====高温Si +2CO ↑ ②由粗硅制纯硅:Si(粗)+2Cl 2=====△SiCl 4SiCl 4+2H 2=====高温Si(纯)+4HCl(3)用石英砂和焦炭制备粗硅的反应必须要隔绝空气在电炉中进行,得到的氧化产物是CO 而不是CO 2。
[练习点点清]1.将碳、硅单质的物理性质和用途用短线连接起来。
答案:①—c,②—a,③—e,④—b,⑤—d2.已知A是灰黑色1的、有金属光泽的固体单质。
根据如图所示的物质之间的转化关系,回答下列有关问题。
(1)写出B、C两物质的名称:B______________________,C___________________________________________。
2019版高考化学一轮复习 第四章 非金属及化合物 4.1 无机非金属材料的主角——硅

如与Na2SiO3反应: ___C_O_2+_N_a2_SiO_3_+H_2O_=_==_= ____ ___H_2S_iO_3↓_+_Na_2C_O_3 ___ 或Na2SiO3+2H2O+2CO2 (足量)====H2SiO3↓+ 2NaHCO3
如与Na2CO3反 应:_____ ____S_iO_2高+__温____ __Na_2C_O_3 _=_==_=____ _ Na2SiO3+CO2↑
只与氢氟酸反应: ___S_iO_2+_4_H_F=_=_==__ ___________
SiF4↑+2H2O
___S_iO_2+_2_N_aO_H_=_=_==__ ___N_a2_Si_O_3+_H_2O__(盛碱 性溶液的试剂瓶 用_____塞)
橡胶
11
二氧化碳
二氧化硅
化 学 性 质
④与盐 反应
K12教育课件
35
(4)氧化物之间以“·”隔开;系数配置出现分数 应化为整数。例如:长石:KAlSi3O8不能写成 K2O· Al2O3·3SiO2,应写成K2O·Al2O3·6SiO2。
1
1
2
2
K12教育课件
36
【题组过关】
1.(RJ必修1·P80改编题)能证明碳酸比硅酸酸性强的
实验事实是
()
SiO32
O3
K12教育课件
22
【解析】选C。红宝石的主要成分是Al2O3,钻石的主要成分是单质碳,玛瑙和水晶的主 要成分是SiO2,A错误;SiO2是酸性氧化物,B错误;酸性:H2CO3>H2SiO3,故可用Na2SiO3溶液 与CO2反应制H2SiO3凝胶,C正确;高纯度的SiO2对光有很好的折射和全反射作用,可用作 光导纤维,而光电池由单质硅制成,D错误。
近年高考化学总复习第四章非金属及其化合物4-1-1考点一碳、硅及其氧化物学后即练1新人教版(202

2019高考化学总复习第四章非金属及其化合物4-1-1 考点一碳、硅及其氧化物学后即练1 新人教版编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2019高考化学总复习第四章非金属及其化合物4-1-1 考点一碳、硅及其氧化物学后即练1 新人教版)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2019高考化学总复习第四章非金属及其化合物4-1-1 考点一碳、硅及其氧化物学后即练1 新人教版的全部内容。
4—1—1 考点一 碳、硅及其氧化物1.由下列实验事实得出的结论正确的是( )A .由SiO 2不能与水反应生成H 2SiO 3,可知SiO 2不是酸性氧化物B .由SiO 2+2C=====高温Si +2CO↑,可知碳的非金属性大于硅C .CO 2通入Na 2SiO 3溶液产生白色沉淀,可知酸性H 2CO 3>H 2SiO 3D .SiO 2可与NaOH 溶液反应,也可与氢氟酸反应,可知SiO 2为两性氧化物解析:SiO 2是酸性氧化物,A 项错误;反应SiO 2+2C 错误!Si +2CO↑不能说明碳的非金属性比硅强,该反应能发生是因为生成CO 气体,它的逸出促进了反应进行,B 项错误;CO 2通入Na 2SiO 3溶液中生成H 2SiO 3胶体,符合强酸制弱酸的规律,证明酸性H 2CO 3>H 2SiO 3,C 项正确;D 项中SiO 2除氢氟酸外不能与其他的酸反应,SiO 2为酸性氧化物,不具有两性,D 项错误.答案:C2.下列叙述中正确的是( )A .因为Na 2CO 3+SiO 2错误!Na 2SiO 3+CO 2↑,所以硅酸的酸性比碳酸强B .碳和硅都是ⅣA 族的元素,所以二氧化碳和二氧化硅的物理性质相似C .二氧化硅既溶于氢氧化钠溶液又溶于氢氟酸,所以二氧化硅是两性氧化物D .二氧化硅和二氧化碳都是酸性氧化物,但二氧化硅不能和水反应生成硅酸解析:A 项中反应不是在水溶液中进行,产物中有气体生成,故不能通过此反应判断H 2CO 3与H 2SiO 3的酸性强弱,A 项错误;CO 2和SiO 2的物理性质差异较大,B 项错误;SiO 2与氢氟酸的反应不属于碱性氧化物与酸生成盐和水的反应,在此反应中SiO 2并没有表现出碱性氧化物的性质,C 项错误。
高中化学第四章 非金属及其化合物知识点总结

第四章 非金属及其化合物第一讲 碳、硅及无机非金属材料考点1 碳、硅单质及其重要化合物的性质一、碳、硅的单质1.存在:自然界中碳元素既有游离态,又有化合态,而硅元素因有亲氧性,所以仅有化合态。
碳单质主要有金刚石、石墨、C 60等同素异形体,硅单质主要有晶体硅和无定形硅两大类。
2.碳、硅单质的结构、物理性质与用途的比较碳、硅在参与化学反应时,一般表现还原性。
碳⎩⎪⎪⎨⎪⎪⎧与O 2反应⎩⎪⎨⎪⎧O 2(足量):C +O 2=====点燃CO 2O 2(不足):2C +O 2=====点燃2CO 与氧化物反应⎩⎪⎨⎪⎧CuO :2CuO +C=====△2Cu +CO 2↑(冶炼金属)SiO 2:SiO 2+2C=====高温Si +2CO ↑(制取粗硅)H 2O :C +H 2O (g )=====高温CO +H 2(制取水煤气)与强氧化性酸反应⎩⎪⎨⎪⎧浓H 2SO 4:C +2H 2SO 4(浓)=====△CO 2↑+2SO 2↑+2H 2O 浓HNO 3:C +4HNO 3(浓)=====△CO 2↑+4NO 2↑+2H 2O 二、碳、硅的氧化物 1.CO 的性质(1)物理性质:无色无味的气体,难溶于水。
能使人中毒的原因是其与人体中血红蛋白相结合,因缺氧而中毒。
(2)化学性质①可燃性:2CO +O 2=====点燃2CO 2。
②还原性:CO 还原Fe 2O 3的反应为Fe 2O 3+3CO=====高温2Fe +3CO 2。
2.二氧化碳与二氧化硅的比较 (1)物理性质①熔、沸点:CO 2的熔、沸点比SiO 2的熔、沸点低。
②溶解性:CO 2可溶于水,SiO 2不溶于水。
(2)化学性质CO 2+H 2OH 2CO 3CO 2:化工原料、灭火剂。
干冰用作制冷剂,人工降雨。
SiO 2:制光学仪器、石英玻璃。
水晶可制作饰品,常用来制造通讯材料光导纤维。
考点2 硅酸盐及无机非金属材料一、硅酸和硅酸钠 1.硅酸(H 2SiO 3)硅酸不溶于水,其酸性比碳酸弱,不能使紫色石蕊试液变红色。
2019届高考化学一轮复习(人教版):第4章 基础课1 碳、硅及其化合物 无机非金属材料(含答案) - 副本

个性化学科优化学案考点一 碳、硅及其氧化物1.碳、硅元素的存在形态(1)碳元素在自然界中既有游离态又有化合态。
碳的同素异形体有金刚石、石墨、无定形碳、C 60等。
(2)硅元素在地壳中的含量占第二位,仅次于氧元素,是一种亲氧元素,全部以化合态存在,单质硅有晶体和无定形两种。
2.3.碳、硅原子的最外电子层都是4个电子,位于元素周期表的第ⅣA 族,不容易失电子也不容易得电子,单质化学性质较稳定,但在一定条件下也能与许多物质发生化学反应,一般表现为还原性(如图)。
(1)碳的化学性质(2)硅的化学性质及制取Ⅰ.①与氢氟酸反应:Si+4HF===SiF4↑+2H2↑;②与NaOHSi+2NaOH+H2O===Na2SiO3+2H2↑;③与F2反应:2F2+Si===SiF4;④与O2反应:Si+O2=====△SiO2;⑤与Cl2反应:Si +2Cl2=====△SiCl4。
Ⅱ.工业制法:用焦炭和二氧化硅在电炉中反应得到粗硅,反应的化学方程式为。
从元素周期表的位置看,硅的还原性比碳强,但碳能与SiO2反应制取Si,试从化学平衡的角度认识该反应发生的原因。
4.二氧化碳和二氧化硅的比较物质二氧化硅二氧化碳结构空间立体网状结构,不存在单个分子存在单个分子物理性质硬度大,熔、沸点高,常温下为固体,不溶于水熔、沸点低,常温下为气体,微溶于水化学性质①与水反应不反应CO2+H2O H2CO3②与酸反应只与氢氟酸反应:不反应③与碱反应(盛碱液的试剂瓶用橡胶塞)CO2少量:、CO2过量:④与盐反应如与Na2CO3反应:SiO2+Na2CO3=====高温Na2SiO3+CO2↑如与Na2SiO3反应:Na2SiO3+H2O+CO2(不足)===H2SiO3↓+Na2CO3或Na2SiO3+2H2O+2CO2(足量)===H2SiO3↓+2NaHCO3⑤与碱性氧化物反应如与CaO反应:SiO2+CaO=====高温CaSiO3如与Na2O反应:Na2O+CO2===Na2CO3用途光导纤维、光学仪器、电子部件制饮料、制碳酸盐利用所提供的试剂和方法除去各混合物中的杂质(括号内为杂质)。
高考化学一轮复习第四单元非金属及其化合物4.1无机非金属材料的主角——硅获奖公开课优质课件

考点二
基础梳理
考点突破
1.硅及其化合物的特性
物质
一般规律
硅还原性强于碳
Si
硅及其化合物特性
2C+SiO2
Si+2CO↑
硅可与强碱溶液反应产生
非金属与强碱溶液反应一
H2:Si+2NaOH+H2O
般不产生 H2
Na2SiO3+2H2↑
非金属一般不与非氧化性
Si+4HF
SiF4↑+2H2↑
酸反应
一般非金属单质为绝缘体 硅为半导体,常用于电子元件
-12考点一
考点二
物质
一般规律
酸性氧化物一般与水反应
生成相应的酸
酸性氧化物一般不与酸发
生反应
SiO2
“较强酸制较弱酸”,H2CO3
酸性强于
H2SiO3:
Na2SiO3+CO2+H2O
Na2CO3+H2SiO3↓
H2SiO3 无机酸一般易溶于水
硅酸盐 大多数硅酸盐难溶于水
基础梳理
考点突破
硅及其化合物特性
SiC。
(3)制备纯硅时,石英管不能更换为玻璃管,因为高温条件下玻璃
管会软化。
-16考点一
考点二
基础梳理
考点突破
跟踪训练
1.(2016福建龙岩教学质量检查)Si、SiO2广泛用于制造晶体管、
光导纤维等。下列有关说法正确的是( )
A.附着油污的晶体管可用碱液浸泡
关闭
B.光导纤维遇碱会影响光信号传输
晶体管中的硅和二氧化硅可以与碱液反应,所以附着油污的晶体管
考点突破
例1SiO2是一种化工原料,可以制备一系列物质(如图所示)。下列
高考化学 一轮复习 第四章 非金属及其化合物 第一节 碳、硅及无机非金属材料 新人教

题点(二) 硅及其化合物的性质
3.下列说法错误的是
(A)
A.(2015·安徽高考)SiO2 既能和 NaOH 溶液反应,又能和氢氟酸反
应,所以是两性氧化物
B.(2015·江苏高考)下列转化能一步实现:粗硅―高C―温l2→SiCl4―高H―温2→Si
C.(2013·广东高考)SiO2 可与 HF 反应,因而氢氟酸不能保存在玻 璃瓶中
与 CuO 反应:
高温 2CuO+C=====
2Cu+CO2↑ (可用于金属
的冶炼);
高温 与 CO2 反应: CO2====CO+H2 (制水煤气);
△ 与浓硫酸反应: C+2H2SO4(浓) ====CO2↑+2SO2↑+
_2_H__2O_ 。 ②硅的化学性质
H2CO3 酸性强于 H2SiO3 H2SiO3 Na2SiO3+CO2+H2O
===Na2CO3+H2SiO3↓
Na2SiO3+CO2↑ 高温
CaCO3+SiO2=====
CaSiO3+CO2↑
无机酸一般易溶于水
硅酸难溶于水
题点(三) 硅的制备
5.半导体工业中,有一句行话:“从沙滩到用户”,即由 SiO2
被还原,所以碳的还原性强于硅的还原性
选B.项盛A放、NDaO的H反溶应液在时高,温使下用均带生玻成璃了塞气的体磨,口使瓶平衡正移,
近年高考化学总复习第四章非金属及其化合物4-1-1考点一碳、硅及其氧化物学后即练2新人教版(202

2019高考化学总复习第四章非金属及其化合物4-1-1 考点一碳、硅及其氧化物学后即练2 新人教版编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2019高考化学总复习第四章非金属及其化合物4-1-1 考点一碳、硅及其氧化物学后即练2 新人教版)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2019高考化学总复习第四章非金属及其化合物4-1-1 考点一碳、硅及其氧化物学后即练2 新人教版的全部内容。
4—1-1 考点一碳、硅及其氧化物5.用四种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是()解析:A项,CO2+,升温至65 ℃以上,C6H5OH完全溶解,溶液变澄清;B项,CO2+Na2SiO3+H2O===Na2CO3+H2SiO3↓,H2SiO3与CO2不反应,浑浊不会消失;C项,CO2+Ca(ClO)2+H2O===CaCO3↓+2HClO,溶液变浑浊后加入品红溶液,被HClO氧化褪色;D 项,首先,CO2+Ca(OH)2===CaCO3↓+H2O,继续通CO2,生成可溶于水的Ca(HCO3),再加入足量的NaOH,则有2NaOH+Ca(HCO3)2===CaCO3↓+Na2CO3+2H2O,溶2液又变浑浊。
答案:B6.标准状况下,将3。
36 L CO2气体通入200 mL 1。
00 mol·L-1 NaOH 溶液中,充分反应后溶液中c(CO错误!)与c(HCO错误!)的比值为(不考虑CO 错误!、HCO错误!的水解)()A.1∶1 B.1∶2C.2∶1 D.1∶3解析:n(CO2)=错误!=0。
150 mol,n(NaOH)=0.200 L×1。
高考一轮复习-化学 第4章 非金属及其化合物4-1a碳、硅及无机非金属材料 章节练习

高考一轮总复习 ·化学
解析 水晶的主要成分是 SiO2 不是硅酸盐,A 错误; 水玻璃是 Na2SiO3 溶液,属于混合物,B 错误;高纯度的 SiO2 用于制光导纤维,高纯度的 Si 用于制太阳能电池,D 错误。
7
高考一轮总复习 ·化学
4.[2016·兰州测试]下列关于碳和硅的叙述中,正确的 是( )
SiO2+2OH-===SiO23-+H2O
16
高考一轮总复习 ·化学
解析 Na2SiO3 是强电解质,应拆成 Na+、SiO23-,CO2 过量,产物应为 HCO-3 ,A 项正确写法是 SiO23-+2CO2+ 2H2O===H2SiO3↓+2HCO- 3 ;B 项正确写法是 CO2+OH- ===HCO-3 ;C 项,氢氟酸是弱酸,在离子方程式中不能拆 分。
A.①②⑥⑦⑨
B.①⑧⑨
C.②③⑧⑨
D.①④⑤⑧
2
高考一轮总复习 ·化学
解析 合成纤维属于有机高分子材料,②错;2NaOH +SiO2===Na2SiO3+H2O,Na2SiO3 有粘性,可将玻璃瓶塞 与瓶颈粘连,③错;2H++SiO23-===H2SiO3↓,④错;CO2 +H2O+SiO23-===H2SiO3↓+CO23-,⑤错;SiO2 可与 HF 反应,也能与强碱溶液反应,⑥、⑦错,B 正确。
①写出由纯 SiHCl3 制备高纯硅的反应的化学方程式: _S_i_H__C_l_3+__H__2_1=_3=_5=_7=_K=__S_i+__3__H_C__l _。
②整个制备过程必须严格控制无水无氧。SiHCl3 遇水剧 烈反应生成 H2SiO3、HCl 和另一种物质,写出配平的化学反 应方程式:__S_i_H_C__l3_+__3_H__2O__=_=_=_H__2_S_iO__3_+__H_2_↑__+__3_H__C_l_____; H2 还 原 SiHCl3 过 程 中 若 混 入 O2 , 可 能 引 起 的 后 果 是 高 ___温__下__,__H_2_遇___O__2 发 ___生__爆__炸_。
2019版高考化学一轮复习第四章非金属及其化合物第1节无机非金属材料的主角—硅课件

②与其他物质的反应(用化学方程式表示): 高温 2CuO + C===== 2Cu+CO2↑ 与 CuO 反应:_________________________ (可用于 金属的冶炼);
高温 与 CO2 反应:CO __________________ 2+C=====2CO ; 高温 与水蒸气反应:_________________________ C+H2O(g)=====CO+H2 (制水
第四章
非金属及其化合物
第 1 节 无机非金属材料的主角 ——硅
1.了解碳、硅元素单质及其重要化合物的制备方法, 掌握其主要性质及其应用。 2. 了解碳、硅元素单质及其重要化合物对环境的影 响。
考点 1 碳、硅单质重要性质及应用 1.碳、硅的存在形态、结构、物理性质和用途
项目 存在 形态 碳 游离态和化合态
煤气); 与浓硫酸反应:
△ C+2H2SO4(浓)=====CO2↑+2SO2↑+2H2O 。 ___________________________________________
(2)硅的化学性质——还原性。 ①与氢氟酸反应的化学方程式:
Si +4HF===SiF4↑+2H2↑; _______________________
②与 NaOH 溶液反应的化学方程式:Si+2NaOH+ H2O===Na2SiO3+2H2↑;
△ Si+O2=====SiO2 。 ③与 O2 反应:________________
3.硅的制备 (1)原料:二氧化硅、焦炭。 高温 SiO2+2C=====Si+2CO↑。 (2)原理:________________________ 高温 高温 (3)提纯:Si+ 2Cl2=====SiCl4,SiCl4+ 2H2=====Si +4HCl。
高考化学一轮复习第四章第一节碳硅及无机非金属材料课件

氧气)中燃烧获得
解析:由转化关系图可知,X 是二氧化碳,碳酸在常温下就容 易分解生成二氧化碳,故 A 错误,C 正确;在高温的条件下, 碳能与氧化铜反应生成铜和二氧化碳,该反应属于置换反应, 故 B 错误;一氧化碳还可以通过还原氧化铁或还原氧化铜等方 法转化成二氧化碳,故 D 错误。 答案:C
2.将足量 CO2 通入 KOH 和 Ca(OH)2 的混合稀溶液中,生成沉 淀的物质的量(n)和通入 CO2 体积(V)的关系正确的是 ( )
题点练通
题点 一 碳及其化合物的性质
1.(2019·合肥瑶海区模拟)碳和碳的化合物
间的部分转化关系如图所示,下列说法
正确的是
()
A.由碳酸转化成 X 一定要在加热条件下进行
B.由碳转化为 X 一定发生的是化合反应
C.物质 X 一定是二氧化碳
D.若使一氧化碳转化成 X,只能通过一氧化碳在空气(或
ห้องสมุดไป่ตู้
当11<nnKCOOH2<21时,反应①、②都发生,产物为 KHCO3、K2CO3、 H2O。
题点 二 草酸(盐)的实验探究
4.(2018·浙江 11 月选考)已知草酸(H2C2O4)是一种弱酸,157 ℃升华, 170 ℃以上分解可放出 CO2 和 CO;可与酸性 KMnO4 溶液反应; 其钠盐易溶于水,钙盐难溶于水。下列说法正确的是( ) A.草酸受热产生的气体,用足量的 NaOH 溶液充分吸收后,可 收集得到纯净的 CO B.草酸受热产生的气体通过灼热的氧化铜,若出现黑色变红色现 象,则说明产生的气体中一定有 CO C.草酸受热产生的气体直接通入足量的澄清石灰水中,若能产生 白色浑浊现象,则说明产生的气体中一定有 CO2 D.H2C2O4 与酸性 KMnO4 溶液反应的离子方程式为 5H2C2O4+ 2MnO-4 +6H+===2Mn2++10CO2↑+8H2O
2019版高考化学一轮复习 第四章 非金属及其化合物 第一板块 1.1 碳、硅及无机非金属材料

如高温结构陶瓷、生物陶瓷、压电陶瓷等。
微点拨
(1)玻璃中含有二氧化硅,因此氢氟酸可用于雕刻玻璃, 盛放氢氟酸不用玻璃瓶而用塑料瓶。
(2)NaOH 等碱性溶液可以用玻璃瓶盛放,但不能用带 玻璃塞的试剂瓶。
对点练习
1.下列变化中,不能一步实现的是
()
A.Na2SiO3―→H2SiO3
B.H2SiO3―→SiO2
对点练习
1.4G 网络让手机“飞”起来了。手机芯片的核心是硅板,
其成分是
()
A.SiO2 C.H2SiO3
B.Si D.Na2SiO3
解析:手机芯片的核心是硅板,其成分是 Si 单质,故选
项 B 正确。
2.下列关于硅的说法不正确的是
()
A.硅是非金属元素,但它的单质是灰黑色有金属光泽的固体
B.硅的导电性介于金属和绝缘体之间,是良好的半导体材料
硅,能与氯气反应生成四氯化硅,D 项正确。
3.从石英砂制取高纯硅的主要化学反应如下:
高温 ①SiO2+2C=====Si(粗)+2CO↑
△ ②Si(粗)+2Cl2=====SiCl4
高温 ③SiCl4+2H2=====Si(纯)+4HCl
关于上述反应的叙述不正确的是
()
A.①、③是置换反应,②是化合反应
3.无机非金属材料 (1)传统无机非金属材料
水泥
玻璃
陶瓷
生产原料 石灰石、黏土 纯碱、石灰石、石英 黏土
主要设备 水泥回转窑
玻璃熔窑
陶瓷窑
生产玻璃的两个反应:
高温 Na2CO3+SiO2=====
Na2SiO3+CO2↑
;
CaCO3+SiO2=高==温== CaSiO3+CO2↑ 。
近年高考化学第4章(非金属及其化合物)第1节碳、硅及无机非金属材料考点(2)硅酸、硅酸盐、无机非金

2019高考化学第4章(非金属及其化合物)第1节碳、硅及无机非金属材料考点(2)硅酸、硅酸盐、无机非金属材料讲与练(含解析)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2019高考化学第4章(非金属及其化合物)第1节碳、硅及无机非金属材料考点(2)硅酸、硅酸盐、无机非金属材料讲与练(含解析))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2019高考化学第4章(非金属及其化合物)第1节碳、硅及无机非金属材料考点(2)硅酸、硅酸盐、无机非金属材料讲与练(含解析)的全部内容。
考点二硅酸、硅酸盐、无机非金属材料李仕才1.硅酸硅酸难溶于水,其酸性比碳酸弱,硅酸不能(填“能”或“不能”)使紫色石蕊试液变红色。
(1)硅酸不稳定,受热易分解:H2SiO3错误!SiO2+H2O。
(2)硅酸能与碱溶液反应,如与NaOH溶液反应的化学方程式为H2SiO3+2NaOH===Na2SiO3+2H2O.(3)硅酸在水中易聚合形成胶体,硅酸凝胶经干燥脱水后得到多孔的硅胶,有很强的吸水能力,常用作干燥剂。
2.硅酸盐(1)概念:由硅、氧和金属元素组成的化合物的总称,是构成地壳岩石的主要成分。
(2)表示方法:硅酸盐矿物的成分复杂,常用氧化物的形式表示它们的组成,如硅酸钠(Na2SiO3)写成Na2O·SiO2,钾云母(KH2Al3Si3O12)写成K2O·3Al2O3·6SiO2·2H2O。
(3)硅酸钠(Na2SiO3)。
①白色、可溶于水的粉末状固体,其水溶液俗称水玻璃,有黏性,水溶液显碱性。
②与较强的酸反应,如与盐酸反应的化学方程式为Na2SiO3+2HCl===2NaCl+H2SiO3↓;与CO2水溶液反应的化学方程式为Na2SiO3+CO2+H2O===H2SiO3↓+Na2CO3。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4-1 碳、硅及无机非金属材料板块三限时规范特训时间:45分钟满分:100分一、选择题(每题6分,共72分)1.下列叙述中不正确的是( )A.单质硅是重要的半导体材料B.二氧化硅是制造光导纤维的材料C.硅酸钠可以作木材防火剂D.自然界里存在大量的单质硅和二氧化硅答案 D解析硅在自然界中以化合态形式存在,多以硅酸盐或二氧化硅的形式存在于岩石、矿物中,D错误。
2.下列说法正确的是( )A.SiO2和CO2都是酸性氧化物B.为防止月饼等富脂食品氧化变质,可在包装袋中放入硅胶C.NaHCO3溶液中含有Na2SiO3杂质,可通入少量CO2后过滤D.SiO2中含Al2O3杂质,可加入足量NaOH溶液然后过滤除去答案 A解析SiO2、CO2分别为H2SiO3、H2CO3对应的酸性氧化物,A正确;硅胶具有吸水性,可以防止食品受潮,而不能防止食品氧化,B错误;除去NaHCO3溶液中的Na2SiO3杂质,应通入足量CO2,发生反应:Na2SiO3+2CO2+2H2O===2NaHCO3+H2SiO3↓,C错误;SiO2、Al2O3均能与NaOH溶液反应,应加入稀盐酸后过滤,D错误。
3.[2017·合肥高三质检]硅及其化合物是带来人类文明的重要物质。
下列说法正确的是( )A.陶瓷、水晶、水泥、玻璃都属于硅酸盐产品B.水玻璃是纯净物,可用于生产黏合剂和防火剂C.某硅酸盐的化学式为KAlSi3O8,可用K2O·Al2O3·6SiO2表示D.高纯硅可用于制造光导纤维,高纯二氧化硅可用于制造太阳能电池答案 C解析水晶的主要成分是SiO2不是硅酸盐,A错误;水玻璃是Na2SiO3溶液,属于混合物,B错误;高纯度的SiO2用于制光导纤维,高纯度的Si用于制太阳能电池,D错误。
4.[2017·银川模拟]下列说法中不正确的是( )A.因SiO2不溶于水,故H2SiO3不是SiO2对应的酸B.CO2通入水玻璃可以得到硅酸沉淀C.SiO2熔点高、硬度大D.氢氟酸能够雕刻玻璃,故不能用玻璃瓶来盛装氢氟酸答案 A解析H2SiO3对应的酸性氧化物是SiO2,但SiO2不能直接与水反应生成H2SiO3。
5.[2017·湖南株洲质检]化学与社会、生产、生活密切相关。
下列说法中不正确的是( )A.煤炭经气化、液化和干馏等过程,可以转化为清洁能源B.利用二氧化碳来制造全降解塑料,可以缓解温室效应C.高纯硅可用于制造太阳能电池、计算机芯片和光导纤维D.在医疗上,可用碳酸氢钠治疗胃酸过多症答案 C解析煤炭经气化、液化和干馏等过程,可以转化为清洁能源,减少污染物的排放,故A正确;利用二氧化碳制造全降解塑料,减少了二氧化碳的排放,可以缓解温室效应,故B 正确;光导纤维的主要成分是二氧化硅,不是硅单质,故C错误;可以用碳酸氢钠中和胃酸,治疗胃酸过多症,故D正确。
6.如图是利用二氧化硅制备硅及其化合物的流程,下列说法正确的是( )A.SiO2属于两性氧化物B.盛放Na2CO3溶液的试剂瓶用玻璃塞C.硅胶吸水后可重复再生D.图中所示的转化都是氧化还原反应答案 C解析SiO2是酸性氧化物,它能与氢氟酸反应是其特殊性质,A错误;在图示转化关系中只有第一行的变化是氧化还原反应,其余均为非氧化还原反应。
7.下列离子方程式中书写正确的是( )A.水玻璃中通入过量的二氧化碳:Na2SiO3+CO2+H2O===2Na++CO2-3+H2SiO3B.澄清石灰水中通入过量二氧化碳:Ca(OH)2+2CO2===Ca2++2HCO-3C.二氧化硅与氢氟酸反应:SiO2+4H++4F-===SiF4↑+2H2OD.二氧化硅溶于烧碱溶液中:SiO2+2OH-===SiO2-3+H2O答案 D解析Na2SiO3是强电解质,应拆成Na+、SiO2-3,CO2过量,产物应为HCO-3,A项正确写法是SiO 2-3+2CO 2+2H 2O===H 2SiO 3↓+2HCO -3;B 项正确写法是CO 2+OH -===HCO -3;C 项氢氟酸是弱酸,在离子方程式中不能拆分。
8.下列说法中不正确的是( )A .光导纤维的主要成分是二氧化硅B .二氧化硅是硅酸的酸酐,但不可以用它和水直接反应来制取硅酸C .硅的化学性质不活泼,但在常温下也可和某些物质反应D .盛放硅酸钠溶液的试剂瓶不能用玻璃塞的主要原因是硅酸钠溶液水解呈碱性答案 D解析 盛放硅酸钠溶液的试剂瓶不能用玻璃塞的主要原因是硅酸钠溶液黏性强,容易使瓶塞和瓶口黏合在一起而不易打开,D 错误。
9.金刚砂(SiC)可由SiO 2和碳在一定条件下反应制得,反应方程式为SiO 2+3C=====高温SiC +2CO↑,下列有关制造金刚砂的说法正确的是 ( )A .该反应中的氧化剂是SiO 2,还原剂为CB .该反应中的氧化产物和还原产物的物质的量之比为1∶2C .该反应中每生成1 mol SiC 转移电子12 molD .该反应中的还原产物是SiC 、氧化产物是CO ,其物质的量之比为1∶2答案 D解析 反应产物SiC 中Si 、C 的化合价分别为+4、-4价,所以SiO 2既不是氧化剂,又不是还原剂;碳元素从0价转变成-4价(SiC)和+2价(CO),CO 是氧化产物,SiC 是还原产物,两者的物质的量之比为2∶1;每生成1 mol SiC 转移电子4 mol 。
10.硅及其化合物是带来人类文明的重要物质。
下列说法正确的是( )A .可以用焦炭还原二氧化硅生产硅:2C +SiO 2=====高温Si +2CO↑B .SiO 2是非金属氧化物,它不与任何酸反应C .在粗硅的制取中发生反应2C +SiO 2=====高温2CO↑+Si ,硅被还原,所以碳的还原性强于硅的还原性D .高纯硅可用于制造太阳能电池,高纯二氧化硅可用于制造计算机芯片答案 A解析 工业上用焦炭在电炉中还原二氧化硅生产硅:2C +SiO 2=====高温Si +2CO↑,A 正确;SiO 2能与氢氟酸反应生成四氟化硅和水,B 错误;在粗硅的制取中发生反应2C +SiO 2=====高温2CO↑+Si ,由于反应是在高温条件下进行,且生成CO 气体从体系中逸出能够进一步促进反应进行,因此尽管是硅被还原,也不能说明碳的还原性强于硅的还原性,C 错误;二氧化硅可用于制造光导纤维,高纯硅可用于制造太阳能电池、计算机芯片等,D 错误。
11.[2017·潍坊模拟]硅是构成无机非金属材料的一种主要元素,下列有关硅的化合物的叙述错误的是( )A.氮化硅陶瓷是一种新型无机非金属材料,其化学式为Si3N4B.碳化硅(SiC)的硬度大,熔点高,可用于制作高温结构陶瓷和轴承C.光导纤维是一种新型无机非金属材料,其主要成分为SiO2D.硅酸盐均不溶于水答案 D解析在氮化硅中,N元素为-3价,Si元素为+4价,则化学式为Si3N4,A正确;硅酸钠易溶于水,D错误。
12.[2017·湖南十三校联考]将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为( )答案 D解析将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,发生反应的先后顺序为Ba(OH)2+CO2===BaCO3↓+H2O、2KOH+CO2===K2CO3+H2O、2KAlO2+CO2+3H2O===2Al(OH)3↓+K2CO3、K2CO3+CO2+H2O===2KHCO3、BaCO3+CO2+H2O===Ba(HCO3)2,根据物质的溶解性可知,只有D项符合题意。
二、非选择题(共28分)13.(15分)石墨在材料领域有重要应用。
某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质。
设计的提纯与综合利用工艺如下:(注:SiCl4的沸点为57.6 ℃,金属氯化物的沸点均高于150 ℃)(1)向反应器中通入Cl2前,需通一段时间N2,主要目的是__________________。
(2)高温反应后,石墨中氧化物杂质均转变为相应的氯化物。
气体Ⅰ中的碳氧化物主要为________。
由气体Ⅱ中某物质得到水玻璃的化学反应方程式为_____________________________________。
(3)步骤①为:搅拌、________。
所得溶液Ⅳ中的阴离子有________________。
(4)100 kg初级石墨最多可获得Ⅴ的质量为________kg。
答案(1)排出装置中的空气(2)CO' SiCl4+6NaOH===Na2SiO3+4NaCl+3H2O(3)过滤' AlO-2、OH-、Cl-(4)7.8解析(1)向反应器中通入Cl2前,需通一段时间N2,主要目的是排尽反应器中的空气,防止高温下初级石墨与空气中的O2反应。
(2)气体Ⅰ中的碳氧化物主要为CO,由气体Ⅱ中某物质得到水玻璃,故其为含硅的化合物SiCl4,反应方程式为SiCl4+6NaOH===Na2SiO3+4NaCl+3H2O。
(3)步骤①为搅拌,并通过过滤操作将沉淀和溶液分离;由题意分析可知,所得溶液Ⅳ中的阴离子有AlO-2、Cl-、OH-。
(4)由溶液Ⅳ生成沉淀Ⅴ,是将AlO-2转化为Al(OH)3,由题意可知Al2O3~2Al(OH)3,n(Al2O3)=100000 g×5.1%102 g·mol-1=50 mol,n[Al(OH)3]=100 mol,则m[Al(OH)3]=100 mol×78 g·mol-1=7800 g=7.8 kg。
14.[2018·江西师大附中月考](13分)氮化硅(Si3N4)是一种优良的高温结构陶瓷,在工业生产和科技领域中有重要用途。
工业上有多种方法来制备氮化硅,下面是几种常见的方法:(1)方法一——直接氮化法:在1300~1400 ℃时,高纯粉状硅与纯氮气化合,其反应方程式为3Si+2N21300~1400 ℃,Si3N4。
(2)方法二——可以用NH3和SiH4(硅烷)在一定条件下反应,并在600 ℃的加热基板上生成氮化硅膜,其化学方程式为________________________________________________________。
(3)方法三——化学气相沉积法:在高温条件下利用四氯化硅气体、纯氮气、氢气反应生成氮化硅和氯化氢,与方法一相比,用此法制得的氮化硅纯度较高,其原因是_______________________。
(4)方法四——Si(NH2)4热分解法:先用四氯化硅与氨气反应生成Si(NH2)4和一种气体:________(填化学式);然后使Si(NH2)4受热分解,分解后的另一种产物的化学式为________。
