无机化学考研辅导2
无机化学考研辅导2

⽆机化学考研辅导2练习题1.完成并配平下列反应⽅程式.(1)Cu+ + OH-→(2)Cu2+ +OH-(浓)→(3)Cu2O + NH3+ NH4Cl + O2→(4)Ag+ + OH-→(5)Zn2+ + OH-→(6)Hg2+ + OH-→(7)HgS + Al + NaOH→(8)Hg22+ + OH-→2.完成并配平下列反应⽅程式(1)Cu2O + HCl→(2)Cu2O + H2SO4 (稀)→(3)Ag2O + HCl→(4)Ag2O + H2SO4(稀)→3.选取合适的配合剂,分别将下列各种微溶盐溶解(1) CuCl (2) AgBr (3) CuS (4) HgI2 (5) CuI (6) HgNH2Cl4.解释下列事实(1)铜在潮湿的空⽓中会慢慢的⽣成⼀层铜绿(2)将CuCl2浓溶液加⽔稀释时,溶液的颜⾊由黄⾊到绿⾊最后变为蓝⾊(3)将SO2通⼊CuSO4与NaCl的混合溶液中会有⽩⾊的沉淀⽣成(4)加热CuCl2·2H2O,得不到⽆⽔CuCl2(5)焊接铁⽪时常⽤浓ZnCl2溶液处理铁⽪表⾯(6)HgS能溶于王⽔或Na2S溶液,但不溶于HCl,HNO3及 (NH4)2S 溶液中(7)Hg(NO3) 2溶液中有NH4NO3存在时,加⼊氨⽔得不到HgNH2NO3沉淀5.请将下列合成⽤反应式表⽰出来(1)由CuS 合成 CuI(2)由CuSO4合成 CuBr(3)由K[Ag(CN) 2]合成Ag2CrO4(4)由ZnS 合成⽆⽔ZnCl2(5)由Hg 制备 K2[HgI4](6)由ZnCO3提取 Zn6.设计⼀个不⽤⽣成硫化物⽽能将下列离⼦分离的⽅案Ag+ Hg22+ Cu2+ Zn2+ Cd2+ Hg2+ Al3+7.⽤简单⽅法将下列混合物分离(1)Hg2Cl2与HgCl2(2)CuSO4与CdSO4(3)Hg(NO3)2与Pb(NO3)2(4)Cu(NO3) 2与AgNO3(5)ZnCl2与SnCl28.⽐较Cu(Ⅱ) 与Hg(Ⅱ)配合物的⼏何构型和稳定性.9.将⽆⽔硫酸铜溶于⽔得到溶液A,⽤过量的浓HCl处理A得到溶液B,将SO2通⼊B后⽤⽔稀释有沉淀C⽣成,将沉淀滤出并⽤蒸馏⽔洗净后溶于氨⽔得到⽆⾊溶液D,D迅速转化为溶液E,如向溶液E中加过量的铜屑,则⼜⽣成D.(1)给出A~E的颜⾊及含铜的组分化学式或配离⼦.(2)给出由D⽣成E的反应式.10.铜副族元素的次外层电⼦已经达全满,为什么铜副族可以形成变价?这种电⼦构型对铜副族元素的物理性质及化学性质有何影响.并与碱⾦属相⽐较.11.为什么⽔溶液中Cu+不如Cu2+稳定,⽽在⼲态时,Cu+⼜⽐Cu2+稳定?12.⽤铜粉还原Cu2+盐制备CuCl时,为什么要加⼊过量的浓盐酸?并简述CuCl的性质.13.试说明在CuSO4·5H2O晶体中Cu2+为六配位.14.试说明在医学上,常⽤Cu2+盐的碱性溶液作为糖尿病患者的检验试剂.15.锌副族和铜副族是否属过渡⾦属?为什么锌副族元素没有+3氧化态的物种存在?16.Hg为什么可以形成+1氧化态的物种?Hg和Zn. Cd在性质上有何差异?17.试说出ZnCl2和CuCl2在⽔溶液中的化学⾏为18.已知下列反应在室温下的平衡常数K=10-2.78Cu(OH) 2 (s) + 2OH- =[Cu(OH) 4]2-结合有关数据,求[Cu(OH)4]2-的稳定常数,在1L的NaOH溶液中,若使0.1molCu(OH) 2溶解,问NaOH的浓度⾄少应为多少?已知Ksp.c u(OH)2 =2.2×10-2019.下⾯两个平衡2Cu+ == Cu2+ + CuHg + Hg2+ == Hg22+.(1)这这两个平衡在形式上是相反的,为什么会出现这样的情况?(2)在什么情况下,平衡会向左移动?试举⼀实例.20.⽤0.1mol·L-1HCN溶液处理过量的AgCN固体,当平衡时溶液的PH是多少?[Ag(CN)2]-的浓度是多少?如果调节平衡的溶液的PH值为中性,那么溶液中AgCN的溶解度为多少? 已知:Ksp(AgCN)=1.2×10-16, ;K稳(Ag(CN)2)-=1.3×1021;Ka(HCN)=6.2×10-1021.已知:Hg22+==Hg2+ + Hg, K=7.04×10-3.在0.1mol·L-1的Hg22+溶液中.有⽆Hg2+存在?能否说Hg22+在溶液中不能发⽣歧化反应?第⼗⼀讲过渡元素(1)⼀、通性过渡元素⼀般是指原⼦的电⼦层结构中d轨道或f轨道仅部分填充的元素。
张祖德《无机化学》修订版辅导用书-名校考研真题-第8章 化学键和分子、晶体结构【圣才出品】

【答案】C
【解析】沸点:主要影响因素是氢键。对羟基苯甲醛形成分子间氢键,邻羟基苯甲醛
形成分子内氢键,所以对羟基苯甲醛比邻羟基苯甲醛的沸点高。熔点:需要破坏分子的晶
体结构。从结构上看,对羟基苯甲醛比邻羟基苯甲醛对称,排列更整齐、密集,要破坏这
个结构就需要更多的能量,即熔点更高。
9.BF3 路易斯共振结构式数目有( )。[湘潭大学 2015 研] A.1 B.2 C.3 D.4 【答案】C
【答案】B
【解析】N 是ⅤA 族元素,作为中心原子,提供 5 个价电子。Cl 是ⅦA 族元素,作为
周围原子,每个 Cl 提供 1 个价电子,3 个 Cl 共提供 3 个价电子。价电子总数
=5+1×3=8 个,即 4 对。所以中心原子杂化方式是 sp3 杂化,分子构型三角锥形。
6.下列各种含氢化合物分子间不含有氢键的是( )。[北京交通大学 2015 研] A.CH4 B.H2O C.H3BO3 D.HF 【答案】A
5.NCl3 分子中,N 原子与三个氯原子成键所采用的轨道是( 2015 研]
A.两个 sp 轨道,一个 p 轨道成键 B.三个 sp3 轨道成键
2 / 33
)。[北京交通大学
圣才电子书
C.Px、Py、Pz 轨道成键
十万种考研考证电子书、题库视频学习平 台
D.三个 sp2 轨道成键
分子的构型不对称,则分子为极性分子;如果对称,则为非极性分子。
4.凡是中心原子采用 sp3d2 杂化轨道成键的分子,其空间构型可能是( )。[中国 科学技术大学 2015 研]
A.八面体 B.平面正方形 C.四方锥 D.以上三种均有可能 【答案】D 【解析】sp3d2 杂化轨道,6 个原子杂化生成 6 个杂化轨道。但分子的空间构型除与 杂化轨道有关外,还要考虑孤对电子的影响。A 项,分子没有孤对电子,空间构型为八面 体;B 项,分子有 4 个成键轨道,2 个轨道容纳孤对电子,那么空间构型为平面正方型; C 项,分子 5 个成键轨道,1 个轨道容纳孤对电子,那么空间构型为四方锥。
张祖德《无机化学》修订版辅导用书-名校考研真题-第2章 化学热力学基础与化学平衡【圣才出品】

A. B. C. D. 【答案】C
7 / 24
圣才电子书
十万种考研考证电子书、题库视频学习平
台
【解析】熵是量度系统无序度的函数,无序度增大的过程即熵增大的过程。C 项,物
5.对于常温下 ΔrH>0,ΔrS>0 不能自发进行的反应,有可能通过下列哪种办法使其 自发进行?( )[华南理工大学 2015 研]
A.增大反应物浓度 B.升高温度 C.加入催化剂 D.以上办法均可 【答案】B
6.室温下,稳定状态的单质的标准摩尔熵为( )。[北京交通大学 2015 研] A.零
2 / 24
C.-3040kJ/mol
D.+1560kJ/mol
【答案】A
【解析】根据标准摩尔反应吉布斯函数公式
rGm= vB f Gm
且热力学稳定的单质的标准摩尔生成吉布斯函数为 0。综上,代入数据可得 ΔfGmΘ 为
-1013kJ/mol。
18.下列反应中 r Sm>0 的是( )。[南京理工大学 2007 研]
台
9.图 2-1-1 是反应 aA( g) +bB( g) ƒ gG( g) +dD( g) 达到化学平衡状态时,生成物
G 的含量(w)与温度及压强的关系图,则下列结论正确的是( )。[厦门大学 2012 研]
图 2-1-1 A.正反应的 ΔH<0,且 a+b>g+d B.正反应的 ΔH<0,且 a+b=g+d C.正反应的 ΔH>0,且 a+b>g+d D.正反应的 ΔH>0,且 a+b=g+d 【答案】B
圣才电子书
十万种考研考证电子书、题库视频学习平
台
第 2 章 化学热力学基础与化学平衡
一、选择题 1.在标准压力和 273K 条件下,液态水凝固成冰时,体系中应是( )。[华南理工 大学 2016 研] A.ΔU=0 B.ΔG=0 C.ΔH=0 D.ΔS=0 【答案】B
张祖德《无机化学》修订版辅导用书-名校考研真题-第6章 化学动力学基础【圣才出品】

第6章 化学动力学基础一、选择题1.某一级反应,浓度由1.0mol·L-1降至0.5mol·L-1需时30min,则浓度从0.5mol·L-1降至0.25mol·L-1所需要的时间是()。
[华南理工大学2016研]A.30minB.超过30minC.低于30minD.无法判断【答案】A2.速率常数k是()。
[北京交通大学2014、2015研]A.无量纲的参数B.量纲为mol·L-1•s-1C.量纲为mol2•L-2•s-1的参数D.量纲不定的参数【答案】Dƒ3.298K时,反应N2(g)+3H2(g)2NH3(g)的∆r H mΘ=-92.22kJ·mol-1,在密闭容器中该反应达平衡,若加入稀有气体,会出现()。
[华南理工大学2015研] A.平衡状态不变B.平衡右移D.正反应速度加快【答案】A4.下列反应达平衡时,,保持体积不变,加入惰性气体He,使总压力增加一倍,则()。
[宁波大学2009研;南开大学2012研;北京航空航天大学2015研]A.平衡向左移动B.平衡向右移动C.平衡不发生移动D.条件不充足,不能判断【答案】C5.当一个化学反应处于平衡时,则()。
[北京交通大学2015研]A.平衡混合物中各种物质的浓度都相等B.正反应和逆反应速率都是零C.反应混合物的组成不随时间而改变D.反应的焓变是零【答案】C6.温度升高导致反应速率明显增加的主要原因是()。
[北京交通大学2014研] A.分子碰撞机会增加C .活化分子数增加D .活化能降低【答案】C7.室温时,若实验测得反应NO 2+CO→NO+CO 2的速率方程为。
在下述几种反应机理中,与速率方程最有可能相符合的机理是()[中南大学2013研]A .;B .C .;D .;【答案】C 8.气相反应2NO +O 2→2NO 2,其速率方程为:,下面的反应历22d (NO)(O )d c k t =程中一定不正确的是( )。
无机化学考研辅导

无机化学考研辅导(下)第五讲 卤 素一、卤素单质的通性1、分子结构和性质元素的价电子构型为ns2np5,易得一个电子形成全满结构,单质均为双原子分子。
最显著的性质是气态的F2、Cl2、Br2、I2的颜色变化,从近无色→紫色,分子最大吸收渐向长波方向移动。
说明双原子MO中最高充满的σ和π*至最低未满的空的σ*轨道之间能量差自上而下减小。
另外,卤素分子的离解能从F2到I2分别为159kj·mol -1,243kJ·mol-1,193kJ·mol-1和151kJ·mol-1。
.除F2外,随着离子半径的增加,键渐弱,因而离解能渐低。
2、反应活性(1)卤素标准电极电势:I2+2e-=2I- φ=0.52VBr2+2e-=2Br- φ=1.06VCl2+2e-=2Cl- φ=1.36VF2+2e-=2F- φ=2.87V氧化能力:F2>Cl2>Br2>I2(还原能力:I->Br->Cl->F-)(2)所以F2,Cl2可与所有金属作用,F2还能与稀有气体作用:形成XeF2,XeF4,XeOF4等化合物。
Br2,I2可与除贵金属外的所有金属作用。
(3)卤素与水作用发生下述两类反应1X2+H2O→2H++2X-+1/2O2F2极易发生此反应,日光下Cl2反应慢,Br2,I2无明显反应。
2X2+H2O→H++X-+HOX X2+2OH-→XO-+X-+H2O第 2类反应即为卤素特征的OX-Re反应即歧化反应。
在酸性条件下,卤素歧化反应不易发生,如Cl2的K=4.0×10-4;而在碱性条件下,歧化极易进行,且XO-还可继续歧化(3XO-→2X-+XO3-)。
Cl2在70摄氏度,Br2在室温,I2在0℃即可发生上述反应。
所以室温下将Cl2,Br2,I2分别加入碱中生成的是ClO-,BrO3-和IO3-。
3、单质制备(1)F21工业制备:电解KHF2与HF混合液阳极(石墨):2F-=F2↑+2e-阴极(电解槽):2HF2-+2e-=H2↑+4F-电解总反应:2KHF2=2KF+H2↑+F2↑2实验室制法:BrF5(g)=BrF3(g)+F2(g)1986年:4KMnO4+4KF+20HF→4K2MnF6+3O2+10H2O2K2MnF6+4SbF5=4KSbF6+F2↑+2MnF3(2)Cl21工业制备:电解NaCl水溶液2实验室制法:MnO2+HCl(浓)= KMnO4+HCl(浓)=(3)Br21工业制法:海水制Br2。
张祖德《无机化学》修订版辅导用书-章节题库-第1章 气体、液体和溶液的性质【圣才出品】

圣才电子书
十万种考研考证电子书、题库视频学习平
台
同。
7.扩散速率约为甲烷 3 倍的气体是( )。 A.H2 B.He C.N2 D.CO2 【答案】A 【解析】根据气体的扩散定律,气体的扩散速率与相对分子质量的平方根成反比:
8.下列各组气体中,在相同温度下两种气体扩散速率最接近整数倍的是( )。 A.H2 和 He B.He 和 N2 C.He 和 O2 D.H2 和 O2 【答案】D 【解析】气体的扩散速率与相对分子质量的平方根成反比,由此可得:
4 / 19
圣才电子书
十万种考研考证电子书、题库视频学习平 台
9.水在 96.5℃时沸腾,这说明外界大气压( )。 A.等于一个标准大气压 B.略高于一个标准大气压 C.低于一个标准大气压 D.远远高于一个标准大气压 【答案】C 【解析】沸点是指纯液体的饱和蒸气压达到外界大气压时的温度。水的正常沸点为 100℃,此时水的饱和蒸气压等于标准大气压。若水在 96.5℃沸腾,说明此时水的饱和蒸 气压小于标准大气压,即外界大气压小于标准大气压。
圣才电子书
十万种考研考证电子书、题库视频学习平
台
第 1 章 气体、液体和溶液的性质
一、选择题 1.在 100℃时,98.7kPa 压力下,硫蒸气的密度为 0.5977g·L-1,已知 S 的原子量是 32.066,则硫的分子式是( )。 A.S8 B.S6 C.S4 D.S2 【答案】D 【解析】硫蒸气的密度为 0.5977g·L-1,即体积为 1L 时,质量为 0.5977g,且温度及 压力已知,根据理想气体状态方程:
A.100kPa B.200kPa C.300kPa D.400kPa 【答案】B
无机化学与分析化学考研复习基本知识篇

分子的分子量越大,色散力就越大。
例题 取向力 诱导力 色散力
CO2 (g)
无
He , H2O
无
CH3OH,H2O 有
HBr 气体 有
I2 , CCl4
无
无
有
有
有
有
有
有
有
无
有
38
Vander.Waals力与物质的性质的关系
分子
F2 2
分子量
Vander.Waals力
Cl2 Br2 I2
② 影响凝结值大小的因素
A、价数越高,凝结值越小.聚沉能力越强。
如:对于负溶胶: Al3+>Mg2+>K+
对于正溶胶: PO43->SO42->Cl-
B、同价阳高高聚沉,同价阴高低聚沉,
如,对负溶胶:
感
一价阳离子的凝结能力次序为:
胶
Cs+>Rb+>K+>Na+>Li+ 二价阳离子的凝结能力次序为:
离 子 序
取值: 0,1, 2,···(n-1) 共n个
对应着 s, p, d, f…... (亚层) n 、l 相同的电子,能量相同,处于同 一能级,
称为等价轨道(简并轨道)。 单电子原子: Ens= Enp= End= Enf
E1s < E2s = E2p < E3s = E3p = E3d< E4s = E4p ......
则速率反程为 = kc(NO)c(Br2)
② 根据实验数据来设定并求解速率方程
10
反应级数
= k c a (A)c b(B)
无机化学考研辅导讲座2

(4)F-+HSO3-=SO32-+HF2、解释下列现象(1)AgI2-和I3-是稳定的,而AgF2-和I2F-不存在?(2)BH3CO稳定存在而BF3CO不能形成?3—6 有效原子序数(EAN)规则(Effective atomic number)一、概念1927年英国化学家西奇维克提出,是指中心原子的电子数和配体给予中心原子的电子数之和。
即中心原子形成稳定配合物的EAN应等于紧跟它后面的惰性原子的序数。
主要用于羰基及其它非经典配合物结构中。
如:[Cr(CO)6]→24e-+12e-=36e-[Fe(CO)5] →26e-+10e-=36e-→Kr(氪) -36e-[Co(NH3)6]3+→24e-+12e-=36e-对于中心原子三偶数电子的,可直接形成羰基配合物,而一般中心原子为奇数电子的羰基配合物多不稳定,(不能满足EAN),所以它们容易氧化,还原或聚和成多核配合物,以符合EAN要求,如V为23e-,在形成V(CO)6的总电子数为35,它不稳定,易被还原成[V(CO)6]-。
而V(CO)6+Na→Na++[V(CO)6]-又如具有奇电子数的Mn(0),Co(0),它们的羰基配合物以二聚体Mn2(CO)10,Co2(CO)8或混合形式[Mn(CO)5Cl]和[HCo(CO)4]存在,它们的结构,有效原子序数计算如下图:二、常见配体提供电子数的计算1、NO:一氧化氮分子虽不是有机配体,但与CO十分类似。
能理解成NO+,与CO 有相当数目的电子(等电子体)。
NO参加配体是以三电子成键,因而许多有亚硝酰作配体的配合物能符合EAN法则。
如:[Co(CO)3NO]→27+6+3=36e- [Fe(CO)2(NO)2] →26e-+4e-+6e-=36e-[Mn(CO)(NO)3] →25+2+9=36e-[Cr(NO)4] →24+12=36e-2、烷基与金属形成σ键,按单电子计算。
对不饱和的碳氢分子或离子可按参加配位双键的π电子数目计算。
无机化学考研辅导讲座2.

(4)F-+HSO3-=SO32-+HF2、解释下列现象(1)AgI2-和I3-是稳定的,而AgF2-和I2F-不存在?(2)BH3CO稳定存在而BF3CO不能形成?3—6 有效原子序数(EAN)规则(Effective atomic number)一、概念1927年英国化学家西奇维克提出,是指中心原子的电子数和配体给予中心原子的电子数之和。
即中心原子形成稳定配合物的EAN应等于紧跟它后面的惰性原子的序数。
主要用于羰基及其它非经典配合物结构中。
如:[Cr(CO)6]→24e-+12e-=36e-[Fe(CO)5] →26e-+10e-=36e-→Kr(氪) -36e-[Co(NH3)6]3+→24e-+12e-=36e-对于中心原子三偶数电子的,可直接形成羰基配合物,而一般中心原子为奇数电子的羰基配合物多不稳定,(不能满足EAN),所以它们容易氧化,还原或聚和成多核配合物,以符合EAN要求,如V为23e-,在形成V(CO)6的总电子数为35,它不稳定,易被还原成[V(CO)6]-。
而V(CO)6+Na→Na++[V(CO)6]-又如具有奇电子数的Mn(0),Co(0),它们的羰基配合物以二聚体Mn2(CO)10,Co2(CO)8或混合形式[Mn(CO)5Cl]和[HCo(CO)4]存在,它们的结构,有效原子序数计算如下图:二、常见配体提供电子数的计算1、NO:一氧化氮分子虽不是有机配体,但与CO十分类似。
能理解成NO+,与CO 有相当数目的电子(等电子体)。
NO参加配体是以三电子成键,因而许多有亚硝酰作配体的配合物能符合EAN法则。
如:[Co(CO)3NO]→27+6+3=36e- [Fe(CO)2(NO)2] →26e-+4e-+6e-=36e-[Mn(CO)(NO)3] →25+2+9=36e-[Cr(NO)4] →24+12=36e-2、烷基与金属形成σ键,按单电子计算。
对不饱和的碳氢分子或离子可按参加配位双键的π电子数目计算。
无机化学考研辅导笔记.打印版35

无机化学(理论部分)知识点应用归纳1、无机物(分子或离子)构型:(1)简单分子(或离子):(2)配合物:2、物质的熔、沸点(包括硬度):(1)晶体类型:原子晶体,离子晶体,金属晶体,分子晶体(2)离子晶体:(3)分子晶体(4)金属晶体:金属键(与价电子、价轨道有关)3、物质的稳定性:(1)无机小分子:(2)配合物:4、物质的磁性:(1)无机小分子:MO (掌握双原子分子轨道能级图)(共价双原子分子)(2)配合物:5、物质的颜色:(1)无机小分子:极化理论(2)配合物:6、无机物溶解度:(1)离子晶体:(2)共价化合物:7、物质的氧化还原性:影响因素(1)溶液酸、碱度(2)物质的聚集状态8、化学反应方向:(1)热力学数据: 、、、、等(2)软硬酸碱理论9、分子极性、键的极性、键角、键长等:10、推导元素在周期表中的位置:能级组取值,选择—组合理量子数:四个量子数取值规则11、溶液中有关质点浓度计算:化学平衡,电离平衡,沉淀—溶解平衡,氧化—还原平衡,配合解离平衡:利用多重平衡规则,K是关键12、常见的基本概念:对角线规则;惰性电子对效应;Lewis酸、碱;质子酸、碱;缓冲溶液;屏蔽效应;钻穿效应;同离子效应;盐效应;镧系收缩;电负性;电离势;电子亲合势;晶格能;键能;有效核电荷及求法等。
二.无机化学(元素部分)(1)结构(2)性质:重点是化学性质3—6 有效原子序数(EAN)规则(Effective atomic number)必考一、概念1927年英国化学家西奇维克提出,是指中心原子的电子数和配体给予中心原子的电子数之和。
即中心原子形成稳定配合物的EAN应等于紧跟它后面的惰性原子的序数。
主要用于羰基及其它非经典配合物结构中。
如:[Cr(CO)6]→24e-+12e-=36e-[Fe(CO)5] →26e-+10e-=36e-→Kr(氪) -36e-[Co(NH3)6]3+→24e-+12e-=36e-对于中心原子三偶数电子的,可直接形成羰基配合物,而一般中心原子为奇数电子的羰基配合物多不稳定,(不能满足EAN),所以它们容易氧化,还原或聚和成多核配合物,以符合EAN要求,如V为23e-,在形成V(CO)6的总电子数为35,它不稳定,易被还原成[V(CO)6]-。
无机化学考研辅导
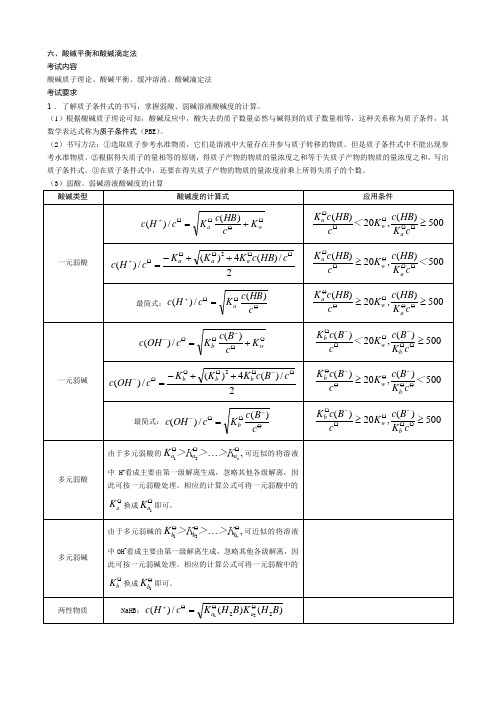
六、酸碱平衡和酸碱滴定法 考试内容酸碱质子理论、酸碱平衡、缓冲溶液、酸碱滴定法 考试要求1. 了解质子条件式的书写,掌握弱酸、弱碱溶液酸碱度的计算。
(1)根据酸碱质子理论可知,酸碱反应中,酸失去的质子数量必然与碱得到的质子数量相等,这种关系称为质子条件,其数学表达式称为质子条件式(PBE )。
(2)书写方法:①选取质子参考水准物质,它们是溶液中大量存在并参与质子转移的物质。
但是质子条件式中不能出现参考水准物质。
②根据得失质子的量相等的原则,得质子产物的物质的量浓度之和等于失质子产物的物质的量浓度之和,写出质子条件式。
③在质子条件式中,还要在得失质子产物的物质的量浓度前乘上所得失质子的个数。
(3)弱酸、弱碱溶液酸碱度的计算 酸碱类型酸碱度的计算式应用条件一元弱酸OO O O ++=wa K cHB c K c H c )(/)(500)(,20)(≥O O O OO c K HB c K <c HB c K a w a 2/)(4)(/)(2O OO O O+++-=c HB c K K K c H c a a a500)(,20)(<c K HB c K c HB c K a w a OO O O O ≥ 最简式:OO O+=c HB c Kc H c a)(/)(500)(,20)(≥≥OO O O O c K HB c K c HB c K a w a 一元弱碱OO-O O-+=wbK c B c K c OH c )(/)(500)(,20)(≥O O -O O-O c K B c K <c B c K b w b 2/)(4)(/)(2O -O O O O-++-=c B c K K K c OH c b b b500)(,20)(<c K B c K c B c K b w b O O -O O-O ≥ 最简式:O-O O -=c B c K c OH c b)(/)(500)(,20)(≥≥O O -O O-O cK B c K c B c K b w b 多元弱酸由于多元弱酸的,21OO O ⋯naa a >K >>K K 可近似的将溶液中H +看成主要由第一级解离生成,忽略其他各级解离,因此可按一元弱酸处理。
张祖德《无机化学》修订版辅导用书-名校考研真题-第3章 酸碱理论与电离平衡【圣才出品】

8.下列各组酸的酸性排序错误的是( A.HI>HBr>HCl>HF B.HClO4>H2SO4>H3PO4>H4SiO4 C.HNO3>HNO2 D.H5IO6>HIO4 【答案】D
6.HAc 在液氨和液态氢氟酸中分别是( A.强酸和强碱 B.强酸和弱碱 C.弱酸和弱碱 D.弱酸和强碱 【答案】B
)。[中南大学 2013 研]
7.考虑下面反应:AgCl(s)+2S2O32-(aq)→Ag(S2O3)23-(aq)+Cl-(aq)。在反应中 起 Lewis 酸和 Lewis 碱作用的是( )。[厦门大学 2012 研]
5 / 23
圣才电子书
十万种考研考证电子书、题库视频学习平 台
2BrF3 ƒ BrF4-+BrF2+
(2)根据溶剂酸碱理论可知,在 BrF3 溶剂中,能电离出 BrF4-的物质为碱,能电离
出 BrF2+的物质为酸。BrF2AsF6 在该溶剂中
BrF2AsF6 ƒ BrF2++AsF6-
)。[华南理工大学 2016 研]
3.将浓度均为 0.1mol·L-1 的下列溶液稀释一倍,其 pH 基本不变的是( 南理工大学 2016 研]
A.NH4Cl B.NaF C.NH4Ac D.(NH4)2SO4 【答案】C
)。[华
4.下列物质的水解产物中既有酸又有碱的是( A.Mg3N2 B.SbCl5 C.POCl3 D.NCl3
所以在 BrF3 溶液中 BrF2AsF6 的行为是酸。
2.试解释为何 H2S 水溶液的酸性比水强,液体 H2S 却比水难电离?[武汉大学 2013 研]
无机化学考研辅导35页PPT

66、节制使快乐增加并使享受加强。 ——德 谟克利 特 67、今天应做的事没有做,明天再早也 是耽误 了。——裴斯 泰洛齐 68、决定一个人的一生,以及整个命运 的,只 是一瞬 之间。 ——歌 德 69、懒人无法享受休息之乐。——拉布 克 70、浪费时间是一人高兴 。野心 是使人 勤奋的 原因, 节制使 人枯萎 。 12、不问收获,只问耕耘。如同种树 ,先有 根茎, 再有枝 叶,尔 后花实 ,好好 劳动, 不要想 太多, 那样只 会使人 胆孝懒 惰,因 为不实 践,甚 至不接 触社会 ,难道 你是野 人。(名 言网) 13、不怕,不悔(虽然只有四个字,但 常看常 新。 14、我在心里默默地为每一个人祝福 。我爱 自己, 我用清 洁与节 制来珍 惜我的 身体, 我用智 慧和知 识充实 我的头 脑。 15、这世上的一切都借希望而完成。 农夫不 会播下 一粒玉 米,如 果他不 曾希望 它长成 种籽; 单身汉 不会娶 妻,如 果他不 曾希望 有小孩 ;商人 或手艺 人不会 工作, 如果他 不曾希 望因此 而有收 益。-- 马钉路 德。
无机化学考研辅导2

练习题1.完成并配平下列反应方程式.(1)Cu+ + OH-→(2)Cu2+ +OH-(浓)→(3)Cu2O + NH3+ NH4Cl + O2→(4)Ag+ + OH-→(5)Zn2+ + OH-→(6)Hg2+ + OH-→(7)HgS + Al + NaOH→(8)Hg22+ + OH-→2.完成并配平下列反应方程式(1)Cu2O + HCl→(2)Cu2O + H2SO4 (稀)→(3)Ag2O + HCl→(4)Ag2O + H2SO4(稀)→3.选取合适的配合剂,分别将下列各种微溶盐溶解(1) CuCl (2) AgBr (3) CuS (4) HgI2 (5) CuI (6) HgNH2Cl4.解释下列事实(1)铜在潮湿的空气中会慢慢的生成一层铜绿(2)将CuCl2浓溶液加水稀释时,溶液的颜色由黄色到绿色最后变为蓝色(3)将SO2通入CuSO4与NaCl的混合溶液中会有白色的沉淀生成(4)加热CuCl2·2H2O,得不到无水CuCl2(5)焊接铁皮时常用浓ZnCl2溶液处理铁皮表面(6)HgS能溶于王水或Na2S溶液,但不溶于HCl,HNO3及 (NH4)2S 溶液中(7)Hg(NO3) 2溶液中有NH4NO3存在时,加入氨水得不到HgNH2NO3沉淀5.请将下列合成用反应式表示出来(1)由CuS 合成 CuI(2)由CuSO4合成 CuBr(3)由K[Ag(CN) 2]合成Ag2CrO4(4)由ZnS 合成无水ZnCl2(5)由Hg 制备 K2[HgI4](6)由ZnCO3提取 Zn6.设计一个不用生成硫化物而能将下列离子分离的方案Ag+ Hg22+ Cu2+ Zn2+ Cd2+ Hg2+ Al3+7.用简单方法将下列混合物分离(1)Hg2Cl2与HgCl2(2)CuSO4与CdSO4(3)Hg(NO3)2与Pb(NO3)2(4)Cu(NO3) 2与AgNO3(5)ZnCl2与SnCl28.比较Cu(Ⅱ) 与Hg(Ⅱ)配合物的几何构型和稳定性.9.将无水硫酸铜溶于水得到溶液A,用过量的浓HCl处理A得到溶液B,将SO2通入B后用水稀释有沉淀C生成,将沉淀滤出并用蒸馏水洗净后溶于氨水得到无色溶液D,D迅速转化为溶液E,如向溶液E中加过量的铜屑,则又生成D.(1)给出A~E的颜色及含铜的组分化学式或配离子.(2)给出由D生成E的反应式.10.铜副族元素的次外层电子已经达全满,为什么铜副族可以形成变价?这种电子构型对铜副族元素的物理性质及化学性质有何影响.并与碱金属相比较.11.为什么水溶液中Cu+不如Cu2+稳定,而在干态时,Cu+又比Cu2+稳定?12.用铜粉还原Cu2+盐制备CuCl时,为什么要加入过量的浓盐酸?并简述CuCl的性质.13.试说明在CuSO4·5H2O晶体中Cu2+为六配位.14.试说明在医学上,常用Cu2+盐的碱性溶液作为糖尿病患者的检验试剂.15.锌副族和铜副族是否属过渡金属?为什么锌副族元素没有+3氧化态的物种存在?16.Hg为什么可以形成+1氧化态的物种?Hg和Zn. Cd在性质上有何差异?17.试说出ZnCl2和CuCl2在水溶液中的化学行为18.已知下列反应在室温下的平衡常数K=10-2.78Cu(OH) 2 (s) + 2OH- =[Cu(OH) 4]2-结合有关数据,求[Cu(OH)4]2-的稳定常数,在1L的NaOH溶液中,若使0.1molCu(OH) 2溶解,问NaOH的浓度至少应为多少?已知Ksp.c u(OH)2 =2.2×10-2019.下面两个平衡2Cu+ == Cu2+ + CuHg + Hg2+ == Hg22+.(1)这这两个平衡在形式上是相反的,为什么会出现这样的情况?(2)在什么情况下,平衡会向左移动?试举一实例.20.用0.1mol·L-1HCN溶液处理过量的AgCN固体,当平衡时溶液的PH是多少?[Ag(CN)2]-的浓度是多少?如果调节平衡的溶液的PH值为中性,那么溶液中AgCN的溶解度为多少? 已知:Ksp(AgCN)=1.2×10-16, ;K稳(Ag(CN)2)-=1.3×1021;Ka(HCN)=6.2×10-1021.已知:Hg22+==Hg2+ + Hg, K=7.04×10-3.在0.1mol·L-1的Hg22+溶液中.有无Hg2+存在?能否说Hg22+在溶液中不能发生歧化反应?第十一讲过渡元素(1)一、通性过渡元素一般是指原子的电子层结构中d轨道或f轨道仅部分填充的元素。
河北省考研化学科目无机化学重点知识点梳理

河北省考研化学科目无机化学重点知识点梳理无机化学是化学科学的重要分支,研究无机元素、化合物以及它们之间的反应。
作为河北省考研化学科目的一部分,无机化学知识点的掌握对于考生来说至关重要。
本文将梳理河北省考研化学科目无机化学的重点知识点,以帮助考生更好地复习备考。
一、元素周期表及周期性元素周期表是无机化学的基础,对其掌握是理解化学反应和化学性质的关键。
元素周期表是由按照元素的原子序数大小排列的,所有元素根据其性质可以划分为不同的区块。
常见的区块有:1. 镧系和锕系元素:这两个区块位于元素周期表的底部,包括57-71号和89-103号元素。
这些元素具有一些共同的化学性质,例如镧系元素通常具有相似的电子结构和氧化态。
2. 主族元素:主族元素是元素周期表的S和P区块,包括1-2族和13-18族。
它们的最外层电子结构决定了它们的化学性质,主族元素通常具有相似的化学性质。
3. 过渡金属:过渡金属位于元素周期表的中央区域,从3至12族。
这些元素常见的特点是反应性中等、形成多种氧化态以及在化学反应中起催化剂作用。
此外,元素周期表还包括其他区块,如金属、非金属、卤素等等。
学生需要对元素周期表的结构和元素的周期性趋势有所了解,包括电离能、电负性、原子半径等。
二、配位化学配位化学是研究配位化合物的形成和性质的学科。
在无机化学考研中,配位化学作为重要的知识点,需要掌握以下内容:1. 配位键:配位化合物通过配位键连接中心金属离子和配体。
掌握不同配位键中的键能和配合物的稳定性是重要的。
2. 配位数:指一个中心金属离子周围配体的数量,掌握不同配位数的特点和常见配位数的配合物是重要的。
3. 配体:指配位化合物中与中心金属离子连接的分子或离子。
掌握不同配体的名称、结构和性质是必要的。
4. 配合物名称:了解符号法和常用命名法,能够正确给出给定配合物的名称。
5. 配位反应:配位反应是指配位化合物中配体的进出过程。
学生需要掌握不同配位反应的机理和条件。
824无机化学二 -回复

824无机化学二-回复中括号内的主题是[824无机化学二],接下来将会针对该主题撰写一篇1500-2000字的文章,逐步回答问题。
无机化学是化学学科中的重要分支之一,研究无机物质的性质、结构和反应规律。
本文将重点介绍824无机化学二课程的内容,包括主要涉及的知识点、实验技术、应用领域以及未来发展和前景等方面。
首先,让我们来了解824无机化学二课程的主要知识点。
该课程通常包含以下内容:配位化学、无机材料化学、固体化学以及化学反应动力学等。
学习这些知识点的目的是为了掌握无机化学的基本理论和实用技术,为后续的研究和应用打下基础。
配位化学是无机化学中的重要分支,研究的是配位化合物的性质和结构。
在824无机化学二课程中,我们将深入学习配位体的配位能力、化合物的配位数、立体化学、空间构型以及电子结构等方面的知识。
此外,我们还将学习到金属配合物的合成方法、表征技术和催化性质。
这些知识将为我们理解配合物的反应机理和应用提供基础。
除了配位化学外,无机材料化学也是824无机化学二课程中的重点内容。
无机材料是指由无机化合物构成的具有特定功能和性能的材料,如金属、陶瓷、玻璃等。
在学习无机材料化学时,我们将深入了解材料的结构与性能之间的关系,以及材料合成、表征和应用的方法。
通过研究无机材料化学,我们可以探索新材料的研发和应用,为技术创新和产业发展提供支撑。
固体化学是无机化学的一个重要分支,研究的是固体物相的结构、性质和反应规律。
在824无机化学二课程中,我们将学习晶体的结构分类、晶体缺陷、晶体生长和晶体结构分析等方面的知识。
此外,我们还将了解固体物相的热力学行为和相变规律,以及固体材料的导电性和磁性等特性。
这些知识对于理解和研究材料的性质和应用具有重要意义。
化学反应动力学是无机化学中一个关键的分支领域,研究的是化学反应的速率与反应条件之间的关系。
在824无机化学二课程中,我们将学习化学反应速率的测定方法、反应动力学定律和反应机理的研究技术。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4、H3PO4、H4P2O7、HPO3加入AgNO3→正磷酸为黄色沉淀,焦、偏磷酸为白色沉淀,偏磷酸能使蛋白质溶液产生沉淀。
六、As、Sb、Bi硫化物1、As、Sb、Bi的硫化物在结构上类似于它们的氧化物,但由于S2-半径大,而且A s(Ⅲ)、Sb(Ⅲ)、Bi(Ⅲ)又是18+2e-型,M(Ⅲ)与S2-之间有较大的极化效应,所以其硫化物更接近共价化合物,在水中溶解度很小,颜色较深,As2S3(黄)、Sb2S3(黑)、Bi2S3(黑)、As2S5(淡黄)、Sb2S5(橙黄)。
2、As、Sb、Bi硫化物酸碱性不同,在酸碱中溶解情况也有很大区别。
与氧化物相似,As2S3基本为酸性;Sb2S3是两性,Bi2S3为碱性。
所以As2S3甚至不溶解于浓HCl,Sb2S3溶于浓HCl,又溶于碱;Bi2S3只溶解于浓HCl不溶于碱。
Sb2S3+6NaOH=Na3SbO3+Na3AsS3+3H2OSb2S3+12HCl=2H3SbCl6+3H2S↑Bi2S3+6HCl=2BiCl3+3H2S↑其中Na3AsS3与Na3SbS3看成是砷(锑)酸盐中O被S取代的产物。
3、用酸性氧化物与碱性氧化物互相作用生成含氧酸盐一样,硫代酸盐可由酸性金属硫化物与碱性金属硫化物互相作用而生成。
3Na2S+As2S3=2Na3AsS33Na2S+Sb2S3=2Na3SbS3对于Bi2S3呈碱性,不溶于Na2S中。
由于As2S5和Sb2S5酸性比M2S3强,更易溶于碱的硫化物中:3Na2S+As2S5=2Na3AsS43(NH4)2S+Sb2S5=2(NH4)3SbS44、As2S3、Sb2S3与M2O3相似,具有还原性,易被多硫化物氧化,As2S3+Na2S2→Na3AsS4Sb2S3+(NH4)2S2→(NH4)3SbS4Bi2S3中Bi(Ⅲ)还原性极弱,不与多硫化物作用。
5、所有硫代酸盐只存在中性或碱性,遇酸分解成硫化物和H2S气体。
2Na3AsS3+6HCl=As2S3↓+3H2S↑+6NaCl2(NH4)3SbS4+6HCl=Sb2S5↓+3H2S↑+6NH4Cl习题1:(1)在P4O10中两种P-O键的键长之差为23pm,而在P4S10中P-S键的键长相差为13pm,说明原因。
(2)磷氮化合物具有环状平面结构,但是在1,1-二苯基三聚氟化磷氮中,三个N原子和结合F的磷原子共平面(在2.5pm以内),而苯基取代的磷原子在平面以上20.5pm,说明原因。
习题2:说明氮族元素氢化物性质上的主要差异及产生这些差异的原因。
习题3:N2很不活泼,需要在很高的温度时才能与空气中的O2反应,而磷很活泼,在室温下与空气接触时即可自燃,试从结构观点加以说明。
习题4:与胺类相比,膦类和砷类更能稳定过渡金属的较低氧化态,请说明原因。
练习题1.完成并配平下列方程式.(1)N2H4 + HNO2→(2) NH4Cl + HNO2→(3)P4 + HNO3→(4)POCl3+ H2O→(5)Zn3P2 + HCl(稀)→(6)AsH3 + AgNO3→(7)N2H4+ AgNO3→(8)Bi(OH) 3+ Cl2+ NaOH →2.写出下列化合物受热分解的反应方程式.(1)NaNO3→(2)NH4NO3→(3)Cu(NO3) 2·2H2O→(4)AgNO2→(5)NH4Cl→(6)(NH4) 2Cr2O7→(7)NaN3→3.回答下列问题.(1)虽然氮的电负性比磷高,但磷的化学性质比氮活泼?(2)为什么Bi(Ⅴ)的氧化能力比同族的其他元素都高?(3)为什么氮可以生成双原子分子N2,而同族的其他元素却不能 ?(4)P4O10中P—O的键长有两中,分别为139pm和162pm?4.如何除去:(1)氮中所含的微量的氧;(2)N2O中混有的少量的NO;(3)NO中含有微量的NO2;(4)溶液中微量的NH4+离子;5.用反应方程式表示下列制备过程;(1)由NH3制备NH4NO3;(2)由NaNO3制备HNO2的溶液;(3)由Ca3 (PO4) 2制备白磷;(4)由BiCl3制备NaBiO3;6.解释下列实验现象;(1)NaNO2会加速铜与硝酸的反应速度;(2)磷和热的KOH溶液反应生成的PH3气体遇到空气冒白烟;(3)向NaH2PO4或Na2HPO4溶液中加入AgNO3均析出黄色的Ag3PO4↓;7.鉴别下列各组物质:(1)NH4NO3和(NH4) 2SO4(2)NaNO2和NaNO3(3)Na3PO4和Na4P2O7和NaPO3(4)AsCl3、SbCl3、BiCl38.As2O3在盐酸中的溶解度随酸的浓度增大而减小,而后又增大,请分析原因?9.为什么PF3和NH3都能和许多过渡金属形成配合物,而NF3不能与过渡金属生成稳定的配合物?10.列举三类实验室中制取氮气的反应,并写出相应的反应方程式.11.共价氮化物BN、AlN、Si3N4、S4N4中那种既可以具有石墨的结构又可以具有金刚石的结构?12.为什么NF3和NCl3都是三角锥型分子,而NF3比NCl3稳定?NF3不易水解而NCl3却易水解?13.比较PH3和NH3的性质。
14.磷酸在高温下对许多金属呈现活泼性,主要表现的是磷酸的什么性质?15.画出(NPCl2) 3的结构式,用价键理论讨论N、P在其中的成键情况,指出此分子中氯原子的性质,什么叫“无机橡胶”?什么叫“磷氮烯高分子”?16.写出NCl3、PCl3、AsCl3、SbCl3、BCl3的水解方程式。
17 为什么要在高浓度的盐酸水溶液中制备As2S5?18 NH4+离子性质与哪种金属离子相似?NH4+的离子的鉴别方法有那些?19.简述磷酸的工业制法和实验室制法。
工业制法产生的废渣磷石膏如何综合利用,磷酸的广泛应用有那些?第八讲碳族和硼族元素8-1碳族元素一、通性:ⅣA:C、Si、Ge、Sn、Pb 5种元素1、价电子层构型ns2np22、氧化数+4→-43、配位数C最高为4,Si等可为6,Pb多为24、氧化还原性:+4→+2,与前族同。
5、C-C单键键能345.6kJ·mol-1>Si-Si单键键能222kJ·mol-1,硅链不长,少于碳化合物数,而Si-O键能452kJ·mol-1>C-O键能357.7kJ·mol-1,高的多,Si-O键化合物占比例大。
二、CO和CO2的结构:1、CO与N2、CN-、NO+都是等电子体,具有相似的结构,由MO知,CO的分子轨道表达为CO(14e):1σ2,2σ2,3σ2,4σ2,1π4,5σ2,2π0。
可见CO分子中有三重键,一个σ键,两个π键,其中一个π键电子为氧原子所提供:CO的偶极矩几乎为零,一般认为可能是由于CO分子中电子云偏向氧原子,但是配键的电子对是氧原子单方向供给的,这又使O原子略带正电荷,两种因素抵消,CO的偶极矩几乎等于零,C原子略带负电荷,这个C原子比较容易向其他有空轨道的原子提供电子对,2、CO2与N3-,N2O,NO2+,OCN-互为等电子体,具有线型构型,长期以来被认为有O=C=O结构,但实验测出C-O键长为116pm介于C=O双键(124pm)及CO叁键(112.8pm)之间,因此,根据VB法,可认为CO2具有以下构型,2个σ键和2个π34大π键。
三、碳酸盐及酸式盐性质1、水溶性:正盐除K+、Na+、Rb+、Cs+、NH4+、Tl+外,其它皆难溶于水。
一般来说,正盐难溶的,盐对应的酸式盐溶解度会较大。
但Na2CO3溶解度大于NaHCO3,是由于HCO3-双聚或多聚的结果。
2、水解性:可溶性碳酸盐在水溶液中呈碱性。
如0.1mol·L-1 Na2CO3溶液pH值为11.7,酸式盐如NaHCO3存在两个平衡,即水解与电离平衡:HCO3-+H2O=H2CO3+OH-HCO3-+H2O=H3O++CO32-溶液中[H+]=(K1K2)1/2,pH约为8.3,水解是主要的,加入金属离子与可溶性碳酸盐或碳酸氢盐溶液中,可生成不同类型沉淀,通过Ksp、溶解度计算。
1于0.2mol·L-1某M与等体积0.2mol·L-1 Na2CO3混合:生成MCO3沉淀有:Ca2+、Sr2+、Ba2+、Ag+等生成M2(OH)2CO3沉淀有:Mg2+、Co2+、Ni2+、Zn2+等生成M(OH)n沉淀的有:Fe3+、Cr3+、Al3+2用NaHCO3作沉淀剂,在0.1mol·L-1NaHCO3中:生成MCO3沉淀有:Ca2+、Sr2+、Ba2+、Mg2+、Cd2+、Mn2+、Ni2+、Ag+生成M2(OH)2CO3沉淀有:Cu2+、Zn2+、Be2+、Co2+等生成M(OH)3沉淀有:Fe3+、Cr3+、Al3+3、热稳定性MCO3(s)=MO(s)+CO2(g)↑△r H m>0,△S>0温度升高,有利于反应,而分解温度差别较大,碱金属MCO3熔化不分解,正盐比酸式盐稳定性大,H2CO3最差,从阳离子有效离子势Ф*=Z*/r的不同,对CO32-的反极化作用不同来解释。
四、锗、锡、铅氢氧化物酸性最强:Ge(OH)4,碱性最强Pb(OH)21、常见Sn(OH)2、Pb(OH)2既溶于酸又溶于碱:Sn(OH)2+2HCl=SnCl2+2H2OSn(OH)2+2NaOH=Na2[Sn(OH)4]Pb(OH)2+2HCl PbCl2+2H2OPb(OH)2+NaOH=Na[Pb(OH)3]2. α-Sn酸制备与性质:SnCl4+4NH3·H2O=S n(O H)4↓+4NH4ClSn(OH)4+2NaOH=Na2Sn(OH)6Sn(OH)4+4HCl=SnCl4+4H2Oβ-Sn酸由Sn+浓HNO3制备,不溶于酸或碱。
α-Sn酸放置久了也会变成β-Sn酸。
五、Ge、Sn、Pb盐氧化还原性1、PbO2的氧化性PbO2+4HCl=PbCl2+Cl2↑+2H2O2PbO2+2H2SO4=2PbSO4+O2↑+2H2O2Mn(NO3)2+5PbO2+6HNO3=2HMnO4+5Pb(NO3)2+2H2O2、PbO2结构非整比,O:Pb=1.88,O原子占据位置有空穴,能导电,铅蓄电池中作电极。
Pb与O2加热673~773K,得Pb3O4俗名“铅丹”或“红丹”。
组成2PbO·PbO2,检验方法:Pb3O4+4HNO3=PbO2+2Pb(NO3)2+2H2OPb3O4中有2/3的Pb(II)和1/3的Pb(IV)。
例题1:设计一实验,证明Pb3O4中的Pb有不同的氧化态。
六、Ge、Sn、Pb硫化物(与As、Sb、Bi类似)硫化物有两种类型,即MS2和MS.其中PbS2不存在.这些硫化物中,高氧化态的显酸性,能溶于碱性试剂中:MS2+Na2S=Na2[MS3];(M=Ge,Sn)低氧化态的硫化物显碱性,不溶于碱性试剂Na2S中.但GeS,SnS可溶于氧化性试剂如多硫化铵(NH4)2S x中生成硫代SnS32-锗酸盐和硫代锡酸盐:GeS+S22-= GeS32-, SnS+ S22-= SnS32-在GeS32-, 或SnS32-的盐溶液中加酸,则析出沉淀:GeS32-+2H+ =GeS2↓+H2S↑ ; SnS32-+2H+ =SnS2↓+H2S↑8-2硼族元素一、通性1、价电子层结构为ns2np1,缺电子原子,有很强接受电子能力,一般为+3氧化态,但随着原子序数的增加,ns2电子对趋向于稳定,因此Ga、In、Tl都有+1氧化态,而且Tl以+1为特征(6s2惰性电子对效应);Tl+的化合物显示强的离子键性质。
