无机化学第7章 金属羰基和π酸配体化合物 (北大)
无机化学第7章金属羰基和π酸配体化合物(北大)

电子数 = 9+4+2+1=16 或者 8+4+2+2=16 d[Ru2(NH3)10N2]Cl4
双氮侧基配体 Rh(PR3)2N2Cl
3. NO配体
3电子给体, 直线形 单电子给体, 弯曲形 自由 NO = 1876cm–1 直线 NO = 1800~1900cm–1 弯曲形 NO = 1500~1700cm–1
Fe(CO)5的还原及酸碱反应
羰基氢化物HMn(CO)5
二.类羰基化合物
类羰基配体: 给体, *受体, 反馈键 1. RNC ( 异腈) R–NC: 例: Cr(CNC6H5)6 2. N2 ( 双氮分子 dinitrogen), CO的等电子体 固氮酶的模型化合物 [Ru(NH3)5N2]Cl2 端基: M: NN 桥基: M: NN: M 侧基
5. 羰基化合物的成键和分子光谱
CO的分子轨道示意图(10e)
CO的HOMO为给体(碱) CO的LUMO为受体(酸)
金属羰基化合物的反馈键(back bond)生成示意图
羰基成键的表征: 分子振动光谱( 红外, 拉曼) 反馈键强, CO的 轨道的电子云密度增大 则C O间的键级减弱 力常数减小 振动频率减低 结论: 中心M 的电子云密度越大, 或者给电子能力越强, 反馈键越强, CO越小
136
1687
16
4. 膦类配体 AX3 ( A= P, As, N), X=卤素, -R, -Ar, -OR :PR3 强给电子体 P M 给体, M P *(d轨道)受体, 反馈键 (弱) 酸性: PF3 > PCl3 > P(OR)3 > PR3
北师大版无机化学习题答案(上、(下册))

第一章物质的结构1-1 在自然界中氢有三种同位素,氧也有三种同位素,问:总共有种含不同核素的水分子?由于3H太少,可以忽略不计,问:不计3H时天然水中共有多少种同位素异构水分子?1-2 天然氟是单核素(19F)元素,而天然碳有两种稳定同位素(12C和13C),在质谱仪中,每一质量数的微粒出现一个峰,氢预言在质谱仪中能出现几个相应于CF4+的峰?1-3 用质谱仪测得溴得两种天然同位素的相对原子质量和同位素丰度分别为79Br 789183占50。
54%,81Br 80。
9163占49。
46%,求溴的相对原子质量(原子量)。
1-4 铊的天然同位素203Tl和205Tl的核素质量分别为202。
97u和204。
97u,已知铊的相对原子质量(原子量)为204。
39,求铊的同位素丰度。
1-5 等质量的银制成氯化银和碘化银,测得质量比m(AgCl):m(AgBr)=1。
63810:1,又测得银和氯得相对原子质量(原子量)分别为107。
868和35。
453,求碘得相对原子质量(原子量)。
1-6 表1-1中贝采里乌斯1826年测得的铂原子量与现代测定的铂的相对原子质量(原子量)相比,有多大差别?1-7 设全球有50亿人,设每人每秒数2个金原子,需要多少年全球的人才能数完1mol金原子(1年按365天计)?1-8 试讨论,为什么有的元素的相对质量(原子量)的有效数字的位数多达9位,而有的元素的相对原子质量(原子量)的有效数字却少至3~4位?1-9 太阳系,例如地球,存在周期表所有稳定元素,而太阳却只开始发生氢燃烧,该核反应的产物只有氢,应怎样理解这个事实?1-10 中国古代哲学家认为,宇宙万物起源于一种叫“元气”的物质,“元气生阴阳,阴阳生万物”,请对比元素诞生说与这种古代哲学。
1-11 “金木水火土”是中国古代的元素论,至今仍有许多人对它们的“相生相克”深信不疑。
与化学元素论相比,它出发点最致命的错误是什么?1-12 请用计算机编一个小程序,按1.3式计算氢光谱各谱系的谱线的波长(本练习为开放式习题,并不需要所有学生都会做)。
北京大学无机化学课件

第一章 酸碱化学
1. 元素在周期表中的酸碱性 2. 酸碱质子理论和酸碱概念的相对性 3. Lewis酸碱 4. 软硬酸碱
1.元素在周期表中的酸碱性
元素周期表中酸性和碱性元素的分布区域
第一过渡系金属的氧化态和酸性的关系
2. 酸碱概念的相对性
醋酸为碱: CH3COOH +H2SO4 CH3COOH2+ HSO4 醋酸为酸: CH3COOH + H2O H3O + CH3COO
EDTA
配位数(coordination number,CN )和配位点
Ag(NH3)2+ CN=2, Cu(CN)2- CN=?
Zn(EDTA)2- CN=6,
配位数 化学计量比 配位数 配体数
二.常见的配体
1. 单齿配体(monodentate ligands)
F、Cl、Br、I、
NH3 、NR3 、PR3、PPh3、P(OR)3,
多齿配体
-OOC -OOC
NCH2CH2N
COOCOO-
六齿配体 EDTA
L
N
N
Co
O
O
四齿配体
二水杨醛缩乙二 胺合钴Co(Salen)
EDTA配合物的结构
三.配合物的几何构形
❖配位数2 (D∞h ) ❖配位数3 (D3h)
❖配位数4 (D4h和Td 点群) ❖ 配位数5 (D3h和T4v 点群) ❖ 配位数6 (Oh, D4h , D3h , D3d , D2h点群) ❖ 配位数8 (D4d四方反棱柱 , D2d 12面体 )
K2Pt(CN)4.0.3Br.3H2O 配合物(分子导线)
2. 基础研究: 量子化学为基础, 波谱学方法 新型无机化合物的合成, 反应机理, 结构表征
《无机化学》(北师大等校第四版)答案

2-1解:O2:.. .. H2O2: .. ..
: O=O: H—O—O—H
共12e共14e
CO: .. CO2: .. ..
:C=O: :O=C=O:
共10e共16e
NCl3.. SF4
F
Cl|
F—S—F
N ..|
F
Cl Cl
共34e
共26e
2-3答:LiH: Li的电子排布:1s22s1H的电子排布:1s1
1-25.解:N=1l=1m=0这一套量子数是不存在的
1-26.解:(a)l=0 (b) l=1 (c) l=2 (d) l=0 (e) l=3 (f) l=4
1-27.解:4s能级有1个轨道5p能级有3个轨道
6d能级有5个轨道7f能级有7个轨道
5g能级有9个轨道
1-28.解:(a)K : 1s22s22p63s23p64s1(b) AL: 1s22s22p63s23p1
(4)XeF2:由VSEPR模型知,XeF2分子属于AY5型分子,AY5的空间构型为三角双锥体,为保证两个Xe不能垂直。略去电子后,XeF2分子应为角形分子,但夹角一定不为90o,其夹角为120o>∠Xe-F-Xe>90o范围内。
(5)SF6:由VSEPR模型知,SF6属AY6型分子,空间构型为正八面体,即其键角为90o。
(c) Cl : 1s22s22p63s23p5(d) Ti : 1s22s22p63s23p64s23d2
(e) Zn : 1s22s22p63s23p64s23d10(f ) As : 1s22s22p63s23p64s23d104p3
1-30.解:a .Be 2s2
b. N 2s22p3
c. F 2s22p5
北大中级无机化学有机金属化学(2)
H H H CH 4
H H H N H3 OH2 H H FH H
H
2. 等瓣相似
R. Hoffmann, (Nobel Lecture, 1982) ―Building Bridges between Inorganic and Organic Chemistry‖
练习
写出下列化合物 的结构、总价电子计数和金属原子 的氧化态 1. (5–C5H5)Mn(CO)3 2. (5–C5H5)Mo(CO)2 (3–C3H5) 3. (5–C5H5)2Ta (CH2)(CH3)
Fe(5–C5H5)2
Fluxional ferrocene 转动势垒低,~ 3.8kJ.mol–1
固态:交错型 D5d
气相:重叠型 D5h 室温时不规则,低温为D5
合成方法: C5H6 C5H5–
1) C5H6(二聚体) + Na (THF) C5H5– + Na+ + H2
FeCl2+ NaC5H5(THF, 苯) Fe(5–C5H5)2
Alkylidyne ( CR )次烷基配合物 Carbyne配合物
3电子给体
OM e (O C ) 5 M o= C Ph OC
+
Br CO Mo OC C O C Ph
+
B B r3
CO
+
B B r2 (O M e )
卡宾化合物
卡拜化合物
Carbene 和 Carbyne的配合物
讨论:
1. 烯丙基配合物[PdC3H5Cl]2的结构和总价电子计数,
R2 C M CR
金属羰基化合物

•
Mo(CO)6Tc2(CO)10 Ru(CO)5 Rh2(CO)8
•
W(CO)6 Re2(CO)10 Os(CO)5 Ir2(CO)8
•
Fe2(CO)9 Co4(CO)12
•
Rh4(CO)12
•
Ir4(CO)12
•
Fe3(CO)12
•
Ru3(CO)12
•
Os3(CO)12
•
Ru6(CO)18
• 除二元的金属羰基配合物外,还有羰 基合金属配阴离子。如 [Mn(CO)5]- [Co(CO)4]- [Fe(CO)4]2-
由于Fe、Co、Ni的相似性,它们常常共存。但是 由于金属Co与金属Ni同CO的作用条件不同(Co和Fe必 须在高压下才能与CO化合,Ni在常温常压就可作用) ,从而利用上述反应就可分离Ni和Co,以制取高纯度 的Ni。
1891年,Mond还发现CO在493 K和2×107 Pa
压力下通过还原Fe粉也能比较容易地制得五羰基合
③ 大多数配合物都服从有效原子序数规则。
Hard
Borderline
Soft
Acids: H+, Li+, Na+, Acids: Fe2+, Co2+, Acids: Cu+, Ag+,
K+, Be2+, Mg2+,
Ni2+, Cu2+ Zn2+, Au+, Tl+, Hg+, 2+,
Ca2+, Cr2+, Cr3+, Al3+, SO3, BF3, Ti4+, Zr4+, Hf4+,VO2+, Cr3+, Cr6+, WO4+,Mn2+ Mn7+, Fe3+,Co3+,
无机化学(上)课程重点纲目(师大第四版)[精华]
![无机化学(上)课程重点纲目(师大第四版)[精华]](https://img.taocdn.com/s3/m/2a2addfd988fcc22bcd126fff705cc1755275f4e.png)
无机化学(上)课程重点大纲第一章原子结构和元素周期系1.了解氢原子光谱和玻尔理论的要点。
2.掌握波粒二象性,德布罗意假设,海森堡测不准原理等概念。
3.重点掌握四个量子数的定义和它的取值要求,并能正确写出任何一个指定电子的正确的四个量子数,以及电子层,能级,原子轨道和运动状态的定义和它们与四个量子数的关系。
4.了解波函数的角度分布和径向分布的图形以及与四个量子数的关系;波函数,电子云和几率的区别。
(特别是s,p和d三种原子轨道的基本形状和在空间的不同伸展方向)5.掌握屏蔽效应和钻穿效应的定义以及用它们解释能级能量的高低(注意能级交错现象)。
6.重点掌握能级组的分组情况(包括含有哪些能级和能量高低排列),对应的周期数和组内的状态数。
7.要求熟练地写出指定元素的核外电子排布式,价电子构型以及所在的周期,族数,元素所在分,最高氧化态等信息。
8.掌握原子半径和离子半径,电离势,电子亲合势和电负性的定义以及它们的主要应用和在周期表中的变化规律。
第二章分子结构1.掌握共价键的定义和特征,重点是σ键和Π键的定义和性质以及区别。
2.重点掌握价层电子对互斥理论的规则,要求能熟练地应用它来判断分子或离子的价电子对空间构型和分子离子空间构型。
3.重点掌握杂化轨道的类型和空间构型,并能正确判断一般共价分子的成键情况和空间构型(包括σ键数,孤对电子数,杂化类型,杂化轨道空间构型和分子空间构型等内容)。
4.掌握离域大π键的定义,形成条件,并要求正确判断分子中是否有大π键存在以及大π键的类型。
5.掌握分子轨道理论的基本概念,要求能正确写出第二周期非金属的双原子分子或离子的分子轨道排布式,并通过键级的大小判断它们的稳定性大小。
6.掌握各种键参数(键能,键长,键角,键的极性)的定义,并能正确判断分子是极性还是非极性的?哪些分子具有磁性以及磁性大小的估算方法?7.掌握分子间作用力和氢键的基本概念和它们的特点,要求能正确判断分子之间存在哪些分子间力(包括取向力,诱导力,色散力和氢键)。
羰基化合物

近年来,我国的甲醇工业得到了迅速发展,大多数甲醇厂使用的是铜基甲醇催化剂,性高,选择性好,许多性能各异的催化剂不断地应用到工业生产中,取得显著的经济效益。
但铜基催化剂对毒物极为敏感,容易中毒失活,使用寿命往往达不到设计要求。
在目前的工艺中,导致甲醇催化剂中毒失活的毒物主要有: (1) 硫及硫的化合物; (2) 氯及氯的化合物; (3) 羰基金属化合物; (4) 微量氨。
多年以来,各科研单位和甲醇生产企业都致力于甲醇合成气中微量硫、氯等有害物质的脱除净化工作,可将合成气中的硫和氯的质量分数降低到0101 ×10 - 6以下,对合成甲醇催化剂的保护起到了积极的作用。
但对羰基金属化合物(主要是羰基铁、羰基镍) 的脱除还没有引起足够的重视,国内外也鲜有关于羰基铁、羰基镍对甲醇催化剂影响的研究报告。
实际生产中,这些毒物的存在严重影响了生产的正常进行,使工厂应用的催化剂达不到设计要求,给企业造成巨大的经济损失。
1 羰基金属化合物形成机理羰基金属化合物是过渡金属与CO 配位体所形成的一类特殊配位化合物,亦称羰基配合物。
除铁系元素的单核羰基配合物及四羰基合镍在常温下为液体外,其他已知的金属羰基配合物验室内,在较温和的压力和温度下将CO 和铁粉或镍粉加热,即可得到挥发性的五羰基铁或四羰基镍。
在甲醇工业中, 羰基金属主要以Fe ( CO) 5 和Ni (CO) 4形式存在,但其生成机理尚未见系统的研究报道,最新研究认为,在以煤、渣油和焦炉气等为原料生产甲醇过程中,Fe (CO) 5 和Ni (CO) 4 的来源主要有以下两种途径1) 原料气中的CO 对设备与管道的腐蚀而成,金属中铁和镍能在较温和的条件下与CO 气体反应形成羰基化合物:Fe + 5CO(g) Fe (CO) 5 (g)Ni +4CO(g) Ni (CO) 4 (g)(2 ) 造气过程中, CO 与铁、镍结合生成Fe (CO) 5 、Ni (CO) 4 ,生成量与Fe 和Ni 的含量以及CO 的分压有关。
北师大版无机化学课件 p区金属

p区金属
主要内容
§21.1 p区金属概述
§21.2 铝 镓分族 §21.3 锗分族
§21.4 锑和铋
本章教学重点
1.掌握Al、Sn、Pb单质及其化合物的 性质及锗分族性质变化规律;
2.掌握锑和铋单质及其化合物的性质;
IIIA
p区金属元素
在周期表中的位置
共10种金属
21.1 p区金属概述
红宝石 Cr2O3
蓝宝石 黄玉/黄晶 Fe2O3和TiO2 Fe2O3
氢氧化铝:Al(OH)3 两性: Al(OH)3+ 3H+ === Al3+ + 3H2O Al(OH)3+ OH-=== [Al(OH)4]- 在碱性溶液中存在[Al(OH)4]-或[Al(OH)6]3- 3- 经光谱实验证实: 简便书写为: AlO2 或AlO3 溶液中不存在AlO 或AlO
铝的性质
(1)物理性质: 银白色,延展性、导电性、导热性较好。 用途: 电讯器材、建筑设备、电器设备的制造 以及特殊材料的制备。
(2)化学性质:
①与非金属单质反应 2Al(s)+3X2=2AlX3(s) 4Al(s)+3O2(g)=2Al2O3(s) 2Al(s)+3S(l)=2Al2S3(s) 铝的亲氧性: 铝与氧反应的自发性程度很大,铝一接触空 气表面立即氧化,生成一层牢固的氧化膜而耐 腐蚀。铝能夺取化合物中的氧且放出大量的热, 致使反应时不必向体系供热。故铝是冶金上常 用的还原剂,在冶金学上称为铝热法。
IIIA Al, Ga, In, Tl IVA Ge, Sn, Pb VA Sb, Bi VIA Po 与S区金属相比 ns2np1 ns2np2 ns2np3 +III(+I) +II, +IV +III, +V
[成套]高中化学竞赛辅导大学无机化学.第07章 原子结构和元素周期表
![[成套]高中化学竞赛辅导大学无机化学.第07章 原子结构和元素周期表](https://img.taocdn.com/s3/m/42e152cfa1c7aa00b52acb9b.png)
第七章 原子结构和元素周期律Chapter 7 The Atomic Structure and Periodic System of Elements这一章中,我们介绍物质的微观结构──原子结构。
化学工作者总是希望通过对物质本质的认识,来阐明元素相互化合的原理,把化学事实系统化,使化学成为可以理解的、容易加以记忆的学科。
人们利用这些原理来预言具有新功能的化合物的诞生。
例如科学家利用等电子原理(the isoelectronic principle )合成新的化合物:In 1971, the following isoelectronic compounds were known :Ni(CO)4、Co(CO)3(NO)、Fe(CO)2(NO)2、and Mn(CO)(NO)3. The last member of this series, Cr(NO)4, was unknown. However, in 1972, several chemists had sufficient faith in the isoelectronic principle to photolyze a solution of Cr(CO)6 in the presence of NO ,and thus they prepared.For many years chemists were unsuccessfully tried to prepare the perbromate ion, 4BrO -.The first successful synthesis of perbromate involved an isoelectronic species as the starting material.8324SeO -834BrO β--+ 因此,学习近代化学知识,从原子内部入手是完全必要的。
我们所关心的原子内部,对于元素及化合物的性质而言,主要集中在原子的电子结构(electronic structure of atoms ),特别是它们的价电子构型(valence electronic structure of atoms )。
π配合物π酸配合物_解释说明以及概述

π配合物π酸配合物解释说明以及概述1. 引言1.1 概述在化学领域中,配合物是由一种或多种参与共价键形成的配体与一个或多个中心金属原子结合而成的化合物。
其中,π配合物和π酸配合物是两个重要的研究领域。
π配体是指可以通过自由电子对与金属原子形成共轭键的配体,它们能够提供额外的稳定性和反应活性给配位化合物。
相比之下,π酸则指那些能够接受其他分子或离子中非键电子对的金属离子。
π酸与π碱之间的相互作用是一方面调控了配位化合物的组装和稳定性,同时也在许多关键化学反应中发挥着重要作用。
本文将对π配合物和π酸配合物进行详细解释和说明,并概述它们的特点、性质和应用。
1.2 文章结构本文共包括五个部分。
首先,在引言部分我们将提供关于π配合物和π酸配合物的概述和背景信息。
其次,在第二部分中,我们将详细介绍π配合物的定义、特点以及其在化学界中所扮演的重要角色。
第三部分将讨论π酸配合物的形成机制以及其独特性质。
接下来,在第四部分中,我们将通过解释和说明一些实际例子和相关实验结果来展示π配合物和π酸配合物在实际应用中的意义和价值。
最后,在结论与展望部分,我们将总结主要研究结果并展望未来在这个领域中的潜在研究方向。
1.3 目的本文的目的是为读者提供关于π配合物和π酸配合物的全面了解。
通过深入探讨它们的定义、特点、性质和应用,我们希望能够增进对这两个重要化学概念的理解,并为进一步研究和应用提供启示。
此外,对于那些从事相关研究或对该领域感兴趣的读者,本文也提供了一个系统而详尽的参考资料。
2. π配合物的定义和特点2.1 π配位理论在配位化学中,π配位是指配体中的π电子云与金属离子形成键合的过程。
π配位可以发生在含有π电子丰富的原子或分子和具有空的d轨道或f轨道的金属离子之间。
π配位通常涉及对接(ligand)中某个共价键中的一个或多个π电子与金属离子形成共平面结构。
根据π配位理论,π键是由于双键或三键上的叠加而形成的,并且具有共振结构。
有机金属化合物(1)

(η1-C5H5): 2
Fe2+:
6
EAN =18
21
EAN规则有例外
EAN=16,稳定存在 多见:Rb(I)、Pt(II)、Au(III)
平面四边形化合物
著名的Wilkinson催化剂 RhCl(PPh3)3
EAN规则也称:十六、十八电子规则
22
§4-1 金属羰基配合物 (π 酸–配合物)
§4-2 烯烃、炔烃配合物 (π–配合物)
§4-1 金属羰基配合物 §4-2 烯烃、炔烃配合物 §4-3 夹心化合物
1
本章要求
能正确命名。
熟悉典型化合物的合成方法,能描述典型化合物的主要化 学性质。
能熟练运用EAN规则。 能准确描述π–配合物和π–酸配合物成键的特点。 能根据分子轨道理论定性解释羰基配合物的成键,并能根 据振动光谱数据判断羰基的配位模式。
10
基本性质
3. M–C键极性↑,化合物活性↑
Li–C Na–C K–C Rb–C Cs–C
离子性% 43 47 52 52 57
活性
增强
离子型化合物反应活性强
在空气中自燃
遇水剧烈水解
与无机物有机物猛烈反应
11
与真空体系相连的无氧无湿装置
12
手套箱(glove box)
13
有效原子序数规则
(Effective Atomic Number Rule) 金属配合物中,金属原子周围的电子总数
+) 2H- 2×2=4
Fe:EAN =18
Mn(CO)6+ :
Mn+
6
+)6CO 2×6=12
Mn:EAN =18
Fe2(CO)9:
无机化学与化学分析(第三版-史启祯,7-12章)

大重叠原则是在符合对称性匹配原则的前提下, 决定分子轨道组合效 率的问题。
异构现象,异构体。 结构异构体:指配位实体中的配位键类型不同的异构体,包 括配位异构体和键合异构体两种。 键合异构体:化学式相同的配位化合物,由于配体具有两个 或两个以上的不同配位原子,配体分别用不同的配位原子和 中心原子(或离子)键合而产生的异构现象。 配位异构体:指直接与金属原子键合的配体不同,配合物的 化学组成相同。 立体异构体:空间排布不同包括几何异构体,旋光异构体。
(5)如配合物里单电子数为零,为反磁性,如存在单电子 则为顺磁性。 晶体稳定化能指电子占据分裂的 d 轨道后产生的高于平均能 量的额外稳定化能。(cfse) 分子轨道理论(配位场理论)一种化学键理论,是原子轨道 理论对分子的自然推广。
原子轨道线性组合的原则 (分子轨道是由原子轨道线性组合而得的) : ⑴对称性匹配原则 只有对称性匹配的原子轨道才能组合成分子轨道, 这称为对称性匹配 原则。 原子轨道有 s、p、d 等各种类型,从它们的角度分布函数的几何图形 可以看出,它们对于某些点、线、面等有着不同的空间对称性。 对 称性是否匹配,可根据两个原子轨道的角度分布图中波瓣的正、负号 对于键轴(设为 x 轴)或对于含键轴的某一平面的对称性决定。 ⑵能量近似原则 在对称性匹配的原子轨道中, 只有能量相近的原子轨道才能组合成有 效的分子轨道,而且能量愈相近愈好,这称为能量近似原则。 ⑶轨道最大重叠原则 对称性匹配的两个原子轨道进行线性组合时,其重叠程度愈大,则组 合成的分子轨道的能量愈低,所形成的化学键愈牢固,这称为轨道最 大重叠原则。 在上述三条原则中,对称性匹配原则是首要的,它决 定原子轨道有无组合成分子轨道的可能性。 能量近似原则和轨道最
溶液的渗透压 渗透(osmosis):由物质粒子通过半透膜单向扩散的现象。 半透膜(semipermeable membrane):在两个不同浓度的溶液 之间,存在一种能有选择地通过或阻止某些粒子的物质。 渗 透 压 (osmosis pressure) : 为 维 持 半 透 膜 所 隔 开 的 溶液与纯溶剂之间的渗透平衡而需要的超额压力。即阻止渗 透作用进行时所需加给的额外压力。
金属羰基化合物,很强的急性毒性,如何预防?
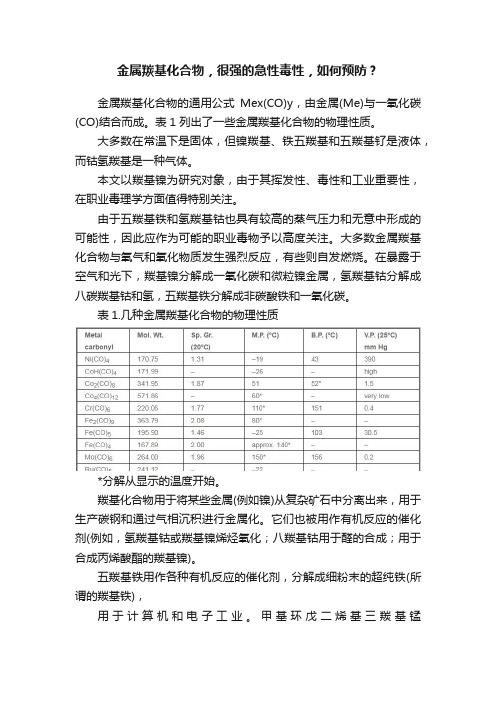
金属羰基化合物,很强的急性毒性,如何预防?金属羰基化合物的通用公式Mex(CO)y,由金属(Me)与一氧化碳(CO)结合而成。
表1 列出了一些金属羰基化合物的物理性质。
大多数在常温下是固体,但镍羰基、铁五羰基和五羰基钌是液体,而钴氢羰基是一种气体。
本文以羰基镍为研究对象,由于其挥发性、毒性和工业重要性,在职业毒理学方面值得特别关注。
由于五羰基铁和氢羰基钴也具有较高的蒸气压力和无意中形成的可能性,因此应作为可能的职业毒物予以高度关注。
大多数金属羰基化合物与氧气和氧化物质发生强烈反应,有些则自发燃烧。
在暴露于空气和光下,羰基镍分解成一氧化碳和微粒镍金属,氢羰基钴分解成八碳羰基钴和氢,五羰基铁分解成非碳酸铁和一氧化碳。
表1.几种金属羰基化合物的物理性质*分解从显示的温度开始。
羰基化合物用于将某些金属(例如镍)从复杂矿石中分离出来,用于生产碳钢和通过气相沉积进行金属化。
它们也被用作有机反应的催化剂(例如,氢羰基钴或羰基镍烯烃氧化;八羰基钴用于醛的合成;用于合成丙烯酸酯的羰基镍)。
五羰基铁用作各种有机反应的催化剂,分解成细粉末的超纯铁(所谓的羰基铁),用于计算机和电子工业。
甲基环戊二烯基三羰基锰(MMT)(CH3C5H4Mn(CO)3)是一种汽油抗爆添加剂。
健康危害金属羰基的毒性取决于一氧化碳的毒性和化合物中金属的毒性,以及羰基本身的挥发性和不稳定性。
接触的主要途径是吸入,但皮肤吸收可以发生在液体羰基化合物。
就急性毒性大鼠LD50而言,羰基镍、氢羰基钴和五羰基铁的之比为1:0.52:0.33。
实验动物吸入这些物质会引起急性间质性肺炎,导致肺水肿和毛细血管损伤,以及脑、肝和肾的损伤。
从关于其毒性的文献来看,羰基钴和五羰基铁在工业中很少对健康造成危害。
然而,当一氧化碳或含有一氧化碳的气体混合物在压力下储存在钢瓶中或通过钢管输送、石油重整产生照明气体或进行气体焊接时,可能会无意中形成五羰基铁。
炼钢过程中,高炉、电弧炉和冲天炉排放的一氧化碳也会导致五羰基铁的生成。
羰基配合物的化学键形式

羰基化合物的化学键形式由表1数据知CO的偶极矩较低,尽管氧原子的电负性(3.44)比碳原子的电负性(2.55)高出许多。
因为π配键的存在抵消了氧和碳原子的电负性差产生的极性,使本来电负性强的氧原子端呈现电正性,原本电负性较弱的碳原子端显示电负性,导致CO的偶极矩μ较小。
H2CO NO HI HBr HCl HF μ(D) 0 0.112 0.159 0.448 0.828 1.09 1.827 表1 偶极矩数据表在金属羰基配合物中总是配体中的碳原子提供孤电子对,与中心离子配位。
EAN规则虽能指出金属羰基配合物的稳定性(即把羰基配合物这种特殊的稳定性看作是中心原子具有稀有气体的电子构型。
但是没有从理论上说明CO能和低氧化态的金属原子形成配合物。
此时要从分子轨道理论入手来说明非经典配合物的成键情况。
CO的分子轨道能图如图一:图 1 CO的分子轨道能级图CO分子中的C和2s和2p原子轨道和O的2s和2p轨道成键。
由于原子中对称性相同的2s和2pz轨道之间轨道杂化,可形成两个sp杂化轨道,因此C原子与O原子形成分子时可以组成2个σ孤电子轨道(其中一个是氧的sp杂化轨道,另一个是碳的sp杂化轨道),一个C-Oσ成键分子轨道和一个空的C-Oσ*分子轨道。
此外还有2个充满电子的π键轨道,是由2个px 轨道和2个py轨道组合而成,分别位于yz和xz平面内。
2个孤电子对所占轨道可看成2个σ轨道,基本上可看成分别为碳原子和氧原子提供。
而中心原子的d电子形成反馈π键(如图2)图2金属M与CO中的σ配键和反馈π键这种反馈π键减少了由于生成σ配键而引起的中心原子上过多的负电荷积累,加强了σ配键,同时σ配键的形成也促进了反馈π键的形成。
这种相互促进和加强的σ—π协同作用,增加了羰基配合物的稳定性。
反馈π键的生成,伴随着碳氧间结合力的削弱,根据羰基配合物中CO的伸缩振动频率可以进一步证实这一点(如表2)化合物Mn(CO)6+Cr(CO)6V(CO)6-Mn2(CO)10Ni(CO)4Fe(CO)42-Fe(CO)5COνco/cm-12090 2018 1800 2017 2066 1790 2035 2143表2一些金属羰基化合物中CO的红外吸收频率在金属羰基簇合物中,一氧化碳分子可以和1个、2个、或3个金属原子键合,一般情况下都是通过碳原子与金属原子结合。
[成套]高中化学竞赛辅导大学无机化学.第07章原子结构和元素周期表
![[成套]高中化学竞赛辅导大学无机化学.第07章原子结构和元素周期表](https://img.taocdn.com/s3/m/3014204dc77da26924c5b0c3.png)
第七章 原子结构和元素周期律Chapter 7 The Atomic Structure and Periodic System of Elements这一章中,我们介绍物质的微观结构──原子结构。
化学工作者总是希望通过对物质 本质的认识,来说明元素相互化合的原理,把化学事实系统化,使化学成为可以理解的、 容易加以记忆的学科。
人们利用这些原理来预言具有新功能的化合物的诞生。
例如科学家 利用等电子原理〔 the isoelectronic principle 〕合成新的化合物:In 1971, the followingisoelectronic compounds were known : Ni(CO) 4 、 Co(CO) 3(NO) 、Fe(CO) (NO)2、 and Mn(CO)(NO) . The last member of thisseries, Cr(NO) , was unknown.234However, in 1972, several chemists had sufficient faith in the isoelectronic principle to photolyze a solution of Cr(CO) 6 in the presence of NO ,and thus they prepared.For many years chemists were unsuccessfully tried to prepare the perbromate ion,BrO 4 .The first successful synthesis of perbromate involved an isoelectronic species as the startingmaterial.83SeO 4283BrO 4因此,学习近代化学知识,从原子内部入手是完全必要的。
我们所关心的原子内部,对于元素及化合物的性质而言,主要集中在原子的电子结构〔 electronic structure of atoms 〕 ,特别是它们的价电子构型〔valence electronic structure of atoms 〕。
北京大学中无机化学答案

北京⼤学中⽆机化学答案⽆机化学习题参考答案(II)第⼀章1.4.解:(1)H 2O 22C(2)S 2O 323v C(3)N 2O (NN O ⽅式) v C ∞(4)Hg 2Cl 2h D ∞(5)H 2C=C=CH 2 2d D (6)UOF 4 C 5v (7)BF 4d T (8)SClF 54v C (9)反-Pt(NH 3)2Cl 2 2h D(10)PtCl 3(C 2H 4)2v C1.B(CH 3)3和BCl 3相⽐,哪⼀个的Lewis 酸性强,为什么?⼀般来说,CH 3为推电⼦基团,Cl 为吸电⼦基团,因此的Lewis 酸性强。
(BCl 3易⽔解;B(CH 3)3不溶于⽔,在空⽓中易燃)2.BH 3和BF 3都可和(CH 3)2NPF 2⽣成加合物,在⼀种加合物中,B 原⼦和N 相连,另⼀种则和P 相连,绘出两种结构式,并说明形成两种结构的原因。
PFFH 3C CH 3NPF F H 3CCH 3NB BH 3F 34. 吸⽔后失效的AlCl 3有什么⽅法可以脱⽔?因为Al 3+是典型的硬酸,与氧的亲合⼒很强,因此实验室不能在HCl ,NH 4Cl ,SOCl 2等⽓氛下加热脱⽔。
(只能加强热⽣成 Al 2O 3后,⽤⾼温下⽤加C 和Cl 2⽤还原氯化法制备,这就不是脱⽔⽅法了)。
第⼆章2.1 解:Ni 2+ d 8组态Pt 2+ d 8组态第四周期(分裂能⼩)第六周期(分裂能⼤)P Ni ClP ClPtCl ClPtCl ClP PPPtrans cis四⾯体构型平⾯四⽅形构型(两种构型)只有⼀种结构(P 代表PPh 3)2.2 解(1)MA 2B 4(2)MA 3B 3M A AB BBB M ABA BBB M ABA ABB M A AA Btrans cis fac(⾯式) mer(经式) D 4h C 2v C 3v C 2v =0 0 0 facmer2.3 Co(en)2Cl 2+D 2hC 2 光活异构体 C 2Co(en)2(NH 3)Cl 2+Cl NH3ClNH 3ClH3Ntrans cis Co(en)(NH3)2Cl2+NH3NH3ClClClNH3ClNH3ClNH3ClNH3ClClNH3NH3trans(1) trans(2) cis2.4 Co(en)33+Ru(bipy)32+⼿性分⼦D3D3PtCl(dien)+ClNCH2CH2CH2NH2NH2CH2基本上为平⾯分⼦,⽆⼿性2.5 (1) 分别⽤BaCl2溶液滴⼊,有⽩⾊沉液出现的为[Co(NH3)5Br]SO4,或分别加⼊AgNO3溶液,产⽣浅黄⾊沉淀的为[Co(NH3)5SO4]Br。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Fe, Ru, Os ( d8 )
全部端羰基
端羰基 + 双桥羰基
.[Ru3(CO)12]
Click on an image to view 3D model
端羰基+双桥羰基
Fe3(CO)10(–CO)2
全部端羰基
M4(CO)9(-CO)3
Ir4(CO)12
M6(CO)12(3–CO)4,
[RuCl(CO)(PPh3)2l(NO)]+
120
136
1520
1687
16
16
4. 膦类配体 AX3 ( A= P, As, N), X=卤素, -R, -Ar, -OR :PR3 强给电子体 P M 给体, M P *(d轨道)受体, 反馈键 (弱) 酸性:
PF3 > PCl3 > P(OR)3 > PR3
6.羰基化合物(阴离子,氢化物)的反应
1. 取代反应: CO被PX3, PR3, P(OR)3, SR2, NR3, OR2, RNC, C6H6或C5H5-等基团取代
Fe(CO)5 +C8H8 C8H8 Fe(CO)3+ 2CO
2. 和碱OH-,H-,NH2-反应生成羰基阴离子
Fe(CO)5 +3NaOH Na[H Fe(CO)4](aq) + Na2CO3 +
H2O
3. 与还原剂反应生成羰基阴离子或氢化物
Co2(CO)8 + 2Na(Hg) 2Na[Co(CO)4]
Co2(CO)4 + H2 2HCo(CO)4
HFe(CO)5+
-
C5H5Fe(CO)2]2
H2SO4 PPh 3
Ph3PFe(CO)4, (Ph3P) 2Fe(CO)3
CH3Mn(CO)5 ( C4v )
HMn(CO)5 ( C4v ) [HV(CO)6 ] ( 不存在) WMe6 ( Oh )
18e (1+7+10) or (2+6+10)
18e (1+7+10) or (2+6+10) 18 e 12e (不符合EAN规则)
3. 多核羰基化合物
单数族( Mn d7, Co d9 )
Ru(acac)3(soln)+H2+12CO(g) Ru3(CO)12(s) + ….
(150º C, 200 atm, CH3OH)
金属化合物 + 还原剂(Na, Al, AlR3, H2, CO) + CO
5. 羰基化合物的成键和分子光谱
CO的分子轨道示意图(10e)
D3h 对称性,振动谱带数为2
IR的CO伸缩谱带数与结构
配合物 M(CO)6 M(CO)5L M(CO)4L2 M(CO)3L3 异构体 点群 Oh C4v D4h C2v C2v C3v C4v Td 谱带数 1 3(2) 1 4(3,2) 3(2) 2 1 1
trans cis mer fac
8e
电子数 = 9+4+2+1=16
或者 d8 8+4+2+2=16
Cl
Ir的化合物 Ir(CO)Cl(PPh3)2
(a) 端羰基
(b) 双桥羰基 (边桥基) 2 -CO 或 –CO
(c) 三桥羰基 (面桥基) 3-CO
提供电子数:2
2. 单核羰基化合物
V(CO)6 ( Oh ) Cr(CO)6 Mo(CO)6 W(CO)6 ( Oh ) Fe(CO) 5 Ru(CO)5 ( D3h ) Ni(CO)4 ( Td ) 17e (不符合EAN规则) 18e 18e 18e
CO的HOMO为给体(பைடு நூலகம்)
CO的LUMO为受体(酸)
金属羰基化合物的反馈键(back bond)生成示意图
羰基成键的表征:
分子振动光谱( 红外, 拉曼)
反馈键强, CO的 轨道的电子云密度增大
则C O间的键级减弱 力常数减小 振动频率减低
结论: 中心M 的电子云密度越大, 或者给电子能力越强, 反馈键越强, CO越小
第7章 金属羰基和酸配体化合物
1. d区过渡金属与羰基:CO和类羰 基 :PR3(膦), :PX3, :AsR3(胂), NO, :CNR(异腈)
2. d区过渡金属为低价态(零价或负价)
HSAB中属于SA
配体为酸( acids)配体,或受体( acceptor)
HSAB中属于SB , 有空的d轨道或*轨道
弯曲形 NO = 1500~1700cm–1
若干含弯曲形MNO化合物的特征
化合物 MNO/ ° NO/cm1 价电子
[Co(en)2Cl(NO)]+
[IrCl(CO)(PPh3)2(NO)]+ IrCl2(PPh3)2(NO)
121
124 123
1611
1680 1560
18
16 16
IrI(CH3)(PPh3)2(NO)
膦配体取代CO后对 CO振动频率的影响
讨论: 不同膦配体取代CO后, 其他CO的红外振 动频率如何变化? fac-Mo(CO)3L3, fac-Mo(CO)3py3 fac-Mo(CO)3(PPh3)3 fac-Mo(CO)3(P(OMe)3)3 fac-Mo(CO)3(PCl3)3 fac-Mo(CO)3(PF3)3 1888, 1746 cm–1 1934, 1836 cm–1 1945, 1854 cm–1 2040, 1991 cm–1 2090, 2055 cm–1
C5H6
C7H8Fe(CO)3
C7H8
HgFe(CO)4 Fe(CO)5 NaOH(aq) Na[HFe(CO)4] UV
Hg
+2
C8H8
H
+
H2Fe(CO)4
C8H8Fe(CO)3
Fe2(CO)9 OH [Fe2(CO)8]-2
-
Fe(CO)5的还原及酸碱反应
O O C C O H
0 97 C C Mn
O
C 160pm O
羰基氢化物HMn(CO)5
二.类羰基化合物
类羰基配体: 给体, *受体, 反馈键 1. RNC ( 异腈) R–NC: 例: Cr(CNC6H5)6 2. N2 ( 双氮分子 dinitrogen), CO的等电子体
固氮酶的模型化合物 M: NN
M: NN: M
[Ru(NH3)5N2]Cl2
M(CO)L5 M(CO)4
讨论:
M(CO)n M(CO)n+ M(CO)n– 哪一个的羰基振动频率高?
Mn(CO)6+ ~2090 Cr(CO)6 ~2000 V(CO)6 ~1860
Mn (CO)3(dien)+ ~2020, ~1900 Cr (dien) (CO)3 ~1900, ~1760
4个面桥基
4. 羰基化合物的制备
a. 直接合成法 Ni(s)+4CO(g) Ni(CO)4(l) Fe(s)+5CO(g) Fe(CO)5(l) (200º C, 200atm) Co(s)+8CO(g) Co2(CO)8(s) (150º C, 35atm)
合成Fe(CO)5的高压反应釜
中性金属羰基化合物中CO伸缩振动频率的大致范围
自由CO: 2143cm–1 端羰基: ~1900~2050cm–1
二桥基( 边桥基): 1800~1900cm–1
三桥基( 面桥基): ~1600~1800cm–1
Fe2(C5H5)2(CO)4的红外吸收光谱
液体Fe(CO)5中羰 基振动的红外和拉 曼光谱
( FeF63–, SiF62– 等为HA-HB的静电 作用)
1.金属羰基化合物(carbonyls)
EAN 规则(十八电子规则) 单核和多核羰基化合物 羰基化合物的成键和振动光谱 制备方法
2.类羰基化合物(carbon monoxide analogs)
一.羰基化合物
1890年, Mond Ni(CO)4 1891年, Mond Fe(CO)5
L的碱性减弱, MCO的反馈减小, CO 增加
第7章本章习题
2,3,4,5,9
端基:
桥基:
N
侧基
M N
4+ Ru
N
Cl PR3
N Rh N PR3
N Ru NH3
双氮桥式配体 [Ru2(NH3)10N2]Cl4
双氮侧基配体 Rh(PR3)2N2Cl
3. NO配体
M
N
O
O M N
3电子给体, 直线形
单电子给体, 弯曲形
自由 直线
NO = 1876cm–1 NO = 1800~1900cm–1
1. 有效原子数规则(Effective Atomic Number EAN规则) 配位电子+中心金属原子的价电子= 18/16 P区元素 d区元素 八隅律 ns np (n-1)d 1 3 5 9个轨道 容纳18个电子
例:
Cr
Mn
3d54s1
3d54s2
6e
7e
Fe
Ph3P
3d64s2
CO Ir PPh3
*b. 还原羰基化 ( reductive carbonylation)
CrCl3 (s)+ Al(s) + 6CO(g) AlCl3(soln) + Cr(CO)6(soln)
(AlCl3, 苯)
Re2O7(s) + 17CO(g) Re2(CO)10(s) + 7CO2
(250º C, 350 atm)
