国家食品药品监督管理总局药品审评中心拟录用工作人员情况
国家食品药品监督管理总局关于药品注册审评审批若干政策的公告(2015年第230号)

根据《中华⼈民共和国药品管理法》、《国务院关于改⾰药品医疗器械审评审批制度的意见》(国发〔2015〕44号)等有关规定,为解决药品注册申请积压问题,提⾼药品审评审批质量和效率,经国务院同意,实⾏如下药品注册审评审批政策。
现予以公告: ⼀、提⾼仿制药审批标准 仿制药按与原研药质量和疗效⼀致的原则受理和审评审批。
其中,对已在中国境外上市但尚未在境内上市药品的仿制药注册申请,应与原研药进⾏⽣物等效性研究并按国际通⾏技术要求开展临床试验,所使⽤的原研药由企业⾃⾏采购,向国家⾷品药品监督管理总局申请⼀次性进⼝;未能与原研药进⾏对⽐研究的,应按照创新药的技术要求开展研究。
已经受理的仿制药注册申请,实⾏分类处理: (⼀)中国境内已有批准上市原研药,申请注册的仿制药没有达到与原研药质量和疗效⼀致的,不予批准。
(⼆)中国境外已上市但境内没有批准上市原研药,申请仿制药注册的企业可以选择按原规定进⾏审评审批,但在药品批准上市3年内需按照国发〔2015〕44号⽂件规定进⾏质量和疗效⼀致性评价,未通过⼀致性评价的注销药品批准⽂号;企业也可以选择撤回已申报的注册申请,改按与原研药质量和疗效⼀致的标准完善后重新申报。
对上述重新申报的注册申请实⾏优先审评审批,批准上市后免于进⾏质量和疗效⼀致性评价。
对申报上市的仿制药注册申请,⾸先审查药学研究的⼀致性,药学研究未达到要求的,不再对其他研究资料进⾏审查,直接作出不予批准决定。
⼆、规范改良型新药的审评审批 对改变原研药剂型、酸根、碱基和给药途径等的药品注册申请,申请⼈需证明其技术创新性且临床价值与原品种⽐较具有明显优势;⽆法证明具备上述优势的,不予批准。
改变剂型和规格的⼉童⽤药注册申请除外。
三、优化临床试验申请的审评审批 对新药的临床试验申请,实⾏⼀次性批准,不再采取分期申报、分期审评审批的⽅式;审评时重点审查临床试验⽅案的科学性和对安全性风险的控制,保障受试者的安全。
加强临床试验申请前及过程中审评⼈员与申请⼈的沟通交流,及时解决注册申请和临床试验过程中的问题。
国家开放大学《药事管理与法规(本)》形考任务1-4参考答案

国家开放大学《药事管理与法规(本)》形考任务1-4参考答案形考任务1一、单项选择题1.从药品使用途径和安全管理角度,可将药品分为()。
a.处方药与非处方药b.新药、仿制药、进口药品和医疗机构制剂c.现代药和传统药d.国家基本药物、国家储备药品2.药品的(),是指在规定的条件下保持其有效性和安全性的能力。
a.安全性b.有效性c.均一性d.稳定性3.《药品管理法》规定,国务院药品监督管理部门颁布的《中华人民共和国药典》和药品标准为()。
a.药品注册标准b.药品经营标准c.国家药品标准d.局颁标准4.()是国家依法对生产、经营和使用的药品质量进行有目的的调查和检查的过程,是药品监督管理部门通过技术方法对药品质量合格与否做出判断的一种重要手段。
a.复验b.指定检验c.抽查检验d.注册检验5.以下关于非处方药的管理要求描述有误的是()。
a.非处方药的包装必须印有国家指定的非处方药专有标识b.非处方药专有标识图案分为绿色和红色,绿色专有标识用于甲类非处方药品,红色专有标识用于乙类非处方药品和用作指南性标志c.非处方药可以在大众媒介上进行广告宣传,但广告内容必须经过审查、批准,不能任意夸大或篡改,以正确引导消费者科学、合理地进行自我药疗d.非处方药的标签和说明书必须经过国家药品监督管理部门批准,用语要科学、易懂,便于消费者自行判断、选择和使用6.()的目标是双重的,既培养药学人才,又出药学研究成果。
a.药品管理行政组织b.药学科研组织c.药事社团组织d.药学教育组织7.()主管全国的药品监督管理工作,对药品的研制、生产、流通、使用等环节实施统一监督管理。
a.国家药品监督管理部门b.工商管理部门c.卫生行政部门d.中医药管理部门8.药品生产企业按()分为化学药生产厂(化学原料药及其/或者制剂厂),为主的中药厂(中药饮片厂、中成药厂),生化药厂和基因工程产品为主的生物技术制药公司等。
a.生产资料所有制形式不同b.所生产的药品类型c.企业规模d.药品分类管理办法9.()成立于1907年,是中国最早成立的学术团体之一a.中国中药协会b.中国处方药物协会c.中国药学会d.中国药师协会10.执业药师注册的有效期是()。
【免费下载】国家药品审评中心审评人员公示名单04

药品审评中心审评人员公示名单 (2015年4月)部门姓名 所负责工作分机中心主任许嘉齐611中心副主任尹红章602中心副主任侯仁萍603中心领导中心主任助理胡 军协助分管主任负责中药药品审评的技术管理工作604负责审评技术资料管理、审评任务分发调度及相关督查协调工作。
承担相关审评报告综合以及审评文件管理,组织开展与新药审评相关的核查、验证工作;承担主动撤回申请和超过规定时限未按要求提交补充资料等品种的相关处理工作;负责与国家食品药品监督管理局相关部门协调技术审评工作;承担业务咨询及业务信息管理工作。
负责中心文电、会务、档案等日常运转工作以及安全保密、印章管理、外部联络等工作。
承担中心交办的其他工作。
副部长温宝书303副部长王 敏172 何燕萍101张晓东102王 鹏104黄清竹105业务管理部协调员刘 璐106负责中药、民族药及天然药物临床试验申请和注册申请的药学研究资料的技术审评工作,提出药学专业审评意见并形成药学专业审评报告。
负责中药、民族药及天然药物7~8类临床试验申请、7~9类注册申请、各类注射剂注册申请、相关补充申请以及进口再注册申请的综合评价工作,形成技术审评报告,并提出明确结论意见及处理建议。
承担中心交办的其他工作。
部长胡 军604 副部长周跃华486阳长明401张永文402曲建博406金 芳407李计萍408周 刚409韩 炜412中药民族药药学部成员马秀璟413负责化学药物1~3类临床试验申请和注册申请、国际多中心临床试验申请的药学研究资料的技术审评工作,提出药学专业审评意见并形成药学专业审评报告。
负责化学药物3类临床试验申请的综合评价工作,形成技术审评报告,并提出明确结论意见及处理建议。
承担中心交办的其他工作。
副部长马玉楠577王 旸502任连杰505康建磊506王亚敏507于 红508王宏亮511马 磊512张 宁513霍秀敏514化药药学一部成员刘宗英515 负责化学药物4~5类临床试验申请、进口药注册申请、进口再注册申请、相关补充申请及其他申请的药学研究资料及生物等效性试验资料的技术审评工作,提出药学专业和相应生物等效性资料的审评意见并形成药学专业审评报告。
2011年药品审评中心CDE-审评人员完整名单及联系方式
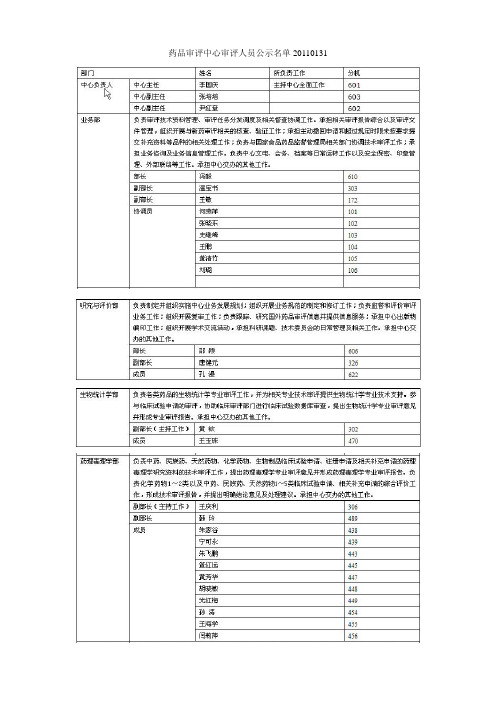
药品审评中心审评人员公示名单20110131关于国家食品药品监督管理局药品审评中心调整主要职责和内设机构的批复国食药监人函[2010]219号(一)业务管理部负责审评技术资料管理、审评任务分发调度及相关督查协调工作。
承担相关审评报告综合以及审评文件管理,组织开展与新药审评相关的核查、验证工作;承担主动撤回申请和超过规定时限未按要求提交补充资料等品种的相关处理工作;负责与国家食品药品监督管理局相关部门协调技术审评工作;承担业务咨询及业务信息管理工作。
负责中心文电、会务、档案等日常运转工作以及安全保密、印章管理、外部联络等工作。
承担中心交办的其他工作。
(二)中药民族药药学部负责中药、民族药及天然药物临床试验申请和注册申请的药学研究资料的技术审评工作,提出药学专业审评意见并形成药学专业审评报告。
负责中药、民族药及天然药物7~8类临床试验申请、7~9类注册申请、各类注射剂注册申请、相关补充申请以及进口再注册申请的综合评价工作,形成技术审评报告,并提出明确结论意见及处理建议。
承担中心交办的其他工作。
(三)化药药学一部负责化学药物1~3类临床试验申请和注册申请、国际多中心临床试验申请的药学研究资料的技术审评工作,提出药学专业审评意见并形成药学专业审评报告。
负责化学药物3类临床试验申请的综合评价工作,形成技术审评报告,并提出明确结论意见及处理建议。
承担中心交办的其他工作。
(四)化药药学二部负责化学药物4~5类临床试验申请、进口药注册申请、进口再注册申请、相关补充申请及其他申请的药学研究资料及生物等效性试验资料的技术审评工作,提出药学专业和相应生物等效性资料的审评意见并形成药学专业审评报告。
负责化学药物4~5类临床试验申请以及5~6类注册申请、进口药临床试验申请、进口再注册申请、相关补充申请及其他申请的综合评价工作,形成技术审评报告,并提出明确结论意见及处理建议。
承担中心交办的其他工作。
(五)生物制品药学部负责生物制品临床试验申请、注册申请及相关补充申请的药学研究资料的技术审评工作,提出药学专业审评意见并形成药学专业审评报告。
药品审评中心审评人员公示名单
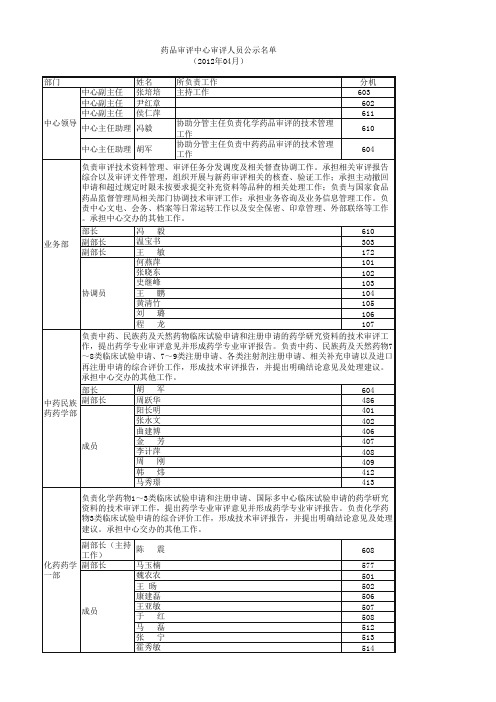
协助分管主任负责化学药品审评的技术管理 610 工作 协助分管主任负责中药药品审评的技术管理 中心主任助理 胡军 604 工作 负责审评技术资料管理、审评任务分发调度及相关督查协调工作。承担相关审评报告 综合以及审评文件管理,组织开展与新药审评相关的核查、验证工作;承担主动撤回 申请和超过规定时限未按要求提交补充资料等品种的相关处理工作;负责与国家食品 药品监督管理局相关部门协调技术审评工作;承担业务咨询及业务信息管理工作。负 责中心文电、会务、档案等日常运转工作以及安全保密、印章管理、外部联络等工作 。承担中心交办的其他工作。 中心主任助理 冯毅 部长 副部长 副部长
负责中药、民族药及天然药物临床试验申请(包括国际多中心临床试验申请)的技术 审评工作,提出临床专业审评意见并形成临床专业审评报告。负责中药、民族药及天 然药物6类临床试验申请、1~6类注册申请以及相关补充申请的综合评价工作,形成 技术审评报告,并提出明确结论意见及处理建议。承担中心交办的其他工作。 中药民族 部长 药临床部 副部长 张 磊 605 李攻戍 487 周 贝 419 王 停 423 成员 裴小静 425 刘炳林 426 吕佳康 427 负责精神障碍疾病药物、镇痛药及麻醉科药物、内分泌用药、抗风湿及免疫药物、呼 吸系统及抗过敏药物、抗肿瘤药物、血液病药物、医学影像学等化学药物以及治疗和 预防用生物制品临床试验申请(包括国际多中心临床试验申请)、注册申请的临床研 究资料的技术审评工作,提出临床专业审评意见并形成临床专业审评报告。负责上述 治疗领域化学药品1~4类及进口药注册申请、国际多中心临床试验申请、相关补充申 请的评价工作,形成技术审评报告,并提出明确结论意见及处理建议。承担中心交办 的其他工作。 化药临床 副部长(主持 杨志敏 304 一部 工作) 副部长 高晨燕 579 张 杰 543 王宏宇 544 赵德恒 548 成员 杨 焕 549 张 虹 553 陈晓媛 554 负责神经系统药物、循环系统药物、肾脏/泌尿系统药物、生殖系统药物、消化系统 药物、抗感染药物、电解质酸碱平衡及营养药、扩容药、皮肤科及五官科药物、器官 移植、外科和其他化学药物以及治疗和预防用生物制品临床试验申请(包括国际多中 心临床试验申请)、注册申请的临床研究资料的技术审评工作,提出临床专业审评意 见并形成临床专业审评报告。负责对上述治疗领域化学药品1~4类及进口药注册申请 、国际多中心临床试验申请、相关补充申请的综合评价工作,形成技术审评报告,并 提出明确结论意见及处理建议。承担中心交办的其他工作。 副部长(主持 王 涛 305 工作) 化药临床 副部长 杨进波 343 二部 卓 宏 555 康彩练 558 钱思源 561 鲁 爽 562 赵 明 563 成员 王水强 564 华尉利 565 赵建中 569 谢松梅 571 左晓春 575 负责各类药品的生物统计学专业审评工作,并为相关专业技术审评提供生物统计学专 业技术支持。参与临床试验申请的审评,协助临床审评部门进行临床试验数据库审 查,提出生物统计学专业审评意见并形成专业审评报告。承担中心交办的其他工作。 副部长(主持 黄 钦 工作) 王玉珠 成员 王 骏 302 470 475
国家药品审评中心审评人员公示名单2015.04.doc

(2015年4月)
部门
姓名
所负责工作
分机
中心领导
中心主任
许嘉齐
611
中心副主任
尹红章
602
中心副主任
侯仁萍
603
中心主任助理
胡 军
协助分管主任负责中药药品审评的技术管理工作
604
业务管理部
负责审评技术资料管理、审评任务分发调度及相关督查协调工作。承担相关审评报告综合以及审评文件管理,组织开展与新药审评相关的核查、验证工作;承担主动撤回申请和超过规定时限未按要求提交补充资料等品种的相关处理工作;负责与国家食品药品监督管理局相关部门协调技术审评工作;承担业务咨询及业务信息管理工作。负责中心文电、会务、档案等日常运转工作以及安全保密、印章管理、外部联络等工作。承担中心交办的其他工作。
副部长(主持工作)
杨建红
607
副部长
黄晓龙
576
9
李 丽
520
田 洁
524
宁黎丽
525
张玉琥
526
张 震
527
李晓峰
529
许真玉
530
李志万
531
何 伍
532
蒋 煜
533
张星一
536
成海平
537
李雪梅
539
生物制品药学部
负责生物制品临床试验申请、注册申请及相关补充申请的药学研究资料的技术审评工作,提出药学专业审评意见并形成药学专业审评报告。负责生物制品临床试验申请及注册申请、相关补充申请的综合评价工作,形成技术审评报告,并提出明确结论意见及处理建议。承担中心交办的其他工作。
部长
胡 军
2013年4月国家药品审评中心审评人员名单

生物统计学部 黄 钦Fra bibliotek副部长(主持工作) 杨志敏
304
副部长
高晨燕
579
成员
张杰
543
王宏宇
544
赵德恒
548
杨焕
549
张虹
553
陈晓媛
554
负责神经系统药物、循环系统药物、肾脏/泌尿系统药物、生殖系统药物、消化系统药物、抗感染药物、电解质 酸碱平衡及营养药、扩容药、皮肤科及五官科药物、器官移植、外科和其他化学药物以及治疗和预防用生物制品 临床试验申请(包括国际多中心临床试验申请)、注册申请的临床研究资料的技术审评工作,提出临床专业审评 意见并形成临床专业审评报告。负责对上述治疗领域化学药品 1~4 类及进口药注册申请、国际多中心临床试验 申请、相关补充申请的综合评价工作,形成技术审评报告,并提出明确结论意见及处理建议。承担中心交办的其 他工作。
2013 年 4 月国家药品审评中心审评人员名单 (2013 年 04 月)
部门
姓名
所负责工作
分机
中心领导
中心主任
张培培
601
中心副主任
尹红章
602
中心副主任
侯仁萍
603
中心主任助理
冯毅
协助分管主任负责化学药品审评的技术管理工作
610
中心主任助理
胡军
协助分管主任负责中药药品审评的技术管理工作
604
业务部
副部长
李攻戍
487
成员
周贝
419
程龙
420
王停
423
化药临床一部 化药临床二部 生物统计学部
裴小静
425
刘炳林
426
药品注册审评CDE组织机构人员信息

药品注册审评CDE最新组织机构、审评流程和人员信息一、CDE组织机构:原管协部二、不同类别的注册申请在不同申报阶段对应的审评部门:按照药品注册分类,不同类别临床试验申请和注册申请的审评部门不同,具体划分如下:注:1、所有的药品申请在各阶段的审评都有业务管理部的参与,表中略;2、表中的“临床”指的是化药临床一部或者二部,具体按品种适应症分。
三、化药相关审评部门人员如下:※:表示主持工作的负责人四、CDE 简易审评流程图:注意事项: (1)药品审评中心自2010年4月6日起在具体注册申请的技术审评过程中同步完成质量标准、说明书、包装标签等文件的修订审核工作,请注册申请人在注册申请到达我中心后及时通过CDE 网站电子提交系统提交相关电子文件。
(2)技术审评阶段如存在以下情况,有可能会影响审评进度,请您关注:请务必在我中心专业审评阶段结束前登陆我中心网站电子提交系统提交相关电子文档(注意根据注册申请的具体事项确定提交的具体内容)。
电子提交工作将有助于提高审评工作的效率。
(3)关注检验报告提示:注册申请如要求提交检验报告,请务必关注检验报告的寄交情况。
如专业审评时仍未收到检验报告,将暂停审评,同时暂停审评计时。
(4)业务管理部接收申报资料后,将对申报资料进行立卷审查:确认电子任务与物理资料是否同步到达、是否缴纳审评费、是否提交研制现场核查报告、仿制药是否提交生产现场检查报告及动态检验报告。
上述条件均满足后,将正式启动审评。
五、CDE 发布的《药品技术审评原则和程序》及审评流程图:详见:/regulat.do?method=view&id=2133专业审评中综合评价技术审核文件制作与中心审核签发业务管理部接受资料业务管理部分配任务审评部安排审评计划呈送SFDA等待执行其它业务药品技术审评简化程序示意图主审人部长部长分配任务主审人部长部长分配任务部长中心主任参审人参参审人单专业审评程序平行审评程序序贯审评程序。
药品审评中心审评人员公示名单 2015.04
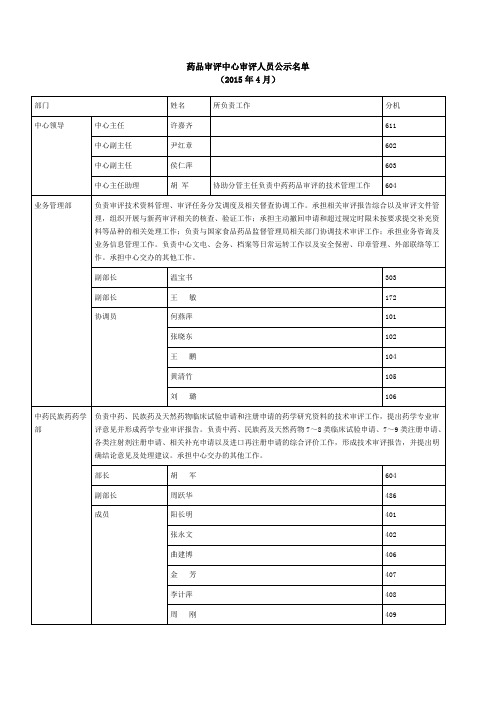
唐健元
326
成员
马 坤
118
申 宁
626
药审中心主审审评员资格人员名单 (2015年4月)
审
评
部
门
中药民族药药学部
胡 军、周跃华、阳长明、张永文、李计萍、马秀璟、金 芳、韩 炜、周 刚
化药药学一部
马玉楠、王亚敏、霍秀敏、于 红、张 宁、马 磊、康建磊
化药药学二部
杨建红、黄晓龙、宁黎丽、张玉琥、成海平、许真玉、何 伍、田 洁、李志万、李雪梅、蒋 煜、张 震、张星一
副部长(主持工作)
杨建红
607
副部长
黄晓龙
576
成员
石 靖
517
章俊麟
519
李 丽
520
田 洁
524
宁黎丽
525
张玉琥
526
张 震
527
李晓峰
529
许真玉
530
李志万
531
何 伍
532
蒋 煜
533
张星一
536
成海平
537
李雪梅
539
生物制品药学部
负责生物制品临床试验申请、注册申请及相关补充申请的药学研究资料的技术审评工作,提出药学专业审评意见并形成药学专业审评报告。负责生物制品临床试验申请及注册申请、相关补充申请的综合评价工作,形成技术审评报告,并提出明确结论意见及处理建议。承担中心交办的其他工作。
生物统计学部
黄 钦
副部长(主持工作)
王庆利
306
副部长
韩 玲
489
成员
朱家谷
438
宁可永
439
朱飞鹏
443
药品审评中心审评人员公示名单[1][1]
![药品审评中心审评人员公示名单[1][1]](https://img.taocdn.com/s3/m/b3b608f29e314332396893ce.png)
治疗用生物制品(呼吸)
常卫红/555
赵超/559
胡晓敏/463
李娅杰/461
治疗用生物制品(精神神经)
常卫红/555
赵超/559
王庆利/525
王水强/518⑤
治疗用生物制品(抗感染)
常卫红/555
赵超/559
孙涛/454
谢松梅/458
治疗用生物制品(抗肿瘤、放射)
罗建辉/549
罗建辉/549
吕佳康/427
呼吸B
黄芳华/425
李计萍/424
黄芳华/425
吕佳康/427
其他
朱飞鹏/426
李计萍/424
黄芳华/425
吕佳康/427
审评四室
消化
笪红远/437
张永文/439
笪红远/437
裴小静/438
妇科B
张永文/439
张永文/439
笪红远/437
裴小静/438
妇科A
裴小静/438
张永文/439
室主任
吕东
复核审评五室所承担品种的综合审评报告
455
审评六室
室主任
赵德恒
复核审评六室所承担品种的综合审评报告
464
审评四部
部长
左晓春
审核审评四部所承担品种的综合审评报告
607
副部长
黄晓龙
协助部长负责审评四部工作
576
审评七室
室主任
高晨燕
复核审评七室所承担品种的综合审评报告
501
审评八室
室主任
陈海峰
复核审评八室所承担品种的综合审评报告
③朱家谷同志负责的五官项目负责人工作暂由马秀璟同志负责。朱家谷同志负责的药理毒理第一专业审评员工作暂由宁可永同志负责(分机号码:419)。
国家食品药品监督管理总局药品审评中心审评员管理暂行办法(试行)剖析

国家食品药品监督管理总局药品审评中心审评员管理暂行办法(试行)第一章总则第一条为推进药品审评审批制度改革,深化国家食品药品监督管理总局药品审评中心(以下简称“中心”)人事制度改革,规范药品审评人员管理,保障审评员的合法权益,根据《事业单位人事管理条例》、《人事部关于在事业单位试行人员聘用制度意见》以及药品医疗器械审评审批制度改革工作意见等法规政策,结合药品审评工作实际,制定本办法。
第二条本办法所称审评员,是指在规定的岗位范围内,按照聘用合同管理,从事药品审评工作的专业技术人员,包括事业编制内和事业编制外审评员.第三条中心按照“招得到、用得好、留得住、退得出”的原则,建立科学、规范、有效的审评员管理制度。
第二章岗位设置第四条根据审评工作需要,科学合理设置审评岗位,坚持按需设岗、精简高效、按岗聘用、分级管理。
第五条根据药品审评职责任务和岗位任职条件,分级设置审评岗位。
审评岗位包括:首席审评员、高级审评员、主审审评员、审评员。
其中主审审评员岗位分为6档,审评员岗位分为4档。
药品审评实行首席审评员负责制,首席审评员对技术审评工作进行总把关,经中心授权签发技术审评意见。
第六条根据审评任务数量、审评任务结构、产业发展趋势等因素合理确定并调整各审评相关学科、各专业审评岗位职数和比例。
第七条各级审评岗位的主要职责如下:(一)首席审评员:负责药品安全、有效、质量可控方面的技术把关,并根据中心授权签发技术审评意见;制定并实施药品审评专业技术领域的学科建设规划,负责跟踪把握国内外本专业领域学科发展前沿趋势,构建药品审评专业技术领域的科学化审评体系;牵头开展药品审评规范、指导原则体系、审评共性问题的研究,组织审评团队解决疑难品种和评审疑难问题;指导和培养其他审评人员开展工作。
(二)高级审评员:负责建立或完善药品审评专业技术领域的科学化审评体系;负责组织开展本专业领域相关技术标准和指导原则的起草工作;负责对本专业领域的疑难问题提出处理意见;指导和培养主审审评员和审评员开展工作。
国家食品药品监督管理局关于公布第七批、第八批重新聘任的国家药品GMP检查员名单的通知

国家食品药品监督管理局关于公布第七批、第八批重新聘任的国家药品GMP检查员名单的通知
文章属性
•【制定机关】国家食品药品监督管理局(已撤销)
•【公布日期】2012.07.24
•【文号】
•【施行日期】2012.07.24
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】药政管理
正文
国家食品药品监督管理局关于公布第七批、第八批重新聘任的国家药品GMP检查员名单的通知
各省、自治区、直辖市食品药品监督管理局(药品监督管理局):
为加强对药品GMP检查员的管理,规范检查员队伍建设,按照国家局开展药品GMP检查员重新聘任工作计划,经各省(区、市)食品药品监管部门推荐,国家局综合考评,杨丽等110人为第七批重新聘任的国家药品GMP检查员,恭庆华等62人为第八批重新聘任的国家药品GMP检查员,两批共计172人,现予公布并核发《国家药品GMP检查员证》。
附件:1.第七批重新聘任的国家药品GMP检查员名单
2.第八批重新聘任的国家药品GMP检查员名单
国家食品药品监督管理局
2012年7月24日附件1
第七批重新聘任的国家药品GMP检查员名单
附件2。
国家食品药品监督管理总局药品审评中心审评员管理暂行办法(试行)剖析

国家食品药品监督管理总局药品审评中心审评员管理暂行办法(试行)第一章总则第一条为推进药品审评审批制度改革,深化国家食品药品监督管理总局药品审评中心(以下简称“中心”)人事制度改革,规范药品审评人员管理,保障审评员的合法权益,根据《事业单位人事管理条例》、《人事部关于在事业单位试行人员聘用制度意见》以及药品医疗器械审评审批制度改革工作意见等法规政策,结合药品审评工作实际,制定本办法。
第二条本办法所称审评员,是指在规定的岗位范围内,按照聘用合同管理,从事药品审评工作的专业技术人员,包括事业编制内和事业编制外审评员。
第三条中心按照“招得到、用得好、留得住、退得出”的原则,建立科学、规范、有效的审评员管理制度。
第二章岗位设置第四条根据审评工作需要,科学合理设置审评岗位,坚持按需设岗、精简高效、按岗聘用、分级管理。
第五条根据药品审评职责任务和岗位任职条件,分级设置审评岗位。
审评岗位包括:首席审评员、高级审评员、主审审评员、审评员。
其中主审审评员岗位分为6档,审评员岗位分为4档。
药品审评实行首席审评员负责制,首席审评员对技术审评工作进行总把关,经中心授权签发技术审评意见。
第六条根据审评任务数量、审评任务结构、产业发展趋势等因素合理确定并调整各审评相关学科、各专业审评岗位职数和比例。
第七条各级审评岗位的主要职责如下:(一)首席审评员:负责药品安全、有效、质量可控方面的技术把关,并根据中心授权签发技术审评意见;制定并实施药品审评专业技术领域的学科建设规划,负责跟踪把握国内外本专业领域学科发展前沿趋势,构建药品审评专业技术领域的科学化审评体系;牵头开展药品审评规范、指导原则体系、审评共性问题的研究,组织审评团队解决疑难品种和评审疑难问题;指导和培养其他审评人员开展工作。
(二)高级审评员:负责建立或完善药品审评专业技术领域的科学化审评体系;负责组织开展本专业领域相关技术标准和指导原则的起草工作;负责对本专业领域的疑难问题提出处理意见;指导和培养主审审评员和审评员开展工作。
国家食品药品监督管理总局办公厅关于公布第一批重新聘任的国家药品GMP检查员名单的通知

国家食品药品监督管理总局办公厅关于公布第一批重新聘任的国家药品GMP检查员名单的通知文章属性•【制定机关】国家食品药品监督管理总局(已撤销)•【公布日期】2016.05.23•【文号】食药监办药化监〔2016〕73号•【施行日期】2016.05.23•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文总局办公厅关于公布第一批重新聘任的国家药品GMP检查员名单的通知食药监办药化监〔2016〕73号各省、自治区、直辖市食品药品监督管理局:为加强药品GMP检查员管理,规范检查员队伍建设,按照食品药品监管总局工作安排,经系统培训、综合考评,现聘任张岩等302人为国家药品GMP检查员,现予公布并核发《国家药品GMP检查员证》。
附件:第一批重新聘任的国家药品GMP检查员名单食品药品监管总局办公厅2016年5月23日附件第一批重新聘任的国家药品GMP检查员名单1.北京(15人)张岩彦玲毕元俞坚净张凤梅李卫华张京航张娟宋然然郭欣张联张彤丁锐孔莉魏锡庚2.天津(8人)刘树春牛东斌王守斌黎阳刘言王岩马竹波王玉洁3.河北(13人)马琳段春改李石赵立新耿革霞李晓鹏杜增辉靳茂礼胡鹏飞董亚林薛东升许海鹰宫晓平4.山西(9人)李泽红雷岚芬李青翠王春芳李晶晶赵运江库晓娟于如海韩小平5.内蒙古(4人)王宇李征田甸丰李怀6.吉林(14人)王琳武永峰姜国明王喜民吴晶孙文杨希凡于文静尹丽华管恩杰沈文爽全菊花王晶波张淑萍7.辽宁(15人)魏晶赵红菊王姝李妮贾娜佟宝光杨宏伟刘彤董英李欣王聚宋敏孙东钟红玲祖延雷8.黑龙江(10人)张丁丁马桔云李素梅冯继承战丹王德胜姜连阁陈雷边丽英单华峰9.上海(10人)李萍XXX 李建平柳涛颛孙燕俞佳宁韦欣陈燕平沈建华季建敏10.江苏(18人)于萌王敦岚衡萍焦灵利王立新李国亮徐厚明王闻珠崔小红王金伟钱生稳范青峰姜莉沈沁唐媛刘海燕葛芝红蒋成11.浙江(14人)鞠波沈黎新翁晓明胡飞凤梅源吴相勇胡淼王静芳李金和陈玉清邓俊斌洪盈盈戴其昌陈晓平12.安徽(8人)许红王玉香蔡辉胡士高周鹏程宫文武张永玲许世辉13.福建(8人)刘立藏吴春敏张江清黄榕珍周仰青许婉锌黄荔红张时勇14.江西(9人)张惠民张朝霞张军平李平王栋徐群志戴寿昌杨国华罗健15.山东(15人)张亚萍李玉基韩莹冉大强许丹国明徐政行赵恒张旗孙忠亲田松林华丽萍刘学起高宇源孙成考16.河南(15人)王智明张伟东杨胜亚秦战勇张伟奇林恒标党明安丰世勤杨敬鹏潘会朝逯华刚程相林任瑞龙李学鑫邹俊17.湖北(9人)李亚武陈相龙李博然曹秀荣李胜松李国庆张跃丽李恒勤姚茂斌18.湖南(10人)陈光建姚金成汪灿袁农黎银波曾三平刘雁鸣李再新湛建峰黄宇19.广东(17人)罗穗黄坤斌毕军吴生齐江映珠陈佩毅谢正福李志伟邹毅林焕冰林奇艺梁蔚阳邓锋邓剑雄彭继烽李薇钟向红20.广西(6人)蒋明廉罗远秀韦莹莹许有诚韦娟孙东科21.海南(8人)王琨林芳梅杨静张辉刘忠陈海峰陈国彪刘洁22.四川(9人)王伯颖骆国军龙飞高向军徐燕孙雪奇蒲晅郑晓黄玉兰23.重庆(7人)杨卫东杨成钢徐飞姜学美曾檀张小松周祥敏24.贵州(6人)王萍高良美童红黄铭铸杨永东张元蓉25.云南(7人)王彬欧阳楠周玲吕强陈祖芬李哲媛范兵26.西藏(1人)李仕勇27.陕西(6人)王斌王四清林毅杜宏伟王少锋卜绥云28.甘肃(6人)王兰霞梁春御王巍杜兴谢楠杨克谦29.青海(3人)韩达斌刘海青郑永彪30.宁夏(2人)海学武逯海龙31.新疆(1人)李颖32.食品药品监管总局(5人)崔浩郭秀侠周乐叶家辉夏杨33.食品药品监管总局核查中心(14人)孙京林陈燕闫兆光岳勇陈慧萍刘爽翟铁伟王元叶笑曹轶杜婧颜若曦周艳臧克承。
卫生部、国家食品药品监督管理局关于开展药物临床试验机构资格认定复核检查工作的通知

卫生部、国家食品药品监督管理局关于开展药物临床试验机构资格认定复核检查工作的通知文章属性•【制定机关】卫生部(已撤销),国家食品药品监督管理局(已撤销)•【公布日期】2009.05.05•【文号】国食药监注[2009]203号•【施行日期】2009.05.05•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文卫生部、国家食品药品监督管理局关于开展药物临床试验机构资格认定复核检查工作的通知(国食药监注[2009]203号)各省、自治区、直辖市卫生厅(局)、食品药品监督管理局(药品监督管理局)、新疆生产建设兵团卫生局,解放军总后勤部卫生部:为进一步加强药物临床研究监督管理,切实提高药物临床研究质量,确保受试者权益和安全,根据《药物临床试验资格认定办法(试行)》(国食药监安〔2004〕44号)的规定,国家食品药品监督管理局(以下简称国家局)会同卫生部将于近期启动药物临床试验资格认定复核检查工作。
现将《药物临床试验机构资格认定复核检查工作方案》(以下简称工作方案)印发给你们,并将有关事项通知如下:一、具有药物临床试验资格的医疗机构(以下简称机构)如在《药物临床试验资格认定证书》有效期届满后继续开展药物临床试验,应向所在地省级卫生行政部门提出药物临床试验机构资格认定复核检查申请。
复核检查期间暂不受理新增专业申请,被检查机构通过复核检查后方可提出新增专业申请。
二、2007年1月1日之前国家局公告的药物临床试验机构,应于2009年6月10日之前提出复核检查申请,国家局会同卫生部于2009年对以上机构进行集中检查;2007年1月1日之后国家局公告的机构,应于《药物临床试验资格认定证书》有效期届满6个月前提出复核检查申请,国家局将结合品种检查计划,及时安排复核检查。
未按以上时限要求申请复核检查的机构,将不再具有承担药物临床试验的资格。
三、申请复核检查的机构除需书面提交药物临床试验机构资格认定复核检查申请资料以外,还需进行网上申报。
第一至六批国家级GMP检查员名单

关于公布第一批重新聘任的国家药品GMP检查员名单的通知国食药监办[2009]313号2009年06月12日发布各省、自治区、直辖市食品药品监督管理局(药品监督管理局):为进一步加强对药品GMP检查员的管理,规范检查员队伍建设,依据《药品管理法》、《药品管理法实施条例》的相关规定,国家局决定对药品GMP检查员进行重新聘任,并核发《国家药品GMP检查员证》。
经各省(区、市)食品药品监管部门推荐和国家食品药品监督管理局综合考评,姚胜林等137名药品GMP检查员为第一批重新聘任的国家药品GM P检查员,现予公布并核发《国家药品GMP检查员证》。
国家食品药品监督管理局二○○九年六月十二日附件:第一批重新聘任的国家药品GMP检查员名单北京市:姚胜林、张凤梅、张岩、孔力天津市:黎阳、王守斌、吴妍汶河北省:马琳、高志清、段春改山西省:王玉军、赵运江、朴晋华、王泽山内蒙古自治区:范曼昕、云秀玲辽宁省:刘智勇、佟宝光、朱延峰、王怡君、刘知音吉林省:武永峰、王琳、王喜民、李雪冬黑龙江省:战丹、谭宏宇、陈雷、张丁丁上海市:刘伟强、李建平、颛孙燕、刘丹华、沈晴、胡建国、张华江苏省:王敦岚、李国亮、姜莉、王立新、胡勇、王惠明、陈伟浙江省:吴相勇、胡淼、梅源、陈玉清、胡飞凤、钟钰、高素英、钱先凤安徽省:周鹏程、储德全、李涛、丁家碧、许世辉福建省:张时勇、黄荔红、肖容英、史晓燕、陈文钦、谢永军、林冬青江西省:张军平、王栋、徐群志、徐飞、张朝霞山东省:李玉基、韩莹、国明、周勇、何慧、林炳勇、曹森河南省:王智明、张伟琦、谷静芳、杨胜亚、关蕾湖南省:曾三平、刘雁鸣、李文、吴胜丹、汪灿、杨清、黄晟、唐春辉湖北省:胡少玉、涂林、姚茂斌、费路华广东省:黄坤斌、江映珠、吴生齐、肖奕阳、谢正福、李薇、林盛文、钟向红、毕军广西壮族自治区:文东旭、梁柳青、许有诚海南省:王有生、王琨、周毓惠重庆市:梁渝陵、李霞、杨成钢、邓开英四川省:孙雪奇、何晓、徐杰、黄玉兰、王伯颖、曾必勇贵州省:黄铭铸、杨永东、张谆、宋勤云南省:王彬、陈祖芬、范兵、魏伟西藏自治区:达娃仓决、刘敬奎陕西省:林毅、翁吉安、杨志信、王力甘肃省:王兰霞青海省:刘海青宁夏回族自治区:海学武、刘雪岚新疆维吾尔自治区:李金凤中国药品生物制品检定所:宁保明关于公布第二批重新聘任的国家药品GMP检查员名单的通知国食药监办[2009]739号2009年11月03日发布各省、自治区、直辖市食品药品监督管理局(药品监督管理局):按照国家局开展药品GMP检查员重新聘任工作计划,经各省(区、市)食品药品监管部门推荐,国家食品药品监督管理局综合考评,张亚东等120人为第二批重新聘任的国家药品GMP检查员,现予公布并核发《国家药品GMP检查员证》。
国家食品药品监督管理总局药品审评中心拟录用工作人员情况001.doc
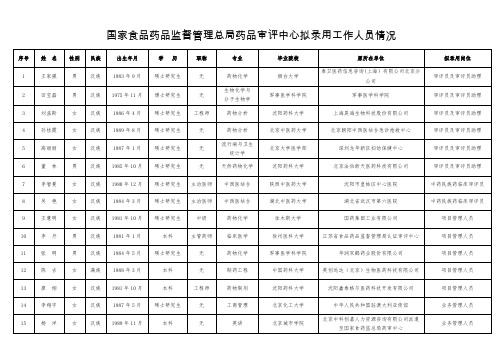
流行病与卫生统计学
北京大学医学部
深圳龙华新区妇幼保健中心
审评员及审评员助理
6
董 林
男
汉族
1985年10月
硕士研究生
无
天然药物化学
沈阳药科大学
北京法伯新天医药科技有限公司
审评员及审评员助理
7
李智曼
女
汉族
1980年12月
硕士研究生
主治医师
中西医结合
陕西中医药大学
沈阳市皇姑区中心医院
中药民族药临床审评员
国家食品药品监督管理总局药品审评中心拟录用工作人员情况
序号
姓 名
性别
民族
出生年月
学 历
职称
专业
毕业院校
原所在单位
拟录用岗位
1
王家强
男
汉族
1983年9月
硕士研究生
无
药物化学
烟台大学
泰卫医药信息咨询(上海)有限公司北京分公司
审评员及审评员助理
2
田宝磊
男
汉族
1975年11月
博士研究生
无
生物化学与
分子生物学
项目管理人员
14
李翔宇
女
汉族
1987年5月
硕士研究生
无
工商管理
北京化工大学
中华人民共和国驻澳大利亚使馆
业务管理人员
15
杨 洋
女
汉族
1989年11月
本科
无
英语
北京城市学院
北京中科创嘉人力资源咨询有限公司派遣至国家食药监总局药审中心
业务管理人员
16
梁喜凤
女
汉族
1988年11月
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
11
曹艳华
女
汉族
1984年12月
硕士研究生
工程师
微生物与生化药学
中国药科大学
江苏万邦生化医药股份有限公司
编制外审评员及审评员助理
12
刘霏霏
女
汉族
1987年2月
硕士研究生
无
临床检验诊断
解放军医学院
海南皇隆制药股份有限公司
编制外审评员及审评员助理
13
李京艳
女
汉族
1973年10月
博士研究生
工程师
生物化工
青岛科技大学
山东省食品药品监督管理局审评认证中心
编制外审评员及审评员助理
6
张锐
男
汉族
1987年12月
硕士研究生
无
药物分析学
中国食品药品检定研究院
北京协和医院
编制外审评员及审评员助理
7
单冬
女
汉族
1989年12月
硕士研究生
无
药物化学
北京大学
北京修正创新药物研究院有限公司
编制外审评员及审评员助理
国家食品药品监督管理总局药品审评中心拟录用工作人员情况
(编制外工作人员)
序号
姓名
性别
民族
出生年月
学历
职称
专业
毕ห้องสมุดไป่ตู้院校
原所在单位
拟录用岗位
1
王俊玲
女
汉族
1979年10月
本科
副研究员
生物化学工程
北京化工大学
北京双鹭药业股份有限公司
编制外审评员及审评员助理
2
关宏峰
女
满族
1982年1月
硕士研究生
无
中药学
沈阳药科大学
8
周宁
女
汉族
1976年9月
博士研究生
副研究员
有机化学
厦门大学
军事医学科学院毒物药物研究所
编制外审评员及审评员助理
9
赵春阳
女
汉族
1989年11月
硕士研究生
无
药理学
北京协和医学院
舒泰神(北京)生物制药股份有限公司
编制外审评员及审评员助理
10
贾东晨
女
汉族
1985年1月
硕士研究生
无
微生物学
云南大学
北京双鹭药业股份有限公司
副研究员
微生物与生化药学
北京协和医学院
北京协和医学院
编制外审评员及审评员助理
14
李源
女
汉族
1985年8月
本科
工程师
药学
河北医科大学
华北制药股份有限公司
编制外综合管理人员
15
杨琛
女
汉族
1984年11月
本科
无
法学
北京中医药大学
西门子医学诊断产品(上海)有限公司
编制外综合管理人员
16
郭永森
男
汉族
1986年4月
本科
工程师
药事管理
沈阳药科大学
石药集团中奇制药技术有限公司
编制外综合管理人员
备注:同岗位拟录用人员按姓氏笔画排序
铨维亚医药科技发展(北京)有限公司
编制外审评员及审评员助理
3
陈继平
男
汉族
1982年4月
硕士研究生
无
药剂学
沈阳药科大学
诺天源(中国)贸易有限公司
编制外审评员及审评员助理
4
那馨竹
女
满族
1989年3月
硕士研究生
无
药剂学
四川大学
东北制药集团股份有限公司
编制外审评员及审评员助理
5
吴小飞
男
汉族
1983年12月
硕士研究生
