四大滴定的相同点及不同点
分析化学四大滴定总结

分析化学四大滴定总结
定性分析化学中的四大滴定,也就是碱度滴定、水的氢离子滴定、质
量滴定(定量滴定)和酸度滴定,是实验室中最基本的定性分析化学方法,用于化学分析当中不同物质的含量测定和种类鉴定。
一、碱度滴定
碱度滴定是指测定溶液的碱离子的含量,即溶液中氢离子浓度的定量
测定,是通过酸度滴定时,将酸离子与碱离子结合,反应形成盐类,消耗酸,使pH值变化,从而测定溶液中碱离子的含量的一种化学滴定方法。
碱度滴定根据反应物是否有色不同,可分为标准的无色滴定和常用的有色
滴定两种类型。
碱度滴定通常用于分析碱性物质的含量,例如碱的溶液,
如NaOH溶液、KOH溶液等。
二、水的氢离子滴定
水的氢离子滴定(也称氢离子滴定)是在水样中测定溶液中氢离子的
含量的一种滴定,是一种实验室中常用的化学分析滴定方法。
水的氢离子
滴定是通过测定溶液中氢离子的浓度来评价溶液的碱度的,它是以硫酸铜
为滴定剂,采用titration程序,以滴定曲线的路径从而测定水质当中氢
离子含量的一种滴定方法。
三、质量滴定
质量滴定,也称定量滴定,是指以一定的量的容量或重量的质量,测
定溶液中其中一种物质的含量的一种化学分析滴定方法。
分析化学四大滴定总结讲解学习

分析化学四大滴定总结一、酸碱滴定原理酸碱滴定法是以酸、碱之间质子传递反应为基础的一种滴定分析法。
基本反应H++ OH- = H2O滴定曲线与直接滴定的条件强碱滴定强酸强碱滴定弱酸强酸滴定弱碱cK a≥10-8cK b≥10-8多元酸的滴定混合酸的滴定多元碱的滴定c o K a1≥10-9c o K b1≥10-9K b1/K b2>104液基准物质无水碳酸钠、硼酸邻苯二甲酸氢钾、苯甲酸应用硼酸的测定、铵盐的测定、克氏定发、酸酐和醇类的测定等酸碱溶液pH计算一元弱酸两性物质二元弱酸缓冲物质理定分析方法。
基本反应M+Y=MY配合物的稳定常数酸效应αY(H)干扰离子效应αY(N)溶液酸度越大,αY(H)越大,表示酸效应引起的副反应越严重。
αY(H)=1+β1[H+] +β2[H+] ²+β3[H+] ³+β4[H+]⁴+βⁿ [H+] ⁿ[Y]越小,αY(N)越大,表示干扰离子效应引起的副反应越严重。
金属离子的配位效应αM(OH)、αM(L)及总副反应αMY的总副反应αY条件稳定常数K’MYαM越小,αY越小,K’MY越小,配合物稳定性越大滴定条件准确直接滴定的条件K’MY≥10-6分别滴定的条件K’MY≥10-6,△lgK≥5配位剂1.无机配位剂 2.有机配位剂:EDTA、CyDTA、EGTA、EDTP等指示剂铬黑T、二甲酚橙、钙指示剂、PAN等指示剂原理指示剂游离态与配合态颜色不同影响滴定突跃范围因素1.金属离子浓度的影响:K’MY一定时,CM越大,ΔpM’越大2.条件稳定常数的影响:CM一定时,K’MY越大,ΔpM’越大3.酸度的影响:pH越小,αY(H)越大,K’MY越小,ΔpM’越小4.其他辅助配位剂的影响:CL越大,αM(L)越大,K’MY越小,ΔpM’越小用掩蔽和解蔽的方法进行滴定常用掩蔽方法配位掩蔽法沉淀掩蔽法氧化还原隐蔽法解蔽法应用测定石灰石中CaO、测定Ga2+、Mg2+Bi3+、Zr4+、Th4+的滴定测定Cu2+、Zn2+、条件电极电位条件对电极电位的影响离子强度副反应酸度一般忽略离子强度的影响,一般用浓度代替活度酸度变化直接影响电对的电极电位条件平衡常数滴定反应条件影响反应速率的因素1.反应物浓度2.温度3.催化剂4.诱导作用滴定化学计量点前化学计量点时化学计量点后曲线与终点的测定指示剂氧化还原指示剂、自身指示剂、专属指示剂预处理预氧化、预还原,除去有机物:干法灰化。
四大滴定比较与总结

生成有色沉淀
与反应物发生可逆颜色反应
沉淀对有机染料吸附而变色
指示剂游离态与配合态颜色不同
应用
1氮的测定
2混合碱的测定
3酸碱浓度的测定
1高锰酸钾法
2碘量法
3高铬ቤተ መጻሕፍቲ ባይዱ钾法
4溴酸钾法
1岩盐中可溶性氯离子的测定
2银的测定
3混合离子的测定
1锌的测定
2钙、镁的测定
相同点
1、反应定量进行,且进行彻底。
四大滴定比较与总结
酸碱滴定
氧化还原滴定
沉淀滴定
配位滴定
基本反应
酸碱反应
H++B-=HB
氧化还原反应
Ox1+ne-=Red1
Red2-ne-=Ox2
沉淀反应
Ag++X-=AgX↓
络合反应
M+Y=MY
滴定曲线纵坐标
pH
电极电位E
沉淀/离子的量
金属离子浓度
稳定常数
酸
碱
条件平衡常数
Ksp=[M+]m×[X-]n
准确滴定的条件
cKa/b≥10-8
ΔφΘ’≥0.059×3(a+b)/n
S要小
lgcMsp×K’MY≥6.0
影响滴定突跃的因素
酸碱的浓度。
酸碱的强度
溶剂的电离度
1条件电位差
2盐效应
3生成沉淀
4生成配合物
5酸效应
1沉淀溶解度S
2指示剂的用量
3溶液的酸度
4其它沉淀的干扰
1配合物的条件稳定常数
2副反应系数,包括
2、反应速度快。
3、有比较简便的方法确定反应终点。
四大滴定比较与总结

四大滴定比较与总结滴定是化学分析常用的一种分析方法,主要用于测定溶液中其中一种物质的含量。
四大滴定是指电位滴定、自动滴定、嗅觉滴定和颜色滴定。
这四种滴定方法各有特点,下面将对它们进行比较与总结。
1.电位滴定电位滴定是通过测定电位的变化来判断滴定终点的方法。
它的优点是滴定速度快、灵敏度高,可以实现自动控制。
电位滴定需要使用较贵的电位计仪器,因此成本较高。
2.自动滴定自动滴定是指通过电动滴定器进行滴定操作,滴定剂的滴定过程由机器自动完成。
自动滴定优点是操作简便、准确度高,可以提高实验效率。
然而,需要注意的是机器操作所需的技术支持较高,且设备价格相对较高。
3.嗅觉滴定嗅觉滴定是通过嗅觉来判断滴定终点的方法。
这种方法不需要任何仪器设备,简便易行。
嗅觉滴定的缺点是主观性较强,准确度较低,且对于不同人来说灵敏度差异较大。
4.颜色滴定颜色滴定是通过颜色的变化来判断滴定终点的方法。
它的优点是操作简便,可观察到直观的颜色变化,使滴定过程更为直观。
而且,现有的颜色滴定剂相对较多,可根据不同的滴定物质选择合适的颜色指示剂。
然而,颜色滴定对于滴定终点的判断常常不够准确,需要较丰富的经验和实践。
综上所述,四大滴定方法各有优缺点。
电位滴定能够实现自动化、快速高灵敏度的滴定分析,但所需设备价格较高。
自动滴定操作简单准确,但设备价格相对较高且需要技术支持。
嗅觉滴定方法简单易行,但主观性较高,准确度较低。
颜色滴定直观易懂,但滴定终点判断较为主观,需要经验和实践。
在实际应用中,选择滴定方法要根据具体的实验需求和条件来确定。
对于要求快速高灵敏度的滴定分析,电位滴定是更合适的选择。
对于操作简便准确度要求较高的滴定,可以考虑自动滴定方法。
对于便捷性要求较高且不需要太高准确度的滴定分析,可以使用嗅觉滴定法。
而颜色滴定方法则适用于对经验要求较高、对实验结果准确度不要求过高的分析。
分析化学四大滴定总结

分析化学四大滴定总结滴定分析法又称为容量分析法,是一种简便、快速和应用广泛的定量分析方法,在常量分析中有较高的准确度。
这其中又有重要的四大滴定方法。
以下是店铺整理的分析化学四大滴定总结,欢迎查看。
一、酸碱滴定原理:利用酸和碱在水中以质子转移反应为基础的滴定分析方法。
可用于测定酸、碱和两性物质。
其基本反应为H﹢+OH﹣=H2O也称中和法,是一种利用酸碱反应进行容量分析的方法。
用酸作滴定剂可以测定碱,用碱作滴定剂可以测定酸,这是一种用途极为广泛的分析方法。
最常用的酸标准溶液是盐酸,有时也用硝酸和硫酸。
标定它们的基准物质是碳酸钠Na2CO3。
方法简介:最常用的碱标准溶液是氢氧化钠,有时也用氢氧化钾或氢氧化钡,标定它们的基准物质是邻苯二甲酸氢钾KHC8H4O6或草酸H2C2O·2H2O:OH+HC8H4O6ˉ→C8H4O6ˉ+H2O如果酸、碱不太弱,就可以在水溶液中用酸、碱标准溶液滴定。
离解常数 A和Kb是酸和碱的强度标志。
当酸或碱的浓度为0.1M,而且A或Kb大于10-7时,就可以准确地滴定,一般可准确至0.2%。
多元酸或多元碱是分步离解的,如果相邻的离解常数相差较大,即大于104,就可以进行分步滴定,这种情况下准精确度不高,误差约为1%。
盐酸滴定碳酸钠分两步进行:﹢ˉCO32-+H→HCO3HCO3ˉ+H﹢→CO2↑+H2O相应的滴定曲线上有两个等当点,因此可用盐酸来测定混合物中碳酸钠和碳酸氢钠的含量,先以酚酞(最好用甲酚红-百里酚蓝混合指示剂)为指示剂,用盐酸滴定碳酸钠至碳酸氢钠,再加入甲基橙指示剂,继续用盐酸滴定碳酸氢钠为二氧化碳,由前后消耗的盐酸的体积差可计算出碳酸氢钠的含量。
某些有机酸或有机碱太弱,或者它们在水中的溶解度小,因而无法确定终点时,可选择有机溶剂为介质,情况就大为改善。
这就是在非水介质中进行的酸碱滴定。
有的非酸或非碱物质经过适当处理可以转化为酸或碱。
然后也可以用酸碱滴定法测定之。
四大滴定的比较与总结

四⼤滴定的⽐较与总结四⼤滴定的⽐较与总结⼀:反应原理及滴定曲线酸碱滴定:滴定曲线:溶液pH 随滴定分数(a)变化的曲线指⽰剂选择: pHep 与pHsp 尽可能接近,以减⼩滴定误差⼀、强碱强酸滴定(⼀)强碱滴定强酸NaOH (0.1000mol/L )→HCL (0.1000mol/L, 20.00mL ) 1.滴定过程中pH 值的变化(1)Vb = 0:(2)Vb < V a :加⼊NaOH 18.00mL(3)Vb = 19.80mL(4)Vb < V a : SP 前0.1% 时,加⼊NaOH 19.98mL(5)Vb = V a (SP ):(6)Vb > V a :SP 后0.1%,加⼊NaOH 20.02mLLmol C Ha /1000.0][==+0.1=pH 320.0018.000.1 5.26310/20.0018.00a b a a bV V H C m ol L V V +---??=?=?=++2.28pH = 3.27pH =[]Lmol C V V V VH a ba ba/100.51.098.1900.2098.1900.205-+=+-=+-=3.4=pH [][]H OH K mol Lw +--===107/0.7=pH 520.0220.000.1 5.010/20.0020.02b a b a b V V OH C mol L V V ----??=?=?=++3.4=pOH 7.9=?pH(7)Vb = 40.00mLNaOH 加⼊量ml PH 范围△ PH 0.00→19.80 1--3.3 2.3 19.80 →19.98 3.3 --4.3 1 19.98 →20.02 4.3--9.7 5.4 ↓0.04 ml△ PH=5.42.滴定曲线的形状40.0020.000.140.0020.02b a b a b V V O H C V V ---??=?=??++1.48pOH =12.52pH ?=pH 0 12滴定分数a9.7 sp+0.1%4.3 sp-0.1%sp 7.0突跃络合滴定基本原理络合滴定:滴定反应为配位反应。
四大滴定的相同点及不同点
影响的主要因素是浓度:浓度越大,滴定突跃范围越小,酸碱浓度变化10倍,突跃变化2个单位
1.条件稳定常数:浓度c一定时,K’MY越大,滴定突跃范围越大
2.pH:pH越小,滴定突跃范围越小,反之越大
1.反应物浓度
2.温度 温度每升高10℃,反应速率v增大2~3倍
3.催化剂
4.诱导作用
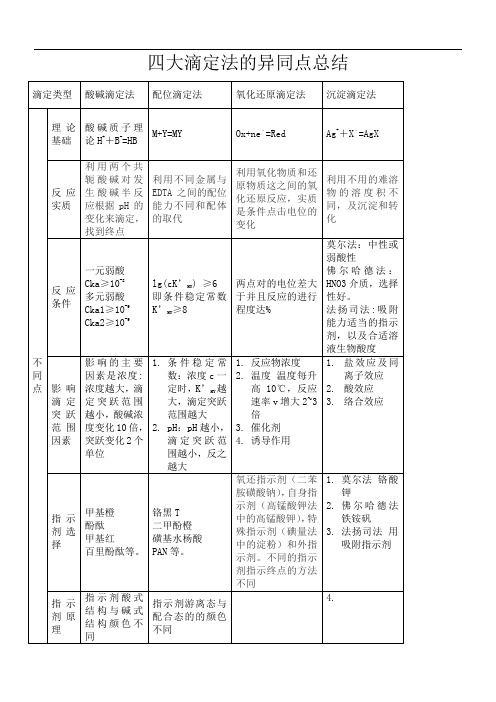
四大滴定法的异同点总结
滴定类型
酸碱滴定法
配位滴定法
氧化还原滴定法
沉淀滴定法
不同点
理论基础
酸碱质子理论H++B-=HB
M+Y=MY
Ox+ne﹣=Red
Ag++X﹣=AgX
反应实质
利用两个共轭酸碱对发生酸碱半反应根据pH的变化来滴定,找到终点
利用不同金属与EDTA之间的配位能力不同和配体的取代
利用氧化物质和还原物质这之间的氧化还原反应,实质是条件点击电位的变化
利用不用的难溶物的溶度积不同,及沉淀和转化
反应条件
一元弱酸
Cka≥10-8
多元弱酸
Cka1≥10-9
Cka2≥10-9
lg(cK’MY) ≥6
即条件稳定常数K’MY≥8
两点对的电位差大于并且反应的进行程度达%
莫尔法:中性或弱酸性
佛尔哈德法:HNO3介质,选择性好。
法扬司法:吸附能力适当的指示剂,以及合适溶液生物酸度
指示剂原理
指示剂酸式结构与碱式结构颜色不同
指示剂游离态与配合态的的颜色不同
4.
应用
氮的测定
1蒸馏法
2定氮
3甲醛法
混合碱的测定
1双指示剂法(用酚酞和甲基橙)
2氯化钡法
1锌的测定
四大滴定的相同点及不同点

MY)≥6
于0.4V并且反应
即条件稳定常数
的进行程度达
K’
MY≥8
99.9%
影响
滴定
突跃
范围
因素影响的主要1.条件稳定常
因素是浓度:数:浓度c一
浓度越大,滴定时,K’
MY越
定突跃范围大,滴定突跃
越小,酸碱浓范围越大
度变化10倍,2.pH:pH越小,
突跃变化2个滴定突跃范
单位围越小,反之
越大1.反应物浓度
相同点1.反应定量进行,且进行彻底,进达到行程度达99.9﹪
2.有一定的化学计量关系,计算比较简便
3.滴定曲线类似,只是横坐标不同
4.反应速度快
5.能用简便的方法确定滴定终点
6.滴定终点附近存在突跃范围
7.根据滴定消耗的标准溶定法配位滴定法氧化还原滴定法沉淀滴定法理论酸碱质子理
M+Y=MY
基础论H++B-=HB
利用两个共
轭酸碱对发
反应生酸碱半反
实质应根据pH的
变化来滴定,
找到终点Ox+ne﹣=RedAg++X﹣=AgX利用氧化物质和还
利用不同金属与利用不用的难溶原物质这之间的氧
EDTA之间的配位物的溶度积不化还原反应,实质
2.温度温度每升
高10℃,反应
速率v增大2~3
倍
3.催化剂
4.诱导作用
甲基橙
指示
酚酞
剂选
甲基红
择
百里酚酞等。
指示指示剂酸式
剂原结构与碱式
理结构颜色不氧还指示剂(二苯
胺磺酸钠),自身指
示剂(高锰酸钾法
铬黑T
中的高锰酸钾),特
高考化学中四大滴定的基本原理与应用!

高考化学中四大滴定的基本原理与应用!四大滴定即:氧化还原滴定,络合滴定,酸碱滴定,沉淀滴定。
四大滴定的区分主要是跟据反应的类型,以及是否便于测定。
比如,氧化还原滴定主要用于氧化还原反应,沉淀滴定主要用于反应中产生沉淀的反应,酸碱滴定主要用于酸性物质与碱性物质的反应或者广义上的路易士酸,而络合滴定则主要用于络合反应的滴定。
一、酸碱滴定法酸碱滴定法是以酸、碱之间质子传递反应为基础的一种滴定分析法。
可用于测定酸、碱和两性物质。
其基本反应为H++ OH- = H2O;也称中和法,是一种利用酸碱反应进行容量分析的方法。
用酸作滴定剂可以测定碱,用碱作滴定剂可以测定酸,这是一种用途极为广泛的分析方法。
酸碱滴定法的实际应用:混合碱的测定(双指示剂法)NaOH ,Na2CO3 ,NaHCO3, 判断由哪两种组成(定性/定量计算);Na2CO3能否直接滴定,有几个滴定突跃点以HCl为标准溶液,首先使用酚酞作指示剂,变色时,消耗HCl溶液体积V1,再加入甲基橙指示剂, 继续滴定至变色,又消耗HCl 溶液体积V2, 如图所示:实验结果与讨论:(1) 当V1>V2 时,混合碱组成:NaOH(V1-V2) , Na2CO3(V2)(2) 当V1 = V2 时,混合碱组成:Na2CO3(3) 当V1<v2 时,混合碱组成:Na2CO3 (V1),NaHCO3 (V2-V1)(4) 当V1 =0 时,混合碱组成:NaHCO3(5) 当V2 =0 时,混合碱组成:NaOH二、络合滴定法络合滴定法是以络合反应(形成配合物)反应为基础的滴定分析方法,又称配位滴定。
络合反应广泛地应用于分析化学的各种分离与测定中,如许多显色剂,萃取剂,沉淀剂,掩蔽剂等都是络合剂。
络合滴定法的实际应用:盐水中Ca2+、Mg2+含量分析:(1)钙离子测定在pH为12~13的碱性溶液中,以钙—羧酸为指示剂,用EDTA标准溶液滴定样品,钙—羧酸为指示剂与钙离子形成稳定性较差的红色络合物,当用EDTA溶液滴定时,EDTA即夺取络合物中的钙离子。
分析化学四大滴定总结

分析化学四大滴定总结1. 介绍滴定是化学分析中常用的一种定量分析方法,通过滴定液与待测物反应的化学反应达到定量的目的。
在分析化学中,有四种常用的滴定方法,分别是酸碱滴定、氧化还原滴定、络合滴定和沉淀滴定。
本文将对这四种滴定方法进行详细介绍和总结。
2. 酸碱滴定酸碱滴定是通过酸碱中和反应进行定量分析的方法。
常用的滴定指示剂包括酚酞、甲基橙等。
在酸碱滴定中,滴定液通常是一种浓度已知的酸或碱溶液,待测物为酸或碱溶液。
滴定过程中,通过观察指示剂的颜色变化来判断滴定终点。
酸碱滴定的一般步骤如下:1.准备滴定液和待测物溶液。
2.取一定数量的待测物溶液放入滴定瓶中。
3.准备滴定管和取靶。
4.滴定管中加入一定量的滴定液。
5.滴定管中的滴定液滴入待测物溶液中,同时搅拌。
6.当颜色变化出现,滴定终点达到。
7.记录加入的滴定液的体积。
3. 氧化还原滴定氧化还原滴定是通过氧化还原反应进行定量分析的方法。
在氧化还原滴定中,常用的滴定指示剂有二茂铁和碘化钾淀粉溶液。
滴定液和待测物之间的氧化还原反应可以通过观察指示剂的颜色变化来判断滴定终点。
氧化还原滴定的一般步骤如下:1.准备滴定液和待测物溶液。
2.取一定数量的待测物溶液放入滴定瓶中。
3.准备滴定管和取靶。
4.滴定管中加入一定量的滴定液。
5.滴定管中的滴定液滴入待测物溶液中,同时搅拌。
6.当颜色变化出现,滴定终点达到。
7.记录加入的滴定液的体积。
4. 络合滴定络合滴定是通过络合反应进行定量分析的方法。
常用的滴定指示剂有硫氰酸铁、二甲基黄等。
滴定液和待测物之间的络合反应可以通过观察指示剂的颜色变化来判断滴定终点。
络合滴定的一般步骤如下:1.准备滴定液和待测物溶液。
2.取一定数量的待测物溶液放入滴定瓶中。
3.准备滴定管和取靶。
4.滴定管中加入一定量的滴定液。
5.滴定管中的滴定液滴入待测物溶液中,同时搅拌。
6.当颜色变化出现,滴定终点达到。
7.记录加入的滴定液的体积。
5. 沉淀滴定沉淀滴定是通过生成沉淀反应进行定量分析的方法。
分析化学四大滴定总结

分析化学四大滴定总结分析化学是研究物质成分和性质的科学,其中滴定是常用的定量分析方法之一、在滴定中,有四种常用的滴定方法被称为“四大滴定”,分别是酸碱滴定、氧化还原滴定、络合滴定和沉淀滴定。
下面将对这四种滴定方法进行详细的介绍和分析。
1.酸碱滴定:酸碱滴定是根据物质的酸碱性质进行滴定的一种方法。
它通过在酸性或碱性介质中,用一种酸或碱溶液滴定另一种碱或酸溶液,以酸碱中和点的发生来确定物质的浓度。
酸碱滴定方法简单、准确,广泛应用于环境监测、药物分析、食品检测等领域。
2.氧化还原滴定:氧化还原滴定是通过氧化还原反应进行滴定的一种方法。
在这种滴定中,被滴定溶液中的氧化还原体与滴定试剂发生氧化还原反应,反应发生到等量点时,可通过指示剂显示出等量点的位置。
氧化还原滴定广泛应用于药物分析、环境监测等领域。
3.络合滴定:络合滴定是通过金属离子与配体之间的化学反应进行滴定的一种方法。
金属离子与配体结合形成络合物,滴定试剂添加之后会与嘌呤等指示剂形成分子或离子配合物,通过颜色的改变来确定等量点。
络合滴定方法用于测定金属离子或配体的浓度,广泛应用于环境监测、地质矿产等领域。
4.沉淀滴定:沉淀滴定是通过沉淀反应进行滴定的一种方法。
在滴定过程中,滴定试剂与被滴定物质反应生成沉淀,滴定至产生等量沉淀时,滴定终点出现。
沉淀滴定可用于测定硬度、氯离子、硫酸根离子等物质的浓度,常用于水质检测、环境检测等领域。
四大滴定方法各有其特点和应用范围。
酸碱滴定适用于测定酸碱度、酸度和碱度;氧化还原滴定适用于测定氧化还原体、氧化还原电位等;络合滴定适用于测定金属离子或配体的浓度;沉淀滴定适用于测定沉淀物的浓度等。
这些滴定方法在分析化学中起着重要的作用,为定量分析提供了可靠的手段。
总结起来,四大滴定是分析化学中常用的滴定方法。
酸碱滴定、氧化还原滴定、络合滴定和沉淀滴定分别通过酸碱性质、氧化还原性质、络合反应和沉淀反应进行滴定,它们分别用于测定各种物质的浓度和性质。
四大滴定方法

四种滴定方法详细介绍1、直接滴定法所谓直接滴定法,是用标准溶液直接滴定被测物质的一种方法。
凡是能同时满足上述滴定反应条件的化学反应,都可以采用直接滴定法。
直接滴定法是滴定分析法中最常用、最基本的滴定方法。
例如用HCl滴定NaOH,用K2Cr2O7滴定Fe2+等。
往往有些化学反应不能同时满足滴定分析的滴定反应要求,这时可选用下列几种方法之一进行滴定。
2、返滴定法当遇到下列几种情况下,不能用直接滴定法。
第一,当试液中被测物质与滴定剂的反应慢,如Al3+与EDTA的反应,被测物质有水解作用时。
第二,用滴定剂直接滴定固体试样时,反应不能立即完成。
如HCl滴定固体CaCO3。
第三,某些反应没有合适的指示剂或被测物质对指示剂有封闭作用时,如在酸性溶液中用AgNO3滴定Cl–缺乏合适的指示剂。
对上述这些问题,通常都采用返滴定法。
返滴定法就是先准确地加入一定量过量的标准溶液,使其与试液中的被测物质或固体试样进行反应,待反应完成后,再用另一种标准溶液滴定剩余的标准溶液。
例如,对于上述Al3+的滴定,先加入已知过量的EDTA标准溶液,待Al3+与EDTA反应完成后,剩余的EDTA则利用标准Zn2+、Pb2+或Cu2+溶液返滴定;对于固体CaCO3的滴定,先加入已知过量的HCl标准溶液,待反应完成后,可用标准NaOH溶液返滴定剩余的HCl;对于酸性溶液中Cl–的滴定,可先加入已知过量的AgNO3标准溶液使Cl–沉淀完全后,再以三价铁盐作指示剂,用NH4SCN标准溶液返滴定过量的Ag+,出现[Fe(SCN)]2+淡红色即为终点。
3、置换滴定法对于某些不能直接滴定的物质,也可以使它先与另一种物质起反应,置换出一定量能被滴定的物质来,然后再用适当的滴定剂进行滴定。
这种滴定方法称为置换滴定法。
例如硫代硫酸钠不能用来直接滴定重铬酸钾和其他强氧化剂,这是因为在酸性溶液中氧化剂可将S2O32–氧化为S4O62–或SO42–等混合物,没有一定的计量关系。
酸碱滴定和氧化还原滴定

酸碱滴定和氧化还原滴定一、四大滴定:酸碱滴定、氧化还原滴定、配位(络合)滴定、沉淀滴定1.共同点:都是利用溶液间的反应,通过溶液(或沉淀)的变色来确定终点,然后根据各物质间的反应的比例关系,来计算出待测物质的含量。
2.不同点:反应的原理不同,酸碱中和滴定是利用酸碱中和,氧化还原滴定是利用氧化还原反应,配位滴定是一般利用不同物质之间的配位能力不同,和配体的取代。
沉淀滴定主要是利用不同的难溶物的溶度积不同,及沉淀和转化。
二、酸碱滴定1.定义:利用酸和碱在水中以质子转移反应为基础的滴定分析方法。
2.质子理论酸:能给出质子(H+)的物质 碱:能够接受质子的物质两性物质:既能给出质子又能接受质子的物质(H 2O 、HCO 3-、HPO 42-)酸 质子 碱HA H+ A-共轭酸碱对: 酸与碱彼此相互依存又互相转化的性质称为共轭性,两者共同构成一个共轭酸碱对。
3.酸碱解离常数定义:在水溶液中,酸的强度取决于它将质子给与水分子的能力,碱的强度取决于它从水分子中夺取质子的能力。
这种给出和获得质子的能力的大小,具体表现在它们的解离常数上。
酸的解离常数Ka,碱的解离常数Kb水的离子积Kw: 这种仅在水分子之间发生的质子传递作用,称为水的质子自递反应。
反应的平衡常数称为水的质子自递常数,又称为水的离子积Kw 。
[H 3O +][OH -]= Kw共轭酸碱对Ka 、Kb 的关系:Kw=KaKb 4. 一元强酸(碱)溶液中H+浓度的计算 精确式: 共轭酸碱对 -++=+OH O H O H O H 32224][2w K c c H ++=+最简式:当C ≥10-6 mol/L 时 C 2+4Kw =C 2[H +]=C 5. 一元弱酸(碱)溶液pH 的计算三、氧化还原滴定1. 氧化还原平衡氧化还原进行的程度与相关氧化剂和还原剂强弱有关,氧化剂和还原剂的强弱可用其有关电对的电极电位(E )高低来衡量。
对一个可逆氧-还电对,电极电位的高低可用 Nernst 方程式表示:E —电对的电极电位(V) , E 0—电对的标准电极电位, T —绝对温度(K) a —物质的活度,R —气体常数,F —法拉第常数,n —电子转移数2.化学计量点:在滴定过程中,当滴入的标准溶液物质的量与待测定组分的物质的量恰好符合化学反应式所表式的化学剂量关系时,称反应达到了化学计量点。
四大滴定指示剂的作用原理

四大滴定指示剂的作用原理
四大滴定指示剂分别是甲基橙、甲基红、酚酞和溴酚蓝。
它们的作用原理如下:
1. 甲基橙:甲基橙是一种弱酸性指示剂,在酸性溶液中呈现红色,而在碱性溶液中呈现黄色。
它的作用原理是基于酸碱指示剂的颜色变化。
当滴定反应达到滴定点时,溶液从酸性变为碱性或从碱性变为酸性,甲基橙的颜色也相应发生变化,从而判断滴定终点。
2. 甲基红:甲基红是一种弱碱性指示剂,在酸性溶液中呈现红色,而在碱性溶液中呈现黄色。
它的作用原理与甲基橙类似,是基于酸碱指示剂的颜色变化来判断滴定终点。
3. 酚酞:酚酞是一种弱酸性指示剂,在酸性溶液中呈现无色或淡黄色,而在碱性溶液中呈现鲜艳的粉红色。
它的作用原理是基于酸碱指示剂的酸碱变化。
当滴定反应达到滴定点时,溶液从酸性变为碱性,酚酞的颜色也相应从无色或淡黄色变为粉红色,从而判断滴定终点。
4. 溴酚蓝:溴酚蓝是一种弱碱性指示剂,在酸性溶液中呈现黄色,而在碱性溶液中呈现蓝色。
它的作用原理是基于酸碱指示剂的酸碱变化。
当滴定反应达到滴定点时,溶液从酸性变为碱性,溴酚蓝的颜色也相应从黄色变为蓝色,从而判断滴定终点。
这四种滴定指示剂的作用原理都是基于它们在酸碱环境中颜色的变化来判断滴定终点,通过观察颜色变化来确定溶液的酸碱性质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
