第7章醇、硫醇、酚
第七章醇、硫醇、酚精品文档

连二醇与Cu(OH)2反应
具有两个相邻-OH的多元醇(连二醇)如1,2-丙二 醇、丙三醇等,加到Cu(OH)2沉淀中去,沉淀消失, 生成绛兰色配合物。
+ CH2—CH—CH2
OH OH OH
Cu(OH)2 -2H2O
CH2—CH—CH2 O O OH
Cu 甘油铜
可 鉴 别 含 邻 二 醇 结 构 "CC H" H 化 合 物 OO HH
多元醇
命名 普通命名法 、 系统命名法
醇的普通命名法:烃基名+醇(省去基字)。
CH3CH2OH 乙醇
ethyl alcohol
(CH3)2CHOH 异丁醇
isopropyl alcohol
(CH3)3COH 叔丁醇
tertbutyl alcohol
CH2OH
苯甲醇(苄醇) benzyl alcohol
Question 2:完成反应式
H3C
(1) b
OH
b H2SO4
CH 3
b OHb (2)
b
H
CH3
-H2O
CH3
(四) 氧化反应
——脱去两个氢:羟基H和a-H
氧化反应(oxidation):得氧或去氢的反应; 还原反应(reduction):得氢或去氧的反应。
常用的氧化剂有K2CrO7(H2SO4溶液)、KMnO4。
第七章 醇、硫醇 、酚
本章重点
掌握醇、硫醇和酚的结构和命名 掌握醇、酚的波谱性质、化学性质 ; 了解二巯基化合物的解毒原理。
英文词汇
alcohol,thiol,phenol,benzyl alcohol,glycerol, catechol,oxidation,reduction
第七章 醇硫醇酚

上页 下页 返回 退出
1.3 醇的化学性质
醇的化学性质主要是由官能团羟基所决定, 同时也受到烃基的一些影响。从化学键来看C-O 和O-H都是极性键;因此,醇容易发生反应的部 位如虚线所示:
R C O H
酸碱性、醚的生成、酯的生成 卤化反应、脱水反应、氧化反应
上页 下页 返回 退出
H C O H
弱碱性
+
C H3
H2O
O H2
C H3 C H
C H C H3
+
重 排
C H3 C H3 C
+
2° 碳正离子
C H C H3 H
CH3 CH3 CH CH CH3 Br
Br-
3° 碳正离子
Br
CH3
仲醇与HX酸反应,
CH3 C Br
CH2 CH3
生成重排产物是SN1机理的重要特征
下页 退出
b. SN2:大多数伯醇,且没有重排反应。
第七章
醇 硫醇 酚
下页 返回 退出
基本内容和重点要求
醇、酚、醚的结构、分类和异构现象 醇、酚、醚的化学性质 环氧乙烷的开环反应 重点掌握醇、酚、醚的化学性质;醇 的氢键对其物理性质(沸点、水溶性)的影 响。
上页 下页 返回 退出
第一节 醇(Alcohols)
1.1 醇的结构、分类和命名
1.2 醇的物理性质
CH3 C CH2
2-甲基-2-乙基-1-己醇
H3C
CH2
CH2
CH2
CH2OH CH3
CH
CH CH3
CH3
OH
2-甲基-1-环己基-1-丙醇 上页 下页 返回 退出
如果为不饱和醇,应选择含有羟基并含有双键或 叁键的最长碳链作为主链,编号时应使羟基的位号最 小;在定名称时,表示主链碳原子数的“天干”或汉 字应写在“烯”字或“炔”字名称的前面。
第七章醇、硫醇、酚

由于R-OH的酸性比水弱,它的共轭碱 RO由于 的酸性比水弱, 的酸性比水弱 醇钠遇水立即分解: 的碱性就比 OH- 强,醇钠遇水立即分解
RONa + H-OH
邓健 制作
R-OH + NaOH
余瑜 审校
上页
OH 一元醇 R—CH2-OH 饱和醇
二元醇 R-CH=CH-CH2-OH 不饱和醇
邓健 制作 余瑜 审校
OH OH 三元醇 Ar-CH2-OH 芳香醇
下页 首页
5
上页
第七章 醇、硫醇、酚
第一节 醇 (一、结构分类命名)
若醇分子中的同一个 C 连两个或两个以上 —OH 时,则易失水形成羰基 则易失水形成羰基(C=O)化合物。 化合物。 化合物
人民卫生电子音像出版社
δ+
δ− δ−
δ+
δ− δ−
上页
下页
首页
4
第七章 醇、硫醇、酚
第一节 醇 (一、结构分类命名)
(二)分类
伯醇 仲醇 叔醇
OH R
R—OH
R' R' OH R C R"
CH2 OH
一元醇 二元醇 多元醇
OH
R
CH2
伯醇
C H
仲醇
CH3
CH2
CH2 OH
叔醇 CH2 CH
OH
CH2
多元醇的命名:“某二醇、某三醇”等。-OH 多元醇的命名: 某二醇、某三醇” 数目与主链碳原子数相同时,可不标出羟基位次。 数目与主链碳原子数相同时,可不标出羟基位次。
7第七章醇硫醇酚1

△
⑤ 脱水(消除)反应
CH3CbH2CHCbH'3 OH
661£00H£2SCO4
CH3CH£CHCH3 £¨Saytzeff££ò £
2-££ £¨£÷££ú ££
CH2 CH CH2CH3 浓H2SO4 OH
CH CH CH2CH3
⑥1). KM氧n化O4反(H应+or OH-)、Na2Cr2O7-H2SO4 、HNO3
(一)酚的构造
.
sp2 H
O.
P–共轭 ··O—H
1.6D
①O–H键极性增强,–H比醇活泼 ②C–O键加强,–OH难取代 ③苯环被活化,环上易取代
(二)分类: 一元、多元酚 (三)命名
OH OH
邻-苯二酚
OH OH
OH 1,2,4-苯三酚
OH
α -萘酚
OH SO3H
间羟基苯磺酸
OH
CHO
对羟基苯甲醛
第七章 醇 硫醇 酚
醇 R-OH -OH(羟基)
酚 Ar-OH
OH -OH(羟基)
硫醇 R-SH -SH (巯基)
第一节 醇 一 醇的结构、分类和命名
H δ+
CO
H
1090
δ+
H
H
SP3
RO H
有较强的极性
1 醇的分类
饱 CH3–OH 甲醇 和 RCH2–OH 伯醇 醇 R2CH–OH 仲醇
按
R– 不饱 和醇
RSH + NaOH
RSNa + H2O
2 硫醇与重金属作用
RSH + Pb2+
R-S R-S Pb
3 氧化反应
[O]
2RSH
大学有机化学第七章 醇、硫醇、酚

C+稳定 脱水成烯越容易, 所以叔醇>仲醇>伯醇。
CH3 b a 提问: CH3-C-CH2CH3 b OH -H2O
*问 140 ℃ H3C C=C H3C
CH3 H
H+ CH3 C
CH3 H CH3 C H CH3 2,3-二甲基-1-丁醇
HOCH2CH2-SH
CH3CH2CH-CH2-CH3 SH
2-巯基乙醇
3-戊硫醇
二、物理性质(略)
三、硫醇的化学性质
1、弱酸性 R—SH + NaOH——>RS-Na+ + H2O 提问: R—OH + NaOH——> X
2、重金属盐的生成
重金属离子:As++、Hg++、Pb++、Cu++、Ag+
3、醛酮与Grignard试剂的加成
+ + H – C = O + R–MgX H2.5 3.5 H 无水乙醚 R-C-OMgX H + MgX2
1° 无水乙醚 CH3-CH-OMgX CH3CHO + CH3CH2MgX CH2CH3 CH3-CH-OH CH2CH3 2° + MgX2
H R-C-OMgX H
与金属钠反应: 伯醇 > 仲醇 > 叔醇
(二)羟基被卤素取代(补充)
R-OH + HX R-X + H2O
反应速度快慢与两种因素有关:
1、与氢卤酸有关: HI > HBr > HCl 2、与醇的类别有关: 如: CH CH3 3 ZnCl2-浓HCl CH3-C-OH CH3-C-Cl + 立即混浊 CH3 CH3
第7章 醇、硫醇、酚

:
:
一、醇的结构、分类与命名
2. 分类
3. 命名 ① 普通命名法
一般适合于简单的一元醇,即“醇”前加烃基名,省去 “基”字。有异构体,按正、异、仲、新、叔等命名。
CH3 CH2
乙醇 ethanol
OH
OH
环己醇 cyclohexanol
CH2OH
苄醇 benznyl alcohol
CH3 CH3 CH OH
CH3CH2CH2SH H2O2
丙硫醇
CH3CH2CH2S SCH2CH2CH3
二丙基二硫
反应能定量进行,可利用该反应测定巯基化合物的含量。 分子中具有的“–S–S–”化学键,叫做二硫键(disulfide bond)。二硫键对于维系和稳定蛋白质分子的特殊空间结构具有 重要作用。 在强氧化剂下, 甲硫醇被氧化成甲磺酸.
硫醚容易被氧化。
O CH3 S CH3
H2O2
CH3
S
CH3
甲硫醚 dimethyl sulfide
二甲基亚砜 dimethyl sulfoxide
二甲基亚砜(DMSO),既能溶解水溶性物质又能溶解脂 溶性物质,俗称“万能溶媒”。在医药领域应用广泛。
概述醇alcohol一醇的结构分类与命名氧原子的电子构型杂化轨道2s轨道分类一醇的结构分类与命名普通命名法乙醇ethanol环己醇cyclohexanolbenznylalcohol异丙醇isopropanol叔丁醇tertbutanol一般适合于简单的一元醇即醇前加烃基名省去基字
第七章 醇、硫醇、酚
4. 醇的氧化反应
醇的鉴别
伯醇 ? ? ? 无变化
无反应,加热后浑浊
仲醇
叔醇
KMnO4/H+
第七章 醇、硫醇、酚

第七章醇、硫醇、酚第一节醇一.醇的结构醇分子在结构上和水有许多相似之处,由氧原子(O)以sp3杂化轨道中的2个杂化轨道分别与碳(C)及氢(H)原子形成σ键,另2个杂化轨道被孤对电子占领。
由于氧的电负性较大,氧原子上的电子云密度较大,而碳和氢上的电子云密度较低,使醇分子的官能团—O H具有较强的极性。
二.命名醇根据烃基的不同可分为:3OH CH3CH2OH2=CH-CH2OHOHOH醇按羟基所连接的碳原子不同可分为:伯醇:羟基所连接的碳为一级碳如RCH2OH仲醇:羟基所连接的碳为二级碳如R2CHOH叔醇:羟基所连接的碳为三级碳如R3COH醇的命名规则见P102页(看书2分钟)(举几个例子让学生一起练习命名)三.物理性质(自学)问题:为什么低级醇易溶于水?为什么醇比多数分子量相近的其他有机物沸点高?四.化学性质醇主要发生O—H键断裂和C—O链断裂,具体表现为羟基H的活泼性及羟基被亲核试剂进攻而发生的亲核取代反应;以及羟基α位受羟基吸电子诱导效应的影响C—H键发生断裂,发生氧化或脱氢反应。
1.与金属钠的反应醇的酸性比水弱,比炔烃强。
表现在可以和活泼金属(Na、K、Mg、A1等)作用,分子中O—H键断裂,生成烷氧基金属(醇钠、醇钾、醇铝等),放出氢气,但反应的剧烈程度不如水。
HOH + Na NaOH + H2ROH + Na NaOH + H22ROH + Mg Mg(OH)2 + H22.形成盐醇可以作为质子的受体,可以接受强酸中的质子,形成盐,因此醇可以溶于强酸。
ROH + HCl [ROH2]++ Cl-3. 与无机盐形成结晶醇例如:CaCl2 4CH3OH CaCl2 4CH3CH2OH4、与无机酸作用硫酸氢甲酯CH3醇与无机酸反应,同样发生O-H 键断裂,生成酯。
例如:CH 3OH + HOSO 2OHCH 3OSO 2OH OH + CH 3OSO 2OH CH 3OSO 2OCH 3硫酸二甲酯硫酸二甲酯是常用的甲酯化试剂,易挥发,有剧毒,对呼吸器官和皮肤有强烈的刺激作用。
第七章醇、硫醇、酚-精选文档

酚 phenol
Ar-OH
芳香烃基
硫醇 thiol
R-SH
脂肪烃基
CH OH 如 : 3
OHCH SH 3
官能团:醇-OH
酚-OH
巯基 -SH
-OH 羟基
第一节
一、结构、分类和命名
醇 alcohol
结构:O采用sp3杂化
杂化
2px 2s 2py 2pz sp3杂化轨道
CH3-OH
1HNMR谱:d
1-6 ppm
O-H(加D2O消失); R2CH-OH
d 3-5 ppm
三、醇的化学性质
官能团为-OH,电负性O > C,C-O和 O-H极性大,易受反应试剂进攻而断裂。 H — C —— O a H 消除
氧 化 脱 氢
酸性;成酯
(一) 与金属钠的反应——O-H的断裂
H— O-H + Na ——> Na OH + H2 弱酸性(比水弱) R—O-H + Na ——> RO Na + H2 (反应激烈) (反应和缓)
醇的系统命名法:与烃类似,最长碳链含-OH,不论饱和 与 否,近-OH编号。取代基的位置常用 a、b、g、d等希腊字母 标明。
CH CH 3 CH 2 CH 2 CH 2CH 3 2-乙基-1-戊醇(b-乙基戊醇) CH 2 OH
CH 2CH 3 H 3C OH
2-ethyl-1-pentanol
连二醇与Cu(OH)2反应
具有两个相邻 -OH 的多元醇 ( 连二醇 ) 如 1,2- 丙二 醇、丙三醇等,加到Cu(OH)2沉淀中去,沉淀消失, 生成绛兰色配合物。
CH2—CH—CH2 OH OH OH
大学化学-第七章-醇、硫醇、酚
NO2
pKa
4.O5
NO2 0.25
酸性比碳酸强
(二)与FeCl3的显色反应
凡具有烯醇式结构的化合物 都有这一显色反应
OH C C OH
7
(三)芳环上的亲电取代反应
OH
OH:邻对位 定位基
O-
O-是比OH- 更强的定位基
苯酚比苯易于亲电取代,反应条件更温和,甚至 要加以控制。
有时会发生多取代。
1. 卤代反应
HH HO OH
顺-1,3-环戊二醇
OH (3Z, 6Z, 8E)-3,6,8-十二碳三烯-1-醇
♦ 羟基作取代基:当其它基团优先于羟基作
化合物类名时。
OH CH3CHCH2CHO
3-羟基丁醛
HO
CH2OH 4-羟基苯甲醇
Cl HO
COOH 3-羟基-4-氯环己基甲酸
二、醇的物理性质 醇的分子间氢键
CrO3 + HCl + N
Pyridine
N H CrO3Cl- PCC
PCC CH2OH CH2Cl2
82%
CHO
双键不被氧化,伯醇氧化只停留在醛的阶段。
4
四、硫醇
一. 含硫有机物概述
O:1S22S22P4
S:1S22S22P63S23P4
亲核性:RSH > ROH RS- > RO-
硫醇、硫酚、硫醚。 含硫有机物
ONa + H2O
OH + NaHCO3
取代酚的酸性: 苯环上连有吸电子基时,酸性增强。
G
OH
G: NH2、CH3O、H、Cl、 NO2 pKa:10.46; 10.21; 10; 9.38; 7.16
有机化学第七章醇硫醇酚

第九页,编辑于星期一:二十三点 十一分。
第十页,编辑于星期一:二十三点 十一分。
第十一页,编辑于星期一:二十三点 十一分。
第十二页,编辑于星期一:二十三点 十一分。
第十三页,编辑于星期一:二十三点 十一分。
第十四页,编辑于星期一:二十三点 十一分。
第十五页,编辑于星期一:二十三点 十一分。
第一页,编辑于星期一:二十三点 十一分。
第二页,编辑于星期一:二十三点 十一分。
第三页,编辑于星期一:二十三点 十一分。
第四页,编辑于星期一:二十三点 十一分。
第五页,编辑于星期一:二十三点 十一分。
第六页,编辑于星期一:二十三点 十一分。
第七页,编辑于星期一:二十三点 十一分。
第八页,编辑于星期一:二十三点 十一分。
第五十八页,编辑于星期一:二十三点 十一分。
第五十九页,编辑于星期一:二十三点 十一分。
第六十页,编辑于星期一:二十三点 十一分。
第六十一页,编辑于星期一:二十三点 十一分。
第六十二页,编辑于星期一:二十三点 十一分。
第六十三页,编辑于星期一:二十三点 十一分。
第六十四页,编辑于星期一:二十三点 十一分。
第四十四页,编辑于星期一:二十三点 十一分。
第四十五页,编辑于星期一:二十三点 十一分。
第四十六页,编辑于星期一:二十三点 十一分。
第四十七页,编辑于星期一:二十三点 十一分。
第四十八页,编辑于星期一:二十三点 十一分。
第四十九页,编辑于星期一:二十三点 十一分。
第五十页,编辑于星期一:二十三点 十一分。
第二十三页,编辑于星期一:二十三点 十一分。
第二十四页,编辑于星期一:二十三点 十一分。
第二十五页,编辑于星期一:二十三点 十一分。
第七章醇硫醇酚(3)

43
CH3CH2OH
75%溶液作消毒剂;溶剂(酊剂、醑剂); 变性酒精。
24
第二节
一、结构与命名 (一)结构 (二)命名 R-SH
硫醇
-SH 巯基
在相应的醇名称中加上“硫”字。 结构复杂时,把-SH 作为取代基。
CH3 SH
CH3CH2SH HOH2C CH2 SH 2-巯基乙醇 2-mercaptoethanol
3、按HO--连碳原子类型分
R R CH2 OH R R 仲醇(2° ) CH OH R C OH CH3OH 甲醇
5
伯醇(1° )
R 叔醇(3° )
二、命名:
(一)IUPAC命名法
脂肪醇命名的一般原则:
1、选主链(含羟基)
2、编号(近羟基一端开始)
3、取代基在前,母体在后(羟基为母体)
6
CH3CHCH2CH2OH
检查司机是否酒后驾车的分析仪就有根据此反应设计的。
在100ml血液中含有超过80mg乙醇(最大允许量)时,
呼出的气体即可使仪器得出正反应。
22
(2) 用CrO3/吡啶溶液
伯醇 仲醇
醛 酮
叔醇没有-H,不被氧化
23
五、甲醇、乙醇的功能与毒性(自学) (一)甲醇 CH3
OH
无色透明液体,有酒味,毒性:10ml失明、30ml致 死。 抗冻剂、溶剂,工业原料合成甲醛等。 (二)乙醇
CH3OH为例
H C H
O H H
109.3°
..
108.9 °
11
..
sp3杂化轨道
四、化学性质:
b a Rc CH CH O H d H H
结构与反应性: a.酸性H反应——O-H键极性
7有机化学-第七章醇、硫醇、酚

RONa + H-OH
R-OH + NaOH
(一) 与活泼金属反应——似水
乙炔钠与醇反应时生成乙炔,说明炔烃的酸性比醇更弱。
HC≡CNa + R-OH ——> HC≡CH + RONa 酸性序:H2O > R-OH > HC≡CH > NH3 > R-H
碱性序:OH < RO
<
HC≡C < NH2 < R
OH
H
慢 β α
快
OH2
C C
-H
+
快
C=C
H 2O
正碳离子
决定反应速度
问题1:伯、仲、叔醇脱水活性顺序如何? 正碳离子稳定性:
叔正碳离子>仲正碳离子>伯正碳离子
脱水反应活性 叔醇>仲醇>伯醇
问题2:不对称的醇脱水产物如何? CH3CHCHCH2 H OH H CH3CH=CHCH3 浓硫酸 主要产物
●常用于鉴别邻二醇类化合物
例如: 用化学方法鉴别下列化合物
(1)1,2-丙二醇与1,3-丙二醇
CH 3
CH CH 2 OH OH
Cu(OH)2
绛蓝色 —
CH 2 CH 2 CH 2 OH OH
(二)与无机含氧酸的酯化反应
甘油与硝酸反应
CH2—OH CH —OH +3HONO2 CH2—OH
H2SO4
第七章
醇、硫醇、酚
醇(alcohol): 是脂肪烃、脂环烃或芳香烃 侧链中氢被羟基取代而成的化合物
硫醇(thiol): 与醇相应的含硫化合物
酚(phenol): 是芳香环上的氢被羟基取代 而成的化合物。 醇:R—OH 硫醇: R—SH 酚:Ar—OH 官能团 —OH 羟基 官能团 —SH 巯基 官能团 —OH 羟基
第七章 醇 硫醇 酚.

*断裂C-O键的反应 (一)与金属钠的反应
醇与水一样,由于O-H键异裂,可表现出酸性,但其 酸性极弱。一般醇的pKa在16~18之间,水的pKa=15.7。
在无水条件下,醇与金属钠作用,生成乙醇钠和氢气。
当乙醇钠遇水时,可立即分解成氢氧化钠和乙醇。因此醇 的酸性只有在无水条件下被活泼金属置换才能表现出来。
此反应是较强的酸(H-OH)把较弱的酸(RO-H)从它的盐中 置换出来,故醇的酸性比水还弱;而形成的相应的碱,RO— 的碱性比OH—要强得多。 酸性: H2O > ROH > RH 碱性: R—> RO—> OH—
三、
除具有一元醇的一般化学性质外,还有一些特殊性质。 1. 与氢氧化铜的反应 乙二醇与稀硫酸铜的碱性溶液可形成绛蓝色的铜盐。
*断裂C-H键的反应
(四) 氧化反应 氧化反应(oxidation)和还原反应(reduction)的概念:
叔醇没有α -氢,一般不能被氧化。
第二节
一、结构与命名
硫醇
醇分子中的氧原子被硫置换后的化合物称为硫醇(RSH),巯基(-SH) 是硫醇的官能团。 简单硫醇的命名,只需在相应的醇名称中加上“硫”字。当硫醇结构 较复杂时,把-SH作为取代基命名。“-SH”基团称为巯基(sulfhydryl,或 mercapto-)。例如:
二
二甲基亚砜(dimethyl sulfoxide,DMSO) 为硫醚 (CH3-S-CH3)的一种氧化产物。它是一种无色、几乎无嗅、 无味或微有苦味的透明液体。DMSO能与水、乙醇、丙酮、 醚、苯和氯仿任意混溶。DMSO俗称“万能溶媒”。 DMSO对皮肤有较强的穿透力,可作载体成为某些药物 的透皮促进剂,比如DMSO可增加醋酸地塞米松、睾丸酮、 肝素、维生素类、水杨酸、胰岛素等药物的透皮吸收。 DMSO本身无毒,但由于其穿透皮肤的能力强,因此在 使用过程中须带手套,以防有毒物质以DMSO为载体进入机 体。
07章 醇、硫醇、酚

NaOOC CH CH COONa S Hg S
CH2 CH CH2 OH SH SH
CH2 CH CH2 SH SH SO3Na
BAL
(三)氧化反应
[O] [H]
KMnO4
2 R SH
R S S
R
CH3SH
CH3SO3H
.. [O] R S. R .
O ↑ S R .. R O
CH3
S
CH3
CH3CH2CH CH2 H2 O CH3CH2CHCH3 H2SO4 OH (1:1) :) 19% CH3CH CHCH3 81%
R CH CH R' H OH
+ 快 R CH CH R' + H H + OH2
慢
RCH
CHR'
快 消消 β -H
R
+ CH CH H
R' + H O 2
甲基1, 迁移 甲基 2迁移
33-苯 基 -2-丁 醇
5. 多元醇 多元醇 选择连有尽可能多的羟 基的碳链作主链, 基的碳链作主链,依羟基数称某二 某三醇等。 醇、某三醇等。
CH2CH2CH2 OH OH
1, 1,3-丙 二 醇
二、Physical Properties of Alcohol
三、Chemical Properties of Alcohol
..
极性大, 极性大 , 易断裂 H 可质子化 易断裂, 易断裂 ,可发生亲核 取代反应和消去反应 可氧化
C
C H
O ..
1. 醇与金属钠反应
2 ROH
+ 2 Na
H R
2 RONa + H2↑
第7章醇、硫醇、酚

1. 结构 Sp3不等性杂化
110℃
醇羟基中的氧原子认为是sp3不等性杂化,利
用两个单电子的sp3轨道形成C-O和O-H键,C-OH的键角接近于110°,余下两对未共用电子对分
别在另两个sp3轨道。
H H C H
sp 109°
3
O
sp
3
H
甲醇的棍棒模型
2. 分类
(1)根据羟基所连烃基结构不同分类 饱和脂肪醇 CH3CH2OH CH2=CHCH2OH
三氧化铬溶于硫酸中配成的试剂成为铬酸试剂
(橙色),铬酸试剂能氧化伯醇或仲醇,反应前 Cr2O72-为橙红色,反应后生成的Cr3+是绿色。故铬 酸试剂可用作醇的鉴别。C=C、C≡C 与铬酸反应 较慢,不能很快观察到颜色变化,故可鉴别开。这
一性质是使用呼吸分析仪检查汽车驾驶员是否酒后
驾车的理论依据。
CH 3CH2OH +
(三)醇的脱水反应
分子内 醇脱水 分子间 烯 醚
(1)分子内脱水生成烯
醇在浓 H2SO4 或 H3PO4 催化下加热,分子内脱水生成烯。
H2C CH2 H OH
浓H 2SO 4 170 ℃
浓 H2SO4 100 ℃
H 2C CH2
+ H2O
H2C CH CH3 H OH
H2C CH CH3 + H2O
2Cr2O7
CH 3COOH + Cr3+
橙色
绿色
四、甲醇、乙醇的功能与毒性(自学)
第二节 硫醇(Mercaptan)
硫和氧在元素周期表中属于同一主族,因此 它们的性质基本上是相似的,在有些有机化合物
中氧的位置可以被硫代替,如硫醇RSH, 硫醚
第七章醇硫醇酚3
Br 2,4,6-三溴苯酚 (tribromophenol)
反应非常灵敏,可用于部分酚类化合物的检验。
化学性质 2、芳环上的亲电取代反应 (1)卤代反应
OH
CS2
+ Br2 0℃
OH + HBr
Br 80~84%
H3C
OH + Br2
CHCl3 0℃
OH
+ HBr
H3C
Br
80 %
化学性质
2、芳环上的亲电取代反应
(2)硝化反应
OH
20% HNO3 25 ℃
OH
OH
+
NO2
O2N
(30~40%) 邻-硝基苯酚
(15%) 对-硝基苯酚
化学性质
2、芳环上的亲电取代反应
(3)磺化反应
25℃ OH
浓 H2SO4
100℃ HO
OH
o-羟基苯磺酸
SO3H
(49%)
浓 H2SO4, 100℃
SO3H p-羟基苯磺酸 (90%)
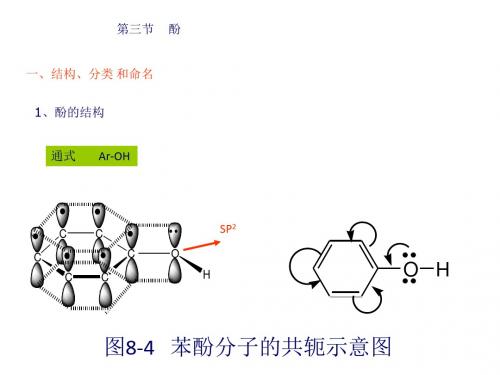
第三节 酚 一、结构、分类 和命名
1、酚的结构 通式 Ar-OH
C C
C
C C
C
SP2 O
H
OH
图8-4 苯酚分子的共轭示意图
一、结构、分类和命名 1、酚 的结构
①氧原子上电子云密度↓ O—H极 性↑ 酸性↑
P- 共轭 ②苯环内电子云密度↑ 环上亲电
的结果:
取代活性↑
③特殊的烯醇式结构 显色反应
蓝紫色 紫色 蓝色 绿色 暗绿色 红色
▲ :凡具有酚羟基结构的化合物均可与FeCl3显色。 应用:鉴别酚类化合物。
4、酚的自氧化与醌的结构
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH3 H 3C C OH CH3 CH2 =CHCH 2 OH CH 2OH
叔丁醇
烯丙醇
苄醇
某些醇也用俗名。俗名一般是根据它们的最初
来源或性质命名。如:
CH3 OH CH2 CH CH2 OH OH OH
木精
(2)系统命名法 1)脂肪醇 ① 选主链
甘油
选含羟基的最长碳链为主链,
根据主链中碳原子数目称为某醇。
CH3 H2C C CH3 H OH
浓 H2SO4 60℃
CH3 H2C C CH3 + H2O
分子内脱水成烯反应的活性:叔丁醇 > 异丙醇 > 乙醇
仲醇和叔醇脱水时遵守查依采夫(Saytzeff)规
则,主产物一般是分子中双键碳上有较多取代基团 的烯烃,也即消除的氢主要来自含氢较少的β碳上。
CH3 CH3 CH C CH2 OH H H
一、醇的结构、分类和命名
1. 结构 Sp3不等性杂化
110℃
醇羟基中的氧原子认为是sp3不等性杂化,利
用两个单电子的sp3轨道形成C-O和O-H键,C-OH的键角接近于110°,余下两对未共用电子对分
别在另两个sp3轨道。
H H C H
sp 109°
3
O
sp
3
H
甲醇的棍棒模型
2. 分类
(1)根据羟基所连烃基结构不同分类 饱和脂肪醇 CH3CH2OH CH2=CHCH2OH
5
4
CH 3CH C CHCH 3 H 2 OH OH
3
CH3
1
OH CH 3 CH 3 CH C OH 2 3 4 1 CH 3 2- 甲基-2,3- 丁二醇
丙三醇3-甲基-2,4-戊二醇 Nhomakorabea2)芳香醇
芳香醇的系统命名是以芳烃基为
取代基,以脂肪醇为母体。如:
3 2 1
CH CH CH 3 4 CH 3 OH 3-苯基-2- 丁醇
正碳离子稳定性:叔碳 > 仲碳 > 伯碳 醇脱水成烯活性:叔醇 > 仲醇 > 伯醇
(2)分子间脱水生成醚
CH3CH2OH + HOCH2CH3 H2SO4 140℃ CH3CH2OCH2CH3 + H2O
这是制备对称醚的方法, 适于由低级伯醇制醚。
叔醇的主要产物为分子内消去产物——烯烃,仲醇成
醚的产量也很低。
二巯基丁二酸钠
二硫基丙醇(BAL)
二硫基丙磺酸钠
三种化合物在结构上的共同点是分子中均
含有两个相邻的巯基,它们与金属离子的亲和
力较强,它们不仅能与进入体内的重金属离子 结合成不易解离的无毒配合物由尿排出体外, 以保护酶系统,而且还能夺取已经与酶结合的 重金属离子,使酶的活性恢复,从而达到解毒
(四)醇的氧化反应
R CH2 OH 伯醇 [O] R CHO 醛 [O] R COOH 羧酸
CH3CH2OH
[O]
CH3CHO
[O]
CH3COOH
H ' [O] R C R OH 仲醇
R C R' O 酮
CH 3 CH CH3 OH
[O]
CH 3 C CH 3 O
R'' R C R OH
'
[O]
46%H2SO4 90~95℃
CH3 CH3CH=CCH3 + 84%
CH3 CH3CH2C=CH2 16%
脱水机制:在无机酸催化下, 醇的羟基质子化, 脱水 生成正碳离子中间体, 最后消去β-H 而生成乙烯。
H
β
C C OH
H
α
+H
快
+
H
β
C C OH2
α
慢
β
C C
α
- H+
快
C=C
H2O
正碳离子
2Cr2O7
CH 3COOH + Cr3+
橙色
绿色
四、甲醇、乙醇的功能与毒性(自学)
第二节 硫醇(Mercaptan)
硫和氧在元素周期表中属于同一主族,因此 它们的性质基本上是相似的,在有些有机化合物
中氧的位置可以被硫代替,如硫醇RSH, 硫醚
RSR。
R OH R O R
醇 醚
R SH R S R
的化合物在临床上可用作重金属的解毒剂。
所谓重金属中毒, 是体内许多酶(乳酸脱氢酶等) 上的巯基与铅、汞等重金属发生了上述反应,使其变
性失活而丧失正常的生理功能所致。
临床上常用作重金属的解毒剂:
CH2 OH CH CH2 SH SH CH2 SH CH CH2 SH SO3Na HS HC CO2Na HS HC CO2Na
通式
伯醇(第一醇)
醇 仲醇(第二醇) 叔醇(第三醇)
R' R C OH R'' CH3
R CH2
R' R CH
OH
H3C CH2
OH
OH
CH 3
CH CH3 OH
CH3 C OH CH3
3. 命名
(1)普通命名法
一般根据烃基的名称命
名,在“醇”字前面加上烃基的名称,称为
“某基醇”,“基”字可省略,称“某醇”。
甘油三硝酸酯(硝酸甘油酯) (缓解心绞痛的药物)
CH3OH + HOSO3H
CH 3OSO 2OH + H2O
硫酸氢甲酯(酸性酯)
CH 3OSO 2OH + HOCH3 CH3OSO2OCH3 + H 2O
硫酸二甲酯(中性酯)
硫酸二甲酯在有机合成中常作为甲基化剂,
有些硫酸酯存在于软骨中。
C12H25OH + H2SO4 40~55 ℃ C12H25OSO3H + H2O
醇与碱金属反应次序:伯醇>仲醇>叔醇 醇的酸性比水弱,其PKa为16~19(水的 PKa为15.74),其共轭碱烷氧负离子(RO―)的
碱性就比OH―强,所以醇钠遇水会立即分解为醇
和金属氢氧化物,因此醇钠的水溶液具有强碱性。
RONa + H-OH
R-OH + NaOH
乙炔钠与醇反应时生成乙炔,说明炔烃的酸性 比醇更弱。
(二)醇与无机含氧酸的酯化反应
酸 + 醇 无机含氧酸 羧酸
(CH 3)2CHCH 2CH 2ONO + H 2O
酯 + 水
(CH3)2CHCH2CH 2OH + HONO
亚硝酸异戊酯 (缓解心绞痛的药物)
CH2 OH CH OH CH2 OH HONO2 + HONO 2 HONO2 CH2 ONO2 CH ONO2 CH2 ONO2 + 3H 2 O
+ H 2O
P OH OH
a - 甘油磷酸酯 a - 磷酸甘油(酸性酯)
O O P O CH2 O O OH
B
O P O CH2 O
3'
B O
O O P O O
5'
磷酸二酯键
B O
核苷酸
O H3CO P OCH=CCl2 OCH3 敌敌畏
CH2
O
磷酸二烷基酯
磷酸三烃基酯
磷酸酯除以上三种形式外,还有烷基二磷酸酯
第七章 醇、硫醇、酚
(Alcohol、Thiol、Phenol)
学习要求:
1. 掌握醇的结构、命名及化学性质。
2. 掌握硫醇和硫醚的结构、命名及化学性质。
3. 掌握酚的结构、命名及化学性质和醌的结构。
醇和酚都含有相同的官能团—羟基(-OH)。
醇:可看作是脂肪烃、脂环烃及芳香侧链上的 氢原子被羟基取代的化合物。
三氧化铬溶于硫酸中配成的试剂成为铬酸试剂
(橙色),铬酸试剂能氧化伯醇或仲醇,反应前 Cr2O72-为橙红色,反应后生成的Cr3+是绿色。故铬 酸试剂可用作醇的鉴别。C=C、C≡C 与铬酸反应 较慢,不能很快观察到颜色变化,故可鉴别开。这
一性质是使用呼吸分析仪检查汽车驾驶员是否酒后
驾车的理论依据。
CH 3CH2OH +
② 编小号 从靠近羟基一端开始编号,羟基 如:
Cl CH3 CHCH2 CH2 CH 2 OH
5 4 3 2 1
的位次和个数写在某醇前面。 ③ 取代基的处理同前
1 4 3
CH3 CH 2 C OH CH 3 2- 甲基-2-丁醇
2
CH 3
4- 氯-1- 戊醇
④不饱和醇的命名 选与羟基相连的碳原子
和不饱和键在内的最长碳链为主链,根据主链中
硫醇 硫醚
一、硫醇的结构与命名
硫醇—可看作是H2S分子中的一个氢原子被烃基
取代的化合物。-SH巯基或氢硫基是硫醇的官能 团。
R SH
硫醇的命名与醇相似,只是在“醇”字前
面加一个“硫”字。结构较复杂的硫醇,以巯 基为取代基。
CH3SH 甲硫醇 CH3CH2SH 乙硫醇
CH 2 SH CH SH 二巯基丙醇 CH 2 OH
脂肪醇
不饱和脂肪醇
醇
脂环醇 芳香醇
OH
CH2 OH
2-莰醇(龙脑)
苄醇(苯甲醇)
(2)根据分子中所含羟基的数目分类
一元醇 醇
多元醇
一个碳原子上连有两个或两个以上羟基时, CH OH
甘油 CH2 OH CH OH
2
不稳定,易脱水生成羰基或羧基化合物。
OH C OH —H2O
C O
(3)根据羟基所连碳原子的种类不同分类
和烷基三磷酸酯,它们广泛存在于生物体中, 具有
重要的生物功能。
O R O P OH OH
烷基一磷酸酯
O O R O P O P OH OH OH
