高考化学复习 易错点3:阿伏伽德罗常数NA
高考化学一轮复习必考点:阿伏加德罗常数

22(2011海南10).1molAl3+离子含有的核外电子数为3NA
23(2011全国Ⅱ12).18gH2O中含的质子数为10NA
24(2011全国Ⅱ12).46gNO2和N2O4混合气体中含有原子总数为3NA
25(2010福建7).在18g18O2中含有NA个氧原子
四、氧化还原反应
考查指定的氧化还原反应。常设置如下问题:氧化还原反应中氧化剂、还原剂、氧化产物、还原产物、电子转移数目等。解决此类问题应正确分析氧化还原反应、电解反应及电极反应中电子转移与反应物或生成物之间的关系,以及熟悉常见元素的化合价。注意某些物质在反应中遇到不同氧化剂(或还原剂)可生成不同产物导致电子转移数目的不同。另外,如常考的化学方程式有:氯气和氢氧化钠反应、过氧化钠和水反应、氯气和铁反应等。相关试题如:
阿伏加德罗常数的正误判断,在近几年的高考中每年都考,稳定性极高,主要以选择题形式出现。因涉及的知识点较多,具有较强的综合性和良好的区分度,倍受高考命题者的青睐。接下来我们就以近四年的高考试题为例,一起回顾、演练,从而达到轻轻松松提分的目的。 一、状况条件
在标准状况(0℃、101.325kPa)时,1mol任何气体的体积约为22.4L,分子数为1NA,即Vm=22.4L/mol的适宜条件是标准状况。在试题中常利用非标准状况如“常温常压;即25℃、101kPa时”来设置陷阱。值得注意的是,温度和压强影响气体的体积,但不影响气体的质量和物质的量,因此,如果讨论物质的量、质量与微粒数目的关系时,则与是否是标况无关,如“常温常压下,1mol氦气的核外电子数为2NA”就是正确的。相关试题如:
52(2009海南8).2.4g金属镁变为镁离子时失去的电子数为0.1NA
五、电离与水解
高考化学专题复习阿伏伽德罗常数

高考化学专题复习——阿伏加德罗常数相关知识点:1、摩尔:表示物质的量的单位,每摩尔物质含有阿伏加德罗常数个微粒;即:n=N/NA;2、阿伏加德罗常数:12C含有的碳原子数就是阿伏加德罗常数;阿伏加德罗常数经过实验已测得比较精确的数值;在这里,采用×1023这个非常近似的数值;3、摩尔质量:单位物质的量的物质所具有的质量叫做摩尔质量,摩尔质量的单位是g/mol或kg/mol;4、物质的量n、物质的质量m和物质的摩尔质量M之间的关系:M=m/n.5、气体摩尔体积:单位物质的量的气体所占有的体积叫做气体摩尔体积;即:Vm=V/n.在标准状况下,1mol的任何气体所占的体积都约是,这个体积叫做气体摩尔体积;6、阿伏加德罗定律:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子;7、物质的量浓度:以单位体积溶液里所含溶质B的物质的量来表示的溶液组成的物理量,叫做溶质B的物质的量浓度;即:cB =nB/V;8、相关原理:电子守恒、电荷守恒、电离平衡、水解平衡、物质结构、晶体结构方面的知识等;解题指导阿伏加德罗常数与微粒问题是高考的传统题型之一;多年来全国高考化学试题重现率几乎为100%;1、考查目的:主要是考查考生对物质的量、阿伏加德罗常数,摩尔质量、气体摩尔体积、物质的量浓度、阿伏加德罗定律这些概念的辩析是否清楚,各种守恒关系、平衡的有关原理掌握得是否牢固;特别是在“摩尔”使用时,微观粒子可以是原子、分子、离子、电子或其它粒子或这些粒子的特定组合,气体摩尔体积的适用范围,阿伏加德罗定律的使用范围,对这些重点和难点反复进行考查;这对考生思维能力的品质—严密性是一个很好的检验;2、考查方法:试题以中学学过的一些重点物质为载体,考查上述有关概念;涉及的物质主要有:Cl2、O2、N2、H2、稀有气体、金属Na、Mg、氢化物、有机物等;为了加强对考生思维品质、适应性、科学性、深刻性的考查,命题者往往有意设置一些陷阱,增大试题的区分度,陷阱的设置主要有以下几个方面:①状况条件:考查气体时经常给非标准状况如常温常压下,101kPa、25℃时等;②物质状态:考查气体摩尔体积时,常用在标准状况下非气态的物质来迷惑考生,如H2O、SO3、已烷、辛烷、CHCl3等;③物质结构:考查一定物质的量的物质中含有多少微粒分子、原子、电子、质子、中子等时常涉及稀有气体He、Ne等为单原子组成,Cl2、N2、O2、H2为双原子分子等;④氧化—还原反应:考查指定物质参加氧化—还原反应时,常设置氧化—还原反应中氧化剂、还原剂、氧化产物、还原产物、被氧化、被还原、电子转移得失数目方面的陷阱;⑤电离、水解:考查电解质溶液中微粒数目或浓度时常涉及弱电解质的电离,盐类水解方面的陷阱;⑥特例:NO2存在着与N2O4的平衡;3、解题策略:要正确解答本类题目,首先要认真审题;审题是“审”而不是“看”,审题的过程中要注意分析题目中概念的层次,要特别注意试题中一些关键性的字、词,要边阅读边思索;其次要留心“陷阱”,对常见的一些陷阱要千万警惕;考生要在认真审题的基础上利用自己掌握的概念仔细分析、比较、作出正确解答;典型考点一、 计算物质中所含微粒的数目一 根据质量求微粒数:关键是摩尔质量及微粒类型 1、14 g 乙烯和丙烯的混合物中总原子数为3N A 个 2、7 g C n H 2n 中含有的氢原子数目为N A3、120g 由NaHSO 4和KHSO 3组成的混合物中含有硫原子N A 个4、18g 冰水混合物中有3N A 个原子和10N A 个电子5、常温常压下,32 g 氧气和臭氧混合气体中含有2 N A 个原子二根据体积求微粒数:用到·mol -1必须注意物质的状态及是否是标准状况 6、标准状况下, L H 2O 含有×1023个H 2O 分子 7、 L CO 2中含有的原子数为××10238、标准状况下,以任意比混和的氢气和一氧化碳气体共,在足量氧气中充分燃烧时消耗氧气的分子数为9、00C,×106Pa 时,氧气所含的氧原子数为N A 10、标准状况下,个HCHO 分子所占体积约为 L三根据浓度求微粒数:注意弱电解质的电离和盐类的水解 11、 mol ·L -1 CuCl 2溶液中含有×1023个Cu 2+12、 L 3 mol ·L -1的NH 4NO 3溶液中含有的NH 4+数目为××1023 13、100 mL mol/L 的盐酸与醋酸溶液中氢离子均为 14、100mL1mol/L 的Na 3PO 4溶液中含有离子数多于 15、1 mol 冰醋酸中含有N A 个CH 3COO - 二、物质结构的考查 一“基”, “根”的区别16、等物质的量的甲基—CH 3和羟基—OH 所含电子数相等 17、在1mol 的CH 5+中所含的电子数为10N A18、常温常压下,1mol 碳烯:CH 2所含的电子数为8N A 19、16g C H 4与18 g N 所含质子数相等二胶体中的胶粒数20、1 mol FeCl 3跟水反应完全转化成氢氧化铁胶体后,生成胶体粒子的数目为N A 三特殊物质中的原子、离子21、在标准状况下,2g 氖气含有N A 个氖原子 22、62 g 白磷中含有2 N A 个磷原子 23、1molNa 2O 2含有阴阳离子总数为4N A 四同位素原子的差异24、18 g D 2O 中含有的质子数目为10N A25、由2H 和18O 所组成的水11g,其中所含的中子数为N A 26、3g 氘变为氘离子时失去的电子数目为N A 五物质的空间结构和化学键的数目27、在石英晶体中,N A 个硅原子与2N A 个氧原子形成共价键 28、31g 白磷分子中,含有的共价单键数目是N A 个 29、1molC 10H 22中含共价键的数目为30N A 三、计算氧化还原反应中得失电子数目30、标准状况下,将m1克锌加入到m2克20%的盐酸中共放出nLH2,则转移电子数为 nN A /31、电解饱和食盐水时,每得到1molNaOH,在阳极上反应的离子就得到1 mol电子32、1 molNa2O2与足量水蒸气反应转移电子数为2N A33、标准状况下,用MnO2和浓盐酸反应制取Cl2,当有4 molHCl被氧化时,生成 LCl234、32 gCu与S完全反应转移的电子数为N A35、 g铁粉与硝酸反应失去的电子数一定为××102336、1mol氯气参加氧化还原反应,转移的电子数一定为2NA37、电解CuCl2溶液时,若有NA个电子通过,则阴极增重64g四、关于阿伏加德罗定律38、N A个氧分子与N A个氢分子的质量比等于16:139、在同温同压下,相同体积的任何气体单质所含的原子数目相同40、同温同压同体积的CO2和SO2所含氧原子数均为2N A五、关于化学平衡41、46g NO2和N2O4的混合物所含的分子数为1NA42、在密闭容器中建立了N2+3H22NH3的平衡,每有17gNH3生成,必有个NH3分子分解六、涉及化学反应的发生及反应进行情况的计算43、标准状况下, LNH3和 LHCl混合后分子总数为N A44、含n molHCl的浓盐酸与足量MnO2反应可生成n N A /4 个氯分子离子反应方程式与离子共存1.复习重点1增加限制条件,如强酸性、无色透明、碱性、pH=1、甲基橙呈红色、发生氧化还原反应等;2定性中有定量,如“由水电离出的H+或OH-浓度为1×10-10mol/L的溶液中,……”;2.难点聚焦一、由于发生复分解反应,离子不能大量共存;1、有气体产生;如CO32-、HCO3-、S2-、HS-、SO32-、HSO3-等易挥发的弱酸的酸根与H+不能大量共存,主要是由于发生CO32-+2H+=CO2↑+H2O、HS-+H+=H2S↑等;2、有沉淀生成;如Ba2+、Ca2+、Mg2+等不能与SO42-、CO32-等大量共存,主要是由于Ba2++CO32-=BaCO3↓、Ca2++SO42-=CaSO4↓微溶;Mg 2+、Al 3+、Cu 2+、Fe 2+、Fe 3+等不能与OH -大量共存是因为 Cu 2++2OH -=CuOH 2↓,Fe 3++3OH -=FeOH 3↓等; SiO 32-、AlO 2- 、S 2O 32-等不能与H +大量共存是因为 SiO 32-+2H +=H 2 SiO 3↓、AlO 2-+H ++H 2O =AlOH 3↓、S 2O 32-+2H +=S↓+SO 2↑+H 2O3、有弱电解质生成;如OH -、ClO -、F -、CH 3COO -、HCOO -、PO 43-、HPO 42-、H 2PO 4-等与H +不能大量共存, 主要是由于OH -+H +=H 2O 、CH 3COO -+H +=CH 3COOH 等; 一些酸式弱酸根及NH 4+不能与OH -大量共存是因为HCO 3-+OH -=CO 32-+H 2O 、HPO 42-+OH -=PO 43-+H 2O 、NH 4++OH -=NH 3·H 2O 等; 4、一些容易发生水解的离子,在溶液中的存在是有条件的;如:AlO 2-、S 2-、HS -、CO 32-、HCO 3-、SO 32-、HSO 3- 、ClO -、F -、CH 3COO -、HCOO -、PO 43- 、SiO 32-、C 6H 5O -等必须在碱性条件下才能在溶液中大量存在;Mg 2+、Al 3+、Cu 2+、Fe 2+、Fe 3+、NH 4+等必须在酸性条件下才能在溶液中大量存在;二、由于发生氧化还原反应,离子不能大量共存1、一般情况下,具有较强还原性的离子不能与具有较强氧化性的离子大量共存;如I -、、S 2-、HS -和Fe 3+不能大量共存是由于2I -+2Fe 3+=I 2+2Fe 2+、2Fe 3++ S 2-=S ↓+2Fe 2+、2Fe 3++3S 2-=S ↓+2Fe S ↓;2、在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存;如NO 3-和I -在中性或碱性溶液中可以共存,但在有大量H +存在情况下不能共存;SO 32- 、S 2O 32-和S 2-在碱性条件下可以共存,但在酸性条件下由于发生2S 2-+SO 32-+6H +=3S↓+3H 2O 、2S 2-+S 2O 32-+6H +=4S↓+3H 2O 不能共存;ClO -与S 2-不论是在酸性条件下还是在碱性条件下都不能大量共存;三、由于形成络合离子,离子不能大量共存中学化学中还应注意有少数离子可形成络合离子而不能大量共存的情况;如Fe 3+和SCN -、C 6H 5O -,由于Fe 3++SCN-FeSCN 2+等络合反应的发生而不能大量共存;四、能水解的阳离子与能水解的阴离子一般不能同时存在在同一溶液中,即离子间能发生“双水解”反应;例如:Al 3+和HCO 3-,Al 3+和CO 32-,Al 3+和S 2-,Al 3+和HS-,Al 3+和AlO 2-,Al 3+和C 6H 5O -,Fe 3+和AlO 2-,Fe 3+和HCO 3-,Fe 3+和CO 32-,NH 4+和AlO 2-等;如3AlO 2-+Al 3++6H 2O=4AlOH 3↓等;特别注意:NH 4+和CO 32-、NH 4+和HCO 3-、NH 4+和CH 3COO -在同一溶液中能大量共存;注意事项:1.首先必须从化学基本概念和基本理论出发,搞清楚离子反应的规律和“离子共存”的条件;在中学化学中要求掌握的离子反应规律主要是离子间发生复分解反应和离子间发生氧化还原反应,以及在一定条件下一些微粒离子、分子可形成络合离子等;“离子共存”的条件是根据上述三个方面统筹考虑、比较、归纳整理而得出的;因此解决“离子共存”问题可从离子间的反应规律入手,逐条梳理;2.审题时应注意题中给出的附加条件,如:①酸性溶液H +、碱性溶液OH -、能在加入铝粉后放出可燃性气体的溶液、由水电离出的H +或OH -浓度为1×10-10mol/L 的溶液等;②有色离子:MnO 4-,Fe 3+,Fe 2+,Cu 2+,FeSCN 2+使溶液呈现一定的颜色; ③MnO 4-、NO 3-、Cr 2O 72-等在酸性条件下具有强氧化性;④注意题目要求“一定大量共存”、“可能大量共存”还是“不能大量共存” 等要求;3.审题时还应特别注意以下几点:1注意溶液的酸碱性对离子间发生氧化还原反应的影响;如:Fe 2+与NO 3-能共存,但在强酸性条件下发生3Fe 2++NO 3-+4H +=3Fe 3+ + NO ↑+2H 2O 而不能大量共存;I-与NO 3-能共存,但在强酸性条件下不能大量共存;MnO 4- 与Cl -在强酸性条件下也不能大量共存;S 2-与SO 32-在碱性条件下可共存,但在酸性条件下不能大量共存;2 弱酸的酸式根离子如HCO 3-、HSO 3-、HS -、HPO 42-、H 2PO 4-既不能与H +大量共存也不能与OH -大量共存;如:HCO 3-+OH -=CO 32-+H 2O HCO 3-遇碱时进一步电离HCO 3-+H +=CO 2↑+H 2O;3 注意挖掘题目中隐含的信息,排除干扰信息,克服非智力因素失分; 离子方程式的书写正误是历年高考必出的试题,考查离子方程式的目的主要是了解考生使用化学用语的准确程度和熟练程度,具有一定的综合性;从命题的内容看,存在着三种特点:⑴所考查的化学反应均为中学化学教材中的基本反应,错因大都属于化学式能否拆分、处理不当、电荷未配平、产物不合理和漏掉部分反应等; 2所涉及的化学反应类型以复分解反应、溶液中的氧化还原反应为主; ⑶一些重要的离子反应方程式,在历年考卷中多次重复; 4. 离子方程式正误判断规律八“看”⑴看离子反应是否符合客观事实,不可主观臆造产物及反应; ⑵看“=”“≒”“↑”“↓”等是否正确;⑶看表示各物质的化学式是否正确;如HCO 3-不能写成CO 32-+H +⑷看是否漏掉离子反应; ⑸看电荷是否守衡;⑹看反应物或产物的配比是否正确; ⑺看是否符合题设条件及要求; ⑻看物料是否守衡; 3. 例题精讲1.下列各组离子,在强碱性溶液中可以大量共存的是A .I -、AlO 2-、Cl -、 S 2-B .Na +、K +、NH 4+、Ba 2+C .Br -、S 2-、Cl -、CO 32-D .SO 32-、NO 3-、SO 42-、HCO 3-2.下列离子在溶液中因发生氧化还原反应而不能大量共存的是A .H 3O +、NO 3-、Fe 2+、Na +B .Ag +、NO 3-、Cl -、K +C .K +、Ba 2+、OH -、SO 42-D .Cu 2+、NH 4+、Br -、OH -3.若溶液中由水电离产生的cOH -=1×10-14mol ·L -1,满足此条件的溶液中一定..可以大量共存的离子组是A .Al 3+ Na + NO -3 Cl -B .K + Na + Cl - NO 3-C .K + Na + Cl - AlO 2-D .K + NH 4+ SO 42- NO 3-4下列离子方程式正确的是A .向NaHSO 4溶液中逐滴加入BaOH 2溶液,至沉淀完全:2H ++SO 42-+Ba 2++2OH -=BaSO 4↓+2H 2OB .碳酸钠与醋酸溶液反应:CO 32-+2CH 3COOH =CO 2↑+2CH 3COO - +H 2OC .将1~2mL 氯化铁饱和溶液加入到20 mL 沸水中:Fe 3++3H 2O FeOH 3胶体+3H +D .氢氧化铁与氢碘酸中和:FeOH 3+3H +=Fe 3++3H 2O5下列离子方程式的书写正确的是A .FeS 固体与稀HNO 3溶液混合 FeS +2H +=2Fe 2++H 2S ↑B .NH 4HSO 4溶液中加入足量BaOH 2溶液 H ++SO 42-+Ba 2++OH -=BaSO 4↓+H 2OC .CaClO 2溶液中通入足量的CO 2气体 Ca 2++2ClO -+CO 2+H 2O =CaCO 3↓+2HClOD .等浓度等体积的CaH 2PO 42溶液与NaOH 溶液混合 Ca 2++H 2PO 4-+OH -=CaHPO 4↓+H 2O6下列离子方程式书写正确的是A .将少量SO 2气体通入NaClO 溶液中 SO 2+2ClO -+H 2O=SO 32-+2HClOB .向KHSO 4溶液中加入BaOH 2溶液至所得溶液的pH=7 Ba 2++2OH -+2H ++SO 42-=BaSO 4↓+2H 2OC .向CaHCO 32溶液中滴入过量的NaOH 溶液 Ca 2++2 HCO 3-+2OH -=CaCO 3↓+CO 32-+2H 2OD .112mLCl 2通入10mL1mol/L 的FeBr 2溶液中 2Fe 2++4Br -+3Cl 2=2Fe 3++6Cl -+2Br 27.有一瓶澄清溶液,其中可能含有:NH 4+、K +、Mg 2+、Al 3+、Fe 2+、NO 3-、Cl -、SO 42-、CO 32-,取该溶液进行下列实验:⑴取部分溶液,向其中逐滴滴入BaOH 2溶液至过量,有白色沉淀生成沉淀量与加入BaOH 2溶液量的关系如右图;⑵取1反应后过滤所得沉淀和滤液,在沉淀中加入稀盐酸后,沉淀不减少; 将滤液分为两等份,一份加热,未产生刺激性气味的气体;另一份加HNO 3酸化 时有白色沉淀产生,继续加HNO 3,沉淀又消失,再加AgNO 3没有变化; 根据以上事实确定:该溶液中肯定存在的离子有________________________, 肯定不存在的离子有________________, 不能确定的离子有________ ______;。
高考化学 阿伏加德罗常数正误的判断试题分析
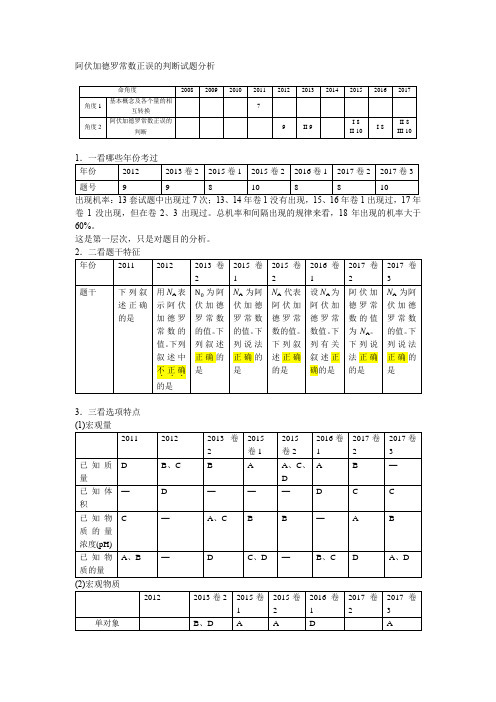
阿伏加德罗常数正误的判断试题分析出现机率:13套试题中出现过7次;13、14年卷1没有出现,15、16年卷1出现过,17年卷1没出现,但在卷2、3出现过。
总机率和间隔出现的规律来看,18年出现的机率大于60%。
这是第一层次,只是对题目的分析。
3.三看选项特点物质变化预测1.题型特征一般不会发生大的变化,还是以阿伏加德罗常数的正误判断为主。
2.所给的已知条件还会是质量、体积、物质的量浓度和物质的量四个方面,要特别关注气体,包括三个方面:一是非常温常压下的;二是常温常压下的;三是非气态物质。
3.考查点还会围绕着微粒和结构设计,主要落脚在“六子”上,包括化学键和晶体结构的考查,以充分体现出化学学科的微观思想。
4.至少有一个选项会判断化学反应过程中电子数的转移。
5.可能有选项会涉及混合物的分析和判断。
因此要关注具有相同的最简式、具有相同的分子式和相同的相对分子质量等。
6.有可能出现溶液方面的知识,如弱电解质的电离、盐类的水解等。
7.有可能会出现利用化学方程式的计算,关注过量的情况,关注可逆反应,关注稳含的反应(如二氧化氮与四氧化二氮的转化)等。
8.关注点。
(1)以物质的量为中心的概念方面要关注物质的量浓度、气体摩尔体积,也要适当关注不同量之间的转化关系、物质的组成特点以及物质在水溶液中的行为等,比如微粒的水解和电离问题。
(2)除宏观和微观之间的转换外,还要关注微观和微观之间的转换,如离子中所含的电子数、中子数和质子数。
(3)组成方面着重关注具有相同组成特点的分子式,比如含有相同的原子个数、具有相同的最简式、具有相同的分子式和相同的相对分子质量等。
(4)结构方面着重关注:晶体类型、原子结构、根和基等原子团结构等。
(5)溶液方面:弱电解质的电离平衡、盐类的水解平衡等。
(6)物质的变化:利用化学方程式的计算,关注过量的情况;关注隐含的反应(如可逆反应)等。
备考指导考题1 阿伏加德常数正误的判断一、题目结构分析1.题干此类题目的题干一般为“设N A为阿伏伽德罗常数的数值,下列说法正确的是”;2.选项(1)选项组成每个选项一般分为四部分:第一部分,宏观量,即给出物质的质量、体积、物质的量浓度或物质的量等前提条件;第二部分,宏观物质,即给出所研究的具体物质和对象;第三部分,微观粒子,即给出要求求算的对象,包括分子、原子、离子、电子、质子、中子、化学键等;第四部分,微观量,即给出微粒数目或其他微观量。
【备战高考】2020年最新高考化学易错点3:NA

易错点三NA瞄准高考1.(课标Ⅱ)阿伏加德罗常数的值为N A。
下列说法正确的是A.1L0.1mol·NH4Cl溶液中,的数量为0.1N AB.2.4gMg与H2SO4完全反应,转移的电子数为0.1 N AC.标准状况下,2.24LN2和O2的混合气体中分子数为0.2 N AD.0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2 N A【答案】D2.(课标Ⅲ)为阿伏加德罗常数的值。
下列说法正确的是A.0.1 mol 的中,含有个中子B.pH=1的H3PO4溶液中,含有个C.2.24L(标准状况)苯在O2中完全燃烧,得到个CO2分子D.密闭容器中1 mol PCl3与1 mol Cl2反应制备PCl5(g),增加个P-Cl键【答案】A【解析】A.11B中含有6个中子,0.1mol 11B含有6N A个中子,A正确;B.溶液体积未定,不能计算氢离子个数,B错误;C.标准状况下苯是液体,不能利用气体摩尔体积计算22.4L苯的物质的量,则无法判断其完全燃烧产生的CO2分子数目,C错误;D.PCl3与Cl2反应生成PCl5的反应是可逆反应,反应物不可能完全转化为生成物,则所1molPCl3与1molCl2反应生成的PCl5小于1mol,增加的P-Cl 键的数目小于2N A个,D错误;答案选A。
3.(课标Ⅰ)设N A为阿伏加德罗常数值。
下列有关叙述正确的是A.14 g乙烯和丙烯混合气体中的氢原子数为2N AB.1 mol N2与4 mol H2反应生成的NH3分子数为2N AC.1 mol Fe溶于过量硝酸,电子转移数为2N AD.标准状况下,2.24 L CCl4含有的共价键数为0.4N A【答案】A锁定考点小题快练1.(山东省济宁市高三上学期期末考试)设N A为阿伏伽德罗常数的值。
下列说法正确的是A. 标准状况下,5.6L.Cl2 与足量NaOH 反应转移的电子数为0.25N AB. 室温下,1LpH=13 的NaOH溶液中,由水电离的OH-离子数目为0.1N AC. 氢氧燃料电池正极消耗22.4L( 标准状况)气体时,电路中通过的电子数目为2N AD. 5NH4NO32HNO3 +4N2↑+9H2O 反应中,生成56gN2 时,转移的电子数目为3.75N A【答案】A【解析】Cl2 与足量NaOH 反应生成氯化钠和次氯酸钠,1mol氯气转移1mol电子,所以标准状况下,5.6LCl2 与足量NaOH反应转移的电子数为0.25N A,故A正确;室温下,pH=13的NaOH溶液中,由水电离的OH-离子的浓度是,1LpH=13 的NaOH溶液中,由水电离的OH-离子数目为N A,故B错误;氢氧燃料电池正极是氧气得电子,1mol氧气得4mol电子,所以消耗22.4L( 标准状况)气体时,电路中通过的电子数目为4N A,故C错误;根据方程式5NH4NO32HNO3+4N2↑+9H2O,生成4molN2 转移15mol电子,所以生成56gN2 时,转移的电子数目为7.5N A,故D错误。
2021年高考化学三轮复习专题:阿伏加德罗常数

阿伏加德罗常数1.(2020·高考全国3卷T9)N A是阿伏加德罗常数的值。
下列说法正确的是A.22.4 L(标准状况)氮气中含有7N A个中子B.1 mol重水比1 mol水多N A个质子C.12 g石墨烯和12 g金刚石均含有N A个碳原子D.1 L 1 mol·L−1 NaCl溶液含有28N A个电子【答案】C2.设N A为阿伏加德罗常数的值。
下列有关叙述正确的是A.标准状况下,2.24LCCl4中含有分子数目为0.1N AB.0. 1molFe粉与稀HNO3反应,转移电子数目为0.3N AC.9.2gNO2和N2O4的混合气体中含有原子数目为0.6N AD.pH = 13的Ba(OH)2溶液中含有OH-数目为0.1N A【答案】C3.设N A为阿伏加德罗常数的值,下列说法正确的是A.100 g溶质质量分数为46%的乙醇水溶液中,含有4N A个氧原子B.标准状况下,11 g T216O中含有的质子数目为6N AC.3.65 g液态HCl中含有的粒子总数为0.2N AD.25 ℃时Ksp(CaSO4)=9×10-6,则该温度下CaSO4饱和溶液中含有3×10-3N A个Ca2+【答案】A4.设N A为阿伏加德罗常数的值,下列说法正确的是()A.124g白磷(P4)中含有4N A个P-P 键B.标准状况下,3.36 L 一氯甲烷(CH3Cl)中含有极性键的数目为 0.6N AC.4.4 g 乙醛和乙酸乙酯的混合物中含有的氢原子数目为 0.2N AD.某温度下,1L NH4Cl 与 NH3·H2O 的中性混合溶液中含有 H+的数目不小于 10-7N A【答案】B5.N A为阿伏加德罗常数,下列说法不正确的是A.78 g苯(C6H6)和苯乙烯(C8H8)的混合物中含有的碳氢键数一定为6N AB.H2O2+8H++2LiFePO4=2Fe3++2H2O+2H3PO4+2Li+,则每生成1 mol Li+转移的电子数为N A C.将0.1 mol Cl2完全溶于水中,所得溶液中Cl2、Cl-、HClO、ClO-的粒子数之和为0.1N A D.1 L1 mol/L的NH4Br溶液中通入适量氨气呈中性,此时溶液中NH4+的数目为N A【答案】C6.设N A 为阿伏加德罗常数的值,下列说法正确的是A .25 ℃时,pH=11的Na 2CO 3溶液中水电离出的OH -的数目为0.001N AB .0.1mol 甲基中所含电子数目为N AC .28g 乙烯、乙烷混合气体中所含原子数大于6N AD .5.6g 铁与硝酸完全反应时转移的电子数目为0.3N A【答案】C7.N A 是阿伏加德罗常数的值,下列说法正确的是A .若1molFeCl 3跟水完全反应转化为氢氧化铁胶体后,其中胶体粒子的数目为N AB .将一定量的Cl 2通入FeBr 2溶液中,当有1molBr -转化为Br 2时,转移的电子数为N AC .44.0g 环氧乙烷中含有6.0N A 个极性键D .1molCaO 2晶体中含离子总数为3N A【答案】C8.下列说法正确的是( )A .13.35g AlCl 3水解形成的Al (OH )3胶体粒子数为0.1N AB .1L0.1mol •L ﹣1的NaHSO 3溶液中,HSO -3和SO 2-3离子数之和为0.1N AC .密闭容器中23g NO 2与N 2O 4的混合气体中氮原子数为0.5N AD .4.6g 乙醇含共价键数为0.7N A【答案】C9.设N A 为阿伏加德罗常数的值,下列说法不正确的是( )A .1molCH 4与Cl 2在光照下反应生成的CH 3Cl 分子数等于N AB .100gCaCO 3和KHCO 3的固体混合物中含有的阳离子数为N AC .一定浓度的硫酸和镁反应,生成11.2L (标准状况)气体,转移电子数为N AD .6.4gSO 2溶于水形成的酸雨中,SO 2、H 2SO 3、HSO 3-和SO 23-的微粒数之和为0.1N A【答案】A10.N A 代表阿伏加德罗常数的值,下列叙述正确的是A .88.0 g 14CO 2与14N 2O 的混合物中所含中子数为 44 N AB .1 mol CH 3COONa 与少量 CH 3COOH 溶于水所得的中性溶液中,CH 3COO -数目为N AC .17.4 g MnO 2与40 mL10 mol/L 浓盐酸反应,转移电子的数目为0.2 N AD.常温下pH=4的醋酸溶液中由水电离出的 H+的数目为 10-10 N A【答案】B11.N A是阿伏加德罗常数的值。
高考化学复习:阿伏伽德罗常数

高考化学复习:阿伏伽德罗常数1.设N A 为阿伏伽德罗常数的值,下列叙述错误的是A.1L0.1mol·L -1(NH 4)2SO 4溶液中NH 4+离子的数目为0.2N AB.Zn 与浓硫酸反应,产生22.4L 气体(标准状况)时,转移的电子数一定为2N A C.16.9g 过氧化钡(BaO 2)固体中阴、阳离子总数为0.2N A D.42.0g 乙烯和丙烯的混合气体中含有的碳原子数为3N A 【答案】AA.NH 4+可以水解,故NH 4+是数目会小于0.2N A ,A 错误;B.Zn 与浓硫酸反应可能生成二氧化硫或二氧化硫和氢气的混合物,方程式为24422Zn+2H SO ()=ZnSO +SO +2H O ↑浓,2442Zn+H SO ()=ZnSO +H ↑稀,根据方程式可知无论生成氢气还是二氧化硫,生成1mol 气体转移电子均为2mol,22.4L 气体(标准状况)的物质的量为1mol,所以转移的电子数一定为2N A ,B 正确;C.16.9g 过氧化钡(BaO 2)的物质的量是0.1mol,由于在一个该固体中含有的阴、阳离子数目是2,所以0.1mol 该固体中含有的离子总数为0.2N A ,C 正确;D.乙烯和丙烯的最简式均为CH 2,故42g 混合物中含有的CH 2的物质的量为3mol,则含3N A 个碳原子,D 正确;2.用A N 代表阿伏伽德罗常数的数值。
下列说法不正确的是A.12g 石墨烯和12g 金刚石均含有A N 个碳原子B.21molNO 与水完全反应转移的电子数为A N C.标准状况下,322.4L NH 含有的电子数为A 10N D.0.1mol 的11B 中,含有A 0.6N 个中子【答案】BA.石墨烯、金刚石都是C 单质,12g 石墨烯和12g 金刚石均含有A N 个碳原子,故A 正确;B.NO 2和水反应生成硝酸和NO,反应方程式为3NO 2+H 2O=HNO 3+NO,21molNO 与水完全反应转移的电子数为23AN ,故B 错误;C.标准状况下,322.4L NH 的物质的量是1mol,含有的电子数为A 10N ,故C 正确;D.11B 含中子数为11-5=6,0.1mol 的11B 中含有A 0.6N 个中子,故D 正确;3.设N A 为阿伏伽德罗常数的数值,下列说法正确的是A.向沸水中滴加含0.1mol 氯化铁的饱和溶液,制得的Fe(OH)3胶体粒子数目是0.1N A B.标准状况下,22.4L 的CH 2Cl 2所含的分子总数为N A C.4.0g H 218O 所含质子数为2N AD.1mol·L -1Na 2CO 3溶液中含有的CO 32-数目小于N A【答案】CA.胶体粒子是许多分子的集合体,向沸水中滴加含0.1mol 氯化铁的饱和溶液,制得的Fe(OH)3胶体粒子数目小于0.1N A ,故A 错误;B.标准状况下,CH 2Cl 2不是气体,不能使用气体摩尔体积进行计算,故B 错误;C.H 218O 的相对分子质量为20,且含有10个质子,4.0g H 218O 的物质的量为 4.0g20g /mol=0.2mol,其中所含质子数为2N A ,故C 正确;D.1mol·L -1Na 2CO 3溶液的溶液体积未知,无法判断其中含有的CO 32-数目,故D 错误;4.A N 为阿伏伽德罗常数的值,下列叙述正确的是A.0.1mol/L 的4HClO 溶液中含有的H +数目为A 0.1N B.0.5mol 雄黄(44As S ,结构如图)含有A N 个As As -键C.化学反应中每生成1mol 2O 转移电子数一定为A4N D.常温常压下,体积为22.4L 的22CH Cl 所含分子数为A 1N 【答案】BA.溶液体积不明确,故溶液中的H +数目无法计算,故A 错误;B.由于As 和N 同主族,所以要达到8电子稳定结构,需形成3个共价键,而S 需形成2个共价键,所以黑色球为As,白色球为S,分子中不存在S-S 键,0.5mol 雄黄As 4S 4含有N A 个As-As 键,故B 正确;C.2mol 过氧化钠与水反应生成1mol 氧气,转移2mol 电子,转移电子数不一定为A 4N ,故C 错误;D.常温常压,Vm≠22.4L/mol,Vm 未知无法计算物质的量,故D 错误;5.N A 为阿伏伽德罗常数的值。
全国2019年高考化学易错点(03)阿伏加德罗常数(知识点讲解)

易错点03 阿伏加德罗常数瞄准高考1.(2018课标Ⅰ)N A 是阿伏加德罗常数的值,下列说法正确的是A. 16.25 g FeCl 3水解形成的Fe(OH)3胶体粒子数为0.1 N AB. 22.4 L (标准状况)氩气含有的质子数为18N AC. 92.0 g 甘油(丙三醇)中含有羟基数为1.0N AD. 1.0 mol CH 4与Cl 2在光照下反应生成的CH 3Cl 分子数为1.0N A 【答案】B2.(2018课标Ⅱ)N A 代表阿伏加德罗常数的值。
下列说法正确的是A. 常温常压下,124 g P 4中所含P—P 键数目为4N AB. 100 mL 1mol·L −1FeCl 3溶液中所含Fe 3+的数目为0.1N AC. 标准状况下,11.2 L 甲烷和乙烯混合物中含氢原子数目为2N AD. 密闭容器中,2 mol SO 2和1 mol O 2催化反应后分子总数为2N A【答案】C【解析】A. 常温常压下,124 g P 4的物质的量是1mol ,由于白磷是正四面体结构,含有6个P -P 键,因此其中所含P—P 键数目为6N A ,A 错误;B. 铁离子在溶液中水解,所以100 mL 1mol·L −1FeCl 3溶液中所含Fe 3+的数目小于0.1N A ,B 错误;C. 甲烷和乙烯分子均含有4个氢原子,标准状况下,11.2 L 甲烷和乙烯混合物的物质的量是0.5mol ,其中含氢原子数目为2N A ,C 正确;D. 反应2SO 2+O 22SO 3是可逆反应,因此密闭容器中,2 mol SO 2和1 mol O 2催化反应后分子总数大于2N A ,D 错误。
答案选C 。
3.(2017课标Ⅱ)阿伏加德罗常数的值为N A 。
下列说法正确的是A .1L0.1mol·NH 4Cl 溶液中,的数量为0.1N A1L -4NH +B .2.4gMg 与H 2SO 4完全反应,转移的电子数为0.1 N AC .标准状况下,2.24LN 2和O 2的混合气体中分子数为0.2 N AD .0.1mol H 2和0.1mol I 2于密闭容器中充分反应后,其分子总数为0.2 N A【答案】D2.(2017课标Ⅲ)为阿伏加德罗常数的值。
阿伏加德罗常数(NA)考点剖析

阿伏加德罗常数(NA)考点剖析摘要:阿伏加德罗常数是化学高考的热点之一,该类试题以中学所学重点物质为平台,考查以NA为载体的相关计算,基本概念、原理、题目涉及的知识面广,灵活性强,因而能很好地考查学生思维的严密性。
关键词:阿伏加德罗常数摩尔体积考点剖析一、气体摩尔体积的适用条件及物质的聚集状态1.由于气体体积受温度、压强的影响,所以气体摩尔体积并非定数。
标准状况下(0℃、101kpa)气体摩尔体积才为22.4L•mol-1。
气体的体积主要决定于分子间的平均距离,分子本身的大小对体积的影响可忽略,所以气体摩尔体积适用于任何气体,也包括混合气体。
但若题目给出气体的质量或物质的量,则微粒数目与外界条件无关。
2.要注意物质的状态:气体摩尔体积适用于标况下的气态物质。
常考在标况下呈气态的物质有n(c)≤4的烃,CH3Cl,HCHO。
非气态的物质有n(c)>4的烃,H2O、SO3、HF、CH2Cl2、CHCl3、CCl4、Br2,苯C6H6等。
现列出相关选项进行分析:A.标准状况下,2.24L CCl4含有的共价键数为0.4NA。
B.标准状况下,2.24L N2和O2的混合气体中分子数为0.2NA。
C.常温下,11.2L甲烷气体含有的甲烷分子数0.5NA。
D.常温下,23g NO2含有NA个氧原子。
分析:在标准状况下,CCl4呈液态,A错。
标况下,混合气体为0.1mol,含分子数为0.1NA,B错。
非标况下,无法计算甲烷物质的量,C错。
0.5mol NO2,含NA个氧原子,D对。
二、明确物质中的粒子数1.注意特殊物质的原子数、电子数。
2.注意同位素原子的差异。
3.常考物质中的化学键数。
4.注意物质中阴、阳离子个数。
应对策略:解决此类问题,需要经过以下几个思维步骤:(1)选择合适的公式计算物质的物质的量。
(2)分析物质的微观结构,注意结构的特殊性等问题。
(3)结合物质的物质的量和结构进行计算。
三、有关氧化还原反应的问题1.歧化反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考化学复习易错点三NA瞄准高考1.(2017课标Ⅱ)阿伏加德罗常数的值为N A。
下列说法正确的是A.1L0.1mol·NH4Cl溶液中,的数量为0.1N AB.2.4gMg与H2SO4完全反应,转移的电子数为0.1 N AC.标准状况下,2.24LN2和O2的混合气体中分子数为0.2 N AD.0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2 N A【答案】D2.(2017课标Ⅲ)为阿伏加德罗常数的值。
下列说法正确的是A.0.1 mol 的中,含有个中子B.pH=1的H3PO4溶液中,含有个C.2.24L(标准状况)苯在O2中完全燃烧,得到个CO2分子D.密闭容器中1 mol PCl3与1 mol Cl2反应制备PCl5(g),增加个P-Cl键【答案】A【解析】A.11B中含有6个中子,0.1mol 11B含有6N A个中子,A正确;B.溶液体积未定,不能计算氢离子个数,B错误;C.标准状况下苯是液体,不能利用气体摩尔体积计算22.4L 苯的物质的量,则无法判断其完全燃烧产生的CO2分子数目,C错误;D.PCl3与Cl2反应生成PCl5的反应是可逆反应,反应物不可能完全转化为生成物,则所1molPCl3与1molCl2反应生成的PCl5小于1mol,增加的P-Cl键的数目小于2N A个,D错误;答案选A。
3.(2016课标Ⅰ)设N A为阿伏加德罗常数值。
下列有关叙述正确的是A.14 g乙烯和丙烯混合气体中的氢原子数为2N AB.1 mol N2与4 mol H2反应生成的NH3分子数为2N AC.1 mol Fe溶于过量硝酸,电子转移数为2N AD.标准状况下,2.24 L CCl4含有的共价键数为0.4N A【答案】A锁定考点小题快练1.(2018届山东省济宁市高三上学期期末考试)设N A为阿伏伽德罗常数的值。
下列说法正确的是A. 标准状况下,5.6L.Cl2 与足量NaOH 反应转移的电子数为0.25N AB. 室温下,1LpH=13 的NaOH溶液中,由水电离的OH-离子数目为0.1N AC. 氢氧燃料电池正极消耗22.4L( 标准状况)气体时,电路中通过的电子数目为2N AD. 5NH4NO32HNO3 +4N2↑+9H2O 反应中,生成56gN2 时,转移的电子数目为3.75N A【答案】A【解析】Cl2 与足量NaOH 反应生成氯化钠和次氯酸钠,1mol氯气转移1mol电子,所以标准状况下,5.6LCl2 与足量NaOH反应转移的电子数为0.25N A,故A正确;室温下,pH=13的NaOH溶液中,由水电离的OH-离子的浓度是,1LpH=13 的NaOH溶液中,由水电离的OH-离子数目为N A,故B错误;氢氧燃料电池正极是氧气得电子,1mol氧气得4mol电子,所以消耗22.4L( 标准状况)气体时,电路中通过的电子数目为4N A,故C错误;根据方程式5NH4NO32HNO3 +4N2↑+9H2O,生成4molN2 转移15mol电子,所以生成56gN2 时,转移的电子数目为7.5N A,故D错误。
2.(2018届陕西省西安市“八校”高三联考)N A表示阿伏加德罗常数的值,下列说法正确的是A. 10L pH =1的硫酸溶液中含有的H+离子数为2N AB. 盛有SO2的密闭容器中含有N A个氧原子,则SO2的物质的量为0.5molC. 标准状况下.2.24LC12溶于水,转移6.02×1022个电子D. 常温常压下,4.0g氢氧化钠溶于1L水所得溶液c(NaOH)=0.10mol/L【答案】B3.(2018届江西省抚州市临川区第一中学高三上学期教学质量检测二)N A表示阿伏伽德罗常数的值。
俗名为“臭碱”的硫化钠应用于冶金、燃料,皮革,电镀等工业。
硫化钠的一种制备方法是Na2SO4+2CNa2S+2CO2↑。
下列有关说法正确的是A. 1mol/LNa2SO4溶液中含氧原于的数目一定大于4N AB. 1L0.1mol/LNa2S溶液中含阴离子的数目小于0.1N AC. 生成1mol氧化产物时转移电子数为4N AD. 通常状况下,11.2LCO2中含质子的数目为11N A【答案】C【解析】A、未注明溶液的体积,无法判断1mol/LNa2SO4溶液中含氧原子的数目,选项A错误;B、1L0.1mol/LNa2S溶液中含有0.1molNa2S,硫离子水解生成HS-和氢氧根离子,阴离子的数目大于0.1N A,选项B错误;C、根据方程式,氧化产物为二氧化碳,生成1mol氧化产物时转移电子数为4N A,选项C正确;D、通常状况下,气体摩尔体积不是22.4L/mol,故11.2LCO2物质的量不是0.5mol,所含质子的数目小于11N A,选项D错误。
答案选C。
4.(2018届山东省菏泽市第一中学高三12月月考)N A为阿伏加德罗常数的值。
下列说法正确的是A. 1L0.1mol • L-1 NaHSO4溶液中含有HSO4- 的总数为0.1N AB. CO2通过Na2O2使其增重bg 时,反应中转移的电子数为bN A/28C. 标准状况下2.24L的Cl2溶于水,充分反应后转移电子数为0.1N AD. N A个Fe(OH)3 胶体粒子的质量为107g【答案】B【解析】A. NaHSO4溶液中完全电离出三种离子Na+、SO42-、H+,不存在HSO4- , A错误;B. CO2与Na2O2反应,有氧气放出,固体增加的质量相当于增加CO质量;Na2O2固体增重bg 时,CO物质的量为b/28mol,1molNa2O2与CO2反应转移电子数为N A,所以该反应共转移电子数为bN A/28,B正确;C.氯气和水反应为可逆反应,0.1 mol氯气和水反应不能转移0.1 mol 电子,C错误;D. N A个氢氧化铁胶粒并不是N A个氢氧化铁分子,它是很多分子的集合体,N A个氢氧化铁胶粒质量远大于107 g,D错误;答案选B。
5.(2018届四川省成都市高三第一次诊断性检测)设N A为阿伏加德罗常数的值,下列叙述一定正确的是A. 2.0gH218O和D2O的混合物中含有质子数为N AB. 1.0L2.0mol/LNaOH溶液中含有氧原子数为2N AC. 3.4gH2O2参加氧化还原反应时转移电子数为0.1 N AD. 标准状况下2.24L的CCl4含有共价键数目为0.4 N A【答案】A【解析】A项,H218O与D2O的相对分子质量均为20,且一个分子所含质子数均为10个,所以2.0gH218O和D2O的混合物为0.1mol,含有0.1N A个分子,则含有质子数为N A,故A正确;B项,NaOH和水中都含有氧原子,所以1.0L2.0mol/LNaOH溶液中含有氧原子数应大于2N A,故B错误;C项,3.4gH2O2的物质的量是0.1mol,参加氧化还原反应时,-1价O可能发生自身氧化还原反应(如2H2O22H2O+O2),也可能作氧化剂全部被还原(如2Fe2++H2O2+2H+=2Fe3++2H2O),还可以作还原剂被氧化(如2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O),上述三种情况中,只有-1价O的自身氧化还原反应时,3.4g(0.1mol)H2O2反应转移电子数为0.1N A,而另外两种情况,3.4g(0.1mol)H2O2反应转移电子数为0.2N A,故C错误;D项,1molCCl4含有共价键数目为0.4N A,而标准状况下CCl4不是气体,所以标准状况下2.24LCCl4物质的量应大于1mol,含有共价键数目肯定大于0.4N A,故D错误。
6.(2018届山东省菏泽市七县一中高三上学期期中考试)用N A表示阿伏伽德罗常数的数值,下列叙述正确的是A. 78g苯中含有的碳碳双键的数目为3N AB. 16gCu2S和CuO组成的混合物中含有的阳离子数为0.2N AC. 将1mol H2与1 mol I2充入一密闭容器中充分反应后,转移的电子书为2N AD. 1 mol Fe 与足量的浓硫酸共热反应,生成SO2的分子数为N A【答案】B7.(2018届北京市昌平区高三化学12月月考)用N A表示阿伏加德罗常数的值,下列叙述正确的是A. 1 mol Na2O2固体中含有离子4N AB. 标准状况下,11.2 L CH3CH2OH中含有分子0.5 N AC. 常温常压下,3.2 g CH4中含有电子2 N AD. 0.3 mol NO2溶于水生成HNO3,转移的电子数目为0.3 N A【答案】C【解析】A、Na2O2由钠离子和过氧根离子构成,故1 mol Na2O2固体中含有离子3N A,选项A错误;B、标准状况下乙醇是液体,不能适用于气体摩尔体积,即标准状况下,11.2 L CH3CH2OH的物质的量不是0.5mol,选项B错误;B、甲烷是10电子微粒,则常温常压下,3.2 g CH4中含有电子的物质的量是×10=2mol,则电子数是2N A,选项C正确;D、根据反应3NO2+H2O=2HNO3+NO,3个NO2中有2个变为HNO3,N元素由NO2中的+4变为HNO3中的+5,失去1个电子×2;1个NO2变为NO,N由NO2中的+4变为NO中的+2,得到2个电子,1mol该反应转移2mol电子,故0.3 mol NO2溶于水生成HNO3,转移的电子数目为0.2N A,选项D错误。
答案选C。
8.(2018届成都实验中学高三年级12月月考)设N A表示阿伏加德罗常数的值。
下列说法正确的是()A. 1.5 gCH3+含有的电子数为N AB. 在l L 0.l mol/L氯化铝溶液中阳离子总数大于0.l N AC. 60g SiO2和12g金刚石中各含有4N A个si—O键和4N A个C—C键D. 标准状况下,11.2 L四氯化碳中含有的C—CI键的个数为2N A【答案】B【解析】A. 每个CH3+中有8个电子,1.5 gCH3+的物质的量为0.1mol,其中含有的电子数为0.8N A,A不正确;B. 氯化铝溶液中有部分铝离子发生水解,每个铝离子水解可以生成3个氢离子,因此,在l L 0.l mol/L氯化铝溶液中,阳离子总物质的量大于0.1mol,总数大于0.l N A,B正确;C. 二氧化硅晶体和金刚石都是原子晶体。
在二氧化化硅晶体中,每个硅原子与周围的4个氧原子形成共价键;在金刚石中,每个碳原子同样与周围4个碳原子形成共价键,所以平均每个碳原子形成2个共价键。
60g SiO2和12g金刚石的物质的量都是1mol,其中各含有4N A个Si—O键和2N A个C—C键,C不正确;D. 标准状况下,四氯化碳是液体,所以无法计算11.2 L四氯化碳的物质的量,也无法计算其中含有的C—CI键的个数,D不正确。
