第五章 地下水的化学成分及其形成
合集下载
地下水基本成因类型与化学成分形成特征

人为因素影响下,形成酸雨,使得雨水的矿化度、 成分、氧化-还原性质、侵蚀性等方面都有所变化。
2、植物-土壤影响阶段(包气带水—岩作用阶段)
雨水降落到地表,在多数情况下先与植物和土壤相遇,并 开始成为地下水(土壤水),植物和土壤对于水的成分显 示了重要的影响。
(1)植物 使水富集一些元素,雨水流经植物根部时,经常 会富集一些植 物中的生物成因元素;
位于不同景观带的土壤,对于地下水成分的影响是不同的。 例如,在森林地带,经过土壤层后,地下水富集了硅、铝、 有机酸;在草原地带,地下水溶解了大量的盐类组分。而 在碱性土分布区,可形成碱性水(PH>7),矿化度可以 较高。
氧化还原作用,溶解作用,生物因素
(4)植物-土壤影响阶段地下水的共同特征:
• 相对于原生铝硅酸盐,一般土壤水都未达到饱和状态,即 具有溶解原生铝硅酸盐的能力。
• 土壤水中含有数量可观的碳酸类化合物,这包括游离碳酸 ( CO2)、HCO3-、CO32-以及仍未被氧化的有机化合物, 后者的进一步分解将使水中碳酸化合物含量进一步提高。
这两点共同特征决定了渗入成因地下水在经过植物-土壤影 响阶段后,仍具有很强的与围岩介质发生反应的能力。
3、水-岩相互作用阶段 地下水进入含水层中,与岩石相接触,发生相互作用。 • 围岩与水之间的地球化学作用类型:溶解作用和氧化
三、沉积成因地下水化学成分的形成与特征
(以海相封存水为例)
由于海相沉积占地壳表层沉积的绝大部分,海 水成分相对较为稳定,因此已有的研究大多集 中在海相沉积-埋藏水上。近年来,注意力开始 转向陆相沉积成因水。 形成过程: 含于沉积物中的水成分(地表水体)→后生作用 (挤压、变形、变质、热液交代、风化等作用) →沉积水.
一、地下水基本成因类型
2、植物-土壤影响阶段(包气带水—岩作用阶段)
雨水降落到地表,在多数情况下先与植物和土壤相遇,并 开始成为地下水(土壤水),植物和土壤对于水的成分显 示了重要的影响。
(1)植物 使水富集一些元素,雨水流经植物根部时,经常 会富集一些植 物中的生物成因元素;
位于不同景观带的土壤,对于地下水成分的影响是不同的。 例如,在森林地带,经过土壤层后,地下水富集了硅、铝、 有机酸;在草原地带,地下水溶解了大量的盐类组分。而 在碱性土分布区,可形成碱性水(PH>7),矿化度可以 较高。
氧化还原作用,溶解作用,生物因素
(4)植物-土壤影响阶段地下水的共同特征:
• 相对于原生铝硅酸盐,一般土壤水都未达到饱和状态,即 具有溶解原生铝硅酸盐的能力。
• 土壤水中含有数量可观的碳酸类化合物,这包括游离碳酸 ( CO2)、HCO3-、CO32-以及仍未被氧化的有机化合物, 后者的进一步分解将使水中碳酸化合物含量进一步提高。
这两点共同特征决定了渗入成因地下水在经过植物-土壤影 响阶段后,仍具有很强的与围岩介质发生反应的能力。
3、水-岩相互作用阶段 地下水进入含水层中,与岩石相接触,发生相互作用。 • 围岩与水之间的地球化学作用类型:溶解作用和氧化
三、沉积成因地下水化学成分的形成与特征
(以海相封存水为例)
由于海相沉积占地壳表层沉积的绝大部分,海 水成分相对较为稳定,因此已有的研究大多集 中在海相沉积-埋藏水上。近年来,注意力开始 转向陆相沉积成因水。 形成过程: 含于沉积物中的水成分(地表水体)→后生作用 (挤压、变形、变质、热液交代、风化等作用) →沉积水.
一、地下水基本成因类型
[理学]5地下水的物理化学性质
![[理学]5地下水的物理化学性质](https://img.taocdn.com/s3/m/72805cafa0116c175f0e4878.png)
5.2地下水的化学成分
• 硫化氢(H2S)、甲烷(CH4):地下水中 出现H2S 与CH4,其意义恰好与出现O2 相反, 说明处于还原的地球化学环境。这两种气体 的生成,均在与大气比较隔绝的环境中,有 有机物存在,微生物参与的生物化学过程有 关。其中,H2S 是SO42-的还原产物。
5.2地下水的化学成分
5.1 地下水的物理性质
• 味
5.2地下水的化学成分
• 地下水中含有各种气体、离子、胶体物质、有 机质以及微生物等。 • 4.2.1 地下水中主要气体成分 • 氧(O2)、氮(N2):地下水中的氧气和氮气 主要来源于大气。它们随同大气降水及地表水 补给地下水,因此,以入渗补给为主、与大气 圈关系密切的地下水中含O2 及N2 较多。
5.2地下水的化学成分
• (3)地下水中的重碳酸根离子HCO3-来源 • ① 碳酸盐岩的溶解: Ca/MgCO3+H2O+CO2→2HCO3-+Ca2+/Mg2+; • ② 岩浆岩、变质岩地区铝硅酸盐矿物风化溶解 (钠、钙长石): • Na2Al2Si6O16+2CO2+3H2O→2HCO3-+2Na++ H4Al2Si2O9+4SiO2。
5.1 地下水的物理性质
• 颜色
5.1 地下水的物理性质
• 透明度
• 测量透明度的方法,用筒底装有放水嘴的量筒, 量筒高100cm,直径3cm,将3mm粗的黑十字 线放在量筒底部,注满水后,慢慢打开放水嘴, 筒内水面缓缓下降,同时观测黑十字线,直到 能看到黑十字线的清晰图象为止。记录量筒内 水柱高度,按表确定水的透明度。
5.2地下水的化学成分
5.2.2地下水中离子及分子成分 阳离子:H+、Na+、K+、NH4+、Ca2+、Mg2+、 Fe3+、Fe2+ 阴离子:OH-、Cl-、SO42-、NO2-、NO3-、HCO3-、 CO32-、PO13主要的有6种离子: Cl-、 SO42-、 HCO3-、 Na+ (K+)、 Ca2+、Mg2+
第五章 地下水的化学成分及其形成

第1节 地下水的化学成分
• 特点 • 水迁移能力很强,但次于Cl-; • 含量由数mg/L~数十g/L。 重碳酸根离子(HCO3-) • 来源 • 来自含碳酸盐的沉积岩与变质岩(如大理岩) CaCO3+ H2O+CO2→2HCO3-+Ca2+ MgCO3+ H2O+CO2→2HCO3-+Mg2+ • 岩浆岩与变质岩地区,主要来自铝硅酸盐矿物 的风化溶解
第1节 地下水的化学成分
细菌成分:如氧化环境中存在的硫细菌、铁细菌; 还原环境中存在的脱硫细菌; 污水中的各种致病细菌等 • 分病源菌和非病源菌 • 细菌分析结果的表示: • 细菌总数:每毫升水或每升水中的细菌总数 • 菌度:含有一条大肠杆菌的水的毫升数 • 检定量:1升水中大肠杆菌的总数
第2节 地下水的主要物理化学性质
第1节 地下水的化学成分
• O2与N2共存---来源于大气并处于氧化环境 • N2单独存在---来源于大气并处于还原环境 • 大气中惰性气体(Ar, Kr, Xe)与N2的比值: (Ar, Kr, Xe)/ N2 = 0.0118 , 则N2是大气起源 (Ar, Kr, Xe)/ N2 < 0.0118,则N2是生物或变 质起源
第1节 地下水的化学成分
微量组分:Br、I、F、B、Sr等 胶体成分:未离解的化合物,颗粒直径10-7~10-5 主要的有:Fe(OH)3、Al(OH)3 及 HsiO3等 还有:CaCO3、MgCO3 各种硫化物:PbS,CuS,CdS等 有机质胶体 粘土质胶体 胶体的形成: 物理风化使矿物机械破碎磨细形成; 急剧化学反应使溶液过饱和并形成许多结晶中心, 但未来得及结晶而形成。
第3节 地下水化学成分的形成作用
工学水文地质学地下水的化学成分及其形成作用

2HNO3→2HNO2→2HNO→N2
chd-qw
16
④如何判断非大气来源的氮
用氩、氪、氙与氮的比值确定
大气中它们的比值恒定(Ar+Kr+Xe)/N2=0.0118
=0.0118 大气来源
<0.0118 N2多,有非大气来源 >0.0118 一般Ar(氩)多
如果地下水中上述比值正好等于0.0118,说明氮 无其它来源,仅大气起源。
chd-qw
4
目前研成是地质历史时期的 产物,所以要从地质历史的角度去研究;
2.水中的化学组分的存在是与地下水的起源 紧密联系在一起的,不同起源,组分不同;
3.组分在地下水中达到饱和的状态,要注意 地下水的运动过程,运动使地下水不断更 新,达到平衡而未达到饱和;
腐植质 → 暗黄色 → 鱼腥味
H2CO3 → 甜味 有机质 → 甜味(不适于饮用)
NaCl → 咸味
Na2SO4 → 涩味
MgCl2或MgSO4 → 苦味
H2S+碳酸气 → 酸味
chd-qw
10
5.2.2 地下水的其它物理性质
1.比重 2.颜色 3.透明度 4.放射性
chd-qw
11
§ 5.3 地下水的化学成分
4.要注意后期的变化--吸附、混合,使其 再一次发生变化。
chd-qw
5
§5.2 地下水的物理、化学性 质(physical characteristic)
地下水的物理性质包括: 水 温 temperature、 颜 色 color、 透 明 度 transparence 、 味 道 taste、 气 味 odor、比重、放射性、导电性electric conductivity等。
chd-qw
16
④如何判断非大气来源的氮
用氩、氪、氙与氮的比值确定
大气中它们的比值恒定(Ar+Kr+Xe)/N2=0.0118
=0.0118 大气来源
<0.0118 N2多,有非大气来源 >0.0118 一般Ar(氩)多
如果地下水中上述比值正好等于0.0118,说明氮 无其它来源,仅大气起源。
chd-qw
4
目前研成是地质历史时期的 产物,所以要从地质历史的角度去研究;
2.水中的化学组分的存在是与地下水的起源 紧密联系在一起的,不同起源,组分不同;
3.组分在地下水中达到饱和的状态,要注意 地下水的运动过程,运动使地下水不断更 新,达到平衡而未达到饱和;
腐植质 → 暗黄色 → 鱼腥味
H2CO3 → 甜味 有机质 → 甜味(不适于饮用)
NaCl → 咸味
Na2SO4 → 涩味
MgCl2或MgSO4 → 苦味
H2S+碳酸气 → 酸味
chd-qw
10
5.2.2 地下水的其它物理性质
1.比重 2.颜色 3.透明度 4.放射性
chd-qw
11
§ 5.3 地下水的化学成分
4.要注意后期的变化--吸附、混合,使其 再一次发生变化。
chd-qw
5
§5.2 地下水的物理、化学性 质(physical characteristic)
地下水的物理性质包括: 水 温 temperature、 颜 色 color、 透 明 度 transparence 、 味 道 taste、 气 味 odor、比重、放射性、导电性electric conductivity等。
河北工程大学 土木工程学院 工程地质 第五章_地下水

●在具有成岩裂隙的岩体为后期地层覆盖 时可构成承压含水层。
25
6. 构造裂隙水
●其发育程度既取决于岩石本身的性质,也取决于 边界条件及构造应力分布等因素。 ●分为层状构造裂隙水和脉状构造裂隙水。 ●可以是潜水,也可以是承压水 ●裂隙各有自己独立的系统:补给源、径流及排 泄条件,水位不一致。 ●渗透性常常显示各向异性。 26
5
3.
重力水-----受重力控制的地下水
当岩石、土层的空隙完全被水饱和时,粘 土颗粒之间除结合水以外的水都是重力水,它 不受静电引力的影响,而在重力作用下运动, 可传递静水压力。
重力水的工程意义:
静水压力 动水压力 浮托力 溶解能力--岩土产生化学潜蚀
6
☆ 含水层:能够给出并透过相当数量 重力水的岩层或土层,称为含水层。 ☆ 隔水层:是指那些不能给出并透过 水的岩层、土层,或者这些岩土层给出与透 过水的数量是微不足道的。 ☆构成含水层的条件: 1.岩土中要有空隙存在,并充满足够数 量的重力水; 2.这些重力水能够在岩土空隙中自由运 动。
36
▲矿化度:地下水中所含各种离子、分子 与化合物的总量称为矿化度,以g/L表示。 习惯上用105~110℃温度将地下水样品蒸 干后所得的干涸残余物总量来表示矿化度。 可以将分析所得阴阳离子含量相加,求得 理论干涸残余物总量。
注意: 由于在蒸干时有将近一半的HCO3-了分解生 成CO,及H2O而逸失。所以,阴阳离子相加时, HCO3 只取重量的50%。
31
32
自流水泉(上升泉):主要靠承压水补给, 动态稳定,年变化不大,主要分布在自流盆地 及自流斜地的排泄区和构造断裂带上。
33
§5.3 地下水的性质
一、地下水的物理性质 地下水的物理性质有:温度、颜色、透明 度、气味、味道、导电性及放射性。 地下水物理性质的研究,使我们能初步了 解地下水的形成环境、污染情况及化学成分, 这为利用地下水提供了依据。
25
6. 构造裂隙水
●其发育程度既取决于岩石本身的性质,也取决于 边界条件及构造应力分布等因素。 ●分为层状构造裂隙水和脉状构造裂隙水。 ●可以是潜水,也可以是承压水 ●裂隙各有自己独立的系统:补给源、径流及排 泄条件,水位不一致。 ●渗透性常常显示各向异性。 26
5
3.
重力水-----受重力控制的地下水
当岩石、土层的空隙完全被水饱和时,粘 土颗粒之间除结合水以外的水都是重力水,它 不受静电引力的影响,而在重力作用下运动, 可传递静水压力。
重力水的工程意义:
静水压力 动水压力 浮托力 溶解能力--岩土产生化学潜蚀
6
☆ 含水层:能够给出并透过相当数量 重力水的岩层或土层,称为含水层。 ☆ 隔水层:是指那些不能给出并透过 水的岩层、土层,或者这些岩土层给出与透 过水的数量是微不足道的。 ☆构成含水层的条件: 1.岩土中要有空隙存在,并充满足够数 量的重力水; 2.这些重力水能够在岩土空隙中自由运 动。
36
▲矿化度:地下水中所含各种离子、分子 与化合物的总量称为矿化度,以g/L表示。 习惯上用105~110℃温度将地下水样品蒸 干后所得的干涸残余物总量来表示矿化度。 可以将分析所得阴阳离子含量相加,求得 理论干涸残余物总量。
注意: 由于在蒸干时有将近一半的HCO3-了分解生 成CO,及H2O而逸失。所以,阴阳离子相加时, HCO3 只取重量的50%。
31
32
自流水泉(上升泉):主要靠承压水补给, 动态稳定,年变化不大,主要分布在自流盆地 及自流斜地的排泄区和构造断裂带上。
33
§5.3 地下水的性质
一、地下水的物理性质 地下水的物理性质有:温度、颜色、透明 度、气味、味道、导电性及放射性。 地下水物理性质的研究,使我们能初步了 解地下水的形成环境、污染情况及化学成分, 这为利用地下水提供了依据。
工程地质学第五章-地下水

• • •
• Darcy定律适合于层流(砂土)。
5.2 地下水类型及其主要特性
地下水按埋藏条件可分为三大类:即包气带
水、潜水、承压水;
根据含水层的空隙性质地下水可分为孔隙水、 裂隙水、岩溶水。 通过这两种分类的组合,可得九类不同特点 的地下水。见教材p124。
裂隙水
孔隙水
含水层
承压水井 自流水井 潜水井 承压水位 潜 水 位
6、 地下水的循环:补给、排泄
上层滞水循环:大气降水补给,垂直蒸发、下渗排泄。 潜水补给: 大气降水,地表水的补给,含水层之间的补给①越流 补给②直接补给,凝结水,人工补给。 潜水排泄:蒸发,泉的排泄,地表水排泄,人为排泄。 承压水补给:大气降水,地表水,潜水。 承压水排泄:潜水排泄,泉的排泄,地表水排泄。
承压水面上高程相等点的连线图
用途:流向,水力坡度,初见水位,水位埋深,水头
5.3 地下水的性质
一、地下水的物理性质
1、温度:主要受气候条件和地热控制
由于地下水形成的环境不同,其温度变化范围很大; 常随埋藏深度不同而异,埋藏越深、水温越高。 纯净的地下水是无色的,当含有某些化学成分或悬浮物质时, 2、颜色: 会带有一定颜色。 纯净的地下水是透明的,但含有有机质、矿物质及胶体时, 3、透明度: 地下水将变得浑浊不清。 地下水一般是无嗅无味的,当含有气体或有机质时,会具有特殊 4、气味:
特点:空间分布极不均匀,动态变化强 烈,流动迅速,排泄集中。
在土木工程建筑地基内有岩溶水活 动,不但在施工中会有突然涌水的事故 发生,而且对建筑物的稳定性也有很大 影响。因此,在建筑场地和地基选择时 应进行工程地质勘察,针对岩溶水的情 况,用排除、截源、改道等方法处理, 如挖排水、截水沟,筑挡水坝,开凿输 水隧洞改道等等。
地下水的物理性质化学成分及其形成作用
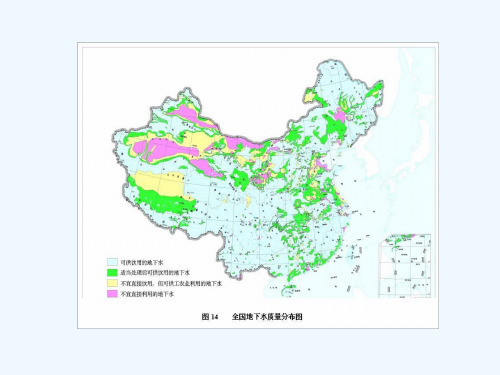
❖ 4、氧的水文地球化学作用 (1)O2决定地下水的氧化还原状态,溶解氧含量
愈多,说明地下水所处的地球化学环境(氧化环境)愈 有利于氧化作用进行。从而影响水中元素的迁移。
如在含氧多的地下水中,Fe形成高价化合物而从水中 沉淀;反之,地下水中含O2少,形成低价态化合物而 易于在水中迁移。
(2)对金属材料具有侵蚀作用。如自来水管的锈蚀。 (3)影响水生动植物的生存。
自然地理与地质发展历史给予地下水的化学面貌以深刻影响。
§2 地下水的物理性质
地下水的物理性质包括水温、颜色、透明度、味道、气味、比 重、放射性、导电性。它在一定程度上反映了地下水的化学成分及其 存在的环境条件。
一、地下水的温度
水温变化范围可达100℃以上。在寒带和多年积雪地带,浅层的地下水 温可低达-5℃以下;在温带和亚热带的平原、丘陵区浅层地下水的年平均温 度一般接近于当地年平均气温;在火山活动地区及地壳深处,地下水的温度很 高 , 可 超 过 100℃ 。 如 我 国 广 东 丰 良 地 区 在 地 下 800m 深 处 , 打 出 了 103.5℃的热水。
①变温带特征:
❖ 处于受太阳辐射影响的地表极薄的带。 ❖ 由于太阳辐射能的周期变化,本带呈现地温的
昼夜变化和季节变化。 ❖ 地温昼夜变化影响地表以下1-2m深。年变化
影响深度一般为15-30m。
②常温、增温带的特征:
❖ 处于变温带以下一个厚度极小的地带。地温的年变化幅度<0.1℃的 地带。
❖ 地温一般比当地年平均气温高出1一2℃,可将当地的多年平均气温 作为常温带地温。
地下水的温度主要受当地气温、地温变化的影响,尤其是地温 。
要研究地下水的温度,首先要研究地温的变化规律。
地壳表层有两个热能来源:
地下水化学成分的形成作用

地下水化学成分的形成作用地下水是指在土壤和岩石间的孔隙中流动的水,其成分受到地质结构、气候、植被、土壤类型等多种因素的影响。
地下水化学成分的形成与这些因素密切相关,下面我们来分析一下它们的作用。
首先,地质结构是地下水化学成分形成的重要因素之一。
不同岩石和土壤中,含有的矿物质种类和含量不同,这些矿物质的溶解度、离子交换能力、化学反应速率等都会影响地下水的化学成分。
例如,含有大量硬度物质的石灰岩地区,地下水中的钙和镁离子浓度较高;而含有大量盐类的沙漠地区,地下水中的钠和氯离子浓度较高。
其次,气候也是影响地下水化学成分的重要因素之一。
气候的干湿、寒暖和降水量等都会影响地下水循环和水文化学过程。
例如,在干燥的气候条件下,地下水很容易蒸发,导致水中溶解的盐类浓度增加;而在多雨的气候条件下,地下水循环强,能更快地从地表流入地下水,从而形成的地下水高度不同,然后散布着不同的化学成分。
第三,植被的类型和密度也会影响地下水的化学成分。
根据植被的不同类型,将直接或间接地吸收更多或更少的水分,降低或增加水中化学成分的浓度。
例如,草原植被可增加碳酸盐的含量,从而影响地下水的PH值;而森林植被能够起到过滤作用,防止有害物质进入到地下水中。
最后,土壤类型也对地下水化学成分的形成起到了重要影响。
土壤的特性决定其在水文学上的特殊能力,从而影响地下水化学成分的多样性。
在不同的土壤中,溶质交换作用不同,而水的化学成分主要是由此生成的。
例如,酸性土壤中的铝和铁离子容易流入地下水中,增加水的a值,改变水的化学组分。
综上所述,地下水化学成分是由地质结构、气候、植被和土壤类型等多种因素共同影响下所形成的。
对此,我们应该注意环境保护,促进人与自然和谐共生,才能维护良好的地下水质量和可持续发展。
水文地质学基础:地下水化学成分的形成作用

二、 浓缩作用
• 定义:当水分蒸发时,盐分仍保留在余下的地下水中,则 其矿化度相对增大,这种作用称为浓缩作用。
• 结果:高矿化度、以易溶离子为主的地下水(Cl-—Na+为主) • 发生条件:
– 干旱或半干旱的气候,地势低平且地下水位埋藏较浅的排泄区,有利 于毛细作用的颗粒细小的松散土层。
– 浓缩作用十分强烈的地区,可以形成矿化度大于300 g/L的地下咸水。
①阳离子被岩土吸附的能力不同:
➢ 阳离子被吸附能力强弱:
H+>Fe3+>Al3+>Ca2+>Mg2+>K+>Na+ (H+是个例外) ➢ 如:
CaSO4 (MgSO4 ) 2Na Na2SO4 Ca2 (Mg 2 )
水
土
水
土
四 、阳离子交替吸附作用-影响因素
② 与地下水中离子浓度有关,某种离子的相对浓度增大, 则该种离子的交替吸附能也随之增大。
– 不产生明显的化学反应
– 高矿化的氯化钠型海水混入低矿化的重碳酸钙镁型地下水,不 产定义:岩土颗粒的表面常带有负电荷, 能够吸附某些阳离子,而将其原来吸 附的阳离子转为地下水中的组分,这 就是为阳离子交替吸附作用。
结果:某种阳离子减少,另一种阳离 子增多
四 、阳离子交替吸附作用-影响因素
地下水化学成分的形成作用
1 溶滤作用 2 浓缩作用
目录
3 脱碳酸作用 4 脱硫酸作用
CONTENTS
5 阳离子交替吸附作用
6 混合作用 7 人类活动的影响
地下水化学成分的形成作用
定义:使地下水化学成分发生变化的各种 作用,称为地下水化学成分的形成作用。
水文地质学 地下水的化学成分及其形成作用

未蒸发浓缩前,地下水为低矿化水,随着蒸发浓缩,溶解 度小的钙、镁的重碳酸盐部分析出,S042-及Na+逐渐成为主 要成分。继续浓缩,水中硫酸盐达到饱和并开始析出,便将 形成以C1-、Na+为主的高矿化水。 (3)产生浓缩作用的条件 1)干旱或半干旱的气候; 2)较浅的地下水位埋深; 3)空间上位于地下水流动系统的势汇—排泄处。
二氧化碳(CO2):地下水中的CO2主要来源于土壤。有机质 残骸的发酵作用与植物的呼吸作用使土壤中源源不断产 生CO2,并溶入流经土壤的地下水中。 含碳酸盐类的岩石,在深却高温下,也可以变质生成 C02: CaCO3 = CaO+CO2 (9—1) 工业与生活应用化石燃料 ( 煤、石池、天然气 ) ,使大气 中人为产生的C02明显增加。 地下水中含CO2 愈多,其溶解碳酸盐岩与对结晶岩进行风 化作用的能力便愈强。
9.4.3脱碳酸作用
在还原环境中,当有有机质存在时,脱硫酸细菌能使S042还原为H2S: S042-+2C+2H2O—H2S+2HCO3 结果使地下水中 S042- 减少以至消失, 2HCO3- 增加, pH 值变大。 封闭的地质构造,如储油构造,是产生脱硫酸作用的有 利环境。因此,某些油由水中出现H2S,而S042-含量很低。 这一特征可以作为寻找油田的辅助标志。
9.4.5 阳离子交替吸附作用
(1) 阳离子交替吸附作用 岩土颗粒表面带有负电荷,能够吸附阳离子。一定条件下,颗 粒将吸附地下水中某些阳离子,而将其原来吸附的部分阳离子转 为地下水中的组分,这便是阳离子交替吸附作用。 不同的阳离子,其吸附自大而小顺序为: H+>Fe3+>Al3+>Cl>Mg2+>K+>Na+ 。离子价愈高,离子半径愈大,水化离子半径愈 小,则吸附能力愈大。H+则是例外。 当含Ca2+为主的地下水,进入主要吸附有Na+的岩土时,水中 的Ca2+便臵换岩土所吸附的一部分Na+,使地下水中Na+增多而Ca2+ 减小。
《水文地质基础》第五章 地下水的化学成分及其形成

地下水按TDS的分类 德国度(H0):一个德国度相当于1升水中含有
10mgCaO或7.2mgMgO。 1meq = 2.8 H0
第2节 地下水的主要物理化学性质
类别
TDS(g/L)
类别
TDS(g/L)
ห้องสมุดไป่ตู้
淡水
微咸水 (低矿化水)
<1 1 ~3
半咸水 (中矿化水)
咸水 (高矿化水)
3 ~ 10 >10
第1节 地下水的化学成分
Na2Al2Si6O16+2CO2+3H2O → 2HCO3-+2Na++ H4Al2Si2O9+4SiO2
• 特点 含量一般不超过1g/L,在低矿化水中为主要阴离子。 钠离子(Na+) • 含量:在低矿化水中的含量一般很低,仅数毫克/
升到数十毫克/升,但在高矿化水中则是主要的阳 离子,其含量最高可达数十克/升。 • 来源:
第1节 地下水的化学成分
微量组分:Br、I、F、B、Sr等 胶体成分:未离解的化合物,颗粒直径10-7~10-5
主要的有:Fe(OH)3、Al(OH)3 及 HsiO3等 还有:CaCO3、MgCO3
各种硫化物:PbS,CuS,CdS等 有机质胶体 粘土质胶体 胶体的形成: 物理风化使矿物机械破碎磨细形成; 急剧化学反应使溶液过饱和并形成许多结晶中心, 但未来得及结晶而形成。
化肥农药,使天然地下水富集了原来含量很低的有 害元素,如酚、汞、砷、铬、亚硝酸等。
第4节 地下水化学成分的基本 成因类型
地球上的水圈是原始地壳生成的。地下水起源于地球深 部层圈。但从形成地下水化学成分的基本成分出发,可 将地下水分为三个成因类型:
溶滤水
10mgCaO或7.2mgMgO。 1meq = 2.8 H0
第2节 地下水的主要物理化学性质
类别
TDS(g/L)
类别
TDS(g/L)
ห้องสมุดไป่ตู้
淡水
微咸水 (低矿化水)
<1 1 ~3
半咸水 (中矿化水)
咸水 (高矿化水)
3 ~ 10 >10
第1节 地下水的化学成分
Na2Al2Si6O16+2CO2+3H2O → 2HCO3-+2Na++ H4Al2Si2O9+4SiO2
• 特点 含量一般不超过1g/L,在低矿化水中为主要阴离子。 钠离子(Na+) • 含量:在低矿化水中的含量一般很低,仅数毫克/
升到数十毫克/升,但在高矿化水中则是主要的阳 离子,其含量最高可达数十克/升。 • 来源:
第1节 地下水的化学成分
微量组分:Br、I、F、B、Sr等 胶体成分:未离解的化合物,颗粒直径10-7~10-5
主要的有:Fe(OH)3、Al(OH)3 及 HsiO3等 还有:CaCO3、MgCO3
各种硫化物:PbS,CuS,CdS等 有机质胶体 粘土质胶体 胶体的形成: 物理风化使矿物机械破碎磨细形成; 急剧化学反应使溶液过饱和并形成许多结晶中心, 但未来得及结晶而形成。
化肥农药,使天然地下水富集了原来含量很低的有 害元素,如酚、汞、砷、铬、亚硝酸等。
第4节 地下水化学成分的基本 成因类型
地球上的水圈是原始地壳生成的。地下水起源于地球深 部层圈。但从形成地下水化学成分的基本成分出发,可 将地下水分为三个成因类型:
溶滤水
水文地质学基础 地下水的化学成分及其形成作用

特点
溶解度大,随矿化度增大,含量增大 在水中最为稳定:不为植物和细菌摄取,不被土壤颗粒表面吸附,水
中迁移能力强
硫酸根SO42-
SO42- 的来源
(黄铁矿)
沉积岩盐类、石膏的溶解
金属硫化物的氧化(煤系地层)
火山喷发
人类活动 产生SO2
“酸雨”
SO42- 的特点 • 水中迁移能力很强,但次于Cl-
大气降水线:GMWL与LMWL
水文地质过程的识别
87Sr/86Sr识别混合关系
放射性同位素:时钟
在确定地下水年龄上,常采用放射性同位素方法,据放射性 同位素衰变原理,利用同位素衰变方程确定地下水年龄:
式中:
C0 为补给时放射性同位素浓度(也称输入函数) C为计算时放射性同位素浓度
t 1 ln C
特点:含量通常较Na+低;高TDS水中含量较多 为植物摄取 参与形成不溶于水的次生矿物(水云母、蒙脱石、绢云母等)
来源
Na+
沉积岩中岩盐的溶解(钠盐) 岩浆岩和变质岩的风化溶解 海水
酸性岩浆岩区常形成Na-HCO3型水 水中阳离子以Na+为主时,HCO3-浓度可超过与Ca2+伴生时的上限
何为同位素
Co
不同定年方法适用的时间尺度
放射性同位素也可用于示踪
其它组分
次要离子:包括H+、Fe2+、Fe3+、Mn2+、NH4+、OH-、 NO2-、NO-、CO32-、SiO32-、PO43-等 微量组分:Br、I、F、B、Sr等 胶体:Fe(OH)3、Al(OH)3、H2SiO3 有机质:可增加地下水的酸度,有利于还原 微生物:① 氧化环境:硫细菌、铁细菌等;②还原环境: 脱硫酸细菌等;③ 污染水:致病细菌
溶解度大,随矿化度增大,含量增大 在水中最为稳定:不为植物和细菌摄取,不被土壤颗粒表面吸附,水
中迁移能力强
硫酸根SO42-
SO42- 的来源
(黄铁矿)
沉积岩盐类、石膏的溶解
金属硫化物的氧化(煤系地层)
火山喷发
人类活动 产生SO2
“酸雨”
SO42- 的特点 • 水中迁移能力很强,但次于Cl-
大气降水线:GMWL与LMWL
水文地质过程的识别
87Sr/86Sr识别混合关系
放射性同位素:时钟
在确定地下水年龄上,常采用放射性同位素方法,据放射性 同位素衰变原理,利用同位素衰变方程确定地下水年龄:
式中:
C0 为补给时放射性同位素浓度(也称输入函数) C为计算时放射性同位素浓度
t 1 ln C
特点:含量通常较Na+低;高TDS水中含量较多 为植物摄取 参与形成不溶于水的次生矿物(水云母、蒙脱石、绢云母等)
来源
Na+
沉积岩中岩盐的溶解(钠盐) 岩浆岩和变质岩的风化溶解 海水
酸性岩浆岩区常形成Na-HCO3型水 水中阳离子以Na+为主时,HCO3-浓度可超过与Ca2+伴生时的上限
何为同位素
Co
不同定年方法适用的时间尺度
放射性同位素也可用于示踪
其它组分
次要离子:包括H+、Fe2+、Fe3+、Mn2+、NH4+、OH-、 NO2-、NO-、CO32-、SiO32-、PO43-等 微量组分:Br、I、F、B、Sr等 胶体:Fe(OH)3、Al(OH)3、H2SiO3 有机质:可增加地下水的酸度,有利于还原 微生物:① 氧化环境:硫细菌、铁细菌等;②还原环境: 脱硫酸细菌等;③ 污染水:致病细菌
第五章 地下水

(二)地下水的酸碱性 酸碱度:氢离子浓度PH值。1PH=1g[H+] 强酸性水PH<5;弱酸性水PH=5-7;中性水 PH=7;弱碱性水PH=7-9;强碱性水PH >9。 酸性侵蚀可以分解水泥混凝土中的CaCO3。
Байду номын сангаас
(三)总矿化度 水中离子、分子和各种化合物的总量称为总 矿化度,以g/L表示。 水按矿化度分:淡水(<1);微咸水(1-3); 咸水(3-10);盐水(10-50);卤水 (>50)。 高矿化度的水能降低水泥混凝土的强度,腐 蚀钢筋,促使混凝土表面风化。
第四节 地下水对公路建设的影响
1、地下水的存在,对建筑工程有着不可忽 视的影响。尤其是地下水位的变化,水的 侵蚀性和流砂、潜蚀等不良地质作用都将 对建筑工程的稳定性、施工及正常使用带 来很大的影响。
1.地基沉降:地下水位的变化,如水位上升,可 引起浅基础地基承载力降低,地震时会加剧砂土 液化,引起建筑物震害加剧,岩土体产生变形、 滑坡、崩塌失稳等不良地质作用。 2.侵蚀性:对混凝土、可溶性石材、管道以及金 属材料的侵蚀危害。潜蚀通常分为机械潜蚀和化 学侵蚀。 3.流沙和潜蚀(管涌):地下水可引起流砂现象, 给施工带来极大困难。 4.地下水的浮托作用: 5.基坑涌水现象:
第五章 水的地质作用
自然界中,水有气态、固态、液态三种。
1、大气水:存在于大气中;
2、地表水:覆盖在地球表面,如海洋、
江河、湖泊等; 3、地下水:埋藏于土中孔隙、岩石孔隙 和裂隙、岩石空洞中。
一、地下水及地下水问题 埋藏在地表以下的土层及岩石的空隙中的水称 为地下水。 地下水是自然界水资源的重要组成部分,它常 为生活和生产的水源,干旱和半干旱地区更是 主要的甚至是唯一的可靠水源。 地下水与岩土相互作用,会使岩体及土体的强 度和稳定性降低,产生各种不良地质现象和工 程地质现象,如滑坡、岩溶、潜蚀、地基沉陷 与冻胀等,对工程造成危害。
地下水的化学成分及其形成作用

换化学成份; 3、人类活动影响地下水化学成份。
总之,地下水的化学成份是地下水与环境以及 人类活动长期相互作用的产物。
第二节 地下水的化学特征
一、地下水中的主要气体成份
常见 O2 , N2 , CO2 , CH 4 , H2S 等,尤以前三种为 主。气体成份一方面能说明地下水所处的地球化 学环境;另一方面,有些气体能够增强水溶解盐 类的能力,促进某些化学反应。
有微生物参与了生物化学反应, (三)CO₂ 主要来源于土壤。 1、有机残骸发酵作用与植物呼吸作用使土壤
中不断产生CO₂溶入径流土壤的地下水中; 2、含碳酸盐类的岩石,在深部高温下,也可
变质生成CO₂:
CaCO3 400℃ CaO CO2
地下水中CO₂愈多,其溶解碳酸盐的能力越强。
其化学成分受岩性、气候、地形等因素的影响。 绝大部分地下水属于溶滤水。 二、沉积水 指与沉积物大体同时生成的古地下水。 河、湖、海相沉积物中的水具有不同的原始成份,
在漫长的地质年代中水质又经历了一系列复杂变化, 通常是一些高矿化的咸水。
三、内生水
20世纪初,曾把岩浆看作温泉分异的产物, 后来发现,在大多数情况下,温泉是大气降水 渗入到深部加热后重新升到地表形成的。近年 来,某些学者通过对地热系统的热均衡分析得 出,仅靠水渗入深部获得的热量无法解释某些 高温水的出现,认为应有10%—30%的水来自 地球深部圈层的高热流体的加入,这样,源自 地球深部圈层的内生水又逐渐为人们所重视。 但内生水的研究,至今尚不成熟。
(2)含钠矿物的风化溶解;
5、K⁺
来源:(1)含钾盐类沉积岩的溶解;
(2)变质岩、岩浆岩盐中含钾矿物的风化溶解。
6、Ca⁺²
总之,地下水的化学成份是地下水与环境以及 人类活动长期相互作用的产物。
第二节 地下水的化学特征
一、地下水中的主要气体成份
常见 O2 , N2 , CO2 , CH 4 , H2S 等,尤以前三种为 主。气体成份一方面能说明地下水所处的地球化 学环境;另一方面,有些气体能够增强水溶解盐 类的能力,促进某些化学反应。
有微生物参与了生物化学反应, (三)CO₂ 主要来源于土壤。 1、有机残骸发酵作用与植物呼吸作用使土壤
中不断产生CO₂溶入径流土壤的地下水中; 2、含碳酸盐类的岩石,在深部高温下,也可
变质生成CO₂:
CaCO3 400℃ CaO CO2
地下水中CO₂愈多,其溶解碳酸盐的能力越强。
其化学成分受岩性、气候、地形等因素的影响。 绝大部分地下水属于溶滤水。 二、沉积水 指与沉积物大体同时生成的古地下水。 河、湖、海相沉积物中的水具有不同的原始成份,
在漫长的地质年代中水质又经历了一系列复杂变化, 通常是一些高矿化的咸水。
三、内生水
20世纪初,曾把岩浆看作温泉分异的产物, 后来发现,在大多数情况下,温泉是大气降水 渗入到深部加热后重新升到地表形成的。近年 来,某些学者通过对地热系统的热均衡分析得 出,仅靠水渗入深部获得的热量无法解释某些 高温水的出现,认为应有10%—30%的水来自 地球深部圈层的高热流体的加入,这样,源自 地球深部圈层的内生水又逐渐为人们所重视。 但内生水的研究,至今尚不成熟。
(2)含钠矿物的风化溶解;
5、K⁺
来源:(1)含钾盐类沉积岩的溶解;
(2)变质岩、岩浆岩盐中含钾矿物的风化溶解。
6、Ca⁺²
第五章 地下水基本成因类型与化学成分形成特征

内生水
岩浆成因的:直接从岩浆分逸出来、首次进入地壳浅部的水
(岩浆水,初生水) 变质成因的:变质作用过程中产生的水(高温下,岩石矿物 中的水由结合状态转为游离状态)(变质水,再生水)
5Mg, Fe3 Si2 O5 OH 4 6CaCO3 14SiO2 3CaMg, Fe5 Si8 O22 OH 2 6CO2 7 H 2 O
(2)CO2分压(TDS低、酸度大)
4、蒸发浓缩阶段
蒸发作用对地下水化学成分影响最明显的地区为 大陆盐渍化发育地区。在蒸发浓缩过程中,盐类 有次序地在地下水中析出。相应地,矿化度增大, 水的化学成分也发生变化。
西北各内陆盆地(塔里木、准噶尔、河西走廊、
柴达木等),都广泛发育大陆盐渍化作用,在地 表形成盐渍土,极大地影响了农业生产,也给铁 路的修建和运营带来了许多问题。
1、大气降水阶段 大气降水的化学成分具有区域特征,盐类组分含量低; (HCO3-, Ca2+;Cl-, Na+)
除了盐类组分外,大气降水含有可溶性气体;
( O2:使水具有氧化作用的能力; CO2:溶于降水形成碳酸,降低了雨水的pH,提高了侵蚀 性)
大气降水较低的盐类组分含量、弱酸性—中性和含 有可溶性气体,造成大气降水相对于化合物(矿 物)远未饱和,具有侵蚀性。因此具有溶解矿物、 使各种元素在水中积聚的能力。 人为因素影响下,形成酸雨,使得雨水的矿化度、 成分、氧化-还原性质、侵蚀性等方面都有所变化。
海水成分特征:
(1)弱碱性; rNa rCl 0.85
(2)海水中溶解的无机物质按其含量顺顺序为Cl-、 Na+、 SO42- 、Ca2+ 、Mg2+ 、 K+ 、HCO3-、 Br- 、 CO32- 等;海水中主要离子含量的固定次序是Na+ + K+ > Mg2+ > Ca2+, Cl- > SO42- > HCO3- + CO32-, 与一般河水的成分恰好相反。
地下水的化学成分形成作用
水文地质学
第八讲
地下水的化学成分及其形成作用(2)
OUTLINE
• • • • 地下水化学成分的形成作用 地下水化学成分的基本成因类型 地下水化学成分的分析内容 地下水化学成分的分类与图示
2019/1/9
2
地下水化学成分的形成作用
• 地下水的主要补给来源是大气降水和地表水。在补给 地下水之前,无论大气降水,还是地表水本身都含有 一定量的化学成分,如被风吹入大气的海水,混入大 气降水的尘埃等。
– 结果:使地下水中的硫酸根离子减少甚至消失,重碳酸离子增 加,pH值增大。
2019/1/9
11
地下水化学成分的形成作用
• 阳离子交替吸附作用:存在比较普遍的形成作用
– 概念:岩土颗粒表面带有负电荷,能够吸附阳离子。一定条 件下颗粒吸附地下水中的某些阳离子,而将其原来吸附的阳 离子转化为地下水的组分,这就是阳离子交替吸附作用。 – 机制:不同的阳离子吸附于岩土表面的能力不同,按吸附能 力排序如下:
Mg 2 2HCO3 CO2 H2O MgCO3
结果:地下水中的重碳酸根离子、钙离子/镁离子减少,矿化 度降低。
2019/1/9
10
地下水化学成分的形成作用
• 脱硫酸作用
– 概念:在还原环境中且有机质存在时,脱硫酸菌使硫酸根离子 还原为H2S,这便是脱硫酸做用。
脱硫酸菌
2 – 机制: SO4 2C 2H 2O H2 S 2HCO3
2019/1/9
9
地下水化学成分的形成作用
• 脱碳酸作用
– 概念:CO2在水中的溶解度随着温度升高或者压力的降低而减 少,一部分CO2便成为游离CO2从水中逸出,这就是脱碳酸做 用。
第八讲
地下水的化学成分及其形成作用(2)
OUTLINE
• • • • 地下水化学成分的形成作用 地下水化学成分的基本成因类型 地下水化学成分的分析内容 地下水化学成分的分类与图示
2019/1/9
2
地下水化学成分的形成作用
• 地下水的主要补给来源是大气降水和地表水。在补给 地下水之前,无论大气降水,还是地表水本身都含有 一定量的化学成分,如被风吹入大气的海水,混入大 气降水的尘埃等。
– 结果:使地下水中的硫酸根离子减少甚至消失,重碳酸离子增 加,pH值增大。
2019/1/9
11
地下水化学成分的形成作用
• 阳离子交替吸附作用:存在比较普遍的形成作用
– 概念:岩土颗粒表面带有负电荷,能够吸附阳离子。一定条 件下颗粒吸附地下水中的某些阳离子,而将其原来吸附的阳 离子转化为地下水的组分,这就是阳离子交替吸附作用。 – 机制:不同的阳离子吸附于岩土表面的能力不同,按吸附能 力排序如下:
Mg 2 2HCO3 CO2 H2O MgCO3
结果:地下水中的重碳酸根离子、钙离子/镁离子减少,矿化 度降低。
2019/1/9
10
地下水化学成分的形成作用
• 脱硫酸作用
– 概念:在还原环境中且有机质存在时,脱硫酸菌使硫酸根离子 还原为H2S,这便是脱硫酸做用。
脱硫酸菌
2 – 机制: SO4 2C 2H 2O H2 S 2HCO3
2019/1/9
9
地下水化学成分的形成作用
• 脱碳酸作用
– 概念:CO2在水中的溶解度随着温度升高或者压力的降低而减 少,一部分CO2便成为游离CO2从水中逸出,这就是脱碳酸做 用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第1节 地下水的化学成分
• 海水 • 岩浆岩和变质岩地区,来自含钠矿物风化溶解。 钾离子(K+) • 来源与Na+相近 • 地下水中含量远低于Na+含量。原因有: • K+大量参与形成不溶于水的次生矿物; • 易被植物吸收。 钙离子(Ca2+) • 来源: • 碳酸盐类沉积物的溶解
第1节 地下水的化学成分
第3节 地下水化学成分的形成作用
地形:高山地区地形切割强烈,地下水循环交替快, 矿化度低;平原地区地下水流动慢,矿化度高。 植物: 人类活动的影响: • 人类生活与生产活动产生的废弃物污染地下水; • 人为作用大规模地改变了地下水形成条件,从而使 地下水化学成分发生变化; • 工业生产的废气、废水与废渣以及农业上大量使用 化肥农药,使天然地下水富集了原来含量很低的有 害元素,如酚、汞、砷、铬、亚硝酸等。
主要的物理性质有:温度、导电性、放射性、味、嗅、色、 透明度、比重等 主要的化学性质有:总溶解固体、硬度、酸碱性 两者关系:物理性质往往是化学性质的外在表现。
温度
水交替缓慢时与地温一致,并取决于:太阳辐射热能、 地球内部热流 分三个带:变温带、常温带和增温带 • 变温带:受太阳辐射热能影响,呈昼夜变化与季节 变化。昼夜变化只影响地表以下1~2m深度。变温带 的下限为15~30m。
第2节 地下水的主要物理化学性质
增温带内某深度(H)地温(T)的计算: T = t + (H - h)/r t为年平均气温;h为年常温带深度;r为地温梯度。 地下水活动对地温的影响:
第2节 地下水的主要物理化学性质
总溶解固体(TDS)(矿化度)
地下水中所含种离子、分子与化合物的总量。(g/L) (Total Dissolved Solids—TDS) 习惯上以105—110℃时将水干所得的涸残余物总量。 因此 ⑴ 计算时挥发性成分不计入; ⑵ HCO3-只取重量的半数 地下水按TDS的分类 德国度(H0):一个德国度相当于1升水中含有 10mgCaO或7.2mgMgO。 1meq = 2.8 H0
第1节 地下水的化学成分
• 特点: • 水迁移能力很强; • 含量变化幅度大:数mg/L~数百g/L 一般岁TDS的增加而有所提高。 硫酸根离子(SO42-) • 来源 • 含石膏(CaSO4•2H2O)或其它硫酸盐的沉积岩 的溶解 ; • 硫化物的氧化 2FeS2+7O2+2H2O→2Fe2++4H++4SO42-
第1节 地下水的化学成分
细菌成分:如氧化环境中存在的硫细菌、铁细菌; 还原环境中存在的脱硫细菌; 污水中的各种致病细菌等 • 分病源菌和非病源菌 • 细菌分析结果的表示: • 细菌总数:每毫升水或每升水中的细菌总数 • 菌度:含有一条大肠杆菌的水的毫升数 • 检定量:1升水中大肠杆菌的总数
第2节 地下水的主要物理化学性质
第2节 地下水的主要物理化学性质
类别 淡 水
TDS(g/L) <1 1 ~ 3
类别 半咸水 (中矿化水) 咸 水 (高矿化水)
TDS(g/L) 3 ~ 10 >10
微咸水 (低矿化水)
第2节 地下水的主要物理化学性质
硬度
水中Ca2+、Mg2+的总含量。(meq/L) 德国度(H0):一个德国度相当于1升水中含有 10mgCaO或7.2mgMgO 1meq = 2.8 H0 分类 • 总硬度(total hardness):水中Ca2+、Mg2+的 总含量 • 暂时硬度(temporary hardness):水煮沸时 因形成碳酸盐沉淀而失去的一部分Ca2+、Mg2+含量 • 永久硬度:水煮沸后仍留在水中的Ca2+、Mg2+含量
第3节 地下水化学成分的形成作用
岩性:可溶成分溶于水,使水中富含这些可溶成分; 难溶成分通过风化溶解进入水中,对地下水 成分产生影响。 地质构造: 隆起构造地区,溶滤作用为主,形成低矿化水; 封闭的向斜构造地区发生浓缩作用使矿化度增高; 气候:潮湿地区降雨量大,地下水矿化度常较低; 干旱的沙漠、半沙漠地区蒸发强,矿化度高。 水文因素: 反映在地表水与地下水的补排关系上。
第3节 地下水化学成分的形成作用
混合作用
成分不同的两种水汇合在一起,形成化学成分与原来两 者都不相同的地下水,便是混合作用。
影响地下水化学成分形成的因素
三大类:自然地理因素(气候、水文、地形、植物) 地质因素(岩性、地质构造等) 人为因素 这些因素的错综组合决定着地下水化学成分形成的方 向及其分布规律。
第1节 地下水的化学成分
• 地球深部高温高压下变质生成: CaCO3---CaO+CO2 SiO2+CaCO3---CaSiO3+CO2 • 工业发展造成人为CO2(温室效应)。 • 作用 地下水中CO2越多,其溶解碳酸盐岩和对结晶岩进 行风化作用的能力越强。
主要离子成分
七种:Cl-、SO42-、HCO3-、Na+、K+、Ca2+和Mg2+
第1节 地下水的化学成分
微量组分:Br、I、F、B、Sr等 胶体成分:未离解的化合物,颗粒直径10-7~10-5 主要的有:Fe(OH)3、Al(OH)3 及 HsiO3等 还有:CaCO3、MgCO3 各种硫化物:PbS,CuS,CdS等 有机质胶体 粘土质胶体 胶体的形成: 物理风化使矿物机械破碎磨细形成; 急剧化学反应使溶液过饱和并形成许多结晶中心, 但未来得及结晶而形成。
第1节 地下水的化学成分
Na2Al2Si6O16+2CO2+3H2O → 2HCO3-+2Na++ H4Al2Si2O9+4SiO2 • 特点 含量一般不超过1g/L,在低矿化水中为主要阴离子。 钠离子(Na+) • 含量:在低矿化水中的含量一般很低,仅数毫克/ 升到数十毫克/升,但在高矿化水中则是主要的阳 离子,其含量最高可达数十克/升。 • 来源: • 沉积岩中岩盐及其它钠盐的溶解;
第3节 地下水化学成分的形成作用
脱硫酸作用
在还原环境中,当有机质存在时,脱硫酸细菌能使 SO42-还原为H2S 。 SO42-+2C+2 H2O→H2S+2HCO3在岩石含有有机物质的情况下,碳氢化合物也可使硫 酸盐还原。
第3节 地下水化学成分的形成作用
阳离子交替吸附作用
概念:一定条件下,颗粒将吸附地下水中的某些阳离 子,而将原来吸附的部分阳离子转为地下水中的组分, 即为阳离子交替吸附作用。 影响因素: • 岩土颗粒的比表面积 • 阳离子吸附于颗粒表面的能力: H+>Fe3+>Al3+>Ca2+>Mg2+>K+>Na+ • 地下水中某种离子的相对浓度。
第3节 地下水化学成分的形成作用
浓缩作用
概念:地下水受到蒸发失去水分或流动将溶解物质带 到排泄区而使地下水中盐分浓缩的过程。 条件: • 干旱或半干旱的气候; • 低平地势控制下较浅的地下水位埋深,有利于毛细 作用的颗粒细小的松散岩土 。 特点: 不仅使地下水的矿化度提高,也使水的化学(成分) 类型发生改变。
硫化氢(H2S)、甲烷(CH4)
• H2S来源: • 硫酸盐还原:
第1节 地下水的化学成分
• 硫化矿物分解:
• 火山喷发 • H2S和CH4的存在表明还原环境 • H2S一般出现在深层地下水中,油田水中含量很高, 常以此作为寻找石油的间接标志。 二氧化碳(CO2) • 来源: • 大气,但含量较低,工业化城市地区含量高。 • 土壤层。有机质残骸的发酵作用与植物的呼吸 作用使土壤中源源不断产生CO2并溶入流经土壤 的地下水中。
第2节 地下水的主要物理化学性质
水的类别 硬度(meq/L) < 1.5 1.5 ~ 3.0 3.0 ~ 6.0 6.0 ~ 9.0 > 9.0
极软水 软水 微硬水 硬水
极硬水
第3节 地下水化学成分的形成作用
溶滤作用
概念:在水与岩土相互作用下,岩土中一部分物质转 入地下水中的过程。 影响因素: • 组成岩土的矿物盐类的溶解度 • 岩土的空隙特征 • 水的溶解能力决定着溶滤作用的强度 • 水中CO2、O2等气体成分的含量决定着某些盐类的 溶解能力 • 地下水的径流与交替强度是决定溶滤作用强度的最 活跃最关键的因素
• 岩浆岩、变质岩中含钙矿物的风化溶解 • 含量 低矿化水中为主要阳离子,一般不超过数百mg/L 高矿化水中含量显著增大,但仍低于Na+的含量。
镁离子(Mg2+) 含量与来源同Ca2+
地下水中的其它成分
次要离子:H+、Fe2+、Fe3+、Mn2+、NH4+、OH-、NO2-、 NO3-、CO32-、SiO32-及 PO43-等
第2节 地下水的主要物理化学性质
计算 • r[Ca2++Mg2+] > r[HCO3-]时, 暂时硬度 = r[HCO3-] 永久硬度 = r[Ca2++Mg2+]- r[HCO3-] • r[Ca2++Mg2+] < r[HCO3-]时, 总硬度 = 暂时硬度 = r[Ca2++Mg2+] 永久硬度 = 0 地下水按硬度分类
第1节 地下水的化学成分
• O2与N2共存---来源于大气并处于氧化环境 • N2单独存在---来源于大气并处于还原环境 • 大气中惰性气体(Ar, Kr, Xe)与N2的比值: (Ar, Kr, Xe)/ N2 = 0.0118 , 则N2是大气起源 (Ar, Kr, Xe)/ N2 < 0.0118,则N2是生物或变 质起源
