高考化学二轮复习课件:专题七 化学与技术
高考化学二轮总复习课件:化学与技术专题练习1 (共43张PPT)

C
5.
化学工业在经济发展中的作用举足轻重,下列有关工业生产的 叙述中正确的是( ) A.硫酸生产中常采用高压条件的方法提高SO2的转化率 B.合成氨中采用及时分离氨气的方法提高反应速率 C.电解精炼铜时,溶液中c(Cu2+)基本保持不变 D.氯碱工业电解饱和食盐水时,阳极得到氢氧化钠和氧气
【解析】 选项 A B C D 【答案】C 内容指向·联系分析 硫酸生产 中使用过量的空气进行反应提高 SO2 的 转化率,并不采用高压条件的方法 合成氨中及时分离氨气,让未反应的 N2.H2 循环使 用,提高原料的利用率,并不能提高反应速率 电解质精炼铜时,溶液中 c(Cu )略有减小,但基本 保持不变 氯碱工业电解饱和食盐水时,阳极得到 Cl2,阴极 得到氢氧化钠和氢气
4.
工业生产中要考虑化学反应速率,下列有关说法正确的是( ) A.在生产中化学反应速率越快越好 B.在生产中,增加一种反应物的量一定可以达到加快反应速率的目的 C.催化剂的用量多少与化学反应速率无关 D.工业生产中采用适当的条件获取适宜的化学反应速率
D
4. 【解析】本题考查化学反应速率的概念及应用 ,意在考查考生 对化学反应速率概念的理解能力。A项,在工业生产中并非反应速 率越快越好,而是用适当的反应条件获取适宜的反应速率 ;B项,如 果一种反应物是固体或纯液体 , 增加它的量并不能加快反应速 率 ;C 项 , 催化剂多一些 , 与反应物的接触面积大一些 , 则反应速率 就快一些。 【答案】D
B
【解析】根据“纳米材料”的颗粒直径可以确定,把纳米粒子分散 到分散剂中可形成胶体 ,A说法正确;纳米级金属颗粒粉剂作催化剂 可加快反应速率 , 但不会影响化学平衡 , 因此反应物的平衡转化率 不变,B说法错误;用纳米颗粒粉剂做成火箭的固体燃料 ,反应更快, 燃烧更充分,因此会产生更大的推动力,C说法正确;银能抑菌.杀菌, 则纳米银粒子植入内衣织物中 , 肯定会具有抑茵 . 杀茵效果 ,D 说法 正确。 【答案】B
化学与技术复习PPT教学课件

三、纯碱的生产(氨碱法) 1.原料:_食__盐__、_氨__气__、__石__灰_石___ 2.生产过程 (1)在精制的饱和食盐水中通入氨气。 (2)将CO2通入氨化的饱和食盐水中,发生反应为:
_N_a__C_l__+_N_H__3_+_C_O__2_+_H_2_O__=_==__N_a_H__C_O_3_↓_+_N__H_4_C_l________
11.了解用化学方法进行金属材料表面处理的原理。 12.了解我国现代材料研究和材料工业的发展情况,了解新材 料的发展方向。
自主复习
一、工业制硫酸的基本生产原理 1.原料:主要有_硫__铁_矿____、___空__气___、有色金属冶炼的烟气、 石膏等。
2.生产流程
(1)SO2的制取(设备:__沸__腾__炉__) ①原料为硫黄:_ __①_S_+_O_2_点_燃_S_O_2_ ___,
二、人工固氮技术——合成氨
1.反应原理N2 g 3H2 (g)
高温高压 催化剂
2NH3 g?H 0
反应特点: (1)该反应为_可__逆_反_应___ 。
(2)正反应为气体体积 __减__小____的反应。
(3)正反应为___放_热____ 反应。
2.条件的选择
结合反应的三个特点及实际生产中的动力,材料设备,成本等
速效、吸收快、不稳 定,受潮、受热易分解, 含氮量为17.7%
NH4NO3 (NH4)2SO4
(NH4)2SO4===2NH3+H2SO4
肥效高、含氮量为 35%,易结块
长期使用会使土壤 板结,酸性增强
(2)钾肥:主要有KCl、_K_H_2_P__O_4_、K2SO4。 (3)磷肥:过磷酸钙。
2.农药 最硫早酸使铜用的农药生石石硫灰 合剂,农药波尔多液是由 ________和________配制的。
高考化学二轮总复习-化学实验基础知识与基本技能课件

mol,质量为 0.05 mol×180 g·mol-1 =9 g。
由步骤④得到纯化的乙酰水杨酸 5.4 g 可计算出实验产率为
59.4gg×100%=60%。
高频考点•探究突破
命题热点一 命题热点二 命题热点三 命题热点四
化学实验仪器的使用 有关化学仪器使用的思维路径
-14-
高频考点•探究突破
高频考点•探究突破
命题热点一 命题热点二 命题热点三 命题热点四
例1某化学小组的同学到实验室学习。在实验桌上摆有下列仪 器:
-17-
高频考点•探究突破
-18-
命题热点一 命题热点二 命题热点三 命题热点四
(1)进行下面的实验,必须用到上述何种仪器,请用该仪器的名称
填空:
①欲配制一定物质的量浓度的氢氧化钠溶液,需使用仪
解析 答案答案
高频考点•探究突破
命题热点一 命题热点二 命题热点三 命题热点四
化学实验的基本操作 有关化学实验基本操作的思维路径
-23-
高频考点•探究突破
-24-
命题热点一 命题热点二 命题热点三 命题热点四
问题探究 1.如何用试纸检测溶液或气体,有哪些注意事项? (1)检验液体:取一小块试纸放在洁净的表面皿或玻璃片上,用干 燥的玻璃棒蘸取(或胶头滴管吸取)待测液,点在试纸的中部,观察试 纸的颜色变化。用pH试纸测溶液pH时,要与标准比色卡对比读数。 (2)检验气体:取一小块试纸润湿,粘在玻璃棒的一端,并使其接近 气体,观察试纸的颜色变化。 (3)注意事项:试纸不可伸入溶液中,也不能与管口接触;检验气体 时,试纸一定要润湿,测溶液pH时,pH试纸不能润湿。
考情分析•备考定向
-5-
专题知识脉络 能力目标解读 热点考题诠释
(统考版)2023高考化学二轮专题复习 第一部分 题型7 电化学原理应用——化学电源与电解技术
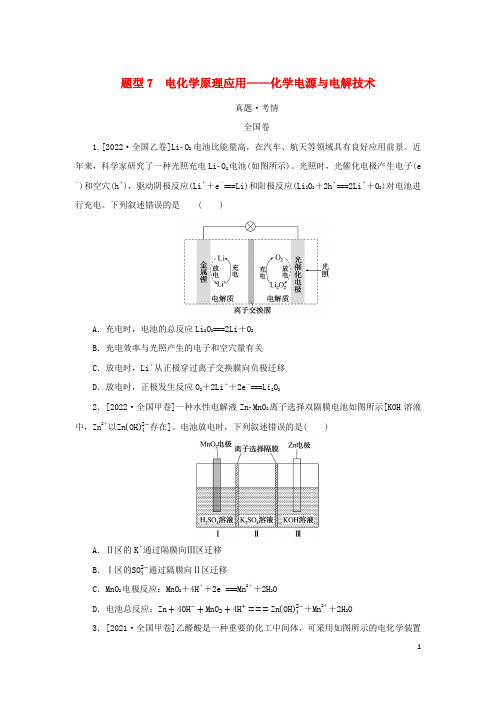
题型7 电化学原理应用——化学电源与电解技术真题·考情全国卷1.[2022·全国乙卷]LiO2电池比能量高,在汽车、航天等领域具有良好应用前景。
近年来,科学家研究了一种光照充电LiO2电池(如图所示)。
光照时,光催化电极产生电子(e-)和空穴(h+),驱动阴极反应(Li++e-===Li)和阳极反应(Li2O2+2h +===2Li++O2)对电池进行充电。
下列叙述错误的是 ( )A.充电时,电池的总反应Li2O2===2Li+O2B.充电效率与光照产生的电子和空穴量有关C.放电时,Li+从正极穿过离子交换膜向负极迁移D.放电时,正极发生反应O2+2Li++2e-===Li2O22.[2022·全国甲卷]一种水性电解液ZnMnO2离子选择双隔膜电池如图所示[KOH溶液中,Zn2+以Zn(OH)42−存在]。
电池放电时,下列叙述错误的是( )A.Ⅱ区的K+通过隔膜向Ⅲ区迁移B.Ⅰ区的SO42−通过隔膜向Ⅱ区迁移C.MnO2电极反应:MnO2+4H++2e-===Mn2++2H2OD.电池总反应:Zn+4OH−+MnO2+4H+===Zn(OH)42−+Mn2++2H2O3.[2021·全国甲卷]乙醛酸是一种重要的化工中间体,可采用如图所示的电化学装置合成。
图中的双极膜中间层中的H2O解离为H+和OH-,并在直流电场作用下分别向两极迁移。
下列说法正确的是( )A.KBr在上述电化学合成过程中只起电解质的作用B.阳极上的反应式为:C.制得2 mol乙醛酸,理论上外电路中迁移了1 mol电子D.双极膜中间层中的H+在外电场作用下向铅电极方向迁移4.[2021·全国乙卷]沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排放并降低冷却效率。
为解决这一问题,通常在管道口设置一对惰性电极(如图所示),通入一定的电流。
2018届高考化学二轮复习 化学与技术 课件(68张)(全国通用)

③氨盐水碳酸化(先将氨气通入饱和食盐水中得氨盐水;再通 入二氧化碳生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液 ), 其 反 应 原 理 为 NaCl + NH3 + CO2 + H2O===NaHCO3↓ + NH4Cl; ④过滤出碳酸氢钠后煅烧得纯碱,同时回收二氧化碳再利用: 煅烧 2NaHCO3=====Na2CO3+H2O↑+CO2↑; ⑤ 将 氯 化 铵 加 石 灰 乳 反 应 , 生 成 氨 回 收 利 用 : CaO + △ H2O===Ca(OH)2,2NH4Cl + Ca(OH)2 ===== CaCl2 + 2H2O + 2NH3↑。
②反应原理 点燃 高温 高温 C+O2=====CO2, CO2+C=====2CO, Fe2O3+3CO=====2Fe +3CO2。 ③环境污染的防治: 高炉煤气:CO、CO2、N2,回收 CO 作燃料。 (2)电解法炼铝 ①主要原料:铝土矿 ②反应原理 a.由铝土矿精制 Al2O3 Al2O3+2NaOH===2NaAlO2+H2O NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3 △ 2Al(OH)3=====Al2O3+3H2O b.电解 Al2O3 2Al2O3 4Al+3O2↑
(2)氨碱法的工艺如下图所示,得到的碳酸氢钠经煅烧生成纯 碱。
ቤተ መጻሕፍቲ ባይዱ
①图中的中间产物 C 是________,D 是________(写化学式); ②装置乙中发生反应的化学方程式为__________________。 (3)联合制碱法是对氨碱法的改进,其优点是____________。 (4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似, 故也可用氨 碱法以氯化钾和石灰石等为原料制碳酸钾。 请结合下图的溶解 度(S)随温度变化曲线,分析说明是否可行?__________。
高考化学二轮复习化学与技术专题练习课件(共47张)(全国通用)

(2)“吸收”工艺过程中,分别将CO2、NH3通入水中,反应生成(NH4)2CO3, 实 际 操 作 中 为 生 成 较 多 的 (NH4)2CO3 , 应 在 水 中 通 ________ , 理 由 是
________________________;
(3)写出向石膏悬浊液中加入 (NH4)2CO3溶液后发生反应的离子方程式: _____________________;
高温 【答案】(1)合成塔 A (2)C+H2O=====CO+H2 (3)防止催化剂中毒 CO23-+CO2+H2O===2HCO-3 (4)在电磁场的作用下,氮氮叁键更容易断裂,降低了合成氨反应所需的能量 降低能 耗,使反应更容易进行(其他合理答案均给分) (5)3 2NH3-6e-===N2+6H+
极 , 以 硝 酸 作 为 电 解 质 , 则 理 论 上 处 理 1 mol 氨 , 电 路 中 转 移 电 子
________mol , 阳 极 的 电 极 反 应 式
为
。
【解析】(1)根据题给工艺流程判断设备Ⅰ的名称为合成塔,沿 X 路线循环利用的物质是 N2
高温 和 H2,选 A。(2)焦炭和水蒸气在高温下反应生成一氧化碳和氢气,化学方程式为 C+H2O=====
B.制取 NaHCO3 的反应是利用其溶解度小 C.第③④⑤步的目的是浓缩、富集溴单质,这三步中溴元素均被氧化 D.过程②中结晶出的 MgCl2·6H2O 可在空气中受热脱水制得无水 MgCl2
【解析】A 项,加入过量的氢氧化钠可以将镁离子沉淀;硫酸根离子用钡离子沉淀,加入过 量的氯化钡可以将硫酸根离子除去;钙离子用碳酸根离子除去,加入的碳酸钠要放在加入 的氯化钡之后,这样碳酸钠还会除去反应剩余的氯化钡;然后进行过滤,再加入盐酸除去 反应剩余的氢氧根离子和碳酸根离子,最后经蒸发操作得到较纯净的氯化钠,错误;C 项, 第④步溴元素化合价由 0 价降低到-1 价,被还原,错误;D 项,结晶出的 MgCl2·6H2O 应 在氯化氢气流中受热脱水制得无水 MgCl2,错误。
二轮复习 化学与技术 课件(新课标)

电解
(2)天然海水吸收含硫烟气后再用氧气进行氧化处理的反应原 理是 2H2SO3+O2===2H2SO4;氧化后的海水中含有硫酸,水 溶液显酸性,所以需要加入氢氧化钠,与之混合后才能排放。 该操作的主要目的是使氢氧化钠与硫酸发生中和反应。
专题十三
化学与技术
(3)①在母液中加入石灰乳的作用是使 Mg2 转化为 Mg(OH)2 沉淀。②MgCl2 是强酸弱碱盐,加热时盐会溶解在结晶水中,
专题十三
化学与技术
考点一 高考命题分析
化学与资源开发利用
以化学与资源开发利用为主要背景的高考题
的主要考查内容包括煤、石油和天然气等综合利用,海水的 综合利用,废旧物资再生与综合利用的作用等。试题与元素 化合物的知识、化学反应原理相结合,重点考查化学知识在 资源开发过程中的具体利用。
专题十三
化学与技术
专题十三
化学与技术
1.获取洁净水的主要方法 主要方法 水的净 化 硬水软 化 污水处 理 海水淡 化 相关原理 加入混凝剂(如明矾)沉淀 水中悬浮杂质 量 中和废水,将其中的重金 属离子转化为沉淀 蒸馏浓缩、离子交换膜的 选择性透过净化海水
混凝法
加热法、药剂法、离 降低水中钙、镁离子的含 子交换法 中和法、沉淀法 蒸馏法、电渗析法
(2014· 高考全国卷Ⅱ,36,15分)将海水淡化与浓海水
资源化结合起来是综合利用海水的重要途径之一。一般是先
将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺 流程提取其他产品。
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是 ②③④ 填序号)。 ________(
①用混凝法获取淡水
专题十三
化学与技术
2016届高考化学二轮专题复习课件:化学与技术

回答下列问题: (1)CO 和 NaOH 在一定条件下合成甲酸钠、甲酸钠加热脱氢 的化学反应方程式分别为 滤渣是 滤渣是 ,过滤操作②的滤液是 。 。 。 、 和 。 , , (2)该制备工艺中有两次过滤操作, 过滤操作①的滤液是
本 学 案 栏 目 开 关
(3)工艺过程中③和④的目的是 的缺点是产品不纯,其中含有的杂质主要是
(5)草酸溶于水形成草酸溶液,用酸性 KMnO4 溶液滴定,发生 氧化还原反应,草酸被氧化为 CO2,KMnO4 被还原为 Mn2 ,
+
依据电子守恒、 电荷守恒、 原子守恒配平反应的离子方程式为
2 5C2O4 + 2MnO4 + 16H ===2Mn2 + 8H2O+ 10CO2↑ ,依据
- - + +
学案 18
【最新考纲展示】
化学与技术
1.化学与资源的开发、利用:(1)了解化学在水处理中的应用;(2)了
本 学 案 栏 目 开 关
解海水的综合利用和海水淡化的主要方法; (3)了解合成氨的主要 原理、重要设备及生产流程,了解催化剂的研制对促进化学工业 发展的重大意义;(4)了解电解食盐水的基本原理,了解氯碱工业 产品的主要用途,了解食盐水电解工艺和主要设备——石棉隔膜 电解槽;(5)了解接触法制硫酸的生产工艺、各阶段反应及主要设 备,了解硫酸工业中“三废”(废气、废水、废渣)的治理和综合利 用;(6)了解从海水中提取镁的过程和原理,了解从铝土矿中提取 铝的过程和原理,了解铝制品及镁铝合金在生活中的广泛应用。
(10)生产、生活中努力实现资源的循环利用,符合节能降耗
题型 1
有关化工原理与流程的考查
本 【真题回顾】 学 案 1.(2013· 新课标全国卷Ⅰ,36)草酸(乙二酸)可作还原剂和沉淀 栏 目 剂, 用于金属除锈、 织物漂白和稀土生产。 一种制备草酸(含 开 关 2 个结晶水)的工艺流程如下:
高考化学大二轮复习 化学与技术课件

。
ppt精选
8
三、化学与材料的开发利用
1. 传统的硅酸盐材料包括 水泥、玻璃 和 陶瓷 ,硅、光导
纤维属于 新型无机非金属
材料。
2. 金属的冶炼方法与金属的 活泼性 有关,铝的冶炼方法 为 电解法 ,原料为 氧化铝 ,辅料为 冰晶石 。
3. 玻璃钢、陶瓷塑料属于 复合 材料。
ppt精选
9
4. 化肥的施用与常见重要化肥的生产原理: (1)农业生产中,大量施用的化肥主要是氮肥、磷肥、钾 肥。过磷酸钙[主要成分是Ca(H2PO4)2·H2O和CaSO4],简称普 钙,它是目前使用最广泛的磷肥。除了我们熟知的用草木灰作 钾肥外,农业上常用的钾肥主要有氯化钾、硫酸钾、硝酸钾 等。
。天然水在净化处理过程中
加入的混凝剂可以是 明矾、硫酸铝、硫酸铁、硫酸亚铁 等,
水的净化与软化的区别是
水的净化是用混凝剂将水中胶体及悬浮物沉淀下来,而水的软
化是除去水中的钙离子和镁离子
。
ppt精选
4
2. 从海水中得到NaCl采用 蒸发法(或盐田法) ,把Br-转 化为Br2的反应为 Cl2+2Br-===Br2+2Cl- ,把Mg2+转化为 Mg(OH)2加入的物质是石灰乳 。
ppt精选
25
(3)两种常见的有机高分子材料:
材料名称
功能高分子材料
复合材料
概念
既具有传统高分子材料的 机械性能,又具有某些特 殊功能的高分子材料
两种或两种以上材 料组成的新型材 料,由基体和增强 体构成
浓度
度
浓度
比为1∶2.8
压强 增大压强
增大压强 10~30 MPa
温度 升高温度
降低温度 400~500 ℃
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
是提高________的产量。 (3)煤的洗选是为了降低原煤中灰分和________的含量。煤
的流化床燃烧是指空气从底部吹向煤炭颗粒,并使全部煤炭 颗粒________进行燃烧的过程。
(4)煤的直接液化是煤与适当溶剂混合后在高温和_________ 存在下与________作用生成液体燃料的过程。
解析:(1)石油分馏在分馏塔中进行。该过程为连续操作过程。(2) 石油裂化分为热裂化、催化裂化和加氢裂化,裂化的目的是提高 轻质燃料油(汽油)的产量。(3)煤的洗选是为了降低原煤中灰分和硫 的含量。煤的流化床燃烧是指空气从底部吹向煤炭颗粒,并使全 部煤炭颗粒浮动进行燃烧的过程。(4)煤的直接液化是煤与适当溶 剂混合后在高温和催化剂存在下与H2作用生成液体燃料的过程。 答案:(1)分馏塔 连续
(3)海水提镁的一段工艺流程如下图:
浓海水的主要成分如下:
离子 浓度/(g·L-1)
Na+ 63.7
Mg2+ 28.8
Cl- 144.6
SO 46.4
该工艺过程中,脱硫阶段主要反应的离子方程式为_________ ____________________________________________________, 产品2的化学式为________________,1 L浓海水最多可得到产 品2的质量为________g。
答案:(1)②③④
5 (2) 3 Mg(OH)2 69.6
2- (3)Ca2++SO4 ===CaSO4↓
电解 (4)MgCl2=====Mg+Cl2↑ 高温 Mg+2H2O=====Mg(OH)2+H2↑
2. (2012· 山东高考)石油和煤炭加工过程涉及多种技术和设备。
(1)石油分馏时,在不断向________(填工业设备名称)内投放 原料的同时获得产品,该过程为________操作过程。 (2)石油裂化分为热裂化、________和加氢裂化,裂化的目的
(2)催化裂化 (3)硫(S) (4)催化剂 轻质燃料油(或汽油)
浮动 氢气(H2)
[掌握破题知能]
1.区分四组概念
(1)分馏和干馏: 分馏是对石油固有成分的分离,是物理变化;干馏是对煤 隔绝空气加强热分解得到新产物,是化学变化。 (2)煤和焦炭:
煤是以碳元素为主的复杂有机物和无机物组成的混合物, 而焦炭的成分主要是碳单质。
③核心设备——电解槽: a.首要问题:防止产物间反应:H2+Cl2===2HCl;Cl2+ 2NaOH===NaCl+NaClO+H2O; b.电极选择:石墨作阳极,碳钢网作阴极; c.种类:隔膜电解槽、离子交换膜电解槽。
[明辨失分陷阱] (1)用药剂法软化硬水时一定要注意加入试剂的先后顺序,
即Na2CO3应在Ca(OH)2 之后加入。 (2)用阳离子交换树脂HR除去硬水中的
专题七 化学与技术
本内容一般围绕以下考点进行考查:
(1)化学与资源的开发利用,主要包括水处理,海水资源的 开发利用,煤、石油和天然气的综合利用。
(2)化学与工农业生产,主要包括合成氨工业、硝酸工业、 硫酸工业、氯碱工业等,与化学反应原理知识联系密切。
(3)化学与材料的制造和利用,主要包括金属的冶炼,玻璃 制造以及高分子材料等。
Ca2+、Mg2+ 时,
溶液中的酸性会增强,应再用碱性溶液中和H+。 (3)污水处理中的酸性废水常用熟石灰中和而不用NaOH溶
[主干知识· 数码记忆]
化学与资源的开发利用
[盘点命题角度]
1.(2014· 新课标全国卷Ⅱ)将海水淡化与浓海水资源化结合起 来是综合利用海水的重要途径之一。一般是先将海水淡化 获得淡水,再从剩余的浓海水中通过一系列工艺流程提取 其他产品。
回答下列问题: (1)下列改进和优化海水综合利用工艺的设想和做法可行 的是________(填序号)。
①用混凝法获取淡水
②提高等的提取工艺
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收。碱 吸收溴的主要反应是Br2+Na2CO3+H2O―→NaBr+NaBrO3+ NaHCO3,吸收1 mol Br2时,转移的电子为________mol。
(4)裂化和裂解: 石油裂化的目的是为了提高轻质燃料(汽油、煤油和柴油等) 的产量,特别是提高汽油的产量;裂解是采用更高的温度,使 其中的长链烃断裂成乙烯、丙烯等小分子烃。
2.获取洁净水的四种方法
3.海水的综合利用 (1)海水制盐:
以蒸发法为主,其原理简单,得到的盐为粗盐。
②核心技术——电解: 阴极:2H++2e-===H2↑;阳极:2Cl--2e-===Cl2↑;总 通电 反应式:2NaCl+2H2O=====2NaOH+H2↑+Cl2↑。
(3)天然气和焦炉气: ①天然气是一种化石燃料,它蕴藏在地层内,从气井上开采
的可燃性气体,其含有CH4、C2H6、C3H8 等小分子烷烃,主要成 分是CH4,它既是一种重要的能源,又是一种重要的工业资源。 ②焦炉气是煤干馏所得产物之一,其主要成分是 H2、
CH4、CO、C2H4 等,它也是重要的气体燃料和化工原料。
(4)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应 的化学方程式为________________;电解时,若有少量水存在 会造成产品镁的消耗,写出有关反应的化学方程式_________ ___________________________________________________。
解析:(1)海水中主要含有 NaCl 等盐,用混凝法不能除去 NaCl, 错误。(2)由方程式可知,Br2 既是氧化剂又是还原剂,根据得失 5 电子守恒知,吸收 1 mol Br2 转移 mol 电子。(3)由题给海水的 3
2 主要成分,脱硫就是除掉硫酸根离子,发生反应: Ca2 + SO4
+ -
===CaSO4↓;由框图信息知,产品 2 为 Mg(OH)2;1 L 浓海水 中含有 Mg2
+
28.8 g,物质的量为 1.2 mol,则最多生成 Mg(OH)2
1.2 mol,质量为 1.2 mol×58 g/mol=69.6 g。(4)电解熔融氯化镁 生成氯气和单质镁,若有水存在,则高温下镁与水反应。
