高二化学卤代烃的化性
卤代烃化学性质

卤代烃化学性质
一、定义
卤代烃,即古称的烯烃,是一类具有特定结构、分子中含有至少一个卤族基团的有机物。
它们由另一个卤族基团和一个烃环相连,包括碘代烃、氰代烃和磺代烃,以及它们的衍生物。
其中碘代烃是最为常见的卤代烃。
二、特征
1.物理性质卤代烃大多为无色液体或气体,熔点较低,沸点较高,且有某些卤代烃具有独特的刺激性气味。
2. 化学性质卤代烃整体上具有相对较强的机械稳定性,它们的化学反应性很弱,比如碘代烃因其反应性极弱而受到应用。
然而它们的碱金属离子非常易于缔合,卤族基团中的卤素离子具有极强的碳链脱氢能力。
三、应用
1. 工业应用由于卤代烃在零下温度下仍保持液相,因此它们常被作为冷冻剂使用,如碘代乙烷、碘代丙烷。
卤代烃的广泛应用还包括提取金属、溶剂、增塑剂、抗凝剂以及用于燃料中的成分。
2. 医学应用通常,卤族基团具有抗肿瘤活性,因此一些卤代烃,如吡咯烷、苯氧氯乙烷和氯代苯甲酸甲酯等,经过衍生后能被用作医药中的药物。
高二化学选修五第二章2.3卤代烃知识点总结大全

1、卤代烃(属于烃的衍生物)(1)定义:烃分子中的氢原子被卤素原子取代后所生成的化合物,通式为R-X,官能团是-X。
饱和一卤代烃通式:C n H2n+1X(2)分类:按分子中所含卤素原子种类的不同,分为氟代烃、氯代烃、溴代烃、碘代烃。
(3)物理性质:①状态:常温下,大多数卤代烃为液体或固体。
(CH3Cl为气体)②溶解性:卤代烃都不溶于水,能溶于大多数有机溶剂,某些卤代烃自身就是很好的有机溶剂。
③熔沸点:随碳原子数的增加而升高。
④密度:随碳原子数的增加而降低,除一氟代烃和一氯代烃比水轻外,其余卤代烃都比水重。
注:卤代烃分子中不一定含有H原子。
如CCl4、F2C=CF2等2、溴乙烷A. 分子组成和结构名称分子式结构式结构简式官能团球棍模型比例模型溴乙烷C2H5Br CH3CH2Br—BrB. 物理性质颜色状态沸点密度溶解性无色液体38O CρC2H5Br>ρH2O不溶于水,易溶于有机溶剂C. 化学性质溴乙烷化学性质稳定,一般不会被酸性高锰酸钾、溴水等强氧化剂氧化。
但能与NaOH水溶液、NaOH醇溶液发生反应。
(1)水解反应(取代反应)溴乙烷与NaOH水溶液的反应:(2)消去反应:有机物在一定条件下,从一个分子中相邻的两个碳原子上脱去一个或几个小分子(如H2O、HX等),而生成含不饱和键化合物的反应。
溴乙烷与NaOH的乙醇溶液反应:3、卤代烃的水解反应与消去反应A. 取代(水解)反应(1)反应条件:强碱的水溶液、加热。
(2)反应本质:卤代烃分子中的—X被水分子中的—OH 所取代:RCH 2X+NaOHRCH 2OH+NaX (X 表示卤素原子)2H O △(3)反应规律:所有的卤代烃在强碱(如NaOH )的水溶液中加热均能发生取代(水解)反应。
B. 消去反应(1)反应条件:强碱的醇溶液、加热。
(2)反应本质:相邻的两个碳原子间脱去小分子HX :CH 3CH 2X+NaOHCH 2=CH 2↑+NaX+H 2O (X 表示卤素原子)乙醇△(3)反应规律:①没有邻位碳原子的卤代烃不能发生消去反应,如CH 3Cl 。
高中化学:第二章卤代烃知识点(精选)

第二章 卤代烃一.卤代烃的结构特点:卤素原子是卤代烃的官能团。
C —X 之间的共用电子对偏向X , 形成一个极性较强的共价键,分子中C —X 键易断裂。
二.卤代烃的物理性质(1)溶解性:不溶于水,易溶于大多数有机溶剂。
(2)状态、密度:CH 3Cl 常温下呈气态,C 2H 5Br 、CH 2Cl 2、CHCl 3、CCl 4常温下呈液态且密度> 1 g/cm 3。
(一氯代烃的密度都小于水)三.卤代烃的化学性质(以CH 3CH 2Br 为例) 1.取代反应①条件:强碱的水溶液,加热 ②化学方程式为:2.消去反应(1)实质:从分子中相邻的两个碳原子上脱去一个卤化氢分子,从而形成不饱和化合物。
例如: CH 3CH 2Cl :+NaOH ――→醇△NaCl +CH 2===CH↑+H 2O(2)卤代烃的消去反应规律①没有邻位碳原子的卤代烃不能发生消去反应,如CH 3Br 。
②有邻位碳原子,但邻位碳原子上不存在氢原子的卤代烃也不能发生消去反应。
例如:。
③有两个相邻碳原子,且碳原子上均带有氢原子时,发生消去反应可能生成不同的产物。
例:CH 3—CH===CH —CH 3+NaCl +H 2O(3)二元卤代烃发生消去反应时要比一元卤代烃困难些。
有些二元卤代烃发生消去反应后可在有机物中引入三键。
例如:CH 3—CH 2—CHCl 2+2NaOH ――→醇△CH 3—C≡CH+2NaCl +2H 2O 四.消去反应与水解反应的比较反应类型 反应条件 键的变化卤代烃的结构特点 主要生成物水解反应 NaOH 水溶液 C —X 与H —O 键断裂C —O 与H —X 键生成 含C —X 即可 醇消去反应 NaOH 醇溶液 C —X 与C —H 键断裂(或—C≡C—) 与H —X键生成与X 相连的C 的邻位C 上有H 烯烃或炔烃特别提醒 (1)通过卤代烃的水解反应可在碳链上引入羟基;通过卤代烃的消去反应可在碳链上引入碳碳双键或碳碳三键。
卤代烃的化学性质

卤代烃的化学性质卤代烃最典型、最具代表性的反应有两类:亲核取代反应和消除反应,另外,卤代烷还可与活泼金属反生成金属有机化合物。
一、亲核取代反应⏹ 在卤代烃分子中,由于Cl 的电负性大于C ,则C-Cl 键中的共用电子对就偏向于Cl 原子一端,使Cl 带有部分负电荷(Cl -δ),碳原子带部分正电荷(C +δ)。
这样C 原子就成为亲电反应中心,当与-OH 、-NH2等一些亲核试剂(带负电或富电子物种)时,亲核试剂就会进攻C +δ,Cl 则带一个单位负电荷离去。
⏹ 亲核试剂:带负电荷或有未共用电子对的具有亲核性的试剂。
⏹ 亲核取代反应:由亲核试剂进攻带部分正电荷的C +δ原子而引起的取代反应。
⏹ 亲核取代反应可用下面反应式表示+XR X +R Nu -Nu -⏹ 亲核试剂(Nucleophile ) 通常用 :Nu- 表示。
⏹ 取代反应(Substitution ) 通常用 S 表示。
⏹ 亲核取代反应 就用 SN 表示。
⏹ 卤烃常见的亲核取代反应有:⏹ 1. 水解 2. 醇解 3. 氰解 4. 氨解 5. 与硝酸银的反应 6. 与炔化钠的反应 (一)卤烃的水解⏹ 卤代烷与水作用,水解为醇,反应是可逆反应。
如:CH 3CH 2Br + H 2O CH 3CH 2OH + HBr在一般情况下,此反应很慢。
为增大反应速率,提高醇的产率,常加入强碱(氢氧化钠),使生成的HX 与强碱反应,可加速反应并提高了醇的产率。
CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr⏹ 此反应工业用途不大,因卤烷在工业上是由醇制取,但可用于有机合成中官能团的转化。
用于复杂分子中引入羟基(先卤代,再水解)。
(二)卤烃的醇解⏹ 卤烃的醇解是卤烃与醇钠的醇溶液反应,生成醚。
CH 3CH 2Cl + CH 3CH 2ONa CH 3CH 2OCH 2CH 3 + NaCl⏹ 此反应是制备混合醚的经典合成方法,称为威廉森(Williamson )合成法。
卤代烃的化学性质

卤代烃的化学性质;乙醇1. 卤代烃(溴乙烷)的主要化学性质:(1)水解反应(2)消去反应2. 乙醇:(1)组成与结构(2)物理性质a. 色、态、味:通常情况下,无色液体,有特殊香味。
b. 溶解性:与水混溶,本身是常用的有机溶剂。
c. 杀菌、消毒:75%<体积分数,乙醇水溶液,可作医用酒精。
(3)化学性质a. 与活泼金属反应b. 取代反应c. 消去反应d. 氧化反应或(此反应可视为以下两步:(4)制备a. 饮用酒:以淀粉为原料,在生物催化剂作用下转变为乙醇。
【疑难解析】例1. 如何理解溴乙烷发生水解反应和消去反应所需的条件?解析:(1)碱性条件:因为反应的机理需OH-参与反应历程,也可以从碱可以和生成的HBr 反应,从而推动反应进行来理解。
(2)条件差异:水解必须有水参与,醇的NaOH溶液自然不能水解,而只能消去。
例2. 如何从化学键的断裂理解乙醇的化学性质?解析:从结构上看,乙醇分子中存在5种不同的化学键。
其中②为非极性键。
在反应中,表现为极性键断裂。
与活泼金属反应:⑤断裂与HBr反应:④断裂生成乙醚:一个乙醇分子断⑤,另一个乙醇分子断④消去反应:①、④断裂催化氧化:③、⑤断裂【例题分析】例1. 是否所有的醇都可以发生消去反应和催化脱氢反应?试举例说明。
解析:分析反应的实质,归纳反应对醇的结构要求。
例2. 以溴乙烷为主要原料,如何合成1,1,2,2-四溴乙烷?(其它试剂可任选)写出各步化学方程式。
解析:生成1,1,2,2-四溴乙烷有两种途径:(1)CH≡CH和Br2加成;(2)CH3CH3和Br2取代,由于取代反应不好控制,生成的是多种取代产物的混合物,故选择(1)。
要生成CH≡CH,必须采用消去的反应,如果从饱和卤代烃开始应进行两步消去,故应先生成1,2-二溴乙烷。
同理不难逆推得结果:例3. 甲醇和乙醇的混合物与浓H2SO4共热可生成的有机物最多有()A. 2种B. 3种C. 4种D. 5种解析:分类:在浓H2SO4加热条件下生成有机物,对醇而言,反应有两种:共4种,选C。
有机化学归纳总结

有机化学归纳总结有机化学知识点归纳总结有机化学归纳总结知识点一:各类烃的衍生物性质总结一、卤代烃:1、通式:饱和一元卤代烃:官能团:2、物性:①均不溶于水,易溶于有机溶剂②一氟代烃、一氯代烃密度比水小,其余比水大。
3、化性:①水解反应:(取代反应)反应通式:条件:强碱的水溶液可加热。
断键方式:羟基取代卤素原子②消去反应:反应通式:条件:强碱的醇溶液必加热。
断键方式:断卤素原子和一个氢,形成。
要求:必须有氢才能发生消去反应。
二、醇:1、通式:饱和一元醇:官能团:2、物性:①甲醇、乙醇、丙醇是与水以任意比混溶的液体。
②含4~11个C的醇为油状液体,部分溶于水。
③含12个C以上的醇为无色固体,不溶于水。
3、化性:⑴与活泼金属反应:显中性反应通式:⑵氧化反应:①燃烧:②醇使酸性高锰酸钾褪色。
③催化氧化:反应通式:断键方式:断羟基氢和一个氢,形成,将CH2OH改为CHO。
要求:有2个氢则被催化氧化生成醛。
有1个氢则被催化氧化生成醛。
无氢则不能被催化氧化⑶消去反应:反应通式:断键方式:断羟基氢和一个氢,形成。
要求:必须有氢才能发生消去反应。
第1页共4页有机化学知识点归纳总结⑷分子间脱水:(取代反应)反应通式:⑸与HX反应:(取代反应)反应通式:三、苯酚:1、结构简式:酚:2、物性:①无色晶体,在空气中因小部分氧化而显粉红色。
②常温在水中溶解度不大,加热到65℃以上与水互溶。
③易溶于酒精、乙醚、苯等有机溶剂。
3、化性;⑴弱酸性:酸性:①②③④⑵取代反应:①②⑶显色反应:酚遇FeC3显紫色。
⑷氧化反应:①在空气中氧化显粉红色。
②燃烧。
③被酸性高锰酸钾氧化,能使酸性高锰酸钾褪色。
⑸加成反应:四、醛:1、通式:饱和一元醛:官能团:2、物性:①无色具有刺激性气味的液体。
②易溶于水、乙醇、苯等有机溶剂。
③易挥发。
3、化性:⑴加成反应;反应通式:断键方式:断碳氧双键,将CHO改为CH2OH。
⑵氧化反应:①燃烧通式:②醛能被酸性高锰酸钾、溴水氧化。
有机化学第六章卤代烃

第六章卤代烃卤代烃是一种简单的烃的衍生物,它是烃分子中的一个或多个氢原子被卤原子(F, CL, Br, I)取代而生成的化合物。
一般可以用R-X表示,X代表卤原子。
由于卤代烃的化学性质主要有卤原子决定,因而X是卤代烃的官能团。
根据卤代烃分子中烃基的不同,可以将卤代烃分为卤代烷烃、卤代烯烃、卤代炔烃和卤代芳烃等。
第一节卤代烷烃一. 卤代烷烃的分类和命名(一) 卤代烷烃的分类1. 根据卤代烷烃分子中所含卤原子的种类,卤代烷烃分为:氟代烷:如CH3-F氯代烷:如:CH3-CL溴代烷:如:CH3-Br碘代烷:如:CH3-I2. 根据卤代烷烃分子中所好卤原子的数目的多少,卤代烷烃分为:一卤代烷:如:CH3CL, CH3-CH2-Br二卤代烷:如:CH2CL2,多卤代烷:CHCL33. 根据卤代烷烃分子中与卤原子直接相连的碳原子的类型的不同,卤代烷烃可以分为:伯卤代烷(一级卤代烷)R-CH2-Br仲卤代烷(二级卤代烷)叔卤代烷(三级卤代烷)(二)卤代烷烃的命名1. 普通命名使用范围:结构比较简单的卤代烷常采用普通命名法命名:原则:根据卤原子的种类和与卤原子直接相连的烷基命名为“某烷”,或按照烷烃的取代物命名为“卤某烷”。
如:CH 3CL甲基氯(氯甲烷)CH 3CH2Br乙基溴(溴乙烷)CH 3CH2CH 2CH2I正丁基碘(正碘丁烷)CH 3BrCH 3I1H 3 C -------- CH -------- CH CL1H 3 C -------- CH --------- CH 2CH 3H3C-—C------------- CL11CH 3异丁基氯仲丁基溴叔丁基氯(异氯丁烷)(仲溴丁烷)(叔氯丁烷)2.系统命名法范围:复杂的卤代烷烃一般采用系统命名法原则:将卤原子作为取代基,按照烷烃的命名原则来R进行命名。
方法:1) 选择连有卤原子的最长碳链为主链,并根据主链 所含碳原子的数目命名为“某烷”作为母体;2)将支链和卤原子均作为取代基;3) 对于主链不带支链的卤代烷烃,主链编号从距离 卤原子最近的一端开始;4) 对于主链带支链的卤代烷烃,主链的编号应遵循 “最低系列规则”;5)把取代基和卤原子的名称按“次序规则”依次写 在“某烷”之前(次序按先后顺序写),即得该卤代烷 烃的名称。
有机化学中卤代烃的性质总结

有机化学中卤代烃的性质总结文件排版存档编号:[UYTR-OUPT28-KBNTL98-UYNN208]有机化学中卤代烃的有关性质总结一.卤代烃的分类1.按照卤元素的种类可分为三种:碘代烃溴代烃氯代烃等2.按照卤代烃的种类可分为吧饱和卤代烃,不饱和卤代烃,芳卤代烃等3.按照卤元素的数目可分为一卤代烃,二卤代烃,多卤代烃等二.物理性质在此直说一些常考的有特殊性的的物理性质,氟甲烷,氟乙烷,氟丁烷,氯甲烷,氯乙烷,溴甲烷为气体,其余卤代烃都是液体,无色。
对沸点而言,卤代烃相对于各自的烃而言沸点更高(原因是他们之间有极性)。
对密度而言,一氯代烷的密度小于1,一溴代烷,一碘代烷的密度大于1三.化学性质对化学性质而言,主要有以下四方面.亲核取代反应消除反应与金属地的反应还原反应1.亲核取代反应(1)RX+NaCN--------RCN+NaX此反应催化剂是醇类物质此的特点就是通过反应增加一个碳原子,用于增加碳链。
(2).与硝酸银在醇的催化下进行取代,同时生成卤化银RX+AgNO3-----------RONO2+AgX此反应可用于鉴别卤化物,是卤化物的特征反应(3)卤代烃与氨的反应CLCH2CH2CL+4NH3---------NH2CH2CH2NH2+2NH4CL此反应的条件要求苛刻必须在封闭容器中,温度在115—120反应5小时,此外,此反应不但生成一级胺还可以连续作用生成二级,三级,四级胺等,如果想得到竟可能多的一级胺则可加过量卤代烃。
(4)卤代烃还能与另一种卤素原子进行互换,C3H7Br+NaI---------C3H7I+NaBr(此处要注意有时候他们之间的互换是不能发生的要依条件而言)2.消除反应卤代烃与氢氧化钠或氢氧化钾在醇的作用下卤代烃脱去一个氢和一个卤原子形成双键形成不饱和烃的反应叫做消除反应。
RCH2CH2X+NaOH-----------R-CH2=CH2+NaX+H2O此反应有个规律(札依采夫规律)当连接卤素的碳原子的相邻碳原子有两种时,通常会消除含氢较少的碳原子上的氢(即那也是主产物)。
第六章卤代烃

CH3CCH3
NaI
CH3CHCH2CN
I
NaBr
丙酮的存在使生成的NaCl、NaBr不溶,使平 衡向右移动。
(5)与硝酸银-乙醇溶液作用 反应是典型SN1历程,生成沉淀的速度是: R3CX >R2CHX> RCH2X
可用于鉴别不同结构的卤烷。
RX
C2H5OH
AgNO3
RONO2
AgX
用化学方法鉴别: 1—溴丁烯 3—溴丁烯 4—溴丁烯 2—溴丁烷
(c)烯丙基型和苄基型卤代烃对SN反应的影响
++
CH2 CH CH2
++
CH2
由于这些碳正离子相当稳定,所以相应卤代烃 SN1反应活性很高。(比叔卤烷活性高)
SN2反应活性也很高(比伯卤烷活性高),因为 共轭而使过渡态活化能降低。
X δH
CCC H
Nu δ-
(d)乙烯型卤化物对SN反应活性的影响
支链增多对消除有利。 2、试剂碱性和亲核性 碱性强对消除有利,对E2更有利;(KOH/醇、
RONa/醇、RONa/DMSO)。 亲核性强对取代有利,SN2更有利,试剂体积
增大对消除有利。
3、反应温度
提高反应温度对取代、消除都有利,对消除更 有利。
六、有机氟化物
1、有机氟化物的命名
(1)含有一个或少数氟原子的化合物可采用系统 命名法命名。
C2H5OH/H2O
回流
CH3CH2CH2OH
NaBr
采用乙醇/水溶液作为溶剂,主要是增加卤烷在
反应体系中的溶解度。
此法常用于高级醇的制备。
(2)被氰基取代得到腈 伯卤烷与氰化钠在乙醇-水溶液中反应,可以得
【知识解析】卤代烃的化学性质

卤代烃的化学性质受官能团卤素原子(—X)的影响,卤代烃的化学性质比烷烃的活泼,既能发生消去反应,又能发生水解反应(取代反应)。
1.卤代烃的水解反应(取代反应)(1)条件:NaOH水溶液、加热。
(2)本质:水分子中的—OH取代了卤代烃中的—X。
R—X+NaOH R—OH+NaXR—CHX—CH2X+2NaOH R—CH(OH)—CH2OH+2NaX教材延伸(1)卤代烃的水解反应可用于制取醇,如CH3Cl+NaOH CH3OH+NaCl(制一元醇)、(制二元醇)、(制芳香醇)。
(2)卤代烃发生水解反应时量的关系:R—X~NaX~AgX↓,即1 mol一卤代烃通过反应可得到1 mol AgX(X=Cl、Br、I)沉淀,常利用此关系来定量测定卤代烃中卤素原子的含量。
2.卤代烃的消去反应(1)条件:强碱的醇溶液、加热。
(2)本质:从有机物分子中相邻的两个碳原子上脱去一分子的HX生成含不饱和键的烃。
(3)卤代烃发生消去反应的规律①与卤素原子相连的碳原子没有邻位碳原子的卤代烃不能发生消去反应,如CH3Cl。
②与卤素原子相连的碳原子有邻位碳原子,但邻位碳原子上无氢原子的卤代烃也不能发生消去反应,如。
③与卤素原子相连的碳原子有两个相邻的碳原子且相邻碳原子上均有氢原子(氢原子不等效)时,发生消去反应可生成不同的产物,如(或CH3—CH=CH—CH3↑)+NaBr+H2O。
名师提醒(1)发生消去反应必须具备的结构条件是分子中有β—H。
如中没有β-H,就不能发生消去反应(与X相连的C叫α-C,与α-C相邻的C叫β-C;α-C上连接的H叫α-H,β-C上连接的H叫β-H)。
(2)由于苯环的特殊结构(很稳定),卤代苯(如)不能发生消去反应。
(3)发生消去反应的有机产物有三种:(4)欲增加有机物分子中某些官能团(如—X、—OH等)的数目,可以先由原料发生消去反应生成含不饱和键的有机物,再由含不饱和键的有机物与卤素单质发生加成反应生成多卤代物,多卤代物还可继续发生水解反应以增加—OH的数目。
卤代烃的化学性质

课堂巩固:
1.下列物质中能发生消去反应的是(D )
并写出可能产物的结构简式。
①
CH 3
②
CH3 CH CH CH3
CH 2Br2
Cl
CH3
③ CH 2 CHBr ④ CH3 C CH2Br
⑤
Br
A.①②③⑤
C.②④⑤
CH3
B.②④ D.①③⑤
2.如何由溴乙烷为主要原料来制备 乙二醇( CH2OHCH2OH ) ?
卤代烃分子中卤原子数目增多,则可燃性降低
二、卤原子的引入对卤代烃化学性质的影响
例:溴乙烷
比例模型
球棍模型
1.分子组成和结构
(1) 分子式 C2H5Br
HH
五 种
(2)
结构式 H
表
C H
C H
Br
示 (3) 结构简式 形
CH3CH2Br 或 C2H5Br
式
HH
(4) 电子式 H C C Br
HH
(5) 键线式
概念延伸
CH3
❖ CH3Cl 、CH3CHCHBrCH3 、H3C C CH2Cl
CH3
CH3
能否发生消去反应?
概念延伸 ❖ CH3Cl 、CH3CHCHBrCH3 、H3C
CH3
能否发生消去反应?
CH3 C CH2Cl CH3
注重对比、归纳 ❖满足什么条件的卤代烃能发生消去反应?
与卤原子相连碳原子相邻的碳原子上有氢
❖水解反应有无这要求? 无
❖卤代烃中卤素原子如何检验?
AgCl 白色
R-X
NaOH溶液
△
HNO3溶液 酸化
AgNO3溶液
AgBr 浅黄色 AgI 黄色
卤代烃的化学性质

卤代烃的化学性质1 概述卤代烃是一类挥发性的有机化合物,有着共烯结构,它们在环境中具有风险,因此,了解卤代烃的化学性质和其他相关特性十分重要。
卤代烃有着广泛的应用,并且具有易挥发、低气味和非常强的物理性质等优点。
它们也具有毒性和挥发性比较强的特点,容易对环境造成污染。
2 结构卤代烃是一种有机化合物,具有烷基卤素化合物的结构,由一个卤素原子(常是氯原子)和一个烃基组成,具有卤烷和烯烃两类结构。
卤烷结构具有卤素原子可以与一个或多个碳原子之间结合螯合的特性,烯烃结构是一种双键,具有支链性,由一个卤素原子与两个碳原子之间形成共价键。
3 物理性质卤代烃的物理性质有很多,其中最显著的特点是体积较小、挥发性较强、气味较低以及可跃迁的特性。
这些特点使得卤代烃在某些行业中具有广泛的应用,例如,低挥发性有机卤化物通常被用作消泡剂、阻燃剂和气味剂。
此外,由于它们具有相对低的毛细吸引力和液体密度,因此,卤素有机体系也可以用作空调液以及燃料合成剂。
4 电化学行为卤代烃的电化学行为取决于卤素的类型,它可以被分为电离反应和化学反应。
电离反应中,卤素可以通过电极受热而生成多种离子,如舍伍德离子、三氟甲烷离子和碳离子等,从而影响卤代烃的溶解性和挥发性。
此外,在化学反应中,卤素可以与分子结合,形成螯合物,进一步影响卤代烃的性质。
5 气相色谱/质谱卤代烃常常被用作气相色谱/质谱检测的标准品。
它们在分离和检测过程中的特性取决于溶剂的类型和种类,相似的物质会放大行为特征,所以卤代烃也可以用于鉴定其他物质的行为和性质。
在气相色谱/质谱分析中,卤素有机体系也可以用来检测有毒成分、有机物和醛类等物质。
6 毒性卤代烃也具有一定的毒性,它们对人体和其他生物具有危害,例如,过敏反应、眼睛痒及恶心等症状。
研究发现,卤代烃有比较强的致癌和致畸性,有一些研究表明,它们可以增加高血压的风险以及提高发病率。
此外,由于它们在空气中的残留性和挥发性比较强,因此也容易对环境造成污染,并造成一定的负面影响。
高中化学第一单元卤代烃苏教版选择性必修3

溴乙烷
诺氟沙星
沸点低
麻醉
3.卤代烃除了用于合成药物,还是制备高聚物的原料例如,________是聚氯乙烯 的单体, 曾是世界上产量最大的通用塑料,常用于建筑材料、工业制品、地板革、地板砖、人造革、管材、包装膜等。由________合成得到的聚氟乙烯、聚三氟乙烯、聚四氟乙烯等高聚物,以优良的耐热、耐磨、耐腐蚀等性能,开辟了材料应用的新领域。
稳定
不易
臭氧
紫外线
臭氧层
02
要点归纳·能力素养全提升
要点一 卤代烃的消去反应与水解反应的比较
反应类型
消去反应
取代反应
卤代烃的结构特点
与卤素原子相连的碳原子的邻位碳原子上有氢原子
反应实质
反应条件
强碱的醇溶液、加热
强碱的水溶液、加热
化学键变化
主要产物
烯烃或炔烃
醇
注意事项
若有多个不同位置发生消去反应可能生成不同的产物
(2)从环境保护角度看,能否大量使用该卤代烃?为什么?________________________________________________________________。
不能大量使用该卤代烃,因为有毒的卤代烃挥发到空气中,会污染环境
[解析] 有毒的卤代烃挥发到空气中,会污染环境。
③反应原理: 。
④定义:有机化合物在一定条件下,从一个分子中______________________(如 、 等),而生成含__________的化合物的反应叫做消去反应(消除反应)。
卤代烃的化学性质
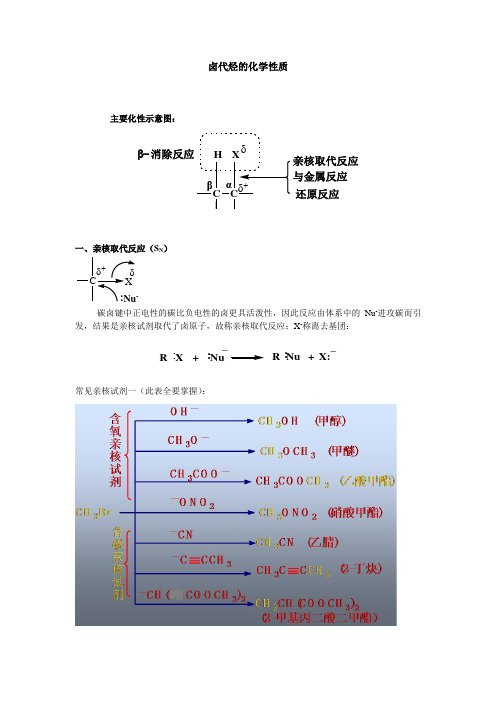
卤代烃的化学性质主要化性示意图:CC Xδ_亲核取代反应与金属反应还原反应H 消除反应β-αβ一、亲核取代反应(S N )C碳卤键中正电性的碳比负电性的卤更具活泼性,因此反应由体系中的Nu -进攻碳而引发,结果是亲核试剂取代了卤原子,故称亲核取代反应;X -称离去基团:R X +Nu_R Nu +X::::_常见亲核试剂一(此表全要掌握):常见亲核试剂二(掌握氨、X -,了解SH -)(一)水解(羟基取代) R X +HOHROH+HX NaOH注:“氢氧化钠水溶液”体系(二)氰基取代R X +R +NaXCNH 2O/H + or OH -(合成多一个碳的酸)(三)氨基取代RX ++HX NH 3:R NH 2(四)烷氧基取代(醇解) +R X +R'ONa NaXOR R'RX+ONa NaX+OR 合成不对称醚(Williamson 合成法)1、制备叔烃基型的醚时,由于叔卤代烃在碱中易发生消去反应,故选用叔醇钠与伯卤代烃反应是较为理想的路径。
2、PhX 型卤代烃活性差,但有致活基团存在则可反应:NO 2CH 3ONa +NO 2OCH 3注:NO 2对苯环的亲核取代——活化,邻对位;(NO 2对苯环的亲电取代——钝化,间位)(五)与硝酸银反应+AgX R +AgONO X EtOHRO NO 2∆用于鉴别、推测反应活性二、β-消除反应(E )C X H Cαβ存在几个β-H 时,产物遵循查氏规则。
查氏规则:①脱去H 少的β-H ;②若能生成共轭烯烃,则共轭烯烃是主产物。
查氏规则的解释:①β-H 数目↓,说明其碳上连有的烃基数↑,故产物双键碳上连有烃基数↑,π-σ数↑,烯稳定性↑,因此脱去H 少的β-H ;②共轭烯烃的稳定性好于其他类型的多烯烃,因此共轭烯烃是主产物。
示例:(1)RCH CH 2βα+醇CH 2CH+NaX +H 2O(注:氢氧化钠的醇溶液)(2)CH 2CH 3CH 2CHCH 3BrCHCH 3CH 3CHCH 3CH 2CH (主)(3)HCl_CH 2CH CH CH CH CH 2 CH 332CH(4)CH 2CH CH 2C CH 3HBr_CH 2CH CH C CH 3CH CH 23CH 2CH 3三、与金属反应卤代烃可以和许多金属作用,生成金属有机化合物。
有机化学基础知识点整理卤代烃和芳香卤代烃

有机化学基础知识点整理卤代烃和芳香卤代烃有机化学基础知识点整理——卤代烃和芳香卤代烃有机化学是研究有机化合物结构、性质和反应机理的学科。
其中,卤代烃和芳香卤代烃是有机化学中重要的两类化合物。
本文将对卤代烃和芳香卤代烃的基础知识点进行整理。
一、卤代烃(Haloalkane)卤代烃是指分子中含有卤素(氟、氯、溴、碘)取代烷烃中一个或多个氢原子的有机化合物。
其命名规则为:将与卤素相连的碳原子编号,并在化合物名称前面加上对应的前缀(氟代、氯代、溴代、碘代)。
例如:氯甲烷、溴乙烷。
1. 卤代烃的性质卤代烃具有以下几个特点:(1)沸点和熔点较低,易挥发;(2)极性较大,易溶于极性溶剂;(3)在碱性条件下容易发生亲核取代反应,生成醇、醚等有机物。
2. 卤代烃的反应(1)亲核取代反应(Nucleophilic Substitution):亲核试剂(如:氢氧根离子、氨水等)与卤代烃发生反应,取代卤素,生成新的有机化合物。
常见的亲核取代反应有SN1和SN2反应机理。
(2)消除反应(Elimination):卤代烃在强碱存在下,失去卤素和氢,生成烯烃等不饱和化合物。
常见的消除反应有E1和E2反应机理。
二、芳香卤代烃(Aryl Halide)芳香卤代烃是指分子中含有卤素取代苯环上一个或多个氢原子的有机化合物。
芳香卤代烃的命名规则为:将卤素的名称直接作为苯环的前缀,并标注位置。
例如:氯苯、溴苯。
1. 芳香卤代烃的性质芳香卤代烃具有以下特点:(1)稳定性较高,不易发生反应,需要较强的反应条件;(2)熔点和沸点较高,不易挥发;(3)极性较低,通常不易溶于极性溶剂。
2. 芳香卤代烃的反应(1)亲电取代反应(Electrophilic Substitution):芳香卤代烃的反应以亲电试剂与苯环发生反应为主,取代卤素。
常见的亲电取代反应有取代、硝化、氨基化等。
(2)金属-卤素交换反应(Metal-Halogen Exchange):芳香卤代烃与金属(如锂、镁)反应,去除卤素,生成芳基金属化合物。
卤代烃的化学性质及在有机合成中的应用

卤代烃的化学性质及在有机合成中的应用卤代烃是一类重要的烃的衍生物,它是联系烃和烃的衍生物的桥梁,新的教学大纲规定,要求学生掌握卤代烃的性质,同时卤代烃这一内容又是新教材中新增内容之一,也是高考中的热点内容之一,应加以重视。
本文仅对卤代烃的化学性质及其在有机合成中的应用,结合近年来的高考试题加以分析和归纳。
一、卤代烃的化学性质1.取代反应由于卤素原子吸引电子能力大,使卤代烃分子中的C—X键具有较强的极性,当C—X键遇到其它极性试剂时,卤素原子就易被其它原子或原子团所取代。
(1)被羟基取代R—X +H2O R—OH +NaX(2)被烷氧基取代卤代烃与醇钠作用,卤原子被烷氧基(RO—)取代生成醚。
如:CH3Br + CH3CH2ONa→CH3—O—CH2CH3+NaBr(3)被氰基取代卤代烃与氰化物的醇溶液共热,卤原子被氰基所取代生成腈,如:R—X +NaCN RCN+ NaX生成的腈分子比原来的卤代烃分子增加了一个碳原子,这是有机合成中增长碳链的一种方法。
2.消去反应卤代烃在碱的醇溶液中加热,可消去一个卤化氢分子,生成不饱和烃。
如:RCH2CH2—X+KOH RCH = CH2 +KX +H2O3.与金属反应卤代烃能与多种金属作用,生成金属有机化合物,其中格氏试剂是金属有机化合物中最重要的一类化合物,是有机合成中非常重要的试剂之一,它是卤代烷在乙醚中与金属镁作用,生成的有机镁化合物,再与活泼的卤代烃反应,生成更长碳链的烃。
RX +Mg RMgXCH2=CHCH2Cl+RMgCl →CH2=CHCH2R +MgCl2卤代烷与金属钠反应可生成烷烃,利用此反应可制备高级烷烃。
2RBr +2Na →R—R +2NaBr二、卤代烃在有机合成中的应用1.烃与卤代之间的转化例1.(2002·广东卷)卤代烃在碱性醇溶液中能发生消去反应。
例如该反应式也可表示为下面是八个有机化合物的转换关系请回答下列问题:(1)根据系统命名法,化合物A的名称是。
教学重点(1)卤代烃的化学性质及其制备方法(2)SN2(精)

氯甲烷 碘代仲丁烷 甲基氯 仲丁基碘 methyl chloride sec-butyl iodide
氯代叔丁烷 叔丁基 tert-butyl chloride
二、命名
2、较复杂的卤代烃 按系统命名法命名;卤原子作为取代基。一般是以含卤原 子的最长碳链作为主链。英文命名时分别将卤原子以词头 氟(fluoro)、氯(chloro)、溴(bromo)、碘(iodo) 表示之。
二、命名
5、卤代环烷烃的命名
环烷烃烃为母体,卤原子为取代基。
Br CH3
(1R,2S)--1—甲基—2—溴环己烷 (1S,2R)--1—bromo—2--methylcyclohexane
第一节 卤代烃的分类、命名及同分异构体
三、同分异构现象
碳干异构、卤原子的位置异构。比烷烃更多异构体。
B、与金属锂的反应
CH3CH2CH2CH2Br ( C2H5)2O CH3CH2CH2CH2Li Li 10 0 C 80--90% LiBr
烷基锂和格氏试剂一样,遇含活泼氢的化合物 也会分解。烷基锂与碘化亚铜反应生成二烷基 铜锂。
2
CH3CH2CH2CH2Li
CuI
( C2H5 )2O
(CH3CH2CH2CH2)2CuLi
微热一分钟
2、消除反应
(3)反应的选则性
消除反应有时可以在碳链的两个不同方向进行;实验证明,反 应的主产物是双键碳上连接烃基最多的烯烃。这个经验规律叫 做札依采夫(Saytzeff)规则。
CH3 CH3CH2CCH3 Br KOH C2H5OH CH3 CH3CH==CCH3
71
0 0
CH3CH2CHCH3 Br
卤代烃和醇的化学性质

消去反应
定义:卤代烃在强碱的作用下,消除 卤素原子和烃基相连的氢原子,生成 不饱和键的反应。
条件:强碱(如氢氧化钠、乙醇钠等) 和加热。
反应机理:卤代烃分子中的卤素 原子与强碱的阴离子形成配位键, 同时消去氢原子,生成烯烃。
实例:以溴乙烷为例,其消去反应生 成乙烯和溴化钠。
氧化反应
卤代烃在氧化 剂的作用下, 可被氧化为醛 或酮或羧酸。
氧化反应
醇可以被氧化 生成醛
醇可以被氧化 生成酮
醇可以被氧化 生成羧酸
醇的氧化反应 可以用于合成 有机化合物
酯化反应
定义:醇与羧酸或 含氧无机酸反应生 成酯和水的反应
反应机理:醇脱去 羟基,羧酸脱去羧 基,形成酯键
催化剂:硫酸、 盐酸、磷酸等强 酸
应用:合成有机化 合物的重要反应, 在工业上有广泛应 用
卤化钠
卤代烃与硝 酸银反应生 成卤化银沉
淀
水解反应
卤代烃与水在酸或碱的催化下发生水解反应,生成醇和卤化氢。 水解反应是可逆的,反应速度受卤素取代基的影响,卤素原子越多,反应速度越慢。 水解反应是卤代烃的重要化学性质之一,也是卤代烃与醇之间的转化途径之一。 在工业生产和实验室中,水解反应的应用广泛,如制备醇、分离混合物等。
卤代烃的氧化 反应通常需要 在强烈的氧化 条件下进行。
卤代烃的氧化 产物取决于所 使用的氧化剂 和反应条件。
在某些条件下, 卤代烃可以通 过氧化反应生 成醇或醚等其 他类型的化合 物。
02
醇的化学性质
取代反应
醇与羧酸反应 生成酯
醇与氢卤酸反 应生成卤代烃 和水
醇与硝酸反应 生成硝基化合 物
醇与硫酸反应 生成硫酸酯
脱水反应
醇与浓硫酸共热至170℃,发生消去反应生成不饱和键 醇与氧化铜加热发生氧化反应生成醛或酮 醇与氢气发生还原反应生成饱和烃 醇与羧酸发生酯化反应生成酯
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2-1-4卤代烃的性质
【任务】
1.能类比溴乙烷的性质理解并熟记卤代烃的性质。
2.能区分卤代烃的水解反应和消去反应;能判断卤代烃能否发生水解或消去反应及其产物种类。
二、化学性质
1. 水解反应——
①反应条件:
②本质:水分子中的 取代了卤代烃分子中的
R-Br +NaOH ――→H 2O
2.消去反应
①反应条件:
②结构要求:a.卤代烃分子中的碳原子数≥
b.卤素原子所连 上必须有氢原子。
如:(CH 3)3C-CH 2X 不能发生消去反应
③消去规律:
a. 邻二卤代烃的消去反应:可以消去两分子HX 分子,变为炔烃。
R 1CHXCHXR 2+NaOH ――→乙醇
△
b. 含有多个β-H 的卤代烃的消去反应:可生成多种不饱和烃,其中以生成的不饱和碳碳键上连接烃基较多的产物为主。
RCH 2CHXCH 3+NaOH ――→乙醇△
【知识小结】 卤代烃的消去反应与水解反应的比较
水解反应
消去反应 反应条件 NaOH 的水溶液,常温或加热 NaOH 的醇溶液,加热
反应实质
结构特点 卤代烃碳原子上连有—X β位碳原子上必须有氢原子
产物特点 引入—OH ,生成醇或酚
消去HX ,生成碳碳双键或碳碳
叁键,生成烯烃或炔烃
【任务检测】
1.下列化合物中,既能发生水解反应,又能发生消去反应,且消去反应生成的烯烃不存在同分异构体的是( )
2.卤代烃RCH 2CH 2X 中化学键如下,则下列说法中正确的是( )
A .当该卤代烃发生水解反应时,被破坏的键是①和③
B .当该卤代烃发生水解反应时,被破坏的键是①
C .当该卤代烃发生消去反应时,被破坏的键是①和④
D .当该卤代烃发生消去反应时,被破坏的键是①和②
3.4-溴环己烯主要用于有机合成,它可发生如图所示的转化,下列叙述错误的是
( )
A .反应①为氧化反应,产物含有溴原子和羧基两种官能团
B .反应②为取代反应,产物含有羟基和碳碳双键两种官能团
C .反应③为消去反应,产物只含碳碳双键和溴原子两种官能团
D .反应④为加成反应,产物只含溴原子一种官能团
4.卤代烃在NaOH 溶液存在的条件下水解,是一类典型的取代反应,其实质是带负电荷的原子或原子团(如OH -等阴离子)取代了卤代烃中的卤素原子,如 CH 3CH 2CH 2—Br +OH -→CH 3CH 2CH 2—OH +Br -。
写出下列反应的化学方程式:
(1)CH 3CH 2Br 与NaHS 反应
(2)CH 3I 与CH 3COONa 反应。
