规范五部曲2
小学语文教学五部曲

中学 生心理健康教 育是 中学素质教 育的重要任务之一,尤其是处于人生观 、 世界观初步形成时期 的高中学生 ,他们经 过中考 的拼搏进入高 中阶段后 ,对未来充 满美好 的憧憬 ,面临来 自家庭 、学校乃 至 社会的压力 ,美好 的理想与 “ 残酷”的现 实形成 了巨大的反差 ,不少学生产生消极 厌学甚至悲观失望的情绪,并 由此背上沉 重的心理负担 , 严重地影响他们的学业和 身心健康 。这个同题务必引起社会各方面 的高度重视。 有厌 学问题 的学生 ,主要有 什么表 现或症状呢?如何去诊断分析呢? 行为 表现一 :对学 习功能存在 认识 偏差 , 认 为 读 书无 用 。 有 人说 “ 读 书 越多 , 收入越少”,“ 文凭越高 , 待 遇 越低 ”。这 种错 误 的认识 是对 社会 体 脑倒 挂 , 分 配 不 公 的 主 观 反 映,也是 流传 的一种 社 会偏 见在 学校中的折射。 但 无 论如 何 ,这 种 观点 对 相 当一部 分学 生产 生 了不 良影 响 ,是 厌学 症 产 生 一 种 主 要 的 社 会 文 化 因素 之一 。 “ 读书 无 用 论 ”是 厌 学者 调节 心 河 理平衡的精神支柱 。 行 为 表现 二 :对 学
充分发挥学生的主观能动性教师应注重学生的主体地ቤተ መጻሕፍቲ ባይዱ学生也更应该提高对自己占据主体地位的认知性成为知识的探索器而不是接收器能发表自己的见解师生之间能够相互讨论从而发展自己的自主学习能学习的开放性与合作性学生学习的不受地点时间的限制注重学生自主选择学习的方法内容学习计划都有自己制定学习更加开放自主学习的开放性又促进了学生之间的合作性与交流性学生根据自身的学习情况与学习特点自主的选择自己的学习伙伴在学习过程中能够做到相互探讨交流不存在个人学习的封闭性能更好吸取他人的长处及时弥补自身的不足
药店销售五部曲

第二步:确定治疗方案
操作要点: 1、仔细分析病情、与顾客共同分析疾病的治疗原则、而不是直接告诉具体用哪些药, 2. 通过一些技巧让顾客联想到他原本想买的药品的局限性 3. 所下的治疗方案必须为所荐的药品做铺垫
如:面对经常口腔溃疡的患者 面对经常感冒的患者 面对经常感冒的儿童(幼儿)
第三步了解病情,答疑解惑
顾客:这个能断根吗?那要怎么才能不反复发作呢?
店员:
第三步
三:了解病情,答疑解惑 询问的关键: 1.顾客来药店里想买的药品是什么 2.家里还有什么药品 3.顾客最想知道的是什么,如何适当制造痛苦 要点:利用适当的方法让顾客认为我们不是为卖药而是 为他服务,是为他的健康服务
第三步
三:了解病情,答疑解惑 询问的关键: 1.顾客来药店里想买的药品是什么 2.家里还有什么药品 3.顾客最想知道的是什么,如何适当制造痛苦 要点:利用适当的方法让顾客认为我们不是为卖药而是 为他服务,是为他的健康服务
促进成交的发问技巧
• 在问的过程中体验顾客
• 了解顾客需求与潜在需求,研读顾客类型
要酸的? 要甜的?
我有 李子卖
为什么买酸的? 她还需要什么?
第三步
三:了解病情,答疑解惑 询问的关键: 1.顾客来药店里想买的药品是什么 2.家里还有什么药品 3.顾客最想知道的是什么,如何适当制造痛苦 要点:利用适当的方法让顾客认为我们不是为卖药而是 为他服务,是为他的健康服务
问病流程五步曲
专业服务系列课程 卢圣芳
大纲
五步流程 理论篇
案例分享 实践篇
一:掌握病情
要点 : 1、 开放式问话 2、不可推明确的药品
目的:仔细询问病情,了解顾客病情发展的来龙去脉,了解分析顾客的用药情况 制造一定的痛苦,让顾客急需知道他的治疗方案 此阶段切不可推明确的药品
班主任工作“五部曲”

班主任工作“五部曲”班主任是中小学教师的重要角色之一,担负着学生全面发展和教育教学管理的重要责任。
为了顺利完成班主任工作,班主任需要按照以下的“五部曲”来进行工作。
第一部曲:了解学生作为班主任,首先要了解自己所带班级的每个学生。
班主任应该尽早与学生建立良好的关系,了解他们的家庭情况、性格特点、学习能力和兴趣爱好等信息。
这样可以更好地把握学生的需求,更有针对性地开展工作。
了解学生的方法可以通过与学生进行面谈、观察和交流等。
班主任还可以与学生的家长进行联系,了解学生在家庭环境中的情况,并及时与家长沟通学生在学校的表现和需要改进的方面。
第二部曲:管理班级班主任需要对所带班级进行全面的管理工作。
在班级管理中,班主任需要制定班级规章制度和班级管理计划,并将其落实到每个学生身上。
班主任还应该认真了解学生的行为表现,及时进行纠正,引导学生良好的行为习惯。
管理班级还包括组织班级活动,如班会、集体活动、文体赛等。
这些活动可以增强学生之间的交流和凝聚力,促进学生成长和发展。
第三部曲:教育学生班主任不仅是学生的管理者,更是学生的教育者。
班主任要注重培养学生的综合素质,培养学生的学习兴趣和能力。
除了传授知识外,班主任还应该引导学生树立正确的人生观和价值观,培养学生的社会责任感和公民意识。
教育学生的方法可以通过组织讲座、班会、心理辅导等。
班主任还可以为学生提供学习辅导和个别指导,帮助学生解决学习和生活中的问题。
第四部曲:与家长合作家校合作是班主任工作的重要内容之一。
班主任要与家长保持密切的联系,及时了解学生在家庭中的情况,解决学生在学校和家庭中的问题。
与家长的沟通交流可以增进双方的了解和信任,从而更好地促进学生的发展。
班主任可以通过学校家长会、家长讲座和家访等方式与家长建立联系。
在与家长交流中,班主任要及时向家长反馈学生在学校中的表现和学习情况,并听取家长的意见和建议。
第五部曲:自我发展班主任作为教育工作者,要不断提高自身的教育教学水平和综合素质。
浅谈小学数学课堂的“五部曲”

浅谈小学数学课堂的“五部曲”小学数学课堂的“五部曲”是指数学课堂教学的五个环节,包括情境引入、学习导入、新课讲解、练习巩固和作业布置。
这种教学模式有助于激发学生的学习兴趣,提高学生的学习效果和能力。
情境引入是数学课堂的第一个环节。
通过生动的实践活动或具体的示例,引导学生了解数学知识的应用领域和实际意义,激发学生的兴趣,为后续学习做好铺垫。
老师可以讲述一个有趣的故事,引导学生思考和讨论相应的数学问题。
学习导入是数学课堂的第二个环节。
在这个环节中,老师可以通过查缺补漏、复习之前学习的知识点等方式,帮助学生温习和回顾已学过的内容,拉近学生与新知识的距离。
老师可以给学生出一些简单的练习题,让学生复习和回忆相应的数学知识。
第三个环节是新课讲解。
在这个环节中,老师会详细讲解新的数学知识和概念,并通过具体的例题进行演示和分析。
在讲解过程中,老师要注重启发学生的思维,引导学生主动思考和探索问题的解决方法。
老师还要解答学生提出的问题,帮助他们理解和消除疑惑。
第四个环节是练习巩固。
在这个环节中,老师会给学生出一些练习题,让学生运用新学的知识解决实际问题。
通过练习,学生可以巩固和运用所学的知识,提高解决问题的能力和技巧。
老师还可以组织学生之间的讨论和合作,促进学生之间的交流和学习。
小学数学课堂的“五部曲”是一种有效的教学模式,可以帮助学生更好地学习和理解数学知识。
在这种教学模式下,教师的角色是引导者和指导者,学生是主体和参与者,通过教师的引导和学生的参与,可以达到提高学生学习兴趣和能力的目的。
销售五部曲

销售五部曲一、建立联系(即欢迎与接待)1 销售人员主动向顾客打招呼并展开销售1、问好式2 在问好中加上活动信息或产品卖点问好即打招呼,微笑!真诚的微笑是你赢得顾客的法宝!迎接顾客,也就是要与顾客交谈,销售人员积极友好的态度,对于销售来说是一个非常良好的开端。
同样,一个良好的开端还需要有一个精心设置的问题。
举例1:销售人员会问顾客“您需要什么?”这是例行公事的职业口吻!一定要避免,大多数情况下顾客会马上摇摇头走开或者说随便看看,慢慢走开。
很少有顾客会直接了当的告诉你他需要什么,除非他已经确认自己需要什么。
举例2:销售人员“您需要xxx吗?”这种废话在我们的销售过程中不允许出现。
这种问题对于一个随便看看的顾客来说可能会吓一跳。
以上的两个例子中,销售员还没有与顾客交谈,还不了解顾客的需求便让销售过程停止了。
因为销售员一开始就向顾客进行了索取,要他回答一个难以回答的问题。
可以这样:例1:顾客只是随便看看。
处理方式:销售人员可以这样开始:“这是xxx产品的区域,有新品/有打折的商品”或“我们现在在进行xxx活动”。
例2:顾客已在看某一产品。
处理方式:销售人员:“这是xxx产品,它是xxx用的,具有xxx功能,有什么养的好处或区别于其他产品或品牌的优势......”要用尽量少的语言介绍产品或独特地方。
例3:顾客的眼光在柜台来回扫视。
处理方式:销售人员应及时捕捉顾客的眼神并与之进行目光交流,向顾客介绍:“这是我们xxx区域,主要有xxx产品”,简单表述一下。
我们通过上述例子不难看出,浏览的顾客通常是已在看某种商品、某类产品或某件产品,而顾客已经少许产生了一些他们的兴趣,所以销售员应该对他们正在看的东西给予相关的说明,说明后多半会引起顾客的一些问题和判断,这往往是销售员需要获得的关于顾客的需求。
可见,一个好的开端是以为顾客提供给予开始的,给予顾客一种服务,一种说明。
所以作为一个成功的销售员,需要牢记永远不要向顾客索取什么,哪怕是一种回答。
GFI _216 - Final Guidance -CMC- Fermentation-2[1]
![GFI _216 - Final Guidance -CMC- Fermentation-2[1]](https://img.taocdn.com/s3/m/3c76621aa300a6c30c229f21.png)
#216 Guidance for Industry Chemistry, Manufacturing, and Controls (CMC) Information — Fermentation-Derived Intermediates, Drug Substances, and RelatedDrug Products for Veterinary Medicinal Use Comments and suggestions regarding this guidance should be sent to the Division of Dockets Management (HFA-305), Food and Drug Administration, 5630 Fishers Lane, Room 1061, Rockville, MD 20852. Comments can be submitted electronically on the Internet at. All written comments should be identified with the Docket No.FDA-2011-D-0112.For questions regarding this document, contact Michael J. Popek, Center for Veterinary Medicine, (HFV-144), Food and Drug Administration, 7500 Standish Place, Rockville, MD 20855, (240) 276-8269, e-mail: michael.popek@.Additional copies of this guidance document can be requested from the Communications Staff (HFV-12), Center for Veterinary Medicine, Food and Drug Administration, 7519 Standish Place, Rockville, MD 20855, and may be viewed on the Internet at/AnimalVeterinary/GuidanceComplianceEnforcement/GuidanceforIndustry/d efault.htm.U.S. Department of Health and Human ServicesFood and Drug AdministrationCenter for Veterinary MedicineMarch 8, 2012TABLE OF CONTENTSI.INTRODUCTION (4)II.BACKGROUND (4)III.SCOPE (5)IV.INTERMEDIATES, DRUG SUBSTANCES, DRUG PRODUCTS (5)A.Identification of Manufacturing Facilities (6)B.Description of Manufacturing Process and Controls (6)1.Pharmaceutical Development Reports (6)2.Cell Growth (Propagation) and Harvest (6)3.Purification and Downstream Processing (7)4.Modification Reactions (If Applicable) (8)a.Chemical Modifications (8)b.Enzymatic Modifications (8)5. Reprocessing, Reworking, Recycling, Regeneration, and Salvaging (8)C.Control of Materials (8)1. Microorganism (8)2.Cell Bank System (9)a.Master Cell Bank (9)b.Working Cell Bank (9)3.Media Components (9)4.Solvents, Reagents, Auxiliary Materials (9)D.Control of Critical Steps and Intermediates (10)E.Non-Critical In-Process Controls (10)F.Process Validation and/or Evaluation (10)G.Characterization (10)1.Elucidation of Structure and other Characteristics (10)a.Structural Elucidation (11)b.Physicochemical Characterization (11)c.Biological Activity (11)2.Impurities (11)3.Degradation Products (13)H.Control of Intermediates, Drug Substances, and Drug Products (13)1.Specifications (13)2.Analytical Procedures (13)3.Validation of Analytical Procedures (14)4.Reference Standards or Materials (14)5.Batch Analyses (14)I.Container Closure System (14)beling (14)K.Stability Summary and Conclusions (15)1.Batch Selection for Stability Studies (15)2.Expiration Date versus Retest Date (15)3.Postapproval Stability Protocol and Commitment (16)4.Stability Data (16)Guidance for IndustryChemistry, Manufacturing, and Controls (CMC) Information — Fermentation-Derived Intermediates, Drug Substances, and Related Drug Products for Veterinary Medicinal UseThis will represent the Center’s current thinking on the topic. It does not create or confer any rights for or on any person and does not operate to bind FDA or the public. You can use an alternative approach if the approach satisfies the requirements of the applicable statutes and regulations. If you want to discuss an alternative approach, contact the FDA staff responsible for implementing this guidance. If you cannot identify the appropriate FDA staff, call the appropriate number listed on the title page of this guidance.I. INTRODUCTIONThis guidance provides recommendations on what documentation to submit to support the chemistry, manufacturing, and controls (CMC) information for fermentation-derived intermediates, drug substances, and related drug products for veterinary medicinal use. This information is filed to the Center for Veterinary Medicine (CVM) in a new animal drug application (NADA), conditional new animal drug application (CNADA), investigational new animal drug file (INAD), abbreviated new animal drug application (ANADA), generic investigational new animal drug file (JINAD), drug master file (DMF), or veterinary master file (VMF).FDA’s guidance documents, including this guidance, do not establish legally enforceable responsibilities. Instead, guidances describe the Agency’s current thinking on a topic and should be viewed only as recommendations, unless specific regulatory or statutory requirements are cited. The use of the word should in Agency guidances means that something is suggested or recommended, but not required.II. BACKGROUNDFermentation processes are frequently used to manufacture intermediates, drug substances, and related drug products for veterinary medicinal use. Traditionally, most manufactured fermentation products were extracted from the media or cell mass and either further purified or molecularly modified to create another entity. Today, a variety of products are manufactured from fermentation processes, including:∙Biomass products (i.e., drug and cell mass constitute the product)∙Competitive exclusion products (i.e., the product consists of one or more microorganisms intended to exclude harmful bacteria, such as Salmonella, from colonizing)∙Biotech productsBacteriophage productsMicrobial systems can introduce manufacturing variability that can affect the purity and quality, and ultimately, the safety and effectiveness of a product, if not controlled. Even though fermentation is a common manufacturing practice, CVM currently provides no CMC guidance to pharmaceutical sponsors about fermentation-derived intermediates, drug substances, or related drug products.III. SCOPEFiling information for the CMC of a new animal drug application is described in 21 CFR 514. The first specific mention of CMC requirements for fermentation products occurs in 21 CFR 514.1(b)(4)(iii)(a-e) in the Component and Composition section. Most other required CMC information is described in 21 CFR 514.1(b)(5). This guidance provides recommendations for CMC information to support fermentation-derived intermediates, drug substances, and related drug products intended for veterinary use.The information in this guidance loosely follows the International Conference on Harmonisation (ICH) Common Technical Document (CTD). Due to the redundancy of information between fermentation-derived intermediates, drug substances, and drug products, sections were combined and are not specifically labeled in the CTD format (e.g. Description of Manufacturing Process and Process Controls (S.2.2)). In addition, some CTD sections may have been omitted as they are common to all intermediates, drug substances, and drug products (e.g. General Information), whether or not they relate to fermentation. CVM will accept quality related documents in CTD format.This guidance does not address postapproval changes associated with fermentation-derived products. Although the guidance addresses fermentation issues associated with semi-synthetic drug substances, it only provides limited information for some semi-synthetic steps post-fermentation. More detailed post-fermentation recommendations can be found in the CVM guidance for industry 169: Drug Substance Chemistry, Manufacturing, and Controls Information. Additionally, this guidance does not address special characterization and control requirements for biomass, competitive exclusion, phage, and other fermentation-related products produced by microorganisms genetically engineered using recombinant DNA (rDNA) technology. Even though these products are not specifically covered, the underlying fermentation principles described in this document would be applicable to these products as well.SUBSTANCES, DRUG PRODUCTSIV. INTERMEDIATES,DRUGCMC information for fermentation-derived intermediates, drug substances, and related drug products can be provided directly in a NADA, CNADA, INAD, ANADA, or JINAD. Typically, the information for intermediates and drug substances are provided by reference to a DMF or a VMF.Master files provide an avenue for manufacturers to submit proprietary information to the Agency without submitting that information to the applicant. Master files can also be used by a drug sponsor as an organizational tool for different processes (e.g., to separate the process for drug substance manufacturing from the finished dosage form process). For the Agency to review aDMF or VMF, a letter of authorization (LOA) from the DMF or VMF holder should be submitted as part of the referencing submission provided by the applicant.The following describes information that should be provided in either a master file(s) or an application, depending on which is used.A. Identification of Manufacturing FacilitiesFacilities involved in the manufacture and/or testing (including contract manufacturers and testing laboratories) of fermentation-derived intermediates, drug substances, and related drug products should be identified. The name, address, and manufacturing responsibility operations/processes performed should be provided for each firm.B. Description of Manufacturing Process and ControlsA detailed description of the manufacturing process and process controls should be provided for intermediates, drug substances, and related drug products:∙Describe the entire process (including original inoculum, propagation, harvest, isolation/purification, and any modification reactions)∙Identify all process controlsFor drug products, a master batch record covering the entire process including original inoculum, propagation, harvest, isolation/purification, and any modification reactions should be provided. Recommendations for executed (completed) batch records are provided in CVM guidance for industry 42: Animal Drug Manufacturing Guidelines-Series of Four Guidelines (1994). CVM encourages the submission of executed batch records for lots of drug substance and drug product used in support of the application as they provide valuable detail and insight into the manufacturing process and proposed controls.1. Pharmaceutical Development ReportsSponsors are encouraged to provide pharmaceutical development reports (PDRs) that describe the scientific rationale for the chosen manufacturing process(es) and controls for fermentation-derived intermediates, drug substances, and related drug products. A sponsor’s ability to demonstrate process understanding can be factored into CVM’s risk-based decision making (e.g., Pre-Approval Inspection Decision Support System (PAIDSS)). Suggestions for PDRs can be found in ICH Q8: Pharmaceutical Development.2. Cell Growth (Propagation) and HarvestA description should be provided that includes a flow diagram illustrating each step in propagation from the original inoculum (e.g., cells from one or more vials of the working cell bank) through the last harvesting operation.∙All steps should be included along with the relevant information, such as the growth conditions and in-process tests performed (e.g., cell concentrations, volumes, pH,cultivation times, temperatures).∙Critical steps and intermediates for which specifications are established should be identified, along with sampling plans and testing time points.∙The flow diagram can be supplemented with information presented in tabular form, if appropriate.A narrative describing each manufacturing step in the process should accompany the flow diagram:∙Identify all process controls and the associated numeric ranges, limits, or acceptance criteria∙Highlight any process controls that are considered critical∙Identify the intended scale of the process. The amounts indicated should be representative of a maximum-sized production batch.We recommend the following be included in the narrative:∙ A description of the major equipment involved in each step∙ A description of inoculation and each step in propagation with growth conditions specified∙The composition of the media used at each step, including water quality and additives used∙The sterilization procedures for media (e.g. a batch sterilization process or continuous system)∙The equipment (e.g. fermentation vessel), feeds, and other materials added during the fermentation process∙Process parameters monitored and controls for critical steps and intermediates∙Procedures used to transfer material between steps∙Procedures used to minimize contamination by adventitious agents∙Process controls to confirm the effectiveness of the specific manufacturing steps used to inactivate and or remove adventitious agents∙Criteria for harvesting∙Criteria for rejecting/accepting a fermentation batch if contamination occurs∙The determination of yields∙Criteria for pooling more than one harvest, if applicable∙Storage conditions and time limits if the harvested crude fermentation product is held prior to further processing3. Purification and Downstream ProcessingThe description should include a flow diagram that illustrates and a narrative that describes all the steps involved in isolating and purifying the crude fermentation product to its final form, along with any relevant information (e.g., volumes, pH, temperatures, holding times). Critical steps and intermediates for which specifications are established should be identified, along with testing time points.The narrative describing each manufacturing step should accompany the flow diagram and should identify all process controls and the associated numeric ranges, limits, or acceptance criteria and include the following:∙Methods used in purification or separation of the crude fermentation product (e.g.precipitation, centrifugation, filtration) including major equipment (e.g. columns, membranes∙Process parameters monitored∙The in-process controls and analytical tests used to show identity, purity, and concentration and to evaluate levels of process- and product-related impurities ∙The determination of yields∙Precautions taken to prevent or control microbial contamination during purification∙Conditions for reuse and/or procedures for regeneration of columns, membranes, and adsorbents∙Storage conditions and time limits, if the purified fermentation product is held prior to further processingReactions (If Applicable)4. Modificationa. ChemicalModificat ionsWhen a product of fermentation is to be subjected to further molecular change through chemical means, a description of the synthetic steps should be included in the procedural narrative. Additionally, a flow diagram of the synthetic process should be provided. For more details, see CVM guidance for industry 169: Drug Substance: Chemistry, Manufacturing, and Controls Information.Modificationsb. EnzymaticWhen the fermentation product is further modified using enzyme catalysts, the steps should be included in the flow diagram and detailed in the procedural narrative. Enzymatic reactions are considered chemical reactions since the conversion of substrate product involves breaking and forming chemical bonds. Thus, much of the information submitted in the manufacturing description should be the same as that submitted for chemical processes (drug substance). However, because enzymatic functionality requires carefully controlled conditions (e.g., pH, temperature, osmolarity), the description should contain detailed information on reaction controls and the optimum range of operation. Furthermore, the biological source of the enzyme should be provided along with a description of the enzyme’s preparation and information about its purity.5. Reprocessing, Reworking, Recycling, Regeneration, and SalvagingWhen appropriate, reprocessing, reworking, recycling, regeneration, and salvaging operations should be described. For more detail, see CVM guidance for industry 169: Drug Substance: Chemistry, Manufacturing, and Controls Information.MaterialsC. ControlofA list of materials used in the manufacture of fermentation-derived intermediates, drug substances, and drug products should be provided (i.e., the microorganism, cell bank system, media components, solvents, reagents, auxiliary materials). Information pertaining to the quality and control of these materials should also be provided.Microorganism1.Information about the microorganism used for production (i.e., genus, species, and type strain) and known genotypic and phenotypic characteristics should be provided. Additionally, the origin of the source material (or isolate) should be identified or described.2. Cell Bank SystemBanka. MasterCellA brief description of the procedures used to generate the master cell bank (MCB) and the criteria used for qualification should be provided. The information should include:∙Method, reagents, and media used in preparation∙Date of preparation∙Process controls∙Storage conditions∙Procedures used in testing for relevant phenotypic and genotypic markers and determining culture purity∙Procedures used to ensure the absence of contamination from adventitious agents (e.g., microbial contamination and cross–contamination by other cell types) with tests andacceptance criteria specifiedb. Working Cell BankPreservation of the microbial purity of the MCB is an important factor in maintaining the production strain. Often a working cell bank (WCB) is created so that the MCB will be less likely to be compromised. Creation of a WCB occurs via the propagation of the MCB through defined culture conditions, and then aliquots of the resultant homogenous culture suspension are partitioned into individual storage containers of appropriate size for routine production purposes.A brief description of the procedures used to derive a WCB from the MCB and the criteria used for qualification should be provided. Information similar to that submitted for the MCB should also be submitted for the WCB.Components3. MediaA list of the media components used at each stage of the fermentation process should be included in the submission. Specifications should be provided for each component for verification that the material is of suitable quality for its intended purpose.∙If ruminant-based media components are used in the fermentation process, they should comply with the proposed BSE Medical Products Rule, issued on January 12, 2007 (72FR 1582).∙All animal-derived components should be identified and appropriate mitigation steps taken to prevent the transmission of adventitious agents.4. Solvents, Reagents, Auxiliary MaterialsA list of solvents, reagents, and other auxiliary materials used in the fermentation process should be provided. Specifications for each material should be included for verification that the materialis of suitable quality for its intended purpose. When water is used in the process, it should be of an appropriate quality for its intended use.D. Control of Critical Steps and IntermediatesAll critical process controls and their associated numeric ranges, limits, or acceptance criteria should be identified and justified and a brief description of the test provided. Furthermore, any experimental data to support the justification should be included.∙Good controls are essential during fermentation to ensure product consistency.∙End product testing alone is not adequate for demonstrating a fermentation process is under control.∙Manufacturing processes, including fermentation, should be controlled to ensure that the product meets previously identified quality attributes.All controls used in determining an isolated intermediate’s acceptability for downstream processing should be identified. When the intermediate represents the end of the fermentation process and the beginning of a synthetic scheme, the controls warranted are generally more extensive than those used for other types of intermediates. For more detail, see CVM guidance for industry 169: Drug Substance: Chemistry, Manufacturing, and Controls Information.E. Non-Critical In-Process ControlsCVM encourages sponsors to identify and describe non-critical in-process controls conducted on a routine basis (e.g., carbohydrate burn rate, may affect yield, but won’t necessarily affect product quality). Although these controls may not directly demonstrate that a process produces a quality product, a description of the tests being conducted and why they are not critical, aid in demonstrating process understanding.F. Process Validation and/or EvaluationWhen a fermentation-derived intermediate, drug substance, or drug product is sterilized, the process validation information and data in support of the sterilization process(es) should be provided. Refer to CVM guidance for industry 48: For the Submission of Documentation for Sterilization Process Validation In Applications For Human And Veterinary Drug Products. Non-sterile process validation is conducted prior to commercial marketing. CVM may request that process validation protocols and data be submitted in support of manufacturing processes. Scale-up issues encountered during process validation and any modifications to the process to accommodate these issues must be reported through the appropriate postapproval submission process (see 21 CFR 514.8(b)).G. CharacterizationStructure and other Characteristicsof1. ElucidationConfirmation of the structure and characterization data for a fermentation-derived intermediate, drug substance, or drug product should be provided. When the fermentation product is a mixture of active components, isolation and purification of individual components for structural analysis and characterization may be appropriate.a. StructuralElucidationStructural confirmation using physical and chemical techniques (e.g., elemental analysis, mass spectrometry, infrared spectroscopy) should be provided for the intermediate or drug substance. Additionally, the data and details of its interpretation should be included. The amount of data warranted to support the elucidation of structure can vary depending on the complexity of the molecule. For USP labeled drug substances, structural confirmation can be accomplished by demonstrating conformance to a USP reference standard.Characterizationb. PhysicochemicalThe kind and extent of the physicochemical characterization information that should be provided depends on (1) the type of drug substance (e.g., semi-synthetic molecule, protein), (2) the type of dosage form in which the drug substance will be used, (3) the ability or tendency of the drug substance to occur in one or more solid state forms, and (4) the importance of the differences in physical characteristics of the different forms to the stability, dissolution, or bioavailability of the drug product. For more details on the type of information that should be submitted, see CVM guidance for industry 169: Drug Substance: Chemistry, Manufacturing, and Controls Information, Draft Guidance.Activityc. BiologicalWhen a biological assay (e.g., antimicrobial activity for antibiotics) is used to assesspotency/strength of the intermediate or drug substance, biological activity data should be provided to complete the characterization profile. Data should be provided on the reference standard lot or other relevant lots to demonstrate the potency/strength of the intermediate, drug substance, or drug product.In some cases, the product of fermentation is a complex mixture of major and minor components that together make up a product’s biological activity. In evaluating the impurity profile for these fermentation products, efforts should be made to identify and characterize the active components (major and minor) that contribute to the product’s overall potency and distinguish them from impurities. This may not be practical or feasible in all cases. We recommend an applicant with related questions consult the appropriate review team for additional guidance.2. ImpuritiesInformation concerning impurities in the fermentation-derived intermediate, drug substance, or drug product should be provided (e.g., organic impurities, inorganic impurities, and residual solvents).∙Impurities may derive from the manufacturing process (e.g., residual media components, residual protein and nucleic acid derived from microbial cells, processing reagents,inorganic salts, filter aids, solvents), or they may be structurally related to the desiredfermentation product, but not share the same properties with respect to biological activity, efficacy, and safety (e.g., other microbial metabolites, precursors, by-products).∙Process related impurities derived from the fermentation and downstream processing should be minimized as much as possible through the use of a well-controlled andreproducible manufacturing process.Structurally related impurities should be identified, tracked, and controlled throughout the fermentation, isolation, and purification processes.A summary should be provided of the impurities most likely to arise during the fermentation, isolation, purification, and storage (e.g., holding time) of the intermediate, drug substance, or drug product. The summary should include impurity profiles (i.e., chromatograms), test results from representative batches, and results from forced degradation studies used to identify the potential impurities that may arise during storage. The impurities reported can be of known structure, partially characterized, or unidentified. Studies done in characterizing the structure of impurities should be summarized. Documentation should also be provided demonstrating that the analytical procedures used in quantifying impurities are properly validated or qualified.The specifications for fermentation-derived intermediate, drug substance, or drug products should include limits for impurities (i.e., organic impurities, inorganic impurities, and residual solvents). Additionally, a rationale for the inclusion or exclusion of impurities in the specifications should be presented. As appropriate, this rationale should include a discussion of the impurity profiles observed in batches used for clinical, safety, and stability testing, as well as batches representative of the proposed commercial process.Although relevant guidances (92: Impurities in New Veterinary Drug Substances, VICH GL10 (R) and 93: Impurities in New Veterinary Medical Products, VICH GL11(R)) on impurities did not address fermentation products, the principles described in these guidances are still applicable. Furthermore, levels for reporting, identifying, and qualifying organic impurities as described in these guidances are applicable to non-complex, well-characterized fermentation products.For complex fermentation products that are not well-characterized in terms of structure, physicochemical properties, biological activity, and purity, it is recommended that the levels for organic impurities be determined on a case-by-case basis.The acceptable levels for organic impurities will also depend on how the fermentation product is to be used. The levels will likely be less stringent for a drug substance or an intermediate that will be subjected to further modification and/or purification compared to that of a drug product that does not undergo further processing.For inorganic impurities and residual solvents, limits should generally be based on pharmacopeial standards (e.g., USP General Chapter <467> Residual Solvents) or known safety data. Additionally, the ICH guidance Q3C Impurities: Residual Solvents or the CVM guidance 100: Impurities: Residual Solvents in New Veterinary Medical Products, Active Substances, and Excipients, VICH GL18(R) should be consulted, as appropriate.For most fermentation products (e.g., antibiotics), it is expected that purification and downstream processing effectively remove process-related impurities, such as residual media components, residual protein and nucleic acid-derived from microbial cells, and other processing reagents. Thus, in most cases, limits need not be included in the specification for these impurities. However, when studies suggest that process-related impurities are not effectively removed from the purification process, these impurities should be controlled with limits in the specifications, as appropriate.Microbial impurities tests (e.g., for endotoxins) for drug products may be required based on the intended route of administration of the drug product in accordance with 21 CFR 514.1(5)(xi). In some instances when there is a safety concern, drug substances (e.g., gentamicin sulfate) may。
单三部曲式

三、单三部曲式的附加结构
作为其它曲式组成部分的单三部曲式一般没有引子、连接、 作为其它曲式组成部分的单三部曲式一般没有引子、连接、 尾声,而作为独立作品的单三部曲式则往往有引子、连接、 尾声,而作为独立作品的单三部曲式则往往有引子、连接、 尾声。 尾声。 由于单三部曲式的结构规模与乐思容量具有很大的伸缩性 和灵活性,所以可能出现较大规模的连接或尾声。 和灵活性,所以可能出现较大规模的连接或尾声。连接一 般出现在中部与再现部之间, 般出现在中部与再现部之间,有时中部的尾部常化为连接 而形成开放1、再现单三部曲式 、 基本图示:┌──A──┐┌──B───┐┌──A──┐ 基本图示: a a1 b b1 a a2 ┨┠──┼──┨ ┠──┼──┨ ┠──┼──┨┠ ┨┠ ┨ ┨ (1)结构特征: )结构特征: A 乐段 乐段——可能由各类乐段构成,包括复乐段、扩充展开 可能由各类乐段构成, 可能由各类乐段构成 包括复乐段、 型乐段。 型乐段。 B乐段 乐段——称为中部。 称为中部。 乐段 称为中部
单三部曲式实例分析曲目
9、门德尔松《威尼斯船歌》(第一册第32页) 、门德尔松《威尼斯船歌》 第一册第 页 10、门德尔松《失掉的欢乐》(第一册第34页) 、门德尔松《失掉的欢乐》 第一册第 页 11、贝多芬《命运交响曲》第三乐章(第二册第204页) 、贝多芬《命运交响曲》第三乐章(第二册第 页 12、肖邦《玛祖卡》(第一册第81页) 、肖邦《玛祖卡》 第一册第 页 13、舒伯特《我的家》(第一册第75页) 、舒伯特《我的家》 第一册第 页 14、蒋祖馨《老人的故事》(第一册第59页) 、蒋祖馨《老人的故事》 第一册第 页 15、贺绿汀《摇篮曲》(第一册第56页) 、贺绿汀《摇篮曲》 第一册第 页
一、概述
单三部曲式由三部分组成,每部分为乐段或相当于乐段的 单三部曲式由三部分组成, 结构。 结构。 由于单三部曲式的结构平衡点处在曲式的中部,所以,单 由于单三部曲式的结构平衡点处在曲式的中部,所以, 三部曲式的结构规模与乐思容量具有很大的伸缩性和灵活 性。 单三部曲式可作为独立作品应用,也可作为其它曲式的组 单三部曲式可作为独立作品应用, 成部分。 成部分。
浅谈语文教学“五部曲”——听、说、读、写、译

新课标指出:“要让学生充分的读,在读中整体感知,在读中有所感悟,在读中受到情感的熏陶。”“书读百遍、其义自见”、“熟读唐诗三百首,不会写诗也会吟”。悦耳的声音、起伏的语调、适宜的节奏,可以激起学生对美的内容的兴趣,发挥出文学作品高度的表现力和感染力,使学生充分感受美。学生在朗读中感受作品的语言,领悟作品的气势章法,探究文本内在的含义,产生情感共鸣,理解言外之意。因此,语文课上就应该让学生真真切切地读,仔仔细细地品,咀嚼揣摩,吟咏成诵。要大声地读,读得痛快淋漓。
五、译
学习古代汉语,需要经常把古文译成现代汉语。做好古文翻译,重要的问题是准确地理解古文,这是翻译的基础。因为古文今译的过程是加深理解和全面运用古汉语知识解决实际问题的过程,也是综合考察古代汉语水平的过程。学习古代汉语,应该重视古文翻译的训练。古文翻译的要求一般归纳为信、达、雅三项。“信”是指译文要准确地反映原作的含义,避免曲解原文内容。“达”是指译文应该通顺、晓畅,符合现代汉语语法规范。“信”和“达”是紧密相关的。脱离了“信”而求“达”,不能称为翻译;只求“信”而不顾“达”,也不是好的译文。因此“信”和“达”是文言文翻译的基本要求。“雅”是指译文不仅准确、通顺,而且生动、优美,能再现原作的风格神韵。
二、说
语文新课标明确要求:说话方面要养成“语音清晰,意思明白,条理清楚,态度自然,有礼貌”的习惯。结合教材内容,让学生多角度多层次地进行说话训练,不仅是深入理解课文的需要,也是提高说话能力的有效途径。让学生细读课文后,说出自己最感兴趣的、最受启发的、语句最优美的片段,说出对文章的感受,美在什么地方,创造出人人发言,各抒己见的氛围,要想方设法紧紧依托课文所提供的场景和重点词句,激发学生的用语兴趣,轻装上阵,言之有理即可,在循序渐进的说话训练中让学生思维敏捷、兴趣盎然、妙语连珠,彰显语文教学之本色。
写好发言稿需奏响“五部曲”

写好发言稿需奏响“五部曲”尊敬的各位领导、亲爱的同事们:大家上午好!首先,我感谢大家对我的信任,给我这次演讲的机会。
今天,我想与大家分享的是关于写好发言稿的“五部曲”。
正如我们所知道的,一个好的发言稿能够让我们表达自己的观点,向他人传递正确的信息,并达到沟通的目的。
而写好发言稿并不是一件容易的事情,它需要我们在准备、结构、内容、语言和表达等方面进行一系列的努力。
下面,我将详细介绍这五个重要的步骤。
第一步是准备:在开始写发言稿之前,我们要对主题进行充分的准备和研究。
这包括收集相关的资料和信息,了解听众的背景和需求,从而能够更好地把握主题和角度。
只有准备充分,我们才能有针对性地写出一个有逻辑和说服力的发言稿。
第二步是结构:一个好的发言稿应该有清晰的结构,包括引言、主体和结尾。
引言的目的是引起听众的注意,概括主题,并引出自己的观点。
主体部分应该包含主要的论据和事实,以支持我们的观点。
结尾部分应该总结发言的要点,并给听众一个深刻的印象。
第三步是内容:一个好的发言稿应该有一个明确的中心思想,并层次分明地展开。
我们可以通过列出主要的观点和论据,然后按照逻辑的顺序进行讲述。
同时,我们还可以通过举例、引用专家的观点和提出问题等方式来充实内容,从而增强说服力。
第四步是语言:一个好的发言稿应该使用简洁、生动的语言来表达观点。
首先,我们要尽量避免使用难懂的专业术语和复杂的句子结构,以免给听众带来困扰。
其次,我们要注意使用恰当的词语和词汇,使我们的观点更加明确和具体。
最后,我们还可以通过使用一些修辞手法和幽默的元素来吸引听众的注意力。
第五步是表达:一个好的发言稿应该通过合适的语调、声音和肢体语言来表达我们的观点。
在演讲中,我们可以通过调整声音的高低、快慢和语调的变化来突出重点和加强语言的表达力。
同时,我们还可以通过肢体语言如手势和身体动作来增强自信和亲和力。
通过这五个步骤的努力,相信我们都能够写好一篇发言稿。
当然,写好发言稿只是一个开始,我们还需要通过反复修改和练习来提高我们的表达能力和演讲技巧。
写好发言稿需奏响“五部曲”

写好发言稿需奏响“五部曲”尊敬的主持人,各位领导、嘉宾、同事们:大家好!今天我非常荣幸能够在这里为大家发表演讲。
今天我想与大家分享的主题是“写一篇好的发言稿需奏响‘五部曲’”。
第一部曲:定位——正确认识发言的目的和意义好的发言稿需要清晰定位——明确发言的目的和意义。
要知道,仅仅是“发表演讲”这个目的是无法为自己的演讲定位的。
我们要想想,发言的实际目的是什么?通常而言,演讲的目的是要给听众带来一些新的思维、观点、知识、技能。
为此,我们需要充分认识到自己在演讲中要传达的信息是什么,能为听众带来什么样的价值和启示。
只有这样,才能够使得我们的演讲变得有针对性,引人入胜。
第二部曲:设计——策划发言的框架和重点好的发言稿需要有清晰的设计——即策划的框架和重点。
一篇高水平的发言稿需要有清晰的结构,让听众可以轻易地理解、同情、并接受我们给出的信息。
因此,在设计妥当的发言稿中,应当包括:引言、主题、结论等。
在这个过程中,需要饱含的是:首先,我们的发言稿应当逻辑清晰、条理分明;其次,我们对于引言的设计应当具有吸引眼球,让听众能够被我们的发言所吸引;最后,我们应当让我们的结论清晰明了,要让听众十分地清楚地了解我们所想要表达的信息。
第三部曲:文笔——培养与自己相符的语言功夫和才思好的发言稿离不开优美的文笔。
语言是一种强有力的武器。
规范优美的文字,不但能使我们的发言更具有说服力,更能为听众提供一份美好的思想享受。
一篇高水平的发言稿需要使用准确、流畅、简洁明了的措辞,更加突显我们的演讲主题,更加贴近听众的实际需求。
为此,我们不能草率从事,更应该精益求精,培养出与自己相符的语言功夫和才思。
第四部曲:灵性——传递感性、共情和鼓励好的发言稿不仅要有理性、逻辑性,还要有温情和人性。
演讲往往是情感交流的过程,必须理性与感性并重。
用自己的真诚、动人、有温度的演讲,让听众真正感受到我们所想要传递的信息,唤醒他们内心深处的共情和鼓励,让他们像我们一样积极乐观地面对生活。
训练五部曲

真功夫训练五步曲岗位核查表一、工作要求使受训者能在较短时间内熟悉岗位操作并100%的依照标准执行,现场训练一名员工完成一个岗位。
二、工作标准百分之百按标准训练。
三、工作步骤准备1、准备资料:确保有岗位表(或录像带)、试卷等;2、准备场所:确定训练地点与其区域负责人沟通好并与值班经理沟通好;3、准备自已:确定训练内容及讲授的先后顺序,与其它组长沟通好确保受训时间内不被干扰;4、准备受训人:与受训人沟通好,做好准备工作并确保受训期间不被打扰。
介绍1、介绍岗位所用到的用料、用具及其存放位置及用料保存温度,并带受训者一一察看;2、介绍岗位所用到的专业术语;3、介绍岗位清洁标准;4、介绍岗位要注意到的安全事项。
示范依照岗位表,百分之百遵循标准完整演示一遍,做到边做边讲解,重点步骤要重复演示实习1、实习共分3次:完全监督、部分监督、无监督实习;2、完全监督实习,监督受训者的每一个动作,发现错误立即纠正,直至其正确操作;3、部分监督实习:监督其重点部分,并再次给予指导;4、无监督实习:不定期跟进受训者,发现问题立即解决,直至其能独立操作。
评估1、评估的连续性:组长应在繁忙时段跟进员工至少3次,再由经理跟进,需1-2周,经理评估合格即可,但还应每2-3月对员工该岗位进行跟进一次;2、跟进方式:分为知会式和非知会式;训练完毕及时与各区域组长及值班经理沟通。
四、第二职责1、在训练时,若发现其它员工操作岗位不标准时,应立即纠正;2、永远做到顾客第一和更新性的原则;3、注意灌输安全的原则;4、做过一个月的训练组长,并熟悉运用各种训练工具;5、一个月内鉴定至少有10张岗位表。
Python回归分析五部曲(二)—多重线性回归

Python 回归分析五部曲(⼆)—多重线性回归基础铺垫多重线性回归(Multiple Linear Regression )研究⼀个因变量与多个⾃变量间线性关系的⽅法在实际⼯作中,因变量的变化往往受⼏个重要因素的影响,此时就需要⽤2个或2个以上的影响因素作为⾃变量来解释因变量的变化,这就是多重线性回归;多重线性回归模型1.模型2.模型关键词解析偏回归系数多重线性模型中包含多个⾃变量,它们同时对因变量y 发⽣作⽤,如果要考察⼀个⾃变量对因变量y 的影响,就必须假设其他⾃变量保持不变;因此,多重线性模型中的回归系数称为偏回归系数,偏回归系数β_1是指在其他⾃变量保持不变的情况下,⾃变量x_1每变动⼀个单位,引起的因变量y 的平均变化;β_2到β_n 依次类推;回顾-回归分析步骤根据预测⽬标,确定⾃变量和因变量绘制散点图,确定回归模型类型估计模型参数,建⽴回归模型对回归模型进⾏检验利⽤回归模型进⾏预测案例实操-⾦融场景下⾯,jacky 通过⼀个⾦融场景的案例,开始我们的分享:某⾦融公司打算新开⼀类⾦融产品,现有9个⾦融产品的数据,包括⽤户购买⾦融产品的综合年化利率,以及公司收取⽤户的佣⾦(⼿续费);如下表所⽰,产品利率为11%,佣⾦为50,我们需要预测这款⾦融产品的销售额产品编号百分⽐利率抽取⽤户佣⾦⾦融产品销售额19755002730370372037545302705603606721379y =α+++...++eβ1x 1β2x 2βn x n 数据分析部落公众号:shujudata⽅程式中:y −因变量−第n 个⾃变量x n α−常数项(回归直线在y 轴上的截距)−第n 个偏回归系数βn e −随机误差785044086203009960510101150?产品编号百分⽐利率抽取⽤户佣⾦⾦融产品销售额import pandasdata = pandas.read_csv('file:///Users/apple/Desktop/jacky_1.csv',encoding='GBK')第⼀步 确定变量根据预测⽬标,确定⾃变量和因变量因变量:销售额⾃变量:利率、佣⾦第⼆步 确定类型绘制散点图,确定回归模型类型从散点图和相关系数结果表可以看出,产品利率和销售额是强正相关;佣⾦与销售额是强负相关;因此,我们可以使⽤多重线性模型来解决这个问题;我们对⾃变量和因变量绘制散点图,因为需要绘制多个变量两两之间的散点图,在这⾥介绍⼀个更先进的绘图⽅法scatter_matrix :我们把⾃变量和因变量从data 中选取出来,然后设置好对应的参数。
电大办公室管理作业答案大全

电大办公室管理作业答案大全办公室管理作业1(第一、第二章)一、单项选择题1.级别高的办公室一般称为(B.办公厅)。
2.中央机关分别采用分理制和综理制设置下属机构,其办公厅(室)属于分理制的是(D.国务院)。
3.办公室的核心功能是(A、塑造出组织文化及价值观)。
4.办公室的本质属性是(C.服务性)。
5.办公室工作的第一要义是(A、服务)。
6.常用办公用品中属于办公文具的是(A、中性笔)。
7.发放办公用品的人员要求是(D.发放人员要提醒使用部门和人员节约办公用品)。
8.办公用品库存管理中的再订货量是指(C、判定需要订购新的办公用品的库存余额)。
9.正确选择办公设备和易耗品供应商不必考虑的因素是(B.名牌和高档)。
10.有权对政府采购合同进行监督和管理的是(A、国家级或省部级财政部门)。
二、判断题1.任何办公室,都是指的单位里的综合办事机构。
(√)2.省政府的办公厅比其他厅的行政级别要高。
(×)3.信息调研是办公室的一项具体职能。
(√)4.办公室的工作具有综合性特点。
(√)5.办公室管理要严格按既定条条框框办事,不能引用弹性原理。
(×) 6.发放办公用品的时候,不需要对用品库存进行记录。
(×)7.办公电话应定期检查并核对电话账单以控制开销。
(√)8.办公用品的最大库存量是指仓库最多能容纳的数量。
(×)9.办公用品的库存管理和监督中,出货卡即是申请领用单。
(√) 10.办公设备使用权的获取只能是通过购买。
(√)三、简答题1.简答办公室的主要特点。
答:(1)辅助性;(2)综合性;(3)服务性。
2.谈谈你对办公室人员应具备的职业素质中“善谋”的理解。
答:能够正确理解领导的意图,替领导过滤重要的事务;要“参”到点子上,“谋”到关键处,注重谏言技巧;学会把握职场环境的运作方法,一是个性与共性协调统一,二是朦胧与含蓄的工作技巧相结合。
3.简述办公设备使用规范。
(1)必须明确每台设备的具体用途,熟悉掌握其操作程序,严格按照使用说明书的要求进行操作。
小学二年级写话五部曲

小学二年级写话五部曲作者:卢晓莺来源:《读天下》2018年第06期摘要:小学二年级写话是作文起步的训练,是培养儿童提高认识能力、形象思维能力和表达能力的良好途径,能够为三年级作文打下良好的基础。
那如何指导二年级学生写话呢?笔者根据自己平时的教学经验谈了一些看法。
关键词:重视积累;学会观察;发挥想象;训练说话;培养习惯小学二年级写话是作文起步的训练,是培养儿童提高认识能力、形象思维能力和表达能力的良好途径。
新的《语文课程标准》在“课程目标”中把1~2年级的写话目标定为:1. 对写话有兴趣,写自己想说的话,写想象中的事物,写出自己对周围事物的认识和感想。
2. 在写话中乐于运用阅读和生活中学到的词语。
3. 根据表达的需要,学习使用逗号、句号、问号、感叹号。
那如何指导二年级学生写话呢?我认为可以让他们唱好这五部曲:一、一部曲:加强阅读,重视积累所谓“书到用时方恨少”,这“少”字的含义有二:一是读的少,二是记的少。
所以写话时就干巴巴的,如果让学生多读点,多积累些,天长日久,待到自己写话时便能呼之即出,好词好句,信手拈来。
“读书破万卷,下笔如有神”说的就是这个道理。
学生一进入二年级学习,我每天会布置他们阅读半小时书籍,读我们所学的语文书,读同步作文,读适合学生读的课外书,以增加学生的阅读量。
二年级下学期开始,我在读的基础上增加了一个写读书笔记的作业,一周写一篇,用市场上常见的带方格的日记本,摘抄好词好句,规定固定格式。
刚开始有过半的同学无法按我的要求完成,或没空一行,或没写四行好词,或好句抄写不规范,我不厌其烦,一一指导纠正。
到二下半学期时,同学们均能按要求做好读书笔记了。
之后我除了格式要求外,还教他们如何找好词好句,如ABB、AABB、ABAC等词组、四字成语,比喻句,拟人句,写景的句子、写语言、动作、心理的句子,都可以摘录下来,让学生在读书笔记质量上有了很大的提升的同时积累好词佳句,为写话打好基础。
二、二部曲:学会观察,提升能力学会观察,这是进行写话的重要条件。
优质服务_2

顾客满意、忠诚与利润
利润
顾客购买商品或服务
使用后感到满意 变成忠实顾客
持续购买
向外宣传,建立口碑
优质服务_2
顾客价值
v 平均一个顾客每月消费200元,消费期按照10年计算, 一个顾客的终生价值是2万元
v 如果你对顾客皱一下眉头,就将看到2万元离去的背 景。
v 我们可以也是必须做到的:使现有顾客保持满意,从 而增加顾客的终生价值。
v 2、诚恳地倾听顾客的诉说,并表示完全相信顾 客所说的话,千万不要还没有听完话就指责顾 客或为自己作辩解,这样最易引起顾客的反感。
v 3、当顾客有抱怨时应立即作出处理,或在24小 时或约定时间内给予答复。
优质服务_2
处理原则
v 4、在处理顾客投诉时,既要迅速,又不能轻率 地承担责任,如当事人无法作出决定时应请示 上级来解决。
➢ 程序上的承诺斩钉截铁
查明之后,我们会依事实来补救
我们一定会尽力,但人非神仙,我们不敢百分百说会如何如何
v 实质上的承诺有所保留
优质服务_2
如何处理顾客抱怨
保持冷静
冷(止):停止(压力、紧张) 静(定):镇定
积极倾听
别动嘴,打开双耳、双眼
付诸行动
保持联络,朋友谅解,及时跟进
随时回馈
把怨家变亲家——跟进拜访,征询意见
➢ 当顾客决定购买我们的商品的时候,我们实际给与他 的,应超过原先的承诺。
➢ 当顾客对我们的商品和服务发出抱怨时,我们应尽快 解决其问题,把顾客的事情当作自己的事来解决。
➢ 当顾客对商品及服务有特别要求,希望我们配合时, 我们要全力以赴,尽一切努力去满足他。实在办不到 时,应详尽说明原因,并表示歉意。同时提出其他替 代建议,供顾客参考。
情意合一实相(二)——读罗长江散文诗《大地五部曲》

情意合一实相(二) Array—读罗长江散文诗《大地五部曲》——扫码悦听◎黄永健二尧情义合一实相理论近年来,我国艺术界原创性不足,跟风模仿盛行,创作失范,评论失衡,文艺理论界具有不可推卸的责任,已有学者指出,我国当代文艺理论研究乃至艺创理论研究越来越远离艺术本体,偏离艺术范畴的认知和认识,沦为哲学、美学、史学,乃至社会文化学、考古学和政治学的附庸,因此,文艺理论研究偏离艺术本体的现象值得警惕。
艺术的本体是情意复合体,或曰“情意合一实相”,“情意合一实相”之相,《说文解字》训为“从木目”,站到树上看,故“目接物曰相”———肉眼能看到的一切都是“相”,相当于与主体相对的客观事物,而在佛学中“实相”为本体、实体、真相、本性,引申而指一切万法真实不虚之体相,或真实之理法、不变之理、真如、法性等,相当于终极存在,只可意会不可言说的“道”、“体”、“绝对理念”等。
艺术作品可见可闻可触,是实际存在的客观事物,是为“实相”,艺术作品又可能永远消失于历史风尘,不可见不可闻不可触,犹如佛家的“法相”,它是虚幻不实的存在,因此,“情意合一实相”又可以指向历史上出现过存在过又消逝了的艺术作品,以及将要出现的艺术作品,“情意合一实相”对应着过去、现在及未来的一切艺术存在,情义合一实相理论可以拿来对当代诗歌包括散文诗文本进行价值评判。
评价艺术作品的第一标准———情性、情感、活感性,其次才—意理、意蕴、意涵。
一切艺术作品“以情为本”,“以情是意——窥真”,痛苦的、绝望的感情与欢快的、昂奋的感情,以及人类一切的悲欢离合是艺术品发生、存在的根据,伟大艺术的第一要义是“真情实感”,而不是“真理妙义”,后现代艺术号称玩观念———观念先导,与文革艺术观念先行,都是背离艺术本体的反艺术行为,其极端是消解了艺术。
但是,艺术徒为畅情、放情、滥情,没有情思、情致、情境———通过情感的自觉抵达生命和宇宙的真实性存在,则这种艺术虽“真”而难以“善美”,有些流行歌曲表现了欲死欲活的世俗情感,迈克尔·杰克逊在舞台上狂情轰炸,观众至晕厥死亡,这种艺术情真意乖,以暴戾之情将艺术接受者引入诡异之境,其意不正,作品在特定时空可以被贴上“伟大”标签,时过境迁,却终归不可能成为经典。
服务五部曲规范标准表
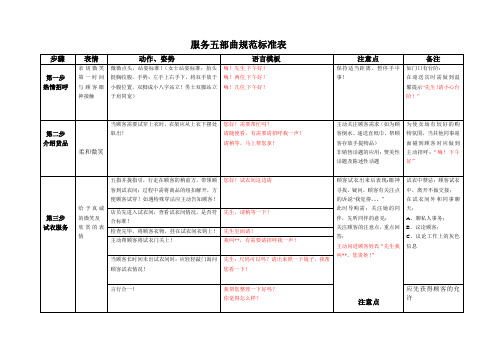
嗨!两位下午好!
嗨!几位,下午好!
保持适当距离、暂停手中事!
如门口有台阶:
在迎送宾时需做到温馨提示“先生!请小心台阶!”
第二步
介绍货品
柔和微笑
当顾客需要试穿上衣时,衣架应从上衣下摆处取出!
您好!需要帮忙吗?
请随便看,有需要请招呼我一声!
请稍等,马上帮您拿!
主动关注顾客需求(如为顾客倒水、递送直纸巾、帮顾客存放手提物品)
Bye
五指并拢指引,行走在顾客的稍前方,将顾客送至门口!
导购与顾客的对话:
*先生,您的商品我帮您拿上了,这边请!
双手将衣物递赠与顾客!
*先生,这是您的衣服,请拿好,谢谢您!请慢
走!ByeBye!
与顾客交接物品时到应做到双手接送!需要顾客输密码或签名时,应五指并拢,指引顾客!
收银员语言内容:您好!*先生,3件是吗?请稍等!请问您是现金还是刷卡谢谢!
现金形式:*先生现金是吗?好的,谢谢!
*先生收您900元,谢谢!
找您12元,请您确认一下,请收好,谢谢!
收银在买单时,不得少于四声谢谢!需做到唱收唱付!
第五步
感恩送客
亲切微笑
收银与导购的对话:收银:需走出收银台做交接工作,双手将衣物交于店员!
**这是*先生的衣服,请拿好,谢谢!
目送顾客:直到顾客消散在我们的视线范围内,如顾客有回头我们因向其挥手!
在目送顾客时也需保持站姿标准,不得与在门口迎宾的同事聊天!
向其顾客挥手!
收银与顾客的对话:
*先生,谢谢您对我们品牌的喜爱,请慢走,Bye
此时导购需:关注她的同伴,先听同伴的意见;
关注顾客的注意点,重点回答;
主动问道顾客姓氏“先生我叫**,您贵姓!”
训练五部曲

训练五步曲内容
示范
必须100%按照标准操作 我说我做 重复
训练五步曲内容
实习
我说他做 他说他做 纠正与提问:过程中/过程 后
训练五步曲内容
实习
完全监督实习 部分监督实习 无监督实习
训练五步曲内容
评估
现场评估 先表扬,后指出不足,再 提出期望 长期评估
02 训练五步曲实务
1 必须要有训练计划 2 必须要有长期跟进 3 训练形式可以因人而异
03 训练五步曲原则
1 100%遵守标准原则 2 知识更新性原则 3 顾客第一原则
04 训练五步曲的评估
1 标准齐全
2 条理性况
训练五部曲回顾
训练五部曲内容 训练五部曲实务 训练五部曲的原则 训练五部曲的评
训练五部曲
训练部 王强龙
训练五部曲概述
01 训练五部曲内容 02 训练五部曲实务 03 训练五部曲的原则 04 训练五部曲的评估
01 训练五步曲内容
1
准备
2
介绍
3
示范
4
实习
5
评估
训练五步曲内容
准备
准备受训人 准备自己 准备训练场地 准备训练资料 准备训练细节
训练五步曲内容
介绍
目的以认知为主 将用具、仪器、物料、产 品、术语等内容分类介绍 必须结合实际物品或场地 循序渐进地介绍 控制语速,表述清晰
颠峰表现-如何实现高绩效的五项准则(2)

在21世纪竞争白热化的市场环境中,究竟如何行事才能取得更佳业绩?
调查1600多名高绩效经理人,平均年龄46岁,拥有17年的 管理经验,其中64%是男性,36%是女性,这些人合计拥有超过 27000年大呢管理经验,并对另外400名高绩效经理作了追踪调 查,以征求更多的意见、案例。
明确您组织的目的和方向
•我们这个工作团队为什么存在? •谁是我们的顾客(内部和外部),他们的期望是什么? •我们必须做好哪些有助于业绩增长的工作?
阐明您在组织中的领导角色
•我的上司对我以及我的组织有何期望? •我的员工对我有何需求? •我必须做哪些能创造价值的工作以取得理想的成果?
形成富有意义的绩效目标何考核方法
及时排除影响工作绩效的障碍? 6. 您有自己的个人绩效改善计划吗? 7. 您是否认真考虑过如何培养您的员工?
工作表1.1 业绩创造评估
答案提示:以坦诚的态度回答以下每一个问题,以评估您自己在改善绩效和业绩方面做得如何.请使用以下评估等级: 1=从不 2=极少 3=有时 4=经常 5=一贯
我做得如何
________ ________ ________ ________ ________ ________ ________ ________ ________ ________ ________ ________ ________ ________ ________ ________ ________ ________ ________ ________
2. 对不同的人,运用同样的方法,至少五次,看看您会有什么发现。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
表情
柔和微笑
动作及标准用语
身体微微前倾; 动作快捷; 拿取搭配图片,双手递给顾客; 指引试衣镜和试衣间方向,右手 五指并拢,手臂微微弯曲,向所 指引的方向水平伸展;
您好,镜子在这边。。。 您想买些什么呢? 您先看看,有需要招呼一声; 您好,这是新货搭配图片, 方便您参考
请稍等,马上帮您拿; 您这边先随意看一下,我马 上帮您拿; 您好,试衣间这边请; 请把门帘拉好(门关好), 我叫※※,有需要请招呼一 声;
第二步:建立联系
介绍货品
• • • • • • 接触顾客时不要有被动跟客现象(保持1.5米) 与顾客交流时保持微笑,目光接触,动作柔和 过程中经过身边的其他顾客要点头问候 认真倾听顾客说话,并予以点头回应 介绍货品时,要主动介绍,方向要正确 当顾客表示兴趣时,应及时引导顾客试衣镜方向 或试衣间或者拿搭配图片给予看穿着效果
动作 引导顾客至收银台, 并分别和收银、顾客 做交接;
规范用语 请,※小姐,收银台 这边走。 ※※,※小姐三件买 单,谢谢;
请这边付款, 谢谢;
第五步:感恩送客
• 由店员帮顾客拎袋子送至门口{开门},微笑点头 道别 • 微笑目送顾客离开,原地停留5秒 • 整个过程始终保持微笑,态度认真,感恩
表情 亲切的中 度微笑
表情 亲切微笑 欣赏眼神
动作
引导镜子方向; 轻柔整理细节; 退后一至两步观察穿着效 果; 陪同时,在顾客稍前方,
您好,我帮您整理一 下好吗? 您觉得怎么样? 您稍等一下,我觉得 有一套衣服会更适合 您;
请问小姐,尺码可以 吗? 您要不要出来照一下 镜子,我帮您看一下? 请问小姐,您贵姓?
第四步:收银服务
第三步:试衣服务
*试衣前, 正确拿取顾客的尺寸及件数,有特殊穿法的衣服 要告知顾客【取下衣架。纽扣,拉链打开挂在试衣间】 *试衣中, 要准备与之可搭配的不同风格的单品及饰品 试衣中途有事离开时,要请同事帮忙照顾顾客 去其区域拿取搭配货品时,要快速小跑拿取,动 作不要夸张 *试衣后, 征的顾客为其造型 整个过程倾听顾客意见,并尊重顾客的选择
*店员引领顾客到收银台 *店员与收银员和顾客做好交接 *收银员要微笑,问好 *收银员与顾客确认货品尺码,件数 *收银员要确认顾客是否会员 *收银员要确认付款方式及金额,以唱收唱付的方式找零 *收银员要将货品叠好,装袋,并告知顾客洗涤保养方法 *收银员要微笑感谢顾客,整个过程要快速,细致
表情 甜蜜的 中度微笑
送客过程中同 时告知顾客洗 涤方式,然后 跟顾客推销自 己
谢谢您, 请慢走
(对于买单的)
您慢走,空 过来看看;
(对于没买的)
服务五部曲---态度决定一切
规范用语
目光接触,微微点 头;放下手中事 身体直立,双肩放 平,双手自然放于 小腹前,左手放在 右手上
表情 亲切明朗的微笑 用动态的脚步有 序的整理带给顾 客活力轻松的第 一感觉
招呼标准用语 早上好/上午好/ 下午好/晚上好/ 您好。欢迎光临 乐町!【日语】
