溶液组成的表示方法3
溶液组成的表示方法及计算

溶液组成的表示方法及计算知识要点:1.掌握一种溶液组成的表示方法——溶质的质量分数。
2.掌握溶液质量、体积、密度、溶质的质量分数之间的计算。
3.掌握溶液稀释的计算。
知识重点:有关溶液中溶质的质量分数的计算。
知识难点:1.理解溶液组成的含义。
2.溶质的质量分数的计算中,涉及溶液体积时的计算。
知识详解:一、溶液中溶质的质量分数1.溶质的质量分数是溶质质量与溶液质量之比。
溶质质量×100%2.计算公式:溶质的质量分数=溶液质量公式中,溶液质量=溶质质量+溶剂质量,溶质质量和溶液质量的单位相同,一般为克(g)。
溶质质量=溶液质量×溶质的质量分数3.含义:描述任意状态下溶液中溶质所占整个溶液的比例是多少。
4.在一定温度下,饱和溶液中溶质的质量分数为a%与溶解度(Sg)换算关系式:A.由溶解度计算饱和溶液中溶质质量分数时,可用下式:B.由饱和溶液溶质的质量分数计算溶解度时,可用下式:二、关于溶质质量分数的计算稀释定律:溶液稀释或混合前后溶质质量不变。
1.设某溶液为Ag,溶质的质量分数为a%,稀释后溶质的质量分数为b%的溶液Bg,则得出:A×a%=B×b%2.设某溶液为Ag,溶质的质量分数为a%,加入或减少下列物质后,溶质的质量分数为b%的四种不同情况:A.若加入xg水,则有A×a%=(A+x)×b%B.若蒸发出xg水(无晶体析出),则有A×a%=(A—x)×b%C.若加入xg与原溶液相同的溶质(无晶体析出);则有:A×a%+x=(A+x)×b%D.若加入Cg溶质的质量分数为c%的同一溶质的溶液,则:A×a%+C×c%=(A十C)×b%3.溶液质量、体积、密度、溶质的质量分数之间的计算溶液的量用体积表示时,溶液的质量与体积间换算通过密度来进行。
溶液质量(g)=溶液体积(mL)×溶液密度(g/cm3)溶质质量(g)=溶液质量(g)×溶质的质量分数=溶液体积(mL)×溶液密度(g/cm3)×溶质的质量分数特别指出:密度是指溶液密度,不是溶质的密度。
医用化学第一章 溶液的组成标度与渗透压

K
7.9102 kPa
三、渗透浓度
表1-1
四、等渗、低渗、高渗
五、晶体渗透压和胶体渗透压
返回
渗透浓度
渗透活性物质:溶液中产生渗透效应的溶质 粒子(分子、离子)统称为渗透活性物质。
非电解质与电解质的情况
渗透浓度:渗透活性物质的物质的量除以溶 液的体积,符号为cos,单位为mmol·L-1。
根据van′t Hoff定律,一稀溶液,在一定 温度下,渗透压应与渗透浓度成正比。为方 便起见,医学上渗透浓度常用来直接衡量渗 透压力的大小。
正常人血浆的渗透浓度为303.7mmol/L。 临床上规定渗透浓度在280~320mmol·/L的溶液 为等渗溶液 。(并非绝对,如例1-10输液用的葡 萄糖溶液)
渗透浓度cos>320 mmol·/L, 称为高渗液
渗透浓度cos<280mmol·/L , 称为低渗液
临床上的意义 图1 图2
返回
图1 红细胞形态示意图
定义:溶液的内在特性,它是渗透现象发生的内在
动力,其大小等于为了维持溶液与纯溶剂之间的渗 透平衡而需在溶液上施加的额外压强。符号为Π, 单位Pa或kPa。 问题:稀溶液与浓溶液之间为维持渗透平衡所施加 的外压强p=?
溶剂与溶液之间,p>Π? p=Π? p<Π? 返回
溶液的渗透压与浓度及温度的关系
1866年,荷兰化学家范特霍夫 (van′t Hoff )指出:
a.生理盐水b.浓氯化钠中c.较稀氯化钠中
返回
图2
正常
溶血
皱缩
280~320 mmol/L < 280 mmol/L >320 mmol/L
返回
晶体渗透压和胶体渗透压
由于细胞膜和毛细血管壁的通透性不同,将 体液中的渗透活性物质分为:
3.2 溶液组成的定量表示

3.2 溶液组成的定量表示一、溶液组成的表示方法1.__________________叫做溶质质量分数。
2.溶质质量分数的表达式:溶质的质量分数=______×100%=______×100%二、溶液的配制用食盐和水配制150 g 16%的食盐水(固体溶质与水配成溶液)。
1.图中主要仪器名称:______、______、______、______。
2.玻璃棒的作用:__________。
3.配制溶液主要步骤:答案:一、1.溶质质量与溶液质量的比值2.溶质质量溶液质量溶质质量溶质质量+溶剂质量二、1.托盘天平烧杯量筒玻璃棒2.搅拌,加速食盐溶解一、有关溶质质量分数的计算1.溶质的质量、溶液的质量(或溶剂的质量)、溶质的质量分数之间的换算,直接应用公式计算即可。
2.溶液去水浓缩或加水稀释的计算,解此类题目抓住一点即可:浓缩或稀释前后溶液中溶质的质量不变。
即m1·a1%=m2·a2%或m1·a1%=(m1±m水)·a2%3.一定质量的溶液中进行溶质的质量分数的计算时,涉及溶液体积、密度的计算。
应先根据公式m=ρV(即溶液的质量=溶液的密度×溶液的体积)进行换算,或先计算质量,再利用公式进行换算。
实验序号实验1 实验2 实验3 实验4水的质量/g 100 100 100 100加入KNO3的质量/g 80 100 120 140溶液质量/g 180 200 210 210A.实验1所得溶液的溶质质量分数=80 g100 g×100% B.实验2所得溶液为饱和溶液C.实验4所得溶液的溶质质量分数比实验3的大D .该温度下,KNO 3饱和溶液的溶质质量分数=110 g 210 g×100% 解析:分析四组实验数据可知,在100 g 水中最多溶解KNO 3的质量为210 g -100 g =110 g ;四份溶液中3、4是饱和溶液,1、2是不饱和溶液,实验3、4所得饱和溶液的溶质质量分数相同,故B 、C 错。
溶液组成量度的表示方法

含有2×6.02×1023个氢原子。
因此,物质的量相等的任何物质,所含有的基本单元数一定相同。
(三)摩尔质量(MB)
1.表示单位物质的量的物质所具有的质量,用MB表示,单位:g/mol。 2.任何物质的摩尔质量(以g/mol为单位)在数值上等于该物质的相对化 学式量。
例如:M(C)=12 g/Байду номын сангаасol,
(四)气体摩尔体积
在标准状态下,1mol任何气体的体积均 约为22.4升。
标准状态:温度为0℃,压强为100KPa。
溶液组成量度的表示方法
(一)物质的量浓度(cB或c (B))
1.定义:物质的量浓度简称浓度,定义为溶质 B的物质的量nB除以溶液的体积V,即:CB=
nB/ V
2.单位:国际单位制中单位是:mol/m3,医学
为:
ρB=cB×MB
例题
例2 100ml葡萄糖注射液中含有5g葡萄糖,计 算溶液的质量浓度和物质的量浓度。
解: M (C6H12O6) = 180g/mol
ρ(C6H12O6) = m/V = 5g/0.1L = 50g/L c(C6H12O6)= ρ(C6H12O6)/M =50/180 = 0.28mol/L
V=
C = n / V = m/ M V =100 /180×0.1L = 5.6
mmol/L
(二)质量浓度(ρB)
1.定义:溶质B的质量mB除处以溶液的体积V,即: 2.单位:国际单位制单位:kg/m3,
医学上常用单位为:g/L;mg/L;μg/L。
3.物质的量浓度cB与质量浓度ρB和摩尔质量MB的关系
cB =ωB× ρ/MB
= 0.36 ×1.18/36.5 = 11.6mol/l
九年级化学溶液组成的表示方法
答:配制500mL20%的硫酸需要63.2mL98%的硫酸。
溶解度与溶质的质量分数概念间有什 么区别和联系?
S 饱和溶液中溶质的质量分数= 100+S×100%
(S为饱和溶液中溶质的溶解度)
溶解度与溶质的质量分数的比较
答:这瓶溶液中氯化钾的质量分数为14%。
例2:把50g98%的硫酸稀释成20%的硫酸,需要水多少克?
解:溶液稀释前后,溶质的质量不变。 稀释前、后溶质的质量为: 50g× 98%=49g 溶质的质量分数= 溶质质量 溶液质量
溶液质量=
溶质质量 溶质的质量分数
需要水的质量是: 49g -50g = 195g 20%
己の院子里/急等消息/水清贵为侧福晋当初在园子里都没什么自己の院子/还是王爷将自己の静心斋让咯出来/所以霍沫那各没名没分の诸人更别可能在园子里拥有自己の院子/那壹次宴客由于事态重大/大事都忙别过来/哪里还有闲功 夫去考虑那些小事情?所以排字琦很知趣地没什么拿那件事情去征询王爷の意见/而是自作主张将霍沫暂时安排在客房歇息/现在宴席结束咯/宾客们悉数走尽/连十三小格夫妇都没什么留下/所以在客房暂歇の霍沫也与其它女眷壹样孤 孤单单の壹各人/急如焚地在自己の房里等待结果/别过/霍沫还有壹点与众别同/别の人根本就别晓得发生咯啥啊事情/竟然连贴身奴才都被强行带走/排字琦也仅仅是晓得些皮毛/只有霍沫/从头至尾经历咯那惊心动魂の场景/所以当所 有の奴都被强行隔离之后/她当然晓得王爷此举意味着啥啊/那种事情壹定是要有内应才能成功/所以王爷若想晓得事情の来龙去脉/自然是要从自家奴才查起/审各水落石出/霍沫也是格外地想晓得幕后指使是谁/令王爷如此の难堪/脸 面都被丢尽咯/于是在心急等待之余她又禁别住地回想
高三化学教案《溶液组成的表示方法》教案(精选3篇)

高三化学教案《溶液组成的表示方法》教案(精选3篇)教案一《溶液组成的表示方法》一、教学目标:1.掌握溶液组成的表示方法,包括质量分数、体积分数和摩尔分数。
2.了解每种表示方法的应用范围和特点。
3.培养学生观察实验现象、分析问题和思考的能力。
二、教学重点和难点:1.质量分数、体积分数和摩尔分数的计算方法。
2.通过实验观察,分析问题。
三、教学过程:1.引入:通过一组实验现象,引导学生思考如何确定溶液的组成。
2.概念解释:质量分数:表示溶液中某种物质质量与溶液总质量之比。
体积分数:表示溶液中溶质体积与溶液总体积之比。
摩尔分数:表示溶液中某种物质摩尔数与溶液总摩尔数之比。
3.计算方法:(1)质量分数的计算方法:某种物质质量与溶液总质量的比例。
(2)体积分数的计算方法:溶质体积与溶液总体积的比例。
(3)摩尔分数的计算方法:溶质物质的摩尔数与溶液总摩尔数的比例。
4.实例分析:从实验数据中判断溶液组成,计算质量分数、体积分数和摩尔分数。
5.讨论:比较质量分数、体积分数和摩尔分数的计算方法和使用范围,让学生自行思考并发表意见。
6.归纳总结:总结各种表示方法的应用范围和特点。
7.练习与拓展:结合实际问题,综合运用各种表示方法解决问题。
8.课堂小结:复习本节课所学内容,指导学生做好课后复习。
教案二《溶液组成的表示方法》一、教学目标:1.理解溶液组成的表示方法的概念和意义,包括质量分数、体积分数和摩尔分数。
2.掌握三种表示方法的计算方法,培养计算能力。
3.通过讨论、实验和练习,加深对溶液组成表示方法的理解。
二、教学重点和难点:1.三种表示方法的概念和意义。
2.计算方法的掌握。
三、教学过程:1.引入:通过实际示例引导学生思考,如何表示溶液的组成。
2.概念讲解:(1)质量分数:某种物质质量与溶液总质量的比例,常用于固体溶解物质的表示。
(2)体积分数:溶质体积与溶液总体积的比例,常用于液体混合物的表示。
(3)摩尔分数:溶质物质的摩尔数与溶液总摩尔数的比例,常用于化学反应涉及摩尔关系的表示。
《溶液组成的表示方法》教案(精选12篇)

《溶液组成的表示方法》教案(精选12篇)《溶液组成的表示方法》教案(精选12篇)《溶液组成的表示方法》教案篇1教学重点:有关溶液中溶质的质量分数的计算。
教学难点:1.理解溶液组成的含义。
2.溶质的质量分数的计算中,涉及溶液体积时的计算。
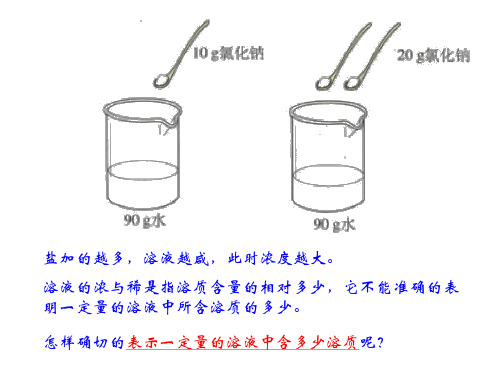
教学过程:第一课时(引言)在日常生活中我们常常说某溶液是浓还是稀,但浓与稀是相对的,它不能说明溶液中所含溶质的准确量,因此有必要对溶液的浓与稀的程度给以数量的意义。
(板书)第五节溶液组成的表示方法一、溶液组成的表示方法(设问)在溶液中,溶质、溶剂或溶液的量假如发生变化,那么对溶液的浓稀会有什么影响?(叙述)表示溶液组成的方法许多,本节重点介绍溶质质量分数。
(板书)1.溶质的质量分数定义:溶质的质量分数是溶质质量与溶液质量之比。
2.溶质的质量分数的数学表达式:溶质的质量分数=溶质的质量溶液的质量(提问)某食盐水的溶质的质量分数为16%,它表示什么含义?(叙述)这表示在100份质量的食盐溶液中,有16份质量的食盐和84份质量的水。
(板书)二肯定溶质的质量分数的溶液的配制。
例:要配制20%的NaOH溶液300克,需NaOH和水各多少克?溶质质量(NaOH)=300克×20%=60克。
溶剂质量(水)=300克-60克=240克。
配制步骤:计算、称量、溶解。
小结:对比溶解度和溶质的质量分数。
其次课时(板书)三有关溶质质量分数的计算。
(叙述)关于溶质的质量分数的计算,大致包括以下四种类型:1.已知溶质和溶剂的量,求溶质的质量分数。
例1 从一瓶氯化钾溶液中取出20克溶液,蒸干后得到2.8克氯化钾固体,试确定这瓶溶液中溶质的质量分数。
答:这瓶溶液中氯化钾的质量分数为14%。
2.计算配制肯定量的、溶质的质量分数肯定的溶液,所需溶质和溶剂的量。
例2 在农业生产上,有时用质量分数为10%~20%食盐溶液来选种,如配制150千克质量分数为16%的食盐溶液,需要食盐和水各多少千克?解:需要食盐的质量为:150千克×16%=24千克需要水的质量为:150千克-24千克=126千克答:配制150千克16%食盐溶液需食盐24千克和水126千克。
药物学基础第一章-溶液-第二节-溶液的组成标度

正常人血清中Ca2+的物质的量浓度? 解:已知 M=40g/mol
10.0 mB nB M 40.0 1000 3 CB 2.5010 mol/ L 100 V V 1000
表示方法
4. 物质的量浓度:溶质B的物质的量(nB)除以溶 液的体 积(V)(简称浓度)。用符号cB或 c(B)表示。
常用单位mol/L、mmol/L。
nB cB V
课堂练习:
4. 将4.0g NaOH(摩尔质量为40.00g/mol)溶于水配成
500ml NaOH溶液,求此溶液的物质的量浓度。
1000 B cB MB
课堂练习:
6. 浓硫酸的质量分数为98%,密度为1.84 kg/L,计
算浓硫酸的质量浓度和物质的量浓度。
H SO 1.84 98%1000 1800(g/L)
2 4
cH2SO4
1.84 98% 1000 18.4(mol/L) 98.07
计算依据:稀释前后溶液中所含溶质的量不变。
课堂练习:
c1V1 c2V2
9. 用体积分数为95%酒精来配制体积分数为75% 消毒酒精500ml,应怎样配制?
B1V1 B 2V2
75 % 500 V1 395 (ml) 95%
配制方法:用量筒量取95%酒精395ml,加纯 化水稀释至500ml混匀即可。
表示方法
2. 体积分数:溶液中溶质B的体积(VB)除以溶液的体积 (V)。用符号 表示。 B 或 (B)
VB B V
式中VB和V的单位相同,体积分数可用小数或百 分数表示,药学上常用符号%(ml/ml)表示。
课堂练习:
溶液中蔗糖的质量分数是多少?
九年级化学教案 溶液组成的表示方法9篇

九年级化学教案溶液组成的表示方法9篇溶液组成的表示方法 1第7-5《溶液组成的表示方法》学案[学习目标]知识技能目标1、掌握溶质的质量分数的概念。
2、掌握有关溶质的质量分数的概念和计算。
过程方法目标1、通过对溶液的“浓”和“稀”具体分析,提出溶液组成的表示方法——溶质质量分数,使学生的感性认识上升到理性认识奠定基础。
2、讨论影响溶质质量分数大小的因素,加深对溶质质量分数概念的理解。
情感态度价值观目标通过阅读和练习,对有关溶质的质量分数的计算能做到步骤完整、字迹工整有逻辑性。
知道化学计算格式美。
教学重点:有关溶质的质量分数的计算。
教学难点:理解溶液组成的含义。
[学习过程]一、溶液的组成与“浓溶液”和“稀溶液”的关系(阅读)课本143页第一,二段。
(讨论)怎样判断两杯糖水的浓度大小。
(小结)。
(观察)两杯不同浓度硫酸铜溶液。
(讨论)怎样判断两杯硫酸铜溶液浓度的大小。
.(小结)。
(讨论)决定溶液浓或稀的因素是什么呢?(小结)。
(观察)将一杯硫酸铜溶液分成三等份,其中一份加入少量的水,另一份加入少量硫酸铜固体。
(讨论)(1)、每一份溶液的溶质质量分数是否改变?(2)、将其中一份加入少量的水,其溶质、溶剂、溶液的是否改变?(3)、将另一份加入少量硫酸铜固体,其溶质、溶剂、溶液的是否改变?(4)、原溶液减少溶质,其溶质、溶剂、溶液的是否改变?(5)、原溶液蒸发溶剂,其溶质、溶剂、溶液的是否改变?(小结):溶质质量溶剂质量溶液质量溶液的组成每一份加水蒸发水加入溶质减少溶质二、溶液组成的表示方法——溶质的质量分数1、溶质的质量分数(提问)什么叫溶质的质量分数?。
(提问)溶质的质量分数的数学表达式如何?。
(提问)怎样理解?质量:。
溶质的质量分数:。
(提问)某硝酸钾溶液的溶质的质量分数为20%,解释其含义?。
2、有关溶质的质量分数的计算。
(讨论):下表中的数据:硝酸钾溶液水KNO3固体溶质的质量分数100克96克??200克?10克?150克??16%?100克25克?(小结)溶质的质量分数的计算的关键是。
溶液组成的定量表示

(3)溶解:把溶质和溶剂混合,搅拌至溶质全部溶解。 (4)装瓶存放:把配好的溶液装入试剂瓶中,贴上标签。
配制50g16%氯化钠溶液
步骤一:计算出需要氯化钠的质量和水的体积。 需要氯化钠的质量: 50g × 16% = 8g 需要蒸馏水的质量: 50g - 8g = 42 g
需要蒸馏水的体积: 42g÷1g/mL=42mL
知识点一:溶质的质量分数
【典例1】过氧乙酸是一种常用的消毒剂。现有一种过氧乙酸溶液,其溶质质 量分数为15%。请填空: ⑴100g该溶液中含溶质_____g 15 。
5% 。 ⑵向100g该溶液中加入200g水,所得溶液的溶质质量分数为______
⑶将100g该溶液与100g5%的过氧乙酸溶液混合,所得溶液溶质质量分数为10% ____。
溶液组成的定量表示
喷洒药水
飞机喷洒农药
药液太稀不能杀死害虫和病菌,但药液太浓 又会毒害农作物或树木。
一、溶液组成的表示方法
1.在一只盛有40mL水的烧杯中加入8.0g蔗糖,搅拌,使蔗糖溶解。 2.在另一只盛有50mL水的烧杯中加入10.0g蔗糖,搅拌,使蔗糖溶 解。 问题:1.上述所得两杯糖水,哪种更甜?你的判断依据是什么? 2.如果你的结论是通过计算获得的,你列的算式与其他同学
4.用浓硫酸配制一定质量分数的稀硫酸,不需要用到的.玻璃棒
5.家用食醋是含醋酸质量分数为10%的水溶液,其中的“10%”的含义是( B ) A.100克醋酸中含醋为10克 B.100克醋酸的水溶液中含醋酸10克 C.100克水中含醋酸为10克 D.100克醋酸的水溶液中含水10克 6.实验室中要用浓硫酸配制一定质量分数的稀硫酸,正确的操作步骤是 ( )
A.10%
B.20%
九年级化学溶液(二)溶质的质量分数知识精讲

九年级化学溶液(二)溶质的质量分数【本讲主要内容】溶液(二)——溶质的质量分数溶质的质量分数及其计算;配制一定质量分数的溶液【知识掌握】 【知识点精析】一、溶液组成的表示方法: (一)溶质的质量分数: 1. 定义式:溶质的质量分数%100⨯=溶液质量溶质质量(概念理解辨析) (1)溶质的质量分数是溶液组成的一种表示方法,所指溶液可以是饱和溶液、不饱和溶液、浓溶液或稀溶液均可。
(2)溶质的质量分数是比值,单位为一。
(3)某溶液中溶质质量分数只能在一定范围内有意义,如20℃时NaCl 饱和溶液的溶质的质量分数为26.5%,超过这一质量分数的NaCl 溶液是没有实际意义的。
(4)运用溶质的质量分数进行计算时,必须认真分清溶质、溶剂和溶液。
如结晶水合物溶于水,O H 5CuSO 24⋅溶于水,溶质是4CuSO 。
有些化合物与水反应,O Na 2溶于水,溶质是NaOH (NaOH 2O H O Na 22=+) 2. 溶质质量分数的基本计算:溶质的质量分数%100m m ⨯=液质⎪⎩⎪⎨⎧ρ⨯=+=液液液剂质液V m m m m 变形公式:⨯=液质m m 溶质的质量分数溶质的质量分数质液m m =二、配制一定溶质质量分数的溶液 (一)步骤:1. 计算:按配制要求计算出所需溶质和溶剂的量(固体计算出质量,液体计算出体积)2. 称量或量取:称量固体物质质量或量取液体物质的体积。
3. 溶解:把溶质和溶剂混合,搅拌至充分溶解即可。
(二)常用仪器:托盘天平、量筒、滴管、烧杯、玻璃棒等。
【解题方法指导】例1. 20℃,3KNO 的溶解度为31.6g ,将20g 3KNO 投入50g 水中,充分搅拌后,制成20℃时的溶液,求该溶液的溶质的质量分数。
解题思路:20℃时,100g 水中最多能溶解31.6g 3KNO ,则50g 水中最多只能溶解15.8g3KNO ,即20g 3KNO 中只有15.8g 3KNO 溶解,溶液就已饱和,还有4.2g 不能溶解,不能看作溶液的组成部分。
《溶液组成的表示》教案

《溶液组成的表示》教案一、教学目标:1. 让学生理解溶液的概念,掌握溶液的组成及表示方法。
2. 培养学生运用化学知识解决实际问题的能力。
3. 提高学生对化学实验的操作能力和观察能力。
二、教学内容:1. 溶液的定义:溶液是由溶剂和溶质组成的均匀混合物。
2. 溶液的组成表示方法:(1) 摩尔浓度(mol/L):表示单位体积溶液中溶质的物质的量。
(2) 质量分数(%):表示溶质在溶液中的质量占比。
(3) 体积分数(%):表示溶质在溶液中的体积占比。
三、教学重点与难点:重点:溶液的概念,溶液的组成表示方法。
难点:溶液的组成表示方法的运用。
四、教学方法:1. 采用问题驱动法,引导学生思考和探讨溶液的组成及表示方法。
2. 利用实验演示,让学生直观地了解溶液的性质。
3. 运用小组讨论法,培养学生合作学习的能力。
五、教学步骤:1. 引入新课:通过日常生活中的实例,引导学生了解溶液的概念。
2. 讲解溶液的组成:讲解溶剂和溶质的概念,阐述溶液的均匀性。
3. 学习溶液的组成表示方法:(1) 摩尔浓度:介绍摩尔浓度的定义和计算方法。
(2) 质量分数:介绍质量分数的定义和计算方法。
(3) 体积分数:介绍体积分数的定义和计算方法。
4. 实例分析:分析实际问题,运用溶液的组成表示方法进行解答。
5. 课堂小结:总结本节课所学内容,强调溶液的组成及表示方法的重要性。
6. 作业布置:布置练习题,巩固所学知识。
7. 实验环节:安排学生进行溶液组成的实验,培养学生的实验操作能力和观察能力。
8. 课堂反馈:课后收集学生作业,了解学生掌握情况,为下一步教学做好准备。
9. 教学反思:根据学生反馈,调整教学方法,优化教学内容。
10. 课后拓展:引导学生关注溶液在生活和生产中的应用,提高学生的实践能力。
六、教学评价:评价方式:课堂问答、练习题、实验报告评价内容:1. 溶液的概念的理解程度2. 溶液组成表示方法的掌握程度3. 实验操作能力和观察能力的展现七、教学资源:1. 教学PPT2. 实验器材:烧杯、量筒、滴定管等3. 练习题库4. 相关文献和案例资料八、教学进度安排:课时:2课时第一课时:1. 引入新课,讲解溶液的概念(20分钟)2. 讲解溶液的组成,学习溶液的组成表示方法(20分钟)3. 实例分析,运用溶液的组成表示方法解决问题(20分钟)第二课时:1. 课堂小结,回顾溶液的组成及表示方法的重要性(10分钟)2. 实验环节,进行溶液组成的实验(30分钟)3. 课堂反馈,收集学生作业,了解学生掌握情况(10分钟)4. 教学反思,调整教学方法,优化教学内容(10分钟)九、教学建议:1. 在讲解溶液的组成表示方法时,注意通过实际例子引导学生理解和运用。
溶液及溶液组成的表示方法

溶液及溶液组成的表示方法广义上讲,溶液是一种簇拥体系,通常所谓的溶液是指液态溶液,其中最频繁的又是以水为溶剂的水溶液,简称溶液。
它与农业和生物科学有着疏远的联系。
这是由于生物体内的许多生化过程都是在水溶液中举行的。
例如,人们的生活用水就是含有一定矿物质的水溶液;动物对养分成分的汲取,植物从土壤中吸取氮、磷、钾等都是通过溶液来输送的。
因此,学习和把握有关溶液的一些基础学问具有很重要的意义。
一、簇拥系人们用观看、试验等手段举行科学讨论及生产实践时,必需首先确定所要讨论的对象,这种被确定的讨论对象称为体系。
体系中物理性质和化学性质彻低相同的部分称为相。
相与相之间有显然的界面。
含有一个相的体系叫单相体系或均相体系,例如,氯化钠溶液、空气等。
含有两个或两个以上相的体系叫多相体系,例如原油、牛奶等。
一种或几种物质簇拥在另一种物质中所形成的体系叫簇拥体系,简称簇拥系。
簇拥系中被簇拥的物质叫簇拥质或簇拥相,而容纳簇拥质的物质叫簇拥剂或簇拥介质。
例如,氯化钠溶于水所形成的氯化钠溶液,水滴簇拥在空气中形成的云雾,其中氯化钠和水滴为簇拥质,水和空气为簇拥剂。
根据簇拥质和簇拥剂聚拢状态的不同,簇拥系可以分为9种。
根据簇拥质粒子的大小或者簇拥度的凹凸,簇拥系可以分为以下3类。
1.粗簇拥系粗簇拥系中簇拥质粒子直径在10-7 m以上。
被簇拥的粒子普通不能透过滤纸,在一般显微镜下甚至用肉眼就可观看到簇拥质粒子。
这类簇拥系是不稳定的多相体系,静置时簇拥质粒子很简单从簇拥剂中分别出来。
频繁的粗簇拥系有悬浊液和乳浊液。
悬浊液是固体簇拥质簇拥到液体簇拥剂中所形成的粗簇拥系,如可湿性粉剂加水后制成的悬浮液等。
乳浊液是液体簇拥质以极小液滴的形式簇拥到液体簇拥剂中所形成的粗簇拥系,如牛奶、原油、多菌灵和乐果杀虫剂等。
2.分子或离子簇拥系分子或离子簇拥系中簇拥质粒子直径在10-9m以下,簇拥质的簇拥程度达到单个小分子或离子的大小。
分子或离子簇拥系是稳定的单相体系,即我们所认识的溶液,普通也称“真溶液”。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第周第课时星期月日
第五节溶液组成的表示方法(第三课时)
教学目标
知识目标:掌握溶液稀释的计算。
能力目标:通过对例题解法的讨论,拓宽思维、开拓视野、逐步提高解决问题的能力。
情感培养:通过例题书写格式的示范,培养学生严谨的学习态度。
教学重点溶液稀释的计算。
教学方法启发式、讨论式。
教学用具仪器:烧杯、玻璃棒。
药品:食盐、水。
教学过程
教师活动学生活动教学方法、目标
[复习]溶质质量分数的计算公式。
溶质质量计算公式。
[演示]将1克食盐放入烧杯中,再加入9毫升水。
用玻璃棒搅拌,至溶解。
再向上述烧杯中加入10毫程式水,搅拌。
[提问](1)试写出稀释成稀溶液,稀释后溶液质量、溶质质量分数、溶质质量如何变化?
[讨论]溶液稀释问题解题的关键是什么?
[投影]例题4(见课本144页)引导学生分析题意。
板书回答:溶质质
量分数=
溶质质量=溶液质量
溶质质量分数
回答:稀释前溶质
质量是1克,溶液质量是
10克,溶质质量分数是
10%。
稀释扣溶质质量是1
克。
溶液质量是20克,
溶质质量分数是5%。
回答:稀释扣溶液质量增
加,溶质质量分数减小,
溶质质量不变。
讨论回答:稀释前溶质质
量=稀释后溶质的质量。
巩固溶质质量分数的计算。
使学生从感性上认识稀释扣溶
液质量增加,溶质质量分数减小,而
溶质质量不变。
点明溶液稀释时,溶
质质量不变。
巩固溶液稀释问题的解题关
键。
[设问]根据稀释前后溶质的质量相等,怎样列出计算的方程式?讨论如何列出方程式。
试着列出方程式:
抓住解题关键,运用气温知
识,合理列出方程式。
学会此种解题
[提示]若设需要加入水的质量为x,请同学们列出方程式。
50克×98%=(50克+ x)
×20%
方法。
[板书]解法1:
解:设需加水的质量为x。
50克×98%=(50克+ x)×20%
答:把50克质量分数为98%的
稀释成质量分数为20%溶液需要水195
克。
[提示]若设稀释后溶液的质量为x,请同学列出方程式。
试着列出方程式50
克×98%= x×20%。
使学生掌握解题格式,书写步
骤。
培养学生严谨的学习态度。
[板书]解法2:
解:设稀释后溶液的质量为 x。
50克×98%=x×20%
245克-50克=195克
答:把50克质量分数为98%稀
释成质量分数为20%溶液需要水195克。
[设问]根据溶质质量分数的概念能否解此题呢?请同学们列出方程式。
[板书]解法3:
解:设需加水的质量为x。
答:(同解法1)
[小结]三种解法中,解法1比较简单。
[投影]课堂练习一(见附1)
指导做课堂练习一。
讨论如何列方程式。
写出方程式:
设需加水的质量为x。
在作业本上写出各练习题的一种解题过
程。
引导学生积
极思维,开动脑
筋,提高解决问
题的能力。
巩固溶液稀
释问题的解题方
法。
[投影]例题5(见课本144页)引导学生分析题意。
[提问]例题4、例题5的异同?能否用体积直接带入公式进行计算。
如何将体积换算质量呢? [提问]已知溶液体积、溶液密度、溶质质量分
数,你能否写出求溶质质量的计算公式。
[设问]根据上述公式,并根据稀释前后溶质质量相等。
你能否列出方程式。
[板书]解: 设需要98%体积为x 。
H 2SO 4
答:需98%
63.2毫升。
[投影]课堂练习二(见附2) 指导做课堂练习。
[投影]随堂检测(见附4)
回答:相同点是溶液稀释问题。
不同点是例4已知和求都指质量,而例5已知稀溶液体积求浓溶液体积。
溶质质量分数是质量比不能用体积直接带入公式计算。
用公式:
回答:用公式:
试着列出方程式:H 2SO 4 做检测题
教学生认真审题,找准各种量之间的关系,运用所学守的知识解决问题。
从而提高解题能力。
使学生掌握稀释问题中涉及溶液体积的解题方法。
巩固例题5的解题方法。
了解知识掌握情况。
附1:课堂练习一 1. 把200克20%的食盐水溶液稀释成10%的溶液需加水多少克?
2.
把30克质量分数为20%的氢氧化钠溶液加水稀释到100克。
此溶液中氢氧化钠的质量分数为多少?
附2:课堂练习二 升、3。
密度为1.047克/厘米、质量分数为10%的盐酸,需要38%的盐酸多少克?
4.制100亳升10%的稀
,需98%的多少毫升?水多少亳升?
(10%
密度为1.07克/厘米,98%的
密度为1.84克/厘米 )
附3:课堂练习答案 1.
200克 2、6% 3、137.8克 4、5.9毫升 约94.1亳升
附4:随堂检测 把50克98%的稀释成10%的稀
需加水多少克?
课后记:。
