最新配位平衡-习题及答案
(完整版)配位平衡和配位滴定法

配位平衡和配位滴定法自测题一.填空题1. 钴离子Co3+和4个氨分子、2个氯离子生成配离子,它的氯化盐的分子式为_______________ ,叫做 ____________ 。
2. 溴化一氯三氨二水合钴(山)的内界为______________ ,外界为_____________ 。
3. 四氯合铂(II)酸四氨合铜(II)的化学式为______________ 。
4. 在[RhBr 2(NH3)2]+中,Rh的氧化态为______________ ,配位数为______________ 。
5. K[CrCI 4(NH3)2]的名称是__________ ,Cr的氧化数是 __________ ,配位数是 __________ <6. 配离子[PtCI(NO 2)(NH 3)4]2+中,中心离子的氧化数为_____________ ,配位数为 _________该化合物的名称为 _________________ 。
7. 螯合物是由 __________ 和__________ 配位而成的具有环状结构的化合物。
8. 在[Ag(NH 3)2]NO3溶液中,存在下列平衡:Ag+ + 2NH 3 = [Ag(NH 3)2]+。
(1)若向溶液中力口入HCI,则平衡向 _______ 移动;(2)若向溶液中加入氨水,则平衡向____________ 移动。
9. [PtCI(NO 2)(NH3)4]CO3名称为_________________ ,中心离子的氧化数为_______ ,配离子的电荷数为 ________ 。
10. KCN为剧毒,而K4[Fe(CN)6]无毒,这是因为__________________________ 。
11. 金属离子M溶液的pH值增大时,副反应系数Y(H) _________________ ,M(OH) ________________ ,条件稳定常数K MY,的变化趋势是 _________________ 。
配位化学答案

配位化学答案一、选择题(每题1分,共15分)1-5A,A,C,B,D6-10C,D,D,B,D11-15B,C,B,B,A二、填空题(1题,每空0.5分,共7分;其余每空1分,共6分)1、+2,平面正方形,N,C u2+,4;d s p2,顺,-3,八面体,C,F e3+,6,s p3d2,顺2、1)硫酸四氨合铜(Ⅱ)2)六氰合铁(Ⅲ)酸钾3)三氯化三乙胺合钴(Ⅱ)4)c i s-[P t(C2H4)C l3].H2O5)N i[(C O)4]6)K3[F e(C N)6]三、名词解释(每题3分,共24分)1、配合物:可以给出孤对电子的分子和具有孤对电子的分子按照一定组成和空间构型所形成的化合物。
2、内轨型配合物:在形成配合物中,配位体的孤对电子所占空轨轨道是有(n-1)d轨道参与的杂化轨道[(n-1)d+ns+np],所以叫轨型配合物3、螯合物:由双齿或者多齿配体与同一个中心原子作用形成的具有环状结构的配合物4、键合异构:当一个单齿配体有两个可能用于配位的不同原子时,分别用不同的原子配位,可能产生键合异构现象5、多核配合物:含有2个或者2个以上中心原子(或者离子)的配合物6、Jahn-Teller 效应:电子在简并轨道中的不对称占据会导致分子的几何构型发生畸变,从而降低分子的对称性和轨道的简并度,使体系的能量进一步下降的现象称为Jahn-Teller 效应。
四、问答题(每题6分,共36分)1 简要阐明配合物的价键理论?答:1)中心离子或原子通过提供与配位数相等数目的杂化了的空轨道接受来自配体的孤电子对(或π键电子对)形成配位共价键。
2)杂化轨道与空间构型的关系为了增强成键能力,中心原子能量相近的空的价轨道要通过适当的方式线性组合成具有更强方向性的、符合σ对称性要求的等价杂化轨道。
2、简述配体的光谱化学序列?答:将一些常见配体按光谱实验测得的分裂能从小到大次序排列称为光谱化学序。
F->H2O>CO(NH2)2>NH3>C2O42-≈en>NCS->Cl-≈CN->Br->(C2H5O)2PS2≈S2-≈I ->C2H5O)2PSe2-3、用晶体场理论解释[Fe(CN)6]4-与FeSO4.7H2O的磁性差异?答:在上述两个配合物中,CN-是强场配体,分裂能大于电子成对能,所以中心原子铁采取低自旋,6个单电子全部成对,所以[Fe(CN)6]4-属于抗磁性配合物;而H2O是弱场配体,分裂能小于电子成对能,所以中心原子铁采取高自旋,6个单电子中只有1对成对,还有4个单电子,所以FeSO4.7H2O属于顺磁性配合物。
第八章 配位平衡 习题

第八章配位平衡习题一.选择题1、配位数是()A.中心离子(或原子)接受配位体的数目B.中心离子(或原子)与配位离子所带电荷的代数和C.直接与中心离子(或原子)配位的配位原子的总数D.中心离子(或原子)与配位体所形成的配位键数目2、乙二胺四乙酸根(-OOCCH2)2NCH2CH2N(CH2COO-)2可提供的配位原子数为()A. 2B. 4C. 6D. 83、下列叙述正确的是()A.配合物由正负离子组成B.配合物由中心离子(或原子)与配位体以配位键结合而成C.配合物由内界与外界组成D.配合物中的配位体是含有未成键的离子4、关于配位体,下列说法中不正确的是()A.配位体中具有孤对电子,与中心离子(或原子)形成配位键的原子称为配位原子B.多齿配位体只有两个配位原子C.只含一个配位原子的配位体称为单齿配位体D.配体的特征是能提供孤对电子5、化合物[Co(NH3)4Cl2]Br的名称是()A.溴化二氯·四氨钴酸盐(Ⅱ)B.溴化二氯·四氨钴酸盐(III)C.溴化二氯·四氨合钴(Ⅱ)D.溴化二氯·四氨合钴(III)6、下列说法中正确的是()A.配位原子的孤电子对越多,其配位能力就越强B.电负性大的元素充当配位原子,其配位能力就强C.能够供两个或两个以上配位原子的多齿配体只能是有机物分子D.内界中有配位键,也可能存在共价键7、下列配合物中,属于螯合物的是()A.[Ni (en)2]Cl2B.K2[PtCl6]C.(NH4) [Cr (NH3)2 (SCN)4]D.Li[AlH4]8、下列关于螯合物的叙述中,不正确的是()A.有两个以上配位原子的配位体均生成螯合物B.螯合物通常比具有相同配位原子的非螯合配合物稳定得多C.形成螯环的数目越大,螯合物的稳定性一定越好D.起螯合作用的配位体一般为多齿配为体,称螯合剂二、填空题1、配位化合物[Cu(NH3)4]2+的名称是。
2、配位化合物二氨合银离子的化学式是。
配位化合物与配位滴定法习题及答案

第九章 配位化合物与配位滴定法习题1.是非判断题1-1中心离子的未成对电子数越多,配合物的磁矩越大。
1-2配合物由内界和外界组成。
1-3配位数是中心离子(或原子)接受配位体的数目。
1-4配位化合物K 3[Fe(CN)5CO]的名称是五氰根·一氧化碳和铁(Ⅱ)酸钾。
1-5一般说来,内轨型配合物比外轨型配合物稳定。
1-6配合物中由于存在配位键,所以配合物都是弱电解质。
1-7同一种中心离子与有机配位体形成的配合物往往要比与无机配合体形成的配合物更稳定。
1-8配合物的配位体都是带负电荷的离子,可以抵消中心离子的正电荷。
1-9电负性大的元素充当配位原子,其配位能力强。
1-10在螯合物中没有离子键。
1-11配位物中心离子所提供杂化的轨道,其主量子数必须相同。
1-12配合物的几何构型取决于中心离子所采用的杂化类型。
1-13外轨型配离子磁矩大,内轨型配合物磁矩小。
1-14配离子的配位键越稳定,其稳定常数越大。
1-15氨水溶液不能装在铜制容器中,其原因是发生配位反应,生成[Cu(NH 3)4]2+,使铜溶解。
1-16在配离子[Cu(NH 3)4]2+解离平衡中,改变体系的酸度,不能使配离子平衡发生移动。
1-17已知[HgI 4]2-的4θβ=K 1,[HgCl 4]2-的4θβ=K 2,,则反应[HgCl 4]2-+4I -=[HgI 4]2-+4Cl -的平衡常数为K 1/K 2。
1-18 [Cu(NH 3)3]2+ 的积累稳定常数β3是反应[Cu(NH 3)2]2+ + NH 3[Cu(NH 3)3]2+的平衡常数。
1-19已知θϕ[Fe 3+/Fe 2+]=,电极反应[Fe(C 2O 4)3]3-+ e=[Fe(C 2O 4)2]2-+ C 2O 42-,在标准状态时,θϕ的计算式为:θθθθθϕϕc O C c c O C Fe c c O C Fe c Fe F /)(/])([/])([lg 0592.0)/e 2422242334223---+⋅++(= 。
配位化学考研试题及答案

配位化学考研试题及答案一、选择题(每题2分,共20分)1. 下列哪项是配位化学中配体的特征?A. 能够提供孤对电子B. 能够接受孤对电子C. 能够提供空轨道D. 能够接受空轨道答案:A2. 在配位化合物中,中心离子或原子的电荷数与配位数的乘积称为?A. 配位数B. 配位数C. 配位能力D. 配位价答案:D3. 配位化合物的几何构型通常由什么决定?A. 中心离子的大小B. 配体的类型C. 配位数D. 以上都是答案:D4. 配位化合物的稳定性主要取决于什么?A. 配体的类型B. 中心离子的电荷C. 配位数D. 配位化合物的几何构型答案:A5. 配位化合物中,配体与中心离子之间的键被称为?A. 离子键B. 共价键C. 配位键D. 金属键答案:C6. 下列哪种类型的配体是硬酸?A. 氨B. 硫氰酸根C. 碘离子D. 溴离子答案:A7. 硬碱和硬酸之间的相互作用被称为?A. 软相互作用B. 硬相互作用C. 软硬相互作用D. 非相互作用答案:B8. 配位化学中,哪种类型的配体可以提供多个孤对电子?A. 单齿配体B. 双齿配体C. 多齿配体D. 桥联配体答案:C9. 配位化合物中,中心离子的氧化态通常由什么决定?A. 配体的类型B. 中心离子的电子构型C. 配位数D. 配位化合物的几何构型答案:B10. 配位化学中,哪种类型的配体可以作为桥联配体?A. 单齿配体B. 双齿配体C. 多齿配体D. 所有类型的配体答案:C二、填空题(每题2分,共20分)1. 配位化合物中,中心离子或原子的电荷数与配位数的乘积称为配位价。
2. 配位化合物的稳定性主要取决于配体的类型。
3. 硬碱和硬酸之间的相互作用被称为硬相互作用。
4. 配位化合物中,中心离子的氧化态通常由中心离子的电子构型决定。
5. 配位化合物的几何构型通常由配位数决定。
6. 配位化学中,多齿配体可以作为桥联配体。
7. 配位化合物中,配体与中心离子之间的键被称为配位键。
南昌大学大学化学第七章习题答案
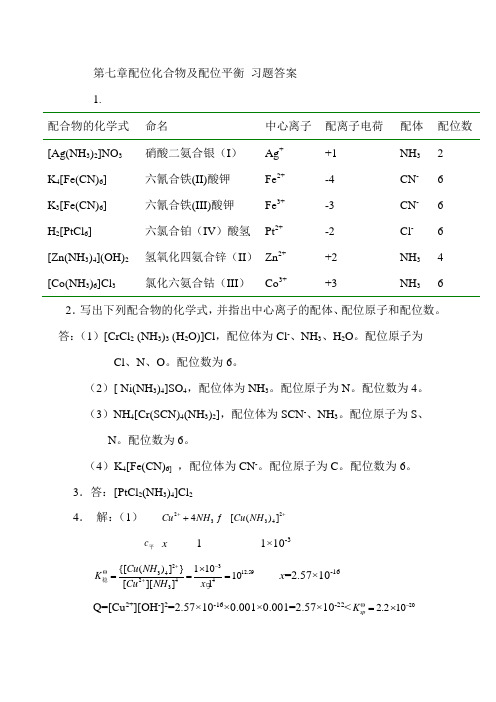
第七章配位化合物及配位平衡 习题答案 1.配合物的化学式 命名 中心离子 配离子电荷 配体 配位数 [Ag(NH 3)2]NO 3 硝酸二氨合银(I ) Ag + +1 NH 3 2 K 4[Fe(CN)6] 六氰合铁(II)酸钾 Fe 2+ -4 CN - 6 K 3[Fe(CN)6] 六氰合铁(III)酸钾Fe 3+-3 CN - 6 H 2[PtCl 6] 六氯合铂(IV )酸氢 Pt 2+ -2 Cl - 6 [Zn(NH 3)4](OH)2 氢氧化四氨合锌(II ) Zn 2+ +2 NH 3 4 [Co(NH 3)6]Cl 3氯化六氨合钴(III )Co 3++3NH 362.写出下列配合物的化学式,并指出中心离子的配体、配位原子和配位数。
答:(1)[CrCl 2 (NH 3)3 (H 2O)]Cl ,配位体为Cl -、NH 3、H 2O 。
配位原子为Cl 、N 、O 。
配位数为6。
(2)[ Ni(NH 3)4]SO 4,配位体为NH 3。
配位原子为N 。
配位数为4。
(3)NH 4[Cr(SCN)4(NH 3)2],配位体为SCN -、NH 3。
配位原子为S 、N 。
配位数为6。
(4)K 4[Fe(CN)6] ,配位体为CN -。
配位原子为C 。
配位数为6。
3.答:[PtCl 2(NH 3)4]Cl 24. 解:(1) 223344[()]Cu NH Cu NH +++ c 平 x 1 1×10-32312.59342443{[()]}11010[][]1Cu NH K Cu NH x +-Θ+⨯=== 稳x =2.57×10-16 Q=[Cu 2+][OH -]2=2.57×10-16×0.001×0.001=2.57×10-22<202.210sp K Θ-=⨯无沉淀。
(2) Q=[Cu 2+][S 2-]=2.57×10-16×0.001=2.57×10-19>366.310sp K Θ-=⨯,有沉淀。
《分析化学》第5章》配位滴定复习题及答案

一、判断题1、(配位比例特点)配位滴定反应中EDTA 与金属离子的比例一般都是1:1。
(√)2、(稳定常数的概念)EDTA 与某金属离子形成的配合物具有较大的稳定性,也就意味着EDTA 与该金属离子配位反应平衡常数较大。
(√)3、(滴定突跃显著性的影响因素)配位滴定中所有的副反应都对使滴定突跃范围变窄。
(×)4、(副反应系数的数值)若滴定过程中不发生副反应,则副反应系数数值为0。
(×)5、(总副反应系数与分副反应系数的关系)某物质可发生两种副反应,则该物质总的副反应系数为两分副反应系数的加和。
(×)6、(酸效应系数的基本概念)配位滴定中,溶液的pH 越高,则酸效应系数越大。
(×)7、(羟基配位效应系数的基本概念) 配位滴定中,溶液的pH 越高,则羟基配位效应系数越大。
(√)8、(金属指示剂原理)EDTA 滴定金属离子,若使用金属指示剂指示SP ,则EDTA 滴入量在SP 附近时指示剂应发生配位态到游离态的转变。
(√)9、(金属指示剂原理)配位滴定时指示剂与待测金属离子形成的配合物的条件稳定常数越大越好。
(×)10、(金属指示剂原理)金属指示剂只有在合适的pH 条件下,游离态与配位态才会有显著的颜色差异。
(√)11、(金属指示剂原理)金属指示剂的封闭现象是指其与金属形成的配合物溶解性差,使变色反应变慢,而导致终点拖后延长。
(×)12、(金属指示剂原理)金属指示剂的僵化现象是指其与金属形成的配合物稳定性太强,计量点处不明显发生配位态到游离态的转变,而导致无法准确指示计量点。
(×)13、(掩蔽的作用)用EDTA 滴定法测定石灰石中的CaO 和MgO ,滴定前需向溶液中加入三乙醇胺,其目的是掩蔽Fe 3+、Al 3+和 Mn 2+,防止干扰测定。
(√)14、(掩蔽的作用)用EDTA 滴定Ca 2+和Mg 2+的混合溶液前,先将溶液pH 调至≥12,目的是使Mg 2+生成沉淀,通过掩蔽消除其对Ca 2+测定的干扰。
无机与分析化学第九章答案

第9章配位平衡与配位滴定法1.无水CrC13和氨作用能形成两种配合物A和B,组成份别为CrC13·6NH3和CrC13·5NH3。
加入AgNO3,A溶液中几乎全数的氯沉淀为AgC1,而B溶液中只有三分之二的氯沉淀出来。
加入NaOH并加热,两种溶液均无氨味。
试写出这两种配合物的化学式并命名。
解:A [Cr(NH3)6]Cl3三氯化六氨合铬(Ⅲ)B [Cr Cl (NH3)5]Cl2二氯化一氯·五氨合铬(Ⅲ)2.指出下列配合的的中心离子、配体、配位数、配离子电荷数和配合物名称。
K2[HgI4] [CrC12(H2O)4]C1 [Co(NH3)2(en)2](NO3)2Fe3[Fe(CN)6]2K[Co(NO2)4(NH3)2] Fe(CO)5解:3.试用价键理论说明下列配离子的类型、空间构型和磁性。
(1)[CoF6]3-和[Co(CN)6 ]3- (2)[Ni(NH3)4]2+和[Ni(CN)4]2-解:4.将·L-1ZnC12溶液与·L-1NH3溶液等体积混合,求此溶液中[Zn(NH3)4]2+和Zn2+的浓度。
解: Zn 2+ + 4NH 3 = [Zn(NH 3)4]2+ 平衡浓度/mol·L -1 x ×+4x ≈ ≈94342243109230050⨯=⋅==++..x .)NH (c )Zn (c ))NH (Zn (c K f θx =c(Zn 2+)=×10-9mol·L -15.在·L -1[Ag(NH 3)2]+溶液中加入1mL 1mol·L -1NaC1溶液,溶液中NH 3的浓度至少需多大才能阻止AgC1沉淀生成?解: [Ag(NH 3)2]++Cl - = AgCl + 2NH 3 平衡浓度/mol·L -1 c(NH 3)107233210771101111-+-⨯⨯⨯===..K K ))NH (Ag (c )Cl (c )NH (c K sp f j 11073510107711011010050--⋅=⨯⨯⨯⨯=Lmol .....)NH (c6.计算AgC1在·L -1氨水中的溶解度。
8.配位平衡和配位滴定法

习 题八一、选择题(将正确答案的序号填在括号内) 1.下列配合物中心离子的配位数有错误的是( )a.[Co(NO 2)3(NH 3)3];b.K 2[Fe(CN)5NO];c.[CoCl 2(NH 2)2(en)2];d.[Co(NH 3)4Cl 2]Cl 。
2.关于配合物,下列说法错误的是( )a.配体是一种可以给出孤对电子或π健电子的离子或分子;b.配位数是指直接同中心离子相连的配体总数;c.广义地讲,所有金属离子都可能生成配合物;d.配离子既可以存在于晶体中,也可以存在于溶液中。
3.关于外轨型与内转型配合物的区别,下列说法不正确的是( )a.外轨型配合物中配位原子的电负性比内轨型配合物中配位原子的电负性大;b.中心离子轨道杂化方式在外轨型配合物是ns 、np 、nd 轨道杂化,内轨型配合物是(n-1)d 、ns 、np 轨道杂化;c.一般外轨型配合物比内轨型配合物键能小;d.通常外轨型配合物比内轨型配合物磁矩小。
4.当下列配离子浓度及配体浓度均相等时,体系中Zn 2+离子浓度最小的是( )a.()+243NH Zn ; b.()+22en Zn ;c. ()-24CN Zn d.()-24OH Zn。
5.Fe(Ⅲ)形成配位数为6的外轨型配合物中,Fe 3+离子接受孤对电子的空轨道是( )a.d 2sp 3;b.sp 3d 2;c.p 3d 3d.sd 5 6.下列配离子能在强酸性介质中稳定存在的是( )a.()-3232O S Ag ; b.()+243NH Ni ; c.()-3342O C Fe ; d.-24HgCl 。
7.测得()+363NH Co 的磁矩µ=0.0B· M,可知Co 3+离子采取的杂化类型为( )a.d 2sp 3;b.sp 3d 2;c.sp 3 ;d.dsp 2 8.下列物质具有顺磁性的是( )a.()+23NH Ag ; b.()-46CN Fe ; c.()+243NH Cu ; d.()-24CN Zn9.下列物质中,能作为螯合剂的为( )a.HO-OH ;b.H 2N-NH 2;c.(CH 32)2N-NH 2;d.H 2N-CH 2-CH 2-NH 2。
中山大学无机化学第8章配位化合物与配位平衡习题及答案

第8章 配位化合物与配位平衡一、选择题8-1 下列配合物的命名不正确的是: ( ) (A) (B)(C)(D)答案: B8-2 下列离子都可以作为配合物的中心原子,但生成的配合物稳定性最差的是: ( ) (A) (B) (C) (D) 答案: D 8-3 的名称是: ( )(A) 三氯化一水二吡合铬(III ) (B) 一水合三氯化二吡合铬(III ) (C) 三氯一水二吡合铬(III ) (D) 一水二吡三氯合铬(III ) 答案: C8-4 下列哪种物质是顺磁性的: ( )(A)(B) (C)(D) 答案: B 8-5用溶液处理再结晶,可以取代化合物中的,但的含量不变,用过量处理该化合物,有氯含量的氯以沉淀析出,这种化合[]()3233K Co(NO )Cl III 三氯三硝基合钴酸钾[]()3233K Co(NO )Cl III 三硝基三氯合钴酸钾()()()2323Co OH NH Cl Cl III ⎡⎤⎣⎦氯化二氯一水三氨合铬[]()26H PtCl IV 六氯合铂酸3+Sc 3+Cr 3+Fe 3+La ()()232Cr py H O Cl ⎡⎤⎣⎦()234Zn NH +⎡⎤⎣⎦()336Co NH +⎡⎤⎣⎦[]4TiF ()336Cr NH +⎡⎤⎣⎦33CoCl 4NH ⋅24H SO 2-4SO -Cl 3NH 3AgNO 1/3AgCl物应该是: ( )(A)(B) (C)(D)答案: A 8-6 羰基合物的磁矩为零,它的空间构型为: ( )(A) 三角双锥形 (B) 四方形(C) 三角锥形 (D) 四方锥形 答案: A8-7 配离子的磁矩为: ( ) (A) 3.88(B) 2.83 (C) 5.0 (D) 0 答案: D8-8 配离子的稳定性与其配位键类型有关,根据价键理论,可以判断下列配合物稳定性的大小,指出正确的是: ( )(A)(B)(C) (D) 答案: B 8-9 化合物的磁矩为,而的磁矩为,对于这种差别可以用下列哪一项所叙述的理由来解释: ( )(A) 铁在这两种化合物中有不同的氧化数 (B) 氰离子比氟离子引起更多的轨道分裂 (C) 氟比碳、氮具有更大的电负性 (D) 氰离子是弱的电子授体 答案: B8-10 某金属中心离子形成配离子时,由于配体的不同,其电子分布可以有1个未成对电()324Co NH Cl Cl ⎡⎤⎣⎦()334Co NH Cl ⎡⎤⎣⎦()324Co NH Cl Cl ⎡⎤⎣⎦()334Co NH Cl ⎡⎤⎣⎦()5Fe CO ⎡⎤⎣⎦()32Cu NH +⎡⎤⎣⎦()B.M.()()33266Fe CN Fe H O -+⎡⎤⎡⎤<⎣⎦⎣⎦()()32266Fe CN Fe H O -+⎡⎤⎡⎤>⎣⎦⎣⎦()()322Ag CN Ag NH -+⎡⎤⎡⎤=⎣⎦⎣⎦()()322Ag CN Ag NH -+⎡⎤⎡⎤<⎣⎦⎣⎦[]36K FeF 5.9B.M.()36K Fe CN ⎡⎤⎣⎦2.4B.M.d d子,也可以有5个未成对电子,此中心离子是: ( ) (A) (B) (C) (D)答案: C8-11 根据晶体场理论,高自旋配合物的理论判据是: ( ) (A) 分裂能 > 成对能 (B) 电离能 > 成对能 (C) 分裂能 > 成键能 (D) 分裂能 < 成对能 答案: D8-12 某金属离子在八面体弱场中的磁矩为 4.9 B.M.,而它在八面体强场中的磁矩为零,该中心金属离子可能是: ( ) (A) (B) (C)(D) 答案: D二、计算题和问答题8-13 用晶体场理论判断配离子,,,(,Co(III) 的电子成对能)是高自旋还是低自旋,并计算配合物的磁矩以及晶体场稳定化能(CFSE )。
配位平衡习题及答案

配位平衡习题及答案配合平衡习题及答案一、判断题:1、Cu (Ⅱ) 、Zn (Ⅱ) 、Cd (Ⅱ) 得易溶盐较多。
( )2、金属锌可以与过量得氨水反应生成氢气。
( )3、Zn 、Cd 、Hg 得金属活泼性分别比Cu 、Ag 、Au 强。
.......... ( )4、[ Cu (NH3 )4 ]2+ 得空间构型为正四面体,Cu2+ 以sp3 杂化轨道与NH3 形成配位键。
、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、( )5、Zn2+ 、Cd2+ 、Hg2+ 与EDTA 形成配位数为 4 得螯合物。
( )二、选择题:1、下列物质在酸性溶液中可以将Mn2+氧化为MnO4得就是、、、、、、、、、、、、、、、、、( )。
(A) PbO; (B) Bi3+; (C) NaClO; (D) (NH4 )2 S2O8。
2、下列金属中,延展性最好得就是....................................................... ( )。
(A) 银; (B) 金; (C) 铜; (D) 锌。
3、下列反应中,配离子作氧化剂得就是......................................... ( )。
(A) [Cu (OH)4]2 与甲醛反应; (B)[ Fe (CN)6]4 与FeCl3 反应;(C) [Co (NH3 )6]2+ 与O2 反应; (D)[ Ag (NH3 )2]+ 与KI 反应。
4、下列化合物中易溶于水得就是...................................................... ( )。
(A) Cu2O ; (B) CuCl ; (C) CuCl2 ; (D) CuI 。
13 配位滴定习题

10、为了测定水中 Ca 、 Mg 的含量,以下消除少量 Fe3+、Al3+干扰的方法中,正确的是 A.于 pH=10 的氨性溶液中直接加入三乙醇胺 D.加入三乙醇胺时,不需要考虑溶液的酸碱性
1
C.于酸性溶液中加入三乙醇胺,然后调至 pH=10 的氨性溶液
三、填空题 1、EDTA 滴定中,终点时溶液呈 的 配合物应_ _与 。 和 值与 pH 的关系求出,反映 pH 与 。 颜色.为使准确指示终点,要求(I)在滴定 pH 条件下,指示剂 有明显差别; (II)指示剂金属离子配合物的 ________ ;(III)指示剂金属离子
__, 再用 EDTA 滴定测得___
1、称取含磷试样 0.1000 g,处理成溶液,并把磷沉淀为 MgNH4PO4,将沉淀过滤洗净后再溶解,然后 用 c(H4y)=0.01000 mol· L-1 的 EDTA 标准溶液滴定,共消耗 20.00 mL,求该试样中 P2O5 的百分含量。 2、 为了测定冰晶石(Na3AlF6)矿样中 F 的含量, 称取试样 1.524 g, 溶解后定容至 100 mL, 移取 25.00 mL, 加入 0.2000 mol· L-1 Ca2+离子溶液 25 mL,使生成 CaF2 沉淀,经过滤收集滤液和洗涤液,调 pH 为 10, 以钙指示剂指示终点,用 0.01240 mol· L-1EDTA 滴定,消耗 20.17 mL,求冰晶石中 F 的含量。 3、在含有 0.020 mol· L-1CaCl2 的 NH3-NH4Cl 缓冲溶液中,已知 NH3 的浓度为 1.00 mol· L-1,该缓冲溶 液的 pH 为 10.0,用等体积的 0.020 mol· L-1 的 EDTA 溶液与上述溶液混合,计算溶液中残留的 Ca2+的 浓度。已知: K 稳 (Cay)=1.0×1011, Ka3(H4y)=6.9×10-7,Ka4(H4y)=5.9×10-11。 4、为测定水样中 Cu2+及 Zn2+的含量,移取水样 100 mL,用碘量法测定 Cu2+的量,消耗 20.20 ml 的 0.1000 mol· L-1Na2S2O3 溶液; 另取水样 10.0 mL, 调节 pH=2.5 后, 加入 50.00 mL 的 0.01000 mol· L-1 EDTA 溶液剩余的 EDTA 恰好与 12.00 mL 的 0.01000 mol· L-1 Cu2+标准溶液反应完全, 计算水样中 Cu2+和 Zn2+ 的含量(g· L-1)。 5、用 0.01060 mol· L-1 EDTA 标准溶液滴定水中的钙和镁含量。准确移取 100.0 mL 水样,以铬黑 T 为 指示剂,在 pH=10 时滴定,消耗 EDTA 溶液 31.30 mL;另取一份 100.0 mL 水样,加 NaOH 溶液使呈强 碱性, 用钙指示剂指示终点, 消耗 EDTA 溶液 19.20 mL, 计算水中钙和镁的含量 (以 CaO mg· L-1 和 MgCO3 mg· L-1 表示)。 一、判断题 1、√2、× 3、× 4、√ 5、× 二、选择题 1、 D 2、 A 3、 B 4、B 5、 D 6、B,C 7、 C 8、B,C 9、B 6、× 7、× 8、√
配位滴定总结复习练学习试题有答案

第七章配位滴定法练习题一、选择题1、某溶液主要含有C a2+、Mg2+及少量铬黑T为指示剂,那么测出的是〔〕Fe3+、Al3+,今在pH=10的参加三乙醇胺,以EDTA滴定,用A、Mg2+量B、Ca2+量C、Ca2+、Mg2+总量D、Ca2+、Mg2+、Fe3+、Al3+总量2、准确滴定单一金属离子的条件是〔〕A、lgcM K′MY≥8B、lgcMKMY≥8C、lgcM K′MY≥6D、lgcMKMY≥63、在配位滴定中,直接滴定法的条件包括〔〕A、lgcK'MY≤8B、溶液中无干扰离子C、有变色敏锐无封闭作用的指示剂D、反响在酸性溶液中进行4、EDTA 滴定Zn +3Cl可〔〕时,参加NH-NHA、防止干扰B、控制溶液的pH 值C、使金属离子指示剂变色更敏锐D、加大反响速度5、取水样100mL,用C〔EDTA〕=L,标准溶液测定水的总硬度,用去毫升,计算水的总硬度是( )〔用CaCOmg/L表示〕3A、20mg/LB、40mg/LC、60mg/LD、80mg/L6、配位滴定终点所呈现的颜色是〔〕A、游离金属指示剂的颜色B、EDTA与待测金属离子形成配合物的颜色C、金属指示剂与待测金属离子形成配合物的颜色D、上述A与C的混合色7、在EDTA配位滴定中,以下有关酸效应系数的表达,〕正确的选项是〔A、酸效应系数越大,配合物的稳定性愈大B、酸效应系数越小,配合物的稳定性愈大C、pH值愈大,酸效应系数愈大D、酸效应系数愈大,配位滴定曲线的pM突跃范围愈大8、以配位滴定法测定Pb2+时,消除Ca2+、Mg2+干扰最简便的方法是〔〕A、配位掩蔽法B、控制酸度法C、沉淀别离法D、解蔽法9、EDTA的有效浓度[Y]与酸度有关,它随着溶液pH值增大而〔〕A、增大B、减小C、不变D、先增大后减小10、EDTA法测定水的总硬度是在pH=()的缓冲溶液中进行,钙硬度是在pH=()的缓冲溶液中进行。
A、4-5B、6-7C、8-10D、12-1311、用EDTA测定SO42-时,应采用的方法是〔〕A、直接滴定B、间接滴定C、返滴定D、连续滴定12、产生金属指示剂的僵化现象是因为〔〕A、指示剂不稳定 B 、MIn溶解度小C、KˊMIn<KˊMYD、KˊMIn>KˊMY13、产生金属指示剂的封闭现象是因为〔〕A、指示剂不稳定B、MIn溶解度小C、KˊMIn<KˊMYD、KˊMIn>KˊMY14、配合滴定所用的金属指示剂同时也是一种〔〕A、掩蔽剂B、显色剂C、配位剂D、弱酸弱碱15、使MY稳定性增加的副反响有〔〕A、酸效应B、共存离子效应C、水解效应D、混合配位效应16、在Fe3+、Al3+、Ca2+、Mg2+混合溶液中,用EDTA测定Fe3+、Al3+的含量时,为了消除Ca2+、Mg2+的干扰,最简便的方法是〔〕A、沉淀别离法B、控制酸度法C、配位掩蔽法D、溶剂萃取法17、水硬度的单位是以CaO为基准物质确定的,10为1L水中含有〔〕A、1gCaOB、C、D、18、配位滴定中,使用金属指示剂二甲酚橙,要求溶液的酸度条件是〔〕A、pH=~B、C、pH>D、pH<19、用EDTA标准滴定溶液滴定金属离子M,假设要求相对误差小于%,那么要求〔A、CM KˊMY≥106B、CM KˊMY≤106C、KˊMY≥106D、KˊMYαY(H)≥10620、配位滴定中参加缓冲溶液的原因是〔〕A、EDTA配位能力与酸度有关B、金属指示剂有其使用的酸度范围C、EDTA与金属离子反响过程中会释放出+HD、Kˊ会随酸度改变而改变MY21、测定水中钙硬时,Mg2+的干扰用的是()消除的。
习题解答10

第十章配位化合物和配位-离解平衡习题解答:1. 给以下各配离子命名(略):⑴Zn(NH3);⑵Co(NH3)3Cl3;⑶FeF;⑷Ag(CN);⑸[Fe(CN)5NO2] 3-。
2. Al2S3受潮时发出一种腐败气味,写出该反应的平衡化学方程式并用软硬酸碱理论讨论之。
(略)3. 对下列各组中的物质两两比较,哪一个可能存在?如都能存在,哪一个稳定性更大?简述理由。
答:⑴ Na2SO4 >Cu2SO4硬亲硬⑵ AlI63- 不存在,AlF63-硬亲硬⑶ HgI42- > HgF42-软亲软⑷ PbI42-> PbCl42-软亲软4. 用晶体场理论解释,为什么ZnCl42- 和NiCl42- 为四面体构型,而PtCl42-和CuCl42- 为平面正方形构型?答: Zn2+为3d10, CFSE =0, 所以ZnCl42-四面体构型; Cu2+为3d9, 弱场条件下正方形场的CFSE 最大, 所以CuCl42- 为平面正方形构型.d8构型的中心离子, 在强场条件下均形成正方形, 在弱场条件下可形成四面体或正方形. Ni2+和Pt2+均为d8构型, 与相同配体结合时, Pt2+的分裂能大于Ni2+的分裂能,所以Pt2+的8个d电子成对, PtCl42-为正方形构型; Ni2+的分裂能较小于电子成对能,故NiCl42-为四面体构型.附:Acta Cryst. (1974). A30, 484-486 [ doi:10.1107/S0567739474001161 ] Relation entre la symétrie des groupements CuCl42-tétraédriques et les propriétés physiques descupritétrachlorures. I. Moment magnétique moyenJ. Lamotte-Brasseur et G. van den BosscheAbstract: For some crystals, the structures of which have already been determined, the flattening, D, of the CuCl42- tetrahedra has been estimated. The paramagnetic susceptibilities of many tetrachlorocuprates have been measured by the Faraday method. The mean magnetic moment decreases linearly as D increases, if D is greater than 0.2. From the known meanmagnetic moment, it is therefore possible to estimate the D value of the CuCl42- tetrahedron.5. 氯化铜溶液随浓度的增大,颜色由浅兰色变为绿色再变为土黄色。
第七章 配位化合物与配位平衡测验题与答案

第七章. 配位化合物与配位平衡测验题一、选择题1、欲用EDTA测定试液中的阴离子,宜采用: ()A.直接滴定法;B.返滴定法;C.置换滴定法;D.间接滴定法2、用EDTA测定Cu2+,Zn2+,Al3+中的Al3+,最合适的滴定方式是: ()A.直接滴定;B.间接滴定;C.返滴定;D.置换滴定(已知lg K CuY=18.8,lg K ZnY=16.5,lg K AlY=16.1)3、EDTA滴定Al3+的pH一般控制在4.0~7.0范围内。
下列说法正确的是: ()A.pH<4.0时,Al3+离子水解影响反应进行程度;B.pH>7.0时,EDTA的酸效应降低反应进行的程度;C.pH<4.0时,EDTA的酸效应降低反应进行的程度;D.pH>7.0时,Al3+的NH3配位效应降低了反应进行的程度4、在Fe3+,Al3+,Ca2+,Mg2+的混合液中,用EDTA法测定Fe3+,Al3+,要消除Ca2+,Mg2+的干扰,最简便的方法是采用: ()A.沉淀分离法;B.控制酸度法;C.溶液萃取法;D.离子交换法5、用指示剂(In),以EDTA(Y)滴定金属离子M时常加入掩蔽剂(X)消除某干扰离子(N)的影响。
不符合掩蔽剂加入条件的是: ()A.K NX<K NY;B.K NX>>K NY;C.K MX<<K MY;D.K MIn>K MX6、已知lg K BiY=27.9;lg K NiY=18.7。
今有浓度均为0.01mol⋅L−1的Bi3+,Ni2+混合试液。
欲测定其中Bi3+的含量,允许误差<0.1%,应选择pH值为: ()pH 0 1 2 3 4 5lgαY(H)24 18 14 11 8.6 6.6A.<1;B.1~2;C.2~3;D.>47、某配离子[M(CN)4]2-的中心离子M2+以(n-1)d、ns、np轨道杂化而形成配位键,则这种配离子的磁矩和配位键的极性将...........................................................................................()。
配位习题

一、单选题:1、某溶液主要含有Ca2+、Mg2+及少量Fe3+、Al3+,今在pH=10的加入三乙醇胺,以EDTA滴定,用铬黑T为指示剂,则测出的是()A、Mg2+量B、Ca2+量C、Ca2+、Mg2+总量D、Ca2+、Mg2+、Fe3+、Al3+总量2、准确滴定单一金属离子的条件是()A、lgcMK′MY≥8B、lgcMK MY≥8C、lgcMK′MY≥6D、lgcMK MY≥63、在配位滴定中,直接滴定法的条件包括()A、lgcK'MY≤ 8B、溶液中无干扰离子C、有变色敏锐无封闭作用的指示剂D、反应在酸性溶液中进行4、EDTA 滴定Zn2+时,加入NH3-NH4Cl可()A、防止干扰B、控制溶液的pH值C、使金属离子指示剂变色更敏锐D、加大反应速度5、取水样100mL,用C(EDTA)=0.02000mol/L,标准溶液测定水的总硬度,用去4.00毫升,计算水的总硬度是( )(用CaCO3 mg/L表示)A、20mg/LB、40 mg/LC、60 mg/LD、80mg/L6、配位滴定终点所呈现的颜色是()A、游离金属指示剂的颜色B、EDTA与待测金属离子形成配合物的颜色C、金属指示剂与待测金属离子形成配合物的颜色D、上述A与C的混合色7、在EDTA配位滴定中,下列有关酸效应系数的叙述,正确的是()A、酸效应系数越大,配合物的稳定性愈大B、酸效应系数越小,配合物的稳定性愈大C、pH值愈大,酸效应系数愈大D、酸效应系数愈大,配位滴定曲线的pM突跃范围愈大8、以配位滴定法测定Pb2+时,消除Ca2+、Mg2+干扰最简便的方法是()A、配位掩蔽法B、控制酸度法C、沉淀分离法D、解蔽法9、EDTA的有效浓度[Y]与酸度有关,它随着溶液pH值增大而()A、增大B、减小C、不变D、先增大后减小10、EDTA法测定水的总硬度是在pH=( )的缓冲溶液中进行,钙硬度是在pH=( )的缓冲溶液中进行。
(完整版)配位滴定练习题有答案

配位滴定法练习题一、选择题1、某溶液主要含有Ca2+、Mg2+及少量Fe3+、Al3+,今在pH=10的加入三乙醇胺,以EDTA滴定,用铬黑T为指示剂,则测出的是()A、Mg2+量B、Ca2+量C、Ca2+、Mg2+总量D、Ca2+、Mg2+、Fe3+、Al3+总量2、准确滴定单一金属离子的条件是()A、lgc M K′MY≥8B、lgc M K MY≥8C、lgc M K′MY≥6D、lgc M K MY≥63、在配位滴定中,直接滴定法的条件包括()A、lgcK'MY≤ 8B、溶液中无干扰离子C、有变色敏锐无封闭作用的指示剂D、反应在酸性溶液中进行4、EDTA 滴定Zn2+时,加入NH3-NH4Cl可()A、防止干扰B、控制溶液的pH值C、使金属离子指示剂变色更敏锐D、加大反应速度5、取水样100mL,用C(EDTA)=0.02000mol/L,标准溶液测定水的总硬度,用去4.00毫升,计算水的总硬度是( )(用CaCO3 mg/L表示)A、20mg/LB、40 mg/LC、60 mg/LD、80mg/L6、配位滴定终点所呈现的颜色是()A、游离金属指示剂的颜色B、EDTA与待测金属离子形成配合物的颜色C、金属指示剂与待测金属离子形成配合物的颜色D、上述A与C的混合色7、在EDTA配位滴定中,下列有关酸效应系数的叙述,正确的是()A、酸效应系数越大,配合物的稳定性愈大B、酸效应系数越小,配合物的稳定性愈大C、pH值愈大,酸效应系数愈大D、酸效应系数愈大,配位滴定曲线的pM突跃范围愈大8、以配位滴定法测定Pb2+时,消除Ca2+、Mg2+干扰最简便的方法是()A、配位掩蔽法B、控制酸度法C、沉淀分离法D、解蔽法9、EDTA的有效浓度[Y]与酸度有关,它随着溶液pH值增大而()A、增大B、减小C、不变D、先增大后减小10、EDTA法测定水的总硬度是在pH=( )的缓冲溶液中进行,钙硬度是在pH =( )的缓冲溶液中进行。
配位平衡 习题及答案

配合平衡习题及答案一、判断题:1、Cu (Ⅱ) 、Zn (Ⅱ) 、Cd (Ⅱ) 得易溶盐较多。
( )2、金属锌可以与过量得氨水反应生成氢气。
( )3、Zn 、Cd 、Hg 得金属活泼性分别比Cu 、Ag 、Au 强。
.......... ( )4、[ Cu (NH3 )4 ]2+ 得空间构型为正四面体,Cu2+ 以sp3 杂化轨道与NH3 形成配位键。
、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、、( )5、Zn2+ 、Cd2+ 、Hg2+ 与EDTA 形成配位数为 4 得螯合物。
( )二、选择题:1、下列物质在酸性溶液中可以将Mn2+氧化为MnO4得就是、、、、、、、、、、、、、、、、、( )。
(A) PbO; (B) Bi3+; (C) NaClO; (D) (NH4 )2 S2O8。
2、下列金属中,延展性最好得就是....................................................... ( )。
(A) 银; (B) 金; (C) 铜; (D) 锌。
3、下列反应中,配离子作氧化剂得就是......................................... ( )。
(A) [Cu (OH)4]2 与甲醛反应; (B)[ Fe (CN)6]4 与FeCl3 反应;(C) [Co (NH3 )6]2+ 与O2 反应; (D)[ Ag (NH3 )2]+ 与KI 反应。
4、下列化合物中易溶于水得就是...................................................... ( )。
(A) Cu2O ; (B) CuCl ; (C) CuCl2 ; (D) CuI 。
无机及分析化学第十章配位滴定课后练习与答案

第十章配位平衡与配位滴定一.选择题1.EDTA与金属离子形成的配合物,其配位比一般为()A.1:1B.1:2C.1:4D.1:62.有关EDTA叙述错误的是()A.EDTA也是六元有机弱酸B.可与大多数离子形成1:1型的配合物C.与金属离子配位后都形成深颜色的配合物D.与金属离子形成的配合物一般都溶于水。
3.已知lgK MY=18.6,pH=3.0时的lgK'MY=10.6,则可求得pH=3.0时的酸效应系数的对数为()A.3B.8C.10D.184.在配位滴定时,金属离子与EDTA形成的配合物越稳定,K越大,则滴定时所允许的pHMY(只考虑酸效应)()A.越低B.越高C.中性D.无法确定5.下列金属离子浓度均为0.01mol.L-1,则pH=5.0时,可用EDTA标准溶液直接滴定的是()A.Mg2+B.Mn2+C.Ca2+D.Zn2+6.EDTA滴定Zn2+时,若以铬黑T作指示剂,则终点颜色为( ) 。
A. 黄色B. 酒红色C.橙色D.蓝色7. 对金属指示剂叙述错误的是()。
A.指示剂本身颜色与其生成的配位物颜色应显著不同B.指示剂应在适宜pH范围内使用C.MIn稳定性要略小于MY的稳定性D. MIn稳定性要略大于MY的稳定性8.如果MIn的稳定性小于MY的稳定性,此时金属指示剂将出现()A.封闭现象B.提前指示终点C.僵化现象D.氧化变质现象9.某溶液主要含有Ca2+、Mg2+及少量Fe3+、Al3+。
在PH=10时,加入三乙醇胺,以EDTA滴定,用铬黑T为指示剂,则测出的是()。
A.Mg2+量B.Ca2+量C.Ca2+、Mg2+总量D.Ca2+、Mg2+、Fe3+、Al3+总量10.在直接配位滴定法中,终点时,一般情况下溶液显示的颜色为()。
A、被测金属离子与EDTA配合物的颜色B、被测金属离子与指示剂配合物的颜色C、游离指示剂的颜色D、金属离子与指示剂配合物和金属离子与EDTA配合物的混合色11. 在EDTA配位滴定中,有关EDTA酸效应的叙述何者是正确的()。
1第19章 配位化合物习题(2)配合物平衡

配位化合物之配位平衡习题目录一判断题;二选择题;三填空题;四计算和回答问题一判断题(返回目录)1 在1.0L0.10mol·L-1[Ag(NH3)2]Cl溶液中,通入2.0molNH3(g)达到平衡时各物质浓度大小的关系是c(NH3)>c(Cl-)≈c([Ag(NH3)2]+)>c(Ag+)。
()2 某配离子的逐级稳定常数分别为K、K、K、K,则该配离子的不稳定常数K=K·K·K·K。
()3 某配离子的逐级不稳定常数分别为K、K、K、K,则该配离子总的稳定常数K=1/(K·K·K·K)。
()4 在1.0L6.0mol·L-1氨水溶液中溶解0.10molCuSO4固体,假定Cu2+全部生成[Cu(NH3)4]2+,则平衡时NH3的浓度至少为5.6mol·L-1。
()5 金属离子A3+、B2+可分别形成[A(NH3)6]3+和[B(NH3)6]2+,它们的稳定常数依次为4⨯105和2⨯1010,则相同浓度的[A(NH3)6]3+和[B(NH3)6]2+溶液中,A3+和B2+的浓度关系是c(A3+)>c(B2+)。
()6 已知[HgCl4]2-的K=1.0⨯10-16,当溶液中c(Cl-)=0.10mol·L-1时,c(Hg2+)/c([HgCl4]2-)的比值为1.0⨯10-12。
()7 对于电对Ag+/Ag来说,当Ag(Ⅰ)生成配离子时,Ag的还原性将增强。
()8 对于电对Cu2+/Cu来说,当Cu(Ⅱ)生成配离子时,Cu(Ⅱ)的氧化性将增强。
()9 在某些金属的难溶盐中,加入含有可与该金属离子配位的试剂时,有可能使金属难溶盐的溶解度增大。
()10 所有物质都会因生成某一配合物而使溶解度增大。
()11 所有配合物在水中都有较大的溶解度。
()12 在含有少量AgCl沉淀的溶液中,加入适量的氨水,可以使AgCl溶解,如果再加入适量的HNO3溶液,又可看到AgCl沉淀生成。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
配合平衡习题及答案一、判断题:1. Cu (Ⅱ) 、Zn (Ⅱ) 、Cd (Ⅱ) 的易溶盐较多。
()2. 金属锌可以与过量的氨水反应生成氢气。
()3. Zn 、Cd 、Hg 的金属活泼性分别比Cu 、Ag 、Au 强。
.............. ()4. [ Cu (NH3 )4 ]2+ 的空间构型为正四面体,Cu2+ 以sp3 杂化轨道与NH3 形成配位键。
.........................................................................................................................()5. Zn2+ 、Cd2+ 、Hg2+ 与EDTA 形成配位数为4 的螯合物。
()二、选择题:1.下列物质在酸性溶液中可以将Mn2+氧化为MnO4-的是.................()。
(A) PbO;(B) Bi3+;(C) NaClO;(D) (NH4 )2 S2O8。
2. 下列金属中,延展性最好的是........................................................... ()。
(A) 银;(B) 金;(C) 铜;(D) 锌。
3. 下列反应中,配离子作氧化剂的是............................................. ()。
(A) [Cu (OH)4]2- 与甲醛反应;(B)[ Fe (CN)6]4- 与FeCl3 反应;(C) [Co (NH3 )6]2+ 与O2 反应;(D)[ Ag (NH3 )2]+ 与KI 反应。
4. 下列化合物中易溶于水的是............................................................. ()。
(A) Cu2O ;(B) CuCl ;(C) CuCl2 ;(D) CuI 。
5. 下列离子分别与Hg2+ 反应不生成沉淀的是........................ ()。
(A) 少量I- ;(B) OH-;(C) Sn2+;(D) Cl-。
6. 在酸度较大的水溶液中也不溶解的盐是( )(A) Ag2SO4 (B) Ag3PO4 (C) Ag2CO3 (D) Ag2S7. 在CuSO4溶液中加入过量的碳酸钠溶液,常形成的产物是( )(A) Cu(HCO3)2 (B) CuCO3 (C) Cu2(OH)2CO3 (D) Cu(OH)28. 组成黄铜合金的两种金属是( )(A) 铜和锡(B) 铜和锌(C) 铅和锡(D) 铝和铜9. Cu+的磁矩是( )(A) 3.88 (B) 5.0 (C) 2.83 (D) 010. 下述有关银的性质的正确论述是( )(A) 从稀盐酸中置换出氢(B) 从浓盐酸中置换出氢(C) 从氢碘酸中置换出氢(D) 从稀硫酸中置换出氢11. 要从含有少量Cu2+离子的ZnSO4溶液中除去Cu2+离子最好的试剂是( )(A) Na2CO3 (B) NaOH (C) HCl (D) Zn12. 能共存于溶液中的一对离子是( )(A) Fe3+和I-(B) Pb2+和Sn2+(C) Ag+和PO43-(D) Fe3+和SCN-13. 欲除去CuSO4酸性溶液中少量Fe3+,加入下列试剂效果最好的是( )(A) 氨水(B) NaOH (C) H2S水(D) Cu2(OH)2CO314. Cu2O 和稀H2SO4反应,最后能生成( )(A) Cu2SO4+ H2O (B) CuSO4+ H2O (C) CuSO4+ Cu + H2O (D) CuS15. 五水硫酸铜可溶于浓盐酸,关于所得溶液的下列说法中,正确的是( )(A) 所得溶液成蓝色;(B) 将溶液煮沸时释放出氯气,留下一种Cu(I) 的配合物溶液;(C) 这种溶液与过量的氢氧化钠溶液反应,不生成沉淀;(D) 此溶液与金属铜一起加热,可被还原为一种Cu(I)的氯配合物。
16. 下列描述银的性质中,正确的是( )(A) 能与浓HCl作用放出氢(B) 能与氢碘酸作用放出氢(C) 能与稀硫酸作用放出氢(D) 能与沸水作用放出氢17. 铜的氧化物和酸反应生成硫酸铜和铜,这氧化物和酸分别是( )(A) 铜的黑色氧化物和亚硫酸(B) 铜的红色氧化物和过二硫酸(C) 铜的红色氧化物和稀硫酸(D) 铜的黑色氧化物和稀硫酸18. 因Ag 中常含有少量的铜,在制备AgNO3时必须除去Cu ,可用的方法是( )(A) 控制温度热分解含Cu(NO3)2的AgNO3(B) 向AgNO3溶液中加新制备的Ag2O(C) 电解AgNO3溶液(D) (A) (B) (C)均可19. 精炼铜时,以粗铜作阳极,CuSO4作电解液,电解进行到一定程度时,电解质溶液的pH 值( )(A) 改变不大(B) 明显增大(C) 明显减小(D) 无法判断20. 加NH3·H2O水于Hg2Cl2上,容易生成的是( )(A) Hg(OH)2 (B) [Hg(NH3)4]2+(C) [Hg(NH3)2]+(D) HgNH2Cl+Hg21. 在工业上欲除去ZnSO4溶液中的Fe3+杂质,需加入最合适的试剂是( )(A) NaOH (B) Na2CO3 (C) ZnCO3 (D) Zn22. 下列的阳离子中,能与Cl-离子在溶液中生成白色沉淀,加氨水时又将转成黑色的是( )(A) 铅(II) (B) 银(I) (C) 汞(I) (D) 锡(II)23. 下列金属单质可以被HNO3氧化成最高价态的是( )(A) Hg (B) Ti (D) Pb (D) Bi24. 黄色HgO 低于573 K 加热时可以转化成红色HgO,这是因为( )(A)加热改变了结构类型(B)加热使晶体出现了缺陷(C)结构相同,仅仅由于晶粒大小不同(D)加热增强了Hg2+对O2-的极化作用25. 氧化锌长时间加热将由白色变成黄色,这是由于加热过程( )(A) 产生异构化(B) 晶粒变小(C) Zn2+对O2-的极化作用增强(D) 晶体出现了缺陷26. 下列各对离子用4 mol·dm-3 NaOH 溶液可分离的是( )(A) Cu2+,Ag+(B) Cr3+,Zn2+(C) Cr3+,Fe3+(D) Zn2+,Al3+27. 下列化合物中,既能溶于浓碱,又能溶于酸的是( )(A) Ag2O (B) Cu(OH)2 (C) HgO (D) Cd(OH)228. 能共存于酸性溶液中的一组离子是( )(A) K+,I-,SO42-,MnO4-(B) Na+,Zn2+,SO42-,NO3-(C) Ag+,AsO43-,S2-,SO32-(D) K+,S2-,SO42-,Cr2O72-29. 不能用H2S( 在0.3 mol·dm-3 HCl溶液中)分离的下述离子对是( )(A) Bi3+,Pb2+(B) Zn2+,Cu2+(C) Ni2+,Cd2+(D) Ni2+,Cu2+三、填空题:1. 在饱和的Hg2 (NO3 )2 溶液中,逐滴加入浓HCl ,开始有⎽⎽⎽⎽⎽⎽色的⎽⎽⎽⎽⎽⎽⎽生成,继续加浓HCl 有⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽和⎽⎽⎽⎽⎽⎽⎽⎽⎽生成。
2. 氢氧化铜是⎽⎽⎽⎽⎽色固体,⎽⎽⎽⎽⎽溶于水。
氢氧化铜⎽⎽⎽⎽⎽溶于浓的氢氧化钠溶液,⎽⎽⎽⎽溶于氨水.。
3 .铬绿的化学式是________,铬酐的化学式是________,铬铁矿的主要成分为________,红矾钠的化学式是_________。
4. Hg 的价层电子构型为⎽⎽⎽⎽⎽⎽⎽⎽⎽,能形成氧化值为⎽⎽⎽⎽⎽⎽⎽和⎽⎽⎽⎽⎽⎽的化合物。
较稳定的汞氧化物为⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽。
5. 向Al2(SO4)3和CuSO4混合溶液中放入一个铁钉,发生反应后可生成___________ 。
6. Al3PO4和AgCl都难溶于水,然而在HNO3溶液中,____________ 能溶解。
在NH3水中,_______________能溶解。
7. 在Ni(OH)2,Cu(OH)2,Ga(OH)3和Mn(OH)2中,______________________和________________________ 是两性氢氧化物。
8. 红色不溶于水的固体____________________与稀硫酸反应,微热,得到蓝色__________溶液和暗红色的沉淀物___________ 。
取上层蓝色溶液加入氨水生成深蓝色___________溶液。
加入适量的KCN 溶液生成无色的____________溶液。
9. Cu+在水溶液中_______________ ,容易发生歧化反应,其反应方程式是____________________________________________________________________ ,所以一价铜在水溶液中只能以____________物和____________物的形式存在。
10. 氯化亚铜溶于氨水之后的溶液,在空气中放置,其发生变化的化学方程式是:_________________________________________________________________。
11. 在氯化银溶于氨水的溶液中加入甲醛并加热,所发生反应的化学方程式是:____________________________________________________________________。
12. 在等浓度(mol·dm-3)等体积的Na3PO4,Na2HPO4,NaH2PO4溶液中,分别加入同浓度、等量(为适量)的AgNO3溶液均生成沉淀,沉淀依次分别是_______;________;__________。
13. 填写下列物质的颜色:Cu(CN)2-______________,VO2+____________________,Cu2O ___________________________,MnO42-_____________________________。
14. CuSO4是杀虫剂,和白灰混合使用的原因是_______________________________________________________________________________________________________。
15. 某含铜的配合物,测其磁矩为零,则铜的氧化态为_____________________;黄铜矿(CuFeS2)中铜的氧化态为________________________________________。
