无机化学 第12章 配位化学基础习题及全解答-
配位化学复习题及答案

配位化学复习题及答案配位化学是无机化学的一个重要分支,它研究金属离子与配体形成配位化合物的过程和性质。
以下是一些配位化学的复习题及答案,供参考:一、选择题1. 什么是配位化合物?A. 含有金属离子的化合物B. 含有配体的化合物C. 金属离子与配体通过配位键结合形成的化合物D. 只含有金属元素的化合物答案:C2. 配位化合物中的配位键是由什么构成的?A. 金属离子和非金属离子之间的离子键B. 金属离子和配体之间的共价键C. 金属离子提供的空轨道和配体提供的孤对电子D. 配体之间的共价键答案:C3. 下列哪个不是常见的配体?A. 水分子B. 氨分子C. 二氧化碳分子D. 硫氰酸根离子答案:C4. 配位数是指什么?A. 配体的数量B. 配位化合物中的金属离子数量C. 与中心金属离子直接相连的配体数量D. 配位化合物中的总原子数量答案:C5. 什么是内界和外界?A. 内界是配体,外界是金属离子B. 内界是金属离子,外界是配体C. 内界是配位化合物的中心,外界是配位化合物的外围D. 内界和外界都是配体答案:B二、填空题6. 配位化合物的化学式通常表示为[M(L)_n]^z+,其中M代表______,L代表______,n代表______,z代表______。
答案:中心金属离子;配体;配位数;电荷数7. 配位化合物的几何构型取决于配位数,例如,四面体、平面正方形、八面体等。
当配位数为4时,常见的几何构型是______。
答案:四面体8. 配位化合物的稳定性可以通过______来衡量,它与配体的电子供体能力有关。
答案:配位常数9. 配位化合物的光学活性是由于分子的______性造成的。
答案:手性10. 在配位化学中,硬酸和硬碱倾向于形成______,而软酸和软碱倾向于形成______。
答案:硬配位键;软配位键三、简答题11. 简述什么是配位化学中的“软硬酸碱理论”?答案:软硬酸碱理论是由R. P. Pearson提出的,它根据中心金属离子和配体的相对电负性差异,将它们分为硬酸、软酸、硬碱和软碱。
配位化学答案

配位化学答案一、选择题(每题1分,共15分)1-5A,A,C,B,D6-10C,D,D,B,D11-15B,C,B,B,A二、填空题(1题,每空0.5分,共7分;其余每空1分,共6分)1、+2,平面正方形,N,C u2+,4;d s p2,顺,-3,八面体,C,F e3+,6,s p3d2,顺2、1)硫酸四氨合铜(Ⅱ)2)六氰合铁(Ⅲ)酸钾3)三氯化三乙胺合钴(Ⅱ)4)c i s-[P t(C2H4)C l3].H2O5)N i[(C O)4]6)K3[F e(C N)6]三、名词解释(每题3分,共24分)1、配合物:可以给出孤对电子的分子和具有孤对电子的分子按照一定组成和空间构型所形成的化合物。
2、内轨型配合物:在形成配合物中,配位体的孤对电子所占空轨轨道是有(n-1)d轨道参与的杂化轨道[(n-1)d+ns+np],所以叫轨型配合物3、螯合物:由双齿或者多齿配体与同一个中心原子作用形成的具有环状结构的配合物4、键合异构:当一个单齿配体有两个可能用于配位的不同原子时,分别用不同的原子配位,可能产生键合异构现象5、多核配合物:含有2个或者2个以上中心原子(或者离子)的配合物6、Jahn-Teller 效应:电子在简并轨道中的不对称占据会导致分子的几何构型发生畸变,从而降低分子的对称性和轨道的简并度,使体系的能量进一步下降的现象称为Jahn-Teller 效应。
四、问答题(每题6分,共36分)1 简要阐明配合物的价键理论?答:1)中心离子或原子通过提供与配位数相等数目的杂化了的空轨道接受来自配体的孤电子对(或π键电子对)形成配位共价键。
2)杂化轨道与空间构型的关系为了增强成键能力,中心原子能量相近的空的价轨道要通过适当的方式线性组合成具有更强方向性的、符合σ对称性要求的等价杂化轨道。
2、简述配体的光谱化学序列?答:将一些常见配体按光谱实验测得的分裂能从小到大次序排列称为光谱化学序。
F->H2O>CO(NH2)2>NH3>C2O42-≈en>NCS->Cl-≈CN->Br->(C2H5O)2PS2≈S2-≈I ->C2H5O)2PSe2-3、用晶体场理论解释[Fe(CN)6]4-与FeSO4.7H2O的磁性差异?答:在上述两个配合物中,CN-是强场配体,分裂能大于电子成对能,所以中心原子铁采取低自旋,6个单电子全部成对,所以[Fe(CN)6]4-属于抗磁性配合物;而H2O是弱场配体,分裂能小于电子成对能,所以中心原子铁采取高自旋,6个单电子中只有1对成对,还有4个单电子,所以FeSO4.7H2O属于顺磁性配合物。
配位化学基础及解题(2)解析共47页

56、极端的法规,就是极端的不公。 ——西 塞罗 57、法律一旦成为人们的需要,人们 就不再 配享受 自由了 。—— 毕达哥 拉斯 58、法律规定的惩罚不是为了私人的 利益, 而是为 了公共 的利益 ;一部 分靠有 害的强 制,一 部分靠 榜样的 效力。 ——格 老秀斯 59、假如没有法律他们会更快乐的话 ,那么 法律作 为一件 无用之 物自己 就会消 灭。— —洛克
60、人民的幸福是至高无个的法。— —西塞 罗
1、最灵繁的人也看不见自己的背脊。——非洲 2、最困难的事情就是认识自己。——希腊 3、有勇气承担命运这才是英雄好汉。——黑塞 4实,会谈使人敏捷,写作使人精确。——培根
配位化学 课后习题答案

配位化学课后习题答案配位化学是化学中的一个重要分支,研究的是金属离子与配体之间的相互作用及其形成的配合物的性质。
在配位化学中,学生常常需要通过课后习题来巩固所学的知识。
本文将为大家提供一些配位化学课后习题的答案,希望能够帮助大家更好地理解和掌握这门学科。
1. 以下哪种配体不是双电子供体?答案:氨(NH3)。
氨分子中的氮原子只能提供一个孤对电子,因此它是单电子供体。
2. 以下哪种配体不是双电子受体?答案:氯(Cl-)。
氯离子中的氯原子已经满足了八个电子,不具有受体性质。
3. 对于配合物[M(H2O)6]2+,其中M代表金属离子,该配合物的配位数是多少?答案:6。
配位数是指一个金属离子周围配位体的数量,根据该配合物的化学式可知,M周围有6个水分子配位,因此配位数为6。
4. 对于配合物[Co(NH3)5Cl]Cl2,其中Co的氧化态是多少?答案:+3。
根据化学式可知,配合物中的氯离子带有-1的电荷,而Cl2带有-2的电荷,因此配合物中的Co离子需带有+3的电荷,即Co的氧化态为+3。
5. 以下哪个配体是取代型配体?答案:CN-。
取代型配体指的是能够替代配位体与金属离子形成配合物的配体,而CN-正是一种常见的取代型配体。
6. 以下哪种配合物是八面体构型?答案:[Fe(CN)6]4-。
八面体构型是指配合物中金属离子周围八个配位体呈八面体排列的结构,而[Fe(CN)6]4-正是一个典型的八面体配合物。
7. 对于配合物[PtCl4]2-,该配合物的配位键是哪种类型?答案:配位键是配体与金属离子之间的化学键,对于[PtCl4]2-,其中的Pt与Cl之间的配位键是配位键。
8. 以下哪个配合物是高自旋配合物?答案:[Fe(H2O)6]2+。
高自旋配合物是指配合物中金属离子的自旋多重度较高的配合物,而[Fe(H2O)6]2+中的Fe离子具有高自旋状态。
9. 对于配合物[Cu(NH3)4(H2O)2]2+,其中的配体是哪个?答案:配体是指与金属离子形成配合物的非金属离子或分子,对于该配合物,配体是NH3和H2O。
配位化学的应用考研题库及答案

配位化学的应用考研题库及答案配位化学是无机化学的重要分支之一,研究金属离子与配体之间的相互作用和配位化合物的性质。
在化学考研中,配位化学的应用题是必考的一部分。
本文将从配位化学的基本概念、应用题的类型以及解题技巧等方面,为考生提供一些有益的信息。
一、配位化学的基本概念配位化学研究的是金属离子与配体之间的配位作用。
在配位化合物中,金属离子通过配体的配位作用形成配位键,形成稳定的配位化合物。
配位化合物的性质与金属离子和配体的性质有关,如配体的配位能力、配位数等。
二、应用题的类型在考研中,配位化学的应用题主要分为以下几种类型:1. 配位数的确定:题目给出一个配位化合物的结构和化学式,要求确定其中金属离子的配位数。
解答此类题目时,可以根据配位化合物的结构和化学式,利用已知的配位数规律进行判断。
例如,八面体结构的配合物一般配位数为6,四面体结构的配合物一般配位数为4。
2. 配位键的类型:题目给出一个配位化合物的结构和化学式,要求确定其中配位键的类型。
解答此类题目时,可以根据配位键的形成原理进行判断。
例如,当配体通过一个或多个氧原子与金属离子形成配位键时,配位键的类型为配位键。
3. 配位反应的类型:题目给出一个配位反应的化学方程式,要求确定配位反应的类型。
解答此类题目时,可以根据配位反应的特点进行判断。
例如,当配位化合物中的一个或多个配体被替换为其他配体时,配位反应的类型为置换反应。
三、解题技巧在解答配位化学的应用题时,可以采取以下一些解题技巧:1. 理清思路:在解答题目之前,先理清思路,明确题目要求和所给信息。
可以先画出配位化合物的结构,标明其中的金属离子和配体,有助于更好地理解题目。
2. 利用已知规律:配位化学有一些已知的规律,如不同配位数对应的配位几何形状、不同配位键的类型等。
在解答题目时,可以利用这些已知规律进行判断和推理。
3. 注意反应类型:在解答配位反应类型的题目时,要注意配位反应的特点。
例如,置换反应中,配体的离去和进入是同时进行的;配体的离去和进入速率不一定相等。
无机化学练习题(含答案)第12章配位平衡

第12章配位平衡12-1:在1L 6mol/L 的NH3水中加入0.01 mol固体CuSO4,溶解后加入0.01mol 固体NaOH,铜氨络离子能否被破坏?(K稳SCN [Cu(NH3)42+]=2.09×1013,K SP[Cu(OH)2]=2.2×10-20)12-2当少量NH4SCN和少量Fe3+ 同存于溶液中达到平衡时,加入NH4F使[F- ]=[SCN-]=1mol/L-1,问此时溶液中[FeF63- ]和[Fe(SCN)3]浓度比为多少?(K稳Fe[SCN]3=2.0×103,K稳[FeF6]=1×1016)解:5×101212-3:在理论上,欲使1×10-5mol的AgI溶于1cm3氨水,氨水的最低浓度应达到多少?事实上是否可能达到这种浓度?(K稳[Ag(NH3)2+]=1.12×107;Ksp(AgI)=9.3×10-17)解:3×102mol/L,实际上不可能达到。
12-4:通过配离子稳定常数和Zn2+/ Zn 和Au+/Au 的电极电势计算出Zn(CN)42-/Zn和Au(CN)2- /Au,说明提炼金的反应:Zn + 2 Au(CN)2- = Zn(CN)42-+ 2Au在热力学上是自发的。
12-5:为什么在水溶液中Co3+(aq) 离子是不稳定的,会被水还原而放出氧气,而3+氧化态的钴配合物,例如Co(NH3)63+,却能在水中稳定存在,不发生与水的氧化还原反应?通过标准电极电势作出解释。
(稳定常数:Co(NH3)62+ 1.38×105 ; Co(NH3)63+1.58×1035.标准电极电势:Co3+/Co2+1.808V,O2/H2O1.229V,O2/OH-0.401V;K b(NH3)=1.8×10-5)12-6:欲在1L水中溶解0.10molZn(OH)2,需加入多少克固体NaOH ?(Ksp[Zn(OH)2]=1.2×10-17;[Zn(OH)42-]=4.6×1017)解:13g12-7:在PH=10的溶液中需加入多少NaF才能阻止0.10mol/L 的Al3+溶液不发生Al(OH)3沉淀?(Ksp Al(OH)3=1.3×20-20; K稳(AlF63-)=6.9×1019)解:1.62mol/L12-8:测得Cu|Cu(NH3)42+ 1.00mol/L,NH31.00mol/L||H+1.00mol/L-1|H21bar, Pt的电动势为0.03V,试计算Cu(NH3)42+ 的稳定常数。
配位化学练习题

配位化学练习题配位化学是无机化学的重要分支,研究的对象是配位化合物和配位反应。
配位化学主要研究金属离子与配体之间的相互作用,以及在配位化合物中金属离子的周围有哪些配体。
以下是一些配位化学的练习题,用以帮助读者巩固相关知识。
题目一:给定以下化学方程式,请推导出反应类型,并写出反应物和生成物的化学式。
1. AgNO3 + NaCl →2. CuSO4 + NH3 →3. FeCl3 + KOH →题目二:根据以下配位化合物的谱系图,请回答以下问题。
1. 对于配位数为4的配合物,属于以下哪种晶体场理论?2. 高自旋和低自旋的配合物分别具有什么样的差异?3. 配体场强度增加,配体键长和配位键数会发生什么变化?4. 对于给定的配合物,如果配位键数为6,那么该配合物的中心离子是什么?题目三:结合以下反应机理,请写出反应的平衡常数表达式。
1. Co(H2O)6 2+ + 6NH3 ⇌ Co(NH3)6 2+ + 6H2O2. NH3 + H2O ⇌ NH4+ + OH-3. Cu(H2O)6 2+ + 4Cl- ⇌ [CuCl4]2- + 6H2O题目四:以下是一些配位化合物的常见名称,请根据化学式给出其对应的名称。
1. Fe2(SO4)32. K3[Fe(CN)6]3. [Co(NH3)4Cl2]Cl题目五:给定以下化学方程式,请写出反应的电子方程式和平衡常数表达式。
1. Co(H2O)6 2+ + [Cr(CN)6]4- → Co(CN)6 4- + [Cr(H2O)6]2+2. [Cu(NH3)4]2+ + 4Br- → [CuBr4]2- + 4NH3题目六:结合以下反应,回答以下问题。
1. 配位化合物的颜色与什么因素有关?2. 过渡金属配合物为什么可以具有催化性质?3. 配合物中的中心离子的电荷数会如何影响配合物的稳定性?4. 配体的选择如何影响配位化合物的形状?这些练习题覆盖了配位化学的不同方面,包括反应类型、配位反应机理、命名和电子结构等。
配位化学试题及答案

配位化学试题及答案一、选择题(每题2分,共10分)1. 下列哪项不是配位化合物的特点?A. 含有中心原子或离子B. 含有配位键C. 含有离子键D. 含有配体答案:C2. 配位化合物的几何构型通常由什么决定?A. 配体的电荷B. 配体的数目C. 配体的电子排布D. 中心原子的氧化态答案:B3. 配位化学中,路易斯碱是指什么?A. 能够提供电子的分子或离子B. 能够接受电子的分子或离子C. 能够提供空轨道的分子或离子D. 能够接受空轨道的分子或离子答案:B4. 下列哪种配体是单齿配体?A. 乙二胺(en)B. 1,3-丙二胺(pn)C. 环己二胺(cn)D. 四齿配体答案:A5. 配位化合物的命名中,配体的名称通常放在什么位置?A. 中心原子的前面B. 中心原子的后面C. 配位化合物的前面D. 配位化合物的后面答案:A二、填空题(每题2分,共10分)1. 配位化学中,中心原子或离子与配体之间形成的化学键称为______。
答案:配位键2. 一个中心原子或离子最多可以与______个配体形成配位键。
答案:63. 配位化合物的配位数是指______。
答案:中心原子或离子周围配体的数量4. 配位化合物的命名中,配体的数目通常用希腊数字表示,其中“二”表示______。
答案:二5. 配位化合物的命名中,配体的电荷通常用罗马数字表示,其中“Ⅱ”表示______。
答案:+2三、简答题(每题5分,共20分)1. 简述什么是内界和外界,并举例说明。
答案:内界是指配位化合物中中心原子或离子与配体形成的配位单元,外界是指配位单元以外的部分。
例如,在[Co(NH3)6]Cl3中,[Co(NH3)6]是内界,Cl3是外界。
2. 什么是螯合配体?请举例说明。
答案:螯合配体是指能够通过多个配位点与中心原子或离子形成配位键的配体。
例如,乙二胺(en)可以与金属离子形成螯合配位化合物。
3. 配位化合物的稳定性与哪些因素有关?答案:配位化合物的稳定性与中心原子或离子的电荷、配体的类型、配位数以及配体与中心原子或离子之间的配位键强度等因素有关。
高中配位化学练习题及讲解

高中配位化学练习题及讲解# 高中配位化学练习题及讲解## 练习题### 一、选择题1. 配位化合物中的配体通常具有哪种性质?A. 氧化性B. 还原性C. 酸性D. 碱性2. 下列哪个不是配位化合物?A. [Cu(NH3)4]SO4B. NaClC. [Fe(CN)6]^3-D. [Zn(H2O)6]Cl23. 配位化合物的配位数是指什么?A. 配体的数量B. 中心原子的氧化态C. 中心原子的电荷数D. 配体与中心原子的化学键数### 二、填空题4. 配位化合物[Cu(NH3)4]SO4中,配体是________,中心原子是________。
5. 配位化合物[Fe(CN)6]^3-中,配位数为________。
### 三、简答题6. 简述配位化合物的定义及其主要特征。
7. 举例说明什么是外球络合物和内球络合物,并说明它们的区别。
### 四、计算题8. 已知配位化合物[Co(NH3)5Cl]Cl2的溶液,其中Co的浓度为0.01 mol/L,求配体NH3的总浓度。
## 讲解### 一、选择题1. 答案:B. 还原性。
配体通常具有提供电子对的能力,因此它们具有还原性。
2. 答案:B. NaCl。
NaCl是普通的离子化合物,不含配位键。
3. 答案:A. 配体的数量。
配位数是指与中心原子通过配位键连接的配体的数量。
### 二、填空题4. 答案:配体是NH3,中心原子是Cu。
5. 答案:6。
在[Fe(CN)6]^3-中,Fe原子与6个CN^-配体相连。
### 三、简答题6. 答案:配位化合物是由中心原子或离子与一定数量的配体通过配位键结合形成的化合物。
其主要特征包括配位键的存在、配位数的确定性以及配位化合物的稳定性。
7. 答案:外球络合物是指配体在中心原子或离子的外部形成配位键,例如[Fe(CN)6]^3-。
内球络合物是指配体直接与中心原子或离子的表面形成配位键,例如[Fe(H2O)6]^2+。
它们的区别在于配体与中心原子的相对位置。
无机化学习题-配位化合物答案

化,形成四配位平面四方配离子 5d8 的 8 个 d 电子全部配对, m = n(n + 2) B. M. = 0。
Pt(IV)应为 d2sp3 杂化,形成内轨型六配位八面体配离子。
该配合物实际化学式可能有:
65.39 y + 16 + 59.024 ´ (2 y -1)
81.39 y
= 0.516 解得 y ≈ 4
183.44 y - 102.048
∴(A)的化学式为 Zn4O(CH3COO)6
2.4ZnCO3 + 6CH3COOH
ZnO(CH3COO)6 + 4CO2 + 3H2O
3.Zn2+为 3d10,Zn2+周围有 4 个 O 原子,∴Zn2+离子采取 sp3 杂化
4.2948 + 14.476x = 3.024 + 15.12x, 0.644x = 1.2708, x = 2
∴Al 为+3 氧化态,Al3+采取 sp3 杂化。
H NEt3
NEt3 H
NEt3 H
Al
H
NEt3
H
Al
H
H
Et3N
NEt3 (非极性分子)
Al H
H
因它们都有对称面,所以都不存在对映体。
十六、1.H C
O
H + CH3OH C
O
(B) LiAlH4
(C) SiCl4
(D) (CH3)2NH (E)
6
N (E)为
H2C H3C N H3C
北师大无机化学习题解答]_《无机化学》(第四版,吴国庆,高等教育出版社)习题答案
![北师大无机化学习题解答]_《无机化学》(第四版,吴国庆,高等教育出版社)习题答案](https://img.taocdn.com/s3/m/7c4cbdf00b4c2e3f5627631c.png)
第一章物质的结构1-1 在自然界中氢有三种同位素,氧也有三种同位素,问:总共有种含不同核素的水分子?由于3H太少,可以忽略不计,问:不计3H时天然水中共有多少种同位素异构水分子?1-2 天然氟是单核素(19F)元素,而天然碳有两种稳定同位素(12C和13C),在质谱仪中,每一质量数的微粒出现一个峰,氢预言在质谱仪中能出现几个相应于CF4+的峰?1-3 用质谱仪测得溴得两种天然同位素的相对原子质量和同位素丰度分别为79Br 789183占50。
54%,81Br 80。
9163占49。
46%,求溴的相对原子质量(原子量)。
1-4 铊的天然同位素203Tl和205Tl的核素质量分别为202。
97u和204。
97u,已知铊的相对原子质量(原子量)为204。
39,求铊的同位素丰度。
1-5 等质量的银制成氯化银和碘化银,测得质量比m(AgCl):m(AgBr)=1。
63810:1,又测得银和氯得相对原子质量(原子量)分别为107。
868和35。
453,求碘得相对原子质量(原子量)。
1-6 表1-1中贝采里乌斯1826年测得的铂原子量与现代测定的铂的相对原子质量(原子量)相比,有多大差别?1-7 设全球有50亿人,设每人每秒数2个金原子,需要多少年全球的人才能数完1mol金原子(1年按365天计)?1-8 试讨论,为什么有的元素的相对质量(原子量)的有效数字的位数多达9位,而有的元素的相对原子质量(原子量)的有效数字却少至3~4位?1-9 太阳系,例如地球,存在周期表所有稳定元素,而太阳却只开始发生氢燃烧,该核反应的产物只有氢,应怎样理解这个事实?1-10 中国古代哲学家认为,宇宙万物起源于一种叫“元气”的物质,“元气生阴阳,阴阳生万物”,请对比元素诞生说与这种古代哲学。
1-11 “金木水火土”是中国古代的元素论,至今仍有许多人对它们的“相生相克”深信不疑。
与化学元素论相比,它出发点最致命的错误是什么?1-12 请用计算机编一个小程序,按1.3式计算氢光谱各谱系的谱线的波长(本练习为开放式习题,并不需要所有学生都会做)。
(完整版)配位化合物习题及解析

《配位化合物》作业参考解析1. 下列说法正确的是A. 配合物的内界和外界之间主要以共价键相结合B. 中心原子与配体之间形成配位键C. 配合物的中心原子都是阳离子D. 螯合物中不含有离子键【B】A、D:一般认为配合物的内界和外界之间主要以离子键相结合,因此螯合物中内界和外界之间是可以存在离子键的;C:中心原子可以是阳离子,也可以是中性原子,例如[Ni(CO)4];B:中心原子与配体化合时,中心原子提供杂化过的空轨道,配体提供孤对电子,而形成配位键。
2. 下列配合物命名不正确的是A. [Co(H2O)(NH3)3Cl2]Cl 氯化二氯·三氨·一水合钴(Ⅲ)B. [Cr(NH3)6][Co(CN)6] 六氰合钴(Ⅲ)酸六氨合铬(Ⅲ)C. K[Co(NO2)3Cl3] 三硝基·三氯合钴(Ⅲ)酸钾D. H2[PtCl6] 六氯合铂(Ⅳ)酸【C】根据配体命名顺序,先无机后有机,先阴离子后中性分子,同类配体根据配位原子在字母表中的先后顺序进行命名。
对于C中的配合物而言,NO2-以N原子为配位原子时,命名为硝基,带一个负电荷,氯离子也是阴离子,同类配体,根据配位原子在字母表中的先后顺序,Cl-离子在前,NO2-离子在后,因此该配合物应该命名为“三氯·三硝基合钴(Ⅲ)酸钾”。
3. 下列配离子具有正方形或者八面体形结构,其中CO32-最有可能作为双齿配体的是A. [Co(NH3)4(CO3)]+B. [Co(NH3)5(CO3)]+C. [Pt(en)(NH3)(CO3)]D. [Pt(en)2(NH3)(CO3)]2+【A】根据题意,配离子具有正方形结构时,配位数为4,形成四个配位键;具有八面体结构时,配位数为6,形成6个配位键。
B:[Co(NH3)5(CO3)]+ 配离子中,已有5个氨作为配体,氨是单齿配体,形成5个配位键,因此该配离子中,CO32-离子只能是单齿配体,这样就形成了6个配位键;C:[Pt(en)(NH3)(CO3)] 配合物中,乙二胺(en)为双齿配体,形成2个配位键,氨为单齿配体,形成1个配位键,因此CO32-离子只能是单齿配体,这样就形成了4个配位键;D:[Pt(en)2(NH3)(CO3)]2+ 配离子中,乙二胺(en)为双齿配体,2个en形成4个配位键,氨为单齿配体,形成1个配位键,因此CO32-离子只能是单齿配体,这样就形成了6个配位键;A:[Co(NH3)4(CO3)]+ 配离子中有4个氨为配体,形成4个配位键,因此CO32-离子必须是双齿配体,这样就形成了4个配位键,如果CO32-离子是单齿配体,那么配离子的配位数为5,这与题意不符。
配位化学配位数和结构练习题深入理解配位化合物中金属离子的配位数和结构的应用

配位化学配位数和结构练习题深入理解配位化合物中金属离子的配位数和结构的应用配位化学是无机化学中的一个重要分支,研究金属离子与配体之间的配位反应和生成的配位化合物的结构与性质。
配位化合物中金属离子的配位数和结构对其性质有重要影响,深入理解配位化合物中金属离子的配位数和结构的应用是化学学习的重要内容。
本文将通过配位化学的配位数和结构练习题来深入理解这一概念。
一、选择题1. 在[Co(NH3)6]Cl3中,Co的配位数是多少?a) 2b) 3c) 4d) 6解析:[Co(NH3)6]Cl3中的NH3为配位体,每个NH3提供一个孤电子对给金属中心。
由于配位体的数量决定了配位数,因此Co的配位数为6。
答案为d。
2. 在[NiCl4]2-中,Ni的配位数是多少?a) 2b) 3c) 4d) 6解析:[NiCl4]2-中的Cl-为配位体,每个Cl提供一个孤电子对给金属中心。
由于配位体的数量决定了配位数,因此Ni的配位数为4。
答案为c。
3. 在[Mn(H2O)6]2+中,Mn的配位数是多少?a) 2b) 3c) 4d) 6解析:[Mn(H2O)6]2+中的H2O为配位体,每个H2O提供两个孤电子对给金属中心。
由于配位体的数量决定了配位数,因此Mn的配位数为6。
答案为d。
二、填空题1. 计算[Fe(CN)6]4-中Fe的配位数是多少?解析:[Fe(CN)6]4-中的CN-为配位体,每个CN-提供一个孤电子对给金属中心。
由于配位体的数量决定了配位数,因此Fe的配位数为6。
2. 在[Pt(NH3)4][AgCl2]中,Ag的配位数是多少?解析:[Pt(NH3)4][AgCl2]中的Cl-为配位体,每个Cl-提供一个孤电子对给金属中心。
由于配位体的数量决定了配位数,因此Ag的配位数为2。
三、解答题1. 请画出[Fe(H2O)6]2+的结构式并说明Fe的配位数。
解析:[Fe(H2O)6]2+的结构式为八面体结构,其中Fe的配位数为6。
配位化学基础及解题
9、化合物B 是1 : 1型电解质。试确定B 的经验式和在
CrLxCly(ClO4)z·H2O中的x、y、z的数值。
1、C10H8N2O2 2、
3、无电荷
4、
5、FeC30H30Cl3N6O21
=–8 Dq
d9组态的CFSE=–4n(d)+6n(d) Dq =–24+18 Dq =–6 Dq
d4~7组态的CFSE=–4n(d)+6n(d)+(n1–n2)P Dq n1与n2分别代表在分裂后和分裂前电子配对数量 此时,在八面体CFSE强场和弱场中不相同 d5组态:八面体强场的CFSE=–4n(d)+6n(d) Dq +2P
490 (蓝绿) 500 (绿)
570 (黄绿) 580 (黄) 600 (橙) 650 (红)
补色 黄绿 黄 橙 红 紫 蓝 蓝绿 绿
1、写出L的分子式。 2、如果L是双齿螯合配体,请画出所用的双吡啶的结构式和L 的结构。
3、配体L有无电荷(净电荷)? 4、画出一个L分子与一个金属离子(M)键合的结构式。 5、根据表4a的数据确定A的经验式。确定FeLm(ClO4)n·3H2O 中的m和n的数值。按惯用IUPAC符号写出A 的完整的分子式。 当A 溶解在水中时,阳离子和阴离子的比为多少? 6、Fe在A 中的氧化数为多少?配合物中的Fe离子有多少个d 电子?写出该配合物可能存在的高自旋和低自旋的电子构型。 你认为哪一个证据最能支持你的答案。
例15:Alfred Werner用“异构体计数法”推断六配位金属配合物的结构。 他考虑了X、Y和Z三种形状的结构:X为平面六边形,Y为三方柱形,Z为 八面体。当所有配体都相同时,MA6都只有一种异构体。但是,当非手性配 体A被一个或多个非手性配体取代时,每一种结构就可能形成几何异构体。 几何异构体的一种或多种可能以对映异构体的形式存在而具有旋光活性。
配位化学习题及答案

配位化学习题及答案
配位化学学习题及答案
配位化学是化学中一个重要的分支,涉及到配合物的结构、性质和反应等方面。
以下是一些配位化学的学习题及答案,希望能帮助大家更好地理解这一领域的
知识。
1. 什么是配合物?
答案:配合物是由中心金属离子和周围的配体组成的化合物。
配体通常是能够
提供一个或多个孤对电子给中心金属离子的分子或离子。
2. 什么是配位数?
答案:配位数是指一个中心金属离子周围配体的数量。
例如,对于[Fe(CN)6]4-
这个配合物来说,铁离子的配位数为6。
3. 什么是配位键?
答案:配位键是指中心金属离子和配体之间的化学键。
这种键通常是由配体中
的孤对电子和中心金属离子形成的。
4. 什么是配位化合物的立体化学?
答案:配位化合物的立体化学涉及到配体和中心金属离子之间的空间排布。
这
种排布对于配合物的性质和反应有很大的影响。
5. 什么是配合物的分子结构?
答案:配合物的分子结构是指配体和中心金属离子之间的空间排布。
这种排布
可以通过X射线衍射等方法来确定。
通过以上学习题及答案,我们可以更好地理解配位化学这一领域的知识。
希木
大家能够通过学习不断提高自己的化学水平,为将来的科研和工作打下坚实的
基础。
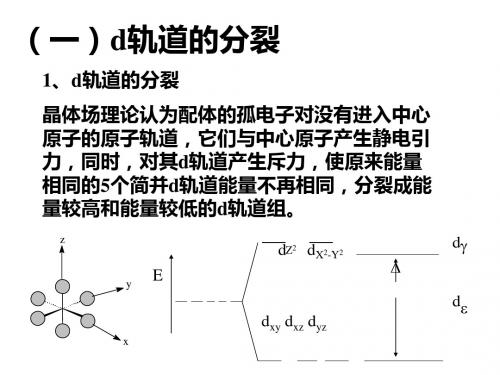
无机化学 第12章 配位化学基础习题及全解答

第12章 配位化学基础1 M 为中心原子,a, b, d 为单齿配体。
下列各配合物中有顺反异构体的是 (A ) (A ) Ma 2bd (平面四方)(B ) Ma 3b (C ) Ma 2bd (四面体)(D ) Ma 2b (平面三角形)2 在下列配合物中,其中分裂能最大的是 (A ) (A ) Rh(NH 3)36+ (B )Ni(NH 3) 36+ (C ) Co(NH 3)36+ (D ) Fe(NH 3)36+3 在八面体强场中,晶体场稳定化能最大的中心离子d 电子数为 (B ) (A ) 9 ,(B ) 6 , (C )5 , (D )34 化合物[Co(NH 3)4Cl 2]Br 的名称是 溴化二氯•四氨合钴(III ) ; 化合物[Cr(NH 3)(CN)(en)2]SO 4的名称是 硫酸氰•氨•二乙二胺合铬(III )。
5 四硫氰·二氨合铬(Ⅲ)酸铵的化学式是 NH 4[Cr (SCN )4(NH 3)2] ; 二氯·草酸根·乙二胺合铁(Ⅲ)离子的化学式是[Fe Cl 2(C 2O 4)en]-4 。
6. 下列物质的有什么几何异构体,画出几何图形(1)[Co(NH 3)4Cl 2]+(2)[Co(NO 2)3(NH 3)3]答:(1)顺、反异构(图略),(2)经式、面式异构(图略)。
7.根据磁矩,判断下列配合物中心离子的杂化方式,几何构型,并指出它们属于何类配合物(内/外轨型。
(1)[Cd (NH 3)4]2+μm =0 ; (2)[Ni(CN)4]2-μm =0 ; (3)[Co(NH 3)6]3+μm =0 ; (4)[FeF 6]3-μm =5.9μB ; 答:8判断下列配离子属何类配离子9 配合物K3[Fe(CN)5(CO)]中配离子的电荷应为 -3 —,配离子的空间构型为八面体,配位原子为 C(碳),中心离子的配位数为 6 ,d 电子在t2g 和e g轨道上的排布方式为 t2g6 e g0—,中心离子所采取的杂化轨道方式为 d2sp3,该配合物属反磁性分子。
大学无机化学第十二章试题及答案

第十三章 硼族元素 总体目标:1.掌握硼单质、氢化物、卤化物和含氧化物的性质、用途和制备方法2. 通过硼及其化合物的结构和性质,掌握缺电子化合物的成键特征3.掌握铝及其化合物的结构、性质和制备4. .认识铍和铝的相似性 各节目标:第一节 硼单质及其化合物1.掌握硼单质的结构、化学性质、用途和制备方法2.掌握乙硼烷、硼酸H 3BO 3、硼砂和三卤化硼的性质、结构和制备方法3.通过硼及其化合物的结构和性质,掌握缺电子化合物的成键特点和桥键的形成第二节 铝单质及其化合物1.掌握铝及其化合物的主要性质和AlCl 3的结构,了解铝的提取和冶炼2.认识铍和铝的相似性,如金属单质、无水卤化物、水合卤化物、氢氧化物 第三节 镓、铟、铊了解镓、铟、铊单质及其重要化合物的性质 习题 一、选择题⒈下列有关硼、铝性质的叙述,错误的是A.都是缺电子原子B.BOH 3是弱酸,AlOH 3是两性偏碱性C.其三卤化物分子都是平面三角形结构D.都是亲氧元素 ⒉在下列a —Al 2O 3的制备方法中,不妥的是A.灼烧AlOH 3B.灼烧AlNO 33C.高温电解Al 2SO 43D.金属铝在氧中燃烧⒊下列铝的化合物不能用湿法制得的是A. Al 2CO 33B.Al 2SO 43C.AlCl 3D.AlAc 3 4. 以下矿物中含有铝的是A.冰晶石B.孔雀石C.白云石D.方铅矿 5. 下列化合物属于缺电子化合物的是 吉林大学无机化学例题与习题A.BCL 3B. HBF 4C. B 2O 3D. NaAlOH 4 6. 在硼的化合物中,硼原子的最高配位数不超过4,这是因为 A .硼原子半径小 B.配位原子半径大 C.硼与配位原子电负性差小 D. 硼原子无价层d 轨道 7. 下列BF 3的叙述中,正确的是A.BF 3易形成二聚体B.BF 3为离子化合物C. BF 3为路易斯酸D. BF 3常温下为液体 8. 下列金属单质中,熔点最低的是 吉林大学无机化学例题与习题 A. Cu B. Zn C. Na D. Ga9. 下列化合物中,熔点最低的是 吉林大学无机化学例题与习题 A. BCl 3 B. CCl 4 C. SiCl 4 D. SnCl 410. 下列物质中水解并能放出H 2的是 吉林大学无机化学例题与习题A. B 2H 6B. N 2H 4C. NH 3D. PH 311. 下列化合物中不能稳定存在的是 吉林大学无机化学例题与习题A. SbI 3B. PI 3C. AlI 3D. TiI 312 . 下列含氧酸中属于一元酸的是 吉林大学无机化学例题与习题A .H 3AsO 3 B.H 3BO 3 C.H 3PO 3 D .H 2CO 313.下列物质中,酸性最弱的是 吉林大学无机化学例题与习题A.. H 3PO 3 B . H 2S C. H 3BO 3 D. H 5IO 6 14.下列金属中,与硝酸反应得到产物的氧化数最低是A .In B. Tl C. Fe D . Bi 15.下列金属中,氧化能力最强的是 吉林大学无机化学例题与习题 A. NO 2 B.SO 3 C .B 2O 3 D. Tl 2O 316.下列分子中,偶极矩最小的是 吉林大学无机化学例题与习题A .B 2H 6 B. SO 2 C. NCl 3 D. SF 4 17.下列化合物中,氧化性与惰性电子对效应有关的是 A .I 2O 5 B. Tl 2O 3C . Mn 2O 7 D. CrO 3 18.与NaCO 3溶液反应生成碱式盐沉淀的离子是A.Al 3+B.Ba 2+C.Cu 2+D.Hg 2+ 19.氧化性最强的是A. Al 2O 3B. Ga 2O 3C. In 2O 3D. Tl 2O 3 20.水解性最强的是A. AlCl 3B. AlBr 3C. NaClD. KNO 3 21.下列物质熔点最高的是A.单质硼B.金属铝C.金属镓D. AlCl 3 22. 用电解法制备金属铅时,在Al 2O 3中加入Na 3AlF 6的作用是 A.使Al 2O 3的熔化温度降低 B.作为原料 C.防止金属铝氧化 D.加快反应速度 23.下列乙硼烷的叙述中,不正确的是A.它是缺电子化合物B.围绕B —B 键可自由旋转C.分子中存在三中心二电子氢桥键D.它最终水解产物是氢气和硼酸24.硼酸与多元醇反应,生成配位酸,使其酸性A.减弱B.增强C.不变D.变化不定二、填空题1. 最简单的硼氢化合物是 , B 原子的杂化方式为 ;由于它属于 化合物,B 与B 存在 碱. 吉林大学无机化学例题与习题2.AlCl 36H 2O 加热后,产物是 .3.由于铝 ,所以它不溶于水.由于铝 ,所以它不与浓硝酸反应.铝与氢氧化钠溶液作用生成 和 . 4.GaCl 2是 磁性物质,结构式应写成5.硼砂的化学式为 ,其为 元碱. 吉林大学无机化学例题与习题6.写出用稀硝酸处理金属铊的反应方程式.7.写出向KI 溶液中加入TlCl 3溶液的反应方程式.8.无机苯的化学式为 ,其结构为 ,与 的结构相似. 9.硼酸为 状晶体,硼酸分子之间以 键结合,层与层之间以结合,故硼酸晶体具有 性,可作为 剂.10.放在手中能够融化的金属有 ,以液相存在的温度范围最大的是 . 吉林大学无机化学例题与习题11.硼酸与乙醇生成硼酸三乙酯的化学式 ,其火焰为 色,以此可以鉴定硼酸. 吉林大学无机化学例题与习题12.B 2O 3与金属氧化物共熔生成的硼珠有特征的颜色,称为硼珠试验,如CoO 的硼珠CoBO 22为深蓝色,则CuO 的硼珠为 色,MnO 的硼珠为 色,NiO 的硼珠为 色,Cr 2O 3的硼珠为 色,Fe 2O 3 的硼珠为 色. 吉林大学无机化学例题与习题 13.判断:⑴ 化合物的热稳定性Ga 2O 3 Tl 2O 3 ⑵ 化学活泼性a —Al 2O 3 r —Al 2O 3 ⑶ 酸性AlOH 3 GaOH 3⑷ 酸性溶液中,氧化性Ga 2O 3 Tl 2O 3 ⑸ In +和Tl +在水中歧化的是14AlCl 3在气态或CCl 4溶液中是 体,其中有 桥键.15.Ga 3+与F -配位时形成 ,与Cl -配位时形成 . 三、简答题TlOH 易溶而TlCl 难溶; 吉林大学无机化学例题与习题 BCl 3 的沸点比 AlCl 3低 吉林大学无机化学例题与习题 CuCl 2 顺磁性而 InCl 2 为逆磁性. 吉林大学无机化学例题与习题 1. 4. 铝和硼有哪些相同和不同的性质2.5. ⑴就铝盐和铝酸盐的生成和性质作一简单扼要的比较.⑵就Al 2Cl 6和B 2H 6的结构作一比较.6.根据铝在酸性或碱性时的标准电极电势说明:1铝在酸、水、碱中溶解的可能性,以便确定铝在这些溶液中的稳定性.2实际上铝不溶于水中,但能溶于 NH 4Cl 或Na 2CO 3的溶液中. 四、计算题⒈在铝盐溶液中滴加碱溶液,并充分搅拌,当刚有AlOH 3沉淀生成时,溶液中Al 3+离子浓度为0.36mol/L,问开始沉淀时溶液的pH 值为多少已知KspAlOH 3=1.9×10-332.求饱和AlOH 3水溶液的pH 值.KspAlOH 3=1.3×10-333.在pH=10时,要使0.10M 铝盐溶液不生成AlOH 3沉淀,NaF 浓度至少需要多大参考答案 一、选择题1.C2.C3.A4. A5.A6.D7.C8.D9.A 10A 11.D 12.B 13.C 14.B 15.D 16.A 17.B 18.C 19.D 20.A 21 A 22. A 23.B 24.B 二、填空题1、乙硼烷,sp3,缺电子,三中心二电子氢桥健. 2. AlOHCl 2+HCl .3.表面有一层致密氧化膜覆盖,能被浓硝酸钝化,NaAlOH 4,H 2 4. 逆,GaGaCl 45.Na 2B 4O 7.10H 2O 二6..3Tl+4HNO 3稀===3TlNO 3+NO ↑+2H 2O7. TlCl 3+3KI===TlI ↓+I 2+3KCl 9.片,氢,分子间力,理解,润滑 10.Cs 和 Ga 11.C 2H 5O 3B ,绿 12.蓝,紫,绿,绿,黄13. ⑴ > ⑵< ⑶> ⑷< ⑸In + 14. 双聚体, 氯 三、简答题1.OH -变形小,与Tl +间极化作用差,TlOH 为离子化合物;Tl +半径较大,与间的离子键不强;所以TlOH 易溶.Cl -变形性比OH -大,Cl -与半径大的Tl +间有相互极化作用,TlCl 中共价成分较大;所以,TlCl 难溶.2.三氯化硼的共价性比三氯化铝强,而分子半径比三氯化铝小,因而三氯化硼的沸点应比三氯化铝低3.CuCl 2中的Cu 2+电子构型为3d 0,有一个单电子,因而CuCl 2为顺磁性.InCl 2化合物是由In + 和 In 3+构成,即可以写成InInCl 4,,In +和 In 3都无单电子,因而InCl 2是反磁性的.4. 答:Al 和B 的价电子层结构都是ns 2np 1,最高氧化态为+3,都是缺电子原子,都有桥状结构化合物,都有MX 3卤化物和M 2O 3氧化物.MX 3是缺电子化合物,为路易斯酸,容易形成卤化物如AlCl 3、BF 3等.这些卤化物也都容易水解.但两者金属性不同,Al 为金属,B 为非金属,AlOH 3系两性,而BOH 3为酸. 5.答:⑴Al 、Al 2O 3或AlOH 3与酸作用都得铝盐Al 3+;与强碱作用,都生成铝酸盐-2AlO .铝盐和铝酸盐一般都溶于水,只要价结合的相反电荷离子无色,这些盐一般无色,它们都水解.Al 3+水解使溶液显酸性,而-2AlO 水解使溶液显碱性.⑵Al 为缺电子原子,它与Cl 2结合形成双聚分子而具有桥状结构.Al 原子进行sp 3杂化,每个Al 原子与3个Cl 原子形成3个Al~Cl σ键,还有一个sp 3空轨道可以接受来自Cl 原子的孤对电子对,形成三中心四电子键,生成桥键配位化合物.这种桥键称卤桥键.B 也是缺电子原子,它与氢形成化合物时也必须形成组成为B 2H 6的分子才能满足价轨道的需要.两个B 原子各以两个sp 3杂化轨道同两个H 原子形成2个B —H σ键,这4个σ键在同一个平面之上,剩下的四个价电子在2个B 原子和另外2个H 原子之间垂直于上述平面的两个三中心两电子键,一个在平面之上,一个在平面之下,每个三中心键是由一个H 原子和二个B 原子共用价电子构成的,这种B —H —B 三中心两电子键称为氢桥键.所以Al 2Cl 6与B 2H 6都是桥式结构,分子中卤桥键及氢桥键也都是三中心键.但由于Cl 原子对由孤电子对,H 原子没有;Al 的原子半径比B 大,Cl 的原子半径比氢大,Cl 桥键的键长比B —H 桥键的键长长一些,键能则弱一些.Al —Cl —Al 桥键同B —H —B 桥键都是离域键,但前者有配键性质. 6. 答:1有关标准电极电势如下:Al 3++3e -=Al E A 0=-1.66V H 2AlO 3-+H 2O+3e --=Al+4CH - E B 0=-1.66V2H ++2e -=H 2 E A 0=0.00V 2H 2O+2e -= H 2+2OH - E B 0=-0.828V由此可见无论在酸、水或碱中Al 都是不稳定的,容易置换溶液中的H +使之成为H 2而自身被氧化为Al Ⅲ.但事实上铝却不与水反应,这是由于铝在空气中放置时表面被氧化生成一层致密的Al 2O 3氧化膜,它不能被水溶解,因而隔绝了与水的进一步接触而使之作用.2Al 之所以溶解于NH 4Cl 和Na 2CO 3溶液中,乃是由于:NH 4++ H 2O=== NH 3 H 2O +H +CO 32-+ H 2O=== HCO 3-+OH -在上述水解反应中产生了H +或OH -,而Al 2O 3膜是两性的,既可溶于酸,又可溶于碱,所以Al 2O 3膜可与水解产生的H + 或OH -作用并被溶解.失去Al 2O 3 覆盖层之后的Al,便很容易在溶液中反应并被溶解. 四、计算题:⒈解:Al 3+OH -3=1.9×10-33 Al 3+=0.36mol/L33336.0109.1][--⨯=OH pOH=3336.0109.1lg -⨯-=10.76 pH=14-pOH=3.24 答:开始沉淀时溶液的pH 值为3.24. 2.解:设AlOH 3饱和溶液的摩尔浓度为x,则:Al 3+OH -3=KspAlOH 3 即x3x 3=1.3×10-3327 x 4=1.3×10-33 x=2.6×10-9∴OH -=3×2.6×10-9=7.8×10-9<10-7即AlOH 3在水溶液中产生的OH -浓度比水电离出的OH -浓度少许多倍,基本 上不影响水的电离,故AlOH 3水溶液的pH 值就是水的pH 值,等于7. 3.解:已知KspAlOH 3=1.3×10-33K 稳AlF 63-=6.9×1019 Al 3++3 OH AlOH 3 Al 3++6F -AlF 63-当pH=10时,H +=10-10M,则OH -=10-4M如在此条件下不生成AlOH3沉淀,则Al3+=Ksp/OH-3≤1.3×10-33/10-43≤1.3×10-21 M又K稳=AlF63-/Al3+ F-6F-6=AlF63-/Al3+K稳∵ F-=0.10/1.3×10-21×6.9×10191/6=1.0M故若要不生成AlOH3沉淀则 F-≥1.0M.。
配位化学习题及答案(1)

配位化学习题及答案(1)配位化学练习题一.是非题1.配合物的配位体都是带负电荷的离子,可以抵消中心离子的正电荷。
2+2+ 2+2.[Cu(NH)] 的积累稳定常数β是反应[Cu(NH)]+NH,[Cu(NH)]的平33332333衡常数。
3. 配位数是中心离子(或原子)接受配位体的数目。
4.配离子的电荷数等于中心离子的电荷数。
5.配合物中由于存在配位键,所以配合物都是弱电解质。
θ6.根据稳定常数的大小,即可比较不同配合物的稳定性,即K愈大,该配合物f愈稳定。
7. 对同一中心离子,形成外轨型配离子时磁矩大,形成内轨型配合物时磁矩小。
3+8.Fe(?)形成配位数为6的外轨型配合物中,Fe离子接受孤对电子的空轨道32是spd。
9.中心离子的未成对电子数越多,配合物的磁矩越大。
10. 配离子的配位键越稳定,其稳定常数越大。
二.选择题1. 下列叙述正确的是()A. 配合物由正负离子组成B. 配合物由中心离子(或原子)与配位体以配位键结合而成C. 配合物由内界与外界组成D. 配合物中的配位体是含有未成键的离子2.下面关于螯合物的叙述正确的是( )A、有两个以上配位原子的配体均生成螯合物B、螯合物和具有相同配位原子的非螯合物稳定性相差不大C、螯合物的稳定性与环的大小有关,与环的多少无关D、起螯合作用的配体为多齿配体,称为螯合剂,,,,,,,,,,,,3.已知lgAgNH=7.05, ,21.7, =7.57,lgAgCNlgAgSCN,,,,,,,,,,,232222,,,,2,,,,,,3,,,,=13.46;当配位剂的浓度相同时,AgCl在哪种溶液中的溶解度lgAgSO,,,,,2232,,1最大( )A. NH?HOB. KCNC. NaSOD. NaSCN 322234.为了保护环境,生产中的含氰废液的处理通常采用FeSO法产生毒性很小的配 4合物是( )3, A、Fe(SCN) B、Fe(OH) 363, C、Fe(CN) D、Fe [(Fe(CN)] 2 665. 下列说法中错误的是()A. 在某些金属难溶化合物中,加入配位剂,可使其溶解度增大3+3+B.FeNaFFe 在溶液中加入后,的氧化性降低3-C.[FeF] 在溶液中加入强酸,也不影响其稳定性63+D.[FeF] 在溶液中加入强碱,会使其稳定性下降66.对于一些难溶于水的金属化合物,加入配位剂后,使其溶解度增加,其原因是()A. 产生盐效应B. 配位剂与阳离子生成配合物,溶液中金属离子浓度增加C. 使其分解D. 阳离子被配位生成配离子,其盐溶解度增加7.下列分子或离子能做螯合剂的是( )-A. HN-NH B. CHCOO C. HO-OH D.HNCHCHNH 22 322228. 配位数是()A.() 中心离子或原子接受配位体的数目B.() 中心离子或原子与配位离子所带电荷的代数和C.中心离子(或原子)接受配位原子的数目D.中心离子(或原子)与配位体所形成的配位键数目 9.关于配合物,下列说法错误的是( )A.配体是一种可以给出孤对电子或π键电子的离子或分子B.配位数是指直接同中心离子相连的配体总数 C.广义地讲,所有金属离子都可能生成配合物 D.配离子既可以存在于晶体中,也可以存在于溶液中210.分子中既存在离子键、共价键还存在配位键的有( )3+AlCl A. B. C.[Co(NH)]Cl D. NaSOKCN3633243+11.下列离子中,能较好地掩蔽水溶液中Fe离子的是( )- ---A.F B.Cl C. Br D. I12. 下列说法中错误的是()A. B. 配合物的形成体通常是过渡金属元素配位键是稳定的化学键C. D. 配位体的配位原子必须具有孤电子对配位键的强度可以与氢键相比较13. 下列命名正确的是()A. [Co(ONO)(NH)Cl]Cl ?III 亚硝酸根二氯五氨合钴()352B. [Co(NO)(NH)] ?III 三亚硝基三氨合钴()2333C. [CoCl(NH)]Cl ?III 氯化二氯三氨合钴()233D. [CoCl(NH)]Cl ?III 氯化四氨氯气合钴()23414. 影响中心离子(或原子)配位数的主要因素有()A. 中心离子(或原子)能提供的价层空轨道数B.空间效应,即中心离子(或原子)的半径与配位体半径之比越大,配位数越大C. 配位数随中心离子(或原子)电荷数增加而增大D. 以上三条都是15. 下列说法中正确的是()A. 配位原子的孤电子对越多,其配位能力就越强B. 电负性大的元素充当配位原子,其配位能力就强C. 能够供两个或两个以上配位原子的多齿配体只能是有机物分子D. 内界中有配位键,也可能存在共价键16.CoCl?5NH?HO已知某化合物的组成为,其水溶液显弱酸性,加入强碱并加332AgNO热至沸,有氨放出,同时产生三氧化二钴的沉淀;加于另一份该化3 AgClAgNO合物的溶液中,有沉淀生成,过滤后,再加入而无变化,但加3 AgCl热至沸又产生沉淀,其重量为第一次沉淀量的二分之一,故该化合物的化学式为()A.[CoCl(NH)]Cl?HOB.[Co(NH)HO]Cl235235233C.[CoCl(NH)]Cl?HOD.[CoCl(NH)]Cl?NH?HO 3522234323+17.Fe 离子能与下列哪种配位体形成具有五元环的螯合离子()--2- A. CO B.CHCOCHCOCH C. HNCHCHNHD.OOCCHCOO 24323222222-18.下列各配合物具有平面正方形或八面体的几何构型,其中CO离子作为螯合 3剂的是( )+ + A.[Co(NH)CO]B.[Co(NH)CO]353333C.[Pt(en)CO]D.[Pt(en)( NH)CO] 33319.下列配离子能在强酸性介质中稳定存在的是( )3,2,3,2,,,,,,,AgSONiNHFeCOHgCl232433244A. B. C.; D.。
配位化学习题答案

配位化学习题答案配位化学是无机化学中的一个重要分支,它研究的是配合物的合成、结构和性质。
在学习配位化学的过程中,学生常常会遇到一些难题,需要进行深入的思考和探索。
本文将针对一些典型的配位化学学习题进行解答和讨论,希望能够帮助读者更好地理解和掌握这一领域的知识。
1. 题目:给出一个配合物的化学式,要求判断其属于哪种配位数。
解答:判断一个配合物的配位数,需要根据中心金属离子周围配体的数目来确定。
常见的配位数有2、4、6等。
例如,对于化学式[Co(NH3)6]Cl3,其中的Co离子周围有6个NH3配体,因此配位数为6。
而对于化学式[Fe(CN)6]3-,其中的Fe离子周围有6个CN配体,配位数同样为6。
2. 题目:给出一个配合物的化学式,要求判断其中的配体是何种配体。
解答:判断一个配合物中的配体种类,需要根据配体的化学式和结构来确定。
常见的配体有水分子(H2O)、氨分子(NH3)、氰根离子(CN-)等。
例如,对于化学式[Co(NH3)6]Cl3,其中的配体是氨分子。
而对于化学式[K4[Fe(CN)6]],其中的配体是氰根离子。
3. 题目:给出一个配合物的化学式,要求判断其中的配体是否具有配位异构体。
解答:配位异构体是指在同一配合物中,配体的排列方式不同所形成的异构体。
判断一个配合物是否具有配位异构体,需要分析配体的排列方式和配位数。
例如,对于化学式[Co(NH3)5Cl]Cl2,其中的配体氨分子和氯离子可以有不同的排列方式,形成配位异构体。
而对于化学式[Co(NH3)6]Cl3,其中的配体氨分子的排列方式只有一种,因此不具有配位异构体。
4. 题目:给出一个配合物的化学式,要求判断其中的配体是否具有手性。
解答:手性是指分子或配合物不重合于其镜像形式的性质。
判断一个配合物是否具有手性,需要分析配体的结构和对称性。
如果配体的结构中存在手性中心或手性轴,那么配合物就具有手性。
例如,对于化学式[Co(en)3]Cl3,其中的配体乙二胺(en)具有手性,因此配合物具有手性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第12章 配位化学基础1 M 为中心原子,a, b, d 为单齿配体。
下列各配合物中有顺反异构体的是 (A ) (A ) Ma 2bd (平面四方)(B ) Ma 3b (C ) Ma 2bd (四面体)(D ) Ma 2b (平面三角形)2 在下列配合物中,其中分裂能最大的是 (A ) (A ) Rh(NH 3)36+ (B )Ni(NH 3) 36+ (C ) Co(NH 3)36+ (D ) Fe(NH 3)36+3 在八面体强场中,晶体场稳定化能最大的中心离子d 电子数为 (B ) (A ) 9 ,(B ) 6 , (C )5 , (D )34 化合物[Co(NH 3)4Cl 2]Br 的名称是 溴化二氯•四氨合钴(III ) ; 化合物[Cr(NH 3)(CN)(en)2]SO 4的名称是 硫酸氰•氨•二乙二胺合铬(III )。
5 四硫氰·二氨合铬(Ⅲ)酸铵的化学式是 NH 4[Cr (SCN )4(NH 3)2] ; 二氯·草酸根·乙二胺合铁(Ⅲ)离子的化学式是[Fe Cl 2(C 2O 4)en]-4 。
6. 下列物质的有什么几何异构体,画出几何图形(1)[Co(NH 3)4Cl 2]+(2)[Co(NO 2)3(NH 3)3]答:(1)顺、反异构(图略),(2)经式、面式异构(图略)。
7.根据磁矩,判断下列配合物中心离子的杂化方式,几何构型,并指出它们属于何类配合物(内/外轨型。
(1)[Cd (NH 3)4]2+μm =0 ; (2)[Ni(CN)4]2-μm =0 ; (3)[Co(NH 3)6]3+μm =0 ; (4)[FeF 6]3-μm =5.9μB ; 答:8判断下列配离子属何类配离子9 配合物K3[Fe(CN)5(CO)]中配离子的电荷应为 -3 —,配离子的空间构型为八面体,配位原子为 C(碳),中心离子的配位数为 6 ,d 电子在t2g 和e g轨道上的排布方式为 t2g6 e g0—,中心离子所采取的杂化轨道方式为 d2sp3,该配合物属反磁性分子。
10 计算下列金属离子在形成八面体配合物时的CFSE/Dq(1) Cr2+离子,高自旋;(2) Mn2+离子,低自旋;(3) Fe2+离子,强场;(4) Co2+离子,弱场。
解:(1) Cr2+离子,高自旋:d4,t2g3 e g1,(-4×3+6×1)Dq = -6Dq;(2) Mn2+离子,低自旋:d5,t2g5 e g0,(-4×5)Dq+2P = -20Dq+2P;(3) Fe2+离子,强场:d6,t2g6 e g0,(-4×6)Dq+2P = -24Dq+2P;(4) Co2+离子,弱场:d7,t2g5 e g2,(-4×5+6×2)Dq = -8Dq。
11 判断下列各对配合物的稳定性的高低:(填“>”或“<”)(1)[Cd(CN)4]2-、[Cd(NH3)4]2+;(2) [AgBr2]-、[AgI2]-;(3)[Ag(S2O3)2]3-、[Ag(CN)2]-(4) [FeF]2+、 [HgF]+;(5)[ Ni(NH3)4]2+、[Zn(NH3)4]2+答:(1) [Cd(CN)4]2->[Cd(NH3)4]2+, CN-是比NH3更强的配体;(2) [AgBr2]-<[AgI2]-, Ag+属于软酸,I-属于软碱,而Br-属于交界碱;(3) [Ag(S2O3)2]3-<[Ag(CN)2]- CN-是比S2O32-更强的配体;(4) [FeF]2+> [HgF]+; F-属于硬碱,Fe3+属于硬酸,而Hg2+属于软酸;(5) [ Ni(NH3)4]2+<[Zn(NH3)4]2+查表发现:logK f(Zn(NH3)42+)=9.46,而logK f(Ni(NH3)42+)=7.96 。
12 已知△0([Co(NH3)6]3+)=23000cm-1,△0([Co(NH3)6]2+)=10100cm-1,通过计算证明fK([Co(NH 3)6]3+)>θf K ([Co(NH 3)6]2+)。
解:(1)对于[Co(NH 3)6]3+,1 Dq=23000cm -1/10=2300cm -1,属于强场配合物,Co 3+属于d 6构型,d 电子排列为:t 2g 6 e g 0,省略电子成对能P ,CFSE ([Co(NH 3)6]3+)=(-4×6)Dq=-24 Dq , CFSE ([Co(NH 3)6]3+)=-24×2300cm -1= -55200cm-1(2)对于[Co(NH 3)6]2+,1 Dq=10100cm -1/10=1010cm -1,属于强场配合物, Co 2+属于d 7构型,d 电子排列为:t 2g 5 e g 1,省略电子成对能P ,CFSE ([Co(NH 3)6]3+)=(-4×6+6×1)Dq=-18 Dq , CFSE ([Co(NH 3)6]2+)=-18×1010cm -1= -18180 cm -1(3)因为CFSE ([Co(NH 3)6]3+)大于CFSE ([Co(NH 3)6]2+), 所以可以判断θf K ([Co(NH 3)6]3+)>θf K ([Co(NH 3)6]2+)。
13 [Co(NH 3)6]3+为低自旋配离子,其电子吸收光谱的最大吸收峰在23000 cm ―1处。
该配离子的分裂能是多少?(分别以cm ―1和kJ/mol 表示),吸收什么颜色的光,呈现什么颜色? 解:(1)用电子吸收光谱的频率表示,分裂能△0等于的最大吸收峰值,所以([Co(NH 3)6]3+)=23000 cm―1;(2)用能量表示, 根据△0=E=h ν= hc/λ,其中波数=1/λ=23000 cm ―1=23000/10-2m ―1= 2300000 m―1,所以△0= 6.626×10-34Js ×1×108ms -1×2300000 m ―1=1.52×10-19J;经单位换算: △0=1.52×10-19J ×10-3KJ/J ×6.023×1023mol -1= 91.55 KJ mol -1(3)吸收光的波数为23000 cm ―1属于兰光,透过余下的光而使[Co(NH 3)6]3+溶液呈现酒红色。
14 在0.10mol ·L -1的K[ Ag (CN)2 ]溶液中,加入固体KCN ,使CN - 的浓度为0.10mol ·L-1,然后再分别加入(1) KI 固体,使I -的浓度为0.10mol ·L -1; (2) Na 2S 固体,使S2- 的浓度为0.10mol ·L-1。
计算体系的J 值并判断是否能产生沉淀 (忽略体积变化)。
(已知()[]()2021048.2⨯=-CN Ag K f θ,()17103.8-⨯=AgI K sp θ , ()492100.2-⨯=S Ag K spθ) (1)解: 步骤1计算[Ag +]:设达到平衡时有X molL -1的[Ag (CN )2]- 发生解离,[Ag +]=XmolL -1Ag ++ 2CN - ==[Ag (CN )2]-X 0.1+2X 0.1-X()[]()2021048.2⨯=-CN Ag K f θ==[Ag (CN )2-]/[Ag +][CN -]2=(0.1-X)/ X(0.1+2X) 2 ==(0.1)/ X(0.1) 2=1/ 0.1 X[Ag +]=X=1/ 2.48X1019=4.03 X10-20(mol ·L -1)步骤2计算[I --] :加入KI 固体,忽略体积变化,使[I --]==0.10mol ·L -1步骤3计算反应商J :J=[Ag +][I --]= 4.03 X10-20X0.10=4.03 X10-21步骤4根据反应商判椐判断:()17103.8-⨯=AgI K sp θ,J=4.03 X10-21因为J 小于()AgI K sp θ,所以不能产生AgI 沉淀。
(2)解:步骤1计算[Ag +]:方法和结果同上,即[Ag +]=4.03 X10-20(mol ·L -1) 步骤2计算[S 2-] :加入Na 2S 固体,忽略体积变化,使[S 2-]==0.10mol ·L -1步骤3计算反应商J :J=[Ag +]2[S 2-]= (4.03 X10-20)2X0.10=1.62⨯10-40步骤4根据反应商判椐判断:()492100.2-⨯=S Ag K sp θ,J=1.62⨯10-40因为J 大于()AgI K sp θ,所以会产生Ag 2S 沉淀。
15 Fe 3+能氧化I -,但Fe(CN)3-6不能氧化I -,由此推断:(1)下列电极电势的大小顺序:(a )E 0(I -/I 2)、(b )E 0(Fe 3+/ Fe 2+)、(C )E 0(Fe(CN)63-/ Fe(CN)64-)(2)下列配合物稳定常数的大小顺序:(a )θf K (Fe(CN)3-6)与(b )θf K (Fe(CN)4-6)解:(1)Fe 3+能氧化I -,证明(b )E 0(Fe 3+ / Fe 2+)>(a )E 0 (I -/I 2);Fe(CN)3-6不能氧化I -证明(a )E 0(I -/I 2)>(C )E 0(Fe(CN)63-/ Fe(CN)64-); 故有电极电势的大小顺序:(b )>(a )>(c )。
(2)根据能斯特方程式E 0(Fe(CN)63-/ Fe(CN)64-)=E (Fe 3+/ Fe 2+)= E 0(Fe 3+/ Fe 2+)+0.059log([Fe 3+]/[Fe 2+])= E 0(Fe 3+/ Fe 2+)+0.059log[K f (Fe(CN)64-)/K f (Fe(CN)63-)] 题意(b )E 0(Fe 3+/ Fe 2+)>(C )E 0(Fe(CN)63-/ Fe(CN)64-)log[K f (Fe(CN)64-)/K f (Fe(CN)63-)] < 0即(a )θf K (Fe(CN)3-6)>(b )θf K (Fe(CN)4-6)故有配合物稳定常数的大小顺序(a )>(b )。
16 已知()[]()2021048.2⨯=-CN Ag K f θ , ()[]()7231067.1⨯=+NH Ag K f θ . 在 1.0 L 的0.10mol ·L -1[Ag(NH 3)2]+溶液中, 加入0.20 mol 的KCN 晶体(忽略因加入固体而引起的溶液体积的变化), 求溶液中[Ag (NH 3)2]+、[Ag (CN)2]-、NH 3 及CN -的浓度。
