食盐中碘含量的光度分析法测定
亚甲基蓝氧化褪色光度法测定食盐中的碘

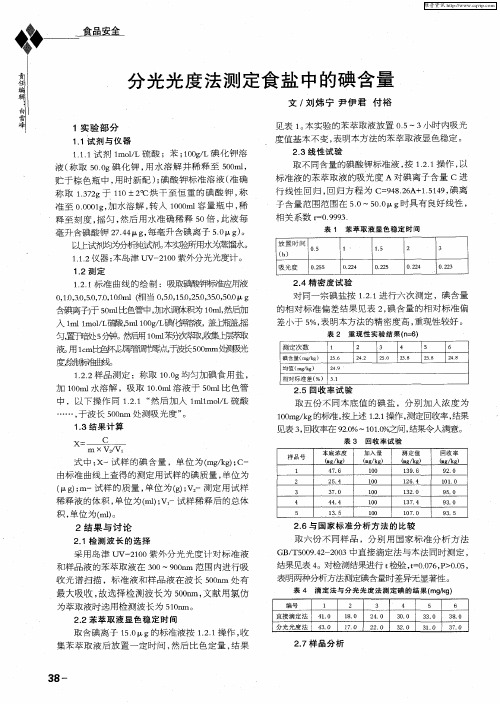
0 2 0 O . 5 0gKI 。于小 烧 杯 中 , 适 量 的水 溶 解 后 转 人 加 2 0mL 5 容量瓶 , 用水 稀释 至刻度 , 摇匀 备用 。
碘酸钾 标 准 溶液 , 0g / 2 g mL( I作 液 ) 用 移 液管 : 准确 移 取 5 O . 0 mL 上 述 制 得 的 碘 酸 钾 贮 备 液 于 2 0mL 5 容量瓶 中, 水稀释 至刻 度 , 匀 。 用 摇
关 系, 尔吸光 系数 为 1 1 O L・ l1・ m_ 。用 于测定食盐 中微量 碘 的含 量 , 摩 . ×1 。 mo_ c 。 结果满 意 。
关键 词 : 甲基蓝 ; 亚 氧化褪 色 ; 光度 法 ; 碘
中 图分 类号 : S 7 T 3
文献标识 码 : B
文章编号 :O O 9 3 2 1 ) 1 1 4 2 1 0 一9 7 ( 0 1 0 一O 1 一O
碘盐检测方法2016详解

方法的选择
方法 直接滴定法 氧化还原滴定法 适用范围 碘酸钾碘盐 添加碘化物或含有还原物质的加碘盐
碘量仪光度法
碘的快速测定
不同类型碘盐的识别
无碘盐
玫 瑰 红 盐 碘 检 测 试 剂 盐 碘 快 速 检 测 试 剂
碘酸钾碘盐
碘化钾碘盐
直接滴定法原理
在酸性介质中,试样中的碘酸根离子氧化碘化钾析 出单质碘,用硫代硫酸钠标准滴定溶液滴定,测 定碘的含量。
滴定管下端伸入容量瓶口内1cm左右,边滴边摇;
每次滴定最好从0mL开始,滴下的液体不要连成线; 读数时滴定管要保持垂直,视线与弯月面下缘最低点在 同一水平上;蓝带滴定管应读取两个弯月面相交的交点 位臵。
氧化还原法
原理
在酸性介质中,次氯酸钠将碘离子氧化成碘酸根,草酸 除去过剩的次氯酸钠,碘酸根氧化碘化钾析出单质碘,用 硫代硫酸钠标准滴定溶液滴定,测定碘含量。 3CLO-+I- →IO3-+3CLH2C2 O4 + CLO- →CL- +2CO2 +H2O + IO3 + 5 I + 6H →3 I2 + 3H2O 2S2O32- + I2 → 2I -+ S4O62-
浓度:c(1/6KIO3)=2.000×10-3mol/L
配制方法:准确称取1.427克于110℃±2℃干燥
至恒重的碘酸钾基准试剂,臵于100mL小烧杯中,
加水溶解,移入1000mL容量瓶中,加水稀释至刻
度,将上述溶液准确稀释20倍。
注意事项
碘酸钾基准试剂于110℃±2℃烘干2小时,至恒重后于干
碘化钾溶液(50 g/L )
1、配制方法
称 取 25 .0 g 碘化钾,1g氢氧化钠(稳定剂),用水溶 解并稀释至500mL。
分光光度法测定食盐中碘含量方法的评述

分光光度法测定食盐中碘含量方法的评述分光光度法测定食盐中碘含量方法的评述随着人们生活水平的提高,大多数居民都能吃上加碘盐。
而有些人为了防治甲状腺病而大量吃海带、紫菜等富含碘的食物,以至碘过量,引起机体一系列的不良反应,甚至危及健康。
因此,及时、准确地测定食盐中的碘含量具有重要意义。
目前常用的测定食盐中碘含量的方法有三种:碘量瓶直接测定法;碘溶液比色测定法和分光光度法。
①分光光度法是一种可以同时测定吸光度和相对强度的物理方法,适合于现场操作,且灵敏度高,准确性好。
但操作繁琐,只适合小批量检测。
②碘量瓶法是将固定在架子上的塑料量筒底部烧灼后磨去,再用铅笔填写被测样品的量,最后将瓶口磨平封死,作为碘的标准液。
然后用分光光度计进行比色测定。
这种方法操作简单,但由于反复磨损,量筒内壁附着大量的铅,会影响到比色的精密度。
另外,由于量筒的大小限制,也使它不能满足批量检测的要求。
③分光光度法是将玻璃比色皿或金属比色皿放在分光光度计下面,当入射光线经过单色器通过棱镜时发生折射和干涉现象,形成各种颜色的光谱。
根据这些光谱的强度和颜色,便可求出待测元素的含量。
该方法操作简单,测定快速,但受客观条件限制较多,比如量程选择不当,将造成假阳性;波长选择不当,会导致吸收峰的损失;样品浓度太低或太高,都将使检测误差增大。
(1)测定样品应用分光光度法,以铁为基准标准。
当仪器校正完毕并做好空白样品测定时,将空白液直接注入已调零的比色管中,关闭玻璃阀门,待其自然沉降后即可读取吸光度。
(2)测定过程要注意条件控制,样品的处理温度、试剂、反应时间以及比色管内的空气要一致。
并使用恒温加热装置,避免温度升得过快。
(3)读数需要借助检流计,仪器采用自动电位滴定器。
并将所用的仪器以及电极和相应的参比溶液全部校正到仪器所给定的参考点。
另外,还应记录仪器测定过程中出现的吸光度值、 A/D变化值、仪器误差等,并与计算值对比,作出检验结果。
(4)试验结束后,试验人员应首先检查结果的精密度和准确度。
加碘酸钾食盐中碘含量的紫外分光光度法测定

Ξ加碘酸钾食盐中碘含量的紫外分光光度法测定刘翠格, 默丽萍, 魏永巨(河北师范大学化学学院,河北石家庄 050016)摘 要:根据碘(I 2)、碘离子(I -)和碘三离子(I 3-)的紫外吸收光谱,拟订了加碘酸钾食盐中碘含量的光度测定方法.在p H 2.4,KI 浓度为0.01mol/L 的HCl 介质中,1mol 碘酸钾可定量转变为3mol I 3-,通过测量I 3-在288nm 或350nm 处的吸光度,可计算食盐样品中碘的含量.方法的加入回收率在96.8%~102.6%之间.本文中,笔者分析了2种市售碘盐样品,结果令人满意.关键词:碘;食盐;紫外分光光度法中图分类号:O 657.32 文献标识码:A 文章编号:100025854(2003)0520497203碘是人体内合成甲状腺素所必需的微量元素.适量的甲状腺素有促进机体生长、调节能量转换、稳定神经系统等作用.缺碘会影响机体代谢,引起甲状腺肿,严重者可致发育停滞、痴呆.按国际推荐标准,成人每日需碘0.1~0.3mg [1].防止碘缺乏的一个重要措施是推广食用加碘食盐.食盐中加碘的方法有2种,一是加入碘化钾,二是加入碘酸钾.1994年,国家规定在食盐中加入碘酸钾[2,3].目前市售加碘酸钾食盐中碘含量一般为(35±15)mg/kg.食盐含碘量的测定方法有多种[2],如滴定分析法、吸光光度法[3~6]、荧光及化学发光法[7]、离子选择电极法、极谱法、色谱法和专用测碘仪法[8]等.笔者在研究碘(I 2)、碘离子(I -)和碘三离子(I 3-)的紫外光谱时,观察到I 3-的紫外光谱与I 2和I -的紫外光谱有明显不同.根据这种光谱差异和碘的化学性质,拟订了加碘酸钾食盐中碘含量的测定方法,实验结果令人满意.1 原 理在酸性介质中,KIO 3与过量KI 反应生成I 2: IO 3-+5I -+6H +=3I 2+3H 2O.(1)I 2与I -结合生成I 3-: I 2+I -=I 3-.(2)反应完成后,溶液中含有I 3-和过量的I -.由于I 3-在260nm 以上有灵敏的光吸收,而I 2和I -在260nm 以上没有吸收(见图1),因而可以通过测定溶液的吸光度而得知I 3-的浓度,进而推算加碘酸钾食盐中碘的含量.2 实验部分2.1 仪器与试剂UV 2501PC 分光光度计(日本,岛津).I 2:分析纯,天津市天大化工实验厂出品,配制成0.500mmol/L 水溶液;KI :分析纯,中国医药公司进口分装,配制成0.050mol/L 水溶液,使用时适当稀释;KIO 3:化学纯,上海化学试剂总厂出品,配制成0.100mol/L 水溶液,使用时适当稀释;HCl :分析纯,配制成水溶液并标定其准确浓度;NaCl :分析纯,1.0mol/L 水溶液;实验用水为蒸馏水.2.2 实验方法在25mL 容量瓶中分别加入I 2,KI ,KIO 3,HCl ,NaCl 等溶液,用水稀释至刻度,摇匀,以水为参比,Ξ收稿日期:20030403;修回日期:20030531作者简介:刘翠格(1954),女,河北保定人,河北师范大学副教授,从事无机化学的教学与研究.第27卷第5期2003年 9月河北师范大学学报(自然科学版)Journal of Hebei Normal University (Natural Science Edition )Vol.27No.5Sep.20031cm 吸收池,扫描吸收光谱,或读取一定波长的吸光度.根据加入HCl 标准溶液的浓度和体积,计算显色溶液的p H 值,加入NaCl 溶液以控制离子强度.3 结果与讨论3.1 I 2,I -和I 3-的吸收光谱按实验方法测量I 2,I -和I 3-的吸收光谱,得图1.图1中I 2的吸收峰在202nm ,I -的吸收峰在193和226nm ,I 2和I -在260nm 以上没有吸收;I 3-的吸收峰在288和350nm ,摩尔吸光系数(ε)分别为3.52×104和2.33×104L/(mol ・cm ).根据反应式(1)和(2),1mol KIO 3可以定量转变为3mol I 3-,因此,KIO 3的反应是一个有倍增效应的高灵敏度显色反应.3.2 溶液酸度的影响溶液酸度对反应(1)有显著影响,实验表明在p H 1.4~3.4之间较为合适(见图2).在高酸度条件下(p H <1.4),I -可与溶解氧发生反应:4I -+4H ++O 2=2I 2+2H 2O ,产生正误差;而在低酸度条件下(p H >3.4),I 2发生歧化反应:3I 2+6OH -=5I -+IO 3-+3H 2O ,此时I 3-将不能生成.本实验控制p H为2.4.λ/nmI 2与I -的浓度均为0.060mmol/L ;I 3-为0.040mmol/L I 2+0.010mol/L KI图1 I 2,I -和I 3-的紫外吸收光谱p HKIO 3:5.0μmol/L ;KI :0.010mol/L ;0.2mol/L NaCl 介质图2 溶液酸度对显色反应的影响3.3 KI 用量的影响I 2:0.040mmol/L ;曲线1和2的测量波长分别为350,288nm图3 KI 用量对显色反应的影响由于I 3-的稳定常数较小(lg K =2.96)[9],为了保证反应(2)进行完全,必须加入过量的KI (见图3).本实验取KI 浓度为0.01mol/L.3.4 显色溶液的稳定性在过量KI 存在下,I 3-是相当稳定的.显色溶液在50min 内吸光度基本不变;时间再延长,溶液吸光度有所下降[5].3.5 共存物质的影响本方法基于氧化还原反应(1),只有氧化性离子如MnO 4,Cr 2O 72-,Cu 2+等才能产生干扰,但在食盐中,这些离子一般不存在,因此,本方法基本不存在干扰物质[4].3.6 工作曲线在p H 2.4,NaCl 浓度为0.2mol/L 的条件下,用KIO 3标准溶液制作工作曲线,回归方程分别如下:288nm :A =0.009+0.787c I ,r =0.99997;894河北师范大学学报(自然科学版)第27卷350nm :A =0.005+0.518c I ,r =0.99995.3.7 加入回收实验在碘盐样品溶液中定量加入KIO 3标准溶液,与样品溶液同时显色后,以样品显色溶液为参比,测量由于加入KIO 3所产生的吸光度增加值,再根据回归方程计算加入碘的浓度,进而计算回收率.以不同样品为基体,做了7次加入回收实验,分别在288和350nm 波长下测量,结果列于表1.表1中回收率在96.8%~102.6%之间,在光度分析允许误差范围内.表1 加入回收实验结果加入碘/(mg ・L -1)288nm吸光度增加值测得碘/(mg ・L -1)回收率/%350nm吸光度增加值测得碘/(mg ・L -1)回收率/%0.2540.20330.24797.20.13540.25299.20.2540.20230.24696.80.13490.25198.80.3810.30860.381100.00.20300.382100.30.3810.30410.37598.40.20000.37698.70.5080.41160.512100.80.27140.514101.20.3810.31430.388101.80.20760.391102.60.2540.20300.24797.20.13290.24797.23.8 样品分析称取市售加碘酸钾食盐10.00g ,溶解后转移至100mL 容量瓶中,以水定容.移取此溶液2.00~4.00mL 至25mL 容量瓶中,加入5.0mL 0.05mol/L KI ,1.0mL 0.1mol/L HCl ,用水稀释至刻度,摇匀,在288或350nm 测量吸光度,由工作曲线计算样品中碘的含量.笔者测定了2种市售加碘酸钾食盐样品,测量数据与计算结果列于表2.其中样品1为自然精制碘盐(执行标准QB 2446—99),样品2为碘盐洗粉(执行标准G B 5461—2000).这2种样品的含碘量标签值均为(35±15)mg/kg.由表2可见,样品2的含碘量平均值 x 与标签值一致,而样品1的含碘量平均值比标签值略低.表2 食盐样品碘含量的测定结果V /mL 样品1288nmAw /(mg ・kg -1)350nmAw /(mg ・kg -1)样品2288nmAw /(mg ・kg -1)350nmAw /(mg ・kg -1)2.000.136620.20.088320.00.243037.10.158837.03.000.189419.10.123219.00.344335.50.227035.74.000.248319.00.161818.90.461035.90.302635.9x ±s 19.4±0.719.3±0.636.2±0.836.2±0.8参考文献:[1] 周爱儒.生物化学[M ].第5版.北京:人民卫生出版社,2000.396.[2] 刘占广.碘盐含碘量分析综述[J ].海湖盐与化工,1999,28(6):33235.[3] 王彦,薛斌.分光光度法测定食盐中的碘含量[J ].辽宁化工,1996,(1):57258.[4] 胡章记.倍增反应紫外吸光光度法测定食盐中微量碘[J ].化学研究,2002,13(1):43244.[5] 马卫兴,薛婉立.紫外光度法测定食盐中的添加剂碘酸钾[J ].中国调味品,1997,(6):22224.[6] 王末肖,高磊红,刘春艳,等.吸光光度法测定碘酸钾的研究[J ].理化检验(化学分册),2002,38(5):2432244.[7] 张子红,杜凌云,王术皓,等.停流流动注射化学发光法测定碘盐中的碘酸根[J ].光谱实验室,2001,18(5):5842587.[8] 陈焕文,于爱民,韩松柏,等.手持式测碘仪现场测定食盐中的碘[J ].分析化学,2001,29(7):8552858.[9] 刘翠格,默丽萍.分光光度法测定I 3-的稳定常数[J ].化学通报,2003,66(3):2132214.(下转第530页)994第5期刘翠格等:加碘酸钾食盐中碘含量的紫外分光光度法测定035河北师范大学学报(自然科学版)第27卷界的物种多样性和遗传多样性的基因库.因此,在白洋淀建立湿地自然保护区,实施保护措施,防止湿地生态环境的破坏和生态功能的退化,无论是从保护湿地生态系统的特殊性、典型性和生物多样性的稀有性上,还是淡水湖泊资源本身所具有的社会经济价值上衡量,都具有十分重要的保护地位.但是,由于保护不力,白洋淀生态环境退化日益严重,已经给淀周边地区的经济和社会发展造成了巨大损失,并制约了淀区社会经济的发展,阻碍了人民生活水平的迅速提高,影响了社会的可持续发展战略的实施.因此,建议尽快建立白洋淀湿地自然保护区,以便使白洋淀能够迅速得到切实、有效的保护.白洋淀湿地自然保护区建立以后,应以生态学、生态经济学和可持续发展理论为指导,以保护湿地资源、生态环境和生物多样性为中心,以确保自然资源永续利用和生态系统的良性循环为目标,严格保护白洋淀湿地生态系统,大力改善和建设湿地生态环境,加大科技投入,积极开展科学研究,科学合理地利用自然资源,实现湿地生态系统的良性循环,促进区域社会经济的持续、稳定、健康发展,把白洋淀湿地自然保护区建设成为集自然保护、科研、宣传教育、生态旅游等多种功能于一体的综合效益显著的湿地类型自然保护区.参考文献:[1] 安新县地方志办公室.白洋淀志[M].北京:新华出版社,1996.[2] 安新县地方志编纂委员会.安新县志[M].北京:新华出版社,2000.On Establishing the N ature Preserve of B aiyangdian EvergladeWEN Zhi2guang(College of Resource and Environment Sciences,Hebei Normal University,Hebei Shijiazhuang 050016,China) Abstract:Illuminates the necessary of the nature preserve of Baiyangdian everglade through analyzing the worthiness of the ecological protect,economic and social benefits,and illuminates the urgent character of establishing the nature preserve of Baiyangdian everglade though analyzing the existent problems in the ecological protect,finally,advises establishing the nature preserve of Baiyangdian everglade as soon as possible and puts forward instructional thought and developmental direction of the constructing the nature preserve of Baiyangdian everglade.K ey w ords:Baiyangdian everglade;marsh;ecology;nature preserve(责任编辑 蔡丹英)(上接第499页)Determination of Iodine in Edible Salt AddedPotassium Iodate by U ltraviolet SpectrophotometryL IU Cui2ge, MO Li2ping, WEI Y ong2ju(College of Chemistry,Hebei Normal Universit y,Hebei Shijiazhuang 050016,China)Abstract:According to the ultraviolet absorption spectra of iodine,iodide ion and triiodide ion,a method for determination of iodine in edible salt added potassium iodate was proposed.In the medium of HCl with p H2.4,0.01mol/L KI,1mol potassium iodate may be quantitatively converted into3mol I3-. By measuring the absorbance of I3-at288or350nm,quantity of iodine in edible salt can be calculated.A recovery percent of this method was found to be96.8%~102.6%.Two samples of edible salt purchased from market were analyzed.The results were satisfactory.K ey w ords:iodine;edible salt;ultraviolet spectrophotometry(责任编辑 邱 丽)。
碘的检测方法和注意事项分解

另外,呈碱性的样品应用酸调至中性后再行检验( 如:添加活性钙的钙强化营养盐)。
4
GB/T 13025.7-2012直接滴定法操作及注意 事项
原理
在酸性介质中,试样中的碘酸根离子氧化碘化 钾析出单质碘,用硫代硫酸钠标准滴定溶液滴 定,测定碘的含量。
计算
• X=V*C*21.15*1000/m
• X——样品中碘的含量,单位为毫克每公斤(mg/kg); • V——测定用样品消耗硫代硫酸钠标准滴定溶液的体积 ,单位为毫升(mL); • c——硫代硫酸钠标准滴定溶液实际浓度,单位为摩尔 每升(mol/L);
• m——样品质量,单位为克(g);
• 21.15——1/6I的摩尔质量
11
GB/T13025.7—2012的氧化还原滴定法用于特殊盐种中 碘的测定。比如:川盐(川盐中的碘仍以碘酸盐形式 存在)、强化其他营养素的盐(如加钙盐)、海藻 (螺旋藻)碘盐。
原理
a、大量钙离子存在时会有干扰 b、新买的次氯酸钠试剂有可能出现次氯酸钠过量,从而 引起惊人的正误差。 除此以外,在取样和称样时还要注意碘的游走性。
注意IO3- 离子在碘盐中的迁移对碘量检 测的影响
1.要消除或控制待检测的碘盐样品中 IO3- 离子迁移的影响。 2.检测取样及测定前要混匀样品。实验证明在非密封或包封不严密的情况 下,外界气湿条件的变化会引起容器(包装)内盐样中 IO3- 离子迁移而 改变其中碘含量的分布状况,因此在碘盐监测取样及测定前都应混匀样 品。 3.碘盐样品采样后检测前应密封包装,否则盐样受潮,不仅使检测的称样 重量误差,而且由于食盐吸湿,盐中水份明显附着于包装物内壁,其中 溶解有较大量碘酸盐,将使盐中碘量减低,这在采样量较小时更加明显。 4.不应在碘盐样品包装内投放纸片作标签或样品编号标记,也不应用纸质物 包装碘盐样品。若有纸片在碘盐样包装内或盐样与纸质物接触,由于纸 的吸水性会吸取盐中的水份,这可使 IO3- 离子迁移富集在纸片上,造成 盐中碘量的明显减低,测定结果相对于样品原来的碘浓度为负偏差
紫外分光光度法测定食盐中的碘含量

Cl,3.0 mL10 % NaCl溶液,再分别加入0,
0.5,1.0,2.0,3.0,4.0,5.0 mL 10.0 μ g / mL的KIO3标准使用液,用水冲至刻 度,摇匀。以空白溶液作为参比,分别在 最大吸收峰285nm和351nm 处测定吸光度值。 浓度为横坐标,对应的吸光度值为纵坐标, 绘制工作曲线或进行线性回归,求得线性
四.实验步骤
1.仪器与试剂
仪器:岛津UV-1700型分光光度计 KIO3标准溶液(储备液):1.0
mg / mL(以KIO3
计),使用时 稀释为10.0μ g / mL 的使用液。
KI溶液:0.05 HCl溶液:0.1 NaCl溶液:10
mol / L mol / L %
四.实验步骤
度,摇匀。分别在285nm和351nm 处测定吸光度值,记录实验数据。
五.数据处理
由线性回归方程求得含量或在工作曲线上查 得含量,计算食盐样品中的碘含量。
A 0.8 0.6 0.4 0.来自 0 0 0.5 u g/ml 1 1.5
y = 0.598x + 0.0836 R 2 = 0.9995
六.思考题
A=lg(I0/It)=kbc
吸光度 介质厚度(cm)
二.紫外分光光度法简介
2 、光学光谱区
远紫外
(真空紫外)
近紫外 可见
近红外
中红外
远红外
10nm~200nm 200nm ~380nm
380nm ~ 780nm
780 nm ~ 2.5 m
2.5 m ~ 50 m
50 m ~300 m
紫外分光光 度法工作区
2.实验流程
吸收曲线绘制
工作曲线绘制 样品测定 吸收曲线的绘制 取步骤[2]中任一标准溶液 在分光光度计上从250 nm 至
分光光度法测定食盐中的碘含量
111 剂 l o/ .. 试 ml L硫酸 ;苯 ;OgL碘 化钾 溶 lO/
液( 称取 5 . 碘 化钾 , 水溶 解并 稀释 至 50 l 0O g 用 0m , 贮于 棕色瓶 中 , 用时新 配 ) 碘酸 钾标准 溶液 ( 确 ; 准
称 取 132 于 10 R 烘 干至 恒重 的碘 酸钾 , . g 7 1 ±22 称 准 至 000 g加 水溶解 , 入 l0 m 容 量瓶 中 , . 1, 0 转 O0 l 稀 释至刻度 , 摇匀 , 然后 用水准 确稀释 5 倍 , 液每 0 此 毫升 含碘酸 钾 2 . g 每毫升 含碘离 子 50 ) 74 4 , . g 。 l 试剂均为分忻纯{剂。 式 本实验所用水为蒸锤 < } 。 1 .仪器 : .2 1 本岛津 u 一 10 v 20 紫外分光光度计 。
表 1 苯 萃取 液显 色稳定 时 间
放 置 时 间
( h)
O5 1 、 15 . 2 3
吸 光 度
02 5 .5
02 4 .2
02 5 .2
024 .2
023 2
1 . 标准 曲线的绘 制 :吸取碘酸钾标准应用液 .1 2
01 ,.,07 ,0 ml( 当 05 ,5 ,5 ,5 ,0 g ,. 3 5 ,01. 0 0. . 0 相 ,. 1. 2 . 3 . 5. 0 0 0 0 0
的相对标准偏 差结果见 表 2 碘 含量的相对 标准偏 , 差小于 5 表明本方法的精密度高 , %, 重现性较好 。
表 2 重现性 实 验结 果(= ) n 6
测 次 定数
均值 ( g ) a r /
1
2 49
} 2
碘的检测方法和注意事项

8.硫代硫酸钠标准溶液的滴入速度不宜过快,避免来不及 与碘作用的部分在酸性溶液中分解。若有分解其分解 物钠对标I准2有溶比液硫消代耗硫体酸积钠数更减高小的,滴样定品度碘,含将量造计成算硫结代果硫偏酸 低。(如果是硫代硫酸钠标定时滴入速度过快,则将 造成硫代硫酸钠标准溶液标定浓度计算结果偏高)
11
GB/T13025.7—2012的氧化还原滴定法用于特殊盐种中 碘的测定。比如:川盐(川盐中的碘仍以碘酸盐形式 存在)、强化其他营养素的盐(如加钙盐)、海藻 (螺旋藻)碘盐。
原理
a、大量钙离子存在时会有干扰 b、新买的次氯酸钠试剂有可能出现次氯酸钠过量,从而 引起惊人的正误差。
除此以外,在取样和称样时还要注意碘的游走性。
2.加1mol/L硫酸2mL 3.加10%KI5mL,溶液变为黄色 4,盖上瓶盖,置暗处5分钟 5.用0.002mol/L硫代硫酸钠滴定至浅黄色,加2mL淀
粉指示剂,继续滴定至颜色消失
计算
• X=V*C*21.15*1000/m
• X——样品中碘的含量,单位为毫克每公斤(mg/kg); • V——测定用样品消耗硫代硫酸钠标准滴定溶液的体积
3.5.2 碘标准中间溶液:吸取10.00mL碘标准储备溶液(3.5.1)置于 100mL容量瓶中,用水稀释至刻度,此溶液1mL含碘10g。储于具 塞严密的棕色瓶,置冰箱(4℃)内可保存1个月。
3.5.3 碘标准使用系列溶液(1) :临用时吸取碘标准中间溶液(3.5.2) 0,0.50,1.00,1.50,2.00,2.50,3.00mL分别置于100mL容量瓶中 ,用水稀释至刻度,此标准系列溶液的碘浓度分别为0,50,100 ,150,200,250,300g/L。
氨氮的测定,亚甲蓝分光光度法测定阴离子洗涤剂,微量液-液萃取气相色谱法监测水中的苯系物,食盐中微量碘的测

实验一氨氮的测定报告完成人:xxx同组实验者:xxx一.实验目的1.掌握絮凝沉淀法和蒸馏法进行水样预处理的操作和技能。
2.掌握用纳氏试剂比色法(传统法)测定氨氮的原理和技术。
二.实验原理碘化汞和碘化钾的碱性溶液与氨反应,生成淡红棕色胶态化合物,其颜色深浅与氨氮含量成正比,通常可在波长410-425nm范围内测其吸光度,计算其含量。
本法最低检出浓度为0..25mg/L,测定上限为2mg/L。
水样最适当的预处理后,本法可适当用于地面水、地下水、工业废水和生活污水中氨氮的测定。
三、实验仪器和试剂(一) 实验仪器1、氨氮蒸馏装置2、分光光度计3、PH计4、50mL比色管(二)实验试剂1、无氨水:每升蒸馏水中加0.1mL硫酸,在全玻璃蒸馏器中重蒸馏,弃去50mL初馏液,接取其余馏出液于具塞磨口的玻璃瓶中,密塞保存。
2、1mol/LHCL:量取43mL浓盐酸,用水稀释至500mL.3、1mol/L NaOH:将20g氢氧化钠溶于水并稀释至500mL4、轻质MgO:将MgO在500o C下加热,以除去碳酸盐5、0.05%溴百里酚蓝指示剂:称取0.05%溴百里酚蓝置玛瑙研钵内,研细,用新煮沸放冷的水稀释至100ml6、2%硼酸吸收液:称取20g硼酸溶于无氨水,稀释至1L7、10%ZnSO4:称取10gZnSO4溶于无氨水,稀释至100mL8、25%NaOH:称取25g氢氧化钠溶于无氨水,稀释至100mL,储存于聚乙烯瓶中。
9. 纳氏试剂:可选择下列方法之一制备:①称取碘化钾5g,溶于10mL无氨水中,边搅拌边分次少量加入二氯化汞(HgCl2)粉末2.5g,直至出现微量朱红色沉淀不易溶解时,充分搅拌混合,并改为滴加二氯化汞饱和溶液,当出现少量朱红色沉不再溶解时,停止滴加。
将上述溶液徐徐注入氢氧化钾溶液中(15g氢氧化钾溶于50mL无氨水中,冷却至是室温),以无氨水稀释至100mLl,混匀。
于暗处静置过夜,将上清液移入聚乙烯瓶中,密塞保存。
甲基紫显色光度法测定食盐中微量碘

文章编号:1000-7571(2002)04-0049-02甲基紫显色光度法测定食盐中微量碘黄典文3,陈敏慧(广东工业大学轻工化工学院,广东广州 510090)摘 要:研究了碘酸根与甲基紫的氧化显色反应,建立了光度法测定微量碘的新方法。
结果表明,在H 2SO 4-K Br 介质中,碘酸根与甲基紫反应生成红色氧化产物,其最大吸收波长为600nm ,表观摩尔吸光系数为3112×104。
碘浓度在0~50μg/25mL 范围遵守比尔定律。
本法用于测定加碘食盐中碘时,结果满意。
关键词:碘;甲基紫;显色反应;分光光度法中图分类号:O657132 文献标识码:B收稿日期:2001-07-31 碘是人体必须的微量元素之一。
光度法测定微量碘常用的方法有淀粉—碘蓝法、萃取光度法[1]和催化光度法[2]。
也有利用碘的变价性质进行碘的测定研究[3]。
利用IO -3的氧化性使甲基紫反应生成红色产物,进行光度法测定碘还未见报道。
本文对此进行研究,试验表明,在H 2SO 4-K Br 介质中,碘酸根与甲基紫反应生成的红色氧化产物与碘的存在量呈线性关系。
方法简单、快速、选择性好、准确度高,用于加碘食盐中碘的测定,结果满意。
1 实验部分111 仪器和试剂721型分光光度计(上海第三分析仪器厂)。
H 2SO 4溶液:015mol/L ;K Br 溶液:215%;甲基紫溶液:0105%;碘标准贮备溶液:1mg/mL ,称取011686g 碘酸钾(优级纯)于100mL 小烧杯中,用适量水溶解后,定容于100mL 容量瓶中,用时逐级稀至10μg/mL 为碘标准工作溶液。
112 实验方法准确移取含碘量为50μg 的碘标准工作溶液于25mL 比色管中,加入215mL H 2SO 4溶液,310mL K Br 溶液,310mL 甲基紫溶液,用水稀至刻度,混匀。
与此同时做试剂空白,一起于沸水浴中加热10min 后,流水迅速冷却。
以试剂空白为参比,用1cm 比色皿,于波长600nm 处测定其吸光度。
铬黑T氧化褪色光度法测定食盐中微量碘

179※分析检验食品科学2005, Vol. 26, No. 10铬黑T氧化褪色光度法测定食盐中微量碘徐茂蓉(盐城工学院化工系,江苏 盐城 224003)摘 要:本文研究了在硫酸介质中,碘酸根氧化铬黑T使其褪色的最佳条件,建立了测定微量碘的新方法。
通过实验,测得最大吸收波长为510nm,碘测定碘的线性范围为0~1.0mg/L。
本方法的相对标准偏差为0.24%~0.28%;回收率为98.7%~103.6%。
用于测定食盐中微量碘,结果令人满意。
关键词:铬黑T;碘;氧化褪色;分光光度法Spectrophotometric Determination of Iodine in the Salts by Oxidation-Decoloration of Eriochrome Black TXU Mao-rong(Department of Chemical Engineering, Yancheng Institute of Technology,Yancheng 224003,China)Abstract :A new method has been developed for determination of the trace iodine by oxidation-decoloration with Eriochromeblack T. The color system had a maximum absorption at 510nm in the medium of sulfuric acid. Beer’s law was obeyed in therange of 0~1.0mg/L of iodine. The relative standard deviation was in the range of 0.24%~0.28%. The recovery was 98.7%~103.6%. The method could be used for determination of the trace iodine in salts.Key words:eriochrome black T;iodine;oxidation-decoloration spectrophotometry中图分类号:O657.32 文章标识码:B 文章编号:1002-6630(2005)10-0179-02收稿日期:2004-03-10作者简介:徐茂蓉(1967-),女,硕士,主要从事分析化学教学与科研工作。
分光光度计测定食盐中的碘含量

不 完善 的情 况 , 还会 引发一 系列疾 病 。 要 想有 效防治碘 缺乏 病,
可 以在 日常生 活 中食 用加碘 盐 。现阶段 ,测 定分析 食盐碘 含量 准 确 性较 高的方 法有两 种 ,分别为 溴氧化 容量法 、溴酚法 ,除此 之 外 ,还有 四氯 化碳 比色法 、砷铈 催化 比色法 等 。而 双氧 水氧化 比 色 法存在 操作便 捷 、 选 择性 良好 的优 势 ,因此 , 本 文通 过该方 法, 分 析食盐碘 含量 。
用量 进 行 了最 优 值 明确 试验 。确保 本 次 实验 其 它条 件恒 定 , 以
0 . 1 m L为 间隔值 ,逐次增加 溶液 中 1 0 g / L淀粉 使用量 ,然后测 定 分析 溶液 的吸 光度 。通 过多 次试验 可知 ,淀粉 溶液使用 量越 多 ,
溶液 的吸光 度值越大 。当溶液 中 1 0 g / L淀粉 的使用量达 到 1 . 0 m L
2 . 4 最优显色时间
本次 实验过程 中 ,以 5分 钟为 间隔值 ,逐 次延 长显色时 间 , 测定 溶液 的吸 光度 。通过分 析实验 数据可 知 ,以双氧水 氧化 比色
( 1 0 0 g / m L ) 。其中碘化 钾溶液 的配 比过程 为:在容积 为 1 0 0 m L
的烧杯 中加入 0 . 1 g 碘 化钾 , 加入 三级 蒸馏水 , 对 其进行 充分溶 解, 然后, 将 溶解液注 入容积 为 1 L的棕色 容量瓶 内,以三 级蒸馏 水行
量普 遍较 少 ,以此 3 0 % 双氧 水进行 测定分 析 ,对 溶液 的需求量 较 少 ,不 易准确操 作 ,导致实验 结果 出现严 重偏 差,所 以,本次 实 验过 程中 ,氧 化剂为 3 % 双氧 水 。参考我 国食盐 碘含量 的规定标 准
食盐中碘含量的测定

食盐中碘含量的测定
食盐中碘含量的测定是指对食盐中碘的含量进行测定的方法。
一、原理:
碘在酸性溶液中发生氧化还原反应,当电位调节到特定pH值时,碘由高价态I3-变为低价态I2,然后与高效毒标剂(如固定甲酸铵)发生毒标反应,得到黄色棕褐色沉淀,其色度强度可以用分光光度计直接测定。
二、试剂:
(1) 碘标准溶液(1000μg/mL);
(2) 0.1mol/L稀硝酸溶液;
(3) 0.1mol/L硫酸溶液;
(4) 高效毒标剂0.05mol/L固定甲酸铵溶液;
(5) 尿素溶液;
三、实验步骤:
1.将1.00g食盐放入50mL烧杯中加入20mL水,搅拌;
2.加入10mL 0.1mol/L稀硝酸,煮沸15min;
3.加入10mL 0.1mol/L硫酸,煮沸15min;
4.冷却,稀释至100mL;
5.滴入尿素溶液调节pH至
6.5;
6.滴入0.05mol/L固定甲酸铵溶液至暗褐色沉淀,搅拌;
7.用分光光度计测定其色度强度;
8.以碘标准溶液调校,计算结果。
双光束流动注射分光光度法测定食盐中的碘含量

双 光 束 流 动 注射 分 光 光度 法 测 定 食 盐 中 的碘 含 量
赵 珍 义 韩 光 喜 徐 锐 张 蕊 宋 溪 明
( 宁 大 学 化 学 院 , 阳 , 10 6 辽 沈 10 3 )
Yan . La gW b Roh is & A u o ,2 0, 1 otc tm 00 2:7 6
2 Hu n Ya f ,Z o in u n a nu h u Ja g a g,Pe g Z n h i n e g u ,Ca n o Ya —
b o,Yu Ai n, Z a g mi h n Ha q ,Jn Qih n J n i i n a . An l a At
s e to ty Li n n ( v r n na o eto r a p cr mer . Xi xi En io me t l Pr tcin Bu e u,Qi g u n,1 3 0 ) ny a 1 3 0
Fi e e e e t Si v lm n s( ,M g,Ca,Sr a d K )i ou n fmi r lwa e r e e mi d by mir wa e n n f r ki ds o ne a t r we e d t r ne c o v
a a a e f hi a l ia p e dv nt g s 0 gh naytc ls e d. a c r c nd pr cson The r c v re fii . e o e i s O t nd r d ton f fv
Spe r m , 2 0, 1 cto 00 5: 1 9 40
催化动力学分光光度法测定生物样品中的碘

1 引言碘广泛分布于自然界,岩石、土壤、水、空气中都含有微量的碘。
食物中碘主要来源于土壤和水中,以海产品如海带、紫菜、贝类、海鱼等含碘最高;其次为蛋、乳、肉类;粮食、蔬菜、水果中含量最低。
人体碘的来源主要有3个方面:80%-90%来自食物;10%-20%来自饮水;仅5%左右来自空气。
随着营养水平的提高,人们对高碘的危害越来越关心和重视。
因此,测定食品中的碘很有必要。
目前,食品中碘的测定方法主要有:电感耦合等离子质谱法、分光光度分析方法、催化动力学分光光度法、极谱分析方法等。
由于催化动力学分光光度法有比较经济、易于推广、精密度好、准确度高等优点,因此选择催化动力学分光光度法对生物样品中的碘进行测定。
2 实验部分2.1 仪器与主要试剂1)TU-900 双光束紫外可见分光光度计。
2)碳酸钠—氧化锌(3:2)混合试剂:分别称取300g无水碳酸钠和200g氧化锌于研钵中研碎,混匀,装瓶中待用。
3)碳酸钠溶液(36g/L):称取36.0g无水碳酸钠(优级纯)于1.0L塑料瓶中,加蒸馏水待全部溶解后稀释至刻度,摇匀备用。
4)醋酸溶液(8+92):80mL冰醋酸(优级纯)(ω(HAc)=99.9%)于1000mL容量瓶中,蒸馏水稀释至刻度,摇匀备用。
5)氯胺T溶液(1.0 g/L):称取1.0g氯胺T于烧杯中,加蒸馏水溶解后,转移至1.0L容量瓶中,蒸馏水稀释至刻度,摇匀备用(现用现配)。
6)四碱(4,4'-四甲基二氨基苯甲烷)溶液(ρ(四碱)=0.1g/L):称取0.1g四碱于50mL烧杯中,加1mL冰醋酸,待全部溶解后,转移至1.0L容量瓶中,蒸馏水稀释至刻度,摇匀备用。
7)碘标准溶液Ⅰ(ρ(Ⅰ)=10ug/mL):称取经105°烘过的碘化钾(高纯试剂)0.01308g于50mL烧杯中,加水溶解后,移入1000mL容量瓶中,蒸馏水定容,摇匀备用。
8)碘标准溶液Ⅱ(ρ(Ⅰ)=0.04ug/mL):移取4mL碘标液Ⅰ(ρ(Ⅰ)=10ug/mL)于1000mL容量瓶中,蒸馏水定容至刻度,摇匀备用。
催化分光光度法测定水中微量碘的方法优化

第42卷第11期贾亮亮等:催化分光光度法测定水中微量碘的方法优化1341 DOI: 10.13822/ki.hxsj.2020007706 化学试剂,2020,42( 11 ),1341 〜1344催化分光光度法测定水中微量碘的方法优化贾亮亮*,尹红云(河北省水文工程地质勘查院,河北石家庄050021)摘要:旨在优化以催化分光光度法定量分析水体中微量碘的分析体系。
在醋酸盐缓冲溶液体系中,碘催化4,4'-四甲基二氨基-二苯基甲烷与氯胺T发生氧化反应,生成蓝色配合物,通过测试该配合物的吸光度可定量分析水体中的碘。
优 化了分析体系中的测定波长、缓冲溶液的用量、显色剂的用量、氯胺T的浓度等实验条件。
在优化的实验条件下,分光光度法的微量碘测定结果的相对标准偏差为2. 1%,检出限为0. 1p g/L。
方法选择性好、操作简便、成本低、灵敏度高,满足 水文地质工作对水中微量碘含量普査的要求。
关键词:催化分光光度法;水;方法优化;微量碘;4,4'-四甲基二氨基-二苯基甲烷;氯胺T中图分类号:0657.32 文献标识码:A文章编号:0258-3283(2020) 11 -1341 -04Optimization of Catalytic Spectrophotometry for the Determination of Trace Iodine in Water JIA Liang-liang*,YIN Hong~yun(T h e Institute of Hydrology and Engineering Geological Prospecting H e b e i Province, Shijiazhuang 050021 , C h i n a), H u a x u e Shiji,2020,42(11) ,1341 ~1344Abstract:T o optimize the analytical system for the quantitative analysis of trace iodine in water by catalytic spectrophotometry,in the acetate buffer solution system ,4^^-tetramethyldiamino diphenylmethane a n d chloramine T reacted to form blue c o m p l e x,a n d iodine in water can be quantitatively analyzed by measuring the absorbance of the c o m p l e x.T h e experimental conditions were optimized, such as the m e a s u r e d wavel e n g t h,the a m o u n t of buffer solution, the a m o u n t of developer a n d the concentration of chloramines T.U n d e r the best experimental conditions,the trace iodine in water w a s determined by spectrophotometry.The relative stand- ard deviation w a s 2. I % ,and the detection limit w a s 0. 1jxg/L.The results s h o w e d that the m e t h o d had the advantages of good selectivity,simple operation,low cost a n d high sensitivity.lt m e t the requirements of hydrogeological w ork for general survey of trace iodine content in water.Key words:catalytic spectrophotometry;water;method optimization;trace iodine;4^^-tetramethyldiamino d i p h e n y l m e t h a n e;chloramine T碘是人体的必需微量元素之一,与人类健康有密切关系,在国防、化工、医药卫生、食品等领域有着不可替代的地位n_4]。
X射线荧光光谱法检测食盐碘含量在线系统设计

X射线荧光光谱法检测食盐碘含量在线系统设计伍乾永;杨平先;唐杰【摘要】The X-ray fluorescent spectrum analysis method(XRF)is used to detect the content of iodium in the salt online. The current correspond to the intensity of the characteristic diagram would convert to the electric signal with the linear relation to the iodium mass ratio in the computer. The signal would be compared with the standard signal stored in the computer , then the error signal will adjust the electromagnetic valve that controls the mass ratio of iodium liquid as the controlling. The iodium content in the salt will be kept in the standard range. The closed-loop controlling of the iodium content in the salt producing will be realized in the end.%采用X射线荧光光谱分析法(XRF)在线检测加碘食盐中的碘含量,将其特征谱线强度对应的电流转换成与碘含量成线性关系的数字电信号送入计算机,该信号与预先存入计算机的标准信号比较,产生的误差信号作为控制量对添加碘液的电磁阀进行调节,使食盐中的碘含量始终保持在规定范围之内.从真正意义上实现食盐生产中的碘含量的闭环控制.【期刊名称】《实验技术与管理》【年(卷),期】2012(029)009【总页数】3页(P33-35)【关键词】食盐;碘含量测定;X荧光光谱法【作者】伍乾永;杨平先;唐杰【作者单位】四川理工学院自动化与电子信息学院,四川自贡643000;四川理工学院自动化与电子信息学院,四川自贡643000;四川理工学院材料与化学工程学院,四川自贡643000【正文语种】中文【中图分类】TS207.3Abstract:The X-ray fluorescent spectrum analysis method(XRF)is usedto detect the content of iodium in the salt online.The current correspondto the intensity of the characteristic diagram would convert to the electric signal with the linear relation to the iodium mass ratio in the computer.The signal would be compared with the standard signal stored in the computer,then the error signal will adjust the electromagnetic valve that controls the mass ratio of iodium liquid as the controlling.The iodium content in thesalt will be kept in the standard range.The closed-loop controlling of the iodium content in the salt producing will be realized in the end.Key words:salt;detection of iodium content;X-ray fluorescent spectrum 食盐中碘的含量直接影响食盐的质量和人类的健康。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
食盐中碘含量的光度分析法测定李继胜,朱自强,彭 滨 摘要: 目的 用较简单的方法测定食盐中碘的含量。
方法 试用分光光度法(波长为590nm)测定食盐中碘的含量。
结果 在30m in内测定其吸光度,碘浓度在0.3~1.6L g/ml范围内呈线性,碘标准曲线的相关系数r=0.992; 5次精密度测定标准偏差RSD s=0.425%;加标试验平均回收率=100.4%。
结论 试验表明:分光光度法测定食盐中微量碘酸钾含量的方法简单、快速,有较高的灵敏度和较好的准确性。
关键词: 碘酸钾;分光光度法;食盐 中图分类号:O657.3 文献标识码:ASpectrophotometer Determination Of Micro Amounts of Potassium Iodate in Edible Salt Li Jisheng,Zhu Ziqiang,Peng Bin (Dept.o f Chemistry,Wuyi University,Jiangmen529020,China) Abstract: Obj ective A m ethod for the determinati on of m icro amounts of potassium iodate in iodized salt by spec-trophotom eter was reported in this paper. Result The l inear range of the method was0.3~1.6L g/ml and r=0.992 ,the average recovery was100.4%,the RSDs were0.425%(n=5). Conclusion The method is pr oved to be sim-pl e,rapid and reliable with hi gher sensiti vity and better accuracy,and has been used for determination of potassium io-date in edible salt wi th satisfactory results. Key words: Potassium iodate;Spectrophotometer;Edible sal t 食盐加碘是防治碘缺乏病的根本措施,食盐的含碘量一般采用直接滴定方法检测。
滴定法较准确,但较麻烦;一般来说分光光度法较方便,耗费试剂较少。
因此,遂探索用分光光度法测定加碘酸钾食盐中碘的含量,现将结果报告如下。
1 材料与方法1.1 材料 KIO3标准原液(含碘1m g/m l):准确称取AR KIO31.6864g,用无碘水溶解于1000ml棕色容量瓶中,定容,摇匀,储藏于暗处备用。
KIO3中间液(含碘10L g/ml):精确吸取5.00ml KIO3标准原液于500ml棕色容量瓶中,加无碘水定容,制成含碘10 L g/m l KIO3中间液,现配现用。
KI溶液(含碘0.4mg/ ml):称取A R KI0.50g,用无碘水溶解于1000m l 棕色容量瓶中定容,在冰箱中保存。
淀粉指示剂(1%):称取1.00g可溶性淀粉于小烧杯中,加无碘水调成稀糊状,在不断搅拌下倒入盛有100ml无碘沸水的烧杯中,搅拌,继续煮沸至透明,冷却至室温,现配现用。
H2SO4 (3mol/L)1.2 方法1.2.1 试验原理 碘酸钾为氧化剂,在酸性条件下,作者单位:五邑大学化工系(中国广东 江门 529020)作者简介:李继胜(1945-),男,广东省龙川县人,高级工程师,主要从事化工实验教学和食品化工技术开发工作。
易被还原生成碘,遇淀粉显蓝色。
用分光光度计测定其颜色深浅。
反应方程式[1]为:KIO3+5KI+6H2SO4=6KHSO4+3I2+3H2O 1.2.2 标准工作曲线的绘制 分别准确吸取KIO3中间液0.50、1.00、2.00、3.00、4.00、5.00ml(相当于5、10、20、30、40、50L g碘)于6支25ml比色管中,各加入KI溶液1.00ml,淀粉指示剂1.00ml,摇匀,再加5滴H2SO4,补充无碘水,定容至25.00ml,摇匀,溶液显蓝色。
用试剂空白为参比,用722型分光光度计,1.0cm比色皿,波长590nm,室温下30m in内测定其吸光度(ABS)值,绘制标准工作曲线。
1.2.3 样品测定 准确称取加碘酸钾的食盐10.000 g,用无碘水溶解、稀释,定容至100.00m l。
精确吸取样品10.00m l于25ml比色管中,以下按1.2.2方法测定。
2 结果2.1 最大吸光度的确定 在25ml比色管加入3.00 ml含碘10ug/m l KIO3中间液作为样品,其余按试验方法在620~550nm波长范围内测定其吸光度,结果表明:波长590nm时吸光度最大。
2.2 测定市售加碘海精盐样品含碘量的精密度试验 在相同条件下,用本试验方法对市售加碘海精盐样有机磷农药中毒对小鼠糖代谢影响的实验研究何军山1,卢新华1,曹慧芳2,李 军1,周志雄3 摘要: 目的 探讨有机磷农药对正常小鼠血糖、肝糖元、肌糖元的影响。
方法 用灌胃法对小鼠进行急性染毒后,测定小鼠血糖、肝糖元、肌糖元的含量。
结果 测定组与对照组比较,小鼠血糖明显增高,肝糖元、肌糖元明显减少。
结论 经有机磷农药染毒后的小鼠血糖明显增高,肝糖元、肌糖元明显减少。
关键词: 有机磷农药;血糖;糖元 中图分类号:R996 文献标识码:AExperimental Research on Eff ects of Organophorous Pesticide Poisoning to Rat's Glycometabolism He Junshan1,Lu Xinghua1,Cao Huif ang2,et al. (Medical School of Chenzhou City,H unan Province,Chenzhou423000) Abstract: Objective To explore the effects of organophorous pesticide on rat's blood sugar,hepatic glycogen and muscle glycogen. Methods The rats'content of bl ood sugar,hepatic glycogen and muscle glycogen were m easured af-ter they were poisoned acutely through douche. Result Comparing wi th the control group,the content of rat's blood sugar in the measurem ent group increased significantl y,and hepatic glycogen and m uscle glycogen l ower ed signi fi caltly. Conclusion The rat's content of blood sugar incr eases signi ficantly,and hepatic glycogen and muscl e glycogen lower signi ficantly after organophor ous pesticide poisoni ng. Key words: Organophor ous pestici de;Blood sugar;Glycogen 有机磷农药是我国目前生产和使用最多的农药,也是引起急性中毒和致死的主要农药。
有机磷农药对作者单位:1郴州医学高等专科学校(中国湖南 郴州 423000); 2郴州市疾病预防控制中心; 3郴州医专附属医院作者简介:何军山(1964-),男,湖南郴州市人,学士,实验师,主要从事预防医学教学及科研工作。
机体影响的研究目前较多集中在其一般性毒性、神经毒性、致畸、致癌、致突变效应,而对血糖、肝糖元、肌糖元的实验研究未见报道。
为了进一步探讨有机磷农药的毒性作用,为有机磷农药中毒的诊断、治疗提供参考依据,遂对其进行了必要的实验研究。
品重复测定5次。
含碘量平均值=27.08(mg/kg);标准偏差RSD=0.425%2.3 测定市售加碘海精盐样品含碘量的准确度试验 在3支25ml比色管中,准确吸取市售加碘海精盐样品溶液5.00ml,并分别加入0.50、1.00、1.50m l KIO3(10L g/ml)中间液,其余按试验方法进行,结果见表1。
表1 加标回收试验结果123本底值(L g)13.5413.5413.54加入量(L g) 5.0010.0015.00测得量(L g)18.6123.6028.40回收率(%)101.4100.699.1 注:平均加标回收率=100.4%2.4 对本分析方法的显著性检验 根据测定结果,采用t-检验法检验[3]分光光度法n1=5,测得样品平均值x1=27.08R1 =0.346直接滴定法n2=5,测得样品平均值x2=27.22R2 =0.286设显著性水平A=0.05,查表n=5,K(n,A)= 3.56,两种方法差别无显著性。
3 讨论本测定方法与其它测定方法[2]相比较,本法不用有毒有机溶剂,也无须萃取操作,基本无三废,测定方法简便,仪器要求不高,测定结果与直接滴定法相差不大,适合于一般化验室对食盐中碘酸钾的分析测定。
[参考文献][1]陈寿椿.重要无机化学反应[M].上海:上海科学技术出版社,1982.1119.[2]黄会秋.气相色谱法测定加碘食盐中的碘[J].食品科学,2002,23(1):122~123.[3]冯亚云.化工基础实验[M].北京:化工出版社,2000.24.(收稿日期:2002-10-23)。
