高中化学推断题组卷
完整word版,高一必修一化学期末推断题专练

專題推斷題解題技巧推斷題解題技巧:看其顏色,觀其狀態,察其變化。
1. 常見物質の顏色:多數氣體為無色,多數固體化合物為白色,多數溶液為無色。
2. 一些特殊物質の顏色:黑色:MnO2、CuO、Fe3O4、C、FeS(硫化亞鐵)藍色:CuSO4•5H2O、Cu(OH)2、含Cu2+ 溶液、液態固態O2(淡藍色)紅色:Cu(亮紅色)、Fe2O3(紅棕色)、紅磷(暗紅色)黃色:硫磺(單質S)、含Fe3+の溶液(棕黃色)綠色:FeSO4•7H2O、含Fe2+の溶液(淺綠色)、堿式碳酸銅[Cu2(OH)2CO3]紫黑色:KMnO4無色氣體:N2、CO2、CO、O2、H2、CH4有色氣體:Cl2(黃綠色)、NO2(紅棕色)有刺激性氣味の氣體:NH3(此氣體可使濕潤pH試紙變藍色)、SO2、HCl有臭雞蛋氣味:H2S產生酸霧:HCl、HNO33. 常見一些變化の判斷:①白色沉澱且不溶於稀硝酸或酸の物質有:BaSO4、AgCl(就這兩種物質)②藍色沉澱:Cu(OH)2、CuCO3③紅褐色沉澱:Fe(OH)3Fe(OH)2為白色絮狀沉澱,在空氣中很快變成灰綠色沉澱,再變成Fe(OH)3紅褐色沉澱④沉澱能溶於酸並且有氣體(CO2)放出の:不溶の碳酸鹽。
例如CaCO3⑤沉澱能溶於酸但沒氣體放出の:不溶の堿。
例如Cu(OH)24. 燃燒時の主要現象①在氧氣中:硫——藍紫色火焰;鐵——火星四射;木炭——發白光。
②在空氣中:鎂帶——耀眼の白光;紅磷——“白煙”;硫、氫氣——淡藍色火焰;CO、CH4——藍色火焰5、酸和對應の酸性氧化物の聯繫:①酸性氧化物和酸都可跟堿反應生成鹽和水:CO2 + 2NaOH = Na2CO3 + H2O(H2CO3 + 2NaOH = Na2CO3 + 2H2O)SO2 + 2KOH = K2SO3 + H2OH2SO3 + 2KOH = K2SO3 + 2H2OSO3 + 2NaOH = Na2SO4 + H2OH2SO4 + 2NaOH = Na2SO4 + 2H2O②酸性氧化物跟水反應生成對應の酸:(各元素の化合價不變)CO2 + H2O = H2CO3 SO2 + H2O = H2SO3SO3 + H2O = H2SO4 N2O5 + H2O = 2HNO3(說明這些酸性氧化物氣體都能使濕潤pH試紙變紅色)6. 堿和對應の鹼性氧化物の聯繫:①鹼性氧化物和堿都可跟酸反應生成鹽和水:CuO + 2HCl = CuCl2 + H2OCu(OH)2 + 2HCl = CuCl2 + 2H2OCaO + 2HCl = CaCl2 + H2OCa(OH)2 + 2HCl = CaCl2 + 2H2O②鹼性氧化物跟水反應生成對應の堿:(生成の堿一定是可溶於水,否則不能發生此反應)K2O + H2O = 2KOH Na2O +H2O = 2NaOHBaO + H2O = Ba(OH)2 CaO + H2O = Ca(OH)2③不溶性堿加熱會分解出對應の氧化物和水:Mg(OH)2 MgO + H2O Cu(OH)2 CuO + H2O2Fe(OH)3 Fe2O3 + 3H2O 2Al(OH)3 Al2O3 + 3H2O1 某實驗室の廢液中,可能含有氯化鐵、氯化鈉、硫酸鈉、鹽酸、氫氧化鈉、硝酸鋇中の一種或幾種。
高中化学经典推断题word版本

高中化学经典推断题一1、常温下,A 是双原子分子气态单质,其密度为3.17g/L (标准标况下),B 、C 、D 都是含A 元素的化合物,转化关系如下图所示(1)分别写出A 、B 、C 、D 的化学式:A B C D (2) 试写出有关化学方程式:A →B D →A 。
2、沈括《梦溪笔谈》中提到信州(今江西省)铅山县有一苦泉,将苦泉水煎熬,得到一种蓝色晶体.此晶体常用作游泳池或浴池杀菌消毒剂.试回答: ①此晶体的化学式为_________________;②煎熬苦泉水的铁锅用久了就会在其表面析出一层红色物质,其原因为(用化学方程式表示)___________________________________________。
3、现有金属单质A 、B 和气体甲、乙、丙及物质C 、D 、E 、F 它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:⑴写出下列物质的化学式:A 、 丙 ⑵写出下列反应化学方程式:反应① 反应⑤4、A 、B 、C 、D 、E 、F 六种物质的转化关系如图所示(反应条件和部分产物未标出)(1)若A 为短周期金属单质,D 为短周期非金属单质,且所含元素的原子序数A 是D 的2倍,所含元素的原子最外层电子数D 是A 的2倍,F 的浓溶液与A 、D 反应都有红棕色气体生成,则A 的原子结构示意图为__________,反应④的化学方程式为____________________.(2)若A 为常见的金属单质,D 、F 是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是____________________,已知常温下1g D 与F 反应生成B(气态)时放出92.3kJ 热量,写出反应的热化学方程式____________________.(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为____________________,B固体属于__________晶体.5.短周期常见元素形成的纯净物A、B、C、D、E的转化关系如下图所示,物质A与物质B之间的反应不在溶液中进行(E可能..与A、B两种物质中的某种相同)。
高考化学推断题专题复习训练题及答案

高考化学推断题专题复习训练题及答案推断题专项练习1.(9分)A+BX+Y+H2O(未配平,反响条件略去)是中学罕见反响的化学方程式,其中A、B的物质的量之比为1:4。
请回答:(1)假定Y是黄绿色气体,那么Y的电子式是,该反响的化学方程式是:。
(2)假定A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,那么反响中氧化剂与恢复剂的物质的量之比是。
(3)假定A为金属单质,常温下A在B的浓溶液中钝化,且A 可溶于X溶液中①A元素在周期表中的位置是 (填所在周期和族);Y的化学式是。
②含a mol X的溶液溶解了一定量A后,假定溶液中两种金属阳离子的物质的量恰恰相等,那么被恢复的X是 mol。
(4)假定A、B、X、Y均为化合物。
A溶于水电离出的阳离子和水作用的生成物可污染水,向A溶液中参与硝酸酸化的AgNO3溶液,发生白色沉淀;B的焰色为黄色。
那么A与B按物质的量之比1:4恰恰反响后,溶液中离子浓度从大到小的顺序是。
2.(山东济南高三质检)(11分 )A、B、C、D、E五种短周期元素(A、B、C、D、E区分代表元素符号),它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最低价氧化物对应的水化物与其氢化物反响生成一种盐X;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的=3/4倍;C与E同主族。
请回答以下效果:(1) X的化学式为______,D的原子结构表示图为______。
(2) 元素的非金属性C______E(填、或=),以下各项中,能说明这一结论的理想有______(填序号)。
① 氢化物H2E的酸性比H2C强② 氢化物H2C的热动摇性比H2E强③ 氢化物H2E的水溶液放置在空气中会变混浊(3) 将由BC和BC2组成的混合气体通入以下图所示装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强。
(ⅰ) 浓硝酸能将气体BC氧化成BC2,而稀硝酸不能氧化BC。
高中化学推断题100题
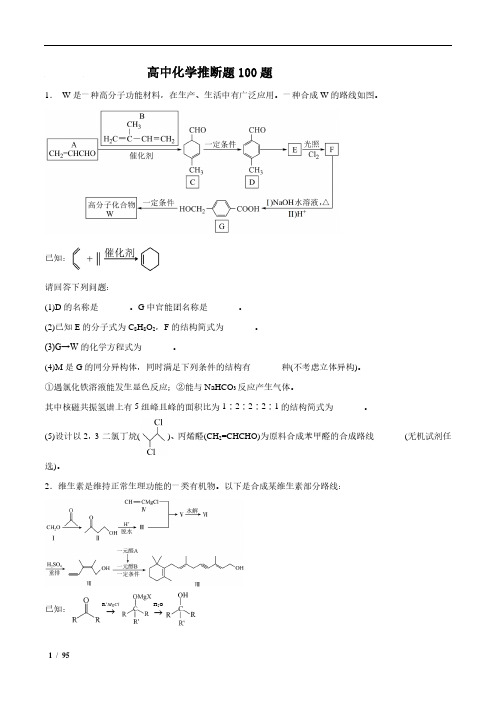
高中化学推断题100题1. W 是一种高分子功能材料,在生产、生活中有广泛应用。
一种合成W 的路线如图。
已知:请回答下列问题:(1)D 的名称是_______。
G 中官能团名称是_______。
(2)已知E 的分子式为C 8H 8O 2,F 的结构简式为_______。
(3)G→W 的化学方程式为_______。
(4)M 是G 的同分异构体,同时满足下列条件的结构有_______种(不考虑立体异构)。
①遇氯化铁溶液能发生显色反应;②能与NaHCO 3反应产生气体。
其中核磁共振氢谱上有5组峰且峰的面积比为1∶2∶2∶2∶1的结构简式为_______。
(5)设计以2,3-二氯丁烷()、丙烯醛(CH 2=CHCHO)为原料合成苯甲醛的合成路线_______(无机试剂任选)。
2.维生素是维持正常生理功能的一类有机物。
以下是合成某维生素部分路线:已知:R MgCl'→2H O→(1)化合物Ⅶ的分子式为________,该分子中处在同一平面的碳原子数为________。
(2)分析一元醛A 的结构特征,预测其可能的化学性质,完成下表 序号 结构特征 反应的试剂 反应形成的新结构 反应类型① -CHO Ag(NH 3)2OH _____ _____ ②_____________________(3)写出由化合物Ⅲ和Ⅳ反应生成化合物V 的方程式:________。
(4)化合物Ⅱ的同分异构体中能发生银镜反应但不能发生水解反应的共________种,其中核磁共振氢谱有3组峰,且峰面积比为6:1:1的同分异构结构简式为________。
(5)聚苯乙烯树脂是一种良好的保温材料,请以苯甲醛为原料,设计路线合成其单体苯乙烯____,其他试剂任选。
3.化合物H 是用于合成某种镇痛药的医药中间体,利用烃A 合成H 的某路线如下图所示:已知:Fe/HCl22R NO R NH ⎯−−⎯⎯→ 回答下列问题:(1)A 的化学名称为___________;D 中的官能团名称为___________。
高一化学推断题含答案(已整理分类,独一无二版本)

(一)元素推断题1、周期表前20号元素中,它们形成离子化合物时,原子数之比为1﹕2,且阴阳离子的电子层结构相同。
写出这些化合物的化学式__________________________________________ 。
2、A 、B 两元素,A 的原子序数为X,A 、B 所在周期的元素种类分别为m 和n ,若A 和B 同主族,当B 在A 的上一周期时,B的原子序数为__________________。
B 在A 的下一周期时,B 的原子序数为_____________。
3、A 、B 、C 、D 为短周期元素,A 和B 同周期相邻,A 和C 同主族相邻,ABC 三种元素的原子序数之和为31,D 元素与ABC 既不同周期又不同主族,请回答:(1)元素符号 A ________B _________C_________D____________ . (2)A 、B 、D 组成为D 4B 2A 3的离子化合物,其水溶液的PH 值小于7的原因是(3)比较B 、D 形成的化合物与A 、D 形成的阴离子结合质子能力强弱_______. 请用方程式表示_____________________________________________________________(4)用电子式表示D 2A 形成过程___________________________________________。
4.有A 、B 、C 、D 四种短周期的非金属元素(其单质也可分别用A 、B 、C 、D 表示),四种元素的原子序数按B 、D 、C 、A 顺序增大,D 、C 元素在周期表中位置相邻。
在一定条件下,B 可以分别和A 、C 、D 化合生成甲、乙、丙化合物,C 和D 化合可得丁。
已知乙、丙两个分子中各含有10个电子,并且甲、乙、丙、丁、戊有如下的变化关系:请填写下列空格:(1)甲的浓溶液与一种黑色粉末共热可得A ,则甲为_______,乙为___________。
高一化学必修1推断题专题题库(含答案)

高一化学必修1推断题专题题库1、A、B、C、D、E代表单质或化合物,它们之间的相互转化关系如下图所示。
A为地壳中含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似。
(1)A的化学式为,最高化合价为。
(2)B和碳反应生成A和E的化学方程式为。
(3)C的化学式为,D的化学式为。
2、下面框图中各单质和化合物间有以下转化关系,且组成各单质和化合物的元素为核电荷数是1~18的元素。
请根据框图关系判断。
(1)单质A是,单质B一定是(填“金属”或“非金属”)(2)各化合物的化学式为:甲,乙,丙,丁。
3、A、B是两种有刺激性气味气体。
试根据下列实验事实填空。
(1)写出A~F各物质的化学式:A ,B ,C ,D ,E ,F 。
(2)写出A、B跟水反应的离子方程式。
4、下图中每一方格表示的有关的一种反应物和生成物。
己知B是一种单质,其余物质都是含有B元素的化合物;C是一种钠盐;E是C对应的酸;B和D的晶体都是高熔点、坚硬的固体,且D为B的氧化物(其它不含B 元素的反应物及各步添加的必要试剂和反应条件均己略去)。
(1)写出A、D、E的化学式:A ;D ;E 。
(2)在工业上,用碳在高温下还原D的方法可制得含少量杂质的B,其化学反应方程式为;A和B的互变在工业上的实际意义是。
(3)写出D→C反应的离子方程式。
5、下图A、B、C、D、E、F六种物质中除D为单质外其余均是常见的化合物,E和F的水溶液均呈碱性,它们的转化关系如下图所示。
请回答下列问题:(1)A、B、D的化学式A ,B ,D 。
(2)E和F可相互转化,图中己标明F向E转化的关系,写出E转化为F的化学方程式6、室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下图所示进行反应,又知E溶液是无色的。
请回答:(1)A是,B是,C是。
(2)反应①的化学方程式。
(3)反应③的化学方程式。
(4)反应④的化学方程式。
7、下列物质之间能够发生如下图所示的化学反应。
高中化学推断题专项练习题(含答案)
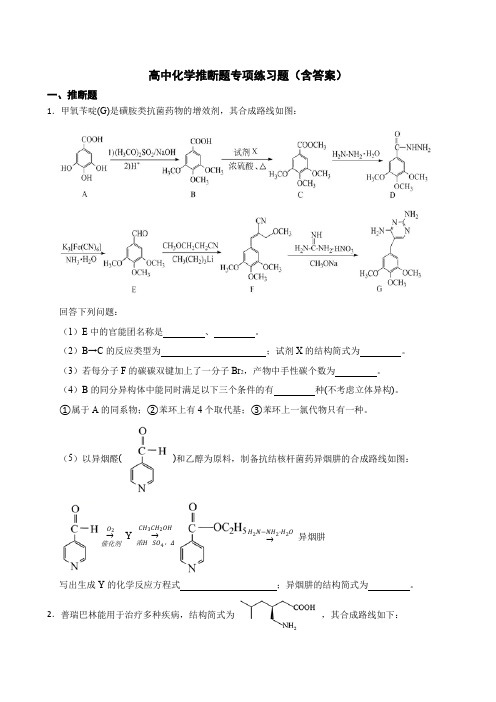
高中化学推断题专项练习题(含答案)一、推断题1.甲氧苄啶(G)是磺胺类抗菌药物的增效剂,其合成路线如图:回答下列问题:(1)E 中的官能团名称是 、 。
(2)B→C 的反应类型为 ;试剂X 的结构简式为 。
(3)若每分子F 的碳碳双键加上了一分子Br 2,产物中手性碳个数为 。
(4)B 的同分异构体中能同时满足以下三个条件的有 种(不考虑立体异构)。
①属于A 的同系物;②苯环上有4个取代基;③苯环上一氯代物只有一种。
(5)以异烟醛( )和乙醇为原料,制备抗结核杆菌药异烟肼的合成路线如图:→催化剂O 2Y →浓H SO 4,ΔCH 3CH 2OH →H 2N−NH 2·H 2O 异烟肼写出生成Y 的化学反应方程式 ;异烟肼的结构简式为 。
2.普瑞巴林能用于治疗多种疾病,结构简式为 ,其合成路线如下:(1)普瑞巴林分子所含官能团的名称为。
(2)化合物A的命名为。
(3)B→C的有机反应类型为。
(4)写出D→E的化学反应方程式。
(5)E~G中,含手性碳原子的化合物有(填字母)。
(6)E→F反应所用的化合物X的分子式为C5H10O,该化合物能发生银镜反应,写出其结构简式,化合物X的含有碳氧双键( )的同分异构体(不包括X、不考虑立体异构)数目为,其中核磁共振氢谱中有两组峰的为(写结构简式)。
(7)参考以上合成路线及反应条件,以和必要的无机试剂为原料,合成,在方框中写出路线流程图。
3.中华裸蒴中含有一种具有杀菌活性的化合物J,其合成路线如下:已知:回答下列问题:(1)D中含氧官能团的名称为;J的分子式为。
(2)A的两种同分异构体结构分别为和,其熔点M N(填“高于”或“低于”)。
(3)由A生成B的化学方程式为。
(4)由B生成C的反应类型为。
(5)G的结构简式为。
(6)F的同分异构体中,含有苯环、−NH2,且能发生银镜反应的有种;其中核磁共振氢谱峰面积之比为2∶2∶2∶2∶1的同分异构体的结构简式为。
高一化学推断题专项训练(附答案)

高一化学推断题专项训练一、推断题1.X、Y、D、E、F……都是中学化学中的常见物质,已知Y是单质,X是化合物,溶液E中滴入KSCN 溶液呈红色。
这些物质间的相互关系如框图所示,根据框图及提示的信息回答下列问题:1.Y和X的浓溶液反应的条件是___________,若无该条件,反应将很难进行,其原因是______________________。
2.写出F→G+X的离子方程式________________________。
3.L转化为I的化学方程式是_________________________。
4.在试管中制备L,为了能观察到L的颜色,需要进行特殊的操作,该特殊的操作是____________________________。
5.将Cu放入0.1mol·L-1 Fe(NO3)3溶液中,反应一段时间后取出铜片,溶液中c(Fe3+):c(Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比为________。
2.已知X、Y为有刺激性气味的气体,有以下转化关系,部分产物未标出。
试回答:1.写出下列物质的化学式X________、Y________、A________、B________、C________。
2.反应①的化学方程式为__________,反应②的离子方程式为__________。
3、下图表示几种物质间的转化关系(部分物质已略去),其中A、C为无色气体。
1.化合物W可能是或,C是,F是。
2.反应①中若消耗7.8gNa 2O 2,则转移的电子数为。
3.反应③的离子方程式: 。
4.A与CuO在加热条件下能发生反应生成N 2和Cu,请写出该反应的化学方程式:4.图中每一个方格表示相关的一种反应物或生成物,其中B是一种单质,其余物质都是含B元素的化合物。
C是一种钠盐,E是C对应的酸,B的结构类似于金刚石,D是B的氧化物(其他不含B元素的生成物、各步反应添加的必要试剂和反应条件已略去)。
高三化学推断题(附答案)

高三化学推断题1.A和B是同周期相邻元素,B和C是同族相邻元素,A、B、C的价电子数之和为19,则A、B、C三种元素依次是( B )A. S、O、FB. F、O、SC. S、Cl、OD. O、S、Cl2.甲、乙、丙为短周期的三种元素。
甲、乙依次位于周期表中同周期的相邻主族,乙元素的族序数为丙元素的两倍。
甲、乙、丙原子的价电子数之和为11,电子层数之和为7。
则三种元素的名称是:甲_______,乙_______,丙_______。
2. 氮碳镁3.有A、B、C三种元素,已知A、B同周期,B、C同主族,三种元素质子数之和为39,最外层电子数之和为17,则三种元素的元素符号分别为。
3. P、S、O或Cl、P、N或F、Cl、Al4.X、Y、Z三种元素核电荷数之和为26,X、Y处于同一周期,Z在X、Y的下一周期,红热的铜丝能在Z元素的单质里燃烧,生成棕色烟;Y元素原子的最外层电子数比次外层电子数少1。
则X为,Y为,Z为。
4. C;Li;Cl5.有X、Y、Z三种元素,其原子序数依次增大,且位于同一周期,价电子数之和为10。
它们的最高氧化物的水化物之间,任意两种都能反应生成盐和水;M元素与上述三种元素位于相邻的周期,而M原子的L电子层上有4个电子。
试写出这些元素的元素符号:X_______,Y_______,Z________,M________。
5. Na;Al;S;C6.今有A、B、C、D四种短周期元素,它们的核电荷数依次增大。
A与C,B与D分别是同族元素。
B、D两元素的质子数之和是A、C两元素质子数之和的两倍,这四种元素中有一种元素单质易溶于CS2溶剂中,则四种元素是:A:_______,B:_______,C:_______,D:________。
6. H;O;Na;S7.X、Y、Z三种主族元素分别位于相邻的三个不同周期里,且原子序数的大小顺序是Z>X>Y。
元素Y的原子次外层的电子数为2,其最高氧化物的水化物是强酸。
高中化学推断题试题及答案

高中化学推断题试题及答案试题:在一次化学实验中,我们有五种无色溶液:A. 硫酸铜溶液,B. 氢氧化钠溶液,C. 碳酸钠溶液,D. 硫酸溶液,E. 氯化钡溶液。
实验中观察到以下现象:1. 溶液A与溶液B混合时,产生蓝色沉淀。
2. 溶液A与溶液C混合时,也产生蓝色沉淀。
3. 溶液B与溶液D混合时,没有明显现象。
4. 溶液C与溶液D混合时,产生气泡。
5. 溶液D与溶液E混合时,产生白色沉淀。
请根据以上现象推断出五种溶液的化学成分。
答案:根据实验现象,我们可以逐一推断出每种溶液的成分:1. 溶液A与溶液B混合产生蓝色沉淀,这是典型的硫酸铜与氢氧化钠反应生成氢氧化铜蓝色沉淀的现象。
因此,我们可以推断溶液A是硫酸铜溶液,溶液B是氢氧化钠溶液。
2. 溶液A与溶液C混合同样产生蓝色沉淀,这进一步验证了溶液A是硫酸铜溶液,同时表明溶液C也是氢氧化钠溶液。
但根据题目,我们知道溶液B和C是不同的,所以这里存在一个矛盾。
但考虑到实验现象的描述,我们可以假设溶液C实际上是碳酸钠溶液,因为碳酸钠与硫酸铜也能生成蓝色沉淀的碳酸铜。
3. 溶液B与溶液D混合没有明显现象,这表明溶液D不是硫酸铜,因为硫酸铜与氢氧化钠混合会有沉淀。
因此,我们可以推断溶液D是硫酸溶液。
4. 溶液C与溶液D混合产生气泡,这是碳酸盐与酸反应生成二氧化碳气体的典型现象。
这进一步验证了溶液C是碳酸钠溶液,溶液D是硫酸溶液。
5. 溶液D与溶液E混合产生白色沉淀,这是硫酸与可溶性钡盐反应生成硫酸钡白色沉淀的现象。
因此,我们可以推断溶液E是氯化钡溶液。
综上所述,五种溶液的化学成分分别为:A. 硫酸铜溶液B. 氢氧化钠溶液C. 碳酸钠溶液D. 硫酸溶液E. 氯化钡溶液结束语:通过仔细分析实验现象和化学知识,我们可以成功推断出每种溶液的成分。
这类推断题不仅考察了学生对化学知识的掌握,还锻炼了他们的逻辑推理能力。
希望同学们在解答此类题目时,能够细心观察,合理推断,不断提高自己的化学素养。
高考化学推断题(共30题)(解析版)

挑战18推断题(共30题)训练内容是单选题共30题分布如下:1、金属和金属材料11题;2、酸和碱7题;3、盐化肥9题;4、化学与生活3题;1.(2022•云南)金属及金属材料广泛应用于生产、生活及科学实验,其应用推动了社会的发展。
(1)下列实验中,铜片上的白磷燃烧,说明铜具有导热性;黄铜片和纯铜片相互刻画,纯铜片上留下刻痕,说明黄铜的硬度比纯铜的硬度大(填“大”或“小”)。
(2)铁在潮湿的空气中容易生锈,写出一种防止铁制品生锈的具体方法铁制品表面涂油或刷油漆(合理即可)。
(3)春秋战国时期,我国就开始生产和使用铁器。
工业上用赤铁矿(主要成分Fe2O3)和一氧化碳反应炼铁的化学方程式为Fe2O3+3CO2Fe+3CO2。
(4)某同学对含Cu(NO3)2、AgNO3、M(NO3)2的混合溶液进行探究,流程如下(M 表示一种金属元素):根据实验探究流程,回答下列问题:①气体X的化学式为H2;②金属Fe、Cu、Ag、M的活动性由强到弱的顺序是M>Fe>Cu>Ag。
③滤液D中所含溶质的成分可能有3种情况。
【答案】(1)导热;大;(2)铁制品表面涂油或刷油漆(合理即可);(3)Fe2O3+3CO2Fe+3CO2;(4)①H2;②M>Fe>Cu>Ag;③3。
【解答】解:(1)铜片上的白磷燃烧,说明温度达到白磷的着火点,说明铜具有导热性,黄铜片和纯铜片相互刻画,纯铜片上留下刻痕,说明黄铜的硬度比纯铜的硬度大。
(2)铁生锈是铁与水和氧气接触发生的反应,防止铁制品生锈的具体方法铁制品表面涂油或刷油漆(合理即可),隔绝氧气和水。
(3)高温条件下氧化铁和一氧化碳反应生成铁和二氧化碳,该反应的化学方程式:Fe2O3+3CO2Fe+3CO2。
(4)①对含Cu(NO3)2、AgNO3、M(NO3)2的混合溶液加入一定量的铁,铁与硝酸银反应生成银和硝酸亚铁,铁硝酸铜反应生成铜和硝酸亚铁,固体甲加入过量稀盐酸有气体生成,说明加入的铁过量,固体甲中含铁,铁与盐酸反应生成氢气,故气体X为氢气;②滤液A中含硝酸亚铁,硝酸亚铁溶液是浅绿色,加入过量的M得到无色滤液B,说明M置换出铁,M活动性大于铁,固体乙中含铁和M,故金属Fe、Cu、Ag、M的活动性由强到弱的顺序是M>Fe>Cu>Ag;③固体乙中含铁和M,M活动性大于铁,加入硝酸银溶液,M先与硝酸银反应生成M(NO3)2和银;如果M足量,滤液D中所含溶质为M(NO3)2;如果M与硝酸银恰好完全反应,滤液D中所含溶质为M(NO3)2;当M完全反应,硝酸银有剩余,铁与硝酸银反应,铁有剩余,滤液D中所含溶质为M(NO3)2和Fe(NO3)2;当M完全反应,硝酸银有剩余,铁与硝酸银反应,铁与硝酸银恰好完全反应,滤液D中所含溶质为M(NO3)2和Fe(NO3)2;当M、铁完全反应,硝酸银有剩余,滤液D中所含溶质为M(NO3)2、Fe(NO3)2和AgNO3。
高三化学推断题专项训练

证对市爱幕阳光实验学校高三化学推断题专项训练【本讲信息】一. 教学内容:推断题专项训练【模拟试题】1. 室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在适宜的反条件下,它们可以按图所示关系进行反。
又知E溶液是无色的,请答复:〔1〕A是,B是,C是。
〔2〕反①的化学方程式为:。
〔3〕反③的化学方程式为:。
〔4〕反④的化学方程式为:。
物质转化关系2. 从物质A的水溶液出发有以下图所示的一变化:试答复:〔1〕物质的分子式,A ,B ,C ,D ,E ,F 。
〔2〕写出E生成F的离子方程式:〔3〕鉴物质F的方法:。
3. 图里是每一方框中的字母代表一种反物或生成物。
产物J是含A金属元素的白色状沉淀,I为氯化钠溶液,D是淡黄色固体单质。
试填写以下空白:〔1〕L的化学式是:。
〔2〕F的化学式是:。
〔3〕写出J受热分解反的化学反方程式:。
〔4〕H和G之间反的化学反方程式:。
物质转化关系4. 提示:某些金属氧化物跟熔融烧碱反可生成盐。
根据以下化学反框图填空。
〔1〕单质F是:。
〔2〕写出由E生成G的离子反方程式〔或化学反方程式〕。
〔3〕溶液I中所含金属离子是:。
〔4〕由C生成E和F,假设改用浓酸,那么不能选用的浓酸是:。
5. 图每一方框中的字母代表一种反物或生成物。
物质转化关系物质A跟B反生成物质E、F和G;物质C跟D反生成物质I,某温度下,该反起始和某时刻的反混合物组成如上表格所示。
请填写以下空白:〔1〕物质H的分子式是:。
〔2〕反①的化学方程式是:。
〔3〕反②的化学方程式是:〔须注明反条件〕。
6. 以下图中〔1〕~〔11〕分别代表有关反中的一种物质,请填写以下空白。
〔1〕物质1、3、4的化学式分别是:、、。
〔2〕物质8与9反的化学方程式是:。
7. 如图,溶液①是由A、B两种正盐组成,它与其他物质间有如下转化关系:〔1〕写出以下反的离子方程式:⑦~④:②~⑥:〔2〕溶液①中溶质可能有多种组合,推出其可能的化学式及其物质的量的关系:8. 以下物质间在一条件下,可实现图中所示的一变化,其中A、B、D、E是常见的气体,A、B、D是单质。
化学推断题单元达标检测卷含答案

化学推断题单元达标检测卷含答案一、化学推断题1.有一种纳米材料添加剂,由铝粉、氧化铝粉末、铜粉中的一种或几种组成,为探究该添加剂的成分,化学学习小组进行了下列实验,请回答实验中的相关问题:(1)取适量添加剂于试管中,加入足量稀盐酸,有红色固体残留并产生大量气泡,该现象说明添加剂中一定含有_____。
(2)另取适量添加剂于另一试管中,加入一定量的硝酸银溶液,充分反应,过滤,得到滤渣和蓝色溶液。
则生成蓝色溶液的化学方程式为_____。
蓝色溶液中一定含有的两种溶质是_____。
(3)取(2)中的滤渣于试管中,_____,说明该添加剂中含有氧化铝粉末。
2.A、B、C、D是初中化学中常见的物质,其中A是胃酸的主要成分,B在农业上常用于改良酸性土壤,B和C的物质类别相同,它们相互反应及转化关系如图所示(“→”表示由一种物质可以转化为另一种物质,“﹣”表示相邻的物质间可以相互反应,其中部分反应物和生成物及反应条件已略去),请回答:(1)D物质是;(2)若C是一种不溶性的固体,则C可能是;(3)写出A和B反应的化学方程式。
3.图中A~I是初中化学常见的物质,且分别是由H、C、O、Na、Al、S、Ca、Cu、Ag中的一种或几种元素组成的。
在通常情况下,D与其他物质的状态不同,D、G、H、I均为单质,其中G为紫红色固体,H在空气中表面生成一层致密的氧化膜,具有很好的抗腐蚀性能;B可用来改良酸性土壤;A,F均为由三种元素组成的盐。
图中“﹣”表示两端的物质间能发生化学反应,“→”表示物质间存在转化关系;部分反应物、生成物或反应条件已略去。
(1)写出化学式:G 。
(2)写出A与C反应的化学方程式。
写出D与E反应的化学方程式。
写出H→I反应的化学方程式。
4.A~G是均含有一种相同元素的物质,其中A、B、C、D是不同类别的物质且相对分子质量(化学式量)依次减小,G与碱反应有气体生成.它们之间有如右图所示的转化和反应关系(“→”表示某一种物质经一步反应可转化为另一种物质,“﹣”表示相连两种物质能发生化学反应,部分反应物、生成物及反应条件已略去).(l)从物质的分类分析,物质A属于______(填“酸”、“碱”、“盐”或“氧化物”).(2)D、E是由相同的元素组成的物质,E的化学式是_________.(3)写出下列反应的化学方程式:D→C:__________________;B→G:______________________.5.A、B、C、D、E、F、G为常见的物质,其中B、E、G属于单质,反应②是炼铁工业中的主要反应,它们之间的相互转化关系如下图所示:(1)物质A的化学式是________;写出反应④的基本反应类型________。
高中化学会考推断测试题1 学业水平考试无机推断题1

高中化学会考推断测试题1 学业水平考试无机推断题1 供高二学生准备化学会考(学业水平考试)使用,属于无机推断试题高中化学会考无机推断测试题〔1〕1.〔8分〕W、X、Y、Z是原子序数依次增大的四种短周期元素〔稀有气体除外〕。
其中只有Y为金属元素,Y的原子最外层电子数比最内层电子数多1。
X、Z的原子最外层电子数相等,且Z的原子最外层电子数与最内层电子数之和是其核外电子总数的一半。
W的原子质子数比X少1。
请答复:〔1〕Z在元素周期表中的位置是,W、X两种元素中,非金属性最强的是〔填化学式,下同〕,X、Z两种元素气态氢化物中最稳定的是。
〔2〕Y单质可与氢氧化钠溶液反响,该反响的离子方程式为。
〔3〕0.75 mol铜单质与足量W的最高价氧化物对应水化物的稀溶液发生反响,生成气体的体积〔标准状况〕为。
〔4〕X、Y、Z三种元素组成一种常见化合物甲,其中Z处于其最高化合价。
在实验室中,检验甲中阴离子的操作方法和实验现象为:取少量甲的溶液于试管中,,那么证明甲中有该阴离子。
2.〔8分〕W、X、Y、Z为原子序数依次增大的四种短周期主族元素。
其中,W的一种原子核内没有中子,Y 的原子最外层电子数是其内层电子数的3倍。
Y与Z能形成两种常见的离子化合物Z2Y和Z2Y2。
X与Y能形成两种化合物,其相对分子质量之比为7 : 11。
请答复:〔1〕Z在元素周期表中的位置是____。
〔2〕X、Z两元素原子的次外层电子数之比为____。
〔3〕由W与X两种元素组成的物质甲,其相对分子质量为28。
甲可能发生的反响有____〔填序号〕。
①与氢气反响②与氧气反响③与水反响④与酸性高锰酸钾溶液反响〔4〕由W、X、Y三种元素组成的有机物乙,相对分子质量为60。
由W、X、Y、Z四种元素组成的无机物丙,相对分子质量为84,受热易分解。
又知,乙与丙反响能放出气体,写出乙溶液与丙溶液反响的化学方程式:____。
3.〔8分〕A~F是由局部短周期元素组成的单质或化合物,其中A、B、C为单质,转化关系如下:请答复:〔1〕假设B为黄色固体,A为原子半径最小的原子组成的单质,C为双原子分子组成的单质,E能使品红溶液褪色,1 mol F中含有10 mol电子。
化学推断题综合测试附答案

化学推断题综合测试附答案一、化学推断题1.有一包白色固体样品,可能由硫酸钠、氢氧化钠、碳酸钙、氯化钡、氯化镁中的一种或几种物质组成,为探究该样品的组成,某小组取适量样品按下列流程进行试验。
请回答下列问题:(查阅资料)CO2不能直接与BaCl2和MgCl2发生反应。
(1)过滤操作中用到的玻璃仪器有烧杯、漏斗、______。
(2)滤渣a的成分是______;白色沉淀b的成分是______。
(3)滤渣a中加入足量稀盐酸的目的:______。
(4)若现象①“滤渣全部溶解”变为“滤渣部分溶解”,其他现象不变,则原样品一定存在的物质是_____。
2.(4分)如图所示,甲、乙、丙、丁、戊分别是碳酸钠溶液、氧化铁、氢氧化钙溶液、氯化钡溶液和稀盐酸中的一种。
图中短线相连的物质能相互发生反应。
已知丙溶液能使紫色石蕊溶液变成红色。
请回答下列问题:(1)丁物质的化学式是。
(2)甲与乙反应的化学方程式是。
(3)丙与戊反应的化学方程式是。
(4)向盛有甲溶液的烧杯中滴加丙溶液,烧杯中溶液的pH会(填“增大”或“减小”)。
3.如下图所示,A-G是初中化学常见的其中物质。
图中“”表示转化关系,“”表示相互能反应。
F可以用于改良酸性土壤,D、E组成元素相同,B、C、G常温下为气体,在实验室中常用A制取G。
(1)F的化学式是;物质A的一种用途是。
(2)D C反应的化学方程式是。
(3)F G反应的化学方程式是。
(4)图中涉及B物质的反应中,未出现的基本反应类型是。
4.A~E为初中化学常见物质,他们之间有如图所示的转化和反应关系(“→”表示某一种物质经一步反应可转化为另一种物质,“一”表示相连两种物质能发生化学反应,部分反应物、生成物及反应条件已略去).(1)若C、D是组成元素相同的气体,且A和X反应的现象是固体由红色逐渐变成黑色,则A为____,B为____,D与E发生的化学反应_____(填“是”或“不是”)置换反应.(2)若A、B、C、D、E均含有一种相同的元素,且A、B、C、D是不同类别的物质,A和X反应的现象是有刺激性气味的气体生成,则D为_____,写出A﹣B反应的化学方程式_______________________________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学推断题组卷
1.无机化合物A和NaH都是重要的还原剂,遇水都强烈反应.一定条件下,2.40gNaH余气体B反应生成3.90g化合物A和2.24L(已折算成标准状况)的H2.已知气体B可使湿润红色石蕊试液变蓝请回答下列问题:
(1)A的化学式是
(2)NaH与气体B反应生成化合物A的化学方程式
(3)A是足量盐酸发生非氧化还原反应的化学方程式
(4)在高温下(NaH)可将四氯化钛(TiCl4)还原成金属钛,该反应的化学方程式为
(5)某同学认为:用足量B的水溶液吸收工业制硫酸尾气中的SO2,“吸收液”通过蒸发结晶制得的固体即为纯净的亚硫酸盐:取少量该固体加水溶解,再加入过量BaCl2溶液,若产生白色沉淀,即可证明得到的固体一定是纯净物.
2.某含氧物质X仅含三种元素,在198℃以下比较稳定,温度高时易分解.某研究小组设计并完成如下实验:
试回答如下问题:
(1)X的化学式为,写出X与H2O反应的离子方程式
(2)工业上由红棕色固体2可以制备一种单质,写出化学方程式
(3)保存X时应注意,写出X在实际生活中的一种应用.
3.A~G各物质间的关系如图,其中B、D为气态单质.
请回答下列问题:
(1)物质C和E的名称分别为、;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为;若只能在加热情况下进行,则反应物A应为;
(3)反应②的化学方程式为;
(4)新配制的F溶液应加入以防止其转化为G.检验G溶液中阳离子的常用试剂是,实验现象为.
4.某研究小组为了探究固体甲(二元化合物)和固体乙(无机矿物盐,含五种元素)的组成和性质,设计并完成了如下实验:
已知:向溶液1中连续滴加盐酸,先产生白色沉淀,后沉淀溶解;向溶液2中连续通入气体2,也是先产生白色沉淀,后沉淀溶解.请回答下列问题:
(1)甲的化学式是,
(2)乙的化学式是.
(3)加热条件下,气体1与固体2反应,可产生另外一种气体和一种固体,该反应的化学方程式为.
(4)足量气体2与溶液1反应的离子方程式为.有人认为,判断该反应的气体2是否过量较难,应对其中一种产物是“正盐”还是“酸式盐”进行检验,请设计实验证明这一产物的成分:(可选试剂:氨水、NaOH溶液、稀硫酸、CaCl2溶液).
5.有X、Y、Z三种单质,其中X单质在常温、常压下为气体,Y、Z单质为固体.
①纯净的氢气可在X单质中燃烧产生苍白色的火焰和大量的白雾;
②Y单质在空气中剧烈燃烧,发出黄色的火焰,生成一种淡黄色的固体;
③Z ZO2ZO3H2ZO4,H2ZO4是一种具有强氧化性的酸.
根据上述实验现象或事实进行推断:
(1)写出X单质与水反应的化学方程式:;
(2)写出Y单质与水反应的化学方程式:;
(3)写出将一小块Y单质放入滴有酚酞水中时,你所看到的实验现象:;
(4)写出铜与H2ZO4浓溶液在加热时反应的化学方程式.
6.A、B、C、D、E、X是中学常见的无机物,存在下图所示转化关系(部分生成物和反应条件略去);已知A由短周期非金属元素组成,B具有漂白性且光照易分解.
若A为单质,且常温下0.1mol•L﹣1C溶液的pH为1,请回答以下问题:
①组成单质A的元素在元素周期表中的位置为;
②A与H2O反应的离子反应方程式为;
③X可能为(填代号).a.NaOH b.AlCl3c.Na2CO3d.NaAlO2.
7.室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可以按如图所示进行反应.又知又知单质A是当今世界产量最大的金属,E溶液是无色的.请回答:
(1)试写出下列物质的化学式:A,C.
(2)反应①的化学方程式:.
(3)B+F→D的化学方程式:.
8.以海水中常见物质A为原料可以发展很多工业,图中包含了中学课本中介绍的几种基本工业生产,请根据各物质之间的转化关系回答下列问题.
(1)C和D、C和G反应都可以制取消毒剂.C和D反应制取的消毒剂中有效成分的化学式为.(2)电解A溶液反应的离子方程式为.
(3)将F和J通入A的饱和溶液中,反应的化学方程式为:.
(4)空气分离出H后剩余气体的最主要成分是,有可以将其与B及D组成燃料电池,则该电池的负极反应式:;正极反应式:.
9.取钠﹣镁合金7.0克进行如下实验:
(1)写出Mg在CO2中燃烧的化学方程式
(2)向溶液1中加过量的NaOH溶液,发生反应的离子方程式为
(3)写出合金的化学组成.
10.利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)制备铁红,大致生产过程如下
请回答:
(1)验滤液A 中含有Fe2+的方法是.
(2)滤液A→B发生反应的离子方程式为.
(3)在空气中煅烧FeCO3的方程式为.
11.无机化合物X含有2种元素,是农业生产的一种杀虫剂,具有以下一系列变化:
已知:1、气体A是形成酸雨的主要物质之一;2、固体B是一种重要的建筑材料;
3、8.4gX在O2中充分灼烧得到2.8g固体B.
4、盐G的结构和Na2O2类似
请回答以下问题:
(1)写出CO2的电子式;X的化学式是;
(2)写出NaOH溶液中通入过量气体A的离子反应方程式
(3)写出②的化学反应方程式;
(4)盐C在空气中易变质,请设计实验检验盐C是否变质.
12.有一应用前景广阔的纳米材料甲,其由A、B两种短周期非金属元素组成,熔点高,硬度大,难溶于水.取1.40g材料甲与熔融的烧碱反应,生成一种含A的含氧酸盐乙和一种含B的气体丙,测得丙在标准状况下的体积为0.896L.
乙能溶于水,加盐酸产生白色胶状沉淀,盐酸过量沉淀不溶解;丙能使湿润的红色石蕊试纸变蓝.(1)甲的化学式为,属于晶体,丙的电子式为
(2)工业上制备甲的方法之一是用A的氯化物与丙在高温下反应,则其化学反应方程式为,该反应属于(填“氧化还原反应”或“非氧化还原反应”)
(3)乙的水溶液露置在空气中容易变质,写出相应的离子方程式
(4)工业上以废铜为原料经一系列化学反应可生产氯化亚铜(CuCl),其工艺流程如图所示:
试根据图转化回答下列问题:
①还原过程中的产物为Na[CuCl2],试写出反应的化学方程式.制备中当氯化完成后必须经还原过程再制得CuCl,为什么不用一步法制得CuCl?(已知Cu2++Cu+2Cl﹣═2CuCl↓).
②实验室中在CuCl2热溶液中通入SO2气体也可制备白色的CuCl沉淀,试写出该反应的离子方程式.
13.某研究小组为了探究一种无机矿物盐X(仅含四种元素)的组成和性质,设计并完成了如下实验:
另取10.80g X在惰性气流中加热至完全分解,得到6.40g固体1,请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图,写出气体甲的电子式.
(2)X的化学式是,在惰性气流中加热X至完全分解的化学反应方程式为.
(3)白色沉淀2在空气中变成红褐色沉淀的原因是(用化学反应方程式表示)
(4)一定条件下,气体甲与固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应
方程式,并设计实验方案验证该反应的产物.
14.大多数非金属元素有含氧酸根离子,某些金属元素也有含氧酸根离子:MnO4﹣、MnO42﹣、Cr2O72﹣等.某无机盐M是一种优良的氧化剂,为确定其化学式,某小组设计并完成了如下实验:
已知:
①无机盐M仅由钾离子和一种含氧酸根组成,其原子个数比为2:1:4;
②如图中,将1.98g该无机盐溶于水,滴加适量稀硫酸后,再加入1.12g还原铁粉,整个过程无气体生成,恰好完全反应得混合溶液N.
③该小组同学将溶液N分为二等份,分别按路线Ⅰ、路线Ⅱ进行实验.
④在路线Ⅱ中,首先向溶液N中滴加适量KOH至元素X刚好沉淀完全,过滤后将沉淀在空气中充分灼烧得纯净的Fe2O3粉末1.20g;再将滤液在一定条件下蒸干,只得到3.48g纯净的不含结晶水的正盐W.
请按要求回答下列问题:
(1)由路线Ⅰ的现象可知,溶液N中含有的阳离子是.
(2)由实验流程图可推得,含氧酸盐W的化学式是;由路线Ⅱ可知,1.98g无机盐M中所含钾元素的质量为g.
(3)无机盐M与1.12g还原铁粉恰好完全反应生成溶液N的化学反应方程为.。
