第四章 炔烃 二烯烃 红外光谱-黑体
第4章 炔烃、二烯烃
碳素酸的弱酸性
Na
+ 2 HC
+
HC
CH
CH
110℃
2 HC
CNa
+H
NH3
2
NaNH2
HC
CNa
+
13
R3C CH
Ka
R3C C
CH
+
44
H
+
物质名称
pKa
HOH
HC
H2 C
CH2
H3 C
CH3
15.7
25
50
端炔酸性的解释 端炔中的碳为sp杂化, 轨道中s成分较大, 核 对电子的束缚能力强, 电子云靠近碳原子, 使分子中的C-H键极性增加, 易断裂:
HC CH
+ 2 Ag(NH3)2NO3
+ 2 Cu(NH3)2Cl
AgC
CAg
+ 2 NH4NO3 + 2 NH3
乙炔银(白色)
HC CH
CuC
CCu
+ 2 NH4Cl + 2 NH3
乙炔亚铜(砖红色)
应用: 区别端炔与非端炔、端炔与烯烃。
RC CH
16
炔化物的生成
注意:炔化银或炔化亚铜在干燥状态下, 受热或震动容易爆炸。实验完毕后 加稀硝酸使其分解。
+
RC
CH2
> RCH
+
CH
22
炔烃的亲电加成
炔烃与烯烃反应活性比较: 炔烃的加成速度比烯烃慢。
加卤素
当化合物中同时含有双键和叁键时, 首先在双键上发生加成反应。
Br2 低温
Br Br
选择性加成
第04章 炔烃 二烯烃 红外光谱

炔烃:分子中含有一个CC的开链烃
sp3—sp
R R H
C C C
C CH C
R'
Internal alkyne Terminal alkyne
H
乙炔
CH3
C
C
H
丙炔
组成上相差一个或几个CH2的炔烃构成同系列
1
炔烃的结构-sp杂化轨道
杂化
2
乙炔的结构-轨道重叠成键图
3
乙炔桶状电子云图
4
炔烃的命名
37
共轭体系的类型-p–共轭体系
CH2 CH
+ CH2 + CH2
CH
CH2
CH2
CH
O
CH2
CH2
CH
O
CH2
CH2
CH2
C
CH
CH3
Cl
CH2
C
CH3
CH2
CH
Cl
+
38
共轭体系的类型-超共轭体系(自由基)
39
共轭体系的类型-超共轭体系(碳正离子)
40
共轭体系的类型-超共轭体系(取代烯烃)
红外光谱-光能团区与指纹区
57
分子的结构与红外吸收
官能团 波数 强度
58
官能团
波数
强度
分 子 的 结 构 与 红 外 吸 收
59
己烷的红外图谱
C-H伸缩振动:2850~2960 cm–1 -CH2-,-CH3面内剪式弯曲振动:1450~1470 cm–1 -CH3面内摇式弯曲振动:1370~1380 cm–1 -CH2-面内摇式弯曲振动:720~725 cm–1
62
41
第四章炔烃二烯烃红外光谱黑体

C=C
H
H
(3) 和水得加成
补充1 (末端炔烃):R-CCH 得:甲基酮 (R-CO-CH3) 补充2 (不对称炔烃): R-CC-R’ 得:混合酮
若:R为一级取代基,R’为二、三级取代基,则C=O 与R’相邻。 (注意空间效应)
为什么发生重排?
CH2=C-OH CH3-C=O
H
H
•乙 醛 得 总 键 能 2 7 4 1 k J / m o l 比 乙 烯 醇 得 总 键 能 2678kJ/mol大,即乙醛比乙烯醇稳定、
CH2=HC-CH2-CCH + Br2 CH2BrCHBrCH2CCH
**为什么炔烃得亲电加成不如烯烃活泼?
•烷基碳正离子(中间体)—正碳原子就是sp2杂化状态,她得正电荷 易分散到烷基上、
•烯基碳正离子(中间体)—sp杂化状态, 正电荷不易分散、所以能 量高,不稳定、形成时需要更高得活化能,不易生成、
• 杂化轨道理论:两个成键轨道(1, 2),两个反键轨道 (1*, 2*)
• 两个成键 轨道组合成了对称分布于碳碳 键键 轴周围得,类似圆筒形状得 电子云、
(5) 总结
•碳碳叁键就是由一个 键和两个 键 组成、
•键能—乙炔得碳碳叁键得键能就是:837 kJ/mol;
乙烯得碳碳双键键能就是:611 kJ/mol;
甲基乙烯基醚
• CH3OH + KOH
CH3O-K+ + H2O
•带负电荷得甲氧基负离子 CH3O-,能供给电子,具有亲近 正电荷(核)得倾向,所以就是亲核试剂、
•反应首先就是由甲氧基负离子攻击乙炔开始、
CHCH + CH3O- CH3O-CH=C-H CH3OH CH3O-CH=CH2 + CH3O-
第四章炔烃和二烯烃全解

1
2
CH2
CH CH2 C CH
1-戊烯-4-炔
3
4
5
应命名为 3-戊烯-1-炔,而不命名为 2-戊烯-4-炔。
H3C C C CH2CHCH3
H3C C C C CH H H
5-乙基-1-庚烯-6-炔
not 3-乙基-6-庚烯-1-炔
(CH3)2CH C C H
H CH2C CH
(E)-6-甲基-4-庚烯-1-炔
CH3C CNa
HBr ROOR CH3CH2CH2Br
CH3C
CH
H2
Lindlar
CH3CH=CH2
CH3C
H2 Ni
CNa CH3C lig . NH3
CCH2CH2CH3
CH3CH2CH2CH2CH2CH3
3、与重金属盐的反应
♦ 1- 炔烃与银氨溶液反应,立即生成白色的炔化银沉 淀;与氯化亚铜氨溶液反应则生成砖红色的炔化亚 铜沉淀,只有端炔有此性质,是 区别端炔与非端炔 及烯烃的方法。
[Ag(NH3)2]
+
R C CH
R C CAg
炔化银
白色沉淀
HC
CH
[Cu(NH3)2]
+
CuC
CCu
砖红色沉淀
乙炔亚铜
区别乙烷、乙烯、乙炔
CH CH CH2=CH2 CH3CH3
Ag(NH3)2+
白色 ( ( ) )
(CH CH )
Br2/CCl4
褪色(CH2=CH2) ( -)
爆炸品——炔化银
炔烃的命名
炔烃的普通命名法是将其他炔烃看成乙炔 的衍生物命名。例如: (CH3)3C–C≡C–H 叔丁基乙炔 (CH3)3C–C≡C–C(CH3)3 二叔丁基乙炔 F3C–C≡C–H 三氟甲基乙炔 系统命名法与烯烃相似,只是将“烯”字 改为“炔”字。
炔烃二烯烃红外光谱

4.4.1.3
炔氢的弱酸性
• 炔烃中的炔氢可以和强碱反应,说明它有弱酸性,这是为 什么呢? • 首先,我们观察一下与炔氢相连的碳原子的情况。
C
H
C
H
C
H
sp-s
sp2-s
sp3-s
• 与 H原子相连的 C原子的杂化方式不同,与炔氢相 连的叁键碳采用的是 sp杂化,与烯烃中双键上H原 子相连的双键碳采用 sp2 杂化,与烷烃中 H 原子相 连的碳原子采用sp3杂化。
• 炔烃中的叁键虽与双键不同,却有共同之处, 它们都是不饱和键,都由键和键构成,所 以烯、炔的性质有相同的地方,都易发生加 成、氧化和聚合反应,另外叁键碳上所连的 氢也有相当的活泼性,可以发生一些特殊的 反应。 • 炔烃可发生以下一些反应:
加成、氧化、聚合
H C C H
炔氢的反应
4.4.1 叁键碳上氢原子的活泼性(弱酸性) • 乙炔和1-炔烃(R-C≡CH)分子中,连接在叁键 碳( sp 杂化)上的氢原子受叁键碳电负性的影 响,其C-H 键中共用电子对偏向叁键碳一侧, 而使得该 H 原子能以质子( H+ )的形式离去,则 该 H 具有弱酸性,是活泼氢原子。它能与强碱 (如金属钠或氨基钠)发生酸碱反应,或与一 些重金属盐(如银盐及亚铜盐)反应生成重金 属炔化物。
• 炔烃的物理性质随分子量的增加而有规律的变化。
• 低级炔烃常温下是气态, C4 以上炔烃为液体,高级 炔烃为固体。沸点比相应的烯烃高 10 ~ 20℃,比重 (相对密度)也稍大,但仍小于1。 • 难溶于水,易溶于CCl4等有机溶剂。
• 常见炔烃的部分性质,见书中P67页表4-1
4.4
炔烃的化学性质
命名
命名与烯烃相似,只要把“ 烯 ”改成“ 炔 ”即 可。
第四章炔烃、二烯烃 红外光谱讲解

• 炔烃可发生以下一些反应:
加成、氧化、聚合
H C CH
炔氢的反应
4.4.1 叁键碳上氢原子的活泼性(弱酸性)
CH3COOH 和
COOH
练习: • 由氧化碎片推出原炔烃的两个片段。
CH3COOH
COOH
CH3C C
则炔烃结构为: 4-甲基-2-戊炔
4.4.4 聚合反应
• 低级炔烃在不同条件下可以聚合成不同的聚合产物。如乙 炔可以发生二聚、三聚和四聚,可聚合成链状化合物,也 可成环,但不易聚合成高聚物。
• 将乙炔通入到热的氯化亚铜和氯化铵的盐酸溶液中,可发 生二聚或三聚。
乙炔亚铜
白色沉淀 砖红色沉淀
爆炸品——炔化银
• 炔化银或炔化亚铜在干燥状态下,受热、震动或撞击时, 可发生猛烈的爆炸。分解成金属和碳并放出大量的热。
AgC CAg
2 Ag + 2C + 336KJ/mol
• 为了安全,实验中生成的重金属炔化物,反应后必须用 硝酸将其分解。
AgC CAg + 2 HNO3
• 乙炔和1-炔烃(R-C≡CH)分子中,连接在叁键 碳(sp杂化)上的氢原子受叁键碳电负性的影 响,其C-H 键中共用电子对偏向叁键碳一侧, 而使得该H原子能以质子(H+)的形式离去,则 该H具有弱酸性,是活泼氢原子。它能与强碱 (如金属钠或氨基钠)发生酸碱反应,或与一 些重金属盐(如银盐及亚铜盐)反应生成重金 属炔化物。
论在什么条件下反应,炔烃都会被氧化成羧酸。根据炔烃的 氧化产物,可以方便地推断出炔烃的结构。
第四章 炔烃和二烯烃

炔烃与HCl加成时,需用HgCl2催化,与HBr加成时, 也有过氧化物效应,生成反马氏规则的产物,烯炔加 卤化氢时,加成反应也是先在双键上进行。
③加水 将乙炔通入含HgSO4的稀H2SO4溶液中,可与一分子 水加成,生成乙醛。反应是先生成不稳定的乙烯醇, 再发生分子重排,生成乙醛的。这一反应称为库切洛 夫(Кучеров)反应。其他炔烃加水则生成酮。
林得勒催化剂,是沉淀在BaSO4或CaCO3上的Pd,并用 醋酸铅或喹啉降低其活性。 烯炔部分被氢化时,三键首先被氢化。烯烃和炔烃分别 加氢时,炔加氢的速度比烯慢,其他加成反应也是如此, 但烯烃和炔烃的混合物加氢时,炔烃更易吸附在催化剂 表面,所以三键先被氢化。
3 亲电加成
①加卤素 炔烃与卤素起加成反应时,先生成二卤化物,继续作用生 成四卤化物。烯炔加卤素时,首先加在双键上。原因:炔 烃的亲电加成反应要比烯烃的难些,是由于三键的π电子 比双键的难以极化,较难给出电子和亲电试剂作用。
H C≡ C H
180°
1.sp杂化轨道
2p 2s
激发
2p 2s
杂化 p
sp
杂化后形成两个sp杂化轨道(含1/2 S和1/2 P成分),
剩下两个杂化P的轨道。两个sp杂化轨道成1800分布,两个
未杂化的P(PY、PZ)轨道互相垂直,它们与中一碳的两个P轨 道两两互相侧面重叠形成两个互相垂直的键。
2-甲基-1,3-丁二烯
CH2 CHCH CHCH CH2
1,3,5-己三烯
多烯烃的顺反异构体的命名也和烯烃相似,碳原子编 号,从离双键最近的一端开始,若两端离双键等距时, 应从构型为Z的双键一端开始。
H
H
CC
H
CH3
CC
第四章 炔烃 二烯烃 红外光谱

第四章炔烃二烯烃红外光谱1. 简要回答问题:为什么CH≡CH的酸性大于CH2=CH2的酸性?解答:CH≡CH中碳原子以sp杂化, 电负性较大;CH2=CH2中碳原子以sp2杂化。
C SP—H键极性大于C SP2—H键2. 用共振论解释1,3-丁二烯的1,2- 和1,4-加成。
解答:3. 写出1,3-丁二烯及1,4-戊二烯分别与1mol HBr或2mol HBr的加成产物。
答案:4. 用化学方法区别下列各组化合物。
(1) 丙烷、丙烯和丙炔????? (2) 1-丁炔,2-丁炔和1,3-戊二烯解答:(1)Br2/CCl4; Ag(NH3)2NO3,??(2)顺丁稀二酸酐; ?Ag(NH3)2NO3,5. 以丙烯为唯一碳源合成:解答:利用炔钠与卤代烷的增碳反应先生成相应的炔烃,而后还原得到反式烯烃。
6. 以所给的起始物为原料(其它化学试剂不限)完成下列合成:解答:产物为顺式结构,合成时必须考虑立体化学的控制,叁键还原时不能用Na/NH3还原,而应用Lindlar 催化剂进行催化加氢。
7. 以乙炔、丙烯为原料合成:解答:8. 某化合物A的分子式为C5H8,在液氮中与NaNH2作用后,再与1-溴丙烷作用,生成分子式为C8H14的化合物B,用KMnO4氧化B得分子式为C4H8O2的两种不同的酸C和D。
A和稀H2SO4/HgSO4水溶液作用,可生成酮E(C5H10O)。
试写出A-E的构造式。
解答:A的不饱和度为2。
从可与NaNH2反应后再与1-溴丙烷反应来看。
A应为端炔。
从B氧化得到两种不同的酸来看,A应有支链,推测为:9. 用红外光谱区别?和???解答:在1715cm-1处有一强吸收峰,在2720 cm-1处有两个弱吸收峰;在1710 cm-1处有一强吸收峰。
根据2720 cm-1的峰可区别两个化合物。
10. 如何用IR光谱区别环己醇和环己酮???解答:环己醇在3200 ~3600 cm-1处有强而宽的吸收峰;环己酮在1720 cm-1处有强的吸收峰。
4炔烃、二烯烃及红外光谱

pKa 26
共轭碱
HC≡CΘ ≡
≡ 25.5 (CH3)3C≡C Θ
16 15.7
CH3CH2OΘ HOΘ
有机化学(Organic Chemistry )
北京化工大学北方学院
22
4.4.1 叁键碳上氢原子的活泼性
有机化学(Organic Chemistry ) 北京化工大学北方学院 5
(2) 乙炔分子中的 σ 键
由炔烃叁键一个碳原子上的两个sp杂化轨道所组 由炔烃叁键一个碳原子上的两个 杂化轨道所组 成的σ键则是在同一直线上方向相反的两个键。 成的σ键则是在同一直线上方向相反的两个键。 在乙炔中,每个碳原子各形成了两个具有圆柱形 在乙炔中, 它们是C 轴对称的 σ 键,它们是 sp-Csp和Csp-Hs。
17
4.3 炔烃的物理性质
(1) 炔烃的物理性质和烷烃,烯烃基本相似; 炔烃的物理性质和烷烃,烯烃基本相似; (2) 低级的炔烃在常温下是气体,但沸点比相 低级的炔烃在常温下是气体, 同碳原子的烯烃略高; 同碳原子的烯烃略高; (3) 随着碳原子数的增加,沸点升高。 随着碳原子数的增加,沸点升高。 (4) 叁键位于碳链末端的炔烃 又称末端炔烃 叁键位于碳链末端的炔烃(又称末端炔烃) 又称末端炔烃 的沸点低于叁键位于碳链中间的异构体。 的沸点低于叁键位于碳链中间的异构体。 (5) 炔烃不溶于水,但易溶于极性小的有机溶 炔烃不溶于水, 如石油醚, 乙醚,四氯化碳等。 剂,如石油醚,苯,乙醚,四氯化碳等。
有机化学(Organic Chemistry ) 北京化工大学北方学院 23
液氨
CH≡C-C2H5 ≡
第四章 炔烃 二烯烃 红外光谱

Br Br CH3 C CH
Br Br
1,1,2,2- 四溴丙烷
与烯烃一样,炔烃与红棕色的溴溶液反应生成无色的溴代烃,所以此反应可用于炔 烃的鉴别。
但炔烃与卤素的亲电加成反应活性比烯烃小,反应速度慢。例如,烯烃可使溴的四 氯化碳溶液立刻褪色,炔烃却需要几分钟才能使之褪色,乙炔甚至需在光或三氯化铁催 化下才能加溴。所以当分子中同时存在双键和叁键时,首先进行的是双键加成。例如在 低温、缓慢地加入溴的条件下,叁键可以不参与反应:
炔烃的主要化学反应如下:
RC C H
炔氢的弱酸性
炔烃的加成反应 炔烃的氧化反应
4.4.1 加成反应 (1)催化加氢 在常用的催化剂如铂、钯的催化下,炔烃和足够量的氢气反应生成
烷烃,反应难以停止在烯烃阶段。
R C C R' H2 Pd
R CH CH R' H2 Pd
R CH2CH2 R'
如果只希望得到烯烃,可使用活性较低的催化剂。常用的是林德拉(Lindlar)催化 剂(钯附着于碳酸钙上,加少量醋酸铅和喹啉使之部分毒化,从而降低催化剂的活性), 在其催化下,炔烃的氢化可以停留在烯烃阶段。这表明,催化剂的活性对催化加氢的产 物有决定性的影响。部分氢化炔烃的方法在合成上有广泛的用途。
CH CH + HCN
Cu2Cl2 5
CH2 CH CN
丙烯腈
丙烯烃
分子中含有两个或两个以上双键的碳氢化合物称为多烯烃。其中含有两个双键的称
为二烯烃或双烯烃,通式为CnH2n-2,与碳原子数相同的炔烃是同分异构体。
4.6 二烯烃的分类和命名
根据二烯烃分子中两个双键的相对位置不同,可将二烯烃分为三种类型。
R C C R' + H2 Lindlar催化剂 R CH CH R'
炔烃二烯烃红外光谱-黑体

二烯烃也可能在波数1250-1350 cm-1范围内出现一个较弱的吸收峰,这是由于C-H键的弯曲振动引 起的。
红外光谱分析的应用
红外光谱分析可用于鉴定化合 物的结构和确定化合物的官能 团。
炔烃二烯烃红外光谱-黑体
目录
• 炔烃和二烯烃的基本性质 • 红外光谱的基本原理 • 炔烃和二烯烃的红外光谱特性 • 黑体辐射与红外光谱 • 炔烃和二烯烃的红外光谱分析
01
炔烃和二烯烃的基本性 质
炔烃的性质
01 炔烃是一种不饱和烃,具有一个碳碳三键。
02 炔烃具有高度的反应活性,可以与多种试 剂发生加成反应。
05
炔烃和二烯烃的红外光 谱分析
炔烃的红外光谱分析
炔烃在红外光谱中显示出明显的特征 吸收峰,主要在波数范围1650-1750 cm-1之间,这是由于C≡C三键的伸缩 振动引起的。
此外,炔烃在波数1380-1480 cm-1 范围内也可能出现一个较弱的吸收峰, 这是由于C-H键的弯曲振动引起的。
二烯烃的红外光谱分析
同化合物。
红外光谱的表示方法
吸光度与透射率
吸光度表示物质对光的吸收程度,透射率表示光 通过物质后的强度与原强度的比值。
峰位与峰强
峰位表示吸收峰的位置,峰强表示吸收峰的强度。
基线与峰谷
基线是光谱曲线的最低点,峰谷是光谱曲线上的 最低点。
红外光谱的实验方法
制样方法
常用的制样方法有KBr压片法、薄膜法、ATR法等。
的。
02
炔烃的C-H伸缩振动通常出现在3300-3500 cm-1之间,但由 于炔烃的C-H键较弱,其吸收峰通常比烯烃的吸收峰更弱。
第四章 炔烃 二烯烃 红外光谱

H
C
③
C①0.134nm C② 122.4°
H
H
C④ H
特点:①π电子云,非“定域” 而是发生了“离域”。
② p轨道平行且相邻时,才发生离域。 离域能 热值体现。
从氢化
现在你正浏览到当前第三十页,共五十四页。
共轭效应(离域效应):
分类:
①π,π共轭效应(单双键交替) ②σ,π超共轭效应( σ键与相邻π键的共轭)
R’
C=C
H
H
例如:
CH2=CH—CH2—C≡CH + H2
林德拉催化剂
CH2=CH—CH2—CH=CH2 顺式加成产物
现在你正浏览到当前第十四页,共五十四页。
⒉ 亲电加成: ① 和卤素加成
HC≡CH Cl2
X2 HC≡CH +I2
HClC=CClH Cl2 X2
I
H
C=C
H
I
HCl2C—CCl2H
(选择性加成)
解释:碳原子采用sp杂化吸电子能力强,形成碳正离子需要更高 的活化能。
现在你正浏览到当前第十六页,共五十四页。
② 和氢卤酸加成
Ⅰ:符合马尔科夫尼科夫规则加成,比烯烃困难些。
R—C≡CH
HX R—C=CH2 HX X
X R—C—CH3
X
可控制在一分子加成上
若要加速反应可采用亚铜盐或汞盐作为催化剂。
乙炔亚铜(红色)
+ 2NH4Cl +2NH3
现在你正浏览到当前第十一页,共五十四页。
金属炔化物干燥状态下受热或受撞击时,易发生爆炸。所以实 验室中不拟再利用的重金属炔化物,应即加酸予以处理。
AgC≡CAg △ 2Ag + 2C + 364KJ/mol
第四章 二烯烃 炔烃 红外光谱.ppt

4.9 红外光谱
一般的红外吸收光谱主要指中红外 范围而言,波数在400-4000 cm-1,谱图 是以波长和波数为横坐标,表示吸收带 的位置,以透射率(T%)为纵坐标,表 示光的吸收强度,整个吸收曲线反映了 一个化合物在不同波长的光谱区域内吸 收能量的分布情况。
一、分子振动、分子结构和红外光谱
分子振动包括键的伸缩振动和键的弯 曲振动。并非所有的分子振动都能吸收 红外光,只有使分子的偶极矩发生变化 的分子振动才具有红外活性,才有相应 的吸收谱带,分子中极性基团很易引起 明显的红外吸收。
+ H2
2、加X2
双键的反应活性较叁键高,∴易发生加成反应。 利用Br2的颜色反应可检验炔烃。
+ Cl2
Cl
Cl
Cl
Cl
Cl
Cl
Br
+ Br2
Br
3、加HX
同样遵循马氏规则,但HBr有过氧化物效应, 亚铜盐和高汞盐可催化该反应。
4、加H2O
需在硫酸汞和稀硫酸的存在下才发生反应,同 样遵循马氏规则,中间有一烯醇式的过渡态, 除乙炔加水生成醛以外,其它炔烃加水都生成 酮,该反应称为库切洛夫反应。
一、物理性质 二、化学性质
(一)、取代反应
乙炔和1-炔烃分子中,连在sp杂化C上的H受叁
键的影响,性质较活泼,具弱酸性,可以被金属 取代,生成金属炔化物。
CH
Na CH
CH
Na
CNa
CNa
CNa
+ NaNH2 NH3
NaNH2
R
液氨
CH + NaNH2
R
CNa + NH3
+ NaNH2
NH3
NaNH2
第四章炔烃二烯烃红外光谱
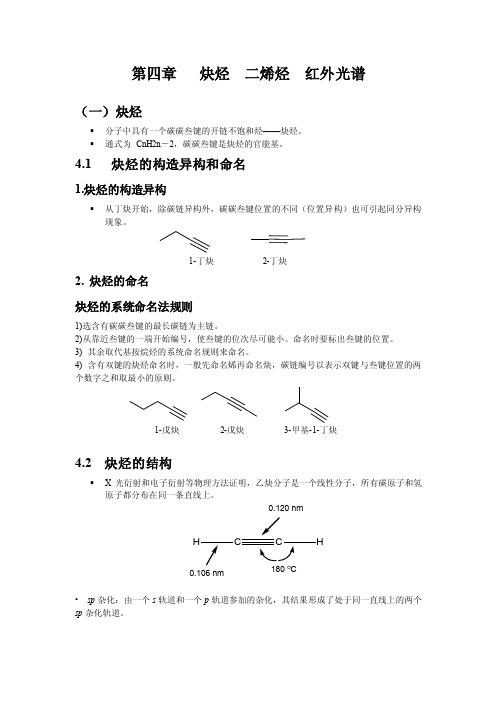
第四章炔烃二烯烃红外光谱(一)炔烃▪分子中具有一个碳碳叁键的开链不饱和烃——炔烃。
▪通式为CnH2n-2,碳碳叁键是炔烃的官能基。
4.1 炔烃的构造异构和命名1.炔烃的构造异构▪从丁炔开始,除碳链异构外,碳碳叁键位置的不同(位置异构)也可引起同分异构现象。
1-丁炔2-丁炔2. 炔烃的命名炔烃的系统命名法规则1)选含有碳碳叁键的最长碳链为主链。
2)从靠近叁键的一端开始编号,使叁键的位次尽可能小。
命名时要标出叁键的位置。
3) 其余取代基按烷烃的系统命名规则来命名。
4) 含有双键的炔烃命名时,一般先命名烯再命名炔,碳链编号以表示双键与叁键位置的两个数字之和取最小的原则。
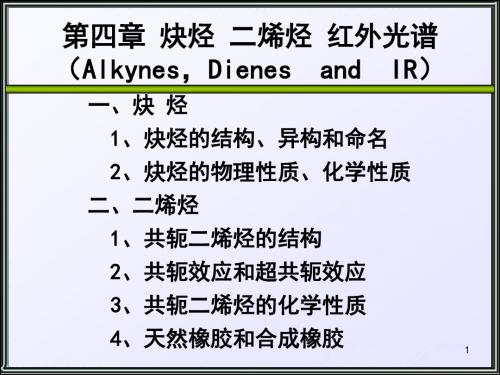
1-戊炔2-戊炔3-甲基-1-丁炔4.2 炔烃的结构▪X光衍射和电子衍射等物理方法证明,乙炔分子是一个线性分子,所有碳原子和氢原子都分布在同一条直线上。
•sp杂化:由一个s轨道和一个p轨道参加的杂化,其结果形成了处于同一直线上的两个sp杂化轨道。
0.120 nm180 o C0.106 nmH乙炔分子中σ键的形成▪乙炔分子中,每个碳原子与另外两个原子形成了一个C sp-H s σ键和一个C sp-C sp σ键,在同一直线上,方向相反,故乙炔分子为线性分子。
乙炔分子中的π键▪每个碳原子上还各有两个未参加杂化的p轨道,互相平行,故这两个p轨道可侧面相互交盖而形成了两个π键,这两个π键并不是孤立分离的,其电子云对称分布在碳碳σ键键轴周围,类似圆筒性状。
参见图4-3。
▪碳碳叁键由一个σ键和两个π键组成。
乙炔键长缩短的原因1)s轨道的电子较p电子接近原子核,故杂化轨道的s成分越多,则在杂化轨道上的电子越接近原子核。
乙炔分子中的C sp-H s σ键,因sp杂化轨道的s成分大(50%),其电子云更靠近原子核。
2)乙炔分子中有两个形成π键,且sp杂化轨道参与了碳碳σ键的组成。
4.3 炔烃的物理性质∙炔烃的物理性质和烷烃、烯烃基本相似。
∙低级的炔烃常温常压下为气体,但沸点比相同碳原子数的烯烃略高。
4章炔烃二烯烃红外光谱6学时

第四章 炔烃 二烯烃 红外光谱学习要求1. 掌握炔烃及二烯烃的命名法。
2. 掌握炔烃的化学C 三C 结构,SP 杂化。
3. 掌握炔烃的化学性质:加成反应,三C —H 反应,碳负离子,酸性,偶合反应。
4. 掌握共轭二烯烃的反应:1,4—加成和1,2—加成,离域。
5. 掌握烷烃、烯烃和炔烃的鉴别、碳原子sp 杂化与sp 2、sp 3杂化的比较 6. 理解炔烃及二烯烃的物理性质。
7. 理解丁二烯的分子结构及分子轨道。
8. 理解速度控制和平衡控制。
9. 理解共轭效应及超共轭效应。
10. 理解红外光谱、紫外光谱的原理。
11. 了解红外光谱、紫外光谱在有机物结构测定中的应用。
12.了解二烯烃的分类。
13.了解异戊二烯。
14. 了解lindear 催化剂。
计划课时数 6课时重点:炔烃的结构,炔烃的化学性质、制法及应用,共轭二烯烃的结构,共轭二烯烃的性质及制法,共轭效应及其相对强弱,红外光谱原理及应用难点:炔烃的结构与性质、共轭二烯烃的结构和性质、共轭效应及其相对强弱。
教学方法 采用多媒体课件、模型和板书相结合的课堂讲授方法。
引言炔烃和二烯烃都是通式为C n H 2n-2的不饱和烃,炔烃是分子中含有-C ≡C-的不饱和烃,二烯烃是含有两个碳碳双键的不饱和烃,它们是同分异构体, 但结构不同,性质各异。
§4.1 炔烃的命名1)与烯烃相似,将“烯”改为“炔”。
例:CH 3CH 2C CHC CCH 3CH CH 3CH 3CCH C CH CH 21-丁炔 4-甲基-2-丁炔 乙炔基 2-丙炔基 2)烯炔(同时含有三键和双键的分子)的命名: (1)选择含有三键和双键的最长碳链为主链。
(2)主链的编号遵循链中双、三键位次最低系列原则。
(3)通常使双键具有最小的位次。
CH 2CH CH 2CCHCH 3CH CH CCH(两种编号中一种较高时,宜取低。
)1-戊烯-4-炔 3-戊烯-1-炔(不叫2-戊烯-4-炔)CH 2CCHCH 3(CH 3CH 2CH 2)2CHCCCH 31-甲基-2-(2-丙炔基)-环己烯 4-丁基-2-庚炔§4.2 炔烃的结构最简单的炔烃是乙炔,我们以乙炔来讨论三键的结构。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
液氨
CHC-C2H5
CH2=CHBr 不反应 氯苯? 不反应
CH2Cl
CH CNa
— 得到碳链增长的炔烃 ---- 炔化合物是重要的有机 合成中间体.
反应
(2) 生成炔化银和炔化亚铜的反应--炔烃的定性检验 • 与硝酸银的液氨溶液作用--炔化银 (白色沉淀)
CHCH + 2Ag(NH3)2NO3 AgCCAg + 2NH4NO3 + 2NH3 乙炔银(白色沉淀) RCCH + Ag(NH3)2NO3 RCCAg + NH4NO3 + NH3
(c)炔烃具有酸性,是与烷烃和烯烃比较而言,其酸性比 水还弱.
(d) 甲基,乙烯基和乙炔基负离子的碱性和稳定性
甲基负离子
稳定性 碱性
CH3-
乙烯基负离子
CH2=CH-
CH≡C-
乙炔基负离子
补充:炔烃的制备
•由相应的碳原子数的烯烃为原料合成: (i)CH3C≡CCH2CH3
解:
Br Br
Br2
CH3CH=CHCH2CH3
乙炔与醛酮的亲核加成【补充】
O HC CH + CH3CCH3 KOH
苯/35-40℃
CH3 CH3
OH C-C
OH C-C
CH3 CH3
• 乙炔与二分子甲醛缩合为丁炔二醇; • 乙炔与一分子丙酮进行加成反应可制取甲基炔醇: CH≡CC(OH)(CH3)2,进而反应生成异戊二烯(橡胶 单体)。
4.4.3 氧化反应 (1) CHCH RCCR`
CH3CH-CHCH2CH3
KOH C2H5OH, CH3C CCH2CH3
(1) 生成炔化钠和烷基化反应 •与金属钠作用 CHCH Na CHCNa Na NaCCNa • 与氨基钠作用 RCCH + NaNH2 液氨 RCCNa + NH3
•
烷基化反应
CHCNa + C2H5Br
林德拉(Lindlar)催化反应 Lindlar催化剂 —附在碳酸钙(或 BaSO4)上的钯并用 醋酸铅处理.铅盐起降低钯的催化活性,使烯烃不再加氢.
Pd-BaSO4
Lindlar催化剂 C2H5
C2H5-CC-C2H5 + H2
H
C=C
C2H5 H
生成顺式烯烃. •由于乙炔比乙烯容易发生加氢反应 ,工业上可利用此性 质控制 H2 用量,使乙烯中的微量乙炔加氢转化为乙烯.
4.3 炔烃的物理性质 (1) 炔烃的物理性质和烷烃,烯烃基本相似; (2) 低级的炔烃在常温下是气体,但沸点比相同碳原子 的烯烃略高; (3) 随着碳原子数的增加,沸点升高. (4) 叁键位于碳链末端的炔烃(又称末端炔烃)的沸点低 于叁键位于碳链中间的异构体. (5) 炔烃不溶于水,但易溶于极性小的有机溶剂,如石油 醚,苯,乙醚,四氯化碳等.
•互变异构现象,互变异构体.酮-烯醇互变异构现象.
H -C-C=O
-C=C-OH
烯醇式
酮式
(3) 亲核加成—与醇的加成 水解产物? CHCH + CH3OH
KOH
加热,加压
CH2=CH-O-CH3 甲基乙烯基醚
反应历程: • CH3OH + KOH CH3O-K+ + H2O •带负电荷的甲氧基负离子 CH3O-,能供给电子,具有亲近 正电荷(核)的倾向,所以是亲核试剂. •反应首先是由甲氧基负离子攻击乙炔开始. CHCH + CH3O- CH3O-CH=C-H CH3OH CH3O-CH=CH2 + CH3O-
•与氯化亚铜的液氨溶液作用--炔化亚铜
乙炔亚铜(红色沉淀)
(红色沉淀)
CHCH + 2Cu(NH3)2Cl CuCCCu +2NH4Cl + 2NH3
RCCH + Cu(NH3)2Cl RCCCu + NH4NO3 + NH3
注 1—炔化物和无机酸作用可分解为原来的炔烃 .在混合 炔烃中分离末端炔烃. 注 2—重金属炔化物在干燥状态下受热或撞击易爆炸 ,对 不再利用的重金属炔化物应加酸处理.
(5) 总结 •碳碳叁键是由一个 键和两个 键 组成. •键能—乙炔的碳碳叁键的键能是:837 kJ/mol; 乙烯的碳碳双键键能是:611 kJ/mol; 乙烷的碳碳单键键能是:347 kJ/mol. •C-H键长—和p轨道比较, s轨道上的电子云更接近原 子核.一个杂化轨道的s成分越多,则在此杂化轨道上的 电子也越接近原子核.由sp杂化轨道参加组成共价键 , 所以乙炔的 C-H 键的键长 (0.106 nm) 比乙烯 (0.108 nm)和乙烷(0.110nm)的C-H键的键长要短. •碳碳叁键的键长—最短(0.120 nm),这是除了有两个 键,还由于 sp 杂化轨道参与碳碳键的组成.
•含有双键的炔烃在命名时,一般 先命名烯再命名炔 . 碳链编号以表示双键与叁键位置的两个数字 之和最小 为原则. 例如: CH3-CH=CH-C CH 3-戊烯-1-炔 (不叫2-戊烯-4-炔)
• 乙炔的衍生物命名法:
CH3CH2C CCH3
CH2=CH-C CH
1-丁烯-3-炔 乙烯基乙炔
4.4.2 加成反应 (1) 催化加氢 R-CC-R`
Pt,Pd或Ni H2
R-CH=CH-R`
Pt,Pd或Ni H2
R-CH2-CH2-R`
•在 H2 过量的情况下,不易停止在烯烃阶段. •乙炔和乙烯的氢化热 • HCCH + H2 H2C=CH2 氢化热=175kJ/mol H2C=CH2 + H2 H3C-CH3 氢化热=137kJ/mol ——所以,乙炔加氢更容易.
4.4 炔烃的化学性质
•炔烃的主要性质是叁键的加成反应和叁键碳上氢原子的 活泼性(弱酸性).
4.4.1 叁键碳上氢原子的活泼性 (弱酸性)
(a) 叁键的碳氢键由 sp 杂化轨道与氢原子参加组成 共价 键,叁键的电负性比较强,使C-H 键的电子云更靠近碳原 子. 这种 C-H键的极化使炔烃易离解为质子和比较稳定 的炔基负离子 (-CC-). (即:有利于炔C-H异裂形成H+; 烷烃C-H易均裂——如氯取代反应) (b)炔烃H原子活泼,有弱酸性和可被某些金属原子取代.
• 戊炔 的构造异构体: CH2CH2C CH 1-戊炔 CH3CH2C CCH3 2-戊炔
(2) 炔烃的命名 • 系统命名:
CH3CHC CH 3-甲基-1-丁炔 CH3
•炔烃的系统命名法与烯烃相似;以包含叁键在内的最 长碳链为主链,按主链的碳原子数命名为某炔,代表叁 键位置的阿拉伯数字以取最小的为原则而置于名词之 前,侧链基团则作为主链上的取代基来命名.
sp杂化 + 2个p轨道
烯基碳正离子的结构
•乙烯和乙炔的电离势能(1015和1088kJ/mol)也说明了这点.
三键与双键的竞争反应【补充】
机理见后,重排?
(B) 和氢卤酸的加成 例1: R-CC-H + HX R-CX=CH2 + HX R-CX2-CH3 • X=Cl,Br,I.
•比烯烃加成要难.
生成顺式烯烃的条件还 有:Pd-Pb 或 Pd-C
(顺-2-丁烯)
补充:反式加成产物得烯烃
• RCCR’
Na,NH3
R H
C=C
H R'
完成下列反应: 将(Z)-2-戊烯转变为(E)-2-戊烯
(2) 亲电加成 (A) 和卤素的加成 例1. 炔烃与氯,溴加成: HCCH + Cl2 ClCH=CHCl + Cl2 HCCl2-CHCl2 R-CC-R` + X2 RXC=CXR` + X2 R-CX2-CX2-R` —— 炔烃与氯 ,溴加成 ,控制条件也可停止在一分子加成 产物上.
•不对称炔烃的加成反应符合马尔科夫尼科夫规律. 例2: H2C=CH-Cl 氯乙烯 •亚铜盐或高汞盐作催化剂,可加速反应的进行. HCCH + HCl
Cu2Cl2 或HgSO4
** 和烯烃情况相似 , 在光 或 过氧化物存在下 , 炔烃和 HBr的加成也是自由基加成反应,得到是反马尔科夫 尼科夫规律的产物. 炔烃与HBr也有过 氧化物效应! CH3CCH + HBr
(3) 乙炔的键
• C : 2s22p2 2s12px12py12pz1 • 乙炔的每个碳原子还各有两个相互 垂直的未参加杂化的p轨道, 不同碳 原子的p轨道又是相互平行的. • 一个碳原子的两个p轨道和另一个碳原子对应的两 个p轨道,在侧面交盖形成两个碳碳键.
(4) 乙炔分子的圆筒形 电子云 • 杂化轨道理论:两个成键轨道(1, 2),两个反键轨道 (1*, 2*) • 两个成键 轨道组合成了对称分布于碳碳 键键 轴周围的,类似圆筒形状的 电子云.
有机化学 Organic Chemistry
教材:徐寿昌 主编 高等教育出版社
第四章
炔烃 二烯烃 红外光谱
主讲教师:王启宝 教授
wqb@
中国矿业大学(北京)化学与环境工程学院
第四章 炔烃 二烯烃 红外光谱
作业(P94)
2 ( 1 、 3 、 6 、7 ) 3 4( 4、 5、 6) 5(注意第二个反应式 条件Pa改为Pd,最后1步参考 P185) 6、 7、 8( 2) 10(1、2 、3 )注意:(2)将左边的双键改为单键. 11 14 15(补充条件:在标准条件下)。
第四章
炔烃
二烯烃
红外光谱
(一) 炔烃 (alkynes)
定义:分子中含有碳碳叁键的烃叫做炔烃,它的通式: CnH2n-2 官能团为: -CC-
4.1 炔烃的异构和命名 (1)异构体——从丁炔开始有异构体. •同烯烃一样,由于碳链不同和叁键位置不同所引起的.由 于在碳链分支的地方不可能有叁键的存在 , 所以炔烃的 异构体比同碳原子数的烯烃要少. •由于叁键碳上只可能连有一个取代基 ,因此炔烃不存在 顺反异构现象.
