电子式书写练习
高二化学电子式书写复习及对应习题讲解、练习

⾼⼆化学电⼦式书写复习及对应习题讲解、练习学员编号:年级:⾼⼆课时数: 2学员姓名:辅导科⽬:化学学科教师:授课类型T 电⼦式 C 结构式T化学键授课⽇期及时段教学内容引导回顾知识点解题⽅法1.电⼦式书写 1. 熟悉元素周期表及原⼦结构2.结构式 2. 熟悉电⼦式书写3.离⼦化合物与供价化合物 3. 离⼦键和共价键4.化合物形成过程书写 4. 离⼦化合物与供价化合物同步讲解微粒电⼦式书写正确与否的判断⽅法⼀、根据化合物类型判断电⼦式是否正确。
1.离⼦化合物正负电荷的代数和为零,查看阳离⼦、阴离⼦所带电荷数是否相等,相等就有可能正确。
2.阴离⼦和复杂的阳离⼦要⽤中括号括起来。
3.⾮⾦属原⼦周围要符合8电⼦稳定结构(H、B例外)。
4.共价化合物要注意极性共价键的共⽤电⼦对要偏向呈负价的元素,⾮极性共价键共⽤电⼦对在中央,孤对电⼦不要忘。
⼆、注意辨别“根”“基”的区别。
5.“根”中的原⼦⼀般都符合8电⼦稳定结构,“根”是带电荷的;例如:OH-、NH4+。
6.“基”中⾄少有⼀个原⼦是不符合8电⼦稳定结构,“基”是不显电性的,例如:-CH3、-OH 。
三、注意微粒间的排列⽅式。
7.离⼦化合物多离⼦微粒阴阳离⼦交替排列。
8.共价化合物(有机物除外)多原⼦微粒正负价原⼦交替排列。
9.注意:过氧离⼦和过氧原⼦团不能拆开。
四、中学理科学⽣化学必会的电⼦式如下:1.原⼦的电⼦式:H、C、N、O、Na、Mg、Al、S、Cl。
2.离⼦的电⼦式:O2-、O22-、S2-、Cl-、Na+、Mg2+、Al3+。
3.“基”的电⼦式:-CH3、-CH2CH3、-OH 、-CHO 、-COOH 。
4.“根”的电⼦式:OH-、ClO- 、HCOO-、CH3COO-、NH4+。
5.单质分⼦的电⼦式:H2、Cl2、N2、(CN)2。
6.共价化合物的电⼦式:(1)氢化物:HCl 、H2O 、NH3、CH4 、C2H4、C2H4 。
(2)氧化物:CO2 、H2O2 。
30中学电子式训练

电子式如下:高一电子式训练1.原子的电子式:H 、C 、N 、O 、Na 、Mg 、Al 、S 、Cl 。
2.离子的电子式:O 2-、O -22、S 2-、Cl -、Na +、Mg 2+、Al 3+。
3.“基”的电子式:-CH 3 、-CH 2CH 3 、-OH 、-CHO 、-COOH 。
4.“根” 的电子式:OH - 、ClO - 、HCOO - 、CH 3COO - 、NH +4。
5.单质分子的电子式:H 2 、Cl 2 、N 2、(CN)2。
6.共价化合物的电子式:(1)氢化物:HCl 、H 2O 、NH 3 、CH 4 、C 2H 4 、C 2H 4 。
(2)氧化物:CO 2 、H 2O 2 。
(3)酸:HCOOH 、CH 3COOH 、H 2CO 3 、HClO 、H 3PO 4 、H 2SO 4 。
7.离子化合物的电子式: (1)氢化物:NaH 、CaH 2 。
(2)氧化物:Na 2O 、Na 2O 2 、MgO 、Al 2O 3。
(3)碱:NaOH 、Ba(OH)2 。
(4)盐:NaOH 、CaCl 2 、Na 2S 、NH 4Cl 、(NH 4)2S 、HCOONa 、CH 3COONa 、NaClO 、Ca(ClO)2 。
(5)类盐:CaC 2 、 Mg 3N 2 。
1、 原子的电子式:H 、C 、N 、O 、Na 、Mg 、Al 、S 、Cl 。
2、 离子的电子式:O 2-、O -22、S 2-、Cl -、Na +、Mg 2+、Al 3+。
[ ]2-[ ]2-[ ]2-[ ]- Na + Mg 2+ Al 3+3、“基”的电子式:-CH 3 、-CH 2CH 3 、-OH 、-CHO 、-COOH 。
H H H H H H4、“根” 的电子式:OH - 、ClO - 、HCOO - 、CH 3COO - 、NH +4。
H H [ ]-[ ]-[ ]-[ ]-[ ]+ H H 5、单质分子的电子式:H 2 、Cl 2 、N 2、(CN)2。
高三专项训练——电子式的书写方法和训练(2020年整理).pptx

①N2
②NH3
—CHO
③H2S
④KCl
⑤CaF2
⑥Na2S
⑦CaO
⑧Na3N
⑨HF
⑩CO2
学海无 涯
【练习 7】
物质 H2
电子式
结构式 空间构型 物质 电子式
直线型
N2
结构式 空间构型 直线型
F2
直线型 HCl
直线型
CH4
正四面体 C2H4
平面型
C2H2
直线型 NH3
三角锥型
H2O
V型
H2S
V型
CO2
..
..
. . ..
Cl2::C..l C..l::C.l.:C..l:
练习
写出练习 1~6 的电子式,含共价键的还有写出结构式: 【练习 1】
H
He
Na Mg
Al
Si
P
【练习 2】 Na+ 、Mg2+、Al3+ 、K+、Ca2+、 H+ 、
+
NH4
+
CH3
S
Cl
Ne
N5+(提示:线状结构)
H3O+
学海无涯
高三化学专项复习——电子式书写规则
玉田一中 江璐
在元素符号周围用“·”和“×”来表示原子的最外层电子(价电子),这种式子叫做电子式。 一、原子和离子的电子式
1. 原子的电子式 由于中性原子既没有得电子,也没有失电子,所以书写电子式时应把原子的最外层电子全部排列在元
素符号周围。排列方式为在元素符号上、下、左、右四个方向均匀对称排列,每个方向不能超过 2 个电子。
..
Na [:O. .:]2 Na 。
学海无 涯
化合物的形成过程
形成用“→”表示,形成之前为原子的电子式并用弯箭头表示电子得失,形成之后为离子化合物的电子
电子式的书写方法和训练题组(A4版)

电子式书写规则在元素符号周围用“·”和“×”来表示原子的最外层电子(价电子),这种式子叫做电子式。
1. 原子的电子式由于中性原子既没有得电子,也没有失电子,所以书写电子式时应把原子的最外层电子全部排列在元素符号周围。
排列方式为在元素符号上、下、左、右四个方向均匀对称排列,每个方向不能超过2个电子。
例如: 2. 阳离子的电子式①金属原子在形成最高价阳离子时,最外层电子已经失去,但电子式仅画出最外层电子,所以在画阳离子的电子式时,就不再画出原最外层电子,但离子所带的电荷数应在元素符号右上角标出。
所以金属阳离子的电子式即为离子符号。
如钠离子的电子式为Na +;镁离子的电子式为Mg 2+. ②非金属元素形成的简单阳离子只有氢离子,表示为H +。
③非金属元素形成的阳离子只有铵根离子:3. 阴离子的电子式 ①简单阴离子最外层一般都达到了稀有元素的稳定结构。
一般非金属原子在形成阴离子时,得到电子,使最外层达到稳定结构,这些电子都应画出,并将符号用“[]”括上,右上角标出所带的电荷数,电荷的表示方法同于离子符号。
例如,[:]H -、[:..:]..F -、[:..:]..S 2-。
②常见的几种复杂阴离子(含共价键)的电子式:应把符号用“[]”括起来,右上角标出电荷数。
例如,氢氧根离子:[:..:]..O H -4. 共价化合物的电子式共价化合物是原子间通过共用电子对结合而成的。
书写时将共用电子对画在两原子之间,每个原子的未成对电子和孤对电子也应画出。
因不同元素原子吸引电子能力不同,则共用电子对偏向吸引电子能力强的原子,而偏离吸引电子能力弱的原子。
例如,H Cl :..:..、:..:..:....Cl Cl 。
5. 离子化合物的电子式先根据离子电子式的书写方法,分别画出阴、阳离子的电子式,然后让阴、阳离子间隔排列,注意相同离子不能合并。
例如,NaCl 、MgCl 2、Na 2O 的电子式分别为Na Cl +-[:..:]..、[:..:][:..:]....Cl Mg Cl -+-2、Na O Na +-+[:..:]..2。
电子式的书写方法和训练题组

桂林十八中廖玲秀电子式书写规则在元素符号周围用“·”和“×”来表示原子的最外层电子(价电子),这种式子叫做电子式。
1. 原子的电子式由于中性原子既没有得电子,也没有失电子,所以书写电子式时应把原子的最外层电子全部排列在元素符号周围。
排列方式为在元素符号上、下、左、右四个方向均匀对称排列,每个方向不能超过2个电子。
例如:2. 阳离子的电子式①金属原子在形成最高价阳离子时,最外层电子已经失去,但电子式仅画出最外层电子,所以在画阳离子的电子式时,就不再画出原最外层电子,但离子所带的电荷数应在元素符号右上角标出。
所以金属阳离子的电子式即为离子符号。
如钠离子的电子式为Na +;镁离子的电子式为Mg 2+.②非金属元素形成的简单阳离子只有氢离子,表示为H+。
③非金属元素形成的阳离子只有铵根离子:④特殊低价阳离子:Pb2+的电子式为:3. 阴离子的电子式①简单阴离子最外层一般都达到了稀有元N F ClM AlHHHH素的稳定结构。
一般非金属原子在形成阴离子时,得到电子,使最外层达到稳定结构,这些电子都应画出,并将符号用“[]”括上,右上角标出所带的电荷数,电荷的表示方法同于离子符号。
例如,[:]H -、[:..:]..F -、[:..:]..S 2-。
②常见的几种复杂阴离子(含共价键)的电子式:应把符号用“[]”括起来,右上角标出电荷数。
例如,氢氧根离子:[:..:]..O H -4. 共价化合物的电子式共价化合物是原子间通过共用电子对结合而成的。
书写时将共用电子对画在两原子之间,每个原子的未成对电子和孤对电子也应画出。
因不同元素原子吸引电子能力不同,则共用电子对偏向吸引电子能力强的原子,而偏离吸引电子能力弱的原子。
例如,H Cl :..:..、:..:..:....Cl Cl 。
5. 离子化合物的电子式先根据离子电子式的书写方法,分别画出阴、阳离子的电子式,然后让阴、阳离子间隔排列,注意相同离子不能合并。
书写电子式练习
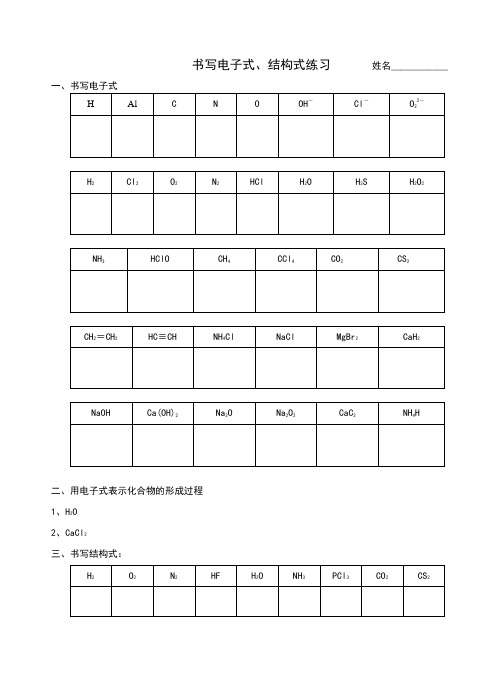
书写电子式、结构式练习姓名____________二、用电子式表示化合物的形成过程1、H2O2、CaCl2三、书写结构式:如何正确书写电子式对于电子式的书写和判断正误是高考试题中常涉及到的一个知识点,现将不同粒子的电子式的书写方法总结如下: 1.原子的电子式①书写方法:首先写出其元素符号,再在元素符号周围用“· ”或“×”标出它的 最外层电子②例子:钠原子 ;镁原子 ;氟原子 2.离子的电子式(1)简单阳离子的电子式①书写方法:用该阳离子的离子符号表示②例子:钠离子 Na + ;镁离子 Mg 2+ ;钡离子 Ba 2+(2)简单阴离子的电子式①书写方法:不但要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:硫离子 ;氟离子 (3)原子团的电子式①书写方法:不仅要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:铵根离子 ;氢氧根离子 3.单质分子的电子式①书写方法:对于以共价键作用结合成的非金属单质分子,他们的电子式由对应原子的电子式组合而成,但同时要表示出共用电子对数;而对其他(金属单质、稀有气体单质等)则一律用原子的电子式表示②例子:氢气分子 ;氧气分子③技巧:可以根据非金属单质中各原子最外层都要达到8电子稳定结构(He 除外),来确定非金属单质中的共用电子对数4.化合物的电子式(1)离子化合物的电子式①书写方法:离子化合物的电子式由阴、阳离子的电子式组合而成, 但相同的离子不能合并②例子:NaCl 的电子式为 ;K 2S 的电子式为 ,(不能写成 ) (2)共价化合物的电子式①书写方法:共价化合物的电子式由对应原子的电子式组成,并要表示出 两原子之间的共用电子对情况②例子:HCl 的电子式为 ;CO 2的电子式: F N H H H H F S 2–Cl Na +Na Mg H H O O K + S 2– K + Cl H C O OK 2+S2– O –H③技巧:一般共价化合物中各元素的化合价的绝对值就是该元素原子形成的 共用电子对数5.用电子式表示物质的形成过程 如:H 2的形成过程 +NaCl 的形成过程 +K 2S 的形成过程 2 +注意:①用“ → ”表示形成过程,不用“=”;②“ → ”左边是形成该物质的所有原子的电子式,相同的原子可以合并,“ → ”右边是该物质的电子式, 相同的原子不可以合并中学化学中常见的电子式大全原子 离子单质分子H H H H Na Cl Cl Na +K S S 2– K + K +形成过程。
课后强化作业:(电子式练习)

课后强化作业:(电子式练习)
一、原子的电子式:
1、原子的电子式书写要求:
2、写出下列原子的电子式:氢原子:锂原子:铍原子:硼原子:
碳原子:氮原子:氧原子:氟原子:钠原子:
镁原子:铝原子:硅原子:磷原子:硫原子:
氯原子:钾原子:钙原子:
二、简单离子的电子式
1、简单阳离子:
书写要求:
写出阳离子的电子式:锂离子:钠离子:镁离子:铝离子
2、简单阴离子:
书写要求:
写出阴离子的电子式:氮离子:氧离子:氟离子:硫离子:氯离子:
三、物质的电子式
1、气体单质分子:氢气:氯气:氧气:氮气:
2、共价化合物分子:氯化氢:水:氨气:甲烷:二氧化碳:
次氯酸:过氧化氢:四氯化碳:
(特别强化)复杂离子:氢氧根离子:氨根离子:过氧根离子:
3、离子化合物:氯化钠:硫化钠:氯化镁;氯化氨:
过氧化钠:氢氧化钠:碳化钙:
四、写出下列物质的形成过程:
氯气:
氯化氢:
氯化钠:
氯化镁:硫化钠:。
(完整版)电子式的书写

电子式的书写
一、表示原子
二、表示分子(技巧:先写出结构式,再改为电子式。
)
Cl2:Cl-Cl→;O2:O=O→;N2:→
HF:H―F→;H2O:H―O―H→;NH3:→;CH4:
→
HClO:H―O―Cl→;CO2:O=C=O→;HCN:→
;H2O2:H―O―O―H→;H2CO3:→。
三、表示基
―OH:;―CH3:;―CHO:。
四、表示离子
Na+、Mg2+、Al3+、、、、、。
五、表示离子化合物
CaCl2与CaC2形似而神不似。
像CaCl2、Mg3N2、Al2O3等非金属原子间无非极性键,而CaC2、Na2O2、CaO2等非金属原子间存在非极性键。
CaCl2:;CaC2:
六、表示化合物的形成过程
常见的错误表示的电子式
N2:(不形成共价键的电子应为孤电子对)、(共用电子对表示方法错误)、(遗漏孤电子对)。
不真实的CO2:(未形成共用电子对)。
HClO:(Cl与O之间未形成共用电子对)。
H2O:(H2O是共价化合物)。
NH4Cl:(Cl―未写成电子式)。
CaCl2:(电子式都是以原子为基本单位组成的,不能出现角码),
(带相反电荷的离子要相邻)。
