医疗器械检测资格认可范围及限制要求
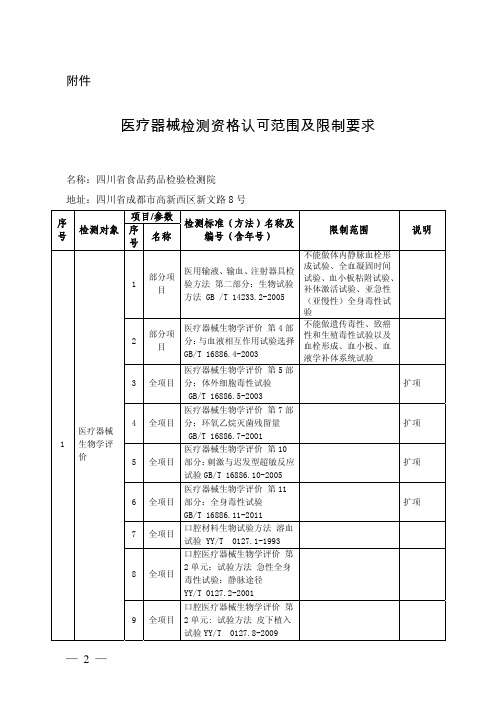
医疗器械检测资格认可范围及限制要求
医用有机硅材料生物学评价试验方法GB/T16175-2008
2
医疗器械及医用材料
31
急性全身毒性
医用输液输血、注射器具检验方法 第2部分:生物学试验法GB/T14233.2-2005
医疗器械生物学评价 第11部分:全身毒性试验GB/T16886.11-1997
35
细菌内毒素试验
医用输液输血、注射器具检验方法 第2部分:生物学试验法GB/T14233.2-2005
医疗器械生物学评价 第11部分:全身毒性试验GB/T16886.11-1997
《中国药典》2010年版
36
无菌试验
医用输液、输血、注射器具检验方法 第二部分:生物试验法GB/T14233.2-2005
医用输液输血、注射器具检验方法 第2部分:生物学试验法B/T14233.2-2005
口腔材料生物学评价 第2单元:口腔材料生物试验方法 皮下植入试验YY/T 0127.8-2001
23
皮内反应试验
医用输液输血、注射器具检验方法 第2部分:生物学试验法GB/T14233.2-2005
医疗器械生物学评价 第10部分:刺激与迟发型超敏反应试验GB/T16886.10-2005
口腔医疗器械生物学评价第2单位:试验方法急性全身毒性试验:静脉途径 YY/T 0127.2-2009
口腔材料生物实验方法 短期全身毒性试验:经口途径 YY/T 0244-1996
医用有机硅材料生物学评价试验方法GB/T16175-2008
32
亚急性全身毒性
医疗器械生物学评价 第11部分:全身毒性试验 GB/T16886.11-1997
医疗器械检测资格认可范围及限制要求
GB/T 16175-2008
口腔医疗器械生物学评价第2单元:试验方法哺乳动物细胞体外染色体畸变试验YY/T 0127.16-2009
口腔医疗器械生物学评价第2单元:试验方法微核试验YY/T 0127.12-2008
口腔医疗器械生物学评价第2单元:试验方法鼠伤寒沙门氏杆菌回复突变试验(Ames试验)YY/T 0127.10-2009
医疗器械生物学评价第12部分:样品制备与参照样品GB/T 16886.12-2005
医疗器械、口腔材料和生物材料的评价和检测
5
热原试验(兔法和细菌内毒素法)
医疗器械生物学评价第11部分:全身毒性试验GB/T 16886.11-1997
医用有机硅材料生物学评价试验方法GB/T 16175-2008
医用输液、输血、注射器具检验方法第二部分:生物试验方法GB/T 14233.2-2005
3
刺激试验
医疗器械生物学评价第10部分:刺激与致敏试验GB/T 16886.10-2005
口腔医疗器械生物学评价第2单元:试验方法口腔粘膜刺激试验YY/T 0127.13-2009
医用有机硅材料生物学评价试验方法
GB/T 16175-2008
医用输液、输血、注射器具检验方法第二部分:生物试验方法GB/T 14233.2-2005
医疗器械检测资格认可范围及限制要求
名称:上海生物材料研究测试中心
地址:上海市局门路427号2号楼201-301
序号
产品名称
项目/参数
检测标准(方法)名称及编号(含年号)
限制范围
及说明
序号
名称
1
医疗器械、口腔材料和生物材料的评价和检测
根据医疗器械监督管理条例及医疗器械检测机构资格认可办法

根据医疗器械监督管理条例及医疗器械检测机构资格认可办法医疗器械监督管理条例是我国医疗器械监管的基本法律,对医疗器械的生产、销售、使用、检测等环节做出了详细规定。
医疗器械检测机构资格认可办法则是对医疗器械检测机构进行资格认定的具体规定。
本文将从医疗器械监督管理条例和医疗器械检测机构资格认可办法两方面展开论述,以期加深对医疗器械监管的理解和认识。
其次,医疗器械监督管理条例还对医疗器械的检测进行了规范。
根据条例,医疗器械的检测必须由具备相应资质的检测机构进行。
医疗器械检测机构必须获得国家药品监督管理局认可,具备相应设备和技术能力,并对检测结果负责。
医疗器械检测机构还需要建立严格的质量管理体系,确保检测的准确性和可靠性。
同时,医疗器械检测机构资格认可办法对医疗器械检测机构的资格认定进行了具体规定。
根据办法,医疗器械检测机构的资格认定分为初次认定和继续认定两个阶段。
初次认定需要提交相关申请材料,并接受资格认定的评审。
评审根据医疗器械检测机构的设备、技术能力、质量管理体系等方面进行评判。
对于初次认定合格的机构,将颁发医疗器械检测机构资格认定证书。
继续认定则需要定期进行,评价标准和程序与初次认定类似。
综上所述,医疗器械监督管理条例和医疗器械检测机构资格认可办法共同构成了我国医疗器械监管的法律体系。
通过这些法规,我们可以确保医疗器械的生产、销售和使用环节遵循规范,保障医疗器械的质量和安全。
医疗器械检测机构资格认可办法则为医疗器械检测机构提供了明确的认证流程和评价标准,加强了对检测机构的管理和监督。
这些法规和制度的实施,有助于促进医疗器械行业的健康发展,保障公众的健康和安全。
[VIP专享]广东省医疗器械质量监督检验所医疗器械检测资格认可范围及限制要求
![[VIP专享]广东省医疗器械质量监督检验所医疗器械检测资格认可范围及限制要求](https://img.taocdn.com/s3/m/1adeb3e0a417866fb94a8e8c.png)
扩项
43m1m“-”J520Gm01m24“492k-Z(1)g2L3-”3060@k%3-g“/1”7mD2%BJ/Tg0d1-ZP318¬-A_2"o70)Xc0?y258z6n”217 NE)
可视性多功能宫内取环
11
1 全部参数
器
可视性多功能宫内取环器 YZB/粤 1308-2011
扩项
12 硬性气管内窥镜
3
1 全部参数
肤治疗仪
激光产品的安全 第 1 部分:设备分 类、要求 GB 7247.1-2012
激光产品的安全 第 14 部分:用户 指南 GB/T 7247.14-2012 激光治疗设备 半导体激光光动力治 疗机 YY 0845-2011 308nm 准分子紫外光皮肤治疗仪 YZB/粤 0130-2010
标准变更
标准变更 扩项 扩项 扩项
—5—
项目/参数
序
号
检测对象
1 全部参数
合器
一次性使用镜下切割吻合器 YZB/ 粤 0618-2012
扩项
Ⅱ 眼科手术器械(6804)
1 泪道探针
1 全部参数
泪道探针 YY 0075-2005
扩项
43m1m“-”J520Gm01m24“492k-Z(1)g2L3-”3060@k%3-g“/1”7mD2%BJ/Tg0d1-ZP318¬-A_2"o70)Xc0?y258z6n”217 NE)
Ⅴ 注射穿刺器械(6815)
一次性使用动静脉内瘘
1
1 全部参数
穿刺针
2 一次性使用套管穿刺针 1 全部参数
一次性使用动静脉穿刺
3
1 全部参数
针
一次性使用动静脉内瘘穿刺针 YZB/ 国 1189-2011 一次性使用套管穿刺针 YZB/粤 0588-2008 一次性使用动静脉穿刺针 YZB/国 0218-2011
(局发文式样)---国家食品药品监督管理总局

扩项
18
激光焊接材料
1
化学成分(Ga Rh Ge Au Pb In Li Co Sn Ir Pd Pt Mn Ag Be Na Zn Cd Ba Ca Fe Ni Cu Cr Mo Ti)
牙科学 激光焊接
ISO 28319:2010
扩项
19
金属材料
1
金属材料腐蚀试验方法
磷矿石和磷精矿中氧化钙含量的测定容量法GB/T 1871.4-1995
不能测羟基磷灰石含量
扩项
2
红外吸收谱
14
羟基磷灰石生物陶瓷
1
微量杂质元素及重金属元素含量极限(Cd Pb As)
羟基磷灰石生物陶瓷
YY 0305-1998
磷矿石和磷精矿中五氧化二磷含量的测定磷钼酸喹啉重量法和容量法GB/T 1871。1-1995
附件
医疗器械检测资格认可范围及限制要求
名称:国家食品药品监督管理局北大医疗器械质量监督检验中心
地址:北京市海淀区中关村南大街22号
序号
产品
名称
项目/参数
检测标准(方法)名称
及编号(含年号)
限制范围及说明
序号
名称
1
牙科学义齿基托聚合物(义齿基托树脂)
1
未聚合的材料-液剂成分
牙科学 基托聚合物 第1部分:义齿基托聚合物
磷矿石和磷精矿中氧化钙含量的测定容量法GB/T 1871。4—1995
不能测相成分及结晶度
扩项
2
红外吸收谱
15
种植体附件
(基台、螺钉、愈合帽、上部结构、牙龈成型器)
1
化学成分(Ga Rh Ge Au Pb In Li Co Sn Ir Pd Pt Mn Ag Be Na Zn Cd Ba Ca Fe Ni Cu Cr Mo C H O N S Ti )
中检所认可的检测机构能力范围
YZB/国723-46-2004钛合金异型接骨板
化学成分、表面缺陷、点蚀电位不能测
14
外科植入物--接骨板弯曲强度和刚度测定
全项目
YY 0342-2002外科植入物接骨板弯曲强度和刚度测定
15
骨水泥
全项目
YZB/国0876-2003复合型骨水泥
16
可降解骨钉、骨板
全项目
YZB/国1502-2003可吸收骨折内固定螺钉
YY/T0268-1995牙科学用于口腔的医疗器械生物相容性临床前评价:第一单元评价与实验项目选择YY/T0279-1995口腔材料生物试验方法:口腔粘膜试验
104
血浆管路
全项目
YY 0326.2 -2002一次性使用离心式血浆分离器
第二部分:血浆管路
105
一次性使用白细胞滤器
全项目
YY0329-2002一次性使用白细胞滤器
60
心肌保护液灌注管
全项目
YZB/USA 1967-2003心肌保护液灌注管
61
主动脉灌注管
全项目
YZB/USA 0669-2003主动脉灌注管
62
医用输液、输血、注射器具聚乙烯专用料
部分项目
YY 0114-1993医用输液、输血、注射柒聚乙烯专用料
熔融指数、弯曲模量、悬臂梁冲击强度不能测
63
输血(液)器具用软聚氯乙烯塑料
84
敷料创伤材料
全项目
YZB/苏0470-2003皮部创面无机诱导活性敷料
85
医用缝合针
部分项目
YY0043-1991医用缝合针
硬度不能测
86
带线缝合针
部分项目
YY0166-2002带线缝合针
医疗器械检测机构资格认可办法(试行)

医疗器械检测机构资格认可办法(试行)第一章总则第一条为了保证医疗器械检测机构工作的规范性、公正性和科学性,根据《医疗器械监督管理条例》的规定,制定本办法。
第二条国家药品监督管理局负责医疗器械检测机构资格的认可工作和监督管理工作。
第三条国家药品监督管理局依据GB/T15481-2000《校准和检验实验室能力的通用要求》对医疗器械检测机构的质量体系和运行能力进行认可。
第四条国家药品监督管理局根据《医疗器械监督管理条例》及相关配套规章、医疗器械通用和专用安全要求标准以及产品标准确定医疗器械检测机构的医疗器械受检目录。
各医疗器械检测机构必须在确定的医疗器械受检目录范围内开展检测工作。
第五条国家药品监督管理局的职责:(一)组织对医疗器械检测机构资格认可评审员的培训及资格评定,建立医疗器械检测机构资格认可评审员专家库;(二)受理医疗器械检测机构资格认可申请。
组织对申请资格认可的医疗器械检测机构进行评审;(三)组织或委托对资格认可后的医疗器械检测机构进行监督和复审。
根据监督或复审结果做出维持认可、限期改正、撤销认可或变更认可范围的决定;(四)受理对医疗器械检测机构资格认可工作和对资格认可的医疗器械检测机构检测工作的申诉。
第二章认可条件和认可程序第六条医疗器械检测机构资格认可条件:(一)医疗器械检测机构应是具有法人资格的专职检测机构;(二)已获得计量认证证书。
具有按GB/T15481-2000《校准和检验实验室能力的通用要求》进行质量体系运行的能力;(三)具备受检目录内医疗器械的检测能力,检测设备配备率不低于95%,并按标准或相应的指导检测实施的技术性文件,作模拟运转,建立并保存原始记录和检验报告;(四)符合《医疗器械检测机构评审细则表》(附后〔略〕)的要求;(五)遵守本办法中的有关规定。
第七条申请资格认可的医疗器械检测机构(以下简称申请方)可向国家药品监督管理局提交意向申请并可咨询有关认可事宜。
国家药品监督管理局向申请方提供最新版本的认可规则和其他有关认可要求的文件。
根据医疗器械监督管理条例及医疗器械检测机构资格认可办法

根据医疗器械监督管理条例及医疗器械检测机构资格认可办法医疗器械监督管理条例介绍与医疗器械检测机构资格认可办法随着医疗技术的不断发展与进步,医疗器械在医疗行业中发挥着重要的作用。
然而,医疗器械的安全性与有效性是保障患者生命健康安全的核心。
为了规范和加强医疗器械的监管工作,我国制定了医疗器械监督管理条例,并制定了医疗器械检测机构资格认可办法。
本文将深入介绍医疗器械监督管理条例的相关内容以及医疗器械检测机构资格认可办法的具体要求。
一、医疗器械监督管理条例医疗器械监督管理条例是我国针对医疗器械管理所制定的法规,旨在加强对医疗器械的生产、销售、使用等环节的监督与管理,确保医疗器械的安全性和有效性。
该条例于2014年6月开始施行,对医疗器械的监督管理起到了重要的法律支撑作用。
医疗器械监督管理条例主要包括以下几个方面的内容:1. 定义和分类:明确了医疗器械的定义,并将其分为三个类别,分别是一类、二类和三类医疗器械。
不同类别的医疗器械在注册、备案、监督等方面要求也有所不同。
2. 注册与备案:对于一类和二类医疗器械,要求生产和经营者必须进行注册备案,以确保其品质可靠、安全有效。
3. 临床试验与评价:针对新的医疗器械产品,要求进行临床试验和评价,确保其安全性和有效性。
4. 监督与管理:明确了医疗器械监督管理的责任部门和职责,包括对医疗器械生产、销售、使用环节进行监督,对不符合要求的医疗器械进行召回、停产等处理措施。
5. 法律责任:对于违反医疗器械监督管理条例的行为,明确了相关的法律责任和处罚措施。
二、医疗器械检测机构资格认可办法为了确保医疗器械的安全可靠,医疗器械检测机构起到了重要的作用。
医疗器械检测机构资格认可办法是我国对医疗器械检测机构进行认可和管理的规定,为推动医疗器械检测的质量提升和标准化发展提供了指导。
医疗器械检测机构资格认可办法主要包括以下几个方面的内容:1. 机构资质要求:规定医疗器械检测机构必须具备合格的检测设备、仪器和设施,同时要求检测人员具备相关的专业知识和技能。
医疗器械检测资格认可范围及限制要求1

医疗器械检测资格认可范围及限制要求摘要医疗器械的使用是与人类健康息息相关的,因此,医疗器械的安全性、有效性和质量是必须保障的。
对于医疗器械检测实验室,必须具备相应的检测资格认证,以确保检测结果的准确性和可靠性,从而保证其检测结果的真实性和可信性。
本文主要介绍了医疗器械检测资格认可的范围及限制要求。
一、医疗器械检测资格认可的范围医疗器械检测资格认可的范围包括检测实验室、检测人员、检测方法、检测设备等。
在进行医疗器械检测资格认证时,需要对检测实验室、检测人员等进行审核,并要求其满足特定的认证标准和要求,以确保其通过了认证后能够独立完成医疗器械检测工作。
1. 检测实验室医疗器械检测实验室需要经过国家相关机构的认证审核,包括但不限于:国家食品药品监督管理总局、中国合格评定国家认可委员会等。
审核主要针对实验室的检测能力、人员素质、设备、质量保障体系等方面。
实验室需要具备完善的质量管理体系和文件管理系统,建立健全的校准和检验体系,对设备进行定期检验和校准,维护设备的正常运转状态。
实验室还需要建立规范的实验室环境,包括通风、照明、温湿度等。
2. 检测人员医疗器械检测人员需要具备相关的资格认证和培训,确保其具备足够的检测技能和专业知识。
相关的认证机构主要有国家高级资格认证机构、中国合格评定国家认可委员会、国家食品药品监督管理总局等。
为确保检测人员的工作能力和素质,相关的认证机构会对检测人员的进行考核和审核,包括考核其理论知识、实验技能和操作规范等,同时也会对检测人员的聘用合同、福利待遇等进行审核和评估。
3. 检测方法医疗器械检测方法是指从医疗器械性能、安全性、有效性等多个方面进行检测的方法。
检测方法主要包括定性和定量两种。
定性测试主要用于评价医疗器械的性能、安全性等方面,例如耐冲击性测试、耐高温测试等。
定量测试主要用于评估医疗器械的定量特性,例如医疗器械的准确性、重复性、灵敏度等。
检测人员需要按照标准化流程进行检测,并记录检测结果。
医疗器械检测资格认可范围及限制要求-医疗器械技术审评中心
常规生化复合定值质控品
全部参数
常规生化复合定值质控品
YZB/粤0707-2010
91
肌酸激酶同工酶校准品
全部参数
肌酸激酶同工酶校准品
YZB/粤0712-2010
92
肌酸激酶同工酶质控品
全部参数
肌酸激酶同工酶质控品
YZB/粤0706-2010
93
乙型肝炎病毒表面抗原诊断试剂盒(酶联免疫法)
全部参数
人工心肺机体外循环管道YY 1048-2007
24
敷布生产用非织造布
全部参数
医用非织造敷布试验方法第1部分:敷布生产用非织造布YY/T 0472.1-2004
25
成品敷布
全部参数
医用非织造敷布试验方法第2部分:成品敷布YY/T 0472.2-2004
26
石膏绷带
全部参数
石膏绷带粉状型YY/T 1117-2001
47
一次性使用静脉采血针
全部参数
一次性使用静脉采血针
YZB/国3285-2011
48
一次性使用聚乙烯薄膜手套
全部参数
一次性使用聚乙烯薄膜手套
YZB/粤惠0001-2009
49
中心静脉导管包
全部参数
中心静脉导管包
YZB/国0238-2010
50
一次性使用压力传感器
全部参数
一次性使用压力传感器
YZB/粤0012-2009
全部参数
可控射频消融电极导管
YZB/国0210-2009
41
一次性使用引流导管包
全部参数
一次性使用引流导管包
YZB/国1730-2009
42
改性甲壳素生物修复膜
医疗器械检测资格认可范围及限制要求-四川食品药品检验检测院
一次性使
用便携式
一次性使用便携式输注泵 非
23 输注泵 非 1 全项目 电驱动 YY 0451-2010
电驱动
一次性使 24 用静脉输
液针
1 全项目 一次性使用静脉输液针 GB 18671-2009
—4—
限制范围
说明
标准变更 标准变更 扩项 标准变更
标准变更
序 号
项目/参数
针
一次性使
用无菌注 17
射器用活
一次性使用无菌注射器用活 1 全项目
塞 YY/T 0243-2003
塞
一次性使 18
用输液器
一次性使用输液器 重力输液 1 全项目
式 GB 8368-2005
一次性使
专用输液器 第 1 部分:一次
19 用精密过 1 全项目 性使用精密过滤输液器
滤输液器
YY 0286.1-2007
YY 0326.3-2005
一次性使 29 用机用采
血器
一次性使用机用采血器 1 全项目
YY 0328-2002
一次性使 30 用去白细
胞输血器
一次性使用去白细胞输血器 1 全项 用血细胞
附件
医疗器械检测资格认可范围及限制要求
名称:四川省食品药品检验检测院
地址:四川省成都市高新西区新文路 8 号
序 号
项目/参数
检测对象 序 号
名称
检测标准(方法)名称及 编号(含年号)
限制范围
说明
不能做体内静脉血栓形
医用输液、输血、注射器具检 成试验、全血凝固时间
1
部分项 目
验方法 第二部分:生物试验
9 全项目 2 单元: 试验方法 皮下植入
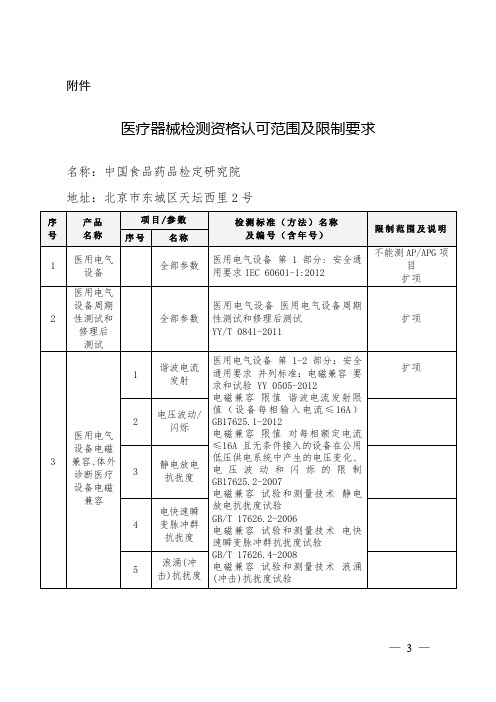
北京医疗器械检测资格认可范围及限制要求
扩项
32
医用超声诊断设备
1
全部参数
超声声场特性确定医用诊断超声场热和机械指数的试验方法
YY/T 0642-2013
扩项
2
全部参数
B型超声诊断设备性能试验方法配接腔内探头YY/T 0906-2013
扩项
33
眼科仪器
全部参数
Ophthalmic instruments-Fundamental requirements and test methods-Part 2:Light hazard protection
扩项
74
脑电生物反馈仪
全部参数
脑电生物反馈仪YY 0903-2013
扩项
75
气腹机
全部参数
医用电气设备内窥镜功能供给装置气腹机YY 0843-2011
扩项
76
眼科高频超声诊
断仪
全部参数
眼科高频超声诊断仪YY 0849-2011
扩项
77
心脏射频消融治疗设备
全部参数
心脏射频消融治疗设备
YY 0860-2011
2
全部参数
超声洁牙设备输出特性的测量和公布YY/T 0751-2009
扩项
55
牙科手机
1
全部参数
牙科手机牙科低压电动马达
YY 0836-2011
扩项
2
全部参数
牙科手机牙科气动马达
YY 0837-2011
扩项
56
牙科综合治疗台
全部参数
牙科学病人椅YY 0949-2012
扩项
57
医用微波设备附件
全部参数
医疗器械检验机构资质认定条件

医疗器械检验机构资质认定条件医疗器械检验机构是负责对医疗器械进行安全性、有效性及质量的检验和评估的机构,对医疗器械的质量管理起到了至关重要的作用。
为了确保医疗器械检验机构具有独立、公正、专业和可信赖的能力,各国都制定了一系列的资质认定条件。
以下为医疗器械检验机构资质认定条件的一般要求:1.法律法规要求:医疗器械检验机构必须遵守相关的法律法规,包括医疗器械监督管理法、医疗器械产品注册管理办法等。
同时,机构的人员必须具备相关的法律法规知识,能够进行合规检验。
2.机构管理要求:医疗器械检验机构必须建立科学、规范的管理制度,包括人员管理、设备管理、质量管理等。
机构必须设立独立的质量管理部门,负责制定和实施相关的质量管理制度和流程。
3.人员要求:医疗器械检验机构必须拥有一支具备相关背景和技能的检验人员队伍。
检验人员必须具备相关的医学、工程、生物或化学等专业背景,并且具备相关的培训和资质认证。
他们必须具备良好的职业道德和专业素养。
4.设备要求:医疗器械检验机构必须配备先进的、准确可靠的检验设备和仪器。
设备必须具备相应的技术指标和检测标准,并且定期进行校准和检验,以确保其准确性和稳定性。
5.检验能力要求:医疗器械检验机构必须具备检验各类医疗器械的能力。
这包括对医疗器械的物理性能、生物相容性、电磁兼容性、安全性等方面进行检验。
同时,检验机构还应具备独立编写、发布和修订检验标准的能力。
6.质量管理要求:医疗器械检验机构必须建立完善的质量管理体系,包括文件控制、记录管理、不合格品管理、纠正措施和预防措施等。
机构必须接受内外部的审计和评估,确保质量管理体系的有效性。
7.法定职责要求:医疗器械检验机构必须具备法定职责,能够向政府部门和社会公众提供必要的医疗器械检验服务。
机构必须具备独立性、公正性和保密性,不能受到政治、经济或其他非专业因素的影响。
8.国际认可要求:医疗器械检验机构应积极参与国际交流合作,并争取与国际相关机构的合作和认可。
医疗器械检测要求

医疗器械检测要求
本文档旨在提供医疗器械检测的要求和指导。
以下是医疗器械
检测的一些重要要求:
1. 设备检测要求:
- 所有医疗器械都需要进行安全性和有效性的检测。
- 检测应根据国家标准和法规进行,并应由资质认可的实验室
进行。
- 检测项目应包括但不限于:材料与构造安全性、电气安全性、生物相容性、功能性能、耐久性。
2. 检测报告要求:
- 检测报告应详细记录测试方法、结果和结论。
- 报告必须提供实验室的名称、地址和资质证明。
- 报告中的数据和结果必须准确、可靠,并配有相关的图表和
图像。
3. 法规要求:
- 医疗器械的生产和销售必须符合相关的法规要求。
- 检测过程和结果应符合国家标准和法规,并获得法定机构的认可。
4. 临床试验要求:
- 对于需要进行临床试验的医疗器械,必须在符合伦理审查的前提下进行。
- 临床试验应具有科学性、有效性,并收集充分的试验数据。
以上是医疗器械检测的一些基本要求和指导,其目的是确保医疗器械的安全性和有效性。
在进行检测时,请遵守相关的法规和标准,并选择合格的实验室进行检测。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
冠状动脉支架
全部参数
冠状动脉支架YZB/国0918-2008
37
腔静脉滤器
全部参数
腔静脉滤器YZB/国4573-2011
38
输送鞘
全部参数
输送鞘YZB/国3428-2011
39
二尖瓣球囊扩张导管配套附件
全部参数
一次性无菌血管内导引导丝、金属延伸器、扩张器YZB/国2766-77-2004
40
可控射频消融电极导管
51
44
纳米银妇女外用抗菌器
全部参数
纳米银妇女外用抗菌器
YZB/粤0329-2003
纳米银妇女外用抗菌器(片型)
YZB/国1312-2006
45
纳米银抗菌医用敷料
全部参数
纳米银抗菌医用敷料
YZB/粤0333-2003
46
一次性使用动、静脉留置针
全部参数
一次性使用动、静脉留置针
YZB/国0598-2006
2
一次性使用避光输液器
全部参数
专用输液器第3部分:一次性使用避光输液器GB 18458.3-2005
3
一次性使用压力输液设备用输液器
全部参数
专用输液器第4部分:一次性使用压力输液设备用输液器YY 0286.4-2006
4
一次性使用吊瓶式和吊袋式输液器
全部参数
专用输液器第5部分一次性使用吊瓶式和吊袋式输液器YY 0286.5-2008
医疗器械检测资格认可范围及限制要求
名称:深圳市医疗器械检测中心
地址:深圳市南山区高新中二道28号
序号
产品名称
项目/参数
检测标准(方法)名称及
编号(含年号)
说明
序号
名称
1
一次性使用精密过滤输液器
全部参数
专用输液器第1部分:一次性使用精密过滤输液器GB 18458.1-2001;
专用输液器第1部分一次性使用精密过滤输液器YY 0286.1-2007
人工心肺机体外循环管道YY 1048-2007
24
敷布生产用非织造布
全部参数
医用非织造敷布试验方法第1部分:敷布生产用非织造布YY/T 0472.1-2004
25
成品敷布
全部参数
医用非织造敷布试验方法第2部分:成品敷布YY/T 0472.2-2004
26
石膏绷带
全部参数
石膏绷带粉状型YY/T 1117-2001
石膏绷带粘胶型YY/T 1118-2001
27
腐蚀敏感性
全部参数
小型植入器械腐蚀敏感性的循环动电位极化标准测试方法YY/T 0695-2008
28
医用超声耦合剂
全部参数
医用超声耦合剂YY 0299-2008
29
动脉支架
全部参数
无源外科植入物心脏和血管植入物的特殊要求动脉支架的专用要求YY 0663-2008
硅橡胶外科植入物
全部参数
硅橡胶外科植入物通用要求YY 0334-2002
18
气管插管
全部参数
气管插管第2部分柯尔型(Cole)插管YY 0337.2-2002
19
呼吸道用吸引导管
全部参数
呼吸道用吸引导管YY0339-2009
20
心血管植入物和人工器官血液透析器、血液透析滤过器、血液滤过器和血液浓缩器
33
氧气透过性
氧气透过性
包装材料塑料薄膜和薄片氧气透过性试验库仑计检测法
GB/T 19789-2005
34
水蒸气透过率
水蒸气透过率
塑料薄膜和薄片水蒸气透过率的测定红外检测器法GB/T 26253-2010
35
封堵器
全部参数
房间隔缺损封堵器YZB/国1417-2008
动脉导管未闭封堵器
YZB/国0632-2008
5
一次性使用流量设定微调式输液器
全部参数
专用输液器第6部分:一次性使用流量设定微调式输液器YY0286.6-2009
6
压力输液设备用一次性使用液路及附件:附件
全部参数
压力输液设备用一次性使用液路及附件第2部分:附件YY0585.2-2005
7
压力输液设备用一次性使用液路及附件:过滤器
全部参数
压力输液设备用一次性使用液路及附件第3部分:过滤器
全部参数
心血管植入物和人工器官血液透析器、血液透析滤过器、血液滤过器和血液浓缩器YY 0053-2008
21
一次性使用空心纤维血浆分离器
全部参数
一次性使用空心纤维血浆分离器YY 0465-2009
22
一次性使用机用采血器
全部参数
一次性使用机用采血器YY 0328-2002
23
人பைடு நூலகம்心肺机体外循环管道
全部参数
47
一次性使用静脉采血针
全部参数
一次性使用静脉采血针
YZB/国3285-2011
48
一次性使用聚乙烯薄膜手套
全部参数
一次性使用聚乙烯薄膜手套
YZB/粤惠0001-2009
49
中心静脉导管包
全部参数
中心静脉导管包
YZB/国0238-2010
50
一次性使用压力传感器
全部参数
一次性使用压力传感器
YZB/粤0012-2009
YY0585.3-2005
8
输液用肝素帽
全部参数
输液用肝素帽YY0581-2005
9
输液、输血用硅橡胶管路及弹性件
全部参数
输液、输血用硅橡胶管路及弹性件YY/T 0031-2008
10
一次性使用无菌胰岛素注射器
全部参数
一次性使用无菌胰岛素注射器
YY 0497-2005
11
自毁型固定剂量疫苗注射器
全部参数
一次性使用无菌注射器第3部分:自毁型固定剂量疫苗注射器
YY 0573.3-2005 ISO 7886-3 2005
12
一次性使用无菌注射器活塞
全部参数
一次性使用无菌注射器用活塞YY/T0243-2003
13
一次性使用无菌牙科注射针
全部参数
一次性使用无菌牙科注射针
YY0587-2005
14
非血管内导管
不测磁共振成像(MRI)相容性评价、
可视性
30
麻醉机和呼吸机用呼吸管路
全部参数
麻醉机和呼吸机用呼吸管路
YY 0461-2003
31
锥头与锥套
全部参数
麻醉和呼吸设备圆锥接头第1部分:锥头与锥套YY 1040.1-2003
32
麻醉剂专用灌充系统
全部参数
麻醉蒸发器麻醉剂专用灌充系统
YY 0755-2009
全部参数
非血管内导管第1部分:一般性能试验方法GB T 15812.1-2005
15
一次性使用无菌血管内导管辅件(套针外周导管管塞)
全部参数
一次性使用无菌血管内导管辅件第2部分:套针外周导管管塞YY0450.2-2003
不测射线可探测性
16
软组织扩张器
全部参数
软组织扩张器YY 0333-2002
17
全部参数
可控射频消融电极导管
YZB/国0210-2009
41
一次性使用引流导管包
全部参数
一次性使用引流导管包
YZB/国1730-2009
42
改性甲壳素生物修复膜
全部参数
改性甲壳素生物修复膜
YZB/粤0508-2009
43
改性甲壳素创面修复凝露
全部参数
改性甲壳素创面修复凝露
YZB/粤0849-2009
