淡水养殖罗非鱼中病原菌和腐败菌的 分离与鉴定初探
惠州地区罗非鱼细菌性疾病病原鉴定及药敏分析
病害监测DISEASE MONITORING惠州地区罗非鱼细菌性疾病病原鉴定及药敏分析■ 王贺 (惠州市海洋技术中心,广东 惠州 516001)李庆勇(惠州市渔业研究推广中心,广东 惠州 516001)惠州是水产养殖大市,全市水产养殖面积51万亩,其中海水养殖12万亩,淡水养殖39万亩,罗非鱼是目前惠州最主要的淡水鱼类养殖品种。
近年来,惠州罗非鱼细菌性疾病多次爆发,导致大量罗非鱼死亡,严重影响了惠州罗非鱼产业乃至整个水产养殖业,十分有必要对罗非鱼细菌性疾病的病原进行分子生物学鉴定并开展药敏试验,弄清惠州地区罗非鱼细菌性疾病的致病原和敏感药物,为罗非鱼细菌性疾病的治疗提供参考。
与传统的细菌鉴定相比,细菌的分子生物学鉴定具有快速、准确以及成本低等特点,且已经建立了完善的鉴定方法步骤,对市级水产养殖技术人员比较适用。
1 材料与方法1.1试验材料试验菌株为2014-2017年在惠州辖区内患病罗非鱼体内采集保存的菌株,共172株。
脑心浸液培养基、血平板等微生物培养试剂耗材全部购自广东环凯生物科技有限公司;药敏片为英国产OXOID品牌;分子鉴定试剂耗材购自大连宝生生物有限公司(TaKaRa)。
1.2 病原鉴定革兰氏染色初步判断。
按照DNA提取试剂盒说明书的方法提取细菌DNA作为模板,以1492r/F27为引物,进行PCR 扩增(扩增条件为94℃预变性5min,94℃变性30s,55℃退火30s,72℃延伸1min,30个循环,72℃延伸7min)。
PCR 产物通过琼脂糖凝胶电泳鉴定条带后,送生工生物工程(上海)股份有限公司进行序列测定,测序结果在GenBank 上进行序列比对,进行16S rRNA的分子鉴定。
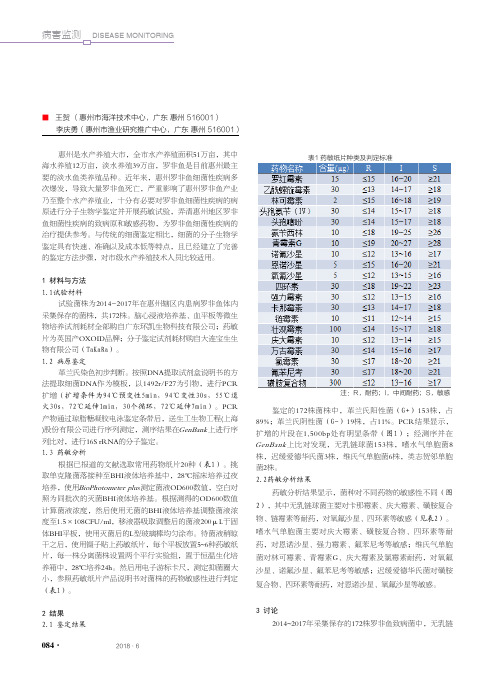
1.3 药敏分析根据已报道的文献选取常用药物纸片20种(表1)。
挑取单克隆菌落接种至BHI液体培养基中,28℃摇床培养过夜培养,使用BioPhotometer plus 测定菌液OD600数值,空白对照为同批次的灭菌BHI液体培养基。
罗非鱼烂尾病病原菌的分离、鉴定及药敏试验

1 材 料 与 方 法
1 . 1 材 料
病 样采 自广 西 博 白县某 罗 非 鱼 养 殖 户 网箱 的 患病 罗非 鱼 , 个体 重 3 6 g左右 。健康 罗 非鱼 购 自广 西 水产科 学研 究 院 那 马 罗 非 鱼养 殖 基 地 , 个 体 重 4 0 g 左右 , 购 回后 先在 广 西大 学 水 产教 学 科研 基 地 水 池 中暂养 1 5 d以上 , 试验 前 随机取 样进 行常 规检 查 和细 菌分 离 , 确认健康 、 无 细 菌 感 染后 用 于 人 工
中时有 发 生 , 同样 可引起 罗非 鱼 的大 量死 亡 。有关
将发 病鱼 带 回实验 室后 , 先对病 鱼 症状 等进 行 常规 检查 , 后用 7 5 %酒精 棉 球 擦拭 患 病 鱼体 表 , 按
无菌操 作 要求 从病 鱼 的心 脏 、 肝脏 和腹 水等部 位 用
接种 环取 样 , 分 别划 线接 种 于普通 营养琼 脂培 养基 和兔 血营 养 琼 脂 培 养 基 上 , 3 6 . 8 ℃ 恒温培养 2 4 h 。 然后 挑取 优势菌 的单 个 菌 落接 种 于普 通 营 养 琼脂 培养基 上 培养 , 经 3次 ~ 4次 的纯 化 培养 后 转 接 于 普通琼 脂斜 面培 养基 上 4  ̄ C冰箱 中保存 备用 。 1 . 3 人工 感染试 验 参 照 黄 钧 等 ( 2 0 1 2) 的方法 , 将 分 离 菌 株 接
定、 动物人工感染试验确定 病原 菌, K — B纸 片 扩 散 法 进
在寻 找对该 病有 效 的防治措 施 , 避免 抗生 素在 罗非
鱼养殖 中的乱用 和滥 用提供 科 学依据 。
罗非鱼的链球菌病

罗非鱼的链球菌病摘要:以前人们普遍认为,罗非鱼的抵抗力强,很少有病害发生,但这种概念是不正确的。
现今,人们逐渐认识到,随着罗非鱼养殖密度增大、养殖环境恶化,罗非鱼的病害一定会发生,并越来越严重。
不管人们愿不愿接受这样的事实,已经有几种疾病在罗非鱼上发现,其中,链球菌病是罗以前人们普遍认为,罗非鱼的抵抗力强,很少有病害发生,但这种概念是不正确的。
现今,人们逐渐认识到,随着罗非鱼养殖密度增大、养殖环境恶化,罗非鱼的病害一定会发生,并越来越严重。
不管人们愿不愿接受这样的事实,已经有几种疾病在罗非鱼上发现,其中,链球菌病是罗非鱼育成期的常见疾病,发病率高,危害严重,常常造成很大的经济损失。
一、病原无乳链球菌(Streptococcusagalactiae)(包括以前定名为S.difficilis/difficiie的链球菌,现在认为是无乳链球菌的同种异名)是养殖罗非鱼的主要病原。
海豚链球菌(StroDtococcusiniae)也可以引起罗非鱼大量死亡,但危害程度不如无乳链球菌。
链球菌是一种革兰氏阳性、非酸性化、无运动、氧化酶阳性、过氧化氢酶阳性的球菌。
二、临床特征不同种类的链球菌引起的临床特性无显著差别。
不正常行为:由于链球菌可以侵害病鱼的中枢神经系统,故临床上表现为病鱼游泳异常、昏沉,常在塘边、水面无方向性地缓慢游动,有时身体屈曲。
眼部损伤:病鱼常呈现眼部症状如眼巩膜白浊(单侧或双侧)、眼球突出以及出血等。
但不是所有病鱼都出现眼部症状。
干酪样脓肿坏死灶:有时在病鱼的两侧前颊上出现2~3毫米的干酪样坏死灶病变,随后坏死灶破裂形成溃疡。
有时在腹鳍的基部出现较大(5毫米)的干酪样坏死,在尾鳍基部可能出现更大(10~20毫米)的坏死灶。
坏死灶内是奶酪样的脓质,如果病鱼康复,这种病灶也会长期保留。
皮肤出血:链球菌常引起罗非鱼身体表面出血,表现在口周围、鳍条基部的点状出血。
有时在肛门或生殖孔周围呈现出血斑。
腹水:罗非鱼的急性链球菌病常见腹腔内有大量腹水,由于腹水的增多,引起肛门突出。
罗非鱼无乳链球菌的分离纯化及鉴定

罗非鱼无乳链球菌的分离纯化及鉴定李旻;梁万文;陈汉忠;王凯;陈明;王瑞;陈福艳;米强;吴文德;李雪;黄甜【摘要】目的:对从广西等地暴发链球菌病的罗非鱼养殖场采集的病料分离的几株致病菌进行分离纯化和鉴定.方法:采用传统的常规方法和分子生物学鉴定方法对病菌菌株进行了综合的分析鉴定.结果:根据分离菌株的形态特征、生化特性初步鉴定这三个分离菌株为无乳链球菌株,再进行PCR检测、克隆测序及Blast比对分析,以及动物致病性回归试验等进行综合的分析,最后将分离纯化的三个菌株鉴定为无乳链球菌株.结论:这些无乳链球菌菌株的分离纯化和鉴定,为进一步研究罗非鱼无乳链球菌病的检测、监测方法和各种防控方法奠定了基础.【期刊名称】《大众科技》【年(卷),期】2017(019)011【总页数】5页(P85-89)【关键词】罗非鱼;无乳链球菌;分离鉴定【作者】李旻;梁万文;陈汉忠;王凯;陈明;王瑞;陈福艳;米强;吴文德;李雪;黄甜【作者单位】广西水产科学研究院·广西水产遗传育种与健康养殖重点实验室,广西南宁 530021;广西水产科学研究院·广西水产遗传育种与健康养殖重点实验室,广西南宁 530021;广西大学动物科技学院,广西南宁 530005;广西大学动物科技学院,广西南宁 530005;广西水产科学研究院·广西水产遗传育种与健康养殖重点实验室,广西南宁 530021;广西水产科学研究院·广西水产遗传育种与健康养殖重点实验室,广西南宁 530021;广西水产科学研究院·广西水产遗传育种与健康养殖重点实验室,广西南宁 530021;广西水产畜牧学校,广西南宁 530021;广西大学动物科技学院,广西南宁 530005;广西大学动物科技学院,广西南宁 530005;广西大学动物科技学院,广西南宁 530005【正文语种】中文【中图分类】S965水生动物类链球菌病是一种由链球菌感染引起的疾病,目前,链球菌已成为全球性主要水生动物类致病菌之一。
罗非鱼链球菌病病原鉴定及中草药药敏试验

中草药药 敏试 验显示 , 陈蒿散 、 茵 黄连解 毒散 、 黄连解 毒散 改方 、 三黄 散 、 连有 良好 的抑 菌效果 。 黄 病 , 论是 网箱 , 是池 塘养殖 的罗 非鱼 , 有此 病 的发生 , 无 还 都 主要危 害亲 鱼及 10克 以上 的幼鱼 和成 鱼 。罗非 鱼链 0
方法 对分 纯菌株 进行革 兰 氏染色 、 镜检 以及溶 血试 验 。
14生 理 生 化 试 验 .
备。 然后取 出含 药纸 片置 于一纱 布袋 中, 以真空抽 气使 之 干燥 。 干燥 后立 即装 入无菌 小瓶 中加 塞 , 于干燥 器 置 内或 冰箱 冰冻层 中保 存备 用 。
取 分纯 细菌 , 分别接 种于各 生化 培养 管 中 ,8C 2  ̄培 养 4h每 天观察 生化 管颜色 变化 。 8,
片 中心相距 不少于 2m 4 m,纸 片 与 平 皿 边 缘 不 少 于
菌 圈 出现 ; 陈蒿散 、 茵 黄连解 毒 散 、 黄连解 毒 散 改方 、 三 黄散 、 黄连 素 为 中敏 , Байду номын сангаас现 出良好 的抑菌 效 果 。其余 各 组 中药 的抑 菌 圈直 径 均在 lmm 以下 为低 敏 ,抑菌 效 O
2 h培 养后 取 出检查 ,用 标 尺度 量 各个 平 板 出现 4 的抑 菌 圈 , 记 录结果 。试 验 结果 表 明 , 照 纸片无 抑 并 对
液 浓度 至 ls /l 0 个 m 。将待 检 菌液 各 取 02 在 普 通 琼 . ml 脂 平 板 上 均 匀 涂 抹 , 盖 后 放 置 5 i, 镊 子 将 药 敏 加 mn 用 纸 片平放 在 平板 上 , 并轻 压使 其 紧 贴在 平板 表 面 , 纸 两
罗非鱼“突眼”病细菌性病原的分离与鉴定

报道 [6, 是对 罗非 鱼 “ 眼” 1 但 _ ] 突 症状 究 竟是 由于何 种 1 病 原茵 鉴定 . 3
原 因所致 , 尚不清 楚 。笔 者 对 罗 非 鱼 “ 眼” 细 菌 突 病 疾 病提 供依据 。
对 分离 菌株 的 生 理 生 化 特 征 鉴 定 按 文 献 [ —] 78
罗 非 鱼 “ 眼 ’ 细 菌 性 病 原 的 分 离 与 鉴 定 突 ’ 病
刘 堂水 D 樊 海 平 陈 昌福 D 一
( 华 中农 业 大 学 水 产 学 院 , 汉 4 0 7  ̄ 福 建 省 淡水 水 产研 究 所 , 州 3 0 0 ) 武 3 0 0 福 5 02
摘要
从 患“ 突眼” 症状 的罗非鱼体 内分离 到多株 细菌 , 经人 工感染 证实其 中 TL 0 2 NA菌株 为病 原菌 , 6 89
养基 平板划线接 种 ,8℃培 养 2 , 选优 势菌 落进 扩增 。根据 文献 [ 1的方 法设 计 引物 : 2 4h 挑 1]
一
步纯化 , 转接 营养琼脂斜 面 , 4℃冰箱保存 备用 。
2 F 5- 7 ' AGAGTTTGATCCTGGCTCAG一 3 5 5- R ' 1 9 GW ATTAC(G GGCKGCTG一 、 3
养殖 场 。将病 鱼用酒精棉球 擦拭体 表 3遍后 , 无菌 10 L 无 菌 去 离 子 水 , 匀 后 在 沸 水 浴 中 加 温 按 0 混 操作 要求从 眼 、 、 、 肝 脾 肾处 用接 种环 取样 , 于普 通培 2mi , 2 0 / n离 心 5 n 取上 清液 用 于 P R n 1 0rmi 0 , mi C
状为 : 应 迟钝 、 反 摄食 量 减 少 ; 眼球 突 出 、 浊 发 白 ; 细菌浓 度 调节 成 1 f/ 浑 0 cumL后 , 对每 尾 试验 鱼 经 腹
罗非鱼(tilapianilotica)简达气单胞菌病的病原分离鉴定及药敏试验

第36卷 第4期 渔 业 科 学 进 展Vol.36, No.4 2015年8月Aug., 2015* 三亚市院地科技合作项目(2011YD115;2012YD73)和三亚市重点实验室建设项目(L1209)共同资助。
杨 宁,E-mail:******************① 通讯作者:黄 海,研究员,E-mail:******************收稿日期: 2014-06-23, 收修改稿日期: 2014-08-261) 邓恒为. 海南罗非鱼链球菌病病原分离鉴定及防治中草药筛选. 海南大学硕士研究生学位论文, 2013, 18−25DOI: 10.11758/yykxjz.20150411 /罗非鱼(Tilapia nilotica )简达气单胞菌病的病原分离鉴定及药敏试验*杨 宁1 姜芳燕2 黄 海1①焦 健3(1. 三亚市南繁科学技术研究院 三亚 572000; 2. 琼州学院 三亚 572022;3. 邯郸市永年县农牧局水产技术服务站 邯郸 057150)摘要 从患病罗非鱼(Tilapia nilotica )体内分离得到细菌NL05,通过回归感染试验确定NL05为致病菌,并测出NL05对罗非鱼的半致死量(LD 50)为1×103 CFU/g 。
结合细菌形态学特征、生理生化指标和16S rRNA 基因同源分析,鉴定NL05为简达气单胞菌(Aeromonas jandaei )。
形态学观察发现,NL05为革兰氏阴性、短杆状;生理生化试验中麦芽糖、甘露醇、葡萄糖、水杨素、硫化氢等13种指标为阳性,蔗糖、阿拉伯糖、木糖、肌醇、卫矛醇等10种指标为阴性。
药敏试验显示,NL05对奥复星、丙氟哌酸、丁胺卡那霉素、多粘菌素B 、氟哌酸、利福平、洁霉素等13种抗生素敏感,对阿奇霉素、菌必治、卡那霉素、链霉素、美满霉素5种抗生素中介,对氨苄青霉素、阿莫西林、恩诺沙星、复方新诺明、甲氧苄啶等13种抗生素耐药。
罗非鱼致病性无乳链球菌的分离鉴定及药敏试验

罗非鱼致病性无乳链球菌的分离鉴定及药敏试验黄艳华;彭亚;刘杰;彭民毅;黄钧;胡大胜;陈明;马旦梅;曾桂忠【摘要】[Objective]Pathogenic bacteria strains were isolated and identified from diseased tilapia cultured in a fish farm in Santang Town, Nanning City, Guangxi. A drug sensitivity test was conducted to seek out the aetiological agent and provide references for effective prevention and control. [Method]The strains were separated from the brain tissue in dying tilapias using routine method. Pathogenicity of the strains was determined by an artificial infection experiment. The strains were identi-fied using API20Strep and the 16S rRNA sequences. K-B was applied to test the drug sensitivity. [Result]Four Gram-positive cocci (GXN01, GXN02,GXN03 and GXN04) possessed strong pathogenicity against healthy tilapia and they might be the aetiological agent causing tilapia to death. The four strains were identified as Streptococcus agalactiae. All the strains shared 99.2%-99.7% similarities with those S. agalactiae strains reported in GenBank (JQ039365,JQ039376,JQ990156, JQ039366, JF423948, HQ645984 andGU217535). These four strains also shared high similarities(99.9%) with each other. Drug susceptibility test results showed that the four strains were sensitive to ofloxacin, cephalosporinVI, cefobid and sarafloxacin hydrochloric,but resistant to gentamicin, norfloxacin, sulfadoxine-6-methoxymethoxypyrimidine and sulfa-methoxy-pyrimidine. [Conclusion]The deaths of tilapia might be caused by S. agalactiae infection. Four kinds of drugs (CephalosporinVI, Ofloxacin, Cefobid andSarafloxacin hydrochloric) could be used for prevention and treatment.%【目的】对广西南宁市郊三塘镇某养殖场患病罗非鱼进行病原菌分离鉴定及药敏试验,旨在找出罗非鱼的发病原因,为该病的有效防治提供依据。
罗非鱼创伤弧菌的分离鉴定和药敏试验

p o i e .A  ̄r m— e ai e p t o e i a tra tan ZH1 wa s l td fo d s a e i p afy c lu e n a r vnc s G a n g t ah g n c b ce lsr i v i sioa e r m ie s d t a i r u t r d i l a m n Zh ha ,Gu n d ng Ari c a n e to x e me t h we h tt e io ae ta n p se s d sr n fr i u i ago . t ili fc in e p r n s s o d t a h s lt d sr i o s s e to g i f i
摘要 :0 0年春季广东 、 21 海南 的养殖罗非鱼苗种 出现较 大范围的死亡现象 , 在广东珠海 某罗非鱼 养殖场 的发病 罗非鱼体上分离到一株病原菌 Z 1 H 。人工感染试 验显示该 分离菌株具有 较强毒力 , 该病原 菌经 A B3 E细菌 T 2 鉴定系统鉴定和 1 Sr N 6 A基 因序列 分析 , R 确定为创伤 弧菌( i i vlics 。药敏试验结果显示 , Vb o un u) r f 该菌株对诺 氟沙星 、 头孢 克洛 、 氧氟沙 星和壮观霉 素等 1 9种试验药物敏 感。本研究病 原的鉴定 与药物敏感 性试 验结果 为
广东罗非鱼无乳链球菌分离鉴定及生物学特性分析

·研究论文·Chinese Journal of Animal Infectious Diseases中国动物传染病学报广东罗非鱼无乳链球菌分离鉴定及生物学特性分析摘 要:本研究旨在明确当前罗非鱼无乳链球菌流行状况和生物学特性,为鱼源无乳链球菌病防控提供新的数据。
本研究于2019—2020年,从广东罗非鱼主养区茂名、湛江地区采集病样进行无乳链球菌的分离鉴定。
用PCR 方法对分离株血清型及4个主要毒力基因进行检测,通过纸片法对分离菌株进行31种抗菌药物药敏试验和多重耐药研究,利用斑马鱼模型进行了致病性试验。
结果显示:从261份病样中分离到35株无乳链球菌;血清型检测表明无乳链球菌分离株的血清型均为Ia 型;主要毒力基因的检测证明,cylE 、sodA 、gapC 基因在所有鱼源分离株及人源、牛源和鱼源参考株中检出率均为100%,而scpB 只在人源参考菌株中检出;药敏试验结果发现,无乳链球菌分离株对19种抗菌药敏感率为90%以上,对6种抗菌药耐药率为50%以上,分离株的耐药基因型和表型部分一致,无乳链球菌分离株均多重耐药,其中5重及以上耐药的菌株为27株,占总菌株数的77.1%;斑马鱼致病试验表明,无乳链球菌分离株可导致斑马鱼不同程度的发病死亡。
本研究明确了当前罗非鱼源无乳链球菌的血清型、毒力基因、耐药特性和致病性,为广东乃至全国罗非鱼无乳链球菌病的防控提供了参考。
关键词:罗非鱼;无乳链球菌;分离鉴定;生物学特性中图分类号:S943文献标志码:A文章编号:1674-6422(2024)02-0073-10I solation and Characterization of Streptococcus agalactiae from Tilapia in GuangdongGUO Changming 1, CHEN Huaijun 2, YUAN Cheng 1, YUAN Sheng 1, JIA Guohua 3,WANG Yiren 3, ZHU Shanyuan 1(1. Jiangsu Key Laboratory for High-T ech Research and Development of V eterinary Biopharmaceuticals, Jiangsu Agri-animal Husbandry Vocational College, T aizhou 225300, China; 2. College of Animal Science and T echnology, Guangxi University, Nanning 530004, China; 3. Zhanjiang HengxingBreeding T echnology Service Co.,Ltd., Zhanjiang 524000, China)收稿日期:2022-03-25基金项目:江苏省高等学校自然科学研究面上项目(19KJB230005);江苏高校“青蓝工程”项目(苏教师函[2021]11号);泰州市科技支撑计划(农业)项目(TN201916);泰州市311高层次人才培养工程([2019]21号)作者简介:郭长明,男,博士,副教授,主要从事兽医微生物学与免疫学研究通信作者:朱善元,E-mail:***************Abstract: The purpose of this study was to investigate the current epidemic status and biological characteristics of Streptococcus agalacti ae in tilapia and to provide new data for the prevention and control of S. agalacti ae disease in fish. In this study, 261 samples of diseased fi sh were collected from 2019 to 2020 from the main culture area of tilapia in Guangdong. The serotypes and four main virulence genes of the isolated strains were tested in PCR. The antibiotic sensitivity and multiple resistance to antibiotics of 31 kinds of antibiotics were detected. Total 35 S. agalactiae strains were isolated from 261 samples and determined to be serotype Ia. The majorv irulence genes cylE , sodA and gapC were detected in all fi sh isolates and all tested human, bovine and fi sh reference strains while virulence gene scpB2024,32(2):73-82郭长明1,陈怀君2,袁 橙1,袁 圣1,贾国华3,王义仁3,朱善元1(1.江苏农牧科技职业学院 江苏省兽用生物制药高技术研究重点实验室,泰州225300;2.广西大学动物科学技术学院,南宁530004;3.湛江恒兴养殖技术服务有限公司,湛江524000)· 74 ·中国动物传染病学报2024年4月罗非鱼具有食性广、生长速度快、抗病能力强等优点,世界范围内已经有100多个国家和地区在养殖罗非鱼,年产量超过300万吨[1]。
罗非鱼源蜡样芽孢杆菌分离、鉴定及药敏特性研究

罗非鱼源蜡样芽孢杆菌分离、鉴定及药敏特性研究杨移斌;余琳雪;刘永涛;杨秋红;苏志俊;宋怿;艾晓辉【摘要】Bacterial strain FJLF was isolated from diseased tilapia suffered from serious hemorrhage disease at a fish farm in Zhangzhou,Fujian Province,and it was identified as Bacillus cereus based on biochemical reaction characters and 16S rRNA gene sequence analyses.Artificial affected fish by intraperitoneal FJLF-injection showed the same clinic signs as the diseased fish in ponds.Therefore,the isolated B.cereus was proved as the main pathogen,and its LD50 to tilapia was determined as2.30×106CFU/g using the probabilistic graphical method.The antibiotic sensitivity test showed that the isolated was very sensitive to norfloxacin,cefotaxime,neomycin,kanamycin,etc.,less sensitive tociflox,furazolidone,erythrocin,streptomycin1,and not sensitive to oxacillin,penicillin,cefadroxil,amoxicillin etc.%从福建漳州某养殖场患出血病死亡的罗非鱼肝脏、肾脏及脾脏分离到一株致病性菌株FJLF.对该菌进行了形态特征观察、理化特性测定及16S rRNA序列分子鉴定.生理生化特征和16S rRNA基因序列分析结果显示,分离到的FJLF株为蜡样芽孢杆菌(Bacillus cereus).人工感染该菌后发病鱼出现与自然发病类似症状,且从病灶中分离到与原感染菌一致菌株.腹腔注射后该菌株对罗非鱼的半致死剂量LD50=2.30×106 CFU/g.FJLF株对诺氟沙星、头孢噻肟、新霉素及卡那霉素等8种抗生素高度敏感;对环丙沙星、痢特灵、红霉素及链霉素中度敏感;对苯唑西林、青霉素、头孢拉定及阿莫西林等10种抗生素耐药.【期刊名称】《淡水渔业》【年(卷),期】2017(047)004【总页数】6页(P51-56)【关键词】罗非鱼(Oreochromismossambicus);蜡样芽孢杆菌(Bacilluscereus);分离;鉴定;药敏特性【作者】杨移斌;余琳雪;刘永涛;杨秋红;苏志俊;宋怿;艾晓辉【作者单位】中国水产科学研究院长江水产研究所武汉 430223;上海海洋大学,上海 201306;中国水产科学研究院长江水产研究所武汉 430223;中国水产科学研究院长江水产研究所武汉 430223;上海海洋大学,上海 201306;中国水产科学研究院,北京100141;中国水产科学研究院长江水产研究所武汉 430223【正文语种】中文【中图分类】S941.42罗非鱼为鲈形目(Perciformes)鲈形亚目(Percoidei)丽鱼科(Cichlaidae)罗非鱼属(Tilapia),俗称非洲鲫[1]。
罗非鱼常见细菌性疾病及其防治措施探究

罗非鱼常见细菌性疾病及其防治措施探究发布时间:2022-10-10T07:50:28.148Z 来源:《科技新时代》2022年7期作者:黄宏举[导读] 在经济迅速发展的影响下,促进了养殖行业发展。
黄宏举南宁市邕宁区蒲庙镇农林水利综合服务中心广西南宁 530000摘要:在经济迅速发展的影响下,促进了养殖行业发展。
由于罗非鱼市场需求量不断提高,进而推动了罗非鱼养殖行业的发展与完善。
然而由于水质环境存在一定变化,导致罗非鱼细菌性疾病较为频发,对养殖效益造成严重影响,因而应加强罗非鱼常见细菌性疾病的防治。
本文分析了罗非鱼常见细菌性疾病,并对各个疾病具体防治措施进行了论述。
关键词:细菌性疾病;罗非鱼;防治措施引言:随着经济不断发展,人们生活水平不断提高,也使得对于饮食有着逐渐提高的要求。
由于罗非鱼具有肉质鲜美以及营养价值高等优势,深受消费者的喜爱,进而促进了罗非鱼养殖行业的发展。
在实际养殖过程中,细菌性疾病会严重威胁到罗非鱼生长,因而应通过高效可行的措施进行防治,为养殖效益的提高提供有力支持。
一、假单胞菌病在养殖罗非鱼的过程中,假单胞菌病较为常见,对罗非鱼的危害较为严重,因而应运用恰当的措施加以防治。
(一)症状假单胞菌病是因感染了荧光假单胞菌导致的,当患上该疾病后,罗非鱼眼球突出且浑浊发白,鱼腹部存在膨胀现象。
通过解剖可知,患病罗非鱼腹部膨胀原因为腹部积水,在鱼鳔以及脾部等都存在病灶,为白色结节状。
当患上该疾病后,会对鱼体生长发育带来严重影响,还会损害到鱼内脏。
养殖人员应注重鱼活动变化,结合上述症状加以诊断,做到早发现与早治疗。
该疾病流行季节不明确,在初夏至秋季相对频发。
(二)防治措施由于该疾病是因感染细菌而导致的,因而应注重鱼抵抗力的提升,还应对生长环境加以完善,对水质进行优化。
可在鱼池内以每立方米0.4克的量进行溴氯海因的施加,在饵料中也应提高免疫多糖的使用,应将用量控制在每千克饵料加入10克,每日进行一次投喂,并连续进行3至5天的投喂。
罗非鱼链球菌病检测技术

养殖与饲料2017年第2期摘要为了解并掌握罗非鱼链球菌检测技术,探索罗非鱼链球菌不同致病性菌株及其基因分型,给有效防控罗非鱼链球菌病提供科学依据,采用PCR 扩增技术及PFGE 图像分析技术对罗非鱼链球菌致病菌株进行分离鉴定,检测分离菌株的致病性特点。
结果表明罗非鱼链球菌病分别由海豚链球菌及无乳链球菌2种病因引起。
罗非鱼链球菌菌株基因型复杂,不同地区的优势菌群存在很大差异,PCR 与PFGE 相结合的鉴定方法可高效、准确地检测到罗非鱼链球菌。
关键词罗非鱼;链球菌病;检测技术罗非鱼链球菌病检测技术吴山楠海南出入境检验检疫局,海口570311收稿日期:2016-12-28基金项目:海南省科技兴海专项“罗非鱼链球菌病快速检测技术研究(XH201409)”吴山楠,男,1981年生,兽医师。
罗非鱼是我国南方的主要鱼种之一。
在广东、广西、海南、福建四省是罗非鱼的主要养殖地,广东省每年罗非鱼的产量约60万t[1];广西罗非鱼仅2010年养殖总产量达到21.6万t [2]。
因其肉质鲜美,营养丰富而远销欧美等发达国家,因此成为我国水产养殖业不可或缺的重要组成部分。
但目前已有许多国家报道食用罗非鱼引发罗非鱼链球菌病的暴发与流行事件[3]。
罗非鱼链球菌病已成为我国乃至世界重要的细菌性疾病之一,不仅危害人类健康,也同时给水产养殖业造成了巨大的经济损失。
据文献报道,仅2012年罗非鱼链球菌病给我国造成直接经济损失10亿~15亿元[4],严重制约了罗非鱼养殖业的健康发展[5]。
因此,本次研究过程中将罗非鱼链球菌菌株进行临床分离,探索罗非鱼链球菌病快速检测的高效技术。
1材料与方法1.1选用的检测试剂及标准菌株1)标准菌株。
自中国微生物菌种贮藏中心购置海豚链球菌ATCC29178、无乳链球菌ATCC27956。
2)检测试剂。
分别自Omega 公司购置质粒DNA 提取试剂盒及胶回收试剂盒;自Invitrogen 公司购置Novagen His Band 蛋白纯化试剂盒;自广东环凯微生物科技有限公司购置DAB 显色试剂盒;自上海生工生物技术有限公司购置EX-Taq DNA 聚合酶;自Promega 公司购置SDS ,EDTARNase Free DNase I 。
罗非鱼荧光假单胞菌的分离鉴定

摘要 : 从发病罗非鱼 中分离获得 1 株革兰氏阴性杆菌 , 依据细菌形态 、 培养 、 理生 化特性初 步鉴定为荧光假单胞 生
菌, 结合P R C 检测 、 克隆测序及 BatL l  ̄对分析 , s 进一步确定该分离菌株为荧光假单胞菌。致疴 性试 验结果显示 , 该分离
菌株具有较高 的致病性 , 能引起罗非鱼发病 、 死亡 , 其病理变化与荧光假单胞 菌引起 的鱼类赤皮病完全相似 。药敏试
荧 光 假 单 胞 菌 ( s u o n st oocn ) 淡 P e dmo a l rse s 是 u 水 鱼 类 赤 皮 病 的 主要 病 原 菌 ,为 革 兰 氏 阴 性 菌 [。 1 ] 草 鱼 、 鱼 、 鱼 、 鱼 等 大 多 数 淡 水 鱼 类 均 可 感 青 鲤 鲫
广西农业科 学
2 1 ,1 6 : 1 — 1 004() 6265
Gu n x rc t r lS i n e a g iAg iul a ce c s u
罗非鱼荧光假单胞菌的分离鉴定
邓 显文,谢芝勋 ,刘加 波 , 志勤 ,谢丽基 ,庞耀珊 谢
( 西兽 医研 究 所 。南 宁 广 500) 3 0 1
பைடு நூலகம்
I o a i n a d i e t c t n o e d m o a u r s e si i p a s l to n d n i a i fPs u o n sf o e c n tl i i f o l n a
D N in w n XI h— u L U J - o X E Z iqn X E L-i P N a —h n E G X a — e , E Z ix n, I i b , I h- i , I ij, A G Y o sa a
罗非鱼养殖之细菌综合病防治技术

罗非鱼养殖之细菌综合病防治技术前言罗非鱼,又称尼罗罗非鱼,是世界范围内广泛分布的淡水鱼类,因其食用价值高,而被人广泛养殖。
然而罗非鱼养殖中,常常会遇到各种疾病与难以掌控的疫情,其中细菌综合病是最为常见且最具破坏性的疾病之一。
因此,对于罗非鱼疾病防治,探究细菌综合病的防治技术,具有重要的意义。
细菌综合病的症状及诊断细菌综合病(Bacterial Septicemia)是一种由多种不同的细菌引起的疾病,具有快速传染、高死亡率的特点。
其主要症状为食欲不振,活力下降、皮肤和鳃部出现广泛的病症,如息肉、瘤样、坏死、颜色暗淡等。
另外,还会伴随有过呼吸、膨胀等各种症状。
为了确诊罗非鱼细菌综合病,需要进行详细的体检,如检查鱼的鳃部、皮肤、肛门、心、腹等器官,并且需要生成比较详细的病史。
一旦确诊后,应采取相应的措施,通常采用细菌感染的抑制剂和抗菌素来进行治疗。
病害的形成原因及处理方法形成原因细菌综合病在罗非鱼养殖中,通常是由多种细菌侵袭而引起的。
常见病原体包括艰难梭菌、光气弧菌、葡萄球菌等。
当饲养密度过高、水质环境不佳、非常规维生素、饲料、药物等添加过多、鱼体抵抗力差等情况发生时,会导致罗非鱼身体机能受损,从而使其变得容易受到多种细菌的感染。
处理方法发生细菌综合病的主要原因通常是由于环境污染以及养殖环境混杂问题引起的。
因此,为了避免细菌综合病的发生,我们需要采取一定的预防措施。
具体来说,可以从以下几个方面着手:注重水质管理水的质量是养殖中最为关键的环节,需要对水进行循环过滤处理,保持水体的清洁,避免水质污染而导致的细菌繁殖。
合理饲养密度适当减少养殖密度,保证鱼头长、重量增长和生长发育的平衡。
注意饲料质量与饲养方法在生物繁殖过程中要注意饲料的质量,合理加入必要的营养元素,同时要避免过度投喂,建议采取分次定量喂养。
保持水体清洁对罗非鱼场进行定期、细致地清洁,及时将死鱼、饲料、外来物等污物及时清除,保证养殖水体的清洁并防止污染。
一株罗非鱼出血病致病菌的分离与鉴定及组织病理观察

一株罗非鱼出血病致病菌的分离与鉴定及组织病理观察王忠敏;黄惠莉【摘要】从患有出血病症状的罗非鱼病灶部位分离筛选出一株高致病性菌(编号为BC-2),结合对菌落形态观察、生理生化实验及16S rDNA测序,确定该高致病菌为一种致罗非鱼死亡的蜡状芽孢杆菌.通过对健康鱼进行不同浓度致病菌的感染试验及定性数据机率的分析,可知其半数致死量(LD50)的对数值为7.534 8、感染的菌浓度为3.4×107 cfu· mL-1、置信限为95%.通过对患病鱼的不同组织器官的切片病理结构观察,可以发现鳃和肠是病变最明显的部位.%A highly pathogenic bacterium (No. BC-2) was isolated from the infected hemorrhage tilapia. Combination of the colonial morphology observation, the biochemistry test and 16S rDNA sequencing, the highly pathogenic bacterium was determined as Bacillus cereus, which could cause tilapia dead. Then infective test was carried out to normal tilapias with different concentrations of the pathogen, and the qualitative probability data analysis results showed that the logarithmic concentration of LD50 was 7. 534 8 with the confidence interval 95% when the infective concentration was 3. 4X 107 cfu· mL-1. After observing the pathological structure of different tissue and organ sections from infected tilapia, we found gill and intestine were the most evident lesion parts.【期刊名称】《华侨大学学报(自然科学版)》【年(卷),期】2012(033)006【总页数】7页(P660-666)【关键词】罗非鱼;蜡状芽孢杆菌;出血病;组织切片;病理【作者】王忠敏;黄惠莉【作者单位】华侨大学化工学院,福建厦门361021;华侨大学化工学院,福建厦门361021【正文语种】中文【中图分类】Q939.124罗非鱼(Tilapia)属于热带鱼类,在广东、海南、福建等地都有大面积养殖,是我国一种主要经济鱼类.导致罗非鱼死亡的主要原因,有溶氧量过低、有毒物质的侵害、温度过低及病原体的感染等.在病原体中,细菌性疾病对罗非鱼的影响最为普遍,如嗜水气单胞菌导致的运动性气单胞菌病、链球菌引起的链球菌病、爱德华氏菌引起的爱德华氏病,以及柱状屈杆菌引起的烂腮鳃病[1]等.近些年,我国科研工作者从鱼体内分离出致病的气单胞菌[2]、嗜水气单胞菌[3]和无乳链球菌[4];在国外,文献[5-7]分别报道柱状黄杆菌(Flavobacterium columnare)、格氏乳球菌(Streptococcus agalactiae)和弗朗西斯氏菌(Francisella sp.)均可引起罗非鱼感染发病.蜡状芽孢杆菌是一种条件致病菌,其致病性受宿主和环境的综合影响.随着水产养殖密度的增大,鱼体的栖息环境越来越恶劣,蜡状芽孢杆菌也很可能从机会致病菌中成为常见病原体.有研究表明[8]:蜡状芽孢杆菌也能通过食物中毒引起人体产生腹泻、呕吐症状的一种食源性病原菌,其本身通常是弱毒性,但其分泌的毒素会引起暴发性的食物中毒.2000年,冯斯敏等[9]报道了蜡状芽孢杆菌能引起军曹鱼大量死亡.本文针对当地养殖中暴发过的一次大批量罗非鱼死亡(以出血病为主)情况,从病灶的肌肉与肠部位分离筛选出致鱼出血病的高致病菌之一,并对该菌进行生理生化实验,观察该菌感染健康鱼后不同组织器官的微观病理结构变化.罗非鱼,由福建厦门集美台商养殖场提供 .无菌脱纤维羊血(购自上海源叶生物科技有限公司),苏木素-伊红法(HE)染色液(购自江苏南京建成生物工程研究所).培养基,主要成分为氯化钠、蛋白胨、酵母膏、琼脂、无菌脱纤维羊血.用75%酒精对病鱼表面进行消毒处理,从病灶部位(肌肉、肠)取少量组织进行研磨成糊,加入10 mL,0.5%的无菌生理盐水混匀,在3 000r·min-1离心机上离心3~5min;然后,取上清液0.5mL,加入到4.5mL,0.5%的无菌生理盐水中,依次制成10-3,10-4,10-5,10-6,10-7,10-8等稀释度备用.取200μL上述每个稀释度进行LB血琼脂平板[10]涂布培养,每个稀释度3个平行,于35℃培养24h.对初筛的各个单菌落在LB琼脂平板中进行纯化培养,直至为单菌落为止,并对每个单菌落进行显微镜观察以确保无杂菌 .最后,用LB血琼脂平板对每个菌落进行涂布以记录观察菌落形态.选取大小基本一致的罗非鱼,分为13组,每组鱼5条 .其中:未注射任何物质的编号BC-00,注射生理盐水的编号BC-0,注射11种浓度致病菌的分别编号BC-1至BC-11.水温控制为20~25℃,水体pH值为6.8~7.0.实验进行腹腔注射[11].对所筛选菌分别扩大培养后制成2.4×107 cfu·mL-1的菌悬液,每条鱼注射剂量0.2mL.制备6.56×109 cfu·mL-1的原菌液,进行不同浓度(10-1,10-2,10-3,10-4)稀释及腹腔注射0.2 mL,并对受感染鱼成活时间和死亡率进行统计 .取感染致死鱼的肌肉、鳃、肠、肝约5mm×5mm×2 mm大小的组织,经中性缓福尔马林固定液固定24h,再经脱水、透明、透蜡、包埋、切片(切片的厚度为15μm)及贴片处理等;然后,根据HE染色试剂盒进行染色,并在油镜下进行观察.供试菌的生理生化实验参考文献[12].经细菌液体培养、离心获得菌体、裂解细胞(破碎或溶菌酶)、沉淀离心、溶解、PCR扩增,最后把扩增的序列送北京三博远志公司和生工生物工程(上海)有限公司进行16SrDNA测序测定.依据实验方法,从鱼的鳃、肠、肌肉等病灶部位筛选到11种菌,其中5株优势菌的形态如表1所示.BC-2菌落与菌株的电镜扫描形态,如图1所示.从图1可知:BC-2菌落呈灰色,菌落直径大小在4~8 mm,溶血圈较大,直径约11mm,为β溶血型;电镜下的BC-2菌为杆菌,从表面上无法看出有无芽孢;革兰氏染色BC-2菌的染色结果为蓝紫色,表明为G+;芽孢染色观察发现菌体成蓝色而芽孢成浅红色.依据实验方法正常充气喂养7d后,对每天每组鱼的感染情况及死亡率进行统计,结果如表2所示.表2中:NI为感染鱼尾数;ND为不同时间死亡鱼的尾数;η为死亡率.从表2可知:BC-2菌的死亡率最大达到80%,且BC-2菌出现病症及死亡时间最快;空白组(BC-0与BC-00两组的死亡率为0%).从各种菌感染后,鱼体表现出的症状所出现的时间快慢、死亡率的高低、症状的差异,表明BC-2菌感染罗非鱼的症状为出血病,且病变反应时间最快,死亡率也最高.此外,BC-2菌的菌落溶血圈明显,说明这种菌是罗非鱼的致病菌,而且是高致病出血病的病原体之一 .所以选BC-2菌为目标菌.BC-2菌的感染症状,主要是鳞有血丝、脱鳞、鳞片间有血丝、腹腔肿胀、大量皮肤表面鳞和皮肤的脱落,如图2所示.选取不同菌浓度(C)的BC-2菌,对6组健康鱼(每组10条)进行感染,统计致病菌后72h罗非鱼的死亡情况,结果如表3所示.根据英国学者D.J.Finney的Probit Analysis机率分析理论[13],运用DPS软件中的生物测定对其进行计数型数据机值分析,并确定其半数致死量(LD50).即拟合程度的卡方值χ2=1.968 3<7.815(自由度等于3时,=7.815),表明所求的毒力回归曲线是合适的,即否定所求模型的异质性的假设.从计算结果中可以得出:LD50的对数值为7.534 8;感染的菌浓度为3.4×107 cfu·mL-1,其置信限为95%,菌的有效作用浓度在9.24×105~3.6×108 cfu·mL-1范围内.将在感染过程中感染致死的死鱼及时保存于4℃冰箱中,以备进行病理组织切片.经过组织切片观察,观察结果如图3所示.图3中,未感染鱼组织做空白对照.从图3可知:未感染鱼的鳃丝的横切片比较完整,而感染组的鱼鳃丝肿大;未感染鱼组的肠上皮细胞排列紧密,而感染组的鱼肠上皮细胞较为疏松,并有裂痕;未感染鱼组与感染组的肌肉结构区别不是很明显,只是细胞略微变大;未感染鱼组与感染组的肝组织细胞变化不大,只是感染组的肝细胞变得修长,且有一些零散的游离细胞.从图3可知:未感染鱼空白组与感染组的鳃与肠的结构有明显的变化,而肌肉和肝的区别不是很明显,故从病理组织结构上进一步确定BC-2是罗非鱼的一种致病菌.所发现供试菌对罗非鱼的病变明显部位在于鳃与肠,对肝的症状却不是很明显,这可能与分泌的肠毒素有一定的关系,有待进一步的研究.经革兰氏染色镜检发现BC-2菌为G+杆菌(图1),其生理生化的鉴定结果如表4所示.由北京三博远志公司测定BC-2菌的16SrDNA的序列长度为1 242bp,GenBank公司经BankIt提交申请获得国际基因库接受的序列号为JN230702.经Blast比对分析后显示与该基因序列同源性较高的全部是芽孢杆菌,其中大部分为蜡状芽孢杆菌.图4为系统发育树,其中括号内编号为GenBank序列号,结点处数字为Bootstrap值.从图4可知:该菌与编号为DQ420176.1的同源性最高(达97%),且聚为一分支 .综合BC-2的形态、生理生化鉴定与16SrDNA基因序列分析结果,将BC-2致病菌鉴定为蜡状芽孢杆菌(Bacillus cereus).蜡状芽孢杆菌群包括蜡状芽孢杆菌、苏云金芽孢杆菌、蕈状芽孢杆菌、炭疽芽孢杆菌、韦氏芽孢杆菌、假蕈状芽孢杆菌[14].蜡状芽孢杆菌是一种革兰氏阳性,需氧,特定条件下厌氧,运动型的,能产生内生孢子并产生有毒物质的棒状杆菌.其内生孢子是一种高度物化的处于休眠状态的一类细胞,能抵抗极端环境,如热、脱水及其他物理刺激 .蜡状芽孢杆菌能在苛刻环境中幸存是由于其孢子,一旦生存环境有利,则孢子会生长并大量繁殖[15].但也有人发现孢子形成的环境对孢子的特性有影响,如耐热性与孢子形成的温度有关[3,16].近年来,对蜡状芽孢杆菌的致病性的研究表明,蜡状芽孢杆菌能引起人体产生腹泻和呕吐[17]、出血病[18]、角膜炎[19]、急性眼内炎[20-21].Lee等[22]报导了有关革兰氏阳性芽孢杆菌引起的皮肤类白侯感染症状.Xing等[23]发现在免疫缺陷病人中蜡状芽孢杆菌能引起肝脓肿和出血病.Chatterjee等[24]通过统计发现4 407只疟蚊幼体中有2.8%被蜡状芽孢杆菌所感染.Andrea等[25]发现在肝病晚期病人中蜡状芽孢杆菌引起的噬肉病,并且认为蜡状芽孢杆菌应该被视为一种病原菌而不仅仅是污染.研究表明蜡状芽孢杆菌是一种能引起人类产生食物中毒的病原菌[8].本研究表明:蜡状芽孢杆菌也能致罗非鱼感染,表现出出血病状并引起高致死率.其不仅对人类健康食品生产是一种威胁,而且对罗非鱼也具潜在危害.因此,进行水产养殖中罗非鱼的致病菌之一——蜡状芽孢杆菌的研究,对于食品安全及水产养殖两方面都具有积极的意义,就像Andrea所呼吁的一样,蜡状芽孢杆菌应该被视为一种致病菌而非仅是一种对食品的污染.关于鱼的病理组织结构已经有不少科学工作者有过相关的研究.蔡完其等[26]研究罗非鱼溃烂病的病理结构时发现其患病骨胳肿大、肝细胞和肾上皮细胞颗粒变性,并且乳酸脱氢酶、苹果酸脱氢酶等同工酶活性减弱或消失 .秦蕾等[27]对养殖中的大菱鲆的爱德华氏病进行了菌种分离,并经16SrDNA鉴定为迟钝爱德华氏菌;而对患病的大菱鲆的组织切片发现的肾脏病变最为明显,用光镜与电镜发现该病的要主特征是巨噬细胞增生以及肉芽肿的形成 .汪开毓等[28]从斑点叉尾急性流行病分离到一株嗜麦芽寡养单胞菌,并对其进行组织病理观察,发现病变主要表现为全身组织器官广泛性水肿,其骨骼肌、肝等部位损伤较为严重,超微结构发现其线粒体与细胞核明显损伤.隗黎丽[29]研究了微囊藻毒素对鱼类的组织结构的变化,发现肝和肾脏等组织有一定程度的受损.这些相关文献的报道,发现病原菌对鱼的病变的主要部位在肝.文中从患出血病的罗非鱼病灶部位筛选出致罗非鱼产生较大死亡率的病源菌,从病理组织切片发现其病变组织最明显的是鳃和肠,其中鳃明显肿胀,而小肠则表现为上皮细胞松散、组织结构明显遭受破坏 .这与之前相关研究人员报道的爱德华氏菌导致的肝是主要的病变部位有区别[26-28,30-31].以该蜡状芽孢杆菌为出发菌株,开发对罗非鱼及水产养殖中对抗此种病的各种疫苗的研制,通过免疫来增强鱼体自身免疫力、减少抗生素的使用营造一个健康、生态的食物链关系,具有一定的研究意义和广泛的应用前景.(责任编辑:钱筠英文审校:刘源岗)【相关文献】[1]曹维国.常见尼罗罗非鱼病的诊治[J].中国水产,1984(2):24-25.[2]李槿年,沈守琼,余为一,等.正常鱼体内条件致病菌种类的调查研究[J].淡水渔业,1999(2):21-24.[3]邓国成,江小燕,叶星,等.草鱼出血病混合感染的嗜水气单胞菌的分离、鉴定与理化特性[J].微生物学通报,2009,36(8):1170-1173.[4]卢迈新,黎炯,叶星,等.广东与海南养殖罗非鱼无乳链球菌的分离、鉴定与特性分析[J].微生物学通报,2010,37(5):766-774.[5]FIGUEIREDO H C P,KLESIUS P H,ARIAS C R,et al.Isolation and characterization of strains of Flavobacterium columnare from Brazil[J].Journal of Fish Diseases,2005,28(4):199-204.[6]EVANS J J,KLESIUS P H,PASNIK D J,et al.Human streptococcus agalactiae Isolate in nile tilapia(Oreochromis niloticus)[J].Emerging Infectious Diseases,2009,15(5):774-776.[7]SOTO E,HAWKE J P,FERNANDEZ D,et al.Francisella sp.,an emerging pathogenof tilapia,Oreochromis niloticus (L.),in Costa Rica[J].Journal of Fish Diseases,2009,32(8):713-722.[8]NA J S,KIM T H,KIM H S,et al.Liver abscess and sepsis with Bacillus pantothenticus in an immunocompetent patient:A first case report[J].World Journal of Gastroenterology,2009,15(42):5360-5363.[9]冯斯敏,云金蕊.蜡状芽胞杆菌引起军曹鱼大批死亡的报告[J].中国水产,2000(8):39-40.[10]彭喜春,张宁,冉艳红,等.海产品中溶藻弧菌的筛选及其致病因子的研究[J].现代食品科技,2008,24(4):312-315.[11]刘云,刘允坤,杨栋,等.牙鲆迟缓爱德华氏菌急性感染实验:4种不同方法的比较[J].海洋科学,2001,25(2):8-11.[12]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.[13]FINNEY D J.Probit analysis[M].Cambridge:Cambridge University Press,1977. [14]ABEE T,GROOT M N,TEMPELAARS M,et al.Germination and outgrowth of spores of Bacillus cereus group members:Diversity and role of germinant receptors [J].Food Microbiology,2011,28(2):199-208.[15]BEDNARCZYK A,DACZKOWSKA-KOZON E G.Pathogenic features of bacteriafrom the Bacillus cereus group[J].Postepy Mikrobiologii,2008,47(1):51-63. [16]CARLIN F,BRILLARD J,BROUSSOLLE V,et al.Adaptation of Bacillus cereus,an ubiquitous worldwide-distributed foodborne pathogen,to a changing environment [J].Food Research International,2010,43(7):1885-1894.[17]ARAGON-ALEGRO L C,PALCICH G,LOPES G V,et al.Enterotoxigenic and genetic profiles of Bacillus cereus strains of food origin in Brazil[J].Journal of Food Protection,2008,71(10):2115-2118.[18]施彪,戚爱军.蜡样芽孢杆菌引起败血症1例[J].淮海医药,1999,17(增刊1):2. [19]张国富,姚远.蜡样芽孢杆菌引起角膜炎结膜炎的诊断与分析[J].实用医技杂志,2001,8(4):252.[20]陈滨,胡勇平,项燕,等.蜡样芽孢杆菌致暴发性眼内炎2例[J].中国眼耳鼻喉科杂志,2009,9(4):255,274.[21]刘春林,徐红云,李红,等.蜡样芽孢杆菌致急性眼内炎1例[J].中国实用医药,2010,5(6):154.[22]LEE P L,LEMOS B,O′BRIEN S H,et al.Cutaneous diphtheroid infection and review of other cutaneous grampositive Bacillus infections[J].Cutis,2007,79(5):371-377. [23]XING Jian-ming,ZHANG Su,DU Ying,et al.Rapid detection of intestinal pathogens in fecal samples by an improved reverse dot blot method[J].World Journalof Gastroenterology,2009,15(20):2537-2542.[24]CHATTERJEE S,GHOSH T S,DAS S.Virulence of Bacillus cereus as natural facultative pathogen of Anopheles subpictus Grassi(Diptera:Culicidae)larvae in submerged rice-fields and shallow ponds[J].African Journal of Biotechnology,2010,9(41):6983-6986.[25]ANDREA H,GUPTE A,MCAULIFFE P F,et al.Bacillus cereus necrotizing fasciitis in a patient with end-stage liver disease[J].Surgical Infections,2010,11(5):469-474.[26]蔡完其,黄琪琰.尼罗罗非鱼溃烂病的病理研究[J].水产学报,1986,10(3):261-271.[27]秦蕾.养殖大菱鲆爱德华氏菌病及其几种重要疾病的病理学研究[D].青岛:中国海洋大学,2006.[28]汪开毓,耿毅,陈德芳,等.斑点叉尾鮰急性流行性传染病的病原分离与病理学观察[J].中国水产科学,2007,14(3):457-465.[29]隗黎丽.微囊藻毒素对鱼类的毒性效应[J].生态学报,2010,30(12):3304-3310. [30]郭琼林,卢全章.鳗鲡爱德华氏菌病的组织病理学研究[J].水生生物学报,1995,19(1):56-60.[31]韩先朴,李伟,潘金培.爱德华氏菌人工经口感染及病理观察[J].水生生物学报,1995,19(3):245-249.。
罗非鱼无乳链球菌的病理学观察-2

罗非鱼无乳链球菌病的病理学观察祝璟琳,李大宇,邹芝英,肖炜,乐贻荣,韩珏,杨弘 (中国水产科学研究院淡水渔业研究中心, 农业部淡水渔业和种质资源利用重点实验室,江苏无锡214081)摘要:采用光学显微镜和透射电子显微镜技术分别对患无乳链球菌(Streptococcus agalactiae)病的罗非鱼的病理学变化进行了研究。
结果显示罗非鱼自然感染无乳链球菌的病理学变化主要是引起各器官的充血,水肿,炎性细胞浸润,严重的细胞变性坏死。
各脏器表现为肝炎、脾炎、脑炎和心肌炎。
超微组织病理学研究显示肝、脾、脑、眼和肠等组织大量链球菌菌进入细胞,破坏细胞结构和各种细胞器。
核溶解,核固缩,出现核沟,细胞界限模糊,细胞质空泡化严重,染色质边集,线粒体肿大,嵴断裂,凋亡。
内质网肿大,断裂,粗面内质网核糖体脱落,出现同心圆小体。
细胞膜上出现伪足,细胞间隙变大,大量溶酶体增生,心肌和骨骼肌纤维断裂,紊乱,肌节长短不一。
研究表明,无乳链球菌能造成罗非鱼全身性多组织器官病变,引起功能障碍,最后导致鱼体死亡。
关键词:罗非鱼; 无乳链球菌; 组织病理;超微病理中图分类号:S941 文献标识码:A无乳链球菌(Streptococcus agalactiae)也称B族链球菌(Group B Streptococcus,GBS),是一种广泛分布于自然界的革兰氏阳性菌,可引起新生儿脑膜炎、败血症及肺炎等(Jones et al., 2003; Brochet et al., 2006; Johri et al., 2006),同时它也感染其它包括猪、牛、鱼等多种脊椎动物。
目前已有12多个国家报道了鱼类链球菌病的暴发与流行,受感染的鱼类包括多种海水和淡水鱼类,罗非鱼等温水性鱼类受链球菌的危害尤其严重(祝璟琳等,2010;Duremdez et al., 2004;Suanyuk et al., 2008;Hernández et al., 2009;Evans et al., 2009;Mian et al., 2009)。
病原体分离与鉴定

挑取优势单菌落,转接至新琼脂平板,同样在恒温培养箱中培养24h进行纯培养。
9、革兰氏染色
挑取溶菌落涂在载玻片上上,草酸铵结晶紫染1分钟,无菌水冲洗,加碘液覆盖涂面染1分钟,再无菌水冲洗,用吸水纸吸去水分。加95%酒精数滴,并轻轻摇动进行脱色,30秒后水洗,吸去水分。蕃红梁色液染10秒钟后,无菌水冲洗。镜检优势菌的形态特征。
10、回感试验
加适量生理盐水在试管中,挑取适量菌落分散在生理盐水中。从108-104CFU/ml浸泡健康鱼苗5min,试验鱼置于1.0 m×0.5 m×0.5 m的水族箱中饲养,连续充气,水温28 ~ 29℃。连续观察14 d,进行观察记录。及时将感染后的鱼取出。解剖观察病变情况。从濒死病鱼的肝脏重新分离、纯化细菌,进行二次人工感染试验。
4、制备组织
用解剖刀划开鱼腹,用灭菌镊子摘取感病鱼的肝脏、肾脏、胆囊,血液分别转入1.5ml灭菌离心管中,剪碎。
5、加入500ul灭菌水,混均。
6、划平板
吸取200ul,涂布平板
或直接用接种针蘸取4步组织碎片,在脂平板上直接划线,在恒温培养箱中培养24h。
7、镜检观察
观察平板上是否有菌落形成,及形态特征。
11、分离及鉴定致病菌
12、致病菌的保存
13、致病菌生理生化试验(按需要进行)
罗非鱼鱼苗病原菌的分离与鉴定
一、材料
发病罗非鱼鱼苗
二、培养基
HBI培养基
LB培养基
牛肉膏蛋白胨培养基
仪器材料:
小离心管
200ul枪头
灭菌甘油
0.9%生理盐水
75%酒精
镊子
2、鱼体称重
实验前对病鱼进行称重,并记录数据。
3、鱼体消毒
取病鱼浸入75%乙醇中,用无菌镊子取出后,转入无菌生理盐水中,洗涤2—3次,再转至无菌生理盐水中备用。
淡水养殖鱼类病原菌药敏实验

淡水养殖鱼类病原菌药敏实验
林春友;王云祥
【期刊名称】《水利渔业》
【年(卷),期】2004(24)3
【摘要】25种抗菌药物对淡水鱼类6种病原菌分别表现出敏感、中度敏感和耐药3种结果.测定14种抗菌药物对淡水鱼类6种病原菌的最小抑菌浓度,结果显示,不同药物对同一病原菌和同一药物对不同病原菌均具有不同的MIC.在淡水鱼类细菌病防治过程中,应选择药敏反应敏感或MIC较低且吸收较好的抗菌药物,并交替使用,以防止耐药菌株的产生.
【总页数】2页(P58-59)
【作者】林春友;王云祥
【作者单位】天津市水产研究所,300221;天津市水产研究所,300221
【正文语种】中文
【中图分类】S948
【相关文献】
1.2016~2017年天津市环湖医院病原菌分布特点及药敏实验结果分析 [J], 辛颖
2.老年肺癌患者化疗期间并发医院感染的危险因素及病原菌分布和药敏实验 [J], 彭燕琼;李秀娟;杜荣
3.黄颡鱼烂身病病原菌的分离及药敏实验 [J], 孙昌飞;祭仲石;韦艳;厉成新;王中清
4.老年慢性阻塞性肺疾病合并肺部感染的病原菌分布情况及药敏实验分析 [J], 唐文成
5.肾盂及输尿管结石患者术后泌尿系统感染的病原菌、药敏实验及影响因素分析[J], 赵卫红;王增利;王明;孙飞达
因版权原因,仅展示原文概要,查看原文内容请购买。
罗非鱼池塘养殖中水质、寄生虫、细菌病的防治方案(2)

罗非鱼池塘养殖中水质、寄生虫、细菌病的防治方案(2)张韵桐
【期刊名称】《渔业致富指南》
【年(卷),期】2012(000)013
【摘要】近年来.罗非鱼细菌性链球菌病发病比较普遍,严重,损失大。
究其原因有:①罗非鱼病原细菌不单是链球菌属,还有爱德华氏菌属、气单胞菌属、假单胞菌属、黄杆菌属、噬纤维菌属,病症有重叠,光靠用眼睛看病症来确定病原很难准确,极可能误判,不能对症用药。
【总页数】1页(P75-75)
【作者】张韵桐
【作者单位】武汉市科洋生物工程有限公司;广东海洋大学水产学院
【正文语种】中文
【中图分类】S965.125
【相关文献】
1.不同投饲策略对池塘养殖罗非鱼生长及主要水质因子的影响 [J], 贾峥;程光平;何绪伟;刘明涛;娄方瑞;张曼;李文红
2.罗非鱼池塘养殖中水质处理及细菌性、寄生虫性疾病防治(上) [J], 张韵桐
3.罗非鱼池塘养殖中水质处理及细菌性、寄生虫性疾病防治(下) [J], 张韵桐
4.罗非鱼池塘养殖中水质、寄生虫、细菌病的防治方案(1) [J], 张韵桐
5.罗非鱼常见细菌病及防治方法 [J], 金霄[1];李灿[1];孙宗毅[1];李明[2];汪建国[2]
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
测定天数(n=27) 实测值
2007/5/14~06/08 适宜范围
表 2 罗非鱼养殖池水的理化指标 (X ± SD) Table 2 Physicochemical parameters in pond culture water (X ± SD)
水温(℃) 28~35 32.17±2.06 25~34
参考标准 GB/T 4789.6 - 2003
SN 0184 - 93 GB/T 4789.4 - 2003 GB/T 4789.10 - 2003 GB/T 4789.7 - 2003 GB/T 4789.11 - 2003
SN/T 0475 - 95 GB 7918.4 - 87
-
培养基 乳糖胆盐发酵培养基、E M B 培养基、生化试验配套试剂 F R A S E R 增菌液、O X A 平板、T S A - T E 、T S B - Y E 、生化试验配套试剂 B P 缓冲液、S C 增菌液、S S 琼脂、生化试验配套试剂 7.5%NaCl 肉汤、Baird-parker 琼脂、血平板、生化试验配套试剂 氯化钠结晶紫增菌液、N a C l 蔗糖培养基、嗜盐琼脂培养基、生化试验配套试剂
so on; but the dominant position were changed with different samples. The bacterial flora were simple in putrid meat, Pseudomonas
cepacie, Aeromonas hydrophila and Bacillus brevis were dominant spoilage organism, with a small number of Edwardsiella tarda
Total 353 isolates were dominated by Gram-negative bacteria. Bacillus sp., Enterobacteriaceae sp. and Vibrionaceae sp. were
predominant in pond water and fresh fish, with a small number of Pseudomonas sp, Enterococcus sp., Staphylococcus sp. and
1.2.2 货价期终点的腐败肉样 冷休克致死后的鱼随机抽取 2 尾,去鳞、内脏和
鳃,洗净沥干,置洁净托盘中,用保鲜膜密封,于 3 7 ℃培养箱中有氧储藏至感官判定腐败。沿脊骨剖切, 取一侧带皮鱼肉,放入组织捣碎机搅碎,取 25g 于 225ml 无菌生理盐水中。
1.2.3 养殖池的水样 分别取罗非鱼养殖池四边形的四个点,采用无菌水
1 材料与方法
1.1 样品采集 鲜活奥尼罗非鱼(Oreochromis niloticus×O.aureus)
取自广东省某淡水罗非鱼养殖场,选择健康活鱼 15 尾, 每尾重 400~500g,立即放入冰水中冷休克,层冰层鱼 层冰放置于隔热泡沫箱中,保持鱼体温度在 0~4℃,并 于 3 h 内运往实验室分析检验。 1.2 微生物取样
in freshwater, were estimated both quantitatively and qualitatively. The results showed that total viable count of bacteria in above
samples respectively were 2.6×104 CFU/ml, 1.0×103 CFU/cm2, 2.2×103 CFU/g, 1.4×105 CFU/g and 5.4×107 CFU/g.
中图分类号:S965.125
文献标识码:A
文章编号:1002-6630(2008)05-0327-05
罗非鱼是我国重要的养殖鱼类之一,具有重要的经 济价值,在出口创汇方面发挥了重要作用,其食用安全 性也越来越受到关注[ 1 ] 。对罗非鱼的养殖环境、产品本
身的主要腐败菌和病原菌进行检测和有效控制是实现罗非 鱼产品质量安全,保障该养殖产业健康发展的关键[ 2 ] 。
葡萄糖肉浸液、血平板、生化试验配套试剂 叠氮化钠培养基、PSE 琼脂、生化试验配套试剂 S C D L P 、十六烷三甲基溴化铵培养基、生化试验配套试剂
假单胞菌选择性培养基,25℃培养 48h
注:以上选择性培养基均购于广东环凯生物技术有限公司。
※生物工程
食品科学
2008, Vol. 29, No. 05 329
2.Beijing Beishui Food Industry Co. Ltd., Beijing 101108, China)
Abstract:The bacterial flora occurring in pond water, surface mucus, gills, intestine and putrid meat of healthy tilapia cultured
摘 要:本实验分析了刚捕获淡水养殖罗非鱼的体表黏液、腮、肠道、腐败肉和养殖池水的细菌菌相,结果表 明,以上样品的菌落总数分别为 1.0 × 103CFU/cm2、2.2 × 103CFU/g、1.4 × 105CFU/g、5.4 × 107CFU/g 和 2.6 × 104CFU/ml;共分离出 353 株菌,以革兰氏阴性菌为主。池水和新鲜鱼体的优势菌为芽孢杆菌、肠杆菌科、弧菌 科,其主导地位随样品不同而有所差异,还有少量假单胞菌属、肠球菌属、葡萄球菌属等。腐败肉中的菌相较 单一,优势菌为洋葱假单胞菌、嗜水气单胞菌和短芽孢杆菌,迟钝爱德华菌和克吕沃尔菌属少量。同时参照 G B 和 S N 标准对刚捕获罗非鱼的体表黏液、腮、肠道中病原菌进行分析,结果表明,在鱼体中检出大肠埃希氏菌、 粪链球菌和铜绿假单胞菌,未检出单核增生李斯特氏菌、沙门氏菌、金黄色葡萄球菌、副溶血弧菌和溶血性链球 菌等病原菌。 关键词:罗非鱼;菌相;病原菌;腐败菌
1.2.1 新鲜鱼体取样
1.2.1.1 体表黏液 采用棉试法,共取鱼体两侧 25cm2 黏液于 225ml 无
菌生理盐水中。
1.2.1.2 肠道 用含 7 5 % 酒精棉球拭擦鱼体表,无菌取出 1 3 尾鱼
的肠道,置于无菌广口瓶中,混匀,取 5 g 于 4 5 m l 无 菌生理盐水中。
1.2.1.3 腮 取样方法同肠道。
※生物工程
食品科学
2008, Vol. 29, No. 05 327
淡水养殖罗非鱼中病原菌和腐败菌的 分离与鉴定初探
刘寿春 1,周 康 1,钟赛意 1,李平兰 1,马长伟 1,* ,彭朝辉 2
(1.中国农业大学食品科学与营养工程学院,北京
100083;
2.北京北水食品工业有限公司,北京 101108)
在取样前后 27d 内,每天早中晚分别测定水温、溶 氧、p H 、盐度、亚硝酸氮( N O 2-- N ) 和氨氮( N H 4+- N ) 。
2 结果与分析
2.1 罗非鱼养殖池水的理化指标分析 罗非鱼养殖池水的理化指标如表 2,采样前后的 27d
内,池水温度较高,p H 中性,溶氧、亚硝酸氮和氨 氮浓度适宜。本实验池为纯淡水,盐度几乎为零。 2.2 淡 水 养 殖 罗 非 鱼 的 池 水 、 黏 液 、 腮 、 肠 及 其 腐
表 1 淡水养殖的罗非鱼体中不同病原菌的分析方法 Table 1 Standard methods on different pathogens of freshwater cultured tilapia
病原菌 大肠埃希氏菌及计数 单核增生李斯特氏菌
沙门氏菌 金黄色葡萄球菌
副溶血弧菌 溶血性链球菌 粪链球菌及计数 铜绿假单胞菌 假单胞菌属计数
pH 6.7~7.2 6.97±0.11 7.0~8.5
溶氧(mg/L) 3.47~4.28 4.15±0.58
and Kluyvera spp. In addition, GB and SN standard methods were used in detecting the pathogens on surface mucus, gills and
intestine of newly-harvested tilapia, Escherichia coli, Pseudomonas aeruginosa and Streptococcus faecalis were detected, but
328 2008, Vol. 29, No. 05
Hale Waihona Puke 食品科学※生物工程
菌菌相的相互关系;也有研究报道从罗非鱼体中分离出 了致病性的链球菌、嗜水气单胞菌、假单胞菌、爱德 华氏菌等[4];而许钟等[5-6]建立了罗非鱼在 0~15℃恒温和 波动温度储藏下特定腐败菌的生长曲线和货架期预测模 型。罗非鱼在捕获后处理、加工、储运和销售过程中 极易受到微生物的污染,导致肉质腐败,影响食用安 全性。这方面的研究极少见于报道。本实验初步探讨 罗非鱼的养殖池水、刚捕获的新鲜鱼体、货价期终点 腐败肉样的菌落总数和菌群组成,同时参照 G B 和 S N 标 准对刚捕获新鲜罗非鱼鱼体的病原菌进行检测与计数; 从而了解罗非鱼的养殖环境和原料自身的细菌学特征, 为后续加工有效控制微生物腐败和潜在危害提供依据。
分别以鱼的体表黏液、肠道、腮、腐败肉和池水 为样品,采用含 0.5% NaCl 的平板计数琼脂(PCA)30℃有 氧培养 48h。选取菌落总数在 30~100 的平板,分离整 个平板一半的菌株或整个平板的所有菌株。肉眼观察菌 落特征完全相同的菌落,并计数, 数量最多的 3~4 种菌 株作为优势菌,采用营养琼脂划线纯化,革兰氏染色, 观察细胞形态,最后参照文献[7]结合 API 系统(法国生 物梅里埃公司) 进行细菌鉴定和分类。为进一步确认罗 非鱼的微生物安全性,本实验还采用 GB 和 SN 标准针对 新鲜鱼体检测以下可能存在的病原菌,并对检出的病原 菌进行计数。具体方法见表 1 。 1.4 理化指标测定
