文件编制申请及批准表(新GSP)
GSP申请表

受理编号:药品经营质量管理规范认证申请书申请单位:雄县康沐医药销售有限公司(公章)填报日期2019 年 1 月 13 日受理部门:受理日期:年月日填报说明1、内容填写应准确、完整,不得涂改和复印。
2、报送认证申请书及其他申报情况表时,按有关栏目填写执业药师或专业技术职称和学历的情况,应附有执业药师注册证书或专业技术职称证书和学历证书的复印件。
3、认证申请书以及其他申报资料,应统一使用A4型纸张,标明目录及页码并装订成册。
GSP认证申报资料初审表注:本表由初审部门根据审查结果填写。
“审查结果”栏根据实际情况填写“合格”或“合理缺项”字样。
企业所属药品经营单位情况表填报单位:(盖章)填报日期: 年月日企业法人、负责人和处方审核人情况表填报单位:(盖章)填报日期: 年月日企业药品质量管理、采购、验收及养护人员情况表填报单位:(盖章)填报日期: 年月日(单位)授权委托书保定市行政审批局:兹委托在保定市行政审批局办理事宜。
授权范围:□1、接受行政机关依法告知的权利。
□2、代为提交申请材料、更正、补正、补充材料的权利。
□3、代理申请人行政许可审查中的陈述和申辩的权利。
□4、签收的权利。
□5、其他权利。
委托期限自年月日至年月日。
委托人(法人或企业负责人签字):被委托人(签字):(委托人单位公章)年月日注:已授权的请在□中打“√”,未授权的请在□中打“×”。
申请材料真实性自我保证声明保定市行政审批局:我单位申请《药品经营质量管理规范》认证,提交如下材料:1.《药品经营许可证》正、副本复印件2. 《营业执照》正、副本复印件3. 地理位置图4. 营业场所平面布局图5. 员工花名册6. 质量管理制度目录7. 设施设备情况表8. 组织机构与质量管理职能框图9. 法人、企业负责人及质量管理人员情况我单位保证:提交的申请材料内容真实、有效,并对申请材料实质内容的真实性负责,如有虚假愿承担相应法律责任。
法定代表人签字:企业公章年月日年月日。
新版GSP体系文件-汇编4-表格

文件编制申请批准表编号:XXXDYF-JL-2017-01申请人(部门):药房员工花名册编号:XXXDYF-JL-2017-02供货方汇总表编号:XXXDYF-JL-2017-03供货方质量体系调查表编号:XXXDYF-JL-2017-04制度检查考核记录表编号:XXXDYF-JL-2017-05证件过期提预警表编号:XXXDYF-JL-2017-06员工培训记录表编号:XXXDYF-JL-2017-07 部门:员工培训计划一览表编号:XXXDYF-JL-2017-08 部门:培训时间:至药师在岗服务记录表编号:XXXDYF-JL-2017-09部门:药师信息表编号:XXXDYF-JL-2017-10部门:药品追回记录表编号:XXXDYF-JL-2017-11日期范围:至部门:药品召回记录表编号:XXXDYF-JL-2017-12日期范围:至部门:药品销售记录表编号:XXXDYF-JL-2017-13部门:日期范围:至药品停售通知编号:XXXDYF-JL-2017-14药品拒收报告单编号:XXXDYF-JL-2017-15门店:验收日期:至药品解除停售通知编号:XXXDYF-JL-2017-16药品采购记录表编号:XXXDYF-JL-2017-17日期范围:销售退回记录表编号:XXXDYF-JL-2017-18部门:日期范围:温湿度检测记录表编号:XXXDYF-JL-2017-19数据修改审批表编号:XXXDYF-JL-2017-20XXXXXXX大药房数据修改记录表编号:XXXDYF-JL-2017-21首营企业审批表编号:XXXDYF-JL-2017-22填表人:首营品种审批表编号:XXXDYF-JL-2017-23填表人:缺货登记记录表编号:XXXDYF-JL-2017-24XXXXXXX大药房员工健康检查汇总表编号:XXXDYF-JL-2017-25 部门:检查日期:至XXXXXXX大药房员工个人健康档案表编号:XXXDYF-JL-2017-26姓名:检查日期:至XXXXXXX大药房设施设备一览表编号:XXXDYF-JL-2017-27部门:XXXXXXX大药房特殊药品复方制剂销售登记表编号:XXXDYF-JL-2017-28部门:登记日期:至XXXXXXX大药房购进药品验收记录表编号:XXXDYF-JL-2017-29部门:日期范围:XXXXXXX大药房供货方人员资质表编号:XXXDYF-JL-2017-30XXXXXXX大药房处方药销售记录表编号:XXXDYF-JL-2017-31陈列药品质量检查记录表编号:XXXDYF-JL-2017-32 日期范围:不合格药品处理记录表编号:XXXDYF-JL-2017-33XXXXXXX大药房不合格药品报损审批表编号:XXXDYF-JL-2017-34XXXXXXX大药房报废药品销毁表编号:XXXDYF-JL-2017-35部门:销毁日期:至顾客意见征询表编号:XXXDYF-JL-2017-36尊敬的顾客:为提高本药店药品经营质量管理水平和服务水平,请您提供宝贵意见和建议。
gsp需要的表格-Microsoft-Word-文档-(9)

新版GSP认证零售药店需要哪些记录表格?一、质量管理体系文件1 文件发放回收记录……………………………… ZD—WJ—01—012 文件变更履历表………………………………… ZD—WJ—01—023 文件销毁申请单………………………………… ZD—WJ—01—034 文件销毁记录…………………………………… ZD—WJ—01—045 文件制作申请单………………………………… GC—WJ—02—016 文件会审单……………………………………… GC—WJ—02—02二、质量管理7 质量信息处理审批单…………………………… ZD—ZG—03—018 质量信息汇总表………………………………… ZD—ZG—03—029 现场调查记录…………………………………… ZD—ZG—04—0110 质量事故报告…………………………………… ZD—ZG—04—0211 质量查询函……………………………………… ZD—ZG—05—0112 质量查询及处理记录…………………………… ZD—ZG—05—0213 药品不良反应报告表…………………………… ZD—ZG—06—0114 归档资料凭单…………………………………… ZD—ZG—08—0115 档案资料借阅登记簿…………………………… ZD—ZG—08—0216 档案资料销毁审批表…………………………… ZD—ZG—08—0317 档案资料销毁记录……………………………… ZD—ZG—08—0418 质量制度检查考核记录………………………… ZD—ZG—09—0119 供货单位质量管理体系评价表………………… ZD—ZG—10—0120 供货单位质量管理体系评价报告表…………… ZD—ZG—10—0221 购货单位质量管理体系评价表(生产、经营) ZD—ZG—11—0122 购货单位质量管理体系评价表(医疗机构)… ZD—ZG—11—0223 药品质量评审计划…………………………… ZD—ZG—12—01 序号记录名称记录编号24 药品购进情况质量评审表……………………… ZD—ZG—12—0225 药品质量评审报告……………………………… ZD—ZG—12—0326 质量管理体系内部审核计划………………………GC—ZG—01—0127 质量管理体系内部审核实施方案……………… GC—ZG—01—0228 质量管理体系内部审核检查表……………………GC—ZG—01—0329 纠正/预防措施跟踪记录表………………………GC—ZG—01—0430 质量管理体系内部审核会议记录…………………GC—ZG—01—0531 质量管理体系内部审核报告………………………GC—ZG—01—0632 参加会议人员签到表………………………………GC—ZG—01—0733 公司质量方针、目标实施情况检查表……………GC—ZG—02—0134 部门质量方针、目标实施情况自查表……………GC—ZG—02—0235 质量方针、目标实施情况评价汇总表……………GC—ZG—02—0336 质量投诉调查处理记录……………………………GC—ZG—03—0137 质量投诉处理结果反馈与跟踪记录………………GC—ZG—03—0238 药品经营各环节质量风险管理评价与控制表……GC—ZG—04—0139 质量风险评估表……………………………………GC—ZG—04—0240 质量风险控制表……………………………………GC—ZG—04—0341 质量风险审核表……………………………………GC—ZG—04—0442 管理评审计划………………………………………GC—ZG—05—0143 管理评审报告………………………………………GC—ZG—05—0244 管理评审改进跟踪验证表…………………………GC—ZG—05—03三、人员与培训45 职工教育培训计划…………………………………ZD—RP—01—0146 培训方案……………………………………………ZD—RP—01—0247 培训签到表…………………………………………ZD—RP—01—0348 个人培训考核记录…………………………………ZD—RP—01—0449 培训考核汇总表……………………………………ZD—RP—01—05 序号记录名称记录编号50 培训汇总表…………………………………………ZD—RP—01—0651 外出培训登记表……………………………………ZD—RP—01—0752 健康检查工作安排…………………………………ZD—RP—02—0153 员工健康档案表……………………………………ZD—RP—02—0254 体检汇总表…………………………………………ZD—RP—02—0355 员工健康异常情况报告单…………………………ZD—RP—02—0456 企业员工花名册……………………………………ZD—RP—03—0157 应聘登记表…………………………………………ZD—RP—03—02四、设施设备58 设施设备台帐…………………………………… ZD—SS—01—0159 设备检查记录…………………………………… ZD—SS—01—0260 设备保养记录…………………………………… ZD—SS—01—0361 设备维修记录…………………………………… ZD—SS—01—0462 设施设备档案…………………………………… ZD—SS—01—05五、校准与验证63 检定、校准与验证计划………………………… ZD—JY—01—01六、计算机64 计算机系统操作权限授权审批表…………………ZD—JX—02—01七、采购65 首营企业审批表………………………………… ZD—CG—02—0166 首营品种审批表………………………………… ZD—CG—03—0167 销售员资格验证记录卡………………………… ZD—CG—04—0168 药品采购计划…………………………………… GC—CG—01—0169 中药材采购计划………………………………… GC—CG—01—0270 中药饮片采购计划……………………………… GC—CG—01—0371 药品采购记录…………………………………… GC—CG—01—0472 中药材采购记录………………………………… GC—CG—01—05 序号记录名称记录编号73 中药饮片采购记录……………………………… GC—CG—01—0674 专门管理药品采购记录………………………… GC—CG—01—0775 冷藏、冷冻药品采购记录……………………… GC—CG—01—0876 直调药品采购记录……………………………… GC—CG—01—0977 购进药品退出通知单…………………………… GC—CG—01—1078 购进药品退出记录……………………………… GC—CG—01—1179 购进专门管理药品退出记录…………………… GC—CG—01—1280 购进中药材退出记录…………………………… GC—CG—01—1381 购进中药饮片退出记录………………………… GC—CG—01—14八、收货与验收82 药品收货记录…………………………………… GC—SY—01—0183 中药材收货记录………………………………… GC—SY—01—0284 中药饮片收货记录……………………………… GC—SY—01—0385 冷藏、冷冻药品收货记录……………………… GC—SY—01—0486 专门管理药品收货记录………………………… GC—SY—01—0587 药品到货拒收记录……………………………… GC—SY—01—0688 中药材到货拒收记录…………………………… GC—SY—01—0789 中药饮片到货拒收记录………………………… GC—SY—01—0890 冷藏、冷冻药品到货拒收记录………………… GC—SY—01—0991 专门管理药品到货拒收记录…………………… GC—SY—01—1092 委托运输药品收货记录………………………… GC—SY—01—1193 委托运输中药材收货记录……………………… GC—SY—01—1294 委托运输中药饮片收货记录…………………… GC—SY—01—1395 委托运输冷藏、冷冻药品收货记录…………… GC—SY—01—1496 委托运输专门管理药品收货记录……………… GC—SY—01—1597 药品到货拒收单……………………………………GC—SY—01—1698 销后退回药品收货记录………………………… GC—SY—01—17序号记录名称记录编号99 销后退回中药材收货记录…………………………GC—SY—01—18 100 销后退回中药饮片收货记录………………………GC—SY—01—19 101 销后退回冷藏、冷冻药品收货记录………………GC—SY—01—20 102 销后退回专门管理药品收货记录…………………GC—SY—01—21 103 销后退回药品到货拒收单…………………………GC—SY—01—22 104 销后退回药品到货拒收记录………………………GC—SY—01—23 105 销后退回中药材到货拒收记录……………………GC—SY—01—24 106 销后退回中药饮片到货拒收记录…………………GC—SY—01—25 107 销后退回冷藏、冷冻药品到货拒收记录…………GC—SY—01—26 108 销后退回专门管理药品到货拒收记录……………GC—SY—01—27 109 药品验收记录…………………………………… GC—SY—02—01 110 中药材验收记录………………………………… GC—SY—02—02 111 中药饮片验收记录……………………………… GC—SY—02—03 112 专门管理药品验收记录………………………… GC—SY—02—04 113 冷藏、冷冻药品验收记录……………………… GC—SY—02—05 114 销后退回药品验收记录………………………… GC—SY—02—06 115 销后退回中药材验收记录……………………… GC—SY—02—07 116 销后退回中药饮片验收记录………………………GC—SY—02—08 117 销后退回专门管理药品验收记录…………………GC—SY—02—09 118 销后退回冷藏、冷冻药品验收记录………………GC—SY—02—10119 直调药品验收记录…………………………………GC—SY—02—11 120 药品验收拒收单…………………………………GC—SY—02—12 121 药品验收拒收记录…………………………………GC—SY—02—13 122 中药材验收拒收记录………………………………GC—SY—02—14 123 中药饮片验收拒收记录……………………………GC—SY—02—15 124 专门管理药品验收拒收记录………………………GC—SY—02—16 125 冷藏、冷冻药品验收拒收记录……………………GC—SY—02—17 序号记录名称记录编号126 销后退回药品验收拒收单………………………GC—SY—02—18 127 销后退回药品验收拒收记录……………………GC—SY—02—19 128 销后退回中药材验收拒收记录……………………GC—SY—02—20 129 销后退回中药饮片验收拒收记录…………………GC—SY—02—21 130 销后退回专门管理药品验收拒收记录……………GC—SY—02—22 131 销后退回冷藏、冷冻药品验收拒收记录…………GC—SY—02—23 九、储存与养护132 近效期药品催销月报表…………………………ZD—CY—03—01 133 外来人员进出库房登记表…………………………ZD—CY—05—01 134 药品库存记录……………………………………GC—CY—01—01 135 专门管理药品库存记录………………………… GC—CY—01—02 136 中药材库存记录………………………………… GC—CY—01—03 137 中药饮片库存记录……………………………… GC—CY—01—04 138 冷藏、冷冻药品库存记录……………………… GC—CY—01—05 139 库房巡检记录…………………………………… GC—CY—01—06 140 药品养护计划…………………………………… GC—CY—02—01 141 重点养护药品养护计划………………………… GC—CY—02—02 142 药品养护记录……………………………………GC—CY—02—03 143 中药材养护记录…………………………………GC—CY—02—04 144 中药饮片养护记录………………………………GC—CY—02—05 145 重点养护药品养护记录…………………………GC—CY—02—06 146 重点养护中药材养护记录………………………GC—CY—02—07 147 重点养护中药饮片养护记录……………………GC—CY—02—08 148 设施设备、环境、卫生养护检查记录…………GC—CY—02—09 149 药品养护分析报告表……………………………GC—CY—02—10 150 不合格药品库存记录……………………………GC—CY—03—01 151 不合格药品销毁审批表…………………………GC—CY—03—02 序号记录名称记录编号152 不合格药品报损审批表…………………………GC—CY—03—03 153 不合格药品报损记录…………………………… GC—CY—03—04 154 不合格药品销毁记录…………………………… GC—CY—03—05 155 不合格药品情况汇总分析表…………………… GC—CY—03—06 156 可疑药品报告确认表………………………………GC—CY—03—07 157 库存盘点报表…………………………………… GC—CY—04—01 158 盘点情况原因分析及处理报告………………… GC—CY—04—02 159 直接入库单……………………………………… GC—CY—04—03160 直接出库单……………………………………… GC—CY—04—04 161 直接入库记录…………………………………… GC—CY—04—05 162 直接出库记录…………………………………… GC—CY—04—06 163 库存不合格药品盘点报表……………………… GC—CY—04—07 164 温湿度监测记录………………………………… GC—CY—05—01 十、销售165 购货单位资格审批表…………………………… ZD—XS—01—01 166 药品销售单……………………………………… GC—XS—01—01 167 药品销售记录…………………………………… GC—XS—01—02 168 专门管理药品销售记录………………………… GC—XS—01—03 169 冷藏、冷冻药品销售记录……………………… GC—XS—01—04 170 中药材销售记录………………………………… GC—XS—01—05 171 中药饮片销售记录……………………………… GC—XS—01—06 172 直调药品销售记录……………………………… GC—XS—01—07 173 药品抽样检查出库单…………………………… GC—XS—01—08 174 药品抽样检查出库记录。
新GSP系统授权权限审批表

客户资质审批表(质量负责人)库房温湿度记录
客户资质变更登记库外温湿度记录
合格供货方管理医疗用毒性药品退出复核记录
合格供货方档案药品陈列环境温湿记录
供货单位法定资格及质量信誉度调查注射剂可见异物检查记录
合格供方企业一览表重量、装量差异检查记录
首营企业一览表溶液颜色检查记录
资料图片维护其他资料
资料图片浏览价签条码制作
商品资料修改申请单自定价签条码
商品修改申请单审核人员名片管理
商品资料修改执行单资料初装
商品资料删除申请单货位线索录入商品
商品修改申请单删除商品初装建账调整
商品删除申请单审核商品初装资料查询
商品删除申请单作废帐薄资料维护
商品资料删除执行单各帐龄段设置
客商资料
商品库存查询销售订单修改历史查询
库存差异查询销售开票修改历史查询
库存余额查询销售退回开票修改历史查询
货位余额查询销售补价单修改历史查询
库存分布查询移库票单修改历史查询
商品分布查询商品损溢票单修改历史查询
库存架位查询基础资料修改记录查询
货位移库汇总查询商品资料修改申请查询
暂存商品出库查询商品资料删除申请查询
效期预警查询往来分析销售单欠款分析
日进销查询应付款分析应付款分析明细应收款分析
应付款分析明细日销售回款分析销售欠款计息查询资金分析
应收应付单据平行帐查询应收款综合分析进货结算预测表
5、信息中心
业务规则货位资料
分类方案设置货位资料
商品价位规划货位合并维护
商品互斥维护货位号维护
商品条码维护批次数量维护
条码快速装入部门资料
疫苗出库复核记录用户接待记录
首营企业审批表(新版GSP)
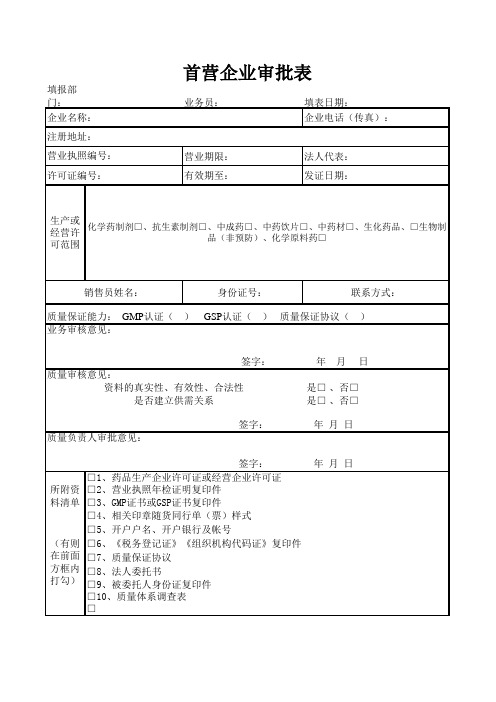
填报部门:
业务员:填表日期:企业电话(传真):
营业期限:法人代表:有效期至:发证日期:身份证号:联系方式: 是□ 、否□ 是□ 、否□
□8、法人委托书
□9、被委托人身份证复印件
□10、质量体系调查表
□生产或经营许可范围
所附资料清单(有则在前面方框内打勾)化学药制剂□、抗生素制剂□、中成药□、中药饮片□、中药材□、生化药品、□生物制品(非预防)、化学原料药□□2、营业执照年检证明复印件
□3、GMP证书或GSP证书复印件
□4、相关印章随货同行单(票)样式
□5、开户户名、开户银行及帐号
□6、《税务登记证》《组织机构代码证》复印件
□7、质量保证协议
是否建立供需关系 签字: 年 月 日
质量负责人审批意见:
签字: 年 月 日
□1、药品生产企业许可证或经营企业许可证
质量保证能力: GMP 认证( ) GSP 认证( ) 质量保证协议( )业务审核意见:
签字: 年 月 日
质量审核意见:
资料的真实性、有效性、合法性
首营企业审批表
企业名称:
注册地址:
营业执照编号:
许可证编号:销售员姓名:。
药品经营企业重新核发GSP变更申请审批表

地州市药品监督管理局
经办人意见:
年 月 日
地州市药品监督管理局意见:
签章:
年 月 日
云南省药品监督管理局
药品安监处审查意见:
年 月 日
药品安监处审核意见:
年 月 日
局领导审批意见:
年 月 日
称:
联 系 人:
联系人电话:
申请时间: 年 月 日
云南省食品药品监督管理局制
企业名称
注册地址
仓库地址
经营范围
法人代表
质量负责人
许可证证号
变更项目
原核准事项
申请变更后事项
企业名称
注册地址
仓库地址
经营范围
变更理由
签章:
年 月 日
以上所填内容真实有效
法人代表(负责人)(签名):
《新版GSP》质量管理体系文件(2019版)

XX大药房股份有限公司GSP 质量管理体系文件目录一、质量管理制度1、质量管理体系文件管理制度2、质量管理体系文件检查考核制度3、药品采购管理制度4、药品验收管理制度5、药品陈列管理制度6、药品销售管理制度7、供货单位和采购品种审核管理制度8、处方药销售管理制度9、药品拆零管理制度10、含麻黄碱类复方制剂质量管理制度11、记录和凭证管理制度12、收集和查询质量信息管理制度13、药品质量事故、质量投诉管理制度14、中药饮片处方审核、调配、核对管理制度15、药品有效期管理制度16、不合格药品、药品销毁管理制度17、环境卫生管理制度18、人员健康管理制度19、药学服务管理制度20、人员培训及考核管理制度21、药品不良反应报告规定管理制度22、计算机系统管理制度23、执行药品电子监管规定管理制度二、各岗位管理标准1、企业负责人岗位职责2、质量管理人员岗位职责3、药品采购人员岗位职责4、药品验收人员岗位职责5、营业员岗位职责6、处方审核、调配人员岗位职责三、操作程序1、质量体系文件管理程序2、药品采购操作规程3、药品验收操作规程4、药品销售操作规程5、处方审核、调配、审核操作规程6、中药饮片处方审核、调配、核对操作规程7、药品拆零销售操作规程8、含麻黄碱类复方制剂销售操作规程9、营业场所药品陈列及检查操作规程10、营业场所冷藏药品存放操作规程11、计算机系统操作和管理操作规程四、质量记录表格1、文件编制申请表2、制度执行情况检查记录3、供货方汇总表4、供货方质量体系调查表5、合格供货方档案表6、采购计划表7、购进质量验收药品目录8、药品质量档案表9、药品购进、质量验收纪录10、药品储存、陈列环境检查记录11、环境温湿度监测记录12、近效期药品催销表13、药品拆零销售记录14、处方药销售调配销售记录15、中药饮片装斗复核记录16、中药方剂调配销售记录17、顾客意见征询表18、药品质量问题查询表19、药品质量问题投诉、质量事故调查处理报告————————药店管理文件1、目的:规范本企业质量管理体系文件管理。
2020年新版GSP药店药房质量管理体系文件制度岗位职责操作规程表格全套资料

××××××大药房质量管理体系文件2020 年 5 月××××××大药房质量管理体系文件使用说明1、本套质量管理体系文件是根据《药品经营质量管理规范》(国家食品药品监督管理总局令第 28 号)和《药品经营质量管理规范现场检查指导原则》(修订稿)的规定,结合本药房实际制定的质量管理体系文件,文件包括质量管理制度、各岗位管理职责、操作规程、质量记录表格。
2、文件根据组织机构职能框架图和《药品经营质量管理规范》规定,合理设置本药房的各岗位。
3、文件经药房负责人批准签发有效执行。
××××××大药房文件(秘)密第[2020]0101号任命书根据《公司法》和本公司章程及质量管理体系文件的有关规定,经本公司领导研究决定:任命XXX 为XXXXXXX 大药房负责人。
任命XXX 为XXXXXXX 大药房质量负责人,兼验收员、处方审核员。
任命XXX 为XXXXXXX 大药房采购员兼养护员、营业员。
任命XXX 为XXXXXXX 大药房收货员兼营业员。
任命XXX 为XXXXXXX 大药房计算机管理员。
××××××大药房2020 年5 月1 日主题词:岗位任命呈送:企业负责人抄送:各岗位人员拟稿人:×××共印3 份××××××大药房组织机构结构框架图××××××大药房质量管理体系文件目录一、质量管理制度××××××大药房质量管理体系文件目录一、质量管理制度××××××大药房质量管理体系文件目录二、各岗位管理职责三、操作规程××××××大药房质量管理体系文件目录三、操作规程四、质量记录表格××××××大药房质量管理体系文件目录四、质量记录表格××××××大药房质量管理体系文件目录四、质量记录表格××××××大药房质量管理体系文件目录四、质量记录表格1、目的:规范本药房质量管理体系文件的管理。
GSP认证文件编制申请批准表

文件编制申请批准表申请人(部门):制度执行情况检查记录检查日期:年月日检查人:供货方汇总表供货方质量体系调查表日期: 供应商: 药品米购计划表计划制定: 审核: 批准:购进、质量验收药品目录药品质量档案表药品验收记录12药品储存、陈列环境检查记录环境温湿度监测记录近效期药品催销表编号: 填报日期: 扌报告人:16药品通用名称:药品拆零销售记录商品名称:处方药销售调配记录17中药饮片装斗复核记录18中药方剂调配销售记录表患者姓名处方内容:性别I年龄I住址开方医院审方I开方医生调配划价价格顾客意见征询表尊敬的顾客:为提高本店药品经营质量管理水平和服务水平,请您提供宝贵意见和建议。
谢谢药品质量问题查询表药品质量问题投诉、质量事故调查处理报告药品质量信息汇总分析表2、养护分析()从 年 月日至其中西药批次;中成药批次; 中药饮片 现的质量问题主要为:过期失效( )、变质()、破损(年度药品质量较满意的供应单位有:签名:日期:年 月 日分析类型:1、购进药品质量分析:(年月日至批次,供货商 家(见附表),合格批次();出现质量问题的药品(主要为:包装破损、圭寸口不劳、衬垫不实、圭寸条严重损坏( 有异常响声和液体渗漏( 次,占购进药品批次的 书不符合规定( 进药品批次的 %。
其他不合格的( 有(、家(见附表)。
附表:出现质量问题的商家名单: )批次,占购进药品批次的 %;药品超出有效期()批次,占购进药品批次的年 月日本企业购进药品)批次,出现的质量问题)批次;占购进药品批次的 %。
包装内%。
包装标识模糊不请、脱落()批)批次,占购进药品批次的%;标签、说明%药品性状不符合规定()批次,占购)批次,占购进药品批次的%。
出现质量问题的商家年 月 日本企业检查药品 批次, 种次;出现质量问题的药品批次,出)、其他( );原因主要有:3、外部反馈的药品质量信息分析: 抽验药品的质量信息分析: 药品 批次,合格 量的 %。
文件编制申请及批准表(新GSP)
LF-QM-062-2015电子商务部管理制度
LF-QM-063-2015技术管理部管理制度
LF-QM-064-2015交易审核部管理制度
LF-QM-065-2015客户服务部管理制度
LF-QM-066-2015数据管理部管理制度
LF-QM-067-2015资金结算管理制度
2、公司新增加滞销药品促销平台,药品效期管理需调整。
申请部门负责人:日期:2015年8月1日
主管领导
意见
文件题目
(见附表)
文件编号
(见附表)
编制要求
进度要求
2015年8月30日前完成
编制部门
质量管理部、财务部起草,质量负责人编制审批
主管领导(签名):日期:年月日
总经理(签名):日期:年月日
QR-002
LF-QM-068-2015档案管理制度
LF-QP-004-2015药品购进控制程序
LF-QM-009-2015药品质量验收的管理制度
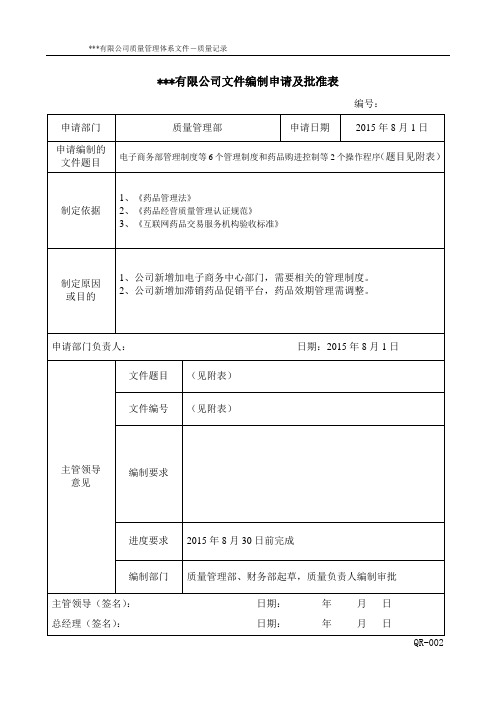
***有限公司文件编制申请及批准表
编号:
申请部门
质量管理部
申请日期
2015年8月1日
申请编制的文件题目
电子商务部管理制度等6个管理制度和药品购进控制等2个操作程序(题目见附表)
制定依据
1、《药品管理法》
2、《药品经营质量管理认证规范》
3、ቤተ መጻሕፍቲ ባይዱ互联网药品交易服务机构验收标准》
制定原因
或目的
1、公司新增加电子商务中心部门,需要相关的管理制度。
文件编制申请批准表

11、含特殊药品复方制剂质量管理制度
12、记录和凭证管理制度
13、收集和查询质量信息管理制度
14、药品质量事故、质量投诉管理制度
15、中药饮片处方审核、调配、核对管理制度
16、药品有效期管理制度
17、不合格药品、药品销毁管理制度
18、环境卫生管理制度
19、人员健康管理制度
20、药学服务管理制度
11、门店冷藏药品存放操作规程
12、计算机系统操作和管理操作规程
13、不合格药品处理操作规程
各岗位质量职责
1、 企业负责人质量职责
2、 质量领导小组质量职责
3、 质量管理部质量职责
4、 质量经理质量职责
5、 质量管理员质量职责
6、 人力资源部岗位职责
7、 财务部岗位职责
8、 营运部岗位职责
9、 市场拓展部岗位职责
部门负责人意见
负责人: 日期:
审核意见
审核人: 日期:
批准意见
批准人: 日期:
1、质量体系文件管理程序
2、 门店进货验收操作规程
3、 药品销售操作规程
4、 处方审核、调配、复核操作规程
5、 中药饮片处方审核、调配、复核操作规程
6、 药品拆零销售操作规程
7、 含特殊药品成分复方制剂销售操作规程
8、 含兴奋剂操作规程
10、药品陈列检查操作规程
21、人员培训及考核管理制度
22、药品不良反应报告规定管理制度
23、计算机系统管理制度
24、执行药品电子监管规定管理制度
25、进口药品管理制度
26、药品退货管理制度
27、计量器具管理制度
28、二类精神药品管理制度
29、含兴奋剂药品管理制度
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
LF-QP-004-2015药品购进控制程序
LF-QM-009-2015药品质量验收的管理制度
***有限公司文件编制申请及批准表
编号:
申请部门
质量管理部
申请日期
2015年8月1日
申请编制的文件题目
电子商务部管理制度等6个管理制度和药品购进控制等2个操作程序(题目见附表)
制定依据
1、《药品管理法》
2、《药品经营质量管理认证规范》
3、《互联网药品交易服务机构验收标准》
制定原因
或目的
1、公司新增加电子商务中心部门,需要相关的管理制度。
电子商务部管理制度等6个管理制度和药品购进控制等2个程序附表:
LF-QM-062-2015电子商务部管理制度
LF-QM-063-2015技术管理部管理制度
LF-QM-064-2015交易审核部管理制度
LF-QM-065-2015客户服务部管理制度
LF-QM-066-2015数据管理部管理制度
LF-QM-067-2015资金结算管理制度
2、公司新增加滞销药品促销平台,药品效期管理需调整。
申请部门负责人:日期:2015年8月1日
主管领导
意见
文件题目
(见附表)
文件编号
(见附表)
编制要求
进度要求
2015年8月30日前完成
编制部门
质量管理部、财Leabharlann 部起草,质量负责人编制审批主管领导(签名):日期:年月日
总经理(签名):日期:年月日
QR-002
