新课标高中化学必修二全册导学案(习题附参考答案)
人教版高中化学必修2全册导学案

《新课程人教版高中化学必修2·学生用书》目录(云溪一中·内部资料)第一章物质结构元素周期律第一节元素周期表 (2)第二节元素周期律 (7)第三节化学键 (12)本章测评 (16)第二章化学反应与能量第一节化学能与热能 (16)第二节化学能与电能 (18)第三节化学反应的速率和限度 (20)本章测评 (22)第三章有机化合物第一节最简单的有机化合物──甲烷 (22)第二节来自石油和煤的两种基本化工原料 (26)第三节生活中两种常见的有机物 (31)第四节基本营养物质 (34)本章测评 (38)第四章化学与可持续发展第一节开发利用金属矿物和海水资源 (38)第二节化学与资源综合利用、环境保护 (41)本章测评 (45)第一章: 物质结构元素周期律第一节元素周期表基础认知1.第一张元素周期表是在1869年由俄国化学家____________将元素按照由小到大顺序排列而制得。
2.按照元素在_____________________________________________,得到原子序数。
原子序数=_____________ = _____________ =______________3.在元素周期表中,把_______________的元素,按_____________递增顺序从左到右排成横行,再把不同横行中_________________相同的元素,按__________________的顺序由上而下排成纵行。
周期表的有关知识(一) (填入相关内容)周期表的有关知识(二)(填入相关内容)根据元素周期表,完成下表:4碱金属的物理性质的比较5.卤族元素的相关知识卤族元素的物理性质的比较卤族元素的原子结构和化学性质比较完成下列变化的方程式:氢气在氯气中燃烧________________________;钾投入水中________________________;锂在空气中加热_______________________;钠在空气中加热_______________________;氯气和水反应________________________;氯气通入碘化钾溶液中__________________。
(27套)人教版高中化学必修2(全册)导学案附答案(打包下载)

1.周期(完成下表)
周期
短周期
长周期
一
二
三
四
五
六
七
对应行数
1
2
3
4
5
6
7
所含元素种数
2
()
8
()
18
()
32(排满时)
每周期0族元素原子序数
2
10
18
36
()
86
118
总结一:
(1)周期:元素周期表有7个横行,也就是7个。前三周期叫,后四个周期叫。第七周期排到112号元素,共有26种元素,由于尚未排满,所以又叫周期。
1.532
38.89
688
铯(Cs)
略带金属光泽、柔软
1.879
28.40
678.4
⑴相似性:碱金属单质中除略带金色光泽外,其它的均是色,碱金属单质都质地较(硬度),有性,碱金属的密度都。碱金属单质的熔点都,如在温度略高于室温时就呈液态。此外碱金属单质的、性能也都很好,如液态钠可用作核反应堆的。
⑵递变性:随着碱金属元素原子的电子层数增加,原子半径逐渐,单质的密度呈趋势,而其中的反常;熔点和沸点逐渐(填“升高”或“降低”)。
⑶卤素单质与水反应
写出Cl2、Br2、I2分别与水反应的化学方程式:
①。
②。
③。
⑷卤素单质与碱溶液反应写出Cl2、Br2分别与NaOH溶液反应的化学方程式:
①。
②。
⑸卤素单质间的置换反应
实验
内容
将少量氯水分别加入盛有NaBr溶液和KI溶液的试管中,用力振荡后加入少量四氯化碳,振荡、静置。
将少量溴水加入盛有KI溶液的试管中,用力振荡后加入少量四氯化碳,振荡、静置。
【文档】高中化学必修二全套导学案(20份)人教课标版3

【教案】学第二节元素周期律(第 1课时)课前预习教案一、预习目标:认识原子构造和原子表示方法。
二、预习内容:⑴原子是由居于_____________的带__________的__________和______带________的______组成的。
⑵原子核是由带____________的_________和_____________的_________组成的。
⑶原子符号“Z A x”中,Z表示_____________,A表示____________,核内中子数用______表示。
(4)写出1-20号原子构造表示图课内研究教案一、学习目标:知识目标:1、知道元素原子核外电子排布规律;2、掌握元素原子核外电子排布、原子半径、主要化合价周期性变化。
能力目标:提升学生们归纳整理的能力。
感情、态度、价值观目标:学会总结,学会归纳,领会构造决定性质的理念。
学习要点难点:要点:元素原子核外电子排布、原子半径、主要化合价周期性变化。
难点:知道元素原子核外电子排布规律。
二、学习过程:研究一:核外电子排布规律1)各电子层最多容纳_______个电子;2)最外层电子数不超出____个电子(K层为最外层时不超出_____个);3)次外层电子数不超出______个电子;(4)核外电子老是尽先排布在能量 ____ 的电子层,而后由里向外,挨次排布在能量逐渐_____的电子层。
分组议论:1、写出1至20号元素的原子构造表示图.2、总结1至18号原子构造的特别性。
(1)原子中无中子的原子:(2)最外层有1个电子的元素:(3)最外层有2个电子的元素:(4)最外层等于次外层电子数的元素:(5)最外层电子数是次外层电子数2倍的元素:(6)最外层电子数是次外层电子数3倍的元素:(7)最外层电子数是次外层电子数4倍的元素:※(8)氩原子电子层构造相同的阳离子是:与氩原子电子层构造同样的阴离子是:分子:阳离子:阴离子:研究二、元素的原子构造和主要化合价及原子半径的变化规律(Ⅰ)半径议论:(1)第二周期元素从左到右半径变化规律是什么?第三周期呢?为何? 比较O2-与O半径大小?Ca2+与Ca原子半径大小?比较O2-与Na+半径大小?总结:简单微粒半径的比较方法 :(Ⅱ)化合价价电子——1、主族元素的最高正化合价=______________=______________2、非金属最高正价+|负化合价|=______(注:副族和第VⅢ族化合价较复杂)族IA IIA IIIA IVA VA VIA VIIA主要化合价气态氢化物的通式最高价氧化物的通式三、反省总结:四、当堂检测1、原子序数从11挨次增添到A.电子层数渐渐增加17,以下递变关系中,错误的选项是B ..原子半径渐渐增大()C.最高正化合价数值渐渐增大D.从Si到Cl,最低负化合价从-4到-12、以下各组元素中按微粒半径递加次序摆列的是()A、LiNaK2+2+Mg2+2++-、NOF B、BaCa、Ca KCl3、以下元素原子半径最大的是()A、LiB、F C、NaD、Cl4、按原子半径增大的次序摆列的一组是)A、Be、N、FB、Mg、Si、CC、Na、Mg、Ca、Cl、S、P5、元素X原子的最外层有3个电子,元素Y原子的最外层有6个电子,这两种元素形成的化合物的化学式可能是()Y Y 326、A、B两种原子,A原子M层比B原子M层少3个电子,B原子L层电子数恰巧是A原子L层的两倍,则A元素是()7、元生性质呈周期性变化的决定要素是)A.元素原子半径大小呈周期性变化B.元素原子量挨次递加C.元素原子最外层电子排布呈周期性变化D.元素的最高正化合价呈周期性变化8、aX n-和bY m+两种简单离子,其电子层构造同样,以下关系式或化学式正确()A、a–n=b+mB、a+m=b–nC、氧化物为YOD、氢化物为HX或XHm n n9、已知元素X能形成H2X和XO化合物,则X的最外层电子数为2某元素气态氢化物的分子式为H2R,该元素的最高价氧化物的化学式为__.10、原子序数为34的元素位于周期,族,属于类单质;原子序数为56的元素位于周期,族,属于类单质。
高中化学必修二导学案:第三章 有机化合物 第四节 第2课时油脂蛋白质 含答案

第2课时油脂蛋白质[学习目标定位] 1.认识油脂和蛋白质的主要性质。
2.了解油脂和蛋白质的组成。
3.知道油脂和蛋白质在日常生活、生产中的应用。
一油脂的分子结构和性质1.油脂的分子结构(1)油脂是由多种高级脂肪酸跟甘油生成的酯,其结构如下图所示:结构式里,R1、R2、R3为同一种烃基的油脂称为简单甘油酯;R1、R2、R3为不同种烃基的油脂称为混合甘油酯。
天然油脂大都是混合甘油酯。
(2)油和脂肪统称为油脂。
油和脂肪的状态不同,油脂中的碳链含碳碳双键较多时,主要是低沸点的植物油;油脂中的碳链含碳碳单键较多时,主要是高沸点的动物脂肪。
2.油脂的化学性质(1)油脂的水解反应①油脂在酸性条件下水解生成甘油(丙三醇)和高级脂肪酸,如:②油脂在碱性条件下的水解反应称为皂化反应,在此条件下油脂水解为甘油、高级脂肪酸盐。
在工业生产中,常用此反应来制取肥皂。
硬脂酸甘油酯与NaOH溶液共热的化学方程式为硬脂酸甘油酯______________硬脂酸钠______甘油。
(2)油脂的氢化反应植物油分子中存在,能与氢气发生加成反应,将液态油脂转化为固态油脂。
归纳总结1.下列关于油脂的叙述不正确的是()A.油脂属于酯类B.油脂的组成元素为C、H、OC.油脂可使酸性高锰酸钾溶液褪色D.油脂不能使溴的四氯化碳溶液褪色答案 D解析油脂是高级脂肪酸与甘油(丙三醇)形成的酯,故它属于酯类,其组成元素为C、H、O。
有些油脂是由不饱和的高级脂肪酸与甘油形成的酯,故可使酸性KMnO4溶液褪色,可使溴的CCl4溶液褪色。
2.下列叙述正确的是()A.羊油是高分子化合物,是纯净物B.羊油是高级脂肪酸的高级醇酯C.工业上将羊油加氢制造硬化油,有利于保存D.羊油可以在碱性条件下加热水解制肥皂答案 D解析本题综合考查了油脂的组成和油脂的化学性质。
羊油是动物脂肪,属于油脂,是多种高级脂肪酸的甘油酯,是混合物而不是纯净物,油脂都不是高分子化合物,所以A选项错误;构成羊油的是高级脂肪酸的甘油酯,而不是高级醇酯,B选项错误;羊油并不是液态油,而是固态酯,是饱和高级脂肪酸形成的甘油酯,因此不存在催化加氢的问题,所以C选项错误;D 选项油脂在碱性条件下水解,这种水解又称为皂化反应,是工业上制肥皂的方法,所以D选项正确。
高中化学必修二(新教材) 全书导学案
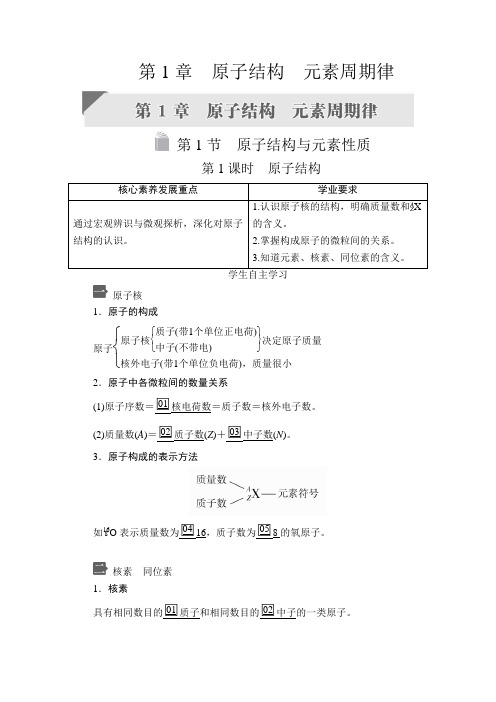
第1章 原子结构 元素周期律第1节 原子结构与元素性质第1课时 原子结构 核心素养发展重点 学业要求 通过宏观辨识与微观探析,深化对原子结构的认识。
1.认识原子核的结构,明确质量数和A Z X 的含义。
2.掌握构成原子的微粒间的关系。
3.知道元素、核素、同位素的含义。
学生自主学习原子核1.原子的构成原子⎩⎨⎧ 原子核⎩⎨⎧⎭⎬⎫质子(带1个单位正电荷)中子(不带电)决定原子质量核外电子(带1个单位负电荷),质量很小2.原子中各微粒间的数量关系(1)原子序数=□01核电荷数=质子数=核外电子数。
(2)质量数(A )=□02质子数(Z )+□03中子数(N )。
3.原子构成的表示方法如16 8O 表示质量数为□0416,质子数为□058的氧原子。
核素 同位素1.核素具有相同数目的□01质子和相同数目的□02中子的一类原子。
氢元素有氕、氘、氚三种核素,分别用□0311H、21H、31H表示。
2.同位素□04质子数相同而□05中子数不同的同一种元素的不同核素互为同位素。
例如11H与□0621H、31H互为同位素。
同位素分为□07稳定同位素和□08放射性同位素。
课堂互动探究一、原子的构成1.离子的质量数是否等于其质子数和中子数之和?提示:是。
因为离子是通过得失核外电子形成的,而质量数只与核内质子数和中子数有关,与核外电子数无关。
2.任何原子都是由质子、中子和电子构成的吗?提示:不一定。
11H中含有一个质子和一个电子,不含有中子。
1.原子的相对质量(M)=原子质量m(126C)12≈质量数=质子数+中子数。
2.原子、离子组成中的数量关系(1)核电荷数=质子数=原子核外电子数。
(2)质量数(A)=质子数(Z)+中子数(N)。
(3)阳离子中:质子数=核电荷数=核外电子数+离子电荷数。
(4)阴离子中:质子数=核电荷数=核外电子数-离子电荷数。
知识拓展核力是使核子组成原子核的作用力,属于强相互作用力的一类。
原子核中有中子、质子,质子是带正电的,所以质子之间会互相排斥。
经典:化学必修二学案带答案(人教版全册最新)

目录第一章物质结构元素周期律 (2)§1.1.1 元素周期表的结构 (2)§1.1.2元素的性质与原子结构(碱金属元素) (6)§1.1.3 元素的性质与原子结构(卤族元素) (10)§1.1.4 核素、同位素 (16)§1.2.1 核外电子排布 (20)§1.2.2 元素周期律 (24)§1.2.2 元素周期表和元素周期律的运用 (28)§1.3.1 离子键 (33)§1.3.2 共价键 (37)第一章物质结构元素周期律单元检测 (41)第二章化学反应与能量 (46)§2.1.1 化学能与热能 (46)§2.2.1 化学能与电能 (51)§2.2.2 发展中的化学电源 (55)§2.3.1 化学反应速率 (60)§2.3.2 化学反应速率的影响因素 (62)§2.3.3 化学反应的限度化学反应条件的控制 (66)§2.3.4 判断化学平衡的标志 (71)第二章化学反应与能量单元测试题 (75)第三章有机化合物 (80)第一节最简单的有机物——甲烷 (80)§3.1.1 甲烷 (80)§3.1.2 烷烃的结构特点及性质 (84)§3.1.3 同系物和同分异构体 (87)第二节来自石油和煤的两种基本化工原料 (91)§3.2.1 乙烯 (91)§3.2.2 苯 (95)第三节生活中两种常见的有机物 (99)§3.3.1 乙醇 (99)§3.3.2 乙酸 (104)第四节基本营养物质 (109)§3.4.1 糖类、油脂、蛋白质的性质 (109)§3.4.2 糖类、油脂和蛋白质在生产、生活中的应用 (112)第三章有机化合物单元测试题 (116)第四章化学与自然资源的开发利用 (120)第一节开发利用金属矿物和海水资源 (120)第1课时金属矿物的开发利用 (120)第2课时海水资源的开发利用 (125)第二节资源综合利用环境保护 (130)第四章化学与自然资源的开发利用单元检测试题 (135)第一章物质结构元素周期律例1 下列有关元素周期表的说法中正确的是( )A .元素周期表中元素种类最多的周期是第五周期B .长周期中每个周期所含元素种类可能是8种、18种或32种C .元素周期表中每个纵行均是一个族D .ⅦA 族元素即卤族元素跟踪练习1 下列各表中的数字均代表元素的原子序数,其表示的元素与它们在元素周期表中的相对位置合理的一组是( ) A .B .C .D .知识点2:元素周期表中的数字规律例2 原子序数为x 的元素位于周期表中的ⅡA 族,则原子序数为x +1的元素不可能...处在( ) A .ⅢA 族 B .ⅠA 族 C .镧系元素 D .ⅢB 族 跟踪练习2 同一主族的两种元素的原子序数之差不可能...是( ) A .16 B .26 C .36 D .46 解析:8+8=16 8+18=26 18+18=36跟踪练习3若第ⅡA 族中,某种元素的原子序数为X ,则与其同周期的第ⅢA 族元素的原子序数是 X+1或X+11或X+25 ,短周期中族序数与周期数相同的元素有哪些 H 、Be 、Al 。
高中化学必修二《导学案+随堂练习题》(全套)

专题1微观结构与物质的多样性第一单元原子核外电子排布与元素周期律第一课时原子核外电子的排布[学习目标] 1.知道核外电子能量高低与分层排布的关系。
2.能够根据核外电子排布规律写出常见简单原子的原子结构示意图。
[学生预习区]1.原子结构示意图以钠原子结构示意图为例2.电子的能量与运动区域电子在原子核外是□05分层排布的:(1)在离核较近的区域运动的电子能量□06较低。
(2)在离核较远的区域运动的电子能量□07较高。
3.电子层的含义多电子原子里,电子分别在能量不同的区域内运动,人们把核外电子运动的不同区域看成不同的电子层。
4.电子层表示方法5.原子核外电子的排布规律(1)电子总是尽量先从□15能量最低的电子层排起,当一层□16排满后再填充下一层。
(2)原子核外各电子层最多容纳□172n2个电子。
(3)原子最外层电子数不能超过□188(K层为最外层时不能超过□192)。
(4)稀有气体元素原子中最外电子层都已填满,形成了□20稳定的电子层结构。
核外电子排布时,是不是每个电子层都达到了最多能容纳的电子数?提示:不是。
含多个电子的原子核外电子排布是按照一定规律进行的,这些规律是相互联系的,应用时需要综合考虑。
每层最多能够容纳2n2个电子,但在具体的原子中,并不是每个电子层都达到了最多能够容纳的电子数,不能简单地将核外电子层中每层最多能够容纳的电子数与实际容纳的电子数混淆。
[教师点拨区]1.最外层8个电子(K层为最外层时为2个电子)的结构,称为相对稳定结构。
当元素原子的最外层电子数小于8(K层小于2)时,是不稳定结构。
在化学反应中,具有不稳定结构的原子,总是“想方设法”(得或失电子)使其结构趋于稳定。
2.离子结构示意图(1)当主族中的金属元素原子失去最外层所有电子变为离子时,电子层数减少一层,形成与上一周期的稀有气体原子相同的电子层结构。
(2)非金属元素的原子得电子形成简单离子时,形成和同周期稀有气体原子相同的电子层结构。
【人教版】高中化学必修二:全册精品导学案

目录第一章物质结构 (1)第一节第1课时元素周期表 (1)第一节第2课时碱金属元素 (3)第一节第3课时卤族元素物理性质 (4)第一节第4课时卤族元素化学性质 (6)第一节第5课时核素 (8)第二节第6课时原子核外电子的排布以及递变性(1) (10)第二节第7课时原子核外电子的排布以及递变性(2) (12)第三节第8课时离子键与共价键 (14)第三节第9课时电子式 (15)第三节第10课时分子间作用力和氢键 (17)第二章化学反应与能量 (19)第1课时热能 (19)第2课时化学能与热能的相互转化 (21)第3课时化学能与电能 (23)第4课时生活中的化学电池 (25)第5课时化学反应的速率 (26)第6课时化学反应的限度 (28)第三章有机化合物 (30)第1课时最简单的有机化合物—甲烷 (30)第2课时烷烃 (32)第3课时来自石油和煤的两种基本化工原料--乙烯 (34)第4课时来自石油和煤的两种基本化工原料--苯 (36)第5课时生活中两种常见的有机物——乙醇 (38)第6课时生活中两种常见的有机物——乙酸 (40)第7课时基本营养物质——糖类 (42)第8课时基本营养物质——油脂,蛋白质 (44)第9课时基本营养物质—糖类,油脂,蛋白质的作用 (45)第四章化学与自然资源的开发利用 (46)第1课时开发利用金属矿物 (47)第2课时开发利用海水资源 (48)第3课时煤、石油和天然气的综合利用 (50)第4课时环境保护与绿色化学 (51)第一章物质结构第一节第1课时元素周期表【考点要求】1、知道周期、族等概念。
2、了解周期序数、主族族序数与原子结构的关系。
【教学目标】1、能描述元素周期表的结构。
1.元素周期表的发展史(1)制作第一张元素周期表的依据(2)将元素按照由小到大依次排列。
(3)将相似的元素放在一个纵行。
2、什么叫原子序数、核电荷数、核外电子数?原子序数与核电荷数、质子数、核外电子数有何关系?原子序数;核电荷数;核外电子数。
高中化学必修二导学案:第三章 有机化合物 第一节 第1课时甲烷的性质 含答案

第一节最简单的有机化合物——甲烷第1课时甲烷的性质[学习目标定位] 1.会写甲烷的分子式、结构式、电子式,知道甲烷的结构特点。
2.知道甲烷能发生氧化反应和取代反应,会写化学方程式。
3.知道取代反应的概念和甲烷发生取代反应时的断键和成键情况。
一甲烷的存在、用途及结构1.甲烷的存在与用途(1)甲烷的存在甲烷是天然气、沼气、油田气和煤矿坑道气的主要成分。
我国的天然气主要分布在中西部地区及海底。
(2)甲烷的主要用途甲烷易燃烧,完全燃烧生成CO2、H2O并放出大量的热量,因此甲烷可用作燃料。
天然气和沼气都是理想的清洁能源。
甲烷还可用作化工原料。
2.甲烷的组成与结构分子式电子式结构式空间构型甲烷的分子模型CH4正四面体结构,C原子位于正四面体中心,H原子位于四个顶点上归纳总结1.结构式:用短线来表示一对共用电子的图式叫做结构式。
2.一个碳原子以4个单键与其他原子相结合时,无论这4个原子是否相同,都分别在四面体的顶点上,但不一定为正四面体,也不可能在同一平面上,并且最多有3个原子共面。
1.以下关于甲烷的说法中错误的是()A.甲烷分子是由极性键构成的分子B.甲烷分子具有正四面体结构C.甲烷分子中四个C—H键是完全等价的键D.甲烷分子中具有非极性键答案 D2.下列各图均能表示甲烷的分子结构,其中更能反映其真实存在状况的是()答案 D解析在这几种形式中,分子结构示意图、球棍模型及比例模型均能反映甲烷分子的空间构型,但比例模型更能形象的表达出H、C的位置及所占比例;电子式只反映原子的最外层电子的成键情况。
二甲烷的性质1.甲烷的物理性质甲烷是一种无色、无味、极难溶于水、密度比空气小的气体。
2.甲烷的化学性质 (1)甲烷的氧化反应将甲烷在空气中点燃观察现象:①甲烷燃烧的化学方程式为CH 4+2O 2――→点燃CO 2+2H 2O 。
甲烷是优良的气体燃料,通常状况下,1 mol 甲烷在空气中完全燃烧,生成二氧化碳和水,放出890 kJ 热量。
最新鲁教版高中化学必修二全册学案(全册 共368页 附答案)

最新鲁教版高中化学必修二全册学案(全册共368页附答案)目录第一章原子结构与元素周期律第一节原子结构第1课时原子核核素第2课时核外电子排布第二节元素周期律和元素周期表第1课时元素周期律第2课时元素周期表第三节元素周期表的应用第1课时认识同周期元素性质的递变规律第2课时预测同主族元素的性质第1章原子结构与元素周期律重点突破第二章化学键化学反应与能量第一节化学键与化学反应第1课时化学键及其类型第2课时化学键与物质类别第3课时化学键与化学反应中的能量变化第二节化学反应的快慢和限度第1课时化学反应的快慢第2课时化学反应的限度第三节化学反应的利用第1课时利用化学反应制备物质第2课时化学反应为人类提供能量第三章重要的有机化合物第一节认识有机化合物第1课时甲烷的性质与结构第2课时有机化合物的结构特点第二节石油和煤重要的烃第1课时石油的炼制乙烯第2课时煤的干馏苯第三节饮食中的有机化合物第1课时乙醇第2课时乙酸第3课时酯和油脂第4课时糖类蛋白质第四节塑料橡胶纤维第1课时有机高分子化合物第2课时塑料橡胶纤维第1章原子结构与元素周期律本章知识体系构建与核心素养解读宏观辨识与微观探析能用原子或物质结构解释元素或相关物质的性质,其实质是能根据原子核外电子排布、典型物质的结构(电子式、结构式等)、典型物质(最高价氧化物对应的水化物、氢化物)性质的变化规律等,通过知识的类比迁移,推断、比较、解释元素及相关物质的性质。
例析短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )A.原子半径:W>Z>Y>XB.最高价氧化物对应水化物的酸性:X>W>ZC.最简单气态氢化物的热稳定性:Y>X>W>ZD.元素X、Z、W的最高化合价分别与其主族序数相等答案 A解析 根据短周期元素W 原子的质子数是其最外层电子数的3倍,可推知W 是P 元素。
【文档】高中化学必修二全套导学案(20份)人教课标版11

来自石油和煤的两种基本化工原料第二课时苯【预习目标】记着苯的物理性质能说出苯的特别构造能说出苯的主要化学性质【预习问题】1、苯的物理性质:色、气味液体,密度比水,剂,沸点:℃易挥发,熔点:℃,若用2、苯分子的构造溶于水,冷却,可凝固成毒,是一种重要溶色体分子式构造式构造简式(凯库勒式)3、苯的化学性质:⑴可燃性:现象:化学方程式⑵苯的代替反响:①苯与液溴的反响:化学方程式溴苯是一种色状液体,密度比水,溶于水②苯与硝酸的反响:反响方程式:硝基苯是一种色状液体,有气味,毒,密度比水,溶于水。
⑶苯的加成反响在镍催化下,与氢气加成:反响方程式:【提出迷惑】课内研究教案【学习目标】知识与技术要求:1)记着苯的物理性质、构成和构造特色。
2)会写苯的焚烧反响、卤代反响、硝化反响、加成反响等化学方程式。
过程与方法要求1)经过剖析推断苯的构造,提升依占有机物性质推断构造的能力。
2)经过苯的主要化学性质的学习,掌握研究苯环性质的方法。
感情与价值观要求:经过化学家发现苯环构造的历史学习,体验科学家艰辛研究、获取成功的过程,培育用科学看法对待事物的看法。
【要点与难点】难点:苯分子构造的理解要点:苯的主要化学性质。
【课始检测】(1)烷烃、烯烃焚烧的现象?2)烷烃、烯烃的特色反响是什么?科学史话】认真阅读科学史话”(苯的发现和苯分子构造学说),回答苯分子应当拥有如何的构造?【研究问题1】(1)若苯分子为链状构造,依据苯的分子式C6H6苯是饱和烃吗?_______(2)在1866年,凯库勒提出两个假说:1.苯的6个碳原子形成_______状链,即平面六边形环。
2.各碳原子之间存在_________________交替形式凯库勒以为苯的构造式:___________;构造简式为:_________【研究问题2】若苯分子为上述构造之一,则其应拥有什么重要化学性质?如何设计实考证明你的猜想?重要化学性质设计实验方案【着手实验】教材第69页实验3-1从实验下手认识苯的物理、化学性质特色。
高中化学(必修二)全套导学案

高中化学(必修二)全套导学案第一单元:物质的组成和结构
第一节:元素、化合物和混合物
导学目标:了解元素、化合物和混合物的概念及其区别
研究内容
1. 元素的定义和特征
2. 化合物的定义和特征
3. 混合物的定义和特征
4. 元素、化合物和混合物之间的区别
研究要点
- 元素是由相同种类的原子构成的纯物质,无法通过化学反应分解成其他物质。
- 化合物是由两种或多种不同元素以固定比例结合而成的纯物质,可以通过化学反应分解成其他物质。
- 混合物是由两种或多种不同物质混合而成的物质,各组成部分在物理性质上保持原有特征。
研究扩展
通过实例分析元素、化合物和混合物的区别,加深对这些概念的理解。
第二节:物质的微粒性
导学目标:认识物质的微粒结构和微观行为
研究内容
1. 物质的微粒结构:原子和分子的概念
2. 原子的组成和结构
3. 分子的组成和结构
4. 物质的微观行为:热运动和粒子间的相互作用
研究要点
- 原子是构成物质的基本微粒,具有质量和体积。
- 原子由质子、中子和电子组成,质子和中子位于原子核中,电子绕核运动。
- 分子是由两个或两个以上原子以共价键相连而形成的微粒,可以是同种元素的原子或不同元素的原子。
- 物质的微观行为受热运动和粒子间相互作用的影响。
研究扩展
通过实验观察和分析物质微粒的热运动和粒子间的相互作用现象,深化对物质微观结构的认识。
*以上内容仅为导学,详情以课堂教学为准。
*。
新课标高中化学必修二全册导学案(习题附参考答案)

新课标高中化学必修二全册导学案习题附参考答案目录期表 1期表 2期表 3期律(1)期律(2)期律(3)与热能与电能(1)化学能与电能的相互转化与电能(2)发展中的化学电源应速率与限度(1)应速率与限度(2)的有机化合物甲烷 1的有机化合物甲烷(2)油和煤的两种基本化工原料 1油和煤的两种基本化工原料 2两种常见的有机物(1)乙醇两种常见的有机物(2)乙酸养物质(1)养物质(2)用金属矿物和海水资源金属矿物的开发利用(1)用金属矿物和海水资源海水资源的开发利用(2)第一章第一节元素周期表 1【学习目标】。
【学习重点】【预备知识】元素周期表中,我们把1、2、3周期称为,周期称为长周期,第周期称为不完全周期,因为一直有未知元素在发现。
类别周期序数起止元素包括元素种数核外电子层数短周期 1 H―He 2 Li―Ne3 Na―Ar 长周期4 K―Kr 5Rb―Xe 6 Cs―Rn 不完全周期7 Fr―112号[归纳与整理]元素周期表中,我们把1.19世纪中叶,俄国化学家门捷列夫的突出贡献是A.提出原子学说 B.制出第一张元素周期表C.提出分子学说 D.发现氧气2.已知元素的原子序数,可以推断元素原子的质子数核电荷数核外电子数离子所带电荷数A.B.C.D.3.由长周期元素和短周期元素共同构成的族是0族主族副族第族A.B.C.D.4.下列说法不正确的是A.已知原子的核电荷数,可以推知该原子的周期序数B.原子的电子层数等于该原子的周期序数,前20号元素中,阳离子的电子层数等于对应原子的周期序数减去1,阴离子的电子层数等于对应原子的周期序数C.知道原子的周期序数,就能确定该元素在周期表中的位置D.知道原子的周期序数,还不能确定该元素在周期表中的位置5.有 a、b、c、d四种主族元素,已知a、b的阳离子和c、d 的阴离子都具有相同的电子层结构,阳离子所带正电荷a b;阴离子所带的负电荷c>d,则四种元素的原子序数关系是A.a>b>c>d B.b>a>d>cC.c>b>a>d D.b>a>c>d6.短周期元素A、B、C在元素周期表中的位置如图所示,已知B、C两元素原子的最外层电子数之和等于A元素原子最外层电子数的2倍,B、C两元素的原子序数之和是A元素原子序数的4倍,A、B、C 三元素应分别为A.C、Al、P B.O、P、ClC.N、Si、S D.F、S、Ar7.下列各表为元素周期表中的一部分,表中数字为原子序数,其中M的原子序数为37的是8.已知元素周期表中前七周期的元素种数如下所示第七周期填满,元素种类为32 :周期序数一二三四五六七元素种类数 2 8 818 18 32 32 分析元素周期序数和元素种类数的关系,然后预测第八周期最多可能含有的元素种数为A.18 B.32 C.50 D.64题号 1 2 3 4 5 6 7 8 答案9.在下列各元素组中,除一种元素外,其余元素可以按某种共性归属一类。
导学案第2辑高中化学必修2人教版第三章训练案及过关测试参考答案

一、1.D 2.C 3.B 二、4.D 5.C 三 、6.D 7.(1)Ⅰ;据 H2 的体积说明乙 醇 分 子 中 有 一 个 H 与 其 他 五 个
中,加入溴水,充分振荡、静置,溴水褪色的是食用油,出现 分
层现象的是石蜡油 8.加入的 NaOH 溶液恰好中和酸;加入的 NaOH 溶液不足,酸
未完全被中和;加 入 的 NaOH 溶 液 过 量,不 仅 中 和 了 酸,而 且酯已经完全水解 9.(1)B、C、D、E (2)F (3)A 三、10.(1)溶解油脂和碱,使皂化反应在均匀液体中进行,加 快 化学反应速率 (2)NaCl;上;盐析 (3)冷凝回流
一、1.D 2.C 3.C 4.B、D 5.A、C 二、6.C 7.D 8.A 三 、9.B 10.(1)首先亚甲基蓝被葡萄糖还原,还原后的无色物质又被 空
气 中 的 氧 气 氧 化 ,又 成 为 亚 甲 基 蓝 ,反 复 作 用
(2)不 能 ;一 段 时 间 后 葡 萄 糖 全 部 转 化 为 其 他 物 质
(3)不 需 要 。
(4)燃 烧 产 物
炽热 CuO
→ 减 轻 m1 g
浓
H2SO4 →
增
重
m2 g
������
������������������������������������������������������ ������������������������������������������������������
������������������������������������������������������������������������������������������ ������������������������������������������������������������������������������������������
高中化学必修二导学案

高中化学必修二导学案高一化学课程是学生们进入高中阶段的重要科目之一,它旨在帮助学生建立坚实的化学基础知识体系,培养其独立思考和解决问题的能力。
本导学案将围绕课程的核心内容进行讲解,以引导学生们掌握化学的基本原理、实验技能和解题方法。
掌握化学基础知识,包括原子结构、化学键、化学反应速率和化学平衡等;本导学案将按照高一化学课本的章节顺序进行讲解。
每章节内容包括核心概念、难点解析、实例解析、实验操作及重点回顾等环节。
通过深入浅出的讲解方式,引导学生们逐步掌握化学知识。
本导学案将采用多种教学方法及手段,包括课堂讲解、实例解析、互动讨论、实验操作等,以激发学生们的学习兴趣和积极性。
同时,将通过实例解析和实验操作等方式,加深学生们对化学知识的理解和掌握。
本导学案将充分利用各种教学资源,包括课本、PPT、实验器材等,以提供丰富多样的学习方式和途径。
同时,将通过互联网等渠道,为学生们提供更加广泛的学习资源和信息。
本导学案将建立完善的学习评估及反馈机制,通过课堂表现、作业完成情况、实验操作表现等方式,及时了解学生们的学习情况和问题,并给予及时的反馈和指导。
同时,将通过定期的测试和考核,检验学生们对化学知识的掌握程度。
本导学案是针对高一化学课程的导学案,旨在帮助学生们掌握化学基础知识,提高分析问题和解决问题的能力。
通过多种教学方法和手段的运用,激发学生们的学习兴趣和积极性,培养其独立思考和解决问题的能力。
将通过完善的学习评估及反馈机制,及时了解学生们的学习情况和问题,并给予及时的反馈和指导。
展望未来,将继续完善教学内容和方法,为学生们提供更加优质的学习资源和指导。
在建筑工程经济学中,下列哪一项不是建筑成本的重要组成部分?在进行建筑工程经济学分析时,下列哪一项因素不应考虑?在进行建筑工程经济学分析时,下列哪一项指标是衡量工程经济性的重要指标?下列哪一项因素最可能影响建筑工程的经济性?在进行建筑工程经济学分析时,下列哪一项因素不应考虑?在进行建筑工程经济学分析时,下列哪一项指标是衡量工程经济效益的重要指标?下列哪一项措施可以有效地提高建筑工程的经济效益?A.提高建筑工人的工资水平以增加他们的积极性D.对建筑工程进行全面的经济学分析以优化资源利用下列哪一项措施可以有效地降低建筑成本?A、通过招标方式选择低价的建筑材料供应商B、加强对建筑工人的技能培训以提高他们的劳动生产率C、优化建筑工程的设计方案以减少不必要的浪费D、提高建筑材料的库存管理效率以减少材料的浪费判断题(每题2分,共20分)在建筑工程经济学中,“机会成本”是一个重要的概念。
【2019统编新教材】部编人教版高中化学必修第二册全册实验教案导学案(实验4-9)

实验4 用化学沉淀法去除粗盐中的杂质离子【学习目标】1.了解化学沉淀法的原理,进一步提高过滤的操作技能,并初步学会运用化学沉淀法对物质进行分离。
2.更加明确酸、碱、盐之间发生反应的规律及其应用。
【学习重难点】重点:明确酸、碱、盐之间发生反应的规律及其应用。
难点:初步学会运用化学沉淀法对物质进行分离。
【学习过程】一、除杂原则1.不增:不增加新的杂质2.不减:不减少被提纯物质3.易分离:被提纯物和杂质易分离4.易复原:被提纯物质要容易复原二、除杂方法:利用复分解反应,将杂质离子转化成气体、沉淀或水去除三、除杂的三必须1.除杂试剂必须过量2.过量试剂必须除去3.除杂途径必须最佳例题:除去NaCl中的杂质Na2SO4牛刀小试:你会选择什么试剂呢?1.NaCl(Na2CO3)2.KCl(K2SO4)3.NaOH(Ca(OH)2)4.NaCl(HCl)四、探究开始:1.粗盐中可溶性杂质离子的除杂顺序及操作:1.涉及的化学反应方程式:步骤1:__________________________________________________________________ 步骤2:__________________________________________________________________ 步骤3:__________________________________________________________________ 步骤4:__________________________________________________________________ 2.注意事项:(1)Na 2CO 3的作用是除去溶液中的CaCl 2和BaCl 2杂质,所以,必须放在BaCl2之后; (2)稀盐酸的作用是除去多余的Na 2CO 3和NaOH ,应放在过滤之后,蒸发过程利用其挥发性除去。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
新课标高中化学必修二全册导学案(习题附参考答案)目录1.1.1元素周期表(1)1.1.2元素周期表(2)1.1.3元素周期表(3)1.2.1元素周期律(1)1.2.2元素周期律(2)1.2.3元素周期律(3)2.1.1化学能与热能2.2.1化学能与电能(1)化学能与电能的相互转化2.2.2化学能与电能(2)发展中的化学电源2.3.1化学反应速率与限度(1)2.3.2化学反应速率与限度(2)3.1.1最简单的有机化合物甲烷 (1)3.1.2最简单的有机化合物甲烷(2)3.2.1来自石油和煤的两种基本化工原料(1)3.2.2来自石油和煤的两种基本化工原料(2)3.3.1生活中两种常见的有机物(1)乙醇3.3.2生活中两种常见的有机物(2)乙酸3.4.1基本营养物质(1)3.4.2基本营养物质(2)4.1.1开发利用金属矿物和海水资源金属矿物的开发利用(1) 4.1.2开发利用金属矿物和海水资源海水资源的开发利用(2)第一章第一节元素周期表(1)【学习目标】了解元素周期表的结构以及周期、族等概念。
了解周期、主族序数和原子结构的关系。
【学习重点】周期、主族序数和原子结构的关系;元素周期表的结构【预备知识】一、原子序数1.定义:按照元素在周期表中的给元素编号,得到原子序数。
2.原子序数与元素的原子结构之间存在着如下关系:原子序数===【基础知识】(一)元素周期表的结构1、周期:元素周期表共有个横行,每一横行称为一个,故元素周期表共有个周期①周期序数与电子层数的关系:②周期的分类元素周期表中,我们把1、2、3周期称为,周期称为长周期,第周期称为不完全周期,因为一直有未知元素在发现。
[课堂练习1]请大家根据元素周期表,完成下表内容。
[思考与交流]如果不完全周期排满后,应为几种元素?[归纳与整理]2、族:元素周期表共有个纵行,除了三个纵行称为Ⅷ外,其余的每一个纵行称为一个,故元素周期表共有个族。
族的序号一般用罗马数字表示。
①族的分类元素周期表中,我们把个纵行共分为个族,其中个主族,个副族,一个族,一个族。
a、主族:由元素和元素共同构成的族,用A表示:ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦAb、副族:完全由元素构成的族,用B表示:ⅠB、ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦBc、第Ⅷ族:三个纵行d、零族:第纵行,即稀有气体元素②主族序数与最外层电子数的关系:③族的别称ⅠA称为元素ⅡA称为元素ⅣA称为元素ⅤA称为元素ⅥA称为元素ⅦA称为元素零族称为元素[归纳小结]:(一)、元素周期表编排原则:1、。
2、。
3、。
(二)、周期表的结构,包括周期的结构:。
族的结构:。
[课堂练习2]请描述出Na、C、Al、S在周期表中的位置。
[课堂练习3]某元素位于第二周期,第ⅦA 族它是___元素。
P相邻的同族元素的原子序数是【基础达标】1.19世纪中叶,俄国化学家门捷列夫的突出贡献是()A.提出原子学说B.制出第一张元素周期表C.提出分子学说D.发现氧气2.已知元素的原子序数,可以推断元素原子的()①质子数②核电荷数③核外电子数④离子所带电荷数A.①③B.②③C.①②③D.②③④3.由长周期元素和短周期元素共同构成的族是()①0族②主族③副族④第Ⅷ族A.①②B.①③C.②③D.③④4.下列说法不正确的是()A.已知原子的核电荷数,可以推知该原子的周期序数B.原子的电子层数等于该原子的周期序数,前20号元素中,阳离子的电子层数等于对应原子的周期序数减去1,阴离子的电子层数等于对应原子的周期序数C.知道原子的周期序数,就能确定该元素在周期表中的位置D.知道原子的周期序数,还不能确定该元素在周期表中的位置5.有a、b、c、d四种主族元素,已知a、b的阳离子和c、d的阴离子都具有相同的电子层结构,阳离子所带正电荷a<b;阴离子所带的负电荷c>d,则四种元素的原子序数关系是()A.a>b>c>d B.b>a>d>cC.c>b>a>d D.b>a>c>d6.短周期元素A、B、C在元素周期表中的位置如图所示,已知B、C两元素原子的最外层电子数之和等于A元素原子最外层电子数的2倍,B、C两元素的原子序数之和是A元素原子序数的4倍,A、B、C三元素应分别为()A.C、Al、P B.O、P、C lC.N、Si、S D.F、S、Ar7.下列各表为元素周期表中的一部分,表中数字为原子序数,其中M的原子序数为37的是()8.已知元素周期表中前七周期的元素种数如下所示(第七周期填满,元素种类为32):周期序数一二三四五六七元素种类数 2 8 8 18 18 32 32分析元素周期序数和元素种类数的关系,然后预测第八周期最多可能含有的元素种数为()A.18 B.32 C.50 D.64题号 1 2 3 4 5 6 7 8答案9.在下列各元素组中,除一种元素外,其余元素可以按某种共性归属一类。
请选出各组中的例外元素,并将该组其他元素的可能归属按所给六种类型的编号填入表内。
元素组例外元素其他元素所属类型编号(a)S、Na、Mg、Al(b)P、N、Sn、As(c)K、Ca、Al、Zn(d)Cu、Fe、Ag、Ca其他元素所属类型编号:①主族元素;②过渡元素;③同周期元素;④同主族元素;⑤金属元素;⑥非金属元素。
【拓展提升】A、B、C为短周期元素,在周期表中所处的位置如图所示。
A、C两元素的原子核外电子数之和等于B原子的质子数。
B原子核内质子数和中子数相等。
(1)写出A、B、C三种元素名称:__________、__________、________。
(2)B位于周期表中第________周期第________族。
(3)写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式:________________________________________________________________________。
【参考答案】1.B2.C[根据原子序数=核电荷数=质子数=核外电子数,可知C项正确。
]3.A4.C[元素在周期表中的位置由周期序数和族序数共同决定,只知道其中一个,不能确定它在同期表中的位置,故C项错误,D项正确;若知道元素的核电荷数,利用周期表的排布原则,可确定其位置,A项正确;原子形成简单阳离子时,失去其最外层电子,其电子层数比对应原子电子层数少1,形成阴离子时电子层数不变,B项正确。
]5.B[由于四种离子的电子层结构相同,则它们的核外电子数相同,由阳离子的原子序数=核外电子数+所带电荷数,则b>a,阴离子的原子序数=核外电子数-所带电荷数,则d >c,故四种元素原子序数的大小关系为b>a>d>c。
]6.B[已知A、B、C为短周期元素,据图示分析,可知A元素位于第二周期,B、C元素位于第三周期。
已知B、C原子序数之和是A原子序数的4倍,设B的原子序数为x,C的原子序数为(x+2),A的原子序数为x+1-8=x-7,得x+(x+2)=4(x-7),x=15。
元素周期表的短周期元素中,相邻四种主族元素呈“T”形的位置关系有如下两种情况:、;各元素的原子序数关系如下所示:、,这些元素应处在第ⅢA~第ⅦA族。
]7.B[根据元素在周期表中的位置推断元素时,要明确一、二、三周期是短周期,元素种类分别为2、8、8种,四、五、六周期为长周期,元素种类分别为18、18、32种,同一周期相邻元素,原子序数差1。
]8.C[由本题图表所示的元素周期序数和元素种类的关系可归纳出:当周期序数n为奇数时,此周期所容纳的元素种类是n+122;当n为偶数时,此周期所容纳的元素种类数是n+222。
因此第八周期所容纳的元素种类数是8+222=50。
]9.(a)S⑤(b)Sn④或⑥(c)Zn①(d)Ca②10.(1)氮硫氟(2)三ⅥA(3)2NH3+H2SO4===(NH4)2SO4(或NH3+H2SO4===NH4HSO4)解析A、B、C均为短周期元素,从三者的相对位置及周期表的结构来看,A、C一定处于第二周期,B处于第三周期,若A的原子序数为x,则C的原子序数为x+2,B的原子序数为x+8+1。
由题意知:x+x+2=x+8+1,x=7,所以A、B、C的原子序数分别为7、16、9,分别为氮元素、硫元素、氟元素。
【学习反思】第一章第一节元素周期表(2)【学习目标】1.了解原子结构与元素性质的关系。
2.初步学会总结元素递变规律的能力。
【学习重点】元素性质的递变规律与元素组成微粒结构的联系【预备知识】请同学们画出碱金属的原子结构示意图,分析碱金属原子结构的共同之处。
元素名称核电荷数原子结构示意图最外层电子数电子层数碱金属元素[推知其化学性质如何?是否完全相同?[实验1]将一干燥的坩埚加热,同时取一小块钾,擦干表面的煤油后,迅速的投入到热坩埚中,观察现象。
同钠与氧气的反应比较。
[实验2]在培养皿中放入一些水,然后取绿豆大的钾,吸干表面的煤油,投入到培养皿中,观察现象。
同钠与水的反应进比较。
钠钾与氧气的反应与水的反应【基础知识】二、元素的性质与原子结构(一)碱金属的化学性质1、与非金属的反应Li+O2Na+O2K+O2K、Rb等碱金属与O2反应,会生成超氧化物。
Rb、Cs在室温时,遇到空气会立即燃烧。
2、与水的反应K+H2O Rb+H2O除Na、K外,其他碱金属元素也都可以和水反应生成相应的碱与H2。
[小结]2M+2H2O == 2MOH+H2↑碱性: [思考与交流]根据实验讨论钠与钾的性质有什么相似性和不同。
你认为元素的性质与他们的原子结构有关系吗?(二)碱金属的物理性质的比较(见课本第7页)[课堂练习1]:钫(Fr)具有放射性,它是碱金属元素中最重的元素,下列预言错误的是:A.在碱金属中它具有最大的原子半径B.它的氢氧化物化学式为FrOH,是一种极强的碱C.钫在空气中燃烧时,只生成化学式为Fr2O的氧化物D.它能跟水反应生成相应的碱和氢气,由于反应剧烈而发生爆炸[阅读教材]第7、8页典型的非金属-----卤素看看他们的性质有原子结构间是否存在联系?[归纳与整理](三)卤素单质的物理性质(见课本第8页)[思考与交流]请大家根据卤素单质的物理性质,总结出卤素单质在颜色、状态、密度、熔沸点、溶解性等各方面的递变规律。
[归纳与整理]颜色:状态:密度:熔沸点:在水中的溶解性:[设问]大家能否根据卤素原子的结构特点来解释一下卤素单质在性质上的相似性与递变性呢?[归纳与小结](四)卤素的化学性质:1、卤素单质与氢气的反应(见课本第8页)卤素和H2的反应可用通式H2+X2==== 来表示,反应时按F2、Cl2、Br2、I2的顺序,反应条件越来越,反应程度依次,形成的卤化氢的稳定性也依次。
[实验1]将少量新制的饱和氯水分别注盛有NaBr溶液和KI溶液的试管中,用力振荡后,在注入少量四氯化碳,振荡。
