高一化学-元素性质递变规律[上学期] 最新
2020-2021学年高中化学新人教版必修第一册 第4章 第2节 课时1 元素性质的周期性变化规律
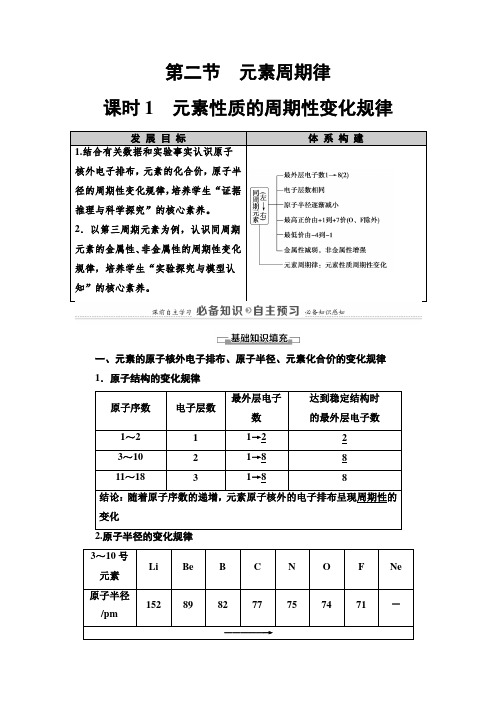
第二节元素周期律课时1元素性质的周期性变化规律发展目标体系构建1.结合有关数据和实验事实认识原子核外电子排布,元素的化合价,原子半径的周期性变化规律,培养学生“证据推理与科学探究”的核心素养。
2.以第三周期元素为例,认识同周期元素的金属性、非金属性的周期性变化规律,培养学生“实验探究与模型认知”的核心素养。
一、元素的原子核外电子排布、原子半径、元素化合价的变化规律1.原子结构的变化规律原子序数电子层数最外层电子数达到稳定结构时的最外层电子数1~2 1 1→2 23~10 2 1→8 811~18 3 1→8 8结论:随着原子序数的递增,元素原子核外的电子排布呈现周期性的变化3~10号元素Li Be B C N O F Ne 原子半径/pm152 89 82 77 75 74 71 -―――――→逐渐减小11~18号元素Na Mg Al Si P S Cl Ar 原子半径/pm186 160 143 117 110 102 99 -变化趋势―――――→逐渐减小结论:随着原子序数的递增,元素原子的半径呈现周期性变化原子序数主要化合价的变化1~2 +1―→03~10+1―→+5-4―→-1―→011~18+1―→+7-4―→-1―→0结论:随着原子序数的递增,元素的主要化合价呈周期性变化二、第三周期元素性质的递变1.钠、镁与水的反应钠镁实验操作实验现象钠熔成小球,浮于水面,四处游动,有“嘶嘶”的响声,反应后溶液加酚酞变红加热前,镁条表面附着了少量无色气泡,加热至沸腾后,有较多的无色气泡冒出,滴加酚酞溶液变为粉红色反应原理2Na+2H2O===2NaOH+H2↑Mg+2H2O=====△Mg(OH)2↓+3(1)实验探究:①向AlCl3溶液中加入足量氨水,现象为产生白色沉淀,反应的离子方程式为Al3++3NH3·H2O===Al(OH)3↓+3NH+4。
②将①实验得到的沉淀分装两支试管中,一支试管中加入盐酸,现象为白色沉淀逐渐溶解,离子方程式为Al(OH)3+3H+===Al3++3H2O;另一支试管中加入NaOH溶液,现象为白色沉淀逐渐溶解,离子方程式为Al(OH)3+OH-===AlO-2+2H2O。
元素性质的递变规律(元素电负性的周期性变化)

三、电负性的应用
1、元素电负性数值的大小可用于衡量 元素的金属性、非金属性的强弱。 一般认为,电负性 大于 2.0的元 素为非金属元素,电负性 小于 2.0的 元素为金属元素。
2、通过电负性判断化学键的类型
一般认为,如果两个成键元素间 的电负性差值大于1.7,他们之间通常 形成 离 子 键;如果两个成键元素间 的电负性差值小于1.7,他们之间通常 形成 共 价 键。
巩固练习 3、电负性差值大的元素之间形成的化学键主要 为( B ) 差值若为零时呢? A.共价键 B.离子键 C.金属键 D.配位键
4、下列不是元素电负性的应用的是( A.判断一种元素是金属还是非金属 B.判断化合物中元素化合价的正负 C.判断化学键的类型 D.判断化合物的溶解度
D)
巩固练习
6、在下列空格中,填上适当的元素符号。 (1) 在第3周期中,第一电离能最小的元素 是 Na ,第一电离能最大的元素是 Ar ; 电负性最小的元素是 Na ,电负性最大的 元素是 Cl 。 (2)在元素周期表中,第一电离能最小的元 素是 Cs ,第一电离能最大的元素是 He ; 电负性最小的元素是Cs ,电负性最大的元 素是 F 。(不考虑放射形元素!)
巩固练习 7、A、B、C、D四种元素,已知A元素是自然界中 含量最多的元素;B元素为金属元素,已知它的 原子核外K、L层上电子数之和等于M、N层电子数 之和;C元素是第3周期第一电离能最小的元素, D元素在第3周期中电负性最大。 (1)试推断A、B、C、D四种元素的名称和符号。 O Ca Na Cl (2)写出上述元素两两化合生成的离子化合物的 化学式。
CaO
Nห้องสมุดไป่ตู้2O
Na2O2 CaCl2
NaCl
3、电负性数值的大小能够衡量元 素在化合物中吸引电子能力的大小
元素性质的递变规律

金属元素形成的盐类性质也随着金属活泼性的变化而变化。例如,钾盐易溶于水且多为无色晶体,而铜盐则多呈蓝色 且溶解度较小。
配合物性质变化规律
金属元素在形成配合物时,其配位数和稳定性也随着金属活泼性的变化而变化。例如,过渡金属元素可 以形成多种配位数的配合物,并且其稳定性随着配位数的增加而增加。
元素性质的递变规律
目 录
• 元素周期表与元素性质 • 原子结构与元素性质 • 金属元素性质递变规律 • 非金属元素性质递变规律 • 递变规律在化学反应中应用 • 总结与展望
01 元素周期表与元素性质
元素周期表简介
元素周期表是按照元素的原子序数(即核内质子 数)从小到大排列的二维表格。
周期表横行为周期,纵列为族,具有相似化学性 质的元素被归入同一族中。
要点二
应用元素性质递变规 律
元素性质递变规律在化学、材料科学 、能源科学等领域具有广泛的应用前 景。未来,人们将更加注重将元素性 质递变规律应用于实际生产和科研中 ,推动相关领域的快速发展。
要点三
拓展元素周期表
目前已知的元素种类有限,未来随着 科学技术的不断进步,人们有望发现 更多的新元素。这些新元素的发现将 进一步拓展元素周期表的范围和内涵 ,为元素性质递变规律的研究和应用 提供新的思路和方向。
VS
电离能反映元素原子失去电子的难易 程度,与元素的金属性、非金属性密 切相关。一般来说,金属元素的第一 电离能较小,非金属元素的第一电离 能较大。
03 金属元素性质递变规律
金属元素通性
具有金属光泽
金属元素通常具有特征性的金 属光泽,如金色、银色等。
导电性
金属元素具有良好的导电性, 是电子工业中重要的材料。
含氧酸
高一化学认识同周期元素性质的递变规律

左下方的元素,其金属性就愈强。 Al,但失电子数目Na比Al少;
碱性:NaOH>Mg(OH)2>Al(OH)3
(2)最高价氧化物的水化物的碱性愈强,金属性则 (3)单质与水或酸反应置换氢的难易,愈易则金属性愈强。
律
1.规律 同周期由左到右,元素的原子得电子能力_增__强___, 失电子能力_减__弱__。
一、同周期元素原子结构与性质的递变规律
项目
同周期(从左到右稀有气体除外)
最外层电子数
由1逐渐增加到7
主要化合价 最高正价+1→+7,负价-4→-1
原子半径
逐渐减小(稀有气体元素除外)
原子得、失电子能 力
解析: C、N、O、F属同一周期的元素,且原子序数依次增大,原子半径逐渐减小,得电子能力依次增强;
1.判断元素金属性强弱 名师点拨: 解答本题应抓住以下两点:
名师点睛: O、F两元素常见化合价无正价,最高正价≠最外层电子数,也无最高价氧化物及其水化物。
(1)在元素周期表中的相对位置,在周期表愈位于 由于F无正化合价,所以第2周期元素的最高化合价不符合W<X<Y<Z。
二、硅、磷、硫、氯得电子能力的比较
1.单质与H2化合的难易程度为:_S_i_<_P_<_S_<_C__l2_。 2.生成气态氢化物的稳定性强弱顺序为: _S_i_H_4_<_P_H__3<_H__2_S_<_H_C__l。 3.最高价氧化物对应水化物的酸性强弱顺序为: _H_3_P_O__4_<_H_2_S_O__4<_H__C_l_O_4_。 4.硅、磷、硫、氯得电子能力的强弱顺序为: _C_l_>_S_>_P_>__S_i 。
【人教版】高中化学必修第一册第四章 第二节 第1课时 元素性质的周期性变化规律

(5)最高价氧化物对应水化物碱性最强的是_________。
【解析】原子序数为11~17的元素是同周期元素,电子层数 相同,核电荷数越大,原子半径越小,非金属性越强;核电 荷数越小,金属性越强。(1)原子半径最小的是Cl。(2)金属性 最强的是Na。(3)非金属性越强的元素,其最高价氧化物对应 水化物的酸性越强,氯的非金属性最强,其对应的最高价含 氧酸是HClO4。(4)非金属性最弱的非金属元素Si的气态氢化 物最不稳定。(5)金属性最强的Na对应的NaOH的碱性最强。
(3)写出气态氢化物的分子式:__H__C_l_、__H__2S__,比较其稳
定性强弱:__H__C_l_>_H__2S___。 【解析】因A原子的L层电子数与K、M层电子数之和相 等,
所以A的核电荷数为2×8=16,A为硫元素;D原子的K、L层电子 数之和等于电子总数的一半,则D原子的核电荷数是(2+8)×2=20, 为钙元素。根据核电荷数依次增大并都能形成离子,排除氩元素, 则B为氯元素,C为钾元素。
4.(1)试从原子结构的角度分析同周期元素性质的递变规律产生 的原因。 (2)同周期元素从左到右,原子半径逐渐减小吗? (3)随着原子序数的递增,第二周期元素的最高正价是逐渐 递增的吗? (4)你能根据元素周期律,比较H3PO4、H2SO4、HClO4的
酸 性强弱以及P3-、S2-、Cl-的还原性强弱吗?
1.“三看”法比较简单粒子的半径大小
2.粒子半径大小的比较
下列粒子半径大小比较正确的是( B ) A.Na+<Mg2+<Al3+<O2- B.S2->Cl->Na+>Al3+ C.Na<Mg<Al<Si D.Cs<Rb<K<Na
(打印)同周期、同主族元素性质的递变规律

同周期元素性质的递变规律:同一周期元素(稀有气体元素除外)的原子,从左往右,最外层电子数逐渐增加,原子半径逐渐减小,元素的原子失电子能力逐渐减弱,得电子能力逐渐增强,即元素的金属性逐渐减弱,非金属性逐渐增强第3周期:元素原子失电子能力(元素的金属性、元素单质的还原性)Na > Mg > Al氧化性:Na+< Mg2+< Al3+(相反)与水或酸反应置换出氢的难易程度:Na > Mg > Al易难剧烈不剧烈最高价氧化物对应的水化物的碱性NaOH > Mg(OH)2> Al(OH)3元素原子得电子能力(元素的非金属性)Si < P < S < Cl还原性:P3->S2->Cl-(Si4-不存在) (相反)元素单质的氧化性Si < P < S < Cl2单质与氢气化合的难易程度Si < P < S < Cl2难易气态氢化物的稳定性SiH4< PH3< H2S < HCl最高价氧化物对应的水化物的酸性H4SiO4(或H2SiO3) < H3PO4< H2SO4< HClO4第2周期:元素原子失电子能力(元素的金属性、元素单质的还原性)Li > Be氧化性:Li+< Be2+(相反)与水或酸反应置换出氢的难易程度:Li > Be易较难剧烈较不剧烈最高价氧化物对应的水化物的碱性LiOH > Be(OH)2元素原子得电子能力(元素的非金属性)C < N < O < F还原性:N3->O2->F-(C4-不存在) (相反)元素单质的氧化性C < N2< O2< F2单质与氢气化合的难易程度C < N2< O2< F2难易气态氢化物的稳定性CH4< NH3< H2O < HF最高价氧化物对应的水化物的酸性H2CO3< HNO3同主族元素性质的递变规律:同主族元素从上到下,电子层数依次增多,原子半径逐渐增大,元素的原子失电子能力逐渐增强,得电子能力逐渐减弱即元素的金属性逐渐增强,非金属性逐渐减弱ⅦA族ⅠA族(除氢H外,即碱金属元素)。
高一化学元素周期表知识精讲

高一化学元素周期表【本讲主要内容】元素周期表元素周期表中主族元素性质的递变规律、原子结构、元素性质及元素在周期表中位置三者的关系、元素周期表的结构及应用、元素的推断等。
其中元素周期表的结构及应用是学习的重点。
【知识掌握】【知识点精析】二. 原子结构、元素性质及元素在周期表中位置三者的关系主族序数质子数原子半径1.同周期左右:非金属性增强。
2.同主族上下:化学性质相似,但又有递变。
1. 原子结构与元素在周期表中的位置关系:(1)核外电子层数=周期数(2)主族元素的最外层电子数=价电子数=主族序数=最高正价数(3)质子数=原子序数=原子核外电子数=核电荷数(4)负价绝对值=8-主族数(限ⅣA~ⅦA)(5)原子半径越大,失电子越易,还原性越强,金属性越强,形成的最高价氧化物的相应水化物碱性越强,其离子的氧化性越弱。
(6)原子半径越小,得电子越易,氧化性越强,非金属性越强,形成的气态氢化物越稳定,形成最高价氧化物的相应水化物酸性越强,其离子的还原性越弱。
2. 周期表与电子排布(1)最外层电子数等于或大于3(小于8)的一定是主族元素。
(2)最外层有1个或2个电子,则可能是ⅠA、ⅡA族元素又可能是副族或零族元素氦。
(3)最外层电子数比次外层电子数多的元素一定位于第二周期。
(4)某元素阴离子最外层电子数与次外层相同,该元素位于第三周期。
(5)电子层结构相同的离子,若电性相同,则位于同周期,若电性不同,则阳离子位于阴离子的下一周期。
3. 从元素周期表归纳元素化合价的规律(1)主族元素的最高正价数等于主族序数,等于主族元素原子的最外层电子数,其中氟无正价。
非金属元素除氢外,均不能形成简单阳离子,金属元素不能形成简单阴离子。
(2)主族元素的最高正价数与最低负价数的绝对值之和为8,绝对值之差为0、2、4、6的主族依次为ⅣA、ⅤA、ⅥA、ⅦA族。
(3)非金属元素的正价一般相差2,如氯元素正化合价有+7、+5、+3、+1等,某些金属也符合此规律,如锡元素正化合价有+4、+2价(4)短周期正价变化随原子序数递增,同周期有一个+1到+7价的变化(ⅠA~ⅦA);长周期有两个+1到+7价的变化(ⅠA~ⅦB,ⅠB~ⅦA)。
元素性质的递变规律(元素第一电离能的周期性变化)

——元素周期律是指元素性质随 着元素核电荷数的递增而呈周期 性变化的规律。
复习回忆
原子结构和性质周期性变化
(1)同一周期元素结构和性质具有一定的递变性;从左到右 原子半径逐渐 减小 ,失电子能力逐渐 减弱 ,得电子能 力逐渐 增强 ,元素的金属性逐渐 减弱 ,非金属性逐渐 增强,对应氢化物的稳定性逐渐 增强 ;最高价氧化物 对应的水化物的酸性逐渐 增强 ;碱性逐渐 减弱 ; (2)同一主族元素结构和性质具有一定的相似性和递变性; 同一主族,从上到下:原子半径逐渐 增大 ,失电子能力 逐渐 增强 ,得电子能力逐渐 减弱 ,金属性逐 渐 增强 ,非金属性逐渐 减弱 ;对应氢化物的稳定性 逐渐 减弱 ;最高价氧化物对应的水化物的酸性逐 渐 减弱 ;碱性逐渐 增强 ;
概念应用
1、已知M(g)-e- →M +(g)时所需最低能量为 mol-1 . 502KJ,则M元素的I1 = 502 KJ· 2、已知Na元素的I1=496 KJ· mol-1,则Na (g) -e→Na +(g) 时所需最低能量为 496 KJ .
探 究 学 习
元素第一电离能大小与原 子失电子能力有何关系?
I1、I2相差不大,I3远大于它们,说明镁容易失 去两个电子,而不易失去第三个电子,因此镁 观察分析下表电离能数据回答问题: 易形成 Mg2+,而不易形成Mg3+。
元素 Na Mg
I1 KJ/mol I2 KJ/mol I3 KJ/mol 496 4562 6912 738 1451形成Na2+; 镁元素易形成Mg2+,而不易形成Mg3+?
课堂练习
1、判断下列元素间的第一电离能的大小:
> F < Mg >
Na
K
Ne Al
元素性质的递变性规律

元素性质的递变性规律第⼆单元元素性质的递变规律【学海导航】元素的性质随着核电荷数的递增⽽呈现周期性的变化,这个规律叫做元素周期律。
⼀、原⼦核外电⼦排布的周期性元素按原⼦序数递增的顺序依次排列时,原⼦的最外层上的电⼦数,由1(s1)到8(s2p6),呈现出周期性变化。
相应于这种周期性变化,每周期以碱⾦属开始,以稀有⽓体结束。
元素的化学性质,主要取决于元素原⼦的电⼦结构,特别是最外层电⼦结构。
所以元素性质的周期性,来源于原⼦电⼦层结构的周期性。
根据元素原⼦的外围电⼦排布的特征,可将元素周期表分成五个区域:s区、p区、d区、ds区、f区。
⼆、元素第⼀电离能的周期性变化1、定义:从⽓态的基态原⼦中移去⼀个电⼦变成+1价⽓态阳离⼦所需的最低能量,称为第Ⅰ电离能。
常⽤符号I1表⽰。
M(g)→ M+(g)+ e-,+1价⽓态阳离⼦移去⼀个电⼦变成+2价⽓态阳离⼦所需的最低能量,称为第Ⅱ电离能。
依次类推。
元素的第⼀电离能越⼩,表⽰它越容易失去电⼦,即该元素的⾦属性越强。
2、影响电离能的因素电离能的⼤⼩主要取决于原⼦的核电荷、原⼦半径及原⼦的电⼦构型。
⼀般说来,核电荷数越⼤,原⼦半径越⼩,电离能越⼤。
另外,电⼦构型越稳定,电离能也越⼤。
3. 电离能的周期性变化同周期中, 从左向右,核电荷数增⼤,原⼦半径减⼩, 核对电⼦的吸引增强, 愈来愈不易失去电⼦, 所以 I 总的趋势是逐渐增⼤。
但有些元素(如Be、Mg、N、P等)的电离能⽐相邻元素的电离能⾼些,这主要是这些元素的最外层电⼦构型达到了全充满或半充满的稳定构型。
同主族元素⾃上⽽下电离能依次减⼩。
但在同⼀副族中,⾃上⽽下电离能变化幅度不⼤,且不甚规则。
4.电离能与价态之间的关系失去电⼦后, 半径减⼩, 核对电⼦引⼒⼤, 更不易失去电⼦, 所以有: I1 < I2< I3<I4…., 即电离能逐级加⼤.三、元素电负性的周期性变化1、定义:电负性: 表⽰⼀个元素的原⼦在分⼦中吸引电⼦的能⼒. 元素的电负性越⼤,表⽰原⼦吸引成键电⼦的能⼒越强,该元素的⾮⾦属性也就越强;电负性越⼩,该元素的⾦属性越强。
(完整版)同主族元素性质的递变规律

2.卤族元素的原子最外层上的电子数 是__7__,其中,非金属性最强的是 __F__。卤素的最高价氧化物对应水化 物的化学式是_H__X__O_(以X表示卤素)。
注:氟元素无最高价氧化物及其水合物,因为氟 元素无正化合价
3.下列性质的递变中,正确的是 ( AB )
A.O、S、Na的原子半径依次增大 B.LiOH、KOH、CsOH的碱性依次增强 C.HF、NH3、SiH4的稳定性依次增强 D.HCl、HBr、HI
元素原子序数依次增加原子半径逐渐减小元素原子失电子的能力逐渐减弱得电子的能力逐渐增强alsigesbte非金属性逐渐增强金属性逐渐增强元素周期表中元素性质递变规律内容同周期从左到右同主族从上到下原子半径电子层结构失电子能力得电子能力金属性或非金属性主要化合价最高价氧化物对应的水化物酸碱性非金属元素气态氢化物的形成与稳定性电子层数相同最外层电子增多逐渐减小逐渐增大逐渐增大逐渐减小金属性减非金属性增金属性增非金属性减最高正价17最高正价族系数碱性逐渐减弱酸性逐渐增强碱性逐渐增强酸性逐渐减弱形成
H、C、O、F、Na
2、用A表示质子数,B 中子数,C 核外电子数, D 最外层电子数,E 电子层数 填写下列各空:
⑴ 原子(核素)种类由_A__B__决定 ⑵ 元素种类由___A__决定 ⑶ 元素同位素由 ___B__决定 ⑷ 元素在周期表中的位置由__D__E__决定 ⑸ 元素的原子半径由___A_E___决定 ⑹ 元素主要化合价由___D___决定 ⑺ 元素的化学性质主要由___D___决定 ⑻ 价电子通常是指___D____
⑶ 论证了量变引起质变的规律性
课堂练习:
1、相邻三个周期的主族元素A、B、C、D、 E,它们的原子序数依次增大,B、C、D元 素在同一周期,A、E在同一主族。除A外 的各元素的原子的电子层内层已填满电子。 其中B的最外层有4个电子。A与B,B与C 都能生成气态的化合物。D与E生成离子化 合物。在离子化合物中它们化合价的绝对 值相等。试回答:它们各是什么元素?
高中化学必修第一册实验活动3同周期、同主族元素性质的递变课件

(2)Mg(OH)2、Al(OH)3的碱性强弱比较 实验一:
【实验操作】向一支试管中加入少量MgCl2溶液,然后逐滴滴加1 mol·L-1 NaOH溶液直至过量,观察现象。
【实验现象】_先__产__生_白__色__沉_淀__,__继__续_滴__加__N_a_O_H_溶__液__,_沉__淀__量_逐__渐__增__大_,_ _最_后__沉__淀__不_消__失_______________________________________。
②碱性:_M__g_(O_H__)2_>________; 金属性:___M_g____>____A_l___。
问题讨论 1.画出并比较元素氟、氯、溴、碘的原子结构示意图,从微观上分 析并解释实验现象。
2.画出并比较元素钠、镁、铝的原子结构示意图,从微观上分析并 解释实验现象。
【化学方程式】_M_g_C_l_2+__2_N_a_O__a_C_l__。
实验二:
【实验操作】向另一支试管中加入少量AlCl3溶液,然后逐滴滴加1 mol·L-1 NaOH溶液直至过量,观察现象。
【实验现象】_先_产__生__白__色_沉__淀__,_继__续__滴_加__N_a_O_H__溶_液__,__沉__淀_量__逐__渐_增__大__,___ _后__逐_渐__溶__解__,_最__后__完_全__消__失_____________________________________。 【化学方程式】_A__lC_l_3+__3_N_a_O_H_=_=_=_A_l_(O_H__)3_↓__+_3_N_a_C_l___; _A_l_(O_H__)3_+__N_a_O_H_=_=_=_N_a_[A__l(_O_H_)_4]___。 【实验结论】①_M__g(_O_H_)_2_不溶于NaOH溶液;__A_l(_O_H__)3_溶于NaOH溶 液。
元素性质的递变规律
课堂练习
2、下列各组元素按电负性由大到小顺序排列
的是
(D )
A. F N O
B. O Cl F
C. Na Mg Al D. Cl S As
三、电负性的意义
反映了原子间的成键能力和成键类 型。
二、电负性的递变规律:
同一周期从左到右,主族元素电负性逐 渐 增 ,大表明其吸引电子的能力逐渐 。同 一主增族从大上到下,元素电负性呈现 趋势, 表明其吸减引小电子的能力逐渐 。
减小
为什么
因为同一周期从左到右随着核电荷数的 增加,元素原子半径减少,核对外层电子引 力逐渐增大,得电子能力逐渐增强,所以元 素的电负性逐渐增强。
3、同主族元素第一电离能从上到下 逐渐减小,为什么?
提示:从原子结构的变化来解释
参考答案:同主族元素从上到下,随核电荷数增大,原子半径逐渐增大, 原子核对核外电子的吸引力逐渐减小,原子失电子能力逐渐增大,第一电 离能逐渐减小。
4、同一周期第一电离能最小的是碱金属元 素,最大的是稀有气体元素。为什么?
规律与总结
总体上:金属元素的第一电离能都 较 ,小非 金属元素和稀有气体元素的第一电离能 都 较 大。
在同一周期中第一电离能最小的是 碱金属元 素,最大的是 稀有气体 元素。
课堂练习
1、下列叙述中正确的是
( )C
A、同周期元素中,VIIA 族元素的原子半
径最大
B、VIA族元素的原子,其半径越大,越容
气态电中性基态原子失去一个电子转化为 气态基态正离子所需要的最低能量叫做第一 电离能(用I1表示),从一价气态基态正离子 中再失去一个电子所需消耗的最低能量叫做 第二电离能(用I2表示),依次类推,可得到I3、 I4、I5……
元素性质的递变规律
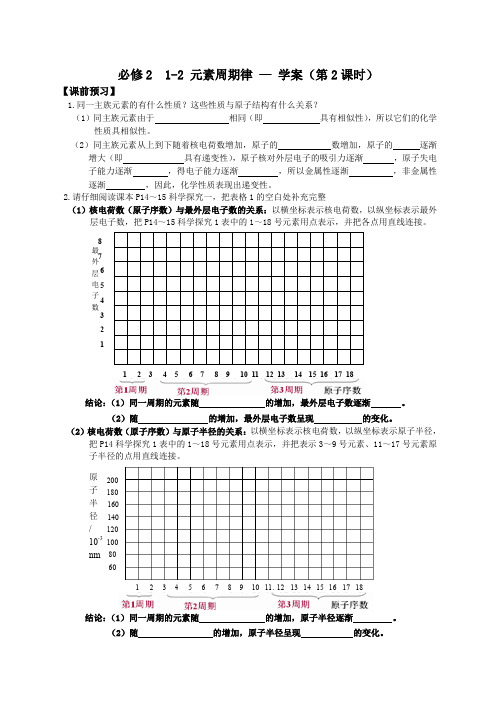
必修2 1-2 元素周期律 — 学案(第2课时)【课前预习】1.同一主族元素的有什么性质?这些性质与原子结构有什么关系?(1)同主族元素由于 相同(即 具有相似性),所以它们的化学性质具相似性。
(2)同主族元素从上到下随着核电荷数增加,原子的 数增加,原子的 逐渐增大(即 具有递变性),原子核对外层电子的吸引力逐渐 ,原子失电子能力逐渐 ,得电子能力逐渐 ,所以金属性逐渐 ,非金属性逐渐 ,因此,化学性质表现出递变性。
2.请仔细阅读课本P14~15科学探究一,把表格1的空白处补充完整(1)核电荷数(原子序数)与最外层电子数的关系:以横坐标表示核电荷数,以纵坐标表示最外层电子数,把P14~15科学探究1表中的1~18号元素用点表示,并把各点用直线连接。
结论:(1)同一周期的元素随 的增加,最外层电子数逐渐 。
(2)随 的增加,最外层电子数呈现 的变化。
(2)核电荷数(原子序数)与原子半径的关系:以横坐标表示核电荷数,以纵坐标表示原子半径,把P14科学探究1表中的1~18号元素用点表示,并把表示3~9号元素、11~17号元素原子半径的点用直线连接。
结论:(1)同一周期的元素随 的增加,原子半径逐渐 。
(2)随 的增加,原子半径呈现 的变化。
12 3 4 5 6 7 8 最 外 层 电 子 数原 子 序 数12 34 56 78 910 11 12 13 14 15 16 17 181 2 3 4 5 6 7 8 9 1 2 10 11 12 13 2 14 15 16 17 18原子序数原子半径 / 10-3nm 6080 100120 140 160 180 200(3)核电荷数(原子序数)与元素化合价的关系:以横坐标表示核电荷数,以纵坐标表示元素化合价,把P14科学探究1表中的1~18号元素用点表示,并把表示3~9号元素、11~17号元素的正负化合价的点分别用直线连接。
结论:(1)同一周期的元素随 的增加,最高正价逐渐 ,负价逐渐 。
同主族元素性质递变的规律

单质的状态: 气 液 固
紫黑 黑色
单质的颜色: 淡黄绿色 黄绿色 深红棕色
颜色逐渐变深
单质的密度: 逐渐增大 单质的熔沸点:依次增高
卤素单质的化学性质
1、同主族化学性质相似
2、同主族从上到下原子得电子 能力逐渐减弱,失电子能力逐
渐增强 。
得电子能力:F>Cl>Br>I 非金属性: 氧化性: F>Cl>Br>I F>Cl>Br>I
回顾同周期元素性质的递变规律:
从左到右:
半径越来越小(稀有气体例外) 失电子能力减弱,得电子能力增强; 还原性减弱,氧化性增强; 金属性减弱,非金属性增强; 与水(酸)反应生成H2越来越难,最高 价氧化物的水化物的碱性越来越弱;
与H2反应越来越容易,氢化物越稳定,最 高价氧化物的水化物的酸性越来越强
从上到下
1)原子失电子能力逐渐 增强 ,得电子能力逐渐 减弱 。
金属性逐渐增强 ,非金属性逐渐减弱。
还原性逐渐增强,氧化性逐渐减弱。
2)最高价氧化物对应的水化物,碱性逐渐 增强 酸性逐渐 减弱 。
,
3)单质与H2反应越来越难,生成的氢化物越来越不稳定。 4)单质与水(酸)反应生成H2越来越容易。
练习
√
B、和F同一主族的元素都是非金属元素
C、化合物中卤族元素都只会得到电子显负价
D、卤族元素原子的原子半径从上到下逐渐减小
2、砹是原子序数最大的卤族元素,根据卤表性质的
递变规律,对砹及其化合物的叙述,正确的是( )
A、与H2化合能力:At2>I2
B、砹在常温下为白色晶体
√
C、砹原子的最外电子层上有7个电子
D、砹能从NaCl溶液中置换出氯单质
以碱金属为例:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考热点选择题——34元素性质递变规律
1、(1997全国)已知铍(Be)的原子序数为4。
下列对铍及其化合物的叙述中,正确的是
A. 铍的原子半径大于硼的原子半径
B. 氧化铍分子中铍原子的最外层电子数是8
C. 氢氧化铍的碱性比氢氧化钙的弱
D. 单质铍跟冷水反应产生氢气(MCE97.10)
2、(1999全国)关于ⅠA族和ⅡA族元素的下列说法中正确的是
A.在同一周期中,ⅠA族单质的熔点比ⅡA族的高
B.浓度都是0.01 mol·L-1时,氢氧化钾溶液的pH比氢氧化钡的小
C.氧化钠的熔点比氧化镁的高
D.加热时,碳酸钠比碳酸镁易分解
3、(2000春京)已知元素砷(As)的原子序数为33,下列叙述正确的是
A.砷元素的最高化合价为+3
B.砷元素是第四周期的主族元素
C.砷原子的第3电子层含有18个电子
D.砷的氧化物的水溶液呈强碱性
4、(2000全国)下列关于稀有气体的叙述不正确
...的是
A.原子的最外电子层都有8个电子
B.其原子与同周期IA、IIA族阳离子具有相同的核外电子排布
C.化学性质非常不活泼
D.原子半径比同周期ⅦA族元素原子的大
5、(2018春京)关于氮族元素(用R代表)的下列叙述正确的是
A.最高化合价是5 B.氢化物的通式为RH5
C.非金属性由上到下递增D.其含氧酸均为一元强酸
6、(2018广东河南)第四周期某主族元素的原子,它的最外电子层上有两个电子,下列关于此元素的叙述正确的是
A.原于半径比钾的原子半径大B.氯化物难溶于水
C.原子半径比镁的原子半径大D.碳酸盐难溶于水
7、(2018全国春理综)某元素X最高价含氧酸的分子量为98,且X的氢化物的分子式不是H2X,则下列说法正确的是
A. X的最高价含氧酸的分子式可表示为H3XO4
B. X是第二周期V A族元素
C. X是第二周VIA族元素
D. X的最高化合价为+4
8、(2018上海春理综)在人体所需的十多种微量元素中,有一种称为“生命元素”的R元素,对处长人类寿命起着重要的作用。
已知R元素的原子有四个电子层,其最高价氧化物分子式为RO3,则R元素的名称为
A.硫
B.砷
C.硒
D.硅
9、(2018上海)NaH是—种离子化合物,它跟水反应的方程式为:NaH+H2O→NaOH+H2↑,它也能跟液氨、乙醇等发生类似的反应,并都产生氢气。
下列有关NaH的叙述错误的是
A.跟水反应时,水作氧化剂
B. NaH中H-半径比Li+半径小
C.跟液氨反应时,有NaNH2 生成
D.跟乙醇反应时,NaH被氧化
10、(2018广东)下列有碱金性铷(Rb)的叙述中,正确的是
A.灼烧氯化铷时,火焰有特殊颜色
B.硝酸铷是离子化合物,易溶于水
C.在钠、钾、铷三种单质中,铷的熔点最高
D.氢氧化铷是弱碱
答案:1AC 2B 3BC 4AB 5A 6CD 7A 8C 9B 10AB。
