高二物理热力学第一定律
高中物理-热力学第一定律

热力学第一定律热力学第一定律热力学第一定律内容是:研究对象内能的改变量,等于外界对它传递的热量与外界对它所做的功之和。
注:热量的传导与做功均需要注意正负性。
热力学第一定律公式热力学第一定律公式:△U=W+Q其中,△U——内能的变化量,单位焦耳(J),如果为负数,则说明研究对象内能减小。
Q——研究对象吸收的热量,单位焦耳(J),如果为负数,则说明研究对象向外释放热量。
在自然态下,Q传导具有方向性,即只能从高温物体向低温物体传递热量。
W——外界对研究对象做的功,单位焦耳(J),如果为负数,则说明研究对象对外界做功。
热力学第一定律理解误区之吸热内能一定增加?老师:并非如此。
如果对外做功,内能可能不变,甚至减小。
物体的内能是变大还是变小,取决于两个外在因素,其一是吸收(或放出)热量,另外一个是做功。
如果吸收了10J的热量,向外界做了20J的功,物体的内能不会增加,反而会减小(减小10J)。
热力学第一定律深入理解之温度与分子平均动能关系老师:分子平均动能Ek与热力学温度T是正比例关系,即分子平均动能Ek越大,热力学温度T就越大。
分子平均动能Ek是微观表现方式,而热力学温度T是宏观表现方式。
热力学第一定律深入理解之做功与气体体积关系老师:W与气体的体积相关,V减小,则是外界对气体做正功(压缩气体)。
反之,V增大,则是外界对气体做负功(气体膨胀向外界做功)。
热力学第一定律深入理解之能量守恒定律在热学的变形式老师:从热力学第一定律公式来看:△U=W+Q这与能量守恒定律是一致的。
能量守恒定律的内容是:能量既不会凭空产生,也不会凭空消失,只能从一个物体传递给另一个物体,而且能量的形式也可以互相转换。
在热学领域,物体内能改变同样遵守能量守恒定律。
物体内能的增加,要么是伴随着外界做功,要么是由外界热量传导引起的。
在物体A内能增加的同时,物体B因为向A做功能量减小,或者物体C把自身内能以热量形式向物体A传导,自身能量减小。
热力学第一定律与第二定律

热力学第一定律与第二定律热力学是研究能量与热的转化和传递规律的科学,它是自然科学中重要的分支之一。
在热力学中,第一定律和第二定律是两个基本的定律,它们定义了能量守恒和能量转化的方向,对于理解热力学系统的行为和实际应用具有重要意义。
1. 热力学第一定律热力学第一定律,也称为能量守恒定律,表明能量在系统与环境之间的传递和转化后总量保持不变。
它可以通过下式表达:ΔU = Q - W其中,ΔU表示系统内能的变化,Q表示系统吸收的热量,W表示系统对外界做的功。
根据热力学第一定律,一个封闭系统的能量是守恒的,能量既不能被创造也不能被销毁,只能从一种形式转化为另一种形式。
热力学第一定律还可以用来推导出热机效率的表达式。
在一个热机中,根据热力学第一定律,系统吸收的热量等于系统对外界做的功加上系统内能的变化。
根据这个原理,我们可以得到热机效率的公式:η = 1 - Qc/Qh其中,η表示热机的效率,Qc表示热机向冷源放出的热量,Qh表示热机从热源吸收的热量。
这个公式表明,在一个热机中,不能把吸收的热量完全转化为功,一部分热量必须放出到冷源中,效率小于1。
2. 热力学第二定律热力学第二定律是热力学中最重要的定律之一,它表明热量不能自发地从低温物体传递到高温物体,而是自发地从高温物体传递到低温物体。
热力学第二定律有多种等效的表述方式,其中最常见的是克劳修斯表述和开尔文表述。
克劳修斯表述中,热量不会自发地从冷热源传递到热热源,即不存在一个热机,它只从一个热源吸热,然后完全转化为功,再把一部分热量放到冷热源上,不对环境产生任何影响。
这相当于说,在一个封闭系统中,不存在一个循环过程,使得系统对外界做的功等于输入的热量。
这个等效表述被称为克劳修斯表述。
开尔文表述中,不可能制造一个只从一个热源吸热,然后完全转化为功的热机,而不对环境产生任何影响。
这相当于说,在一个封闭系统中,不存在一个循环过程,使得系统吸收的热量完全转化为功,不放出热量到冷热源。
高二热力学第一定律

∵ PV/T=恒量 △ P=0 V ∴△ U<0 ∵ △ V>0∴W<0 根据热力学第一定律△U=Q+W Q=△U-W ∴Q>0
能量守恒定律
表述:能量既不会凭空产生,也不会凭空消失, 它只会从一种形式转化为另一种形式,或者从 一个物体转移到别的物体,在转化或转移过程 中其总量不变。
◆能量守恒定律普遍适用,那个包含了所有形式 的能量。
• 表述:一个热力学系统的内能增量等于外界向 它传递的热量与外界对它做功之和。
• 热力学第一定律反映功、热量与内能改变之间 的定量关系 • 公式:
△U=Q+W
• 运用热力学第一定律前要明确系统
(一)功W
1 广义的功:力学相互作用下的能量传递。
2 符号
W>0
W<0
外界对系统做功
系统对外界做功
(二)热量Q
1 系统与外界存在温度差时,系统与外界交 换的能量。 2 符号
Q>0 Q<0
系统从外界吸热
系统向外界放热
(三)内能增量△U
1 内能U的含义 (1)微观含义:
(2)不包括系统整体宏观运动的机械能 2 符号
△U>0
△U<0
内能增加
内能减少
归纳:
符号 W
QБайду номын сангаас△U
练习: (1)
>0
外界对系统做功
系统从外界吸热 系统 内能增加
10.3热力学第一定律 能量守恒定律
复习:
• 绝热过程,系统内能增量=外界对系统做的功
△U=W
• 单纯传热过程,系统内能增量=系统从外界吸热
△U=Q
思考:
高二物理选修课件热力学第一定律能量守恒定律

01
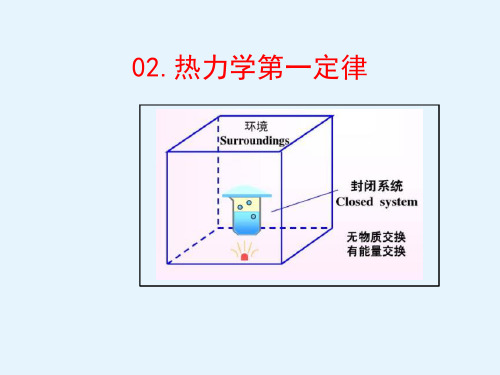
孤立系统
与外界既没有物质交换也没有 能量交换的系统。
02
封闭系统
与外界有能量交换但没有物质 交换的系统。
03
开放系统
与外界既有能量交换又有物质 交换的系统。
能量转化与传递方式
03
做功
热传递
内能变化
在热力学中,做功是指系统对外界或外界 对系统所做的功,它是能量转化的一种方 式。
热量从高温物体传向低温物体的过程,或 者从同一物体的高温部分传向低温部分的 过程。
01
热力学第一定律概述
热力学第一定律定义
01
热力学第一定律
02
能量守恒
热量可以从一个物体传递到另一个物体,也可以与机械能或其他能量 互相转换,但是在转换过程中,能量的总值保持不变。
热力学第一定律表明,能量在封闭系统内不能被创造或消灭,只能从 一种形式转化为另一种形式,总量保持不变。
热力学系统与外界关系
热力学第一定律在日常生 活中的应用
汽车引擎工作原理及效率分析
汽车引擎工作原理
汽车引擎通过燃烧汽油或柴油等燃料,将化学能转化为热能 ,再通过热机过程将热能转化为机械能,从而驱动汽车行驶 。
效率分析
在汽车引擎中,燃料的化学能只有一部分转化为机械能,其 余部分以废热的形式散失到环境中。引擎的效率取决于多个 因素,如燃烧效率、热传导损失、机械摩擦损失等。
太阳能热水器工作原理及性能评价
太阳能热水器工作原理
太阳能热水器利用太阳能集热器吸收太阳辐射能,将其转化为热能并传递给水, 使水温升高。太阳能集热器通常由吸热板、保温层和外壳组成。
性能评价
太阳能热水器的性能主要取决于集热器的集热效率、保温性能以及热水器的容量 和结构设计。高效的太阳能热水器能够在充足的阳光下提供大量的热水,同时保 持较低的散热损失。
热力学第一定律

热力学第一定律热力学第一定律是热力学中最基本的定律之一,也被称为能量守恒定律。
它描述了能量在物质系统中的转化和守恒关系。
在本文中,我们将深入探讨热力学第一定律的原理和应用。
1. 热力学第一定律的原理热力学第一定律表明,一个系统的内能的增量等于吸热与做功之和。
简单来说,即能量的增加等于热量输入和功输入之和。
在一个封闭系统中,内能变化可以表示为ΔU = Q + W,其中ΔU表示内能变化量,Q表示吸热,W表示做功。
根据能量的守恒原理,一个系统的能量不会凭空消失或增加,而是转化成其他形式。
2. 热力学第一定律的应用热力学第一定律在各个领域都有广泛的应用。
以下是其中一些常见的应用场景:2.1. 理想气体的过程分析在理想气体的过程分析中,热力学第一定律被广泛应用于计算气体的工作、吸热和内能变化等参数。
根据热力学第一定律的原理,我们可以通过测量系统吸热和做功的量来计算内能的变化。
2.2. 热机效率的计算热力学第一定律也可用于计算热机的效率。
根据热力学第一定律原理,热机的效率可以表示为η = 1 - Q2/Q1,其中Q1表示热机输入的热量,Q2表示热机输出的热量。
通过计算输入和输出的热量可以确定热机的效率。
2.3. 化学反应的能量变化热力学第一定律也可用于描述化学反应的能量变化。
在化学反应中,热力学第一定律可以帮助我们计算反应的吸热或放热量,从而确定反应是否放热或吸热以及能量变化的大小。
3. 热力学第一定律在能源利用中的应用能源利用是热力学第一定律的一个重要应用领域。
通过研究能源的转化过程和能量损失,我们可以更有效地利用能源资源。
3.1. 热力学循环热力学循环是将热能转化为功的过程,如蒸汽轮机和内燃机。
通过分析热力学循环中各个环节的能量转化和损失,可以优化循环系统的效率,提高能源利用率。
3.2. 可再生能源利用热力学第一定律也可以应用于可再生能源的利用。
通过分析可再生能源的收集、转化和储存过程中的能量转化和守恒关系,可以优化利用这些能源的方式,减少能量的损失和浪费。
高二物理竞赛-热力学第一定律课件

V
V
特征
恒量
准静态过程:从一个平衡态到另一平衡态所经过的每一中间状态均可近似看做平衡态的过程.
另一部分转化为系统对外所做的功.
理想气体内能:对给定的理想气体,它的内能仅是温度的单值函数.
Q V E 1 功是能量传递和转换的量度,它引起系统热运动
另一部分转化为系统对外所做的功.
E2
E1
QV
E2
5
2.等压过程
特征 p恒量
p
p (pⅠ,V1,T1) (p,ⅡV2,T2)
过程方程 VT1 恒量
W
功
W V2
p
V1
pdVp(V2V1)
o V1
M
W pp(V2V1)Mmol R(T2T1)
V2 V
M Q p E p (V 2 V 1 ) E 2 E 1 M m o lR (T 2 T 1 )
6
p
等 压
p (pⅠ,V1,T1) (p,ⅡV2,T2)
VV
热力学第一定律 dQV dE
Q VEE2E1
4
等 p p Ⅱ(p,V,T) 2 二 准静态过程(理想化的过程)
1)包括热现象在内的能量转换和守恒定律 .
2
2
p
等 p1
体 功是能量传递和转换的量度,它引起系统热运动
1)包括热现象在内的能量转换和守恒定律 .
体
通过传热方式传递能量的量度,系统和外界之间存在温差而发生的能量传递 .
物理意义 1)包括热现象在内的能量转换和守恒定律 .
第一类永动机是不可能制成的 .
2)实验经验总结,自然界的普遍规律 .
3
二 热力学第一定律在理想气体等值过程中的应用
高二物理选修热力学第一定律能量守恒定律教案

3. 几点说明
⑴.自然界存在着多种不同形式的运动每种运动对应着 一种形式的能量如机械运动对应机械能;分子热运动 对应内能;电磁运动对应电磁能பைடு நூலகம்
⑵.不同形式的能量之间可以相互转化摩擦可以将机械 能转化为内能;炽热电灯发光可以将电能转化为光能
3.热力学第一定律、机械能守恒定律都是能量守恒定 律的具体体现
A
A.Q1—Q2=W2—W1 C.W1=W2
B.Q1=Q2 D.Q1>Q2
点拨:整个过程的内能不变 ΔU= 0
由热力学第一定律 ΔU=W总+Q总=0
Q总= - W总
∴ Q1—Q2=W2—W1
练习4.一定量的气体吸收热量体积膨胀并对外做
功则此过程的末态与初态相比
D
A.气体内能一定增加
B.气体内能一定减小
2.热传递改变物体内能的过程是内能从一个 物体转移到另一个物体的过程
总结 能量可以由一种形式转化为另一种
形式也可以从一个物体转移到另一个物 体.
二.能量守恒定律
1. 历史过程 P54
2. 能量守恒定律
能量既不会凭空产生也不会凭空消失它只 能从一种形式转化为另一种形式或者从一个物 体转移到别的物体在转化或转移的过程中其总 量不变这就是能量守恒定律
例1.一定质量的气体在被压缩过程中外界对气体 做功300J但这一过程中气体的内能减少300J 问此过程过程中气体是吸热还是放热吸收或放 出多少热量
•解:由题意知:W=300JΔU= -300J 由ΔU=W+Q可得: Q=ΔU-W =-300J-300J= -600J Q为负表示气体放热600J
• 通过前边的学习我们知道: 1.做功改变物体内能的过程是内能和其他形 式的能的转化过程
第一节 热力学第一定律

第一节热力学第一定律
一、热力学第一定律
热力学第一定律又称“平衡状态原理”,又称“达到热平衡状态的原则”,是物理学家拉瓦锡和开普勒于19世纪50年代提出的一个基本定律。
它指出,只要一个热系统达到热平衡的状态,它的物理量必定满足某种定律。
该定律可以用如下的数学表达式表示:
U=Q-W
其中,U表示可用热量,Q表示向系统中输入的热量,W表示从系统中放出的热量。
热力学第一定律可以用来定义热力学系统的热平衡状态,以及实现这种状态所需要采取的步骤。
热力学第一定律可以用来研究物理热系统中的热量在系统中的流动情况,从而为热工程领域的设计提供参考。
由于热力学第一定律只阐述了关于热量的流动情况,因此它只能认为热平衡是否能达到由热量的流动情况来决定,而不能推断系统中物理量是否已经达到平衡状态。
对物理量的平衡情况,则必须依赖其他的定律,例如力学和物理化学等定律。
- 1 -。
高二物理课件 10.3 热力学第一定律 能量守恒定律 (人教版选修3-3)

【标准解答】选B、D.抽开隔板K后,a内的稀薄气体进入真空 b内,a内的稀薄气体做功W=0,绝热容器不与外界发生热传 递,则Q=0,根据热力学第一定律:Δ U=W+Q,可得Δ U=0,则 内能不变,故A错误,B正确;稀薄气体可看做理想气体,内 能仅由温度决定,由于Δ U=0,则气体温度不变.根据玻意耳 定律,气体体积变大,则压强变小,故C错误,D正确.
内能Δ U的符号理解记忆,增加取正号减少取负 号,然后利用单纯绝热过程理解W的符号.Δ U=W.内能增加,当 然要外界对物体做功时取正号.再利用单纯的热传递过程理解Q 的符号.Δ U=Q,内能增加,当然要吸热,故吸收热量时取正号.
2.改变内能的两种方式比较
3.判断是否做功的方法 一般情况下外界对物体做功与否,需看物体的体积是否变化. (1)若物体体积增大,表明物体对外界做功,W<0; (2)若物体体积变小,表明外界对物体做功,W>0.
【典例3】(2010· 全国高考)如图,一 绝热容器被隔板K隔开a、b两部分.已知 a内有一定量的稀薄气体,b内为真空. 抽开隔板K后,a内气体进入b,最终达 到平衡状态.在此过程中( )
A.气体对外界做功,内能减少 B.气体不做功,内能不变 C.气体压强变小,温度降低 D.气体压强变小,温度不变 【解题指导】解答本题时可按以下思路分析:
1.能量的存在形式及相互转化 各种运动形式都有对应的能:机械运动有机械能,分子的热运 动有内能,还有诸如电磁能、化学能、原子能等. 各种形式的能,通过某种力做功可以相互转化,例如:利用电 炉取暖或烧水,电能转化为内能;煤燃烧,化学能转化为内 能;列车刹车后,轮子温度升高,机械能转化为内能. 2.与某种运动形式对应的能是否守恒是有条件的,例如,物体 的机械能守恒,必须是只有重力或弹力做功;而能量守恒定律 是没有条件的,它是一切自然现象都遵守的基本规律.
高二物理竞赛第章热力学第一定律课件

一、内能 功和热量
1 内能(internal energy) :系统处于一定状态时系 统内所有分子能量的总和
2 理想气体内能 E M i RT
2
内能是状态量,是状态参量T的单值函数 3 实际气体内能: 所有分子热运动的动能和分子间势能的总和
R(T2 T1)
Q p E p(V2 V1)
O V1
V2 V
pV RT
i 2
R(T2
T1 )
R(T2
T1 )
i
2RT
2
C p,mT
定压过程中系统吸收的热量一部分用来增加
系统的内能,一部分对外做功。
. dQ dE pdV
三. 等温过程
p1 p I
pV RT
T=恒量,dT=0,dE=0
绝热线比等温线更陡。
膨胀相同的体积绝热比等温压强下降得快
绝热过程中功的计算
1)热一定律,Q=0, A E CV T
2) A p1V1 p2V2
1
由功的定义 A V2 pdV V1
绝热过程方程 p1V1 p2V2 pV
p p1(VV1)
A VV12 p1V1
dV V
p1V1
1 V 1
内能是状态参量T、V的单值函数 E E(T ,V )
4 系统内能改变的两种方式 1) 做功改变系统内能
摩擦升温(机械功)、电加热(电功) 功是过程量 2) 热量传递改变系统内能 热量是过程量 内能是状态量
改变系统状态,传热和作功是等效的 作功是系统内能与外界其它形式能量转换的量度 热量是系统与外界内能转换的量度
p F S pe
高二物理选修3-3 热力学第一定律

高二物理选修3-3 热力学第一定律【知识要点】1.热力学第一定律(1).一个热力学系统的内能增量等于外界向它传递的热量与外界对它所做的功的和。
这个关系叫做热力学第一定律。
其数学表达式为:ΔU=W+Q(2).与热力学第一定律相匹配的符号法则(3)热力学第一定律说明了做功和热传递是系统内能改变的量度,没有做功和热传递就不可能实现能量的转化或转移,同时也进一步揭示了能量守恒定律。
(4)应用热力学第一定律解题的一般步骤:①根据符号法则写出各已知量(W、Q、ΔU)的正、负;②根据方程ΔU=W+Q求出未知量;③再根据未知量结果的正、负来确定吸热、放热情况或做功情况。
2.能量守恒定律⑴能量既不会凭空产生,也不会凭空消失,它只能从一种形式转化为另一种形式,或者从一个物体转移到别的物体,在转化或转移的过程中其总量不变。
这就是能量守恒定律。
⑵热力学第一定律、机械能守恒定律都是能量守恒定律的具体体现。
⑶能量守恒定律适用于任何物理现象和物理过程。
3.第一类永动机不可能制成任何机器运动时只能将能量从一种形式转化为另一种形式,而不可能无中生有地创造能量,即第一类永动机是不可能制造出来的。
【典型例题】例1.一定量的气体在某一过程中,外界对气体做了8×104J的功,气体的内能减少了1.2×105J,则下列各式中正确的是()A.W=8×104J,ΔU =1.2×105J ,Q=4×104JB.W=8×104J,ΔU =-1.2×105J ,Q=-2×105JC.W=-8×104J,ΔU =1.2×105J ,Q=2×104JD.W=-8×104J,ΔU =-1.2×105J ,Q=-4×104J例2.一定质量的理想气体经过一系列过程,如图所示.下列说法中正确的是( )a→过程中,气体体积增大,压强减小,气体吸热A.bb→过程中,气体压强不变,体积增大,气体对外做功B.cC.a c →过程中,气体压强增大,体积变小,气体吸热D.a c →过程中,气体内能增大,体积不变例3.水在1个标准大气压下沸腾时,汽化热为L=2264 J/g ,这时质量m=1g 的水变为水蒸气,其体积由V1=1.043 cm3变为V2=1676 cm3,在该过程中水增加的内能是多少?例4.“和平号”空间站己于2001年3月23日成功地坠落在南太平洋海域,坠落过程可简化从为一个近圆轨道(可近似看作圆轨道)开始.经过与大气摩擦,空间站的大部分经过升温、熔化、最后汽化而销毁,剩下的残片坠入大海.此过程中,空间站原来的机械能中除一部分用于销毁和一部分被残片带走外,还有一部分能量E’通过其他方式散失(不考虑坠落过程中化学反应的能量).(1)试导出下列各物理量的符号表示散失能量E’的公式. (2)算出E’的数值(结果保留两位有效数字). 坠落开始时空间站的质量M=1. 57×105㎏; 轨道离地面的高度为h =146km ; 地球半径为R=6.4×106m ;坠落空间范围内重力加速度可看作g =10m/s 2; 入海残片的质量m =1.2×104㎏; 入海残片的温度升高△T=3000K ; 入海残片的入海速度为声速v =340m/s ;空间站材料每1千克升温1k 平均所需能量C=1.0×103J ; 每销毁1千克材料平均所需能量7100.1⨯=μJ【当堂反馈】1.如题图,某同学将空的薄金属筒开口向下压入水中。
高二物理 热力学第一定律 能量守恒定律

高二物理热力学第一定律能量守恒定律【三维目标】[知识与技能]1、了解热力学第一定律,会用其数学表达式进展简单计算;2、理解热力学第一定律公式中各量的正负号的含义3、理解能量守恒定律,能应用其解释一些现象;4、知道第一类永动机是不可能制成的,它违反了能量守恒定律。
[过程与方法]1.结合实例,引导学生自己归纳出热力学第一定律ΔU =W+Q以与ΔU、W、Q正负号的意义,注重过程的探讨,培养学生应用所学知识分析问题的能力。
2. 能量守恒定律是自然科学的根本定律之一,应用能量守恒的观点来分析物理现象、解决物理问题是很重要的物理思维方法。
[情感、态度与价值观]1.通过了解能量守恒定律确立的过程,体会科学家们探索物理规律的艰辛,培养学生勇于探索、不畏困难的意志品志。
2.通过了解第一类永动机不可能制成,使学生明白“不想付出,却想获得〞是不可能的,要想有所成就,就必须付出加倍的努力。
【重点难点】[重点]热力学第一定律和能量守恒定律,强调能量守恒定律是自然科学中最根本的定律。
学会运用热力学第一定律和能量守恒定律分析、计算一些物理习题。
[难点]1.热力学第一定律中各个物理量正负的取值.2.运用能的转化和守恒定律对具体的自然现象进展分析,并能够说明能量是怎样转化的. 【新课导入】通过前面两节的学习,我们明确了做功和热传递都可以改变物体的内能,它们的最终目的都是使物体的内能发生变化。
反过来讲,如果一个物体的内能发生了变化,我们能否判断出其变化的原因是做功还热传递呢?这又说明了什么?生:不能。
说明二者在改变物体内能方面是等效的。
师:如果做功和热传递同时进展,△U、W、Q之间有什么样的数量关系呢?导语二:打个比方,甲如果给我三块钱,乙不给我钱,那么我身上就增加了三块钱,如果甲不给我钱,乙给我五块钱,那么我身上就增加了五块钱,如果甲乙同时分别给我三块钱和五块钱,那么我身上就增加了八块钱。
对于一个热力学系统来讲,如果外界向它做功的同时也向它传递热量,那么它的内能变化是多少呢?【互动探究】1.热力学第一定律(1)定义:一个热力学系统的内能增量等于外界向它传递的热量与外界对它所做功的和。
人教版高二下物理选修3-3:10.3热力学第一定律 能量守恒定律 (共51张PPT)

解析
28
热力学第一定律的理解和应用
1.关于内能的变化,以下说法正确的是 ( ) A.物体吸收热量,内能一定增大 B.物体对外做功,内能一定减少 C.物体吸收热量,同时对外做功,内能可能不变 D.物体放出热量,同时对外做功,内能可能不变
29
解析
解析 根据热力学第一定律ΔU=W+Q,物体内能的变化与做功及热传递两个因素均有关,物体吸收热 量,内能不一定增大,因为物体可能同时对外做功,故内能有可能不变或减少,A错; 物体对外做功,还有可能吸收热量,内能可能不变或增大,B错,C正确; 物体放出热量,同时对外做功,内能一定减少,D错误.
22
解析
答案 由a状态变化到b状态,气体体积变大,因此气体对外界做功,即W<0. 答案 由p-V图象知从a状态变化到b状态,温度升高,故ΔU>0.由ΔU=W+Q得Q>0,即气体吸热,内 能增加.
23
[知识深化]
对于理想气体,常把热力学第一定律与理想气体状态方程结合起来分析其状态变化规律,常见的分析思 路如下: (1)利用体积的变化分析做功问题.气体体积增大,对外做功;气体体积减小,外界对气体做功. (2)利用温度的变化分析理想气体内能的变化.一定质量的理想气体的内能仅与温度有关,温度升高,内 能增加;温度降低,内能减小. (3)利用热力学第一定律判断是吸热还是放热. 由热力学第一定律ΔU=W+Q,则Q=ΔU-W,若已知气体的做功情况和内能的变化情况,即可判断气 体状态变化是吸热过程还是放热过程.
32
热力学第一定律的理解和应用
3.(多选)用密封性好、充满气体的塑料袋包裹易碎品,如图8所示,充气袋四周被挤压时,假设袋内气体 与外界无热交换,则袋内气体( ) A.体积减小,内能增大 B.体积减小,压强减小 C.对外界做负功,内能增大 D.对外界做正功,压强减小
热力学第一定律知识点

热力学第一定律知识点热力学第一定律是热力学的基础定律之一,也被称为能量守恒定律。
它描述了能量在系统中的转化和守恒关系。
在本文中,我们将介绍热力学第一定律的基本概念、应用以及相关的几个重要知识点。
一、热力学第一定律的基本概念热力学第一定律是指,在一个封闭系统中,能量的变化等于系统对外做功加热量的和。
这个定律可以用以下的数学公式表示:ΔU = Q - W其中,ΔU表示系统内能的变化,Q表示系统吸收的热量,W表示系统对外做的功。
二、热力学第一定律的应用热力学第一定律的应用非常广泛,以下是其中的几个主要方面。
1. 热力学循环热力学循环是指系统在经历一系列过程后,回到初始状态的过程。
这些过程中,系统吸收或释放热量,还可能对外做功。
根据热力学第一定律,热力学循环的总吸热量等于总放热量,总做功等于总吸热量减去总放热量。
2. 热力学过程中的能量转化热力学过程中,能量可以以不同的形式进行转化,包括内能的变化、吸收或释放的热量以及对外做的功。
热力学第一定律描述了能量在不同形式之间的转化以及转化前后的守恒关系。
3. 热力学第一定律的实验验证热力学第一定律是通过实验进行验证的。
实验中可以测量系统的内能变化、吸热量以及对外所做的功,以验证热力学第一定律的成立。
三、热力学第一定律的注意事项1. 引入准则热力学第一定律是基于能量守恒原理的,需要引入准则才能确保能量守恒成立。
例如,在计算吸热量时,需要考虑到化学反应的发生,以充分考虑系统的能量转化。
2. 内能的定义热力学第一定律中的内能指的是系统的总能量,包括系统的热能、机械能以及其他形式的能量。
在实际应用中,需要注意内能的定义和计算方法。
3. 对外所做的功热力学第一定律中的对外所做的功指的是系统对外界做的机械功。
需要注意区分系统对外界做功和外界对系统做功的情况,并进行正确的计算。
结语:热力学第一定律是热力学研究的基础,它描述了能量在系统中的转化和守恒关系。
通过理解和应用热力学第一定律,我们可以更好地理解和解释各种热力学现象,推动科学研究的发展。
高二物理竞赛热力学第一定律课件

与温度 无关
i 3,
CV ,m
3 2
R,
C p,m
5 2
R,
5 1.67
3
对于刚性双原子分子气体
i 5,
CV ,m
5 2
R,
C p,m
7 2
R,
7 1.40
5
对于刚性多原子分子气体
i 6,
CV ,m 3R,
Cp,m 4R,
4 1.33
3
用 γ 的理论值和实验值比较,常温下符合很好,多原子分 子气体则较差,见教材p112 表3.1;
1、热力学第一定律
在质心参考系中, Aext Eint,B Eint, A
设在某一宏观过程中,某系统内能从初始状态 E1 变化到 终了状态 E2,系统从外界吸收热量Q,同时对外做功A。 实验表明,系统从外界吸收的热量等于系统内能的增量和 系统对外界做功之和。这就是热力学第一定律。
Q = E2 – E1 + A
表明:系统从外界吸收的热量一部分使系统内能增加,另 一部分则用来对外做功。它是能量守恒定律在涉及热现象 宏观过程中的具体表述。
热力学第一定律对于理想气体等值过程的应用
一、等体过程
1. 过程特征 气体体积 V = const.,即 dV = 0 气体对外不做功,即 dA = pdV = 0
2. 过程方程:p / T = const. 初态与末态的状态参量关系为 p1 p2 T1 T2 在 p-V 图上,等体过程线为平行于 p 轴的直线段。
(2)
由(1)、(2)式 Qp (CV ,m R)(T2 T1) C p,m (T2 T1)
C p,m CV ,m R 或 C p,m CV ,m R 迈耶公式
热力学第一定律(高中物理教学课件)完整版
2.应用热力学第一定律解题的一般步骤: ①根据符号法则列出各已知量(W、Q、ΔU)的正 负; ②根据方程ΔU=W+Q求出未知量; ③再根据未知量结果的正负来确定吸放热情况、 做功情况或内能变化情况
二.热力学第一定律的应用
3. 气体状态变化的几种特殊情况:
①绝热过程:Q=0,则ΔU=W,不发生热传递,系统内 能的变化只与做功有关(分绝热膨胀和绝热压缩) ②等温过程: ΔU=0,则W=-Q,气体内能不变,外 界对气体做的功与气体吸收的热量等值异号(分等温膨 胀和等温压缩) ③等容过程:W=0,则ΔU=Q,气体不做功,系统内能 的变化只与热传递有关(分升温升压和降温降压) ④等压过程:等压膨胀,温度升高,内能增加,对外做 功,气体吸热;等压压缩,温度降低,内能减少,对内 做功,气体放热
解:根据热力学第一定律:U W Q 2.5105 J 1.2105 J Q
Q 1.3105 J, 气体向外界放热1.3105 J的功
二.热力学第一定律的应用
1.判断气体是否做功的方法: 一般情况下看气体的体积是否变化. ①若气体体积增大,表明气体对外界做功,W<0 ②若气体体积减小,表明外界对气体做功,W>0
例13. (多选)如图是某喷水壶。未喷水时阀门闭合,压 下压杆可向瓶内储气室充气;多次充气后按下按柄打开
阀门,水会自动经导管从喷嘴处喷出。储气室内气体可
热力学第一定律-高二物理课件(人教版2019选择性必修第三册)

能变化的可能原因的说法,其中不可能的是( D )
A.从A到B的绝热过程中,外界对气体做功160J B.从A到B的单纯传热过程中,外界对气体传递了160J的热量 C.从A到B的过程中吸热280J,并对外界做功120J D.从A到B的过程中放热280J,外界对气体做功120J
高中物理选择性必修第三册 第三章:热力学定律 第2节: 热力学第一定律
5.如图所示,导热良好的圆筒形气缸竖直放置在水平地面上,用活塞将一定质量的气 体封闭在气缸内,活塞上堆放着铁砂,系统处于静止状态。现缓慢取走铁砂,忽略活
塞与气缸之间的摩擦,外界环境温度不变,则在此过程中缸内气体( D )
A.对外做功,其内能减少 B.温度不变,与外界无热量交换 C.分子平均动能变大 D.气体压强变小,单位时一定律物理意义:不仅反映了做功与传热在改变系统内能方面是等效 的,而且给出了功、热量跟系统内能改变之间的定量关系。
二、热力学第一定律的应用
定律 ΔU=Q+ W 中各量的正、负号及含义
物理量
符号
W
+
Q
+
ΔU
+
意义 外界对物体做功
物体吸收热量 内能增加
符号
意义
-
物体对外界做功
-
物体放出热量
高中物理选择性必修第三册 第三章:热力学定律 第2节: 热力学第一定律
6.带有活塞的汽缸内封闭一定量的理想气体。气体开始处于状态a;然后经过过程ab
到达状态b或经过过程ac到达状态c,b、c状态温度相同,如图所示。设气体在状态b和
状态b的压强分别为pb和pc,在过程ab和ac中吸收的热量分别为Qab和Qac,则 B
高二物理热力学第一定律

3.如果物体在跟外界同时发 生做功和热传递的过程中, 内能的变化ΔU与热量Q及 做的功W之间又有什么关系 呢?
1.一个物体,如果它既没有 吸收热量也没有放出热量, 那么,外界对它做多少功, 它的内能就增加多少;物 体对外界做多少功,它的 内能就减少多少.
返回
2.如果外界既没有对物体做 功,物体也没有对外界做 功,那么物体吸收了多少 热量,它的内能就增加多 少,物体放出了多少热量, 它的内能就减少多少.
热力学第一定律
分子 动能
•分子因热运动而具有的能量 •同温度下各个分子的分子动能EK 不同
•分子动能的平均值仅和温度有关
分子 势能
•分子间因有相互作用力而具有的、由它 们相对位置决定的能量 • r<r0时,r↓→EP↑;r>r0时,r↑→EP↑; r=r0时,EP 最低 •EP 随物态的变化而变化
外界对物 - 体做功 物体吸收 - 热量 内能增加 -
三、应用
例题:一定量的气体从外界吸收了 2.6×105J的热量,内能增加了4.2 ×105J。
问:①是气体对外界做了功,还是外界对气体 做了功?做了多少焦耳的功? ②如果气体吸收的热量仍为2.6×105J不变, 但是内能只增加了1.6×105J,这一过程做功情 况怎样?
热力学第 一定律 各量的正 负号含义
应用
能量守 恒定律
用动机不 可能制成
总结
一、热力学第一定律
1.一个物体,它既没有吸收热量也没有 放出热量,那么: ①如果外界做的功为W,则它的内能 如何变化?变化了多少? ②如果物体对外界做的功为W,则它 的内能如何变化?变化了多少?
2.一个物体,如果外界既没有对物体 做功,物体也没有对外界做功,那么: ①如果物体吸收热量Q,它的内能如 何变化?变化了多少? ②如果放出热量Q,它的内能如何变 化?变化了多少?
高二物理热力学第一定律

D、大气压力对水不做功,水的内能增加
习题精选
1、一定质量的理想气体,如果体积膨胀,同时吸收热量, 下列关于该气体内能变化的说法中正确的是( A、C )
A、如果气体对外做的功大于吸收的热量,气体内能将减少 B、如果气体对外做的功小于吸收的热量,气体内能将减少 C、如果气体对外做的功等于吸收的热量,气体内能将不变 D、如果气体对外做的功等于吸收的热量,气体内能可能改变
典型例题
如图所示容器,A、B 中各有一个可以自由移动的活塞, 活塞下面是水,上面为大气,大气压恒定。 A、B 间用带有 阀门的管道相连,整个装置与外界隔热.A 容器的横截面积 大于 B 容器的横截面积,开始时 A 的液面高于 B 的液面, 开启阀门后,A 中的水逐渐流向 B,直至两边液面相平.在 D ) 这个过程中( A、大气压力对水做功,水的内能增加 B、水克服大气压力做功,水的内能减小 C、大气压力对水不做功,水的内能不变
解:重锤打击一次的动能:EK=Mv2/2= 200 ( J )
重锤连续打击20次的动能 K总=4000 ( J ) 转化成内能ΔU=ηE总=2400(J) 由Q = C m Δt 吸收的热量Q= η ΔU=1200(J) 得Δt = 4 ℃
布置作业:
1、认真阅读课本选修3-3第65-68页,理解所学内容。 2、做题,课本选修3-3第69页问题与练习。
三、永动机不可能制成
1、 第一类永动机
概念:不消耗能量的机器。
结果:无一例外地归于失败。
原因:违背了能量守恒定律。
2、永动机给我们的启示
人类利用和改造自然时,必须遵循自然规律。
下面让我们来看看几种永动机模型 。见识一下人 们对永动机的研究情况:
著名科学家达·芬奇早在15世纪就提出过永动机不可能 的思想,他曾设计过一种转轮,如图1所示,
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• 4.永动机不可能制成
• 指导学生阅读课本P81第七自然段,讨论: 第一类永动机是否真的能永远运动下去? • 分析课本图11-11提供的一种永动机的设 计方案,指出它不可能持续运动的原因: 虽然右边每个球的力矩大,但球的个数少, 左边的每个球产生的力矩虽然小,但是球 的个数多,于是轮子不会持续转动下去对 外做功,只会摆动几下便停在图中物体做什么样的运动具有机械能?机 械能转化和守恒定律的内容是什么?
二、新课教学 • 1.热力学第一定律
• • 分析下列特殊情况: ①如果物体只与外有热交换,没有做功,外界 传给物体4J热量物体的内能增加了多少?物体 若向外界传出了4J热量,物体内能如何变化? 结论:在没有做功情况下,物体与外界间传递 热量Q,物体内能变化为 △U,则△U=Q, 为了在此表达式中能反映物体对外界是吸热不 是放热,作出规定:吸热Q取正值,放热Q取负 值,由此可知:物体吸热,内能增加,放热, 内能减少。
• 综上所述: • 在能的转化转移过程中,一个物体,如果 没有吸收热量也没有放出热量,那么外界 对它做多少功它的内能就增加多少;如果 它既没有对外做功,外界也没有对其做功, 则它从外界吸收多少热量,它的内能就增 加多少。 • 用△U表示物体内能的增量,用Q表示吸收 的热量,用W表示外界对物体所做的功,那 么: • △U=Q+W • 上式就是热力学第一定律。
• 机械能可以与内能相互转化(摩擦生热, 消耗了机械能通过做功的形式转化为内能; 热机中的气体推动活塞做功把气体内能转 化为机械能) • 其它形式有能也可以转化为内能,如电流 通过导体时,把电能转化为内能;炽热的 灯丝发光,又把内能转化成光能;燃烧时, 把化学能转化成内能)
• 3.能量守恒定律
• 内容: • 能量既不会凭空产生,也不会凭空消失, 它只能众一种形式转化为另一种形式,或 者从一个物体转移到别的物体,在转化和 转移的过程中其总量不变。
zth40awb
再问:“如你说,便该怎的?”刘晨寂便讲了几样药味,又道:“这倒是险了些,论平常,我也不敢用,但需等到病者痰粘至不能喘息,扶起来, 把这灌下去,倒能好了。”又道:“需早些煎下,一直热着等,上气不接下气时立刻灌下,若早些灌,怕伤了身体,若迟些灌,怕病人就不能吞 咽了。”于大夫走后,因刘晨寂太年轻,进内帏不便,另换个老大夫给表 诊脉,为着道上尊重同僚的本份,方子未动过。刘晨寂虽讲得理路清晰, 别人也未敢就叫他进内院,但今早起,表 病情又凶险,痰越积越重,又只苦咳不出,喘气越来越艰难,丫头们便谈论起刘晨寂前日的说话来。宝 音听得此话,人命关天,倒是要紧,便问:“如今是吃什么方子?”“还是老方,听说不见效。”“刘大夫呢?”“芋大娘吃坏了肚子,他来诊 脉,正好在。”芋大娘是厨中的厨娘,几样小菜、卤味,极是拿得出手,却是馋了点——或者正因为馋了点,厨艺才精进?——怪道宝音刚才在 厨房未见她呢,却原来节下不检点,替人添麻烦。宝音皱皱眉,道:“我去看看芋大娘。”“宝音你在这里!”苍老的声音,邱妈妈气喘吁吁的 赶来。宝音敬她年来,忙迎上前扶住了,又给她行礼,她且顾不得这个,一把扯住宝音,哭诉姑娘不好了,听说有个刘大夫说过一帖奇方,求宝 音帮帮忙,先让人煎上。“有方子,自然能煎,”宝音斥旁边小丫头飘儿道,“府里头药房是作什么的,叫邱妈妈这把年纪跑到这里来找人?” 第六章 前生后世两茫茫(2)飘儿委委屈屈解释:表 现在大夫又不是刘大夫。于大夫去后换了位老大夫嘛不是?刘大夫说的方子,老大夫也看了, 批说太凶险,病灶除去,怕病人也跟着一命呜呼了。药房听说此语,就不敢煎。这也没错啊!邱妈妈耳背,听飘儿的话听了半天,不是帮自己的, 把她气得一推,自己跟宝音啰哩啰嗦的讲,姑娘这病真是凶了,凶得可怕了,老大夫看来不中用,实在不行就试试刘大夫的,左不过不中用。刘 大夫没见病人的面都能说出这些来,照她想是比其他大夫还可信的。宝音当机立断道:“药先煎上,若表 真有刘大夫所说的症状,老大夫有应对 之法还是先用老大夫的,”握握邱妈妈的手,“终是年老沉稳靠得住些。但要是他没法子急救,便照刘大夫的药进上!但愿不必有那么凶险时候 罢!”又道,“你们先去药房传话,我去找刘大夫要那药方。”邱妈妈怀中掏出油纸包藏的一张纸:“我有!上次听她们讲,我央会字的人给我 写下来了!”她对自小乳大的 ,真是忠心耿耿。飘儿与邱妈妈便先往药房去了。宝音晓得大太太、二太太都不太待见表 ,更不愿在表 的病情上 担肩膊,去回了也无用,老太太年纪大了,精神易疲乏,这上下在养神呢,不便打扰,因此一力承担下来,料药
高中物理新人教版 选修1-2系列课件
第二章《能量的守恒与耗散》
第二节 《热力学第一定律》
教学目标
• 知识与能力: • 1.认识物质的运动形式有多种,对应不同运动形 式的运动有不同形式的能,各种形式的能在一定 条件下可以相互转化 • 2. 进一步掌握能的转化和守恒定律,并了解能的 转化和守恒定律的意义 • 3.运用公式△U=W+Q分析有关问题并具体进 行计算 • 教学重点:热力第一定律 • 教学难点:能量守恒 • 教 具:多媒体课件
•
• ②如果物体和外界不发生热交换,当外界对物体做 了10J功,物体内能增加了多少?当物体对外做了 10J功,物体内能又如何变化? • 结论:在无热交换情况下,△U=W(对外做功时, W取负值)
• ③如果物体内能在改变的过程中,既有热传递又有 做功,例如外界对物体做了10J的功,同时物体吸收 4J热量,物体的内能如何变化? • ④又如,外界对物体做10J功,物体放热4J物体内能 又如何变化?又物体对外界做了10J功,物体吸热4J, 物体放热4J物体内能又如何变化?
• [例]一定量的气体从外界吸收了 2.6×105J的热量,内能增加了4.2×105J, 外界对物体做了多少功?
• 解:根据热力学第一定律得, • W=△U-Q=4.2×105J-2.6×105J= 1.6×105J
• 2.能的转化
• 课件展示,举例说明物体的每一种运动形式都有一 种对应的能 • 机械运动――机械能 热运动――内能 • 电荷运动――电能 化学运动――化学能 • 生物运动――生物能 原子核内部的运动 ――原子能 • 各种形式的能可以相互转化: • 机械能中的动能和势能可互相转化(自由落体运动)
• 通过课件展示历史上几种永动机的设计图, 指出:不消耗能量的机器从来没有制成功 过。 • 能量不能创生,工程技术的任务在于设法 找出合理利用能源途径和减少能量损耗, 而不是去研制永动机。
• 三、布置作业 P83 2、3
; / 布袋除尘器 泊头市净化除尘设备厂
