化学试卷双项细目表
高中化学双向细目表

59
了解常见盐类的性质和用途。
■
60
了解常见化肥的基本性质。
■
61
了解硫、氮、碳的氧化物对大气的污染及其防止。
■
62
初步了解氟氯烃、含磷洗涤剂及二氧化硅粉尘对环境及人类健康的影响。
■
63
初步了解一些生活用水的净化及污水处理的基本原理。
■
有
机
化
学
基
础
64
理解基团、官能团的概念;识别结构式(结构简式)中的基团和官能团
■
75
了解有机物的主要来源,了解石油化工、煤化工、农副产品化工、资源综合利用及污染和环保的概念
■
76
了解在生活、生产中常见有机物的性质和用途
■
化
学
实
验
77
常见化学仪器的主要用途、使用方法,包括玻璃仪器的洗涤
■
78
能绘制和识别典型的实验仪器装置图
■
79
常见试剂的化学性质及其保存方法
■
80
化学实验的基本操作(药品取用,天平使用,仪器连接,气密性检查,物质的加热、过滤、蒸发,试纸的使用,容量瓶使用,萃取、分液、蒸馏等)
■
42
理解电解原理。了解铜的电解精练、镀铜、氯碱工业反应原理。
■
元
素
及
其
化
合
物
常
见
金
属
元
素
的
性
质
43
了解金属钠的物理性质,掌握钠和镁化学性质。
■
44
从原子的核外电子排布,理解ⅠA、ⅡA族元素(单质、化合物)的相似性和递变性。
■
45
以氢氧化钠为例,了解重要的碱的性质和用途。了解钠的重要化合物。
初中化学学业水平双向细目表
3/3 √
9 10/16(2) 23
3
√
3/2/4 √
1/14
3/3 √
质量守恒定律
16(3)/18(3) 2/2/6 24
化学与能源和资源的利 19/20(1)
用
常见的化学合成材料
5
化学物质与健康
4/2
3
√
保护好我们的环境
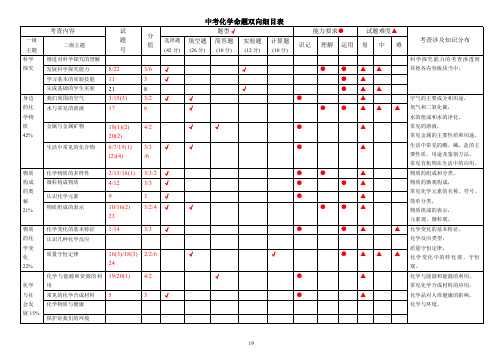
中考化学命题双向细目表
题型√ 填空题 简答题 实验题 计算题
(26 分) (10 分) (12 分) (10 分)
19
一级 主题 科学 探究
身边 的化 学物 质 42%
物质 构成 的奥 秘 21%
物质 的化 学变 化 22%
化学 与社 会发 展 15%
考查内容
二级主题
增进对科学探究的理解 发展科学探究能力 学习基本的实验技能 完成基础的学生实验 我们周围的空气 水与常见的溶液
试 题 号
8/22 11 21 3/15(3) 17
分
选择题
值
(42 分)
3/6 √
3
√
8
3/2 √
6
金属与金属矿物 生活中常见的化合物
18(1)(2) 4/2 20(2)
6/7/15(1) 3/3 √
(2)(4)
/6
化学物质的多样性 微粒构成物质 认识化学元素 物质组成的表示
化学变化的基本特征 认识几种化学反应
2/13/16(1) 3/3/2 √
4/12
√
√ √ √
√
√
√
√
√
√
√
能力要求● 识记 理解 运用
●● ● ●
● ●●
●
●
●
化学双向细目表

阿伏伽德罗常数考察
改编
9
0.60
事实推断
改编
10
0.68
推断综合题
选编
11
0.63
离子方程式的正误判断
改编
12
0.59
除杂
原创
13
0.64
元素推断和相关性质的考察
改编
14
0.67
离子推断
选编
15
0.57
元素周期律、计算、氧化还原反应
选编、改编
16
0.63
实验大题涉及溶液配置等相关内容
选编、改编
17
0.64
化工大题
改编
18
0.65
实验和计算
改编
19
0.62
绵阳南山中学高2023级期末热身考试化学试题双向细目表
考查主要内容
试题来源
题号
预估难度系数
化学与生活
改编
10Biblioteka 78物质的分类改编
2
0.72
化学键
选编
3
0.73
化学用语表示方法
改编
4
0.74
实验题
改编
5
0.68
钠、氯、铁、胶体的基础知识
原创
6
0.71
离子共存
选编
7
0.72
阿伏伽德罗定律和推论应用
选编
8
高中化学试卷双向细目表

高中化学试卷双向细目表题目1:选择题1.下列电子构型不正确的是()A. Ar:1s²2s²2p⁶3s²3p³B. Ca:1s²2s²2p⁶3s²3p⁶4s²C. Br:1s²2s²2p⁶3s²3p⁶4s²3d¹⁰4p⁵D. O:1s²2s²2p¹⁶2.下列物质中属于离子键的是()A. O₂B. SO₂C. PCl₃D. KF3.Am威森逊差错理论认为晶体的缺陷是指()A. 固体中存在的缺陷B. 晶体中存在的缺陷C. 气体中存在的缺陷D. 溶液中存在的缺陷参考内容:1. A. Ar原子的电子构型为1s2 2s2 2p6 3s2 3p6,所以其离子有8个价电子。
Ca原子的电子构型为1s2 2s2 2p6 3s2 3p6 4s2,所以其离子有2个价电子。
Br原子的电子构型为1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5,所以其离子有7个价电子。
O原子的电子构型为1s2 2s2 2p4,所以其离子有6个价电子。
因此,选项A的电子构型不正确。
2. D. 离子键的形成是由于非金属原子减少电子,形成阴离子,金属原子增加电子,形成阳离子,由电子互相吸引形成的。
因此,选项D的KF是离子键化合物。
3. B. Am威森逊差错理论是由Am威森逊和W.L.布列格共同提出的。
该理论认为,晶体的缺陷是指晶体中存在的缺陷,如点缺陷、面缺陷、体缺陷等。
因此,选项B的晶体中存在的缺陷是正确的。
题目2:填空题1.化学计量中,将能使反应发生的最少的反应物称为________。
2.酸碱滴定中,pH=7是________指示剂的转换区间。
3.化合物HCOOH是一种________酸。
参考内容:1. 限制反应物。
2. 中性。
3. 有机酸。
最新高考化学双向细目表

最新高考化学双向细目表分类序知识点内容近三年高考再现号化学基本概念物质的组成、性质和分类1物质的分子、原子、离子、元素等概念的含义;17 18 193物理变化与化学变化的区别与联系。
28盐类反应中的基础涉及84混合物纯净物、单质和化合物、金属和非金属的概念5 同素异形体的概念。
6酸、碱、盐、氧化物的概念及其相互联系。
化学用语7熟记并正确书写常见元素的名称、符号、离子符号。
熟悉常见元素的化合价。
能根据化合价正确书写化学式(分子式),并能根据化学式判断化合价。
8,综合化合价,共价键主要考C族元素27,综合元素周期律68熟悉常见元素的化合价。
能根据化合价正确书写化学式(分子式),并能根据化学式判断化合价。
掌握电子式、原子结构示意图、分子式、结构式和结构简式的表示方法。
能正确书写化学方程式、离子方程式、电离方程式、电极反应式。
化学中常用计量12了解相对原子质量、相对分子质量的含义。
11,综合原子结构中等6,氧化还原涉及简单13物质的量的单位--摩尔(mol),摩尔质量、气体摩尔体积(相应单位为g·mol-1、L·mol-1)。
14 物质的量浓度(mol·L-1)、阿伏加德罗常数。
15 掌握物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系。
化学反应与能量16掌握化学反应的四种基本类型:化合、分解、置换、复分解。
12氧化还原、物质的量、化学计算中等26题一问6,综合部份物质的量计算,主要得失电子守恒、部份氧化还原,中上13题氧化与离子综合10,得失电子守恒,方程式配平17理解氧化还应反应,了解氧化剂和还原剂等概念。
掌握重要氧化剂、还原剂之间的常见反应。
18能判断氧化还原反应中电子转移的方向和数目,并能配平反应方程式。
19了解化学反应中的能量变化,吸热反应、放热反应、反应热、燃烧热和中和热及新能源的开发等概念。
26,热方程,反应热7分11热化学书写反应热,中等7热化学书写反应热,中等溶液20 了解溶液的含义8涉及21了解溶液的组成,理解溶液中溶质的质量分数的概念。
化学选考题双向细目表
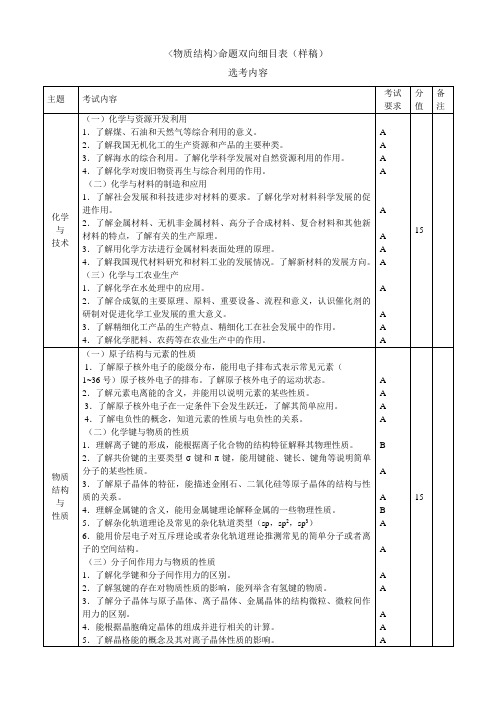
3.了解蛋白质的组成、结构和性质。
4.了解化学科学在生命科学发展中所起的重要作用。
(四)合成高分子化合物
1.了解合成高分子的组成与结构特点,能依据简单合成高分子的结构分析其链节和单体。
2.了解加聚反应和缩聚反应的特点。
3.了解新型高分子材料的性能及其在高新技术领域中的应用。
(三)化学与工农业生产
1.了解化学在水处理中的应用。
2.了解合成氨的主要原理、原料、重要设备、流程和意义,认识催化剂的研制对促进化学工业发展的重大意义。
3.了解精细化工产品的生产特点、精细化工在社会发展中的作用。
4.了解化学肥料、农药等在农业生产中的作用。
A
A
A
A
A
A
A
A
A
A
A
A
15
物质结构与
性质
(一)原子结构与元素的性质
4.了解合成高分子化合物在发展经济、提高生活质量方面的贡献。
A
A
A
A
A
A
B
A
A
A
A
A
A
A
A
A
A
A
A
A
15
6.能用价层电子对互斥理论或者杂化轨道理论推测常见的简单分子或者离子的空间结构。
(三)分子间作用力与物质的性质
1.了解化学键和分子间作用力的区别。
2.了解氢键的存在对物质性质的影响,能列举含有氢键的物质。
3.了解分子晶体与原子晶体、离子晶体、金属晶体的结构微粒、微粒间作用力的区别。
4.能根据晶胞确定晶体的组成并进行相关的计算。
(二)化学与材料的制造和应用
双向细目表填写范例

双向细目表(针对大型考试及“交叉命题”使用)
科目:化学
年级:高一
考试时间:90分钟
题
序
知识内容
(考查、考试)
试题形式
难易度
识
记
理
解
应
用
分
析
综
合
评
述
1
化学实验正确的操作方法
选择题
易
√
2
物质(离子)的检验方法
选择题
易
√
3
混合物的分离和提纯
选择题
易
√
√
4
物质的量及单位的含义
中
√
25
表现手法分析
主观
1
中
√
初中命题分值比例:6:3:1高中命题分值比例:5:3:2
预测目标:平均分:75优秀率:20%合格率:88%
备长签名
科组长意见
双向细目表11年09月14日
科目:语文
年级:高一
考试时间:11.10.08
题序
知识内容(考查、考试)
试题
形式
题数
难易度
识记
理解
分析综合
鉴赏评价
表达应用
探究
1
字音
客观
1
中
√
2
字音
客观
1
中
√
3
字音
客观
1
中
√
4
成语
客观
1
易
√
5
成语
客观
1
易
√
6
成语
客观
1
易
√
7
病句
化学期末测试双向细目表

初三化学上学期期末试题双向细目表
初三化学考试说明
一考试性质
本次属于阶段考试,即检查了学生基础知识的掌握情况,也为后期学习打下牢固的基础。
二命题原则
命题本着“基础性,科学性,创新性”的原则,注重在具体情境中考查学生对基本概念和原理的理解,注重联系生活实际三命题依据
命题以《课程标准》中的“内容标准”规定的科学内容为范围
四考试内容:九年级化学上册第一章、第二章及第三章第一节
五考试形式及试卷结构
闭卷,笔试。
100分
试题类型:选择,填空,实验,计算题
试卷易,中,难试题的比例在6:3:1
参考答案:
一、选择:C、A、D、A、D、D、D、A、D、D、B、D、C、C
二、填空:
1、A、分子不断运动
B、分子间有间隔
2、(1)残留液会腐蚀标签
(2)高温生成物会炸裂集气瓶
(3)腐蚀胶头
3、16、15
4、(1)2、(2)3、(3)
5、(4)1、2、4(5)3、4(6)3、5
5、D;BC;A;BCD
三、实验探究题
1、集气瓶量筒铁架台 A;CD;
2、(1)冒出大量白烟;
(2)磷 + 氧气−
−点燃五氧化二磷
−→
(3)五分之一;氮气;答案略;
(4)答案略
3、耀眼的白光热量白固镁 + 氧气−
−点燃氧化镁
−→
4、20;凹液面最低处;<
5、(1)4 (2)BD (3)D (4)答案略
四、计算题
解:氧的相对原子质量=12b/a。
初中化学命题双向细目表(空白).doc

2.2 2.2 2.3 2.3 2.3 2.3
知 识点内容
化学的概念及研究的范畴 化学发展简史及绿色化学的特点 物质的变化 物质的性质 实验观察、记录方法 对蜡烛及其燃烧的探究 科学探究特点及对人呼吸气体的探究 常用仪器名称、用途、操作原理 化学药品的使用要求及安全注意事项 化学实验基本操作 空气中氧气含量的测定及空气的组成 混合物和纯净物 N2、O2、稀有气体的性质和用途 空气的污染源及保护空气 C、S、P、Fe、Mg 与 O2 反应的现象、 方程式、实验注意事项 氧气的性质及用途 化合反应和氧化反应 氧气的实验室制法 根据气体的性质选择收集方法 催化剂、催化作用、分解反应 氧气的工业制法
知识层次 了解 理解 运用
选择
题型、题号
赋 分 难度分值 合
填空 实验探究 计算
易中难 计
第1页共5页
内序 章 容号 节
知 识点内容
知识层次 了解 理解 运用 选择
022 3.1 分子、原子的概念及基本性质
023 3.1 分子、原子理论的运用
024 3.2 原子的结构
第 三 单
025 026
3.2 3.2
075 8.3 金属资源的保护
076 8.3 含杂质的计算
077 9.1 溶液的组成及特征
078
9.1
乳化作用及溶液、悬浊液、 乳浊液的用途
079 9.1 溶解过程的吸热和放热
第 九 单
080 081
9.2 9.2
饱和与不饱和溶液及其相互转化 溶解度
元 082
9.2
溶液的“浓、稀”和 “饱和、不饱和”的关系
单 061 7.2 化石燃料
元 062 7.2 化学反应的能量变化
化学试题双向细目表
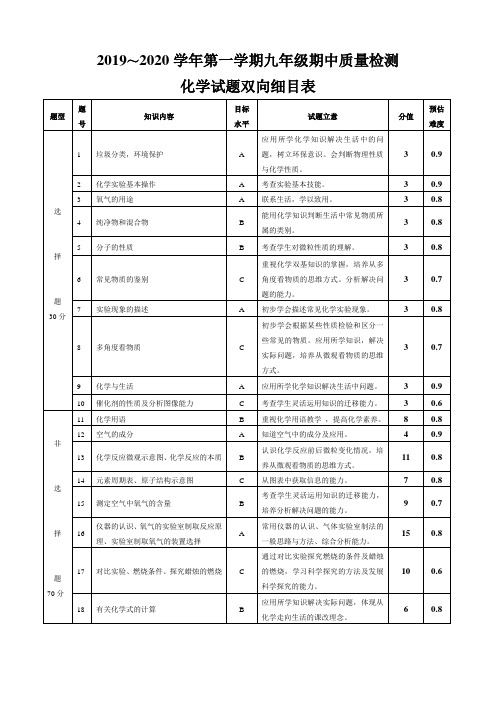
题号
知识内容
目标水平
试题立意
分值
预估难度
选
择
题
30分
1
垃圾分类,环境保护
A
应用所学化学知识解决生活中的问题,树立环保意识。会判断物理性质与化学性质。
3
0.9
2
化学实验基本操作
A
考查实验基本技能。
3
0.9
3
氧气的用途
A
联系生活,学以致用。
3
0.8
4
纯净物和混合物
B
能用化学知识判断生活中常见物质所属的类别。
11
0.8
14
元素周期表、原子结构示意图
C
从图表中获取信息的能力。
7
0.8
15
测定空气中氧气的含量
B
考查学生灵活运用知识的迁移能力,培养分析解决问题的能力。
9
0.7
16
仪器的认识、氧气的实验室制取反应原理、实验室制取氧气的装置选择
A
常用仪器的认识、气体实验室制法的一般思路与方法、综合分析能力。
15
0.8
3
0.7
9
化学与生活
A
应用所学化学知识解决生活中问题。
3
0.9
10
催化剂的性质及分析图像能力
C
考查学生灵活运用知识的迁移能力。
3
0.6
非
选
择
题
70分
11
化学用语
B
重视化学用语教学,提高化学素养。
8
0.8
12
空气的成分
A
知道空气中的成分及应用。
4
0.9
13
化学反应微观示意图、化学反应的本质
高中化学双向细目表

序号
内容
知道
了解
理
解
应
用
第一
章
物质结构儿糸周期
律
第一节
元素周期表
1、元素周期表的结构以及
周期、族等概念
V
2、原子结构与元素在周期
表中位置间的关系
V
3、通过对碱金属、卤族元素性质的探究,理解元素性质与原子结构以及元素在周期表中的位置的相互关系,掌握碱金属和卤族元糸的相似性和递变性
1、乙醇的物理性质,乙酸和乙酸乙脂的物理性质
2、乙醇的生理作用和工业制法
3、理解乙醇的结构,通过分析乙醇的结构式掌握乙醇在发生化学反应时的断键位置,从而推断乙醇所具有的化学性质
V
4、乙酸的物理性质以及它
与人们生活的关系
5、通过分析乙醇和乙酸的结构式,掌握它们发生脂化反应的原理以及实验的操作方法,分析实验现象,会熟练地书写该化学方程式
V
第二节
化学能与电能
1、火力发电中的能量转化
V
2、原电池的原理
V
3、氧化还原反应是使化学
能转换为电能的关键
V
4、通过对原电池装置的分析,掌握原电池正、负极判断方法
V
5、通过原电池装置来判断
金属的活动性顺序
V
6、几种发展中的化学电源
V
7、学会自己设计原电池
V
第三节
化学反应的速率和限度
1、化学反应速率的涵义及
V
4、掌握蛋白质的基本性质,认识蛋白质是生命现象最基本的物质基础
V
第四
章
化学与可持续发展
第一节
开发利用金属矿物和海水
资源
1、了解金属冶炼的一般原理,理解金属冶炼方法的选择同金属活动性的关系,了解常见金属的冶炼方法
高考化学双向细目表

9题涉及
12题综合周期律、表
31
以第3周期为例,掌握同一周期内元素性质(如:原子半径、化合价、单质及化合物性质)的递变规律与原子结构的关系;以I A 和ⅦA 族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
8,选择,6分,,简单27,综合元素化合物15分
28元素周期律和元素化合物知识共15分难度中等及中上
29题综合卤代烃、酯类、烯烃类,醛类主要官能团反应
12酚、酯考查,官能团计算30题共15分有机推断
13有机综合迁移能力,烯烃复分解30题综合推断,增加了未知知识点推导未知知识点的给规律题型
71
了解石油化工、农副产品化工、资源综合利用及污染和环保的概念。
72
了解在生活和生产中常见有机物的性质和用途。
73
9,选择,6分,
13离子反应量变关系
41
理解盐类水解的原理。了解盐溶液的酸碱性。
10综合电离水解
中上难度
8涉及
42
理解原电池原理。初步了解化学电源。了解化学腐蚀与电化学腐蚀及一般防腐蚀方法。
10主要电解综合原电池
43
理解电解原理。了解铜的电解精练、镀铜、氯碱工业等反应原理。
10,选择,6分,
元
素
及
其
化
合
物
常
见
金
属
元
素
的
性
质
44
了解金属钠的物理性质,掌握钠和镁化学性质。
45
从原子的核外电子排布,理解ⅠA 、ⅡA族元素(单质、化合物)的相似性和递变性。
46
以氢氧化钠为例,了解重要的碱的性质和用途。了解钠的重要化合物。
47
了解金属的通性,金属冶炼的一般原理。初步了解金属的回收和资源保护。
化学双向细目表
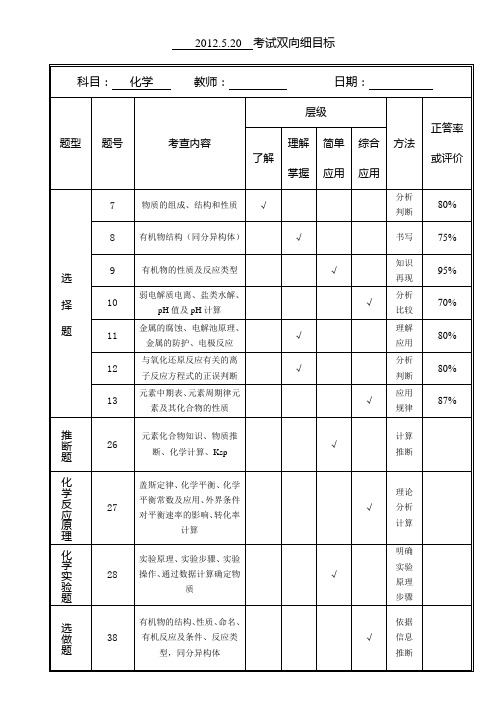
28
实验原理、实验步骤、实验操作、通过数据计算确定物质
√
明确实验原理步骤
选做题
38
有机物的结构、性质、命名、有机反应及条件、反应类型,同分异构体
√
依据信息推断
2012.5.20考试双向细目标
科目:化学教师:日期:
题型
题号
考查内容
层级
方法
正答率或评价
了解
理解
掌握
简单应用
综合
应用
选 择 题
7
物质的组成、结构和性质
√
分析判断
80%
8
有机物结构(同分异构体)
√
书写
75%
9
有机物的性质及反应类型
√
知识再现
95%
10
弱电解质电离、盐类水解、pH值及pH计算பைடு நூலகம்
√
分析
比较
70%
11
金属的腐蚀、电解池原理、金属的防护、电极反应
√
理解
应用
80%
12
与氧化还原反应有关的离子反应方程式的正误判断
√
分析
判断
80%
13
元素中期表、元素周期律元素及其化合物的性质
√
应用
规律
87%
推断题
26
元素化合物知识、物质推断、化学计算、Ksp
√
计算推断
化学反应原理
27
盖斯定律、化学平衡、化学平衡常数及应用、外界条件对平衡速率的影响、转化率计算
√
理论分析计算
近六年高考化学试题双向细目表
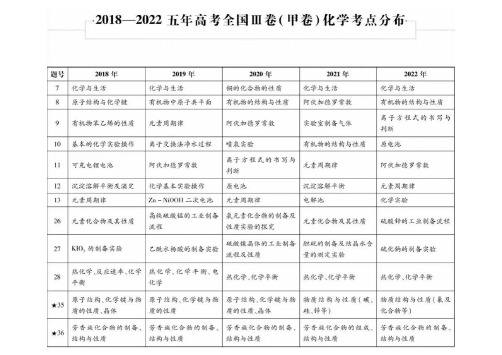
年普通高等学校招生全国统一考试理科综合能力测试化学部分全国甲卷细目表2023()题号7分值题型考查知识点666666选择题选择题选择题选择题选择题选择题化学与生活(食品防腐剂苯甲酸钠、丁达尔效应、S O2漂白原理、抗氧化剂维生素C)有机物的结构与性质(酯基的水解、原子共面、官能团的识别、与溴水反应)89化学实验基础(配制一定浓度的溶液需要使用的仪器)10 11 12阿伏加德罗常数(共价键数目、电子数目、溶液中离子数目、V m的适用范围)元素位构型推断(四种元素N、O、Mg、S、原子半径、简单氢化物沸点、化合物类型、最高价含氧酸的酸性)电解原理的应用——电化学还原C O2制多碳产物(电极反应的判断、电极反应式、离子移动方向、电化学的计算)沉淀溶解平衡p M-p H图像(难溶物K sp的计算、溶解度的计算、金属离子分步沉淀的原因、特定条件下金属离子沉淀的最大浓度的计算)13 26 27 28 35 366选择题以BaS O为原料制备粉状BaTiO(试剂的用途及试剂的选择与原因、化学方程式与离子方程式的书写、产物中物431414151515化学工艺流程题化学综合实验题化学反应原理综合题物质结构与性质有机化学基础质的物质的量比值的计算)无机物钴配合物[C o(N H)]C l的制备(仪器的选择、实验操作、实验操作的目的、不溶物成分的确定、试剂的作363用)甲烷选择性氧化制备甲醇(盖斯定律的应用、平衡常数的计算、曲线的分析、转化率的计算、反应进程-能量图的分析)酞菁、钴钛菁、三氯化铝、碳纳米管的相关考查(同素异形体、晶体类型、分子间作用力、化合价的判断、化学键类型、杂化轨道、配位数、晶体密度的计算)阿佐塞米(化合物L)的合成路线(有机物名称、有机化学方程式书写、条件的选择、含氧官能团的名称、反应类型的判断、结构简式的书写、同分异构体数目的判断及结构简式的书写)年普通高等学校招生全国统一考试理科综合能力测试化学部分全国乙卷细目表2023()题号7分值题型考查知识点6666666选择题选择题选择题选择题选择题选择题选择题生活中的氧化还原反应(明矾净水、撒盐融雪、暖贴原理、荧光指示牌发光原理)有机物的合成与性质(酯的合成方法、反应类型的判断、原子共面、有机物名称)实验装置的判断(制备C O、分离乙醇和乙酸、SO酸性验证、气体体积的测定)892210 11 12 13元素位构型推断(三种元素C、O、Mg、化合价、原子半径比较、化合物的性质、同素异形体)符号表征:用化学方程式解释化学变化(铁盐的性质、硫化钠的性质、溴水褪色的原因、胆矾的变化)二次电池钠-硫电池(离子移动方向判断、电子流动方向判断、正极反应式、特殊材料的作用)沉淀溶解平衡图像分析(图像的分析、特殊点的分析、反应的平衡常数的计算、离子沉淀的先后顺序)李比希元素分析法对有机化合物C H O进行C、H元素分析(实验操作的先后顺序、试剂的选择与作用、实验操4642614化学综合实验题化学工艺流程题作的补充、分子式的确定)以菱锰矿M n C O为原料制备L i M n O(化学方程式的书写、试剂的选择及原因、涉及K的计算、沉淀成分的确324sp27 28 35141515定、离子方程式的书写)化学反应原理综合题FeSO·7H O的脱水反应及分解反应(热重曲线的分析、盖斯定律的应用、分压及K的计算、K的影响)42p p橄榄石矿物Mg Fe SiO中元素的相关考查(价电子排布式、电负性比较、物质熔点的原因、物质的空间结构、x2x-4物质结构与性质有机化学基础杂化类型、物质化学式的确定、原子间的最近距离)奥培米芬(化合物J)的合成路线(含氧官能团的名称、结构简式的书写、有机物的化学名称、反应类型的判断、一定条件下同分异构体数目的判断及特定情况结构简式的书写)3615年普通高等学校招生全国统一考试理科综合能力测试化学部分新课标卷细目表2023()题号分值题型考查知识点7 8 9666选择题选择题选择题文物中的化学知识(竹简、龟甲的化学成分、修复古陶瓷的熟石膏、颜料中的铁红)有机化合物的合成与性质(有机材料的性质、手性碳原子的判断、产物结构的分析、反应类型的判断)物质结构与性质(氢键的判断、第一电离能大小比较、未成对电子数判断、杂化轨道类型)二次电池以V O和Zn为电极、Z n(C F SO)水溶液为电解质的电池(正负极的判断、离子的移动方向、充电时2533210 11 12666选择题选择题选择题总反应方程式、充电时阳极电极反应式)实验方案的评价(氧化性强弱比较、离子的检验、金属性强弱的比较、有机化学反应)N H O H与N H转化为肼的反应历程(极性分子的判断、化学键的断裂与形成、催化剂的变化历程、同位素产物23的分析)溶液中离子浓度的对数关系图(曲线的判断、溶度积的计算、反应的平衡常数的计算、溶液中离子浓度大小的比较)13 27 286选择题1414化学工艺流程题化学综合实验题以铬钒渣为原料分离提取铬和钒(物质化学式的确定、浸渣成分的确定、不同pH的影响、离子方程式的书写)以安息香为原料制备二苯乙二酮(仪器的识别、实验操作的目的分析、实验方案的评价、试剂的用途、产率的计算)以合成氨为载体考查化学反应原理(盖斯定律的应用、速控步的分析、晶胞中所含原子数目的计算、平衡曲线的分析、压强平衡常数K p的计算)29 301515化学反应原理综合题物质结构与性质莫西赛利(化合物K)的合成路线(有机物的化学名称、杂化轨道类型、官能团的名称、反应类型的判断、结构简式的书写、化学方程式的书写、同分异构体数目的判断与特定条件的结构简式的书写)年普通高等学校招生全国统一考试理科综合能力测试化学部分湖南卷细目表2023()题号分值题型考查知识点13选择题化学与传统文化(物理变化与化学变化、淀粉和纤维素、常见合金的组成、传统硅酸盐材料)化学用语(共价型分子结构式、电子式、原子中相关数值及其之间的相互关系、电子排布式、价层电子对互斥理论的应用)23选择题3 433选择题选择题化学实验基本操作(化学实验基础操作、蒸馏与分馏、过滤、中和滴定)物质结构和性质(分子的手性、配合物的应用、氢键对物质性质的影响、酰胺的性质与应用)离子方程式(离子方程式的正误判断、水解的离子方程式书写、电解池电极反应式及化学方程式的书写与判断、常见阳离子的检验)5 633选择题选择题物质结构和性质位构性推断(微粒半径大小的比较方法、根据原子结构进行元素种类推断、能级间能量大小比较、元素性质与电负性的关系)7 8 9333选择题选择题选择题化学实验基本操作(氨水的性质、氢氧化铝、铁盐的检验、常见的几种羧酸)有机化学基础(催化剂对化学反应速率的影响、电解原理的应用、羧酸酯化反应、多官能团有机物的结构与性质)化学工艺流程微题型(水解的离子方程式书写、溶度积常数相关计算)元素及其化合物(氧化还原反应方程式的配平、基于氧化还原反应守恒规律的计算、利用杂化轨道理论判断分子的空间构型)10 11 12333选择题选择题选择题物质结构和性质晶胞结构(根据晶胞结构确定晶体化学式、晶胞的有关计算)水溶液中的离子平衡曲线(影响水电离的因素、酸碱中和滴定原理的应用、盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理、盐溶液中离子浓度大小的比较)化学反应原理化学平衡图像(影响化学反应速率的因素、化学平衡图像分析、化学平衡状态的判断方法、化学平衡常数的影响因素及应用)13 14 1533选择题选择题化学反应机理图(氧化还原反应的规律、催化剂对化学反应速率的影响、共价键的形成及主要类型)雷尼N i的制备及其催化氢化性能探究(铝与强碱溶液反应、常用仪器及使用、物质制备的探究、综合实验设计与评价)中化学实验综合以聚苯乙烯为载体考查化学反应原理知识(盖斯定律及其有关计算、催化剂对化学反应速率的影响、化学平衡的有关计算、溶度积)16 17 18难难中化学反应原理化学工艺流程有机化学基础以粗镓为原料制备超纯G a(C H3)3(控温的原因、电极反应式书写、化学方程式书写、理由的分析、分子中键角大小的判断)含吡喃萘醌骨架有机化合物的制备(有机合成综合考查、多官能团有机物的结构与性质、有机酸酸性强弱比较、同分异构体数目判断、合成路线的设计)题号分值 题型 考查知识点 13 选择题 化学与 S T S E (吸热反应和放热反应、化学科学对人类文明发展的意义、新能源的开发) 化学反应基本规律(氧化还原反应的几组概念、难溶电解质溶解平衡定义及特征、原电池原理理解、同主族元素性质递 变规律理解及应用) 23 选择题 3453 3 3 选择题 选择题 选择题 元素及其化合物(硅的制备、熵判据、实验安全、常见共价晶体的结构) 有机化学基础(有机官能团的性质及结构、常见官能团名称、组成及结构、分子的手性、多官能团有机物的结构与性质) 物质结构与性质(化学用语综合判断、共价型分子结构式、电子式、缩聚反应机理及判断、共价键的实质与形成) 物质结构与性质位构性推断(电离能变化规律、键能、键长、键角及应用、价层电子对互斥理论、极性分子和非极性分 子) 63 选择题 化学与 STSE (淀粉和纤维素组成与结构、淀粉、纤维素的水解、氢键对物质性质的影响、化学科学对人类文明发展的 意义) 783 3 3 3 3 选择题 选择题 选择题 选择题 选择题 化学实验基础(乙酸的酯化反应、乙酸乙酯制备实验、常见有机物的制备) 分子结构与性质(键能、键长、键角及应用、价层电子对互斥理论、价层电子对互斥理论的应用、利用杂化轨道理论判 断分子的空间构型)。
高考试卷试题复习化学试卷双向细目表
18
淀粉、蛋白质的性质
第四章生命中的基础有机化学
A
容易
2分
单项选择题
19
合成高分子化合物的基本方法
第五章进入合成有机高分子化合物的时代
A
容易
2分
单项选择题
20
合成高分子化合物的基本方法
第五章进入合成有机高分子化合物的时代
B
中难
2分
填空简答题
21
烯烃的性质
第二章烃和卤代烃
A
容易
7分
填空简答题
定额市鞍钢阳光实验学校2007-2008第一学期高中期末调研测试
高二化学试题
双向细目表(选修五基础有机化学)
(必做题)
题型
题号
知识点
章节
考试水平
难度估计
分值
单项选择题
1
有机物的结构特点和分类
第一章认识有机物
A
容易
2分
单项选择题
2
烃的结构及分子式
第二章烃和卤代烃
A
容易
2分
单项选择题
3
有机物的结构特点及高分子的合成
第五章进入合成有机高分子化合物的时代
A
容易
2分
单项选择题
4
有机实验探究方法
第三章烃的含氧衍生物
A
容易
2分
单项选择题
5
有机分子结构特点
第二章烃和卤代烃
A
容易
2分
单项选择题
6
烯烃的性质及加成反应特点
第二章烃和卤代烃
B
中难
2分
单项选择题
7
有机物的命名
第一章认识有机物
A
四调化学双向细目表
高三学年化学学科15-16学年度第四次调研考试双向
课标要求:依据本学科课程标准填写,分四个层次:1.识记(了解、指导)、2.理解、3.应用(运
能力要求:依据本学科考纲说明中的能力要求填写。
题型:1.选择题;2.填空题;3.问答题;4.论述题;5.计算题;6.实验题;7.写作;8、推断题;9.证明题;12.探究题;13.评价题
试题出处:填写原创、改编和成题
注:序号(行数)不够可以添加(插入),但不得破坏原来格式,不得缺项。
教务处制表
计算题;6.实验题;7.写作;8、推断题;9.证明题;10.材料题;11.改错
用(运用、迁移)和4.分析综合。
试双向细目表。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《考题大观》P26932题改编
题型
题号
知识点
预估难度
知识点在课本中分布
课标
要求
材料出处
填
空
与
简
答
题
27
分
14
灭火原理燃烧条件
较易2分
P80燃烧条件,P81灭火原理
认识
自编
15
溶解度曲线及应用,饱和与不饱和溶液
较易1分
中等2分
P207溶解度曲线,P208气体溶解度的影响因素,P203饱和与不饱和溶液
《解题决策》P24218题改编
18
离子鉴定
中等2分较难1分
P226Cl-、CO32-,P247SO42-
P252NH4+检验
了解
《解题决策》P23910题改编
19
元素名称、分类、化肥、据信息比较原子半径大小
较易2分
中等2分较难1分
P90元素周期表,P251常用化肥
知道
认识
《中学生学习报》42期18题改编
实
验
与
探
究
题
14分
20
常见仪器、氧气的制取、收集,实验装置的选择,实验现象描述及
化学方程式书写
较易7分
中等1分
P6常用仪器,P71制取氧气
学会
知道
《四星题库》P1464题改编
21
标签残损的试剂鉴定探究
较易3分
中等2分
较难1分
P232常见的碱,P243常见的盐
P237PH的测定P247CO32-离子鉴定
了解
《四星题库》P773题改编
16
CO2性质据信息写化学方程式
低碳理念
较易4分
P143CO2的性质,P123如何书写化学方程式P275白色污染,P37空气污染源
知道
学会
《2012金卷》P4415题改编
17
合金、酸、盐、氧化物间反应
较易2分
中等2分
P174合金,P142CO性质
P228复分解反应
了解
学会
理解区分
《2012金卷》P5528题改编
计
算
题
7分
22
有关化学式的计算
较易2分
P118根据化学式的计算
看懂
《中学生学习报》28期改编
23
化学方程式书写及计算
溶质质量分数的计算
较易3分
中等1分
较难1分
P126根据化学方程式的计算
P247盐—盐反应
P211溶质质量分数
学会
《中考真题》P7639题改编
说明:本试卷预估较易题42分,占总分的60%,中等题21分,占总分的30%,较难题7分,占总分的10%。《科学探究》10分,《身边的化学物质》27分,《物质构成的奥秘》13分,《物质的化学变化》11分,《化学与社会发展》9分,试卷满分共70分。
2011年鄂尔多斯市初中毕业升学考试化学科命题双向细目表
题型
题号
知识点
预估难度
知识点在课本中分布
课标
要求
材料出处
单
项
选
择
题
22
分
1
物理变化
较易2分
P16物理变化
理解
自编
2
化学实验操作
较易2分
P16氧气化学性质,P231浓硫酸的稀释
P214配制NaCl溶液,P122托盘天平使用
知道
《高频考点》P101
P121质量守恒定律
认识
《高频考点》P396题改编
8
金属活动性顺序
较易2分
P172金属活动性顺序
了解
自编
9
判断化学反应基本类型
中等2分
P173置换反应
认识
《2010中考试题》P9714题改编
10
酸、碱、盐的性质及溶液酸碱性
中等1分较难1分
P222复分解反应,P237溶液酸碱性
了解
《四星题库》P1505题改编
11
金属的化学性质
较难2分
P172金属与酸的反应
了解
《解题决策》P26916题改编填空与简答题27分
12
天然纤维化石燃料
较易3分
P272分辨纤维的方法,P153天然气主要成分、化石燃料的综合利用
知道
了解
自编
13
金属、有机合成材料、硬水的软化
较易3分
P169常见金属,P268塑料
P109硬水的软化
知道
《2010中考》P1、P98、P116改编
3
原子构成
较易2分
P54原子内部的奥秘
知道
自编
4
金属锈蚀
中等2分
P186钢铁锈蚀的因素
了解
《考题大观》》P975、6题改编
5
化学用语
中等2分
P114化学式意义
记住
自编
6
元素化合价
较易2分
P117化合价与化学式
说出
《中学生学习报》27期例2改编
7
质量守恒定律
中等2分
