第3章 影响腐蚀的结构因素
第二章 影响腐蚀的结构因素

钢(00Cr18Ni9)管更换。使用不到两年出现泄漏,
检查管道外表面发生穿晶型应力腐蚀破裂。
16
实例2:某化工厂生产氯化钾的车间,一台SS-800
型三足式离心机转鼓突然发生断裂,转鼓材质为
1Cr18Ni9Ti。经鉴定为应力腐蚀破裂。
17
实例3:CO2压缩机一段、二段和三段中间
第二章 影响腐蚀的结构因素
主要内容
掌握: 1.常见的局部腐蚀形式
2.各种局部腐蚀产生的条件 3.各种局部腐蚀的机理及防护措施 学会: 分析腐蚀事例,并提出防护措施
1
局 部 腐 蚀
力学因素
几何因素
异种金属偶接
焊接因素
减轻局部腐蚀的途径
2
第一节
力学因素
力学因素主要表现在不同性质的力与腐蚀介质共同 作用产生的腐蚀。
对一种合金材料,并非在所有环境中都会发生SCC; 在一种环境中,并非所有合金材料都会发生SCC。 常见的发生应力腐蚀的条件组合见书P41表2-1
4
3.应力腐蚀的破裂速度和裂纹形貌
分两种情况: 金属在无裂纹、无蚀坑或缺陷的情况下,SCC分为三 个阶段: 1)腐蚀引起裂纹或蚀坑—潜伏期 90% 10%
11
裂纹内的过程:
裂纹内的闭塞电池,因为 尺寸小,使其内部溶液不易与 外部发生对流交换。因而溶液 将浓缩。同时,金属腐蚀产生 的金属离子在裂纹中的浓度增 高,为保持电中性,裂纹内部 的金属离子与外部的活性阴离 子相向扩散迁移,尤其是Cl-, 将使溶液酸化,这样裂纹尖端 的腐蚀速度相当大。
由上述过程看出,裂纹尖端微区具有动力阳极的特征, 这就是为什么微观裂纹一旦形成就加快扩展的原因。 12
金属腐蚀与防护

第一章绪论腐蚀:由于材料与其介质相互作用(化学与电化学)而导致的变质和破坏。
腐蚀控制的方法:1)、改换材料 2)、表面涂漆/覆盖层3)、改变腐蚀介质和环境 4)、合理的结构设计5)、电化学保护均匀腐蚀速率的评定方法:失重法和增重法;深度法;容量法(析氢腐蚀);电流密度;机械性能(晶间腐蚀);电阻性.第二章电化学腐蚀热力学热力学第零定律状态函数(温度)热力学第一定律(能量守恒定律) 状态函数(内能)热力学第二定律状态函数(熵)热力学第三定律绝对零度不可能达到2.1、腐蚀的倾向性的热力学原理腐蚀反应自发性及倾向性的判据:∆G:反应自发进行<∆G:反应达到平衡=∆G:反应不能自发进行>注:ΔG的负值的绝对值越大,该腐蚀的自发倾向性越大.热力学上不稳定金属,也有许多在适当条件下能发生钝化而变得耐蚀.2.2、腐蚀电池2.2.1、电化学腐蚀现象与腐蚀电池电化学腐蚀:即金属材料与电解质接触时,由于腐蚀电池作用而引起金属材料腐蚀破坏.腐蚀电池(或腐蚀原电池):即只能导致金属材料破坏而不能对外做工的短路原电池.注:1)、通过直接接触也能形成原电池而不一定要有导线的连接;2)、一块金属不与其他金属接触,在电解质溶液中也会产生腐蚀电池.丹尼尔电池:(只要有电势差存在)a)、电极反应具有热力学上的可逆性;b)、电极反应在无限接近电化学平衡条件下进行;c)、电池中进行的其它过程也必须是可逆的.电极电势略高者为阴极电极电势略低者为阳极电化学不均匀性微观阴、阳极微观、亚微观腐蚀电池均匀腐蚀2.2.2、金属腐蚀的电化学历程腐蚀电池:四个部分:阴极、阳极、电解质溶液、连接两极的电子导体(即电路)三个环节:阴极过程、阳极过程、电荷转移过程(即电子流动)1)、阳极过程氧化反应++-M nM→ne金属变为金属离子进入电解液,电子通过电路向阴极转移.2)、阴极过程还原反应[]--⋅DDne+ne→电解液中能接受电子的物质捕获电子生成新物质.(即去极化剂)3)、金属的腐蚀将集中出现在阳极区,阴极区不发生可察觉的金属损失,只起到了传递电荷的作用金属电化学腐蚀能够持续进行的条件是溶液中存在可使金属氧化的去极化剂,而且这些去极化剂的阳极还原反应的电极电位比金属阴极氧化反应的电位高2.2.3、电化学腐蚀的次生过程难溶性产物称二次产物或次生物质由于扩散作用形成,且形成于一次产物相遇的地方阳极——[]+n M(金属阳离子浓度)(形成致密对金属起保护作用) 阴极——pH高2.3、腐蚀电池类型宏观腐蚀电池、微观腐蚀电池、超微观腐蚀电池2.3.1、宏观腐蚀电池特点:a)、阴、阳极用肉眼可看到;b)、阴、阳极区能长时间保持稳定;c)、产生明显的局部腐蚀1)、异金属(电偶)腐蚀电池——保护电位低的阴极区域2)浓差电池由于同一金属的不同部位所接触的介质浓度不同所致a、氧浓差电池——与富氧溶液接触的金属表面电位高而成为阳极区eg:水线腐蚀——靠近水线的下部区域极易腐蚀b、盐浓差电池——稀溶液中的金属电位低成为阴极区c、温差电池——不同材料在不同温度下电位不同eg:碳钢——高温阳极低温阴极铜——高温阴极低温阳极2.3.2、微观腐蚀电池特点:a)、电极尺寸与晶粒尺寸相近(0.1mm-0.1μm);b)、阴、阳极区能长时间保持稳定;c)、引起微观局部腐蚀(如孔蚀、晶间腐蚀)原因:a)、化学成分的不均匀性;b)、金属组织结构的不均匀性;多项合金不同相的电位不同c)、金属物理状态的不均匀性——应变、内应力不均匀;d)、金属表面膜(涂层)的不完整性.由于以上原因而形成的微观电池并不是金属发生电化学腐蚀的充分条件,还应在溶液中具有去极化剂才可发生2.3.3、超微观腐蚀电池特点:a)、电极用肉眼和普通显微镜难以分辨(100-1000nm);b)、阴、阳极区随时间不断变化;c)、引起均匀腐蚀2.4、电极电位与电化学腐蚀倾向性的判断2.4.1、电极和电极电位电极:指电子导体和离子导体组成的体系,常以金属/溶液表示注:腐蚀中的电极只指电子导体电极电位的表示:1)、金属浸入溶液中经水化作用而形成双电层 负点性金属水化后金属阳离子进入溶液——水化能 > 金属键能难溶性金属水化后从溶液中吸附阳离子——水化能 < 金属键能2)、形成气体电极——极难溶金属(Pt)和非金属导体(石墨)特点:电极导体本身不参与反应,仅起导电和反应载体作用2.4.2、平衡电极电位和非平衡电极电位平衡电极电位:水合与脱水达到动态平衡时的电极电位能斯特方程:⎪⎪⎭⎫ ⎝⎛+=R a a nF RT e e 0ln θ其中:e θ为标准电极电位; F 为法拉第常数;R aa 0为氧化态物质与还原态物质的活化比 注:浓度对电极电位有影响对于非平衡电极电位,其电极反应是不可逆的,因为电极过程中,即使阴极与阳极过程反应速率相等,达到了电子交换的平衡,但物质交换达不到平衡. 非平衡电极电位可以是稳定的也可以是不稳定的.电荷转移速率相等时即为稳定点位,也称开路电位或自腐蚀电位,即外电流为零时的电位.非平衡电极电位不服从能斯特方程,只能实验测得.2.4.3、电化学腐蚀倾向性的判断和电动序∵nFE G P T -=∆, e A e C E E E -=其中:F 为法拉第常数,F =96500 C/mol ; n 为参与反应的电子数;e C E 、e A E 分别为阴、阳极反应的平衡电位e A e C E E <:电位为e A E 的金属不会发生腐蚀 ∴电极电位判据 e A e C E E =:平衡状态e A e C E E >:电位为e A E 的金属自发进行腐蚀电动序:按金属在标准电极电位值E e 由低(负)值到高(正)值逐渐增大的次序排 列,得到的次序表称电动序.标准氢电极电位为零,电位比其低的为负电性金属,比其高的为正点性金属. 金属负电性越强,其在酸性溶液中越易发生析氢腐蚀.在可自发发生的反应中,电极电位较负的反应是氧化反应,较正的反应是还原反应.电偶序:金属或合金在一定电解质溶液中测得的稳定电位的相对大小排列而成的 次序表.电偶序比电动序更能反映金属实际腐蚀的性质.2.5、电位-pH 图及其应用2.5.1、水的E-pH 图要素:两条直线三个区域:a ---氢电极反应平衡电位-pH 关系的直线;b ---氧电极反应平衡电位-pH 关系的直线.b 线以上: 水被阳极电解为氧气;a 线以下: 水被阴极电解为氢气;a 、b 线之间: 水稳定区.2.5.2、电位-pH 图的绘制A 、列出可能发生的反应方程;B 、列出每个反应相应的Nernst 公式;C 、在水的电位-pH 图上绘制平衡关系。
第三章 压力容器破坏形式

第三章压力容器破坏形式压力容器常会由于设计结构不合理,制造质量差,使用维护不当或其他原因而发生破裂,并且破裂事故的形式多样,且很多是在使用限期内发生。
发生事故时,往往不仅容器本身遭到破坏,而且还会危及周围设施和职工的生命与健康,因此我们必须从各方面采取积极可靠的措施来保证安全运行,防止事故的发生。
第一节延性破裂延性破裂是压力容器在内部压力作用下,器壁上产生的应力达到器壁材料的强度极限,从而发生断裂的一种形式。
这种形式属韧性破裂,因此,该形式的破坏也称韧性破坏。
(一)机理压力容器的金属材料在外力作用下引起变形和破坏分为三个阶段(1)弹性变形阶段指当对材料施加的外力不超过材料固有的弹性极限值时,一旦外力消失,材料仍能回复到原来的状态而不产生明显的残余变形。
(2)弹塑性变形指对材料施加的外力超过材料固有的弹性极限值,材料将产生很大的塑性变形,外载荷消失后材料不再恢复原状,塑性变形仍将保留。
(3)断裂阶段指材料发生塑性变形后,如施加外力继续增加,当应力超过了材料的强度极限后,材料将发生断裂。
(二)特点及预防发生延性破裂的容器,其承受的压力、变形程度、断口特点及破裂具有以下特点:压力容器发生延性破裂是在较高的应力下发生的,即容器内的压力先后超过最高工作压力、设计压力而达到了容器的爆破压力值,容器破裂时的实际爆破压力往往接近于计算的爆破压力值。
若观察发生破裂的容器可知,由于容器在爆破前发生了明显变形,直径增大,破裂处的器壁显著减薄。
发生延性破裂的容器一般无碎片飞出,只是裂开一个口,口的大小与容器爆破时所释放的能量有关。
对于在液压试验中出现的延性破裂,由于液体的可压缩性极小,因此容器的裂口也比较窄,最大也不会超过半径。
但容器由于内部气体压力急骤升高而引起的破裂,裂口就比较宽。
既然容器发生延性破裂是由于超压而引起的,那么容器在试压和使用过程中就应该严禁超压,要严格按照有关规定进行压力试验与操作。
同时,也应按规定安装合适的安全泄压装置,并保证其灵敏可靠;与此同时,也要加强对容器的维护与检查,发生器壁腐蚀,减薄、变形应立即停止使用。
第三章 飞机腐蚀的检查方法

第3章 飞机腐蚀的检查方法
3.2 检查方法 涡流法
第3章 飞机腐蚀的检查方法
3.2 检查方法 涡流法
➢ 应用:高频→表面,低频→内部 • 对疲劳裂纹和应力腐蚀裂纹灵敏度最高 • 检测时无需去除表面涂层 • 对蒙皮背面的晶间开裂等腐蚀损伤敏感 • 低频涡流仪可检测多层结构的缺陷 • 可检测螺栓孔、铆钉孔周边裂纹 • 可原位检测
3.2 检查方法
X射线探测法
➢ 操作:定距→X射线照 射→冲洗胶片→缺陷判 断→处理措施
➢ 照相规范
• 对比度:管电压、胶片、 X射线波长
• 清晰度:距离、焦点、 胶片、技术水平和经 X射线探测法
➢ 胶片分析评判 ➢ 缺陷成像特征 • 裂纹:锯齿形黑色条纹 • 腐蚀:无规则的斑、点、块 ➢ 应用 • 机身 • 机翼 • 尾翼
第3章 飞机腐蚀的检查方法
3.2 检查方法 渗透检测法
第3章 飞机腐蚀的检查方法
3.2 检查方法 渗透检测法
➢ 真实缺陷显示
第3章 飞机腐蚀的检查方法
3.2 检查方法 渗透检测法
➢ 假显示 • 水渍、水流 • 印痕、指纹 • 粗糙表面 • 刀痕、划伤 • 装配压痕
第3章 飞机腐蚀的检查方法
第3章 飞机腐蚀的检查方法
3.2 检查方法 X射线探测法
➢ 原理:X射线透射→散射和吸收→材料内部缺陷 的种类、形状、大小、发布→照相底片
第3章 飞机腐蚀的检查方法
3.2 检查方法 X射线探测法
第3章 飞机腐蚀的检查方法
3.2 检查方法 X射线探测法
过程装备腐蚀与防护课件-绪论

船舶在海洋环境中的腐蚀
绪论
3、能源电力
水电:水轮机组的腐蚀,叶片空蚀; 火电:锅炉和管道的腐蚀; 核电站:高温、辐照、液态金属等腐蚀; 煤矿安全; 油气开采、运输。
绪论
4、化工工业
5、机械电子
6、民生
7、环境污染
绪论
腐蚀造成的经济损失(美国): 占国民生产总值的1.8%~4.2%
绪论
腐蚀造成的经济损失(中国):
2002年 柯伟院士
绪论
腐蚀防护的意义:
绪论
腐蚀防护的意义:
绪论
腐蚀防护的意义:
腐蚀科学的发展:
绪论
绪论
腐蚀科学的发展:
绪论
腐蚀科学的发展:
腐蚀的定义:
绪论
绪论
绪论
腐 蚀
金属腐蚀
机 理 破坏 特征
非金属腐蚀
腐蚀 环境
化 学 腐 蚀
电 化 学 腐 蚀
全 面 腐 蚀
局 部 腐 蚀
大 气 腐 蚀
土 壤 腐 蚀
电 解 质 溶 液 腐 蚀
熔 融 盐 中 的 腐 蚀
高 温 Байду номын сангаас 体 腐 蚀
应 力 腐 蚀
疲 劳 腐 蚀
磨 损 腐 蚀
小 孔 腐 蚀
晶 间 腐 蚀
缝 隙 腐 蚀
电 偶 腐 蚀
其 它
绪论
1.
腐蚀的危害性
材料腐蚀给国民经济带来巨大损失
腐蚀事故危及人身安全
腐蚀造成资源和能源浪费
腐蚀引起环境污染
目录
绪论
第一章 金属电化学腐蚀基本原理
第二章 影响腐蚀的 结构因素 第三章 金属在某些环境中的腐蚀 第四章 金属结构材料的耐蚀性 第五章 非金属结构材料的耐蚀特性
第三章 水轮机的空化与空蚀(10)讲解

2g
2
p2 r
w22 2g
u22 2g
hk2
----(1)
Z2
p2 r
v22 2g
Za
pa r
va2 2g
h2a
--、2点很靠近,即
uK u2 , hK2 0 , 且令 Z2 Za Hs
由于
h2a
分析和推导空化系数是以翼型空化为基础, 计算出转轮叶片上最低点的压力值,若不发生 空化,则必须使最低点的压力值大于或等于该 水温下的汽化压力。
如图所示,设k点为转轮叶片背面靠近出水边的 压力最低点,求k点的压力值。
对k-2点,2-a点分别列能量平衡方程式
Zk
pk r
wk2 2g
u
z k
h 但是,用 表示水轮机空化性能还不太 v
合理,因速度与水头成正比,同一水轮机当工
h 作水头不相同时, 也不相同,这不便于用 v 同一标准进行空化性能的比较,为此,采用单
位水头下的动态真空值表示,即,动态真空相
对值
hv H
wk2 w22 2gH
w
v22 2gH
hv H
wk2 w22 2gH
即
pk r
pv r
pa r
pv r
Hs
H
则压力余量的相对值为:
pk
pv
pa r
pv r
Hs
rH
H
令
pa r
pv r H
Hs
p
称电站的空化系数
腐蚀电化学原理课件第3章极化与混合电位理论

涂层保护
通过在金属表面涂覆一层耐腐蚀的涂层,将 金属与腐蚀介质隔离,以减缓腐蚀速率。
缓蚀剂
通过在腐蚀介质中添加能够抑制腐蚀反应的 物质,降低腐蚀速率。
其他实用的腐蚀防护措施
控制环境因素
如温度、湿度、pH值等,以降低金属的腐蚀速率。
改高其耐 蚀性。
根据混合电位理论,可以通过选择适 当的材料组合或表面处理方法,使不 同金属在腐蚀介质中形成低电位差, 从而降低腐蚀速率。
防腐涂层设计
在防腐涂层设计中,可以利用混合电 位理论优化涂层材料的选择和搭配, 以提高涂层的保护效果。
混合电位理论的局限性与发展趋势
局限性
混合电位理论的应用受到腐蚀介质、金属种类和接触条件等多种因素的影响,有时难以准确预测腐蚀行为。
发展趋势
随着材料科学和电化学技术的不断发展,混合电位理论有望与现代测试技术相结合,进一步提高预测腐蚀行为的 准确性。同时,研究不同金属在复杂环境中的腐蚀行为和机制,有助于拓展混合电位理论的应用范围。
04
CATALOGUE
电化学阻抗谱在腐蚀研究中的应用
电化学阻抗谱的基本原理
阻抗谱是一种测量电极系统在交流电信号作用下的阻抗值随频率变化的电化学技术 。
概念
极化现象是腐蚀过程中的一个重 要现象,它涉及到金属表面的电 荷分布和电子转移过程,对腐蚀 速率产生影响。
极化现象对腐蚀速率的影响
01
02
03
降低腐蚀速率
当金属表面发生阳极极化 时,金属的腐蚀速率会降 低,因为阳极反应受到抑 制。
加速腐蚀
当金属表面发生阴极极化 时,金属的腐蚀速率会加 速,因为阴极反应得到促 进。
通过对比不同极化条件下金属在腐蚀 介质中的失重程度,可以验证极化现 象对腐蚀速率的影响。
铜及其合金的腐蚀问题

铜及其合金的腐蚀问题材研1001 杜伟 602080502038第一章绪论一研究铜及铜合金腐蚀的意义铜及铜合金色泽美观,性能优异,广泛应用于机械、化学、电子等众多工业领域。
铜的化学性质较为活泼,长时间暴露于空气或水中,尤其是在有腐蚀介质存在的环境中很容易发生腐蚀。
因此铜的腐蚀与防护问题是腐蚀学领域一个亟待解决的重要问题。
在有色金属的生产中,铜的产量仅次于铝,居第二位。
在电化学顺序中,铜具有比氢更高的正电位(+0.35 VSHE),故铜有较高的热力学稳定性,不会发生氢的去极化作用,被列为耐腐蚀金属之一。
但是在湿度较高、腐蚀性介质(如含二氧化硫的空气、含氧的水、氧化性酸以及在含有CN-、NH4+等能与铜形成络合离子的液体)中,铜则发生较为严重的腐蚀。
铜合金表现出比纯铜更高的耐腐蚀性,如:黄铜(Cu Zn合金)耐冲击腐蚀性好;铜镍合金具有耐酸耐碱、耐海水的性能以及抗应力腐蚀开裂的特性;锡青铜合金可耐各种腐蚀;硅青铜合金机械强度高、耐应力腐蚀开裂性能好。
铜会发生腐蚀早已为人们所知,可以说人类一开始使用铜就发现了这一现象。
虽然金属腐蚀现象极其广泛和常见,但作为一门科学对其进行研究却还是近百年的事。
在现代科学中,金属腐蚀的定义是:“金属在环境介质的作用下,由于化学反应、电化学反应或物理作用而产生的破坏”[1,2]。
由此定义可见,金属腐蚀的发生必须有包括金属材料和环境介质在内的相界面上的作用体系,金属发生腐蚀需要外部环境。
腐蚀是对金属材料的一种破坏,这种破坏使许多金属设备的使用寿命大为缩短甚至报废,带来巨大的经济损失,它会使生产停顿、物质流失、资源耗损、产品质量降低、环境受到污染、影响新技术的发展。
二铜的腐蚀环境铜的腐蚀按铜的使用环境可分为气相腐蚀和液相腐蚀,而液相腐蚀可按酸碱度进一步分为酸性液体、中性液体和碱性液体中的腐蚀。
在过去的数十年里,人们对铜在酸性溶液中、碱性溶液中和中性盐类溶液中以及自来水供水系统中的腐蚀进行了深入广泛的研究。
金属电化学腐蚀基本原理 第二章-1

1
当载荷逐渐增大,σ达到某一临界值σc,构件中裂缝将发生急速的 失稳扩展而脆断。此时与σc相对应的K1c称为材料的“断裂韧性”,
它与试件的形状和尺寸无关,是表示材料固有韧性的特性值,反映
有裂纹材抖对破裂的实际抗力,可以通过实验测定。 在腐蚀环境中具有裂缝的试件的应力场强度因子K1同样存在一个临 界值K1SCC,称为应力腐蚀破裂临界强度因子,K1SCC低于K1c。
2
影响腐蚀的结构因素
— 过程装备腐蚀与防护
2
影响腐蚀的结构因素
(3) 采用合理的热处理方法消除残余应力,或 改善合金的组织结构以降低对SCC的敏感性
采用退火处理消除内应力:钢铁在500 ~ 600 oC处理0.5
~ 1 h,然后缓慢冷却;奥氏体不锈钢可以加热到900 oC
左右再缓冷。但高温处理有可能引起金属表面氧化,形
无应力存在下的局部腐蚀速度(如孔蚀等),
— 过程装备腐蚀与防护
2
影响腐蚀的结构因素
• 应力腐蚀破裂裂纹形貌:应力腐蚀裂纹形态有 晶间型、穿晶型和混合型三种。混合型是以一 种形态为主,支缝中出现另一种形态。
— 过程装备腐蚀与防护
2
影响腐蚀的结构因素
不同的金属一环境体系,将出现不同的裂纹形态, SCC裂纹起源于表面,裂纹的长宽不成比例,可相 差几个数量级,裂纹扩展方向多垂直于主拉伸应力 方向,裂纹一般呈树状。 不同的材料有不同的破裂方式:碳钢、高强钢、 铝合金、铜合合多半是沿晶间断裂,奥氏体不锈钢、 镁合金大多是穿晶型,钛合金为为混合型。 裂纹断口的形貌,宏观上属于脆性断裂,即使塑 性很高的材料也是如此。 但从微观上观察,在断裂面有塑性流变痕迹。断 面有裂纹分叉现象,断面形貌呈海滩条纹、羽毛状、 撕裂岭、扇子形和冰糖块等征状。
无机材料物理化学(贺蕴秋) 答案

第一章几何结晶学基础1-1. 晶体,晶胞的定义;空间格子构造的特点;晶体的基本性质. 1-2. 参网页上的模型,运用对称要素组合定律,写出四方柱,六方柱,四方四面体,斜方双锥,六八面体,三方柱,复三方三角面体,四六面体的点群符号, 并写出其所属的晶系和晶族. 1-3. 参阅网页上的模型,请确定单型中的六八面体,复三方偏三角面体,复六方双锥,和聚型中2,3,4 号模型在晶体定向中,各晶体的晶轴分别与哪些对称轴重或晶棱方向平行? 1-4. 请写出单型三方柱,四方柱,四方双锥,六方柱,菱面体,斜方双锥各晶面的主要晶面符号. 1-5. 请写出下列聚型模型各晶面的晶面符号:1,2,3,4.两个对称面相互成1)60°,2)90°,3)45°,4)30°,可组合成什么点群? 1-6. 由两根相交的二次轴互成1)90°,2)60°,3)45°,4)30°,可以组合成什么点群? 1-7. 试在面心立方格子中画出菱面体格子一晶面在X,Y,Z 轴分别截得2,4,6 个轴单位,请写出此晶面符号. 1-8. 作图表示立方晶体的(123),(012),(421)晶面. 1-9. 在六方晶体中标出晶面(0001),(2110),(1010),(1120),(1210) 的位置. 1. 答:晶体最本质的特点是其内部的原子,离子,或原子集团在三维空间以一定周期性重复排列而成, 晶体的空间格子构造有如下特点: 结点空间格子中的点,在实际晶体中它们可以代表同种质点占有的位置,因此也称为晶体结构中的等同点位置. 行列结点在一维方向上的排列 . 空间格子中任意两个结点连接的方向就是一个行列方向.面网结点在平面上的分布构成面网.空间格子中,不在同一行列上的任意三个结点就可联成一个面网.平行六面体空间格子中的最小单位.它由六个两两平行且大小相等的面组成. 晶体的基本性质是指一切晶体所共有的性质, 这些性质完全来源于晶体的空间格子构造.晶体的基本性质主要包括以下五点: 1 ) . 自限性(自范性),指晶体在适当条件下自发形成封闭几何多面体的性质. 晶体的的多面体形态是其格子构造在外形上的反映. 暴露在空间的晶体外表, 如晶面,晶棱与角顶分别对应其晶体空间格子中的某一个面网,行列和结点. 2 ) . 结晶均一性,指同一晶体的各个不同部分具有相同的性质.因为以晶体的格子构造特点衡量,晶体不同部分质点分布规律相同,决定了晶体的均一性. 3 ) . 对称性,指晶体中的相同部分在不同方向上或不同位置上可以有规律地重复出现.这些相同部位可以是晶面,晶棱或角顶.晶体宏观上的对称性反映了其微观格子构造的几何特征. 4 ) . 各向异性,指晶体的性质因方向不同而具有差异.如云母的层状结构显示了在不同方向上的结合强度不同.从微观结构角度考虑,代表云母晶体的空间格子在不同方向上结点位置的排列不同.5 ) . 稳定性(最小内能),指在相同的热力学条件下,具有相同化学组成的晶体与气相,液相,非晶态相比,晶体具有最小内能,因此也是稳定的结构. 2. 答: 点群运用组合定律晶系晶族四方柱L 4 4L 2 5PC 1,2,3 四方中级六方中级六方柱L6 6L 2 7PC 1.2.3 四方四面体Li 4 2L 2 2P 4,5 四方中级斜方双锥3L 2 3PC 1,2,3 正交低级六八面体3L 4 4L 3 6L 25 等轴高级9PC 三方中级复三方三角面L 3 3L 2 3PC 1,2,3 体四六面体3L 4 4L 3 6L 25 等轴高级9PC 六方中级三方柱Li 6 3L 2 3P 4 3 答:略4. 答: 三方柱晶面1(2110) 晶面2( 1210) 晶面3(1120) 晶面4(0001) 晶面5(0001) 四方柱晶面1(100) 晶面2(010) 晶面3(100) 晶面4(010) 晶面5(001) 晶面6(001) 四方双锥晶面1(h0l) 晶面2(0kl) 晶面3(h0l) 晶面4(0kl) 晶面5(h0l) 晶面6(0kl) 晶面7(h0l) 晶面8(0kl) 六方柱晶面1(10l0) 晶面2(01l0) 晶面3(l100) 晶面4(l010) 晶面5(0l01) 晶面6(1l00) 晶面7(0001) 晶面8(000l) 菱面体晶面1(h00l) 晶面2(0k0l) 晶面3(h00l) 晶面4(0l0l) 晶面5(00il) 晶面6(00il) 斜方双锥晶面1(hkl) 晶面2(hkl) 晶面3(hkl) 晶面4(hkl) 晶面5(hk l ) 晶面6(hk l ) 晶面7 (hkl) 晶面8(hkl) 5. 答: 60°L33P 90°L22P 45°L44P 30°L66P 6. 答: 90°3L 2 60°L33L2 45°L 4L 30°L 6L 6 4 2 2 7. 答:略.(632) 8. 答:略9. 答:略第二章晶体化学基础和无机化合物晶体结构1-1. 晶格能与哪些因素有关?已知MgO 晶体具有氯化钠的结构型, 其晶格常数 a 为0.42nm,试计算MgO 的晶格能. 1-2. 计算具有简单立方(SC)和体心立方(BCC)结构金属(单质)晶胞的堆积密度(空间利用率). 1-3. 金属钼具有BCC 结构,其晶格常数 a 为0.3146nm,试计算钼原子的半径. 金属铬的晶格常数 a 为0.2884nm,密度为7.19g/cm3,通过计算确定铬是简单立方,体心立方还是面心立方结构.(Cr 52.00) 1-4. 在氧离子面心立方紧密堆积中,画出适合正离子填充的空隙形状和位置, 并分析八面体空隙和四面体空隙数分别与氧离子数有什么关系? 1-5. 比较面心立方最紧密堆积和六方最紧密堆积的异同点. 1-6. ThO2 具有萤石结构:Th4+离子半径为0.100nm,O2-离子半径为0.140nm,试问1)实际结构中的Th4+正离子配位数与预计配位数是否一致?2)结构是否满足鲍林规则. 1-7. 从负离子的立方密堆积出发,说明以下情况各产生什么结构类型:1)正离子填满所有四面体空隙位置;2)正离子填满一半四面体空隙位置;3)正离子填满所有八面体空隙位置. 1-8. 在萤石晶体中Ca2+半径为0.112nm,F-半径为0.131nm,求萤石晶体的堆积密度?萤石晶体a=0.547nm,求萤石的密度. 1-9. 根据教材中的萤石结构图,画出萤石晶胞的投影图,并注明Ca2+离子和F离子的标高. 1-10. 下列硅酸盐矿结构各属何种结构类型?(有Al3+离子的要说明其在结构中所处的位置): CaMg[Si2O6] Ca2Al[AlSiO7] Mg[Si4O10](OH)2 K[AlSi3O8] 1.答:因素为(1)离子的电子结构(2)离子的晶体结构类型(3)正负离子平衡距离.MgO 的晶格能为3955.5 KJ mol . 2.答:SC 堆积密度为52.36%,BCC 堆积密度为68.02%. 3.答:钼原子半径为0.1362nm.铬是体心立方BCC 结构. 4.答:四面体数:氧离子数=2:1,八面体数:氧离子数=1:1. 5.答:略. 6.答: (1)半径计算得出Th4+应为六配位,由于ThO2 为萤石结构,故不一致. (2) 不满足多面体规则,电价规则可满足. 7.答:1)反萤石结构.2)闪锌矿结构.3)NaCl 型结构. 8.答:堆积密度为60.41%,萤石的密度为 3.17g cm3. 9.答:图略. 10. 答:CaMg[Si2O6] 单链状. Ca2Al[AlSiO7] 组群状,双四面体.Al3+离子一部分位于氧八面体空隙, 另一部分位于四面体空隙. Mg[Si4O10](OH)2 层状. K[AlSi3O8] 架状.Al3+离子位于氧四面体空隙.第三章晶体的结构缺陷.3-1 方镁石(MgO)的密度是 3.58g/cm3,其晶格常数是0.42nm,计算MgO 中每个晶胞中肖特基缺陷的数目. 3-2 1)在CaF2 晶体中,弗兰克尔缺陷形成能为2.8eV,肖特基缺陷的生成能为 5.5eV, 计算在25℃和1600℃时热缺陷的浓度? 2)如果CaF2 晶体中,含有百万分之一的YF3 杂质,则在1600℃时,CaF2 晶体中是热缺陷占优势还是杂质缺陷占优势?请说明原因. 3-3 在下述晶体中,你认为何类缺陷占优势?1)用MgCl2 掺杂的NaCl;2)用Y2O3 掺杂的ZrO2;3)用YF3 掺杂的CaF2;4)在一种还原性气氛中加热的WO3. 3-4 试写出下列缺陷方程: 1) 3) 2) 4) 3-5 当ZrO2 添加到Y2O3 中,为保持结构的电中性,在形成置换型固溶体的同时, 还产生正离子空位,写出其缺陷反应方程式. 3-6 高温结构材料Al2O3 可以用ZrO2 来实现增韧,也可以用MgO 来促进Al2O3 的烧结:1)如加入0.2mol%ZrO2,试写出缺陷反应式和固溶体分子式;2)如加入0.3mol%ZrO2 和Xmol%MgO 对Al2O3 进行复合取代,试写出缺陷反应式,固溶体分子式,并求出X 值. 3-7 ZnO 属六方晶系,a=0.3242nm,c=0.5195nm,每个晶胞中含有2 个ZnO 分3 子,测得晶体密度分别为5.74,5.606g/cm ,求两种情况下各产生什么型式的固溶体? 3-8 非化学计量化合物FexO 中,Fe3+/Fe2+=0.1,求FexO 中空位浓度及x 值. 1.答:平均每个晶胞0.0082 对肖特基缺陷. 2.答:⑴T1=298K,弗兰克缺陷浓度2.21×10-24 ,肖特基缺陷浓度为1.374×10-31;T2=1873K, 弗兰克缺陷浓度 1.72×10-4,肖特基缺陷浓度为 1.4×10-5;⑵T=1600℃,热缺陷1.72×10-4,杂质缺陷1×10-6,热缺陷占优势3.答: 4.答:略5. 答: 6.答:①Al1.997Zr0.002O3 ②Zr0.003Mg0.003Al1.994O3 7.答:略8.答:Fe0.957O,空位浓度[ ]=0.0435第四章非晶态固体4-1 试分析影响熔体粘度的因素有哪些? 4-2 名词解释:晶子学说和无规则网络学说,单键强度,网络形成剂和网络变性剂4-3 玻璃的组成是13mol%Na2O,13mol%CaO,74mol%SiO2,计算非桥氧分数. 有两种不同配比的玻璃,其组成如下: 序号1 2 Na2O( mol%) 8 12 CaO( mol%) 12 8 SiO2( mol%) 80 80 试用玻璃结构参数说明两种玻璃高温下粘度的大小. 4-4 有一组二元硅酸盐熔体,其R 志变化规律如下,写出熔体一系列性质的变化规律:R = 2 , 2.5, 3, 3.5, 4 游离碱含量的变化; O/Si 比的变化; 低聚物数量; 熔体粘度; 形成玻璃的能力; 析晶能力. 4-5 什么是硼反常现象?为什么会产生硼反常现象. 1. 答:溶体组成,质点活化能,温度等. 2. 答:略. 3. 答:R 值为2.35.X 值为0.7.非桥氧分数为17.5%.两种玻璃结构参数相同,但(1)的钙含量高,所以(1)粘度大. 4.答:游离碱含量的变化增大; O/Si 比的变化增大; 低聚物数量增多; 熔体粘度递减; 形成玻璃的能力递减; 析晶能力递增. 5.答:略.第五章固体的表面与界面行为5-1 名词解释: 表面能,表面张力,吸附,接触角,晶界结构,润湿角. 5-2 试说明晶界能总小于两个相邻晶粒的表面能之和的原因. 5-3 MgO-Al2O3-SiO2 系统的低共熔物放在Si3N4 陶瓷片上,在低共熔温度下, 液相的表面张力为900×10-3N/m,而液体与固体的界面能为600×10- 3 N/m,测得接触角为70.52°. (1) (2) 求Si3N4 的表面张力; 把Si3N4 在低共熔温度下进行热处理,测试其热腐蚀的槽角为60°,求Si3N4 的晶界能. 5-4 生产氧化铅瓷件过程中需要镀银,已知1000℃时γAl2O3 s=1.0×10-3N/m, γAg L=0.92×10-3N/m,γAg L/Al2O3 s=1.77×10-3N/m,问液态银能否润湿氧化铅瓷件表面?可以用什么方法改善它们之间的润湿性? 5-5 5-6 5-7 5-8 影响润湿效果的主要因素有哪些? 大块状的石英材料经煅烧后易于破碎,这是为什么? 试说明晶粒之间的晶界应力大小对晶体性能的影响. 在真空中和在空气中将云母片剥落后再合上,会出现什么现象?说明理由? 5-9 5-10 什么是粘附功?粘附性越好是否就意味着粘附功越小,为什么? 1 克石英当它粉碎(在湿空气中)成每颗粒半径为1μm 的粉末时质量增加至 1.02 克,它的吸附水膜厚度为多少?(石英密度是2.65g/cm3) 1. 3. 答:略2. 答:略答:⑴900×10-3N/M ⑵1559×10-3N/M 4. 答:θ=147°>90°,液态银不能润湿氧化铅表面,可以通过以下方法改善它们之间的润湿性:增大瓷件表面粗糙度;设法除去表面吸附膜等. 5. 略6. 略7. 略8. 略9. 略10. 答:膜厚度为0.0177um第六章相图及其相平衡6-1 名词解释: 凝聚系统;介稳平衡;无变量点;低共熔点;双升点;双降点;液相独立析晶. 6-2 简述SiO2 的多晶转变现象,说明为什么在硅酸盐产品中SiO2 经常是以介稳状态存在. 6-3 具有不一致熔融二元化合物的二元相图(图6-11 所示),在低共熔点E 发生如下析晶过程: .已知 E 点 B 含量为20%,化合物AmBn 的 B 含量为64%.现有C1 和C2 二种配合料,已知C1 中的 B 含量为C2 中 B 含量的 1.5 倍,且在高温熔融冷却析晶时,从该二配合料中析出的初相(即到达低共熔温度前析出的第一种晶体)含量相等.试计算C1 和C2 配合料的组成. 6-4 今通过实验测得如图所示的各相图,试判断这些实验结果的正确性,若有错误,予以修正,并说明理由. 6-5 已知 A 和 B 两组份构成具有低共熔点的有限固溶体二元系统(图6-17). 试根据下列实验数据绘制概略相图: 的熔点为1000℃, 的熔点为700℃. A B 含B25%的试样在500℃完全凝固, 其中含73.3.%初相SA(B)和26.7%SA(B)+SB(A) 共生体.含B50%的试样在同一温度下凝固完毕,其中含40%初相SA(B) 和60%SA(B)+SB(A) 共生体,而SA(B)相总量占晶相总量的50%,实验数据均在达到平衡状态时测定. 6-6 试完成下图中的配料点1,2,3 的结晶路程(表明液,固相组成点的变化及其结晶过程各阶段系统中发生的相变化). 6-7 下图所示为一个三元化合物的三元相图. (1) (2) (3) (4) 判断三元化合物N 的性质; 标出边界曲线的降温方向(转熔界线用双箭头); 指出无变点K,L,M 的性质分析点1,2 的结晶路程(表明液固相组成的变化及各阶段的相变化) 6-8 如图6-43,配合料P 的液相在无变点K 发生独立析晶,最终在低共熔点 F 结束结晶.试问此时所获得的C3S,C2S,C3A 和C12A7 四种晶相的含量各为多少?,如果在F 点仍未达到平衡,残留液相能否离开F 点向其它无变点继续转移?为什么? 6-9 如图6-43,今取配合料成分恰好如无变点h 的组成,在充分平衡条件下, 问: (1) (2) (3) 加热该配合料,什么温度开始出现液相? 要使物料全部熔融,至少要加热到多高温度? 写出配合料加热到开始出现液相时和全部熔融时的反应过程. 6-10 如图6-43,若原始液相组成位于配合料圈内,并恰好在CaO 和C3S 初相区的边界曲线上: (1) (2) 说明此液相的结晶路程在缓慢冷却到无变点K 的温度1455℃时急剧冷却到室温,则最终获得哪些相? 各相含量如何? 1.答:名词解释略. 2.答:略,提示从动力学角度说明. 3.答:C1 配料组成为 A 74.1%,B 25.9%;C2 配料组成为 A 82.7%,B 17.3%. 4.答:(A)B 的熔点温度只有一个,两点应该重合.(B)液相组成不应该存在范围.(C)低共熔温度不应该是一条倾斜的直线,应该是水平的.(D)(E)均为二元系统,P 最大为3,不应该出现四相点和四相区域. 5.答:图略,提示低共熔温度线上三点的B%分别为5%,80%,95%. 6.答:略. 7.答:(1)N 为不一致熔融三元化合物.(2)略.(3)L 点位于△BNC 内部,为低共熔点, 点位于△ANB 交叉位, K 为双升点, 点位于△ANC 内部, M 为低共熔点. (4)略. 8.答:C3S,C2S,C3A 和C12A7 四种晶相的含量略,残留液相不能离开F 向其它无变量点转移,因为三元系统最多存在四相,在F 点已有四相. 9.答:(1)加热该配合料,1335 度开始出现液相.(2)要使物料全部熔融,至少要加热到2570 度.(3)略. 10. 答:最终获得C3S,C2S,玻璃相.第七章扩散与固相反应7-1 名词解释: 无序扩散,晶界扩散,表面扩散,本征扩散,非本征扩散,自扩散,互扩散,稳定扩散,不稳定扩散,扩散活化能,扩散通量. 7-2 已知CaO 的肖特基缺陷生成能为6ev,欲使Ca2+在CaO 中的扩散直至CaO 的熔点(2600 ℃)都是非本征扩散,要求三价杂质离子的浓度是多少? 7-3 设有一条内径为30mm 的厚壁管道,被厚度为0.1mm 的铁膜隔开.通过管子的一端向管内输送氮气,以保持膜片一侧氮气浓度为1 200mol/m ,而另一侧的氮气浓度为100 mol/m3.如在700℃下测得通过管道的氮气流量为 2.8×10-8mol/s,求此时氮气在铁中的扩散系数. 7-4 在二根金晶体圆棒的端点涂上示踪原子Au,并把棒的两端如图所示连接. 在920℃下加热100 小时,Au 示踪原子的扩散分布如图所示,并满足下列关系: 3 M 为实验中示踪原子总量,求此时金的自扩散系数. 7-5 试定性地分析和讨论从室温到熔融温度范围内,氯化锌添加剂(10-4mol%) 对氯化纳单晶中所有离子(Zn,Na,Cl)的扩散能力的影响. 7-6 试从扩散介质的结构,性质,晶粒尺寸,扩散物浓度,杂质等方面分析影响扩散的主要因素. 7-7 根据ZnS 烧结的数据测定了扩散系数,在450℃和563℃时,分别测得扩散系数为1.0 ×10 cm /s 和3.0×10 cm /s.(1)确定激活能和D0;(2)根据你对结构的了解, 试从运动的观点和缺陷的产生来推断激活能的含义;(3)根据ZnS 和ZnO 相互类似的特点,预测D 随硫的分压而变化的关系. 7-8 试分析碳原子在面心立方和体心立方铁八面体空隙间跳跃情况并以D=λ Pг形式写出其扩散系数(设点阵常数为a).式中λ为跃迁自由程,P 为跃迁几率,而г为跃迁频率. 7-9 指出以下概念中的错误: (1) (2) (3) 如果固体中不存在扩散流,则说明原子没有扩散; 因固体原子每次跳动方向是随机的,所以在任何情况下扩散流量为零; 晶界上原子排列混乱,不存在空位,所以以空位机制扩散的原子在晶界处无法扩散; -4 2 -4 2 (4) 间隙固溶体中溶质浓度较高,则溶质所占据的间隙越多,供扩散的空余间隙越少,即Z 值越小,越容易导致扩散系数的降低. 7-10 以空位机制进行扩散时,原子每次跳动一次就相当于空位反向跳动一次, 并未形成新的空位,而扩散活化能中却包含着空位形成能,此说法正确吗?请给出说明. 1. 2. 3. 4. 答:略答:1.1×10-5mol/m3 答:D=3.6×10 m /s 答:根据表中数据,以-ln ,求D 为2.33×10-7m2/s 对x2 作图,得一直线,求斜率K,t=360000s,D= -12 2 5. 答:低温时,以杂质扩散为主,ZnCl2 的加入对Na 离子的扩散能力有扩散作用, 而对氯离子的扩散能力影响不大,在高温条件下,本征扩散为主要形式, ZnCl2 的加入影响可忽略. 6. 略7. 答:①Q=48.9kJ,D0=0.39cm2/s ②质点处于其他质点作用的三位势阱中作周期性振动,若要摆脱其他质点的束缚,必须具有克服势阱作用的能量,这部分能量称为激活能,激活能包括迁移能和缺陷形成能. ③D∝PS2-1/4,硫分压越小,D 越大,硫分压增大,D 减小. 8. 9. 答:面心立方(fcc), = ,P= ,D= ,体心立方(bcc),D= 答:①扩散流的产生需要一个推动力,但在宏观上不存在扩散流,只要有一定温度,原子之间存在杂乱无章的自扩散. ②当有外力作用,如处于电场中,扩散流量不为零,只有在平衡状态下,扩散流量为零. ③晶界上原子所受束缚力低,其能量/振动频率搞,迁移能力强,其原子迁移到内部相党羽空位的反向扩散,不仅存在扩散,其扩散能力还比内部强. ④对扩散系数的影响可以忽略. 10.答:不正确.扩散系数是宏观值不是单个原子跳动机理的简单叠加.第八章固相反应8-1 MgO 和SiO2 固相反应生成Mg 2SiO4,反应时扩散离子是什么?写出界面反应方程. 8-2 MoO3 和CaCO3 反应时, 反应机理受到CaCO3 颗粒大小的影响. MoO3 : 当CaCO3 =1:1,MoO3 的粒径r1 为0.036mm,CaCO3 的粒径r2 为0.13mm 时,反应是扩散控制的;而当CaCO3 :MoO3=15:1,r2<0.03 时,反应由升华控制, 试解释这种现象. 8-3 试比较杨德方程和金斯特林格方程的优缺点及其适用条件. 8-4 当测量氧化铝-水化物的分解速率时,发现在等温试验期间,质量损失随时间线性增加到50%左右,超过50%时,质量损失的速率就小于线性规律.线性等温速率随温度指数地增加,温度从451℃增大到493℃时速率增大10 倍,试计算激活能,并说明这是一个扩散控制的反应?还是一般反应或是界面控制的反应. 8-5 1 平均粒径为1μm 的MgO 粉料与Al2O3 粉料以1: 摩尔比配料并均匀混合. 将原料在1300℃恒温3600h 后,有0.3mol 的粉料发生反应生成Mg Al2O4, 该固相反应为扩散控制的反应.试求在300h 后,反应完成的摩尔分数以及反应全部完成所需的时间. 答:扩散离子是Mg2+和Si4+,界面反应方程为: g 2+ +SiO4 Mg2SiO4+Si4+ Si4++4MgO Mg2SiO4+2 Mg2+ 2.答:当MoO3 的粒径r1 为0.036mm,CaCO3 的粒径r2 为0.13mm 时, CaCO3 颗粒大于MoO3,反应由扩散控制,反应速率随着CaCO3 颗粒度减小而加速,当r2<r1 时存在过量CaCO3,由于产物层变薄,扩散阻力减小,反应由MoO3 粒径升华控制, 并随着MoO3 粒径减小而加剧. 3.答:略. 4.答:1):. 由阿累尼乌斯公式: K=Aexp(-Q/RT)得: Q=R In k2/k1 (T1T2/T2-T1)=In10 *R*776*724/(493-451)=257.189KJ/mol R 故反应激活能为257.189kJ/mol 2):此反应为热分解反应,反应是在反应物与产物层的界面处进行的.由题中所述,反应进行到一定程度后质量损失速率小于线性规律,由此可推测该反应由扩散控制, 即后期由于反应物表层已被先前生成的大量产物层所包裹,导致新产生的气体无法扩散到外界去,从而减缓反应进行. 5.答:由于该固相反应为扩散控制反应,且粉料可视为均状大小球形,故用金斯特林格方程得: 1-2/3G-(1-G) 2/3 =kt G1=0.3/(1+1)=0.15 代入得K=7.45×10 -7 由题中所给条件;t1=3600h 所以当t2=300h 时,G2=0.045 令G=1,则T=1/3k=4.47×10 h 5第九章相变9-1 名词解释: 一级相变,二级相变,玻璃析晶,玻璃分相,均态成核,非均态成核,马氏体相变,亚稳分解,不稳分解. 9-2 为什么成核生长机理的相变过程需要有一定的过冷或过热, 相变才能发生, 在什么情况下需要过冷, 什么情况下需要过热?一般物质具有的最大成核速率的过冷度应该如何求得? 9-3 当一个球形晶核在液态中形成时,其自由能的变化△G=4πr2γ+ 4/3 r3△GV.式中r 为球形晶核的半径;γ为液态中晶核的表面能;△GV 为单位体积晶核形成时释放的体积自由能,求临界半径rk 和临界核化自由能△Gk. 8-4 如果液态中形成一个边长为a 的立方体晶核时, 其自由能△G 将写出什么形式?求出此时晶核的临界立方体边长ak 和临界核化自由能△Gk, 并比较球状晶核时,哪一种形状的△G 值更大,为什么? 9-5由 A 向 B 转变的相变过程中, 单位体积能变化△GV 在1000℃时为-419J/cm3, 在900℃时为-2093J/cm3,设A-B 间界面能为5×10-5J/ cm3,求: (1) (2) 在900℃和1000℃时的临界半径; 在1000℃进行相变时所需的能量. 9-6 试从热力学,动力学和形貌等方面比较亚稳分解和不稳分解这两种分相过程的特点. 9-9 某物质从熔体析晶,当时间分别为1s 和5s 时,测得晶相的体积分数分别为0.1%与11.8%,试用Vβ/V=1-exp(-Ktn)式计算Avrami 指数及其速率常数K. 9-10 如果直径为20μm 的液滴,测得成核速率IV=10 S cm ,如果锗能够过冷227℃,试计算锗的晶-液界面能?(TM=1231K,△H=34.8kJ/mol,ρ =5.35g/cm ) 9-11 举例说明相变理论在科学研究和生产实际中的应用. 1. 2. 答:略答: ,当,过热,过冷度为扩散活化能. 3. 4. 答: 答: , , ,显然立方体晶核形成, ,球形晶核较大. ,过冷;当, 3 -1 -1 -3 5. 答:900℃, ×10-17J =4.778, 1000℃, =2.387nm, 6. 9. 10. 11. 答:略答:n=3,K=10-3 答: 答:略第十章烧结过程10-1 名词解释: 熔融温度,烧结温度,烧结,烧成,液相烧结,固相烧结,晶粒生长,二次再结晶,晶粒极限尺寸,晶粒平均尺寸. 10-2 烧结的模型主要有哪几种?各适用于哪些典型的传质过程? 10-3 若固-气界面能为0.1J/m ,如果用直径为1μm 的粒子组成压块的体积为1cm ,试计算由烧结推动力而产生的能量是多少? 10-4 设有粉料粒度为5μm,若经2h 烧结后,x/r=0.1.如果不考虑晶粒的生长,若烧结至x/r=0.2.并分别通过蒸发-凝聚;体积扩散;粘性流动; 溶解-沉淀传质,则各需要多少时间?若烧结8h,则各传质过程的颈部增长x/r 又是多少? 10-5 如上题粉料的粒度改为16μm,烧结至x/r=0.2,各传质需要多少时间? 若烧结时间为8h,各个过程的x/r 又是多少?从两题计算的结果,讨论粒度与烧结时间对四种传质过程的影响程度? 10-6 下列过程中, 哪些能使烧结强度增加, 而不产生致密化过程?试说明理由.(1) 蒸发-凝聚(2)体积扩散(3)粘性流动(4)晶界扩散(5)表面扩散(6)溶解-沉淀. 10-7 制造透明Al2O3 材料时, 原始粉料粒度为2μm, 烧结至最高温度保温0.5h, 测得晶粒尺寸10μm,试问若保温时间为2h,晶粒尺寸多大?为抑制晶粒生长加入0.1%MgO,此时若保温时间为2h,晶粒尺寸又有多大? 10-8 晶界遇到夹杂物时会出现几种情况,从实现致密化目的考虑,晶界应该如何移动?怎样控制? 10-9 在烧结时,晶粒生长能够促进坯体致密化吗?晶粒生长会影响烧结速率吗?试说明之. 10-10 影响烧结的因素有哪些?最易控制的因素是哪几个? 1.答:名词解释略. 2.答:略. 3.答:烧结推动力而产生的能量是0.6J.提示,先算出粒子个数,再算出气固界面消失的面积. 4.答:根据查得各传质方式公式可得: 时间分别为16h,64h,8h,128h,若只烧结8h,则X/R 分别为0.1×41/3,0.1×4 1/5,0.2,0.1×41/6. 5.答:略6.答:略. 7.答:略3 2。
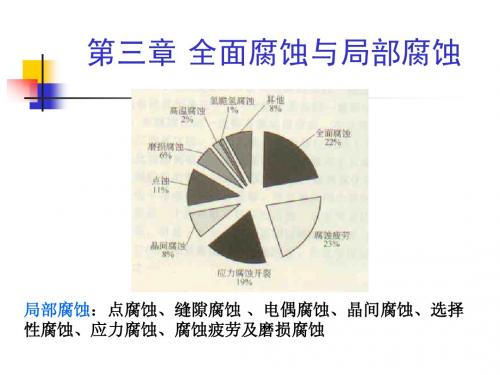
第三章 局部腐蚀
18 Cr) 缝隙 CPT Mo
流动状态
在流动介质中金属不容易发生孔蚀, 在流动介质中金属不容易发生孔蚀, 而在停滞液体中容易发生, 而在停滞液体中容易发生,这是因为介质 流动有利于消除溶液的不均匀性,所以输 流动有利于消除溶液的不均匀性, 送海水的不锈钢泵在停运期间应将泵内海 水排尽。 水排尽。
在钝态金属表面上,蚀孔优先在一些敏感位置 在钝态金属表面上,蚀孔优先在一些敏感位置 上形成,这些敏感位置(即腐蚀活性点)包括 包括: 上形成,这些敏感位置 即腐蚀活性点 包括: 晶界(特别是有碳化物析出的晶界 特别是有碳化物析出的晶界), 晶界 特别是有碳化物析出的晶界 ,晶格缺陷 。 特别是硫化物 硫化物,如 非金属夹杂 特别是硫化物 如FeS、MnS,是 、 , 最为敏感的活性点。 最为敏感的活性点。 钝化膜的薄弱点 如位错露头、划伤等)。 的薄弱点(如位错露头 钝化膜的薄弱点 如位错露头、划伤等 。 孕育期: 孕育期:1/τ=K[Cl-]
几
25-13-1MO-N
与 海 水 温 度 的 关 系
种 不 锈 钢 的 孔 蚀 电 位
( ( ( ( 系 ) ) ) )
蚀 1.6 电 位 (伏 1.2 ) 0.8
孔
孔蚀临界Cl 离子浓度与 孔蚀临界Cl-离子浓度与Cr 含量的关系
[H+]=iN 孔蚀临界Cl 孔蚀临界 -离 铬含量(%) 铬含量( ) 子浓度(N) 子浓度( )
缝隙形成
机器和设备上的结构缝隙 机器和设备上的结构缝隙 结构 固体沉积 泥沙 腐蚀产物等)形成的缝 固体沉积(泥沙、腐蚀产物等 形成的缝 沉积 泥沙、 隙。 金属表面的保护模 如瓷漆 清漆、 如瓷漆、 金属表面的保护模 (如瓷漆、清漆、磷 化层、金属涂层)与金属基体之间形成的 化层、金属涂层 与金属基体之间形成的 缝隙。 缝隙。
材料腐蚀与防护 第三章

在一定的敏化温度下,随着加热时间的增加,钢 的晶间腐蚀倾向愈严重,但是加热时间过长,晶间腐 蚀倾向又复降低,甚至完全消除。
原因是在一定敏化温度下,随加热时时间过长,
析出的碳化物颗粒逐渐聚集长大,晶界贫铬区不再连 续,而且由于Cr在晶粒和晶界上的浓度差较大,C在 晶粒和晶界上的浓度差较小,随着回火时间的延长Cr 的扩散最终将超过C的扩散。通过Cr的扩散使晶粒内 部与晶界上的铬浓度均匀,结果晶界耐蚀性又上升, 晶间腐蚀敏感性减小。
(4)点蚀的孕育期
从金属与溶液接触一直到点蚀刚刚产生,这段时间称作 孕育期,孕育期随氯离子浓度增大及电极电位升高而缩短。
二: 点腐蚀机理
点蚀可分为两个阶段,即蚀孔成核(发生)和蚀孔生长(发展).
1蚀孔成核(发生)
目前通常有二种学说,即钝化膜破坏理论和吸附理论。
钝化膜破坏理论:
这种说法认为当腐蚀性阴离子(如氯离子)在不锈钢钝化膜上 吸附后,由于氯离子半径小而穿过纯化膜,氯离子进入膜内后 “污染了氧化膜”,产生了强烈的感应离子导电,于是此膜在 一定点上变得能够维持高的电流密度,并能使阳离子杂乱移动 而活跃起来,当膜—溶液界面电场达到其一临界值时,就发生 点蚀。
如不锈钢易在含卤族元素阴离子Cl-、Br - 、I –中发生, 而铜则对SO4 2-更敏感。
当溶液中含有FeCl 3、CuCl2为代表的二价以上重金 属氯化物时,由于金属离子强烈的氧化作用,将大大促 进点蚀的形成和发展。
(2)介质浓度
以卤族离子为例,一般认为,只有当卤族离子 达到一定浓度才发生点蚀。可以把产生点蚀的最 小浓度作为评定点蚀趋势的一个参量。
这一阶段的腐蚀主要是介质状态的不均匀性引起 的。
3.3 点腐蚀 点腐蚀(孔蚀)是一种腐蚀集中于金属表面的很小范 围内,并深入到金属内部的蚀孔状腐蚀形态,一般是 直径小而深度深。
腐蚀的原理

腐蚀的原理腐蚀是指金属或合金在特定环境中受到化学或电化学作用而逐渐失去其原有性能的过程。
腐蚀是一种不可逆的过程,会导致材料的损坏和性能下降,因此对腐蚀的原理进行深入了解对于材料保护和延长使用寿命具有重要意义。
腐蚀的原理主要包括化学腐蚀和电化学腐蚀两种类型。
化学腐蚀是指金属在化学环境中与其他物质发生化学反应而导致腐蚀,例如金属与氧气发生氧化反应形成金属氧化物。
而电化学腐蚀是指金属在电解质溶液中发生的电化学反应,产生阳极和阴极两种区域,从而引发腐蚀。
化学腐蚀的原理是金属与其他物质发生化学反应,形成金属的氧化物、硫化物、氯化物等化合物,这些化合物会导致金属表面的腐蚀和破坏。
例如,铁与氧气发生氧化反应生成铁氧化物,即铁锈,导致铁制品的腐蚀。
另外,金属与酸、碱等化学物质也会发生化学反应导致腐蚀。
电化学腐蚀的原理是在电解质溶液中,金属表面会形成阳极和阴极两种区域,阳极区域发生氧化反应,而阴极区域则发生还原反应,从而引发金属表面的腐蚀。
电化学腐蚀的速度与电解质的浓度、温度、金属的组成和结构等因素密切相关。
腐蚀的原理不仅涉及化学和物理方面的知识,还与材料的结构、组织、表面状态等密切相关。
例如,金属的晶粒大小、晶界、缺陷等都会影响金属的腐蚀行为。
此外,环境因素如温度、湿度、氧气浓度等也会对腐蚀的发生和发展产生重要影响。
为了防止腐蚀的发生,可以采取一系列的防腐措施,包括表面涂层、阴极保护、合金设计、材料选择等。
通过了解腐蚀的原理,可以有针对性地选择合适的防腐措施,从而保护金属材料,延长其使用寿命。
总之,腐蚀的原理是一个复杂的过程,涉及多方面的知识。
深入了解腐蚀的原理对于材料保护和应用具有重要意义,也为我们提供了有效的防腐方法和措施。
希望通过对腐蚀原理的深入研究,能够为材料科学和工程技术的发展提供有益的参考。
[化学]第三章-电化学局部腐蚀
![[化学]第三章-电化学局部腐蚀](https://img.taocdn.com/s3/m/5fa024a769eae009591bec88.png)
⑵电化学保护:不能完全解决缝隙腐蚀问题。因为是否有 足够的电流达到缝内,以产生必须的保护电位。
⑶缓蚀剂:用磷酸盐、铬酸盐、亚硝酸盐的混合物,对钢、 黄铜、锌结构是有效的,也可再接合面上涂有缓蚀剂的油 漆。
第三节 电偶腐蚀
一、电偶腐蚀:当两种金属或合金相接触,在溶液中可以发现 在该液中电位较负的金属腐蚀速度加大,而电位较正的金属受 到保护,这种现象就是电偶腐蚀。 电动序和电偶序: 电偶腐蚀是与相互接触的金属在溶液中的电位有关,因此构 成了腐蚀原电池。接触金属的电位差为电偶腐蚀的推动力。 一般来讲,两种金属的电极电位差愈大,电偶腐蚀愈严重。 电动序:按金属元素标准电极电位高低排列成的次序表。它 是从热力学公式计算出来的,此电位是指金属在该金属盐 (活度为1)的溶液中的平衡电位。而实际情况下,金属常不 是纯金属,而是合金,有的还带有膜。而溶液也不可能刚好 是该金属离子,且活度为1。
电偶序:是实用金属和合金在具体使用介质中的电位(即 非平衡电位)排列次序表。
无论电动序或电偶序都只能反映一个腐蚀倾向,不能表 示出实际的腐蚀速度。而有时某些金属在具体介质中双方 电位可以发生逆转。所以电动序和电偶序都有一定局限性。
图4-4说明电偶腐蚀关系的极化示意图
电偶腐蚀原理
金属A、B在酸性溶液中相接触,金属A的腐蚀电位为EA, 自腐蚀电流为iA,金属B的腐蚀电位为EB,自腐蚀电流为iB, iA与iB是由阳极反应M→Mn++ne(曲线1)和阴极反应 2H++2e→H2 (曲线2)的理论极化曲线的交点决定。曲线4
二、晶间腐蚀机理:晶间腐蚀的产生必须有两个基本因素:
一是内因,即金属或合金本身晶粒、晶界化学成分的差异, 导致电化学性质不同,从而使金属具有晶间腐蚀倾向:
第三章磺化反应

止生成的二磺酸过多,一般采用向被磺化物中缓慢加入磺 化剂的方法。
精品资料
3.2 磺化方法(fāngfǎ)
二、三氧化硫(sān yǎnɡ huà liú)磺化 法
三氧化硫(sān yǎnɡ huà liú)活性大, 反应能力强,且不生成水,不需大大地 过量,加入量接近理论量即可进行磺化 反应。
温度除对反应速度有影响外,还会影响 磺酸基的引入位置。
精品资料
3.1 磺化反应(fǎnyìng)的基本 原理
精品资料
3.1 磺化反应(fǎnyìng)的基 本原理
萘磺化时,温度对磺化产物的比例(bǐlì)亦有影响
由表可见,低温有利于磺酸基进入α位,高温则有利于磺酸基进入β位
精品资料
3.1 磺化反应(fǎnyìng)的基 本原理
化法和氧磺化法。 烷烃的氯磺化和氧磺化就是在氯或氧的作用下,
二氧化硫与烷烃化合的反应,二者均为自由基的 链式反应。 氯磺化的反应式为
精品资料
3.1 磺化反应(fǎnyìng)的基本 原理
烷烃的氧磺化也是在紫外光照射下激发(jīfā)的自 由基反应。如
生成的过氧化烷基磺酸与二氧化硫和水反应生成 烷基磺酸。
精品资料
➢其它(qítā)磺化剂
氨基磺酸(H2NSO3H)作为磺化剂主要用 于醇的硫酸化,是一种稳定的不吸湿的固体。一 般(yībān)在高温无水介质中使用。
二氧化硫加氯气或加臭氧的混合物可用作烷烃的磺 化,在紫外光下进行磺氯化或磺氧化。
亚硫酸氢盐可以用于与某些烯烃化合物发生加 成磺化。
精品资料
其他强磺化剂磺化时。或者浓度和温度 较高时,极易生成砜等副产物。加入醋 酸可抑制(yìzhì)砜的生成,硫酸钠和苯磺 酸钠也有同样作用。在羟基蒽醌的磺化 中往往加入硼酸,使其与游离酚的羟基 反应形成硼酸酯.以阻止氧化副反应的 发生。
咪唑啉缓蚀剂的研究

摘要在许多化工生产中都要用到盐酸,或含氯化合物在适当的条件下也会生成盐酸,因此盐酸对化工设备引起的腐蚀是严重的、常见的。
阻止金属腐蚀的方法有很多种,但有机缓蚀剂在抑制金属腐蚀上具有经济、高效、环保等优点,被广泛应用于化学清洗、工业用水、机械设备等工业领域,并成为工业生产中不可缺少的防腐蚀材料。
大多数有机缓蚀剂为吸附型缓蚀剂,它们会在金属表面吸附时会形成保护膜,可阻碍腐蚀介质与金属表面的接触,从而达到减缓金属腐蚀的目的。
然而,有关缓蚀剂的缓蚀机理仍需深入研究,以期为设计开发新型缓蚀剂提供理论指导。
本论文以油酸咪唑啉为缓蚀剂,盐酸为腐蚀剂,研究碳钢在不同条件下制备的油酸咪唑啉中的腐蚀效果。
同样的钢片在缓蚀剂中,改变条件,诸如:反应温度、缓蚀剂浓度、腐蚀剂浓度等,可以测出缓蚀剂能发挥出更好的缓蚀效果的条件,以帮助工业生产节约更多的缓蚀剂购买费用以及设备保养、维修费用。
经实验测定,合成咪唑啉缓蚀剂的最佳操作条件为反应温度150℃,反应时间2.5小时,胺酸比1.2:1。
测定咪唑啉缓蚀剂缓蚀效果的条件为在pH值为6的水中,缓蚀剂加入量20mg/L,最大缓蚀率可达91.86%。
在柴油中添加油溶性咪唑啉20mg/L时,最大缓蚀率为94.78%。
关键词:咪唑啉;腐蚀速度;缓蚀率IAbstractHydrochloric acid was used in many chemical productions. Or chlorine- containing compound under the properly conditions will generate hydrochloric acid. So, the corrosion of chemical equipment caused by hydrochloric acid is serious, common. There are many ways to prevent metal from corrosion, but as an economic and effective technique to inhibit corrosion, organic corrosion inhibitor has been widely applied in various industrial departments, such as chemical cleaning, industrial water, mechanical equipment, which has become an indispensable industrial anti- corrosion material. Most organic corrosion can adsorb onto the metal surface and form a protective film, which block corrosive medium diffusion to metal surface, and thus slow down corrosion rate. However, the inhibition mechanism of inhibitor is still need to further research in order to guide designing newly-type inhibitor.In this paper, Oleic acid imidazoline is used to as a corrosion inhibitor and hydrochloric acid as etchant to make a study of carbon steel in oleic imidazoline corrosion the corrosion effectiveness which is prepared under the different conditions. At the same time, change the reaction conditions, such as: reaction temperature, concentration of the inhibitor, concentration of the etchant, and so on. This will help measure the inhibitors under which conditions can play a better inhibition effectiveness. In order to help industrial production to save more puechase costs of the inhibitor and the maintenance, maintenance costs of the equipment.The result shows that the best operating conditions of prepared imidazoline are the ratio of amic amine to oleic acid is 1.2:1, the reaction temperature is 150℃, the reaction time is 2.5h from the experiment. Determination of the inhibition efficiency for imidazoline corrosion inhibitors at pH 6 in water, corrosion inhibitor dosage 20mg/ L, the maximum inhibition efficiency can be achieved 91.86%. Added to the diesel oil-soluble imidazoline 20mg/L, the maximum inhibition efficiency can be achieved 94.78%.Keywords: Imidazoline; Corrosion velocity; Inhibition efficiencyII目录摘要 (I)ABSTRACT ................................................................................................................. I I 目录 ......................................................................................................................... I II 第1章引言 .. (1)1.1盐酸腐蚀简介 (1)1.1.1盐酸的腐蚀机理 (1)1.1.2盐酸腐蚀影响因素 (1)1.2缓蚀剂 (2)1.2.1缓蚀剂的概念及分类 (2)1.2.2缓蚀剂的发展历程 (4)1.2.3国内外研究现状 (4)1.2.4缓蚀剂的发展趋势 (6)1.3咪唑啉类缓蚀剂 (6)1.3.1咪唑啉类缓蚀剂的结构及特性 (6)1.3.2咪唑啉类缓蚀剂的分类 (7)1.3.3 咪唑啉及其衍生物的合成 (7)1.3.4咪唑啉及其衍生物的作用机理 (8)1.3.5分子结构因素影响 (10)1.3.6咪唑啉及其衍生物在合成过程中需要注意的问题 (13)第2章实验部分 (15)2.1实验原理 (15)2.2实验原料及仪器设备 (15)2.2.1实验原料及试剂 (15)2.2.2实验仪器及设备 (16)2.3实验操作步骤 (18)2.3.1实验方案 (18)2.3.2实验具体操作过程 (18)2.4分析方法 (19)III2.5产品收率与缓蚀率的计算 (19)第3章实验数据及讨论 (21)3.1咪唑啉缓蚀剂的合成 (21)3.1.1反应温度的影响 (22)3.1.2胺酸摩尔比的影响 (22)3.1.3反应时间的影响 (23)3.1.4带水剂的影响 (24)3.2咪唑啉缓蚀剂缓蚀曲线分析 (25)第4章结论 (29)参考文献 (30)致谢 (32)IV第1章引言1.1盐酸腐蚀简介盐酸在现代化工生产中应用十分广泛,用于如:稀有金属的湿法冶金、有机合成、漂染工业、金属加工、食品工业、无机药品及有机药品的生产等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
蒸馏水、湿大气、H3S溶液、ClNaOH、Cl-、F、Br、海水、工业及海洋大气、H2S溶液、H2SO4、 HNO3、氨溶液、(NH4)H2PO4 Cl-、海水、有机氯化合、湿的氯化镁绝缘物、F-、Br-、H2S 溶液、连多硫酸、硫酸、锅炉水、含氯化物的冷凝水气、 高温高压含氧高纯水
NaCl+H2O2、NaCl溶液、大气、海水、CaCl2、 NH4Cl、COCl2溶液NaCl、KCl、MgCl2、 NaCl+NaHCO3、NaCl+H2O2
极的裂纹内部与大阴极的金属表面构成腐蚀电池,由于活性阴
离子(如Cl—)进入形成闭塞电池的裂纹或蚀坑内部,使浓缩的 电解质溶液水解而被酸化,促使裂纹尖端的阳极快速溶解,在 应力作用下使裂纹不断扩展,直至破裂。
所谓“活性途径”通常多半是晶粒边界、塑性变形引起
的滑移带以及金属间化合物、沉淀相,或者由于应变引起表
左图是处理工作压力为1.8MPa,介质为
H2S溶液的塔设备入孔衬里结构。由于不锈钢
衬里与高颈法兰内壁贴合不好,致使局部有
间隙处产生过高的局部应力,在介质腐蚀的
共同作用下平行轴线位置出现裂纹。后来改 用不锈钢衬里,在衬筒两端焊接时,由于未 待第一道焊缝完全冷却就焊第二道,两道焊 缝收缩时间重叠,造成衬筒过大的轴向应力,
低碳钢 低合金钢 高强度钢 马氏体及铁素不锈钢 奥氏体不锈钢
铝 及 铝 合 金 铜 及 铜 合 金 镍 及 镍 合 金 Al-Mg Al-Cu Al-Cu-Mg Al-Mg-Zn Al-Zn-Mg-Mn(cu) Al-Zn-Cu
NaOH溶液、NaOH+Na2SiO3溶液、NO—溶液
NO-3溶液、NCN溶液、H2S溶液、Na3PO4、HAC溶液、NH4CNS溶液、液 氨(水<0.2%)碳酸盐和重碳溶液湿的CO-CO2-空气、海洋大气、 工业大气、浓硝酸、硝酸和硫酸混合物
小阳极/大阴极的活化-钝化电池体系,使点蚀急速发展。
易钝化的金属在含有活性阴离子(最常见的是 Cl-)的介质中,最容易发生孔蚀。孔蚀的过程大 体上有蚀孔的形成与成长两个阶段。
孔蚀的防止方法
1、主要从材料上考虑如何降低有害杂质的含量 和加入适量的能提高抗孔蚀能力的合金元素; 2、改善热处理制度,或者设法降低介质中尤其 是卤素离子的浓度; 3、结构设计时注意消除死区,防止溶液中有害 物质的浓缩。此外,也可以采用阴极保护。
第二节
表面状态与几何因素
不适合的表面状态和几何构形还会引起孔蚀、缝隙腐蚀以及
浓差电池腐蚀等等。 实际上许多工程结构发生的应力腐蚀、疲劳腐蚀和磨损腐蚀, 也是由于几何形状设计不合理造成的,但它们的破坏本质上是力 学因素与腐蚀环境共同作用的结果,这些已在上一节进行了讨论。
孔蚀
又叫坑蚀,俗称点蚀、小孔腐蚀,它只发生在金属表面的局部地
氧的浓度差所引起的,因此就用浓差腐蚀的概念来解释这类腐蚀形态。
金属的腐蚀与防护
教学课件
石油工程学院海工教研室
第三章
影响腐蚀的构因素
腐蚀过程总是从材料与介质界面上开始的,因此任何可
能引起材料或介质特性改变的因素都会使整个腐蚀进展发生 变化。仅集中在金属表面局部地区进行,其余大部分地区腐 蚀很微弱,甚至几乎不腐蚀,这一类的腐蚀称为局部腐蚀。
局部腐蚀与全面腐蚀具有不同的特征。后者在材料表面
Cu Cu-Zn-(Sn、Al、Pb、Mn) Cu-Ni(<33%)
Ni(99%) Ni-Cu-Fe(76-16-7) Ni-Cu(66-32)
常用材料可能产生应力腐蚀破裂的环境
钛及钛合金
铅
醋酸铝+硝酸、大气、土壤
3.应力腐蚀破裂速度与裂纹形貌 金属在无裂纹、无蚀坑或缺陷的情况下,SCC过程可分为三个阶段。 第一阶段为腐蚀引起裂纹或蚀坑的阶段,也即导致应力 集中的裂纹源生核孕育阶段,常把相应的这一阶段时间称为潜 伏期或诱导期。接着为裂纹扩展阶段,即由裂纹源或蚀坑发展 到单位面积所能承受最大载荷的所谓极限应力值时的阶段。最 后是失稳纯力学的裂纹扩展阶段,即为破裂期。第一阶段受应 力影响很小,时间长,约占破裂总时间的90%,后两阶段仅占 总破裂时间的10%。 应力腐蚀裂纹形态 晶间型、穿晶型和混合型
湍流腐蚀、空泡腐蚀、微振腐蚀等几种形式。
化工生产装置中最常见的是前两种。 湍流腐蚀是流体速度达到湍流状态而导致加速金属腐蚀的一种腐 蚀形式。 空泡腐蚀又称穴蚀或汽蚀。它是由于腐蚀介质与金属构件作高速 相对运动时,气泡在金属表面反复形成和崩溃而引起金属破坏
的一种特殊腐蚀形态。
微振腐蚀:由于两个接触面间相对反复微小滑动而产生的磨损, 对轴承而言,是在滚道面和滚动体的接触部分上产生。 为了避免或减缓磨损腐蚀,最有效的办法是合理的结构设计与正 确选择材料。结构设计时,应尽可能使几何形状的变化不致产生涡流、 湍流。选择能形成保护性好的表面膜的材料,以及提高材料的硬度, 可以增强抗磨损腐蚀的能力。 此外,采用适当的涂层或阴极保护也能减轻磨损腐蚀。
面膜的局部破裂。当有较大应力集中时,会使这些活性途径 处进一步产生变形,形成新的活性阳极。 电化学阳极溶解理论已被合金的阴极极化所证实,因
为采用阴极保护可以抑制合金裂纹的产生和发展,如果取消
阴极保护,裂纹又继续扩展。
5.防止或减轻应力腐蚀的途径 影响SCC的因素有环境、应力和冶金三个方面,因此,有效 的防止方法就是消除这三个方面一切有害的因素。对于一定的材 料来说,主要是从控制环境条件和消除应力两方面采取措施。在 实际应用中控制环境有许多困难 ,比较有效而广泛应用的方法是
混合型是以一种形态为主,支缝中出现另一种形态。几 种裂纹形态的示意图见图3-5。不同的金属—环境体系,将出 现不同的裂纹形态。
图3-5 裂纹形态的主要模式 (a)晶间裂纹;(b)穿晶裂纹;(c)混合型裂纹
4.应力腐蚀机理
由于影响SCC的因素众多而复杂,对于各种金属—环境体 系,目前要提出一个统一的理论尚有困难。现在解释SCC机理的
的断裂称为疲劳断裂。由于腐蚀介质和变动负荷联合作用 而引起金属的断裂破坏。
1、腐蚀疲劳的产生条件与应力腐蚀比较,它没有特定的腐蚀介质
的限定,也就是说,在任何腐蚀环境中都可能发生。
2、从撕裂特征来看,应力腐蚀裂纹既可为穿晶型,也可能为晶间 型,且裂纹分枝多,呈树根状。而腐蚀疲劳裂纹多为穿晶型,裂纹分 支亦较少。它所产生的裂纹数量往往比纯力学疲劳的多得多。 3、从破坏的断面来看,纯力学疲劳破坏的断面大部分是光滑的, 小部分是粗糙面,呈现一些结晶形状。腐蚀疲劳破裂的断面大部分被 腐蚀产物所覆盖,小部分呈粗糙的碎裂状。
区。粗糙表面往往不容易形成连续而完整的保护膜,在膜缺陷处,容易 产生孔蚀;一旦形成了蚀孔,如果存在力学因素的作用,就会诱发应力 腐蚀或疲劳腐蚀裂纹。孔蚀时,虽然金属失重不大,但由于腐蚀集中在 某些点、坑上,阳极面积很小,因而有很高的腐蚀速度;加之检查蚀孔
比较困难,因为多数蚀孔很小,通常又被腐蚀产物所遮盖,直至设备腐
NH3气及溶液 NH3气溶液、含NH3大气、FeCl3、Cu(NO3)2、KCl、 K2CrO7、KMnO4、湿SO2、湿CO2、HNO3、胺、HgCl2
NaOH、KOH、氟硅酸、硫、NaNO3 NaOH、Na2S、HF(蒸气及无氧溶液) 、高温水(>35º C) NaOH及KOH(熔态及浓溶液)、MgCl2、NaNO3、铬酸、HF(蒸气 及无氧溶液)、有机氯化物 红发烟硝酸、Na2O4(含O2、不含NO、24~74℃)HCl、Cl-、海水、 甲醇(溶液蒸气)、三氧乙烯、CCl4
腐蚀疲劳过程比较复杂,因此关于腐蚀疲劳的机理至今尚无统 一的认识。其中有一种观点认为:腐蚀疲劳是一个力学—电化学过程。
腐蚀疲劳的防护方法有各种途径,提高金属或合金的抗拉强度
对改善纯力学疲劳是有利的,但对腐蚀疲劳却反而有害。最为有效的
办法是降低部件的应力,这可以通过改变设计和正确的热处理予以改
善。
三、磨损腐蚀 磨损腐蚀 腐蚀性流体与金属构件以较高速度作相对运 动而引起金属的腐蚀损坏。 磨损腐蚀
缓。
材
料
环
境
产生SCC的另一重要条件是环 境因素(包括腐蚀介质性质、浓度、 温度),对于某种材料其对应的环境 条件是特定的,也就是说只有在一 定的材料和一定环境的组合情况下 才能发生这类腐蚀破坏。最早发现 的这种特定组合为数不多,例如: “黄铜-氨溶液”、“奥氏体不锈钢 -C1—溶液”、“碳钢-OH—溶液”等。 随着对SCC研究的深入,发现这种组 合不断扩大。表3-1列出了一些工程 上常用材料可能产生SCC的环境介质。
消除或降低应力值。
如何消除或降低应力值?
(1)降低设计应力,使最大有效应力或应力强度降低到临界值 以下。
(2)合理设计与加工减少局部应力集中。
(3)采用合理的热处理方法消除残余应力,或改善合金的组织 结构以降低对SCC的敏感性。
(4)其他方法:合理选材。
二、腐蚀疲劳
腐蚀疲劳
金属构件在变动负荷作用下,经过一定周期后所发生
学说很多,这些理论都只能解释部分实验现象,并且带有不同
学科的侧重点,但是对于裂纹的发展和断裂,认为与化学因素 及力学因素密切相关的观点是一致的。下面仅对电化学阳极溶 解理论作扼要介绍。
电化学阳极溶解理论的论点 认为合金中存在一条阳极溶解的“活性途径”,腐蚀沿这 些途径优先进行,阳极侵蚀处就形成狭小的裂纹或蚀坑。小阳
径。
第三章 影响腐蚀的结构因素
第一节 第二节 第三节 第四节
力学因素 表面状态与几何因素 异种金属组合因素 焊接因素
第一节
力学因素
随着机械设备结构上存在或外加不同性质的应 力如:拉、交变、剪应力,在与腐蚀介质共同作用下, 将分别产生应力腐蚀、腐蚀疲劳、磨损腐蚀,它们的 腐蚀特征和机理各不相同。
2.应力腐蚀产生条件
应力腐蚀是应力与 腐蚀介质综合作用的结 果。其中应力的性质必 须是拉应力,而压应力 的存在不仅不会引起 SCC,甚至可以使之延
