生物实验报告-坐骨神经腓肠肌标本制备
实验02 坐骨神经-腓肠肌标本的制备.

实验二 坐骨神经-腓肠肌标本的制备
[实验目的与要求]
1.学习蛙类动物单毁髓与双毁髓的方法。 2.学习并掌握蛙类坐骨神经-腓肠肌标本以及腓
肠肌的制备方法。 3.了解电刺激的极性法则。
[实验动物与器材]
蟾蜍,常用的手术器械(手术剪、手术镊、手术刀、 金冠剪、眼科剪、眼科镊、毁髓针和玻璃分针) , 解剖盘,蛙板,铜锌弓,培养皿,污物缸步骤]
1.将蟾蜍单毁髓和双毁髓 2.制备坐骨神经-腓肠肌标本 ①先制备后肢标本 ②分离两后肢 ③分离坐骨神经 ④游离腓肠肌 ⑤分离股骨头或胫腓骨头 ⑥检验标本
[实验结果]
你制备的坐骨神经-腓肠肌标本机能正常吗?如 何检验标本的机能?
[分析讨论] 如何保持坐骨神经-腓肠肌标本的正常机能? [结论]
[实验注意事项]
1.毁随要彻底;毁髓时不要将蟾蜍对着其他同学,
防止刺破的耳后腺毒液射入其他同学眼中。 2.操作过程中不可将剥皮后的标本同皮肤、内脏等
弃物放在一起。 3.制作标本的过程中要经常用任氏液湿润标本。 4.分离神经时,不能过度牵拉或用手术器械夹持神
经。
[思考题]
剥去皮肤的后肢能用自来水冲洗么,为什么?
坐骨神经腓肠肌标本制备实验结论

坐骨神经腓肠肌标本制备实验结论一、实验目的二、实验原理三、实验步骤四、实验结果五、实验结论一、实验目的本次实验的主要目的是通过坐骨神经腓肠肌标本制备,了解人体肌肉组织的结构和特点。
同时,通过对标本制备过程中各个步骤的操作,掌握标本制备技能和方法。
二、实验原理1. 坐骨神经腓肠肌标本制备原理坐骨神经腓肠肌标本制备是指将动物或人体组织切割成薄片并进行染色处理,使其能够在显微镜下观察。
在这个过程中,需要进行以下几个步骤:(1)取样:从动物或人体中取出需要观察的组织样品。
(2)固定:将组织样品放入固定液中进行固定处理。
(3)包埋:将固定后的组织样品放入包埋剂中进行包埋处理。
(4)切片:将包埋后的组织样品切成薄片。
(5)染色:将切片进行染色处理,使其能够在显微镜下观察。
2. 坐骨神经腓肠肌结构原理坐骨神经腓肠肌是人体下肢的一部分,由坐骨神经支配。
它主要由三个部分组成:大腿后侧的半膜状肌、半腱状肌和小腿后侧的胫长伸肌。
这三个部分都是由肌纤维束组成的,每个束内又包含有许多个单独的肌纤维。
三、实验步骤1. 取样:从动物或人体中取出需要观察的组织样品。
2. 固定:将组织样品放入10%福尔马林液中进行固定处理,固定时间为24小时。
3. 包埋:将固定后的组织样品放入包埋剂中进行包埋处理,包埋时间为48小时。
4. 切片:将包埋后的组织样品切成厚度为5微米左右的薄片。
5. 染色:将切片进行染色处理,常用染色方法有HE染色法和Masson染色法等。
本次实验采用HE染色法进行染色处理。
6. 封片:将染好色的切片放入玻璃片上,加上封片胶,用玻璃片盖住,使其能够在显微镜下观察。
四、实验结果经过以上步骤的操作,制备出了坐骨神经腓肠肌标本。
在显微镜下观察到了肌纤维束组成的三个部分:半膜状肌、半腱状肌和胫长伸肌。
每个束内又包含有许多个单独的肌纤维。
五、实验结论通过本次实验,我们了解到了坐骨神经腓肠肌标本制备的基本步骤和操作方法,并且通过观察标本结构,掌握了人体肌肉组织的结构和特点。
生物实验报告-坐骨神经腓肠肌标本制备

生物实验报告-坐骨神经腓肠肌标本制备
本实验旨在通过制备坐骨神经腓肠肌标本的过程,掌握基础的组织学实验技能,同时加深对神经肌肉解剖结构的理解。
材料与方法:
材料:成年大鼠标本、无水乙醇、石蜡、光学显微镜、麻醉手套、组织取样器、组织取样盒、理化试管架等。
1.准备标本
用麻醉手套将成年大鼠净化神经集中于坐骨神经下1-2厘米范围内,然后将腓肠肌标本从骨骼中取出。
2.固定标本
将取出的腓肠肌标本置于10%的无水乙醇中固定24小时;
3.去水
从10%、20%、30%、40%、50%、60%、70%到80%的无水乙醇渐次去除,每步时间为1小时;
4.透明
将固定去水的腓肠肌标本分别置于50%敌敌畏-乙醇溶液、70% 敌敌畏-乙醇溶液和100% 敌敌畏透明液溶液中,每步时间为2小时,至标本彻底透明。
5.包埋
取出已透明的腓肠肌标本,置于石蜡组织取样盒中,根据实验需求,选择合适的包埋方向。
6.取薄片
将石蜡包埋的腓肠肌标本取出,用微型切片机切制厚度为5微米的切片,将切片拉直后在干净的水晶片上展开。
7.染色与制成玻片
用哈里斯血液染色将切片染色,脱色后洗净水片后,在水晶片上滴几滴覆盖剂,然后用平凡玻片将组织接口反过来盖住薄片,压紧即可。
实验成果:
经过制备和染色后,我们取得了成年大鼠坐骨神经腓肠肌的标本,通过光学显微镜的观察与检测,我们发现该标本包含完整的腓肠肌结构及肌纤维分离范围。
切片上清晰可见腓肠肌内有明显的核团和细胞质呈透明状,同时染色后肌纤维呈现出红色,血管呈现出蓝色,系统性地展示了腓肠肌肌纤维和血管位置的分布情况。
结论与意义:。
坐骨神经-腓肠肌标本制备

使用轮转式切片机将组织切成薄片,调整切片厚度以满足实验要求。
染色
染色液选择
根据实验需要选择适当的染色液,如苏木素-伊红染色液 (H&E)、Masson三色染色液等。
染色过程
将切片放入染色液中,按照染色液的要求进行染色处理,以 便更好地观察组织结构和细胞形态。
03 结果观察
显微镜观察
观察神经纤维的排列和结构
结果对比
结果解释
02
03
Байду номын сангаас
结果应用
将实验结果与预期结果进行了对 比,分析了实验误差产生的原因。
对实验结果进行了详细的解释, 阐明了实验现象背后的原理和机 制。
探讨了实验结果在现实生活和生 产中的应用前景,为后续研究和 应用提供了参考。
实验改进与优化
实验方法优化
针对实验过程中存在的问题和不足,提出了 改进措施和方法,以提高实验效率和准确性 。
实验设备升级
针对实验设备的局限性和不足,提出了设备升级和 改进的建议,以提高设备的性能和稳定性。
实验流程完善
针对实验流程的缺陷和不足,提出了完善和 优化的建议,以使实验流程更加合理和高效 。
THANKS FOR WATCHING
感谢您的观看
肝素钠 葡萄糖溶液
02 实验步骤
取材
取材前准备
01
确保实验环境清洁,准备好所需器材和试剂,如手术刀、镊子、
固定液、脱水剂、包埋剂等。
选取适宜的坐骨神经-腓肠肌标本
02
选择健康、新鲜的动物,如小白鼠或大白鼠,并确保所选标本
无病变或损伤。
剥离组织
03
使用手术刀和镊子仔细剥离坐骨神经和腓肠肌周围的脂肪和结
生理学实验 坐骨神神经腓肠肌标本制备

实验一 坐骨神经腓肠肌标本制备【实验目的】掌握坐骨神经腓肠肌标本的制备技术,为以后有关实验打下基础。
【实验原理】两栖类的一些基本生命活动和生理功能与温血动物相似, 而其离体组织所需的生活条件 比较简单,易于建立、控制和掌握。
因此在实验中常用蟾蜍或蛙的坐骨神经腓肠肌标本来观 察兴奋与兴奋性的一些规律以及骨骼肌的收缩特点等。
所以坐骨神经腓肠肌标本的制备是生 理实验的一项基本操作技术。
【实验对象】蟾蜍或蛙。
【实验材料】两栖类手术器械 1套(粗剪刀、组织剪、眼科剪、组织镊、眼科镊、金属探针、玻璃 分针、蛙板)、手术线、蛙尸缸、滴管、平皿、锌铜弓、任氏液。
【实验步骤】1. 破坏脑和脊髓取蟾蜍 1 只,用自来水冲洗干净。
左手握住蟾蜍,用拇指按压背部,食指按压头部 前端使其头部前俯,右手持金属探针在头前缘沿正中线向尾端触划,所触划到的头部后 端的凹陷处,即为枕骨大孔所在部位。
在此处将金属探针垂直刺入皮肤,有突破感后再 将金属探针折向前经枕骨大孔刺入颅腔,左右搅动捣毁脑组织;然后将金属探针回抽至 枕骨大孔处,转向后刺入脊椎管,反复提插捣毁脊髓。
此时如蟾蜍的四肢松软,呼吸运 动消失,表示脑和脊髓已完全破坏,否则应按上法再行捣毁。
2. 剪除躯干上部及内脏如图 1-1 所示,在骶髂关节位置用左手将蟾蜍提起,在骶髂关节水平以上 0.5~l 厘米处用粗剪刀剪断脊柱,然后将粗剪刀尖向下深入体腔沿躯干两侧剪开皮肤,使蟾蜍 头、上肢与内脏自然下垂,将其一并剪除弃去,仅留后肢、骶骨、脊柱及紧贴于脊柱两 侧的坐骨神经。
在整个剪除过程中注意勿损伤神经。
3. 剥皮左手用组织镊夹紧或用手直接捏住脊柱断端(注意:不要夹住或接触神经),右手捏,将标本放在盛有任氏液 住其上的皮肤边缘,用力向下剥掉全部后肢皮肤(见图 1-2)的平皿中。
将手及用过的粗剪刀、组织镊等全部手术器械洗净,再进行下述步骤。
4. 分离两腿用镊子从背位夹住脊柱将标本提起,剪去向上突出的骶骨(注意勿损伤坐骨神经),然后沿正中线用粗剪刀将脊柱分为两半,并从耻骨联合中央剪开两侧大腿,然后将分离的两条腿浸于盛有任氏液的平皿中备用。
实验一坐骨神经腓肠肌标本制备.

【思考题】
1、剥去皮肤的后肢能用自来水冲洗吗?为什么?
2、金属器械碰压或损伤神经与腓肠肌,可铜弓检验标本兴奋性时,在神经和肌肉内 部发生了哪些事件?
5、刺激有几种形式?如何解释对食盐的不同处理 对肌肉收缩的影响?
蛙类坐骨神经-腓肠肌标本是研究神经冲动和肌肉收缩机 能等生理实验最常用的实验材料,制备此标本是生理实验 的一项基本但又非常重要的操作技术。
【动物、器材与试剂】(以下是每组所需 的种类和数量)
蛙或蟾蜍1只、纱布1块、毁髓针1支、眼科 镊(或尖头无齿镊)1把、手术剪1把、普 通剪刀1把、手术刀1把、玻璃板1块、蛙板 1块、培养皿1套、蛙钉2只、玻璃分针2支、 锌铜弓1支、滴管1支、细棉线30cm、酒精 灯1只、玻棒1支、解剖盘1只、任氏液至少 100mL、食盐1g。
6、游离腓肠肌 一手捏住趾端,另一手用手术镊(尖头镊)在腓肠肌跟腱下面穿线,并
用结线扎紧。提起结线,游离腓肠肌。 7、分离股骨头或胫腓骨头 如果所用动物个体小,可分离股骨头。方法是一手捏住股骨,沿膝关
节剪去股骨周围的肌肉,再用金冠剪自膝关节向前刮于净股骨上的肌 肉,保留1cm股骨头并剪断股骨。提起腓肠肌上的扎线,剪去膝关节 下部的后肢,仅保留腓肠肌与股骨的联系。
底向上,用蛙钉将标本固定在玻璃板下方的蛙板(木板或 硬泡沫塑料板)上。用玻璃分针沿脊神经向后分离坐骨神 经。股部沿腓肠肌正前方的股二头肌和半膜肌之间的肌缝, 找出坐骨神经。坐骨神经基部(即与脊神经相接的部位), 背部有一梨状肌盖住神经,用玻璃分针轻轻挑起肌肉,便 可看清下面穿行的坐骨神经。剪断(或用玻璃分针扯断)梨 状肌,完全暴露坐骨神经与其相连的脊神经再用玻璃分针 轻轻挑起神经,自前向后剪去支配腓肠肌之外的神经分支, 将坐骨神经分离至腘窝处(图4)。取一下脊柱端的蛙钉, 保留伸经发出部位的一小块脊柱骨,用金冠剪剪去其余部 分脊柱骨及肌肉,再用手术镊轻轻提起连有神经的脊柱骨 片,将神经移开股骨。
实验三 坐骨神经腓肠肌标本制备

三、动物与器材
蟾蜍、常用手术器械、蜡盘、蛙板、玻 璃针、固定针、锌铜弓或电刺激器、培 养皿、滴管、纱布、粗棉线、任氏液
四、方法与步骤
[方法与步骤] 1、双毁髓的方法 2、剥制后肢标本 3、分离两后肢 4、分离坐骨神经 5、分离股骨头 6、游离腓肠肌 7、检验标本
毁髓1 坐骨神经——腓肠肌标本2 坐骨神经——腓肠肌标本3 坐骨神经——腓肠肌标本4 坐骨神经——腓肠肌标本5
实验三坐骨神经—腓肠机标本的制 备)
一、目的要求
1.学习破坏蟾蜍脑和脊髓的方法. 2.熟悉并掌握蟾坐骨神经-腓肠肌标 本的制备
二、基本原理
腓肠肌由许多肌纤维组成,当刺激支配腓肠肌 的坐骨神经时,不同的刺激强度会引起肌肉的 不同反应,当使用阈下刺激时,不引起肌肉发 生收缩反应,而阈刺激可引起少数肌纤维发生 反应,顶刺激引起所有肌纤维发生反应,一次 单收缩可分为潜伏期,缩短期和舒张期三个时 期。当同等强度的连续阈上刺激作用时,出现 多个收缩反应的融合,称为强直收缩。
五、注意事项
1.标本不能用自来水冲洗,也不能用金 属器械碰压 2.连续刺激时间不宜过长 3.标本固定不要过度牵拉
六、作业和思考
1.如何保持标本在实验中机能正常 2.何为标本的最适刺激强度 3.实验结果说明骨骼肌有哪些生理特性 4.分析讨论肌肉发生收缩总和的条件和 机制 5.分析讨论不完全强直收缩和完全强直 收缩的条件和机制
神经肌肉标本制备

生理学实验介绍/神经肌肉标本制备
一、实验结果
坐骨神经-腓肠肌标本制备:
1.双毁髓处死牛蛙后,可见牛蛙四肢肌肉完全松弛。
2.剪断脊柱,除去前肢和内脏等后,可见牛蛙背侧明显的白色坐骨神经丛。
3.用玻璃分针把大腿背侧股二头肌和半膜肌分开,见一条粗大的坐骨神经。
4.标本制作完成后,用锌铜弓轻触坐骨神经,肌肉收缩。
触碰坐骨神经的不同部位,发现越靠近腓肠肌,肌肉收缩越迅速、灵敏。
二、分析与讨论
1.锌铜弓轻触坐骨神经引起肌肉收缩的原理
任氏液是电解质溶液,当锌铜弓刺激坐骨神经表面,形成原电池,引起接触点的动作电位。
该动作电位沿着坐骨神经传播到神经-肌肉节点,突触前膜释放递质。
该递质与突触后膜上的受体结合,使腓肠肌肌肉细胞膜去极化,最终引起肌肉收缩。
2.标本检查后的反思
用锌铜弓检查标本的兴奋性时,并不是每次都成功。
刺激越靠近腓肠肌,成功率越高。
可能有两个原因:①标本制备过程中,远离肌肉端的神经剥离较早,受到损伤。
②标本制作完成后,浸泡在任氏液的时间不够长,肌肉兴奋性不稳定。
坐骨神经-腓肠肌标本制备

第九章实验内容实验1 坐骨神经-腓肠肌标本的制备【实验目的】掌握制备坐骨神经-腓肠肌标本的操作技术,为此后有关的神经肌肉实验打下基础。
【实验原理】蛙或两栖类动物的一些基本生命活动及生理功能与温血动物近似,而且其离体组织需要的生活条件非常简单,易于控制和掌握。
因此在生理学实验中,坐骨神经-腓肠肌标本是研究神经肌肉生理最常用的对象,经常用来研究神经肌肉的兴奋性、刺激与反应的规律、肌肉收缩的特点、兴奋性的周期性变化等。
【实验器材和药品】蛙类手术器械一套(金属探针1根,粗剪刀、眼科剪刀各1把,圆头镊子、眼科镊子各1把,玻璃分针2根),蛙板和玻璃板各1块,培养皿,滴管,废物缸、锌铜弓,丝线,棉花;任氏液。
【实验对象】蟾蜍或蛙。
【实验方法和步骤】1.破坏脑和脊髓(常用的有三种方法)(1) 俯式捣毁法:是最常用的方法。
以左手持蟾蜍,将其腹面朝向手心,前肢夹在食指和中指之间固定,后肢夹在无名指和小指之间固定,并用拇指按压蟾蜍头部使之下俯30~40度角;然后右手持金属探针沿蟾蜍头部的中线下划,可触及一凹陷处即为枕骨大孔(图9-lA)。
将探针从枕骨大孔垂直刺入1~1.5mm,再向前刺入颅腔,左右搅动(可感觉到探针与颅骨壁的碰击),破坏脑组织;再将探针退回至进针处,但不拔出而是转向后方刺入椎管,破坏脊髓。
(2) 仰式捣毁法:将蟾蜍仰卧于蛙板上,拉开下颌,右手持探针在颅底两眼之间向前下刺入颅腔,用探针在颅腔内向四周捣毁脑组织,然后将探针退至粘膜下,针尖向后平行刺入椎管内以破坏脊髓。
(3) 横断脊柱后捣毁法:左手持蟾蜍,右手持粗剪刀,在两腋窝稍下横断脊柱,然后在脊柱呈白色的脊髓断面处,向上插入探针破坏脑,再向下插入探针破坏脊髓。
以上方法破坏脑和脊髓成功后,蟾蜍出现四肢(尤其是后肢)瘫软,并常有尿失禁现象。
2.剪去躯干上部及内脏用粗剪刀在两侧腋部稍下(或在骶髂关节以上1.5 ~ 2cm处)剪断脊柱(图9- 1B),用左手握住蟾蜍后肢,拇指按压骶骨,使蟾蜍头部及内脏自然下垂;避开腰骶神经丛后,右手用粗剪刀沿脊柱两侧剪开腹壁,在耻骨联合处将躯干上部及内脏剪掉,弃入废物缸内。
生物实验报告坐骨神经腓肠肌标本制备

生物实验报告姓名:班级:日期:同组者:实验序号:实验题目:坐骨神经-腓肠肌标本的制备实验目的:1.学习蛙类动物双毁髓的实验方法。
2.学习并掌握坐骨神经-腓肠肌标本的制备方法。
实验原理:两栖类动物的离体组织所需要的生活条件比较简单,易于控制和掌握。
因此在生理实验中常用蟾蜍的坐骨神经——腓肠肌标本来观察兴奋性、兴奋过程、刺激强度、刺激频率与肌肉收缩反应的一些规律以及骨骼肌的收缩特性等。
实验对象:蟾蜍实验器材:常规手术器械(粗剪刀、手术剪、眼科剪、手术镊、眼科镊)蛙板、蛙钉、探针、锌铜弓、玻璃分针、培养皿、任氏液、滴管、手术线等。
实验方法及步骤:1、破坏脑脊髓部位枕骨大孔。
如果蟾蜍四肢松软,呼吸消失,表示脑脊髓已完全破坏,否则按上述方法再进行捣毁。
2、剪去躯干上部及内脏在骶髂关节前1 cm处用金冠剪(粗剪)剪断脊柱(可在下肢前端)。
沿脊柱切口向下剪开两侧腹部皮肤至耻骨处,将头、前肢、内脏及腹部软组织全部剪掉,放于污物盘,只保留下端脊柱和下肢。
在腹侧脊柱两旁可看到腰骶神经丛。
注意切勿触及或损伤坐骨神经。
3、剥后肢皮肤左手持镊子夹住脊髓断端,右手捏住断端边缘,剥掉全部后肢皮肤。
将标本放于盛有任氏液的培养皿内,将手和手术器械洗净。
4、分离两腿用金冠剪剪去尾骨杆(骶骨),沿脊椎中线将脊柱剪开,再沿耻骨联合正中央剪开两侧大腿,使两腿完全分离(切勿伤及神经),将两腿浸于任氏液中。
5、游离坐骨神经取一后肢,腹面向上(背位),固定于蛙板上,沿脊柱侧用玻璃分针轻轻勾起坐骨神经,逐一剪去神经分支至股端。
用金冠剪剪断脊柱,只保留一小段椎骨片与坐骨神经相连。
将标本改为背面向上(腹位)固定,用镊子提起梨状肌,剪断,用玻璃分针将坐骨神经小心勾至背部。
再沿坐骨神经沟(半膜肌和股二头肌的肌间缝)分离坐骨神经。
用镊子夹住与神经相连的脊椎骨,提起神经,用眼科剪将神经分支及结缔组织膜顺序剪断,将神经一直游离到腘窝处。
6、游离腓肠肌用镊子夹住脊椎骨,将神经搭在腓肠肌上,用剪刀将膝关节周围的大腿肌肉完全剪除,用金冠剪将膝关节上方的股骨刮干净,暴露骨股并在距膝关节上1 cm处剪断,分离腓肠肌的跟腱,用线结扎,然后自跟腱的附着点剪断,提起跟腱,将腓肠肌分离至膝关节处,将小腿其余部分剪掉。
坐骨神经腓肠肌标本制备

坐骨神经-腓肠肌标本制备一、实验目的要求1、学习蛙类动物单毁髓与双毁髓的方法。
2、学习并掌握坐骨神经-腓肠肌标本及腓肠肌标本的制备方法。
3、了解电刺激的极性法则。
二、实验原理1、蛙或蟾蜍等两栖类动物的一些基本生命活动和生理功能与温血动物相似,而其离体组织生活条件易于掌握,在任氏液的浸润下,神经肌肉标本可较长时间保持生理活性。
因此,在生理学实验中常用蛙或蟾蜍坐骨神经腓肠肌离体标本来观察神经肌肉的兴奋性、兴奋过程以及骨骼肌收缩特点等。
2、细胞的静息膜电位为外正内负,电刺激可改变可兴奋细胞的膜电位差。
膜电位减小时,细胞去极化,细胞兴奋;膜电位增大时,细胞超极化,细胞兴奋性被抑制。
蘸有任氏液的锌铜弓接触活组织时,可产生沿锌片—活组织—铜片流向的电流对细胞产生刺激效应。
三、实验材料和仪器1、实验材料:牛蛙2、实验器材:手术剪、手术镊、手术刀、眼科剪、眼科镊、毁髓针、蛙板、固定针、滴管、培养皿、玻璃分针锌铜弓、污物缸、粗棉线、任氏液四、实验步骤1、洗净实验动物→毁髓→剥制后肢→分离坐骨神经→游离腓肠肌→游离股骨头→标本检验→电刺激极性法则的验证2、双毁髓一只手握住牛蛙,使其背部向上。
用拇指压住牛蛙背部,食指按压其头部前端,另一只手持毁髓针,由两眼之间沿中线向下触划,触及凹陷处即为枕骨大孔。
将毁髓针垂直刺入枕骨大孔。
将针尖向前刺入颅腔内搅动,此时为单毁髓;将毁髓针退回枕骨大孔,针尖转向后方,与脊椎平行刺入椎管内捣毁脊髓,完成双毁髓。
3、坐骨神经-腓肠肌标本制备(1)剥制后肢标本:轻提双毁髓蛙,自背面耻骨联合上方约1公分处横向剪断脊柱。
轻轻托起后肢,看清坐骨神经位置,沿脊柱两侧横向切口剪断体壁,去除断口以上肢体和内脏放入污物缸。
剥去后肢皮肤后放入任氏液中备用。
(2)分离两后肢:用粗剪刀纵向剪开脊柱,并剪断两后肢相连的肌肉,一只用于剥制标本,一只放入任氏液中保存。
(3)分离坐骨神经:将后肢标本脊柱端腹面向上,趾端向外侧用蛙钉将标本固定在蛙板上。
坐骨神经-腓肠肌标本制备 骨骼肌的单收缩、收缩总和与强 …

目的要求
1.学习蛙类动物双毁髓的实验方法。 2.学习并掌握坐骨神经一腓肠肌标本的制备方法。 学习神经-肌肉实验的电刺激方法和记录肌肉收缩的 方法; 2.观察刺激强度与肌肉收缩反应之间的关系; 3.掌握阈刺激、阈下刺激、阈上刺激、最大(适)刺 激等概念。 4.学习应用Pclab系统。
方法步骤
1. 双毁髓 2. 剥制后肢标本 3. 分离两后肢(耻骨联合) 4. 分离坐骨神经 5. 分离股骨头(2cm) 6. 游离腓肠肌,肌腱处打结。 7. 检验标本
实验步骤
8. 进入PcLab实验内容 9. 连接刺激输出线、肌槽、张力换能器、万能 支架 10.设定刺激参数,预采样。 11.放上坐骨神经-腓肠肌标本,观察,测定 11.保存和打印实验结果
注意事项
保留股骨头完整关节,不能从关节面之间剪开 实验后利用蛙躯体前部练习双毁髓
实验原理
对于单根神经纤维或肌纤维来说,对刺激的反应具有 “全或无”的特性。神经-肌肉标本是由许多兴奋性 不同的神经纤维或肌纤维组成的,在保持足够的刺激 时间(脉冲波宽)不变时,刺激强度过小,不能引起 任何收缩反应;随着刺激强度增加到某一定值,可引 起少数兴奋性较高的运动单位兴奋,引起少数肌纤维 收缩,表现出较小的张力变化。该刺激器度称为阈强 度,具有阈强度的刺激称为阈刺激。
动物与器材
蛙;任氏液;肌槽、张力换能器(50~ 100g)、支架、双凹夹、Pclab系统(含输入 接线和刺激输出线)、常用手术器械、锌铜弓、 蜡盘、培养皿、滴管、棉线、橡皮泥。
实验原理
此后随着刺激强度的继续增加,会有较多的运 动单位兴奋,肌肉的收缩幅度及产生的张力也 不断增加,此时的刺激称为阈上刺激。但当刺 激强度增大到某一临界值时,所有的运动单位 都被兴奋,引起肌肉最大幅度的收缩,产生的 张力也最大。此后,再增加刺激强度,也不会 再引起反应的继续增加。可引起肌肉发生最大 收缩反应的最小刺激强度为最适刺激强度,该 刺激叫最大(适)刺激。
实验 坐骨神经腓肠肌标本制备

• 其各部连接关系如下: • 脊柱小块→坐骨神经→膝关节→腓肠 肌→跟腱→线(连接张力换能器) • ↓ • 股骨小段(固定于肌肉槽内的侧孔)
• 【注意事项】 • 1.沿脊柱中央把下半身剪为左右两大半时, 要正中,否则会损伤坐骨神经。
• • 2.神经分离需用玻璃分针,分离过程中操 作必须精细,避免用金属器械碰夹神经, 以免损伤。同时要注意持针分离方向应由 中心向外周,以免将神经上段撕伤。坐骨 神经
实验三 、坐骨神经腓肠肌标本制备
【实验步骤和观察指标】 • 1、毁髓 • 2、剪去躯干上部及内脏 • 3、剥皮
• 4.分离两腿 • 剪去的尾杆骨(注意勿损伤坐骨神经)。 然后沿正中线用剪刀将脊柱和耻骨联合中 央辟开两侧大腿,并完全分离。将两条腿 浸入盛有任氏液的培养皿中。
• 5、分离坐骨神经 • 取一条腿放置在蛙板上,用一固定针将脊柱固定 (腹面朝上),将下肢拉直并向外旋转趾蹼朝上 (背面朝上), 用固定针固定。
• 在用玻璃分针轻轻挑起神经,自前向后剪 去支配腓肠肌之外的神经分支,将坐骨神 经分离至膝关节处。取下脊柱端的固定针, 保留神经发出部位的一小块脊柱骨,用金 冠剪剪去其余部分脊柱骨及肌肉。再用手 术镊轻轻提起连有神经的脊柱骨片,将神 经移开股骨。
• 6、分离腓肠肌 • 用玻璃分针或镊子将腓肠肌跟腱分离,并 穿线结扎。在结扎远端用粗剪刀剪断跟腱, 左手执线提起腓肠肌,以手术剪刀剪去其 周围联系的组织,但保留腓肠肌起始点与 骨的联系,唯须注意勿损伤支配该肌的神 经分支。
• 周围的组织和神经的小分枝,可用分针纯 性分离或用剪刀逐步剪掉。
• 3.所用的器械要洁净,接触蛙皮肤,特别是 蟾蜍皮肤的用具必须洗净后使用。
• 4.应经常用任氏液湿润标本,防止干燥。
生物实验报告坐骨神经腓肠肌标本制备

坐骨神经腓肠肌标本得制备与神经干动作电位得观察与传导速度得测定一、实验目得:1.学习蛙类动物双毁髓得实验方法、2。
学习并掌握坐骨神经—腓肠肌标本得制备方法。
3.观察蛙坐骨神经干复合动作电位得基本波形,并了解其产生得原理。
4.学习蛙与蟾蜍离体神经干上神经冲动传导速度得方法与原理、二、实验材料:1.实验对象:蟾蜍2、实验器材:常规手术器械(粗剪刀、手术剪、眼科剪、手术镊、眼科镊)蛙板、蛙钉、探针、锌铜弓、玻璃分针、培养皿、任氏液、滴管、手术线、PC机、信号采集处理系统、神经屏蔽盒等。
三、实验原理:神经干在受到有效刺激以后可以产生复合动作电位,标志着神经发生兴奋。
如果在离体神经干得一段施加刺激,从另一端引导传来得神兴奋冲动,可以记录出双相电位,加入在引导得两个电极之间将神经干麻醉或损伤,阻断其兴奋传导能力,这时候记录出得动作电位就成为单相电位、神经细胞得动作电位就是以全或无得方式产生得。
但就是,复合动作电位得幅值在一定刺激强度下就是随刺激强度得增加而增大得。
如果在远离刺激点得不同距离处分别引导离体神经干动作电位,两引导点之间得距离为m,在两引导点分别引导出得动作电位得时相差为s。
即可按照公式v=m/s来计算出兴奋得传导速度、蛙类得坐骨神经干属于混合性神经,其中包含有粗细不等得各种纤维,其直径一般为3-29um,其中直径最粗得有髓纤维为A类纤维,传导速度在正常室温下为35-40 m/s。
神经每兴奋一次极其在兴奋以后得回复过程中,其兴奋性都要经历一次周期性得变化,其全过程依次包括绝对不应期、相对不应期、超常期与低常期4个时期。
为了测定坐骨神经在发生一次兴奋以后兴奋性所发生得周期性变化,首先要给神经施加一个条件性刺激引起神经兴奋,然后在前一兴奋及其恢复过程不同时相再施加一个测试性刺激,用于检查神经得兴奋阈值与所引起得动作电位得幅度,以判定神经兴奋性得变化。
四、实验方法及步骤:1、坐骨神经干标本制备(1) 破坏脑与脊髓:取蛙一只,用自来水冲洗干净,左手持蛙,用食指下压其吻部,拇指按压在其骶髂关节下方,使其头尽量前俯,右手持探针沿两眼之间中线向后方轻划,至触及头颈部正中得凹陷处,即为枕骨大孔得位置。
生物实验报告-坐骨神经腓肠肌标本制备

坐骨神经腓肠肌标本的制备和神经干动作电位的观察与传导速度的测定一、实验目的:1.学习蛙类动物双毁髓的实验方法。
2.学习并掌握坐骨神经-腓肠肌标本的制备方法。
3.观察蛙坐骨神经干复合动作电位的基本波形,并了解其产生的原理。
4.学习蛙和蟾蜍离体神经干上神经冲动传导速度的方法和原理。
二、实验材料:1.实验对象:蟾蜍2.实验器材:常规手术器械(粗剪刀、手术剪、眼科剪、手术镊、眼科镊)蛙板、蛙钉、探针、锌铜弓、玻璃分针、培养皿、任氏液、滴管、手术线、PC机、信号采集处理系统、神经屏蔽盒等。
三、实验原理:神经干在受到有效刺激以后可以产生复合动作电位,标志着神经发生兴奋。
如果在离体神经干的一段施加刺激,从另一端引导传来的神兴奋冲动,可以记录出双相电位,加入在引导的两个电极之间将神经干麻醉或损伤,阻断其兴奋传导能力,这时候记录出的动作电位就成为单相电位。
神经细胞的动作电位是以全或无的方式产生的。
但是,复合动作电位的幅值在一定刺激强度下是随刺激强度的增加而增大的。
如果在远离刺激点的不同距离处分别引导离体神经干动作电位,两引导点之间的距离为m,在两引导点分别引导出的动作电位的时相差为s。
即可按照公式v=m/s来计算出兴奋的传导速度。
蛙类的坐骨神经干属于混合性神经,其中包含有粗细不等的各种纤维,其直径一般为3-29um,其中直径最粗的有髓纤维为A类纤维,传导速度在正常室温下为35-40 m/s。
神经每兴奋一次极其在兴奋以后的回复过程中,其兴奋性都要经历一次周期性的变化,其全过程依次包括绝对不应期、相对不应期、超常期和低常期4个时期。
为了测定坐骨神经在发生一次兴奋以后兴奋性所发生的周期性变化,首先要给神经施加一个条件性刺激引起神经兴奋,然后在前一兴奋及其恢复过程不同时相再施加一个测试性刺激,用于检查神经的兴奋阈值和所引起的动作电位的幅度,以判定神经兴奋性的变化。
四、实验方法及步骤:1、坐骨神经干标本制备(1)破坏脑与脊髓:取蛙一只,用自来水冲洗干净,左手持蛙,用食指下压其吻部,拇指按压在其骶髂关节下方,使其头尽量前俯,右手持探针沿两眼之间中线向后方轻划,至触及头颈部正中的凹陷处,即为枕骨大孔的位置。
生物实验报告坐骨神经腓肠肌标本制备

生物实验报告坐骨神经腓肠肌标本制备集团标准化工作小组 [Q8QX9QT-X8QQB8Q8-NQ8QJ8-M8QMN]坐骨神经腓肠肌标本的制备和神经干动作电位的观察与传导速度的测定一、实验目的:1.学习蛙类动物双毁髓的实验方法。
2.学习并掌握坐骨神经-腓肠肌标本的制备方法。
3.观察蛙坐骨神经干复合动作电位的基本波形,并了解其产生的原理。
4.学习蛙和蟾蜍离体神经干上神经冲动传导速度的方法和原理。
二、实验材料:1.实验对象:蟾蜍2.实验器材:常规手术器械(粗剪刀、手术剪、眼科剪、手术镊、眼科镊)蛙板、蛙钉、探针、锌铜弓、玻璃分针、培养皿、任氏液、滴管、手术线、PC机、信号采集处理系统、神经屏蔽盒等。
三、实验原理:神经干在受到有效刺激以后可以产生复合动作电位,标志着神经发生兴奋。
如果在离体神经干的一段施加刺激,从另一端引导传来的神兴奋冲动,可以记录出双相电位,加入在引导的两个电极之间将神经干麻醉或损伤,阻断其兴奋传导能力,这时候记录出的动作电位就成为单相电位。
神经细胞的动作电位是以全或无的方式产生的。
但是,复合动作电位的幅值在一定刺激强度下是随刺激强度的增加而增大的。
如果在远离刺激点的不同距离处分别引导离体神经干动作电位,两引导点之间的距离为m,在两引导点分别引导出的动作电位的时相差为s。
即可按照公式v=m/s来计算出兴奋的传导速度。
蛙类的坐骨神经干属于混合性神经,其中包含有粗细不等的各种纤维,其直径一般为3-29um,其中直径最粗的有髓纤维为A类纤维,传导速度在正常室温下为35-40 m/s。
神经每兴奋一次极其在兴奋以后的回复过程中,其兴奋性都要经历一次周期性的变化,其全过程依次包括绝对不应期、相对不应期、超常期和低常期4个时期。
为了测定坐骨神经在发生一次兴奋以后兴奋性所发生的周期性变化,首先要给神经施加一个条件性刺激引起神经兴奋,然后在前一兴奋及其恢复过程不同时相再施加一个测试性刺激,用于检查神经的兴奋阈值和所引起的动作电位的幅度,以判定神经兴奋性的变化。
操作流程-坐骨神经-腓肠肌标本制备.
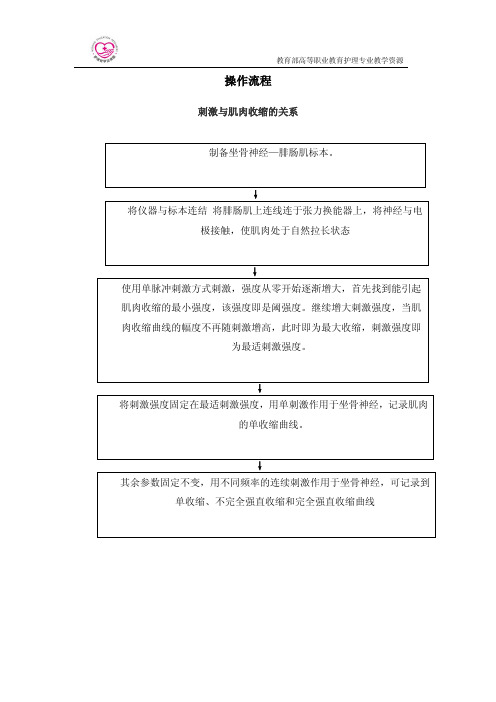
ห้องสมุดไป่ตู้操作流程
刺激与肌肉收缩的关系
制备坐骨神经—腓肠肌标本。
↓ 将仪器与标本连结 将腓肠肌上连线连于张力换能器上,将神经与电
极接触,使肌肉处于自然拉长状态
↓ 使用单脉冲刺激方式刺激,强度从零开始逐渐增大,首先找到能引起 肌肉收缩的最小强度,该强度即是阈强度。继续增大刺激强度,当肌 肉收缩曲线的幅度不再随刺激增高,此时即为最大收缩,刺激强度即
为最适刺激强度。
↓ 将刺激强度固定在最适刺激强度,用单刺激作用于坐骨神经,记录肌肉
的单收缩曲线。
↓ 其余参数固定不变,用不同频率的连续刺激作用于坐骨神经,可记录到
单收缩、不完全强直收缩和完全强直收缩曲线
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
坐骨神经腓肠肌标本的制备和神经干动作电位的观察与传
导速度的测定
一、实验目的:
1.学习蛙类动物双毁髓的实验方法。
2.学习并掌握坐骨神经-腓肠肌标本的制备方法。
3.观察蛙坐骨神经干复合动作电位的基本波形,并了解其产生的原理。
4.学习蛙和蟾蜍离体神经干上神经冲动传导速度的方法和原理。
二、实验材料:
1.实验对象:蟾蜍
2.实验器材:常规手术器械(粗剪刀、手术剪、眼科剪、手术镊、眼科镊)蛙板、蛙钉、探针、锌铜弓、玻璃分针、培养皿、任氏液、滴管、手术线、PC机、信号采集处理系统、神经屏蔽盒等。
三、实验原理:
神经干在受到有效刺激以后可以产生复合动作电位,标志着神经发生兴奋。
如果在离体神经干的一段施加刺激,从另一端引导传来的神兴奋冲动,可以记录出双相电位,加入在引导的两个电极之间将神经干麻醉或损伤,阻断其兴奋传导能力,这时候记录出的动作电位就成为单相电位。
神经细胞的动作电位是以全或无的方式产生的。
但是,复合动作电位的幅值在一定刺激强度下是随刺激强度的增加而增大的。
如果在远离刺激点的不同距离处分别引导离体神经干动作电位,两引导点之间的距离为m,在两引导点分别引导出的动作电位的时相差为s。
即可按照公式v=m/s来计算出兴奋的传导速度。
蛙类的坐骨神经干属于混合性神经,其中包含有粗细不等的各种纤维,其直径一般为3-29um,其中直径最粗的有髓纤维为A类纤维,传导速度在正常室温下为35-40 m/s。
神经每兴奋一次极其在兴奋以后的回复过程中,其兴奋性都要经历一次周期
性的变化,其全过程依次包括绝对不应期、相对不应期、超常期和低常期4个时期。
为了测定坐骨神经在发生一次兴奋以后兴奋性所发生的周期性变化,首先要给神经施加一个条件性刺激引起神经兴奋,然后在前一兴奋及其恢复过程不同时相再施加一个测试性刺激,用于检查神经的兴奋阈值和所引起的动作电位的幅度,以判定神经兴奋性的变化。
四、实验方法及步骤:
1、坐骨神经干标本制备
(1)破坏脑与脊髓:
取蛙一只,用自来水冲洗干净,左手持蛙,用食指下压其吻部,拇指按压在其骶髂关节下方,使其头尽量前俯,右手持探针沿两眼之间中线向后方轻划,至触及头颈部正中的凹陷处,即为枕骨大孔的位置。
用探针在凹陷处垂直刺入枕骨大孔,再将其针尖转向前刺入颅腔,左右搅动探针,彻底捣毁脑组织;然后缓慢地把探针退至枕骨大孔处,将其转向后方,与脊柱平行捻动探针使其刺入整个椎管,彻底捣毁脊髓。
彻底捣毁脊髓时,可看到动物后肢突然蹬直,然后瘫软。
(2)剪去躯干上部及内脏
在骶髂关节前1 cm处用金冠剪(粗剪)剪断脊柱(可在下肢前端)。
沿脊柱切口向下剪开两侧腹部皮肤至耻骨处,将头、前肢、内脏及腹部软组织全部剪掉,放于污物盘,只保留下端脊柱和下肢。
在腹侧脊柱两旁可看到腰骶神经丛。
注意切勿触及或损伤坐骨神经。
(3)剥后肢皮肤
左手持镊子夹住脊髓断端,右手捏住断端边缘,剥掉全部后肢皮肤。
注意不要握住或接触坐骨神经。
将全部皮肤剥除后,把标本置于盛有任氏液的培养皿中。
将手和手术器械洗净,以免皮肤分泌物、血液污染神经标本。
(4)分离两腿
在任氏液里把标本上的血迹冲洗干净,用镊子从背位夹住脊柱将标本提起,剪去向上突出的骶骨(避开坐骨神经),然后沿正中线用粗剪刀将脊柱分为两半,再从耻骨联合中央剪开两后肢。
将已分离的标本浸入盛有任氏液的培养皿中。
(5)制备坐骨神经标本
取出一侧下肢,用蛙钉固定于蛙板上,固定时要注意使坐骨神经和腓肠肌朝上。
先用玻璃分针沿脊柱侧游离坐骨神经,神经干应尽可能分离的长一些。
要求上自脊髓附近的主干,下沿腓总神经或胫神经一直分离至踝关节附近止。
坐骨神经在膝关节后分为胫神经和腓神经两支,如要制备腓神经,则在分叉的下端将胫神经剪断,膝关节附近的腓神经表面有肌肉和筋膜覆盖,仔细分离并沿腓肠肌沟一直下行分离至跟踺,然后将棉线用任氏液浸泡后,在脊髓侧坐骨神经起始处和跟腱处将神经结扎,在结扎的外侧将神经干剪断,制成坐骨神经-腓神经标本。
另外,也可保留胫神经而将腓神经剪断,制成坐骨神经-胫神经标本。
将制备好的神经干标本浸于任氏液中数分钟,待其兴奋性稳定后开始实验。
注意在分离过程中,应把神经周围的结缔组织去除干净,并把神经的细小分支剪断,但要注意不要用金属器械碰触神经,也不要对神经过度牵拉。
实验期间应不断滴加任氏液使神经保持湿润。
制备好的标本应如下:
图1 坐骨神经腓肠肌标本示意图
2、神经干动作电位的观察
(1)连接实验装置:将刺激电极连接刺激输出,记录电极连接到1通道和2通道,注意避免接触不良或连接错误,注意地线的连接。
(2)将神经标本置于神经屏蔽盒的电极上将神经的近中枢端置于刺激电极上,外周端置于记录电极上。
(3)进入生物信号采集处理系统,设置参数进行测定。
五、实验结果及讨论:
1.神经干动作电位:
所测得蟾蜍坐骨神经干复合动作电位图如下,神经干受刺激后,记录的动作电位即为双相动作电位。
2.神经干动作电位的传导速度测定
本实验采用两个通道同时记录由两对引导电极记录下的动作电位来计算动作电位传导速度。
先分别测量从刺激伪迹到两个动作电位起始点的时间,设上线为t1,下线为t2,求出t2-t1的时间差值。
然后再测量标本屏蔽盒中两对引导电极起始电极之间的距离d,则神经冲动的传导速度V=d/(t2-t1)。
通过实验,我们测得t1=1.9ms,t2=2.2ms,d=1cm,V=33.33m/s。
相比标准值(35-40)来说偏低,可能因为神经纤维放置时间过长,不够湿润而使传导速度
下降。
六、注意事项:
1、在制备标本时,避免过度牵拉神经,不可用手或金属器械触碰神经干。
2、避免动物皮肤分泌物(蟾酥、血液等)污染神经和肌肉,也不要用水冲洗,以免影响组织机能。
3、制备标本时,要随时用任氏液润湿神经和肌肉,防止干燥。
4、分离神经时,一定要把周围结缔组织剥离干净。
5、实验要迅速,以免时间过长影响标本活性(兴奋性)。
