2018秋高中化学第二章化学反应与能量2.2.2化学能与电能课件新人教版必修2
合集下载
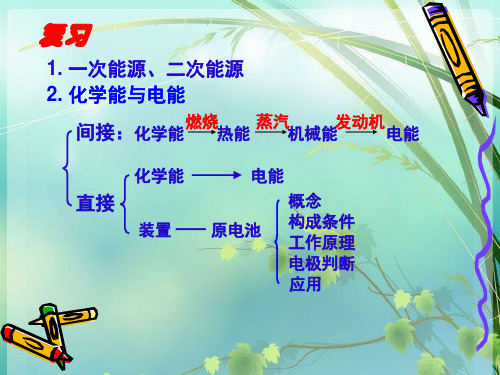
人教版高中化学必修二课件第二节 化学能与电能(第一课时)

初步诊断:营养不良,缺乏能源电池 处理意见: 补充能源,产生电流
柠檬(ningmeng) 别名 :洋柠檬,益母果 英文名:lemon
柠檬中含有丰富的柠檬酸,因 此被誉为“柠檬酸仓库”。它
的果实汁多肉脆,有浓郁的芳 香气。因为味道特酸,故用来 调制饮料菜肴、化妆品和药品。
按座位分成12个小组,对 各个小组表现评价,最后 评出第一名,给予奖励!
作
两个组合(可重复),证 明谁能产生电流?
电 极
药物动力学研究
要
动手操作:
形
将两个电极分别 成
插入两个柠檬中。 闭
合
试试看,行吗?为什么呢?
回 路
药物动力学研究
动手操作:
电
将电极从柠檬 解
中拔出,清洗, 质
擦干,再插入到 溶
花生油中
液
两个不同的 导体作电极
处方
条件
闭合回路
电解质溶液
药物动力学研究
请评价各组表现!
锂 电 池
低碳世博
电 动 车
1、课后
土
第三题
豆
供
2、查阅资料,
电
了解各种电池
学习的道路上 不要轻言放弃 希望就在前方
谢谢各位同学合作 谢谢各位老师指教
河南省开封市第二十五中 学 侯艳华
正是合作、质疑,张扬自己的时代, 亲爱的朋友,愿你的小组成功!
药物动力学研究
铁铁钉钉/铁钉2 铁 铁铅钉钉笔//铅 牙签笔2 铅 铅牙笔笔签//铅 牙笔 签2
牙签/牙签
药物动力学研究
镁镁带带镁//镁铜带带钥2匙
两 个
镁铜铜带钥钥匙/吸/匙管铜钥2匙 铜钥吸匙管/吸2管
吸管/吸管
不 同 导
柠檬(ningmeng) 别名 :洋柠檬,益母果 英文名:lemon
柠檬中含有丰富的柠檬酸,因 此被誉为“柠檬酸仓库”。它
的果实汁多肉脆,有浓郁的芳 香气。因为味道特酸,故用来 调制饮料菜肴、化妆品和药品。
按座位分成12个小组,对 各个小组表现评价,最后 评出第一名,给予奖励!
作
两个组合(可重复),证 明谁能产生电流?
电 极
药物动力学研究
要
动手操作:
形
将两个电极分别 成
插入两个柠檬中。 闭
合
试试看,行吗?为什么呢?
回 路
药物动力学研究
动手操作:
电
将电极从柠檬 解
中拔出,清洗, 质
擦干,再插入到 溶
花生油中
液
两个不同的 导体作电极
处方
条件
闭合回路
电解质溶液
药物动力学研究
请评价各组表现!
锂 电 池
低碳世博
电 动 车
1、课后
土
第三题
豆
供
2、查阅资料,
电
了解各种电池
学习的道路上 不要轻言放弃 希望就在前方
谢谢各位同学合作 谢谢各位老师指教
河南省开封市第二十五中 学 侯艳华
正是合作、质疑,张扬自己的时代, 亲爱的朋友,愿你的小组成功!
药物动力学研究
铁铁钉钉/铁钉2 铁 铁铅钉钉笔//铅 牙签笔2 铅 铅牙笔笔签//铅 牙笔 签2
牙签/牙签
药物动力学研究
镁镁带带镁//镁铜带带钥2匙
两 个
镁铜铜带钥钥匙/吸/匙管铜钥2匙 铜钥吸匙管/吸2管
吸管/吸管
不 同 导
人教版高中化学必修二课件第二章第二节第2课时化学电源.pptx

空Байду номын сангаас演示
在此输入您的封面副标题
化学反应与能量
第二节 化学能与电能 第2课时 化学电源
情 境 导 入
课
知
标
识
点
导
击
学
典 例 精 析
课 时 训 练
第2课时 化学电源
锂离子电池的阴极材料为锂金属氧化物,具有高效率、 高能量密度的特点,并具有放电电压稳定、工作温度范围宽、 自放电率低、储存寿命长、无记忆效应及无公害等优点。但 目前锂离子电池在大尺寸制造方面存在一定问题,过充控制 的特殊封装要求高,价格昂贵,所以尚不能普遍应用。目前 世界上运行的最大锂离子储能系统是A123公司投资建设的, 装机容量为2兆瓦。
变式应用 2.镍镉电池是一种可充电电池,其反应的化学方程式
为:Cd(OH)2+Ni(OH)2Cd+2NiO(OH)+2H2O。由此可知, 该电池的负极材料是( )
A.CdB.NiO(OH)
C.Cd(OH)2D.Ni(OH)2
解析:在判断原电池的负极材料时应看放电过程,且负 极发生的是氧化反应,化合价升高,所以镍镉电池的负极材 料为Cd。
答案:A
水平测试 1.某原电池总反应的离子方程式为2Fe3++Fe===3Fe2+, 不能实现该反应的原电池是( ) A.正极为Cu,负极为Fe,电解质溶液为FeCl3溶液 B.正极为C,负极为Fe,电解质溶液为Fe(NO3)3溶液 C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液 D.正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3溶液
答案:B
4.废旧电池处理不当不仅会造成浪费,还会对环境造 成严重污染,对人体健康也存在极大的危害。有同学想变废 为宝,他的以下想法你认为不正确的是( )
在此输入您的封面副标题
化学反应与能量
第二节 化学能与电能 第2课时 化学电源
情 境 导 入
课
知
标
识
点
导
击
学
典 例 精 析
课 时 训 练
第2课时 化学电源
锂离子电池的阴极材料为锂金属氧化物,具有高效率、 高能量密度的特点,并具有放电电压稳定、工作温度范围宽、 自放电率低、储存寿命长、无记忆效应及无公害等优点。但 目前锂离子电池在大尺寸制造方面存在一定问题,过充控制 的特殊封装要求高,价格昂贵,所以尚不能普遍应用。目前 世界上运行的最大锂离子储能系统是A123公司投资建设的, 装机容量为2兆瓦。
变式应用 2.镍镉电池是一种可充电电池,其反应的化学方程式
为:Cd(OH)2+Ni(OH)2Cd+2NiO(OH)+2H2O。由此可知, 该电池的负极材料是( )
A.CdB.NiO(OH)
C.Cd(OH)2D.Ni(OH)2
解析:在判断原电池的负极材料时应看放电过程,且负 极发生的是氧化反应,化合价升高,所以镍镉电池的负极材 料为Cd。
答案:A
水平测试 1.某原电池总反应的离子方程式为2Fe3++Fe===3Fe2+, 不能实现该反应的原电池是( ) A.正极为Cu,负极为Fe,电解质溶液为FeCl3溶液 B.正极为C,负极为Fe,电解质溶液为Fe(NO3)3溶液 C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液 D.正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3溶液
答案:B
4.废旧电池处理不当不仅会造成浪费,还会对环境造 成严重污染,对人体健康也存在极大的危害。有同学想变废 为宝,他的以下想法你认为不正确的是( )
高一化学人教版新课标化学能与热能的相互转化PPT教学课件

思考与交流
• 在设计实验装置和操作时应从两个方面考虑,一 是注重“量”的问题,如① 反应物的浓度和体积 取定值;② 测量反应前后的温度值;③ 做平行 实验取平均值。二是尽量减小实验误差,如① 用 经过标定的盐酸和氢氧化钠溶液;② 量液器最好 使用移液管;③ 搅拌使反应充分进行;④ 及时 散热,使混合液温度均衡;⑤ 温度计的精确度高, 最好使用精度为0.1 ℃或更高的温度计;⑥ 盐酸 跟氢氧化钠溶液混合后液面上方的空间尽可能小; ⑦ 使用绝缘装置,避免热量散发到反应体系之外; ⑧ 温度计要读准确。
3、 如右图所示,把试管放入盛有25℃时饱 和石灰水的烧杯中,试管中开始放入几小块 镁片,再用滴管滴入5mL盐酸于试管中.试回 答下列问题:
(1)实验中观察到的现象是
(2)产生上述现象的原因是
(3)写出有关反应的离子方程式
(4) 由 实 验 推 知 , MgCl2 溶 液 和 H2 的 总 能 量 (填“大于”、“小于”、“等于”)镁片和 盐酸的总能量.
实验来测定盐酸与氢氧化钠反应的中和热, 你认为在设计实验装置和操作时应该注意 哪些问题?你准备如何设计并进行实验? 请与同学讨论、交流。
中和热的测定 装置
在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大 烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸 条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开 两个小孔,正好使温度计和环形玻璃搅拌棒通过,以达到保温、 隔热、减少实验过程中热量损失的目的,如上图所示。该实验也 可在保温杯中进行。
随堂练习
1. 下列说法正确的是
( AB )
• A. 大多数的化合反应是释放能量的反应
• B. 大多数分解反应是吸收能量的反应
人教版高中化学必修二2-2化学能与电能 PPT课件 图文
应用:广泛用于收录机、无线对讲机、电子闪光灯、
电动剃须刀等
③锂离子电池:
是新一代可充电的绿色电池,现已成为笔记本电脑、 移动电话、数码相机、摄像机等低功耗电器的主流 电源
3.燃料电池
(1)原理:利用原电池的工作原理,将燃料和 氧化剂(如O2)反应所放出的化学能直 接转化为电能
a. 燃料电池是一种高效、环境友好的发电装置 b.它的电极材料一般为活性电极,具有很强的
线两两相连组成原电池。若a、b相连时,a为负 极;c、d相连时,电流由d到c;a、c相连时,c 极上产生大量气泡,b、d相连时,b上有大量气 泡产生,则四种金属的活动性顺序由强到弱的 为( B )
A.a>b>c>d B.a>c>d>b C.c>a>b>d D.b>d>c>a
分析:①a>b ② c>d ③ a>c ④ d>b
负极:电子流出的电极——失电子,发生氧化反应 (较活泼的金属)
正极:电子流入的电极——得电子,发生还原反应 (较不活泼的金属、石墨等)
2.原电池的工作原理
Zn
Cu
发生失电子的氧化反应
Zn - 2e- = Zn2+
发生得电子的还原反应
2H+ + 2e- = H2↑
负极
H2SO4
e- 外电路
正极
阴离子 溶液中 阳离子
催化活 性,如铂电极,活性炭电极等 c. 燃料电池由3个主要部分组成
负极——燃料电极 正极——氧气或空气电极 电解质溶液 d. 两电极材料均为惰性电极,电极本身不发生反应, 而是由引入到两电极上的物质发生反应
(2)常见的燃料电池:
电动剃须刀等
③锂离子电池:
是新一代可充电的绿色电池,现已成为笔记本电脑、 移动电话、数码相机、摄像机等低功耗电器的主流 电源
3.燃料电池
(1)原理:利用原电池的工作原理,将燃料和 氧化剂(如O2)反应所放出的化学能直 接转化为电能
a. 燃料电池是一种高效、环境友好的发电装置 b.它的电极材料一般为活性电极,具有很强的
线两两相连组成原电池。若a、b相连时,a为负 极;c、d相连时,电流由d到c;a、c相连时,c 极上产生大量气泡,b、d相连时,b上有大量气 泡产生,则四种金属的活动性顺序由强到弱的 为( B )
A.a>b>c>d B.a>c>d>b C.c>a>b>d D.b>d>c>a
分析:①a>b ② c>d ③ a>c ④ d>b
负极:电子流出的电极——失电子,发生氧化反应 (较活泼的金属)
正极:电子流入的电极——得电子,发生还原反应 (较不活泼的金属、石墨等)
2.原电池的工作原理
Zn
Cu
发生失电子的氧化反应
Zn - 2e- = Zn2+
发生得电子的还原反应
2H+ + 2e- = H2↑
负极
H2SO4
e- 外电路
正极
阴离子 溶液中 阳离子
催化活 性,如铂电极,活性炭电极等 c. 燃料电池由3个主要部分组成
负极——燃料电极 正极——氧气或空气电极 电解质溶液 d. 两电极材料均为惰性电极,电极本身不发生反应, 而是由引入到两电极上的物质发生反应
(2)常见的燃料电池:
人教版高中化学必修2-2.1《化学能与热能》教学课件3

第二章 化学反应与能量
第一节 化学能与热能
问题情境
? 水能载舟,亦能覆舟。
水能灭火,亦能点火。
2Na2O2+2H2O=4NaOH+O2↑
化学能是能量的一种形式, 可以转化为其它形式的能量, 如热能、光能等。
第一节 化学能与热能
问题一 有没有热能转化成化学能的反应呢?
或者说有没有吸收热量的化学反应呢?
放出热量的反应 ——放热反应
化学能转化为热能
吸收热量的反应 ——吸热反应
热能转化为化学能
资料收集——想一想
常见的放热反应和吸热反应
放热反应
吸热反应
大部分化合反应
酸碱中和反应 金属与酸或水的置换反应
可燃物的燃烧反应 缓慢氧化还原反应(食 物腐败、铁的生锈、葡 萄糖体内氧化)
Ba(OH)2·8H2O+2NH4Cl =BaCI2+2NH3↑+10H2O
理论探究 1.宏观
资料卡片:各种物质都储存有化学能。不同的物质不
仅组成不同、结构不同,所包含的化学能也不同。
反应物和生成物的能量必然不同 根据能量守恒定律
化学反应过程中必然有能量的吸收或放出
通常表现为吸热或放热 化学反应是吸收能量还是放出能量,取决于 反应物的总能量与生成物的总能量的相对大小。
理论探究
化学反应
物质变化 (质量守恒)
能量变化
(能量守恒) 主要
热量变化
放热反应
实验
宏观
提供能量、
微观
动力
吸热反应
化工生产、 研制新物质
试一试
已知断开1molH-H键需要吸收436 kJ,断开1molClCl键吸收243kJ,形成1molH-Cl键放出能量为431kJ。 判断反应H2+Cl2=点=燃2HCl的热量变化。
第一节 化学能与热能
问题情境
? 水能载舟,亦能覆舟。
水能灭火,亦能点火。
2Na2O2+2H2O=4NaOH+O2↑
化学能是能量的一种形式, 可以转化为其它形式的能量, 如热能、光能等。
第一节 化学能与热能
问题一 有没有热能转化成化学能的反应呢?
或者说有没有吸收热量的化学反应呢?
放出热量的反应 ——放热反应
化学能转化为热能
吸收热量的反应 ——吸热反应
热能转化为化学能
资料收集——想一想
常见的放热反应和吸热反应
放热反应
吸热反应
大部分化合反应
酸碱中和反应 金属与酸或水的置换反应
可燃物的燃烧反应 缓慢氧化还原反应(食 物腐败、铁的生锈、葡 萄糖体内氧化)
Ba(OH)2·8H2O+2NH4Cl =BaCI2+2NH3↑+10H2O
理论探究 1.宏观
资料卡片:各种物质都储存有化学能。不同的物质不
仅组成不同、结构不同,所包含的化学能也不同。
反应物和生成物的能量必然不同 根据能量守恒定律
化学反应过程中必然有能量的吸收或放出
通常表现为吸热或放热 化学反应是吸收能量还是放出能量,取决于 反应物的总能量与生成物的总能量的相对大小。
理论探究
化学反应
物质变化 (质量守恒)
能量变化
(能量守恒) 主要
热量变化
放热反应
实验
宏观
提供能量、
微观
动力
吸热反应
化工生产、 研制新物质
试一试
已知断开1molH-H键需要吸收436 kJ,断开1molClCl键吸收243kJ,形成1molH-Cl键放出能量为431kJ。 判断反应H2+Cl2=点=燃2HCl的热量变化。
高中化学必修2第二章化学能与热能(PPT)

吸热反 应
3、注意问题:
物质反应开始时需加热的反应:可能是吸热反 应,也可能是放热反应。 反应的热量变化与反应发生是否需要加热没有必 然联系。 例1.下列说法正确的是( CD ) A.需加热方能发生的反应一定是吸热反应 B.放热反应在常温下一定很易发生 C.反应是吸热还是放热必须看反应物和生成 物具有的总能量的相对大小 D.吸热反应在一定条件下也能发生
(一)燃烧热
在101kPa时,1mol物质完全燃烧生成稳 定的氧化物时所放出的热量,叫做该物质的燃 烧热。 例如,测得101 kPa时1molC完全燃烧放 出393.5kJ的热量,这就是C的燃烧热。 C(s)+O2(g)
=
CO2(g);
ΔH=-393.5 kJ/mol
又如,由实验测得,101 kPa时 1molH2 完全燃烧生成液态水,放出 285. 8 kJ/mol 的热量,这就是H2 的燃烧热。 热化学方程式为:
(3)热化学方程式中的计量数可以是整数可以是分数
H2(g)+Cl2(g) 2HCl(g);ΔH=-184.6 kJ/mol
(4)注意∆H的数值与反应物或生成物的物 质的量的匹配。 (5)注意: “+、-” ,/mol 。
返回
例、已知充分燃烧ag乙炔气体时生成1mol二氧化碳气体和液态水, 并放出热量bkJ,则乙炔燃烧的化学方程式正确的是( A )。 A、2C2H2(g) + 5O2 (g) == 4CO2 (g) + 2H2O(l);△H=−4bkJ/mol B、C2H2(g) +5/2O2 (g) == 2CO2 (g) + H2O(l);△H=2bkJ/mol C、2C2H2 (g) + 5O2 (g) == 4CO2 (g) + 2H2O(l);△H=−2bkJ/mol D、2C2H2(g) + 5O2 (g) == 4CO2 (g) + 2H2O(l);△H=bkJ/mol 解析:由于乙炔燃烧是放热反应,△H为“-”,可排除B、C项; 又因为生成4mol CO2应该放出热量4bkJ,故选A。
新课标化学必修2《化学能与电能(第一课时)》优质说课PPT

现
象
正极: Cu(+) Cu Cu
2H++2e-=H2↑(还原反应)
1.Zn片溶解 2.Cu片上有气泡 3.电流表指针发 生偏转
电池总反应式:
Zn+2H+=Zn2++H2 ↑
四、教学程序
2. 原电池的构成条件教学:
分组实验、比较探究、交流讨论、归纳总结。
分组实验:实验探究二
实验序号 实验装置 第一小组:实验①②③④
第二节 化学能与电能 一、化学能与电能的相互转化 1.火力发电的过程
2.原电池:将化学能转化为电能的装置。 锌片: Zn-2e-=Zn2+ (氧化反应) 铜片: 2H++2e-=H2↑(还原反应) 总反应式: Zn+2H+=Zn2++H2↑ 3. 原电池的构成条件 ① 有两种活动性不同的金属(或非金属单质)作电极。 ② 电极材料都插入电解质溶液中。 ③ 两极相连形成闭合电路。
两极相连形成闭合回路
(三)、当堂检测
1.下列装置中能组成原电池形成电流的是(
A
Cu Cu
)
A Zn Cu
A
H2SO4 A Zn Cu Zn
B
酒精 A Cu
C
H2SO4
D
H2SO4 H2SO4
反馈练习:
2、下列装置哪些属于原电池,请说明理由。 如是,请指出正极、负极。
A
Zn Cu
Aቤተ መጻሕፍቲ ባይዱ
Al
Ag 生铁 Cu
四、教学程序 2. 建立新思维,提出新的研究任务
①什么是火力发电,火力发电的 原理是什么? ②指出火电站中从开始到结束能 量是怎样转化的?
③火力发电的利与弊是什么?
化学必修2《化学能与热能》PPT课件

教学过程
二、提供素材:
为了能够解答上面所提出的问题,给出氢气和氯气 混合气体,在光照下发生爆炸的实验视频,并通过分 析得出爆炸的原因是反应放出了大量的热。接下来, 引导学生通过化学键来分析推理,为什么该反应会放 热。 特色:增强学生的感性认识,激发学习积极性 突出重点:化学能可转化为热能
教学过程
点燃
CO2
实验:氢气和氯气混合气体光照
H2
H —H
断 开 吸 收 能 量
+
Cl2
Cl —Cl
断 开 吸 收 能 量
光照
2HCl
· · · · : · Cl H· + · · → H Cl · ·
· · · ·
资料卡片
从化学键的角度分析:
• 1.化学反应的发生必然伴随能量的变化 • 2.化学键的形成与断裂是化学反应中能量变 化的主要原因 • 3.一个反应是放出热量还是吸收热量取决于 断键吸收的总能量与成键放出总能量的相 对大小
通过PPT展示书上的示意图,发现,一个化学反应 是吸收能量还是放出能量,取决于反应物的总能量和 生成物总能量的相对大小
教学过程
六、即时演练
现场让同学们做两道选择题,及时反馈学生们的 课堂吸收情况,并巩固这节课所学习的知识点。
THANK YOU!
新课标人教版化学必修Ⅱ
第二章
第一节 化学能与热能
C + O2
1、已知反应A+B=C+D为放热反应,对该反应 的下列说法中正确的是( C )
A. B. C. D.
A的能量一定高于C B的能量一定高于D A和B的总能量一定高于C和D的总能量 该反应为放热反应,故不必加热就一定 能发生
2、下列说法中正确的是( AD ) A. 物质发生化学反应都伴随着能量变化 B. 所有物质的内部都“储存”有能量,而 且这些能量都是相等的 C. 在一个确定的化学反应关系中,反应 物的总能量总是高于生成物的总能量 D. 化学反应的过程实质是断开旧化学键 形成新化学键的过程
人教版高中化学必修二2.1《化学能与热能》课件.ppt

8.在 25℃、101kPa 的条件下,断裂 1 mol H—H 键吸收 436 kJ 能量,断裂 1 mol Cl—Cl 键吸收 243 kJ 能量,形成 1 mol H—Cl 键放出 431 kJ 能量。
二、化学能与热能的相互转化 1. 两条基本的自然定律 (两 个 守 恒):________定 律 、 ________定律。 2.吸热反应和放热反应 (1)定义 吸热反应:吸收热量的化学反应。 放热反应:放出热量的化学反应。 (2)实验探究
①
现 象有 温度变化用 用产部水 手 温生感银 轻 度到柱 触 计发试 测热管 量底 ,
第二章 化学反应与能量
第一节 化学能与热能
课
课
课
前
堂
后
预
练
作
习
习
业
课基前础训预练习
一、化学键与化学反应中能量变化的关系 1.化学反应的实质 化学反应的实质是原子(或原子团)的重新组合,即反应物 中化学键的________和生成物中________。 2.化学反应中能量变化的原因(微观角度) (1) 物 质 中 的 原 子 ( 或 原 子 团 ) 之 间 是 通 过 ________ 相 结 合 的。
(2) 当 物 质 发 生 化 学 反 应 时 , 断 开 反 应 物 中 的 化 学 键 要 ________能量,而形成生成物中的化学键要________能量。
(3)化学键的________是化学反应中能量变化的主要原因。
3.化学反应中能量变化的决定因素(宏观角度) (1)反应物的总能量________生成物的总能量,则化学反应 释放能量,如图________所示; (2)反应物的总能量________生成物的总能量,则化学反应 吸收能量,如图________所示。
高中化学必修二(人教版 课件)-第二章 化学反应与能量 2.1

答案: D
B(g)+C(g)为吸热反应 ,B(g)+C(g)
A(g)为放热反应 ,B、C 两项错误,D 项正确。
首页
自主预习
合作探究
1 2
当堂检测
3 4 5
5.导学号52090047在研究化学反应中的能量变化时,我们通常做下 面的实验:
在一只小烧杯里,加入20 g已研磨成粉末的Ba(OH)2· 8H2O,将小烧杯 放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10 g NH4Cl晶体,根据实验步骤,填写下表,并回答问题。
4.由图分析,下列叙述正确的是 (
)
A.A(g) B(g)+C(g)和 B(g)+C(g) 反应吸收或放出的能量不相等
A(g)两个
B.A(g) B(g)+C(g)是放热反应 C.A(g)具有的能量高于 B(g)和 C(g)具有的总能量 D.B(g)+C(g) A(g)是放热反应
解析: 根据能量守恒定律可知 A 项错误;A(g)具有的能量低于 B(g) 和 C(g)具有的总能量,故 A(g)
首页
重难点一 重难点二
自主预习
合作探究
当堂检测
重难点一化学键与化学反应中能量变化的关系 情景引入
氢气的燃烧 讨论探究 1.化学反应中,反应物和生成物具有的总能量是否相同?并从该角 度解释:2H2+O2 2H2O为什么是放热反应? 提示:一定不相同。化学反应都伴随着能量的变化,所以反应物 和生成物具有的总能量一定不相同。在H2的燃烧反应中,反应物H2 和O2具有的总能量大于H2O具有的总能量,所以该反应是放热反应。
首页
自主预习
合作探究
当堂检测
第二章 化学反应与能量
B(g)+C(g)为吸热反应 ,B(g)+C(g)
A(g)为放热反应 ,B、C 两项错误,D 项正确。
首页
自主预习
合作探究
1 2
当堂检测
3 4 5
5.导学号52090047在研究化学反应中的能量变化时,我们通常做下 面的实验:
在一只小烧杯里,加入20 g已研磨成粉末的Ba(OH)2· 8H2O,将小烧杯 放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10 g NH4Cl晶体,根据实验步骤,填写下表,并回答问题。
4.由图分析,下列叙述正确的是 (
)
A.A(g) B(g)+C(g)和 B(g)+C(g) 反应吸收或放出的能量不相等
A(g)两个
B.A(g) B(g)+C(g)是放热反应 C.A(g)具有的能量高于 B(g)和 C(g)具有的总能量 D.B(g)+C(g) A(g)是放热反应
解析: 根据能量守恒定律可知 A 项错误;A(g)具有的能量低于 B(g) 和 C(g)具有的总能量,故 A(g)
首页
重难点一 重难点二
自主预习
合作探究
当堂检测
重难点一化学键与化学反应中能量变化的关系 情景引入
氢气的燃烧 讨论探究 1.化学反应中,反应物和生成物具有的总能量是否相同?并从该角 度解释:2H2+O2 2H2O为什么是放热反应? 提示:一定不相同。化学反应都伴随着能量的变化,所以反应物 和生成物具有的总能量一定不相同。在H2的燃烧反应中,反应物H2 和O2具有的总能量大于H2O具有的总能量,所以该反应是放热反应。
首页
自主预习
合作探究
当堂检测
第二章 化学反应与能量
高中化学人教版必修二《第二章化学反应与能量第2节化学能与电能第1课时原电池-化学能转化为电能》课件

用导线把锌片和铜片连接起来,插入到稀 H2SO4中所组成的原电池, 叫做Cu-Zn原电池
Cu-Zn原电池 Zn片上Zn溶解,Zn 失电子,发 生 氧化反应。 可表示为:
Zn: Zn-2e=Zn2+
Cu片上产生气泡,H+ 得电子,发生 还原 反应。 可表示为:
Cu:2H++2e=H2↑
定义2:在原电池中,电子流出的一极叫负极, 负极发生氧化反应;电子流入的一极叫正极, 正极发生还原反应。
[实验现象]:铜片上有气泡产生,锌片不断溶解,电流表的指 针发生偏转。
[实验结论]:导线中有电流通过。
实验结论:
1.该装置实现了将__化__学__能转化为_电____能。 2.该装置的化学反应本质是:_氧__化__还_原__反__应_____.
2. 原电池
定义1:使化学能转化为电能的的装置,叫做原 电池。
例1.如图装置中,明显有电流产生的是( C )
解析:A项中酒精不是电解质溶液,不能构成原电池;B项中的两电极材料 与电解质溶液不能发生自发的氧化还原反应,因而也不能构成原电池;D项 中的装置没有构成闭合回路,不能构成原电池;只有C选项中的装置符合原 电池的构成条件。
例2.[2019·河南省实验中学高一检测]关于原电池及其电极名称的下列 叙述中正确的是( C ) a. 原电池的正极和负极必须是两种活动性不同的 属 b. 正极上发生还原反应,一定产生气体 c. 电子流出的一极为负极 d. 阴离子在电解质溶液中向正极移动 解析:a错,构成原电池正极和负极的必须是两种活动性不同的电极,可 以是两种不同 属,也可以是一种 属、一种非 属。b错,原电池中正极上 发生还原反应,但不一定产生气体。c对,原电池中电子流出的一极为负 极,电子由负极流向正极。d错,原电池放电时,电解质溶液中阴离子向 负极移动。
Cu-Zn原电池 Zn片上Zn溶解,Zn 失电子,发 生 氧化反应。 可表示为:
Zn: Zn-2e=Zn2+
Cu片上产生气泡,H+ 得电子,发生 还原 反应。 可表示为:
Cu:2H++2e=H2↑
定义2:在原电池中,电子流出的一极叫负极, 负极发生氧化反应;电子流入的一极叫正极, 正极发生还原反应。
[实验现象]:铜片上有气泡产生,锌片不断溶解,电流表的指 针发生偏转。
[实验结论]:导线中有电流通过。
实验结论:
1.该装置实现了将__化__学__能转化为_电____能。 2.该装置的化学反应本质是:_氧__化__还_原__反__应_____.
2. 原电池
定义1:使化学能转化为电能的的装置,叫做原 电池。
例1.如图装置中,明显有电流产生的是( C )
解析:A项中酒精不是电解质溶液,不能构成原电池;B项中的两电极材料 与电解质溶液不能发生自发的氧化还原反应,因而也不能构成原电池;D项 中的装置没有构成闭合回路,不能构成原电池;只有C选项中的装置符合原 电池的构成条件。
例2.[2019·河南省实验中学高一检测]关于原电池及其电极名称的下列 叙述中正确的是( C ) a. 原电池的正极和负极必须是两种活动性不同的 属 b. 正极上发生还原反应,一定产生气体 c. 电子流出的一极为负极 d. 阴离子在电解质溶液中向正极移动 解析:a错,构成原电池正极和负极的必须是两种活动性不同的电极,可 以是两种不同 属,也可以是一种 属、一种非 属。b错,原电池中正极上 发生还原反应,但不一定产生气体。c对,原电池中电子流出的一极为负 极,电子由负极流向正极。d错,原电池放电时,电解质溶液中阴离子向 负极移动。
高中化学第2章化学反应与能量第1节化学能与热能课件新人教版必修2

2.吸热反应和放热反应 (1)定义 吸热反应: 吸收热量的化学反应。 放热反应: 放出 热量的化学反应。 (2)示例 ①金属与酸的置换反应是 放热反应;②燃烧反应为 放热反应;③中和反应 为放热反应;④CO、H2 的还原反应一般为 吸热反应。
3.化学能与热能相互转化的意义 化学能过过程程12热能 过程(1):提供了人类生存和发展所需要的 能量和动力。 过程(2):人类进行化工生产、研制新物质不可或缺的条件和途径。
[合作·探究] 利用化学键的数据计算反应中的能量 1.背景材料 利用化学键的能量变化可粗略计算化学反应过程中的能量变化。以反应 H2+ Cl2===2HCl 为例:
2.问题探究 (1)断裂 1 mol H—H 和 1 mol Cl—Cl 形成 H 和 Cl,能量有什么变化?数值为 多少? 【提示】 吸收能量。数值为(436+243)kJ。 (2)H 与 Cl 形成 2 mol H—Cl,能量有什么变化?数值为多少?
(3)结论:化学键的 断裂和形是成物质在化学反应中发生能量变化的主要原因。
①Q(吸)>Q(放):反应 吸收能量。 ②Q(吸)<Q(放):反应 放出能量。
2.化学反应中能量变化的决定因素——宏观角度 E(反应物)>E(生成物)化―学―反→应 放出 能量 E(反应物)<E(生成物)化―学―反→应 吸收 能量 结论:化学反应中的能量变化决定于 反应物的总能量与生成物的的总相能对量 大小。
【提示】 相等。
[核心·突破] 1.化学反应中能量变化的原因 在化学反应中,断开反应物中的化学键(即破坏旧化学键)需要吸收一定能量(E1) 克服原子(或离子)间的相互作用;而形成新化学键时,又要释放一定的能量(E2)。 E1>E2,反应吸收能量; E1<E2,反应释放能量。
高中化学化学能与热能课件新人教版必修

本身不反应, 是溶液中的阳离子得电子 发生还原反应。
•
1.判断下列哪些装置构成了原电池?
练 若不是,请说明理由;若是,请指 习 出正负极名称,并写出电极反应式.
①
②
(×)
(×)
•
巩 1.判断下列哪些装置构成了原电池? 固 若不是,请说明理由;若是,请指 练 出正负极名称,并写出电极反应式. 习
负极:Zn-2e-=Zn2+
•
1.原电池
(1)概念: 将________转化为______的装置。
(2)原电池的化学反应本质是:_____。
(3)原电池的电极反应: 负极:Zn – 2e- = Zn2+ 氧化反 正极:2应H+ +2e- = H2↑ 还原反应
•
(4)总反应式(两个电极反应之和) Zn + 2H+ = Zn2+ + H2↑ Zn + H2SO4(稀) = ZnSO4 + H2↑
高一年级 化学必修2
第二章
化学反应与能量
•
一、化学能转化为电能
•
?•
讨论:
⑴将Zn片插入H2SO4溶 液中有什么现象?为什 么?
⑵ 将Cu片插入H2SO4溶 液中有什么现象?为什 么?
•
演示与讨论 ⑶将一Zn片,Cu片平行插入
H象2?SO为4溶什液么中?,有什么现
⑷若将Zn片,Cu片用一导线 连接再浸在H2SO4溶液中, 有什么现象?为什么?
•
(5)原电池的工作原理
负极发生氧化反 应,正极发生还 原反应,电子从 负极经外电路流 向正极,从而产 生电流,使化学 能转变成电能。
原电池微观原理 •
•
•
•
1.判断下列哪些装置构成了原电池?
练 若不是,请说明理由;若是,请指 习 出正负极名称,并写出电极反应式.
①
②
(×)
(×)
•
巩 1.判断下列哪些装置构成了原电池? 固 若不是,请说明理由;若是,请指 练 出正负极名称,并写出电极反应式. 习
负极:Zn-2e-=Zn2+
•
1.原电池
(1)概念: 将________转化为______的装置。
(2)原电池的化学反应本质是:_____。
(3)原电池的电极反应: 负极:Zn – 2e- = Zn2+ 氧化反 正极:2应H+ +2e- = H2↑ 还原反应
•
(4)总反应式(两个电极反应之和) Zn + 2H+ = Zn2+ + H2↑ Zn + H2SO4(稀) = ZnSO4 + H2↑
高一年级 化学必修2
第二章
化学反应与能量
•
一、化学能转化为电能
•
?•
讨论:
⑴将Zn片插入H2SO4溶 液中有什么现象?为什 么?
⑵ 将Cu片插入H2SO4溶 液中有什么现象?为什 么?
•
演示与讨论 ⑶将一Zn片,Cu片平行插入
H象2?SO为4溶什液么中?,有什么现
⑷若将Zn片,Cu片用一导线 连接再浸在H2SO4溶液中, 有什么现象?为什么?
•
(5)原电池的工作原理
负极发生氧化反 应,正极发生还 原反应,电子从 负极经外电路流 向正极,从而产 生电流,使化学 能转变成电能。
原电池微观原理 •
•
•
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
充电
2 PbSO4 + 2H2O
(3)新型燃料电池
把能源中燃料燃烧反应的化学能直接转化为电能的 “能量转换器”
燃料电池不是把还原剂、氧化剂物质全 部贮藏在电池内,而是在工作时,不断从外 界输入,同时将电极反应产物不断排出电池
优点:效率高、无污染,装置可持续使用
怎样书写燃料电池的电极反应式和总反应式?
正极: 2H++2e-=H2↑
+=Zn2++H ↑ Zn+2H 总反应: 2
及时训练
负极: Zn-2e-=Zn2+ 正极: Cu2+ + 2e-=Cu
总反应: Zn + Cu2+=Zn2+ + Cu 或 Zn + CuSO4=Cu + ZnSO4
干电池—— Zn- Mn普通干电池
负极(锌筒):Zn-2e-=Zn2+
以下为附加内容 不需要的朋友下载后 可以编辑删除,谢谢
让更多的农民成为新型职业农民
中央农业广播电视学校
刘天金
2013˙05˙07
陕西
农业部部长韩长赋:
这是一项基础性工程、创新性工作,
要大抓特抓、坚持不懈。
——让更多的农民成为新型职业农民(目标) ——生产更多更好更安全的农产品供给社会(方向)
负极:Zn + 2OH--2e- = Zn(OH)2 正极:2MnO2 + 2H2O + 2 e- = 2MnO(OH) + 2OH- 总反应:Zn + 2MnO2 + 2H2O = Zn(OH)2 + 2MnO(OH)
铅蓄电池
(1)电极材料及原料 正极:PbO2 (2)电解质溶液 负极:Pb H2SO4溶液
负极H2:2H2+4OH- -4e- =4H2O 正极O2:O2+2H2O +4e- =4OH总反应: O2+2H2 =2H2O
燃 料 电 池
介质
电池反应: 2H2 +O2 = 2H2O 负极 正极 负极 正极 负极 正极
酸性 中性 碱性
2H2 - 4e- = 4H+ O2 + 4H+ + 4e-= 2H2O
3)优点:
①能量转换效率高,供能稳定可靠。 ②可以制成各种形状和大小、不同容量和电压的电池 和电池组,使用方便。 ③易维护,可在各种环境下工作。
三、常见电池电极反应式的书写 铜锌原电池 先分析
正、负极,再根据负极发 生氧化反应,正极发生还 原反应的规律书写电极反 应式。
负极: Zn-2e-=Zn2+
正极(石墨):2MnO2+2NH4++2e-=Mn2O3+2NH3+H2O
总反应:Zn+ 2MnO2+2NH4+=Zn2++ Mn2O3+2NH3+H2O
碱性Zn- Mn干电池
锌锰碱性电池是一种新型的干电池。 正极材料为MnO2 ,负极材料为Zn, 还原产物为MnOOH,电解质是KOH溶液, 总: Zn + 2MnO2 + 2H2O = Zn(OH)2 + 2MnOOH 请写出电极反应式并分析其工作原理。
书写步骤:(1)写出燃烧反应,根据电解液改写燃 料电池总反应; (2)写出正极的电极反应式(一般较简单);
(3)由燃料电池总反应减去正极的电极反应式得负极 的电极反应式。
正极反应一般为 ①酸性介质 O2+4H++4e-=2H2O ②碱性介质
O2+2H2O+4e-=4OH-
(1)氢氧燃料电池
氢氧燃料电池是一种新型的 化学电池,其构造如图示: 两个电极均由多孔性碳制成, 通入的气体由孔隙逸出,并 在电极表面放电。碱性介质
CH4燃料电池(酸性介质)
1、燃料电池总反应: CH4+2O2=CO2+2H2O ① 2、正极反应:O2+4H++4e-=2H2O ② 3、负极反应:①-②×2,得: CH4-8e-+2H2O=CO2+8H+
(3)甲醇燃料电池(酸性介质) 总反应: 2CH4O + 3O2 === 2CO2 + 4H2O 正极的电极反应式为: 3O2+12e-+12H+ === 6H2O 负极的电极反应式为: 2CH4O-12e-+2H2O === 12H++ 2CO2
2H2 - 4e- = 4H+ O2 + 2H2O + 4e-= 4OH-
2H2 +4OH-- 4e- = 4H2O O2 + 2H2O + 4e-= 4OH-
(2)CH4燃料电池(碱性介质)
1.燃烧总化学反应: CH4+2O2→CO2+2H2O
2.燃料电池总反应:
CH4+2OH-+2O2 = CO3 2 -+3H2O 3.正极: 2O2+4H2O+8e-= 8OH4.负极: CH4+10OH--8e-= CO32-+7H2O
甲醇燃料电池(碱性介质)
总反应式: 2CH4O + 3O2 +4KOH === 2K2CO3 + 6H2O 正极的电极反应式为: 3O2+12e- + 6H20===12OH负极的电极反应式为: 2CH4O -12e-+16OH- === 2CO32- +12H2O
小
结
①本节课学习了哪些知识和学习方法? ②通过本节课的学习你有哪些收获或感想?
(3)电极反应式:
负极(Pb): Pb- 2e-+ SO4 2 - =PbSO4
正极(PbO2): PbO2+4H++SO42 -+ 2e-= PbSO4 +2H2O 总反应: Pb+PbO2+2H2SO4 =2PbSO4 +2H2O
铅蓄电池的放电过程——原电池
负极:Pb+SO42- =PbSO4+2e正极:PbO2+SO42-+4H++2e - =PbSO4+ 2H2O 电池总反应:Pb+ PbO2+2SO42- +4H+
铅蓄电池的充电过程——电解池
阴极: PbSO4 +2e- = Pb+SO42阳极: PbSO4+ 2H2O = PbO2+SO42-+4H++2e电池总反应:2PbSO4+2H2O= Pb+ PbO2+2SO42- +4H+
=2PbSO4+2H2O
铅蓄电池的充放电过程
放电
PbO2 + Pb + 2H2SO4
第二节 化学能与电能
(第2课时)
学习目标 (1). 掌握简单的电极反应 的书写。 (2). 了解常见化学电池的组成与应 用。 (3). 通过原电池原理加强对新型 原电池、燃料电池的掌握和理解。
一,常见的各类电池
锂电池
叠层电池
各 类 电 池
干电池
纽扣电池
二:化学电池
1)概念: 将化学能变成电能的装置 ①一次电池又称不可充电电池——如:干电池 2)分类: ②二次电池又称充电电池——蓄电池 ③燃料电池
