2014化学化学平衡及图像
化学平衡移动(图像)

实验数据作出下列关系图下列判断一定错误的是
A.图I研究的是不同催化剂对反应的影响,且乙使用的催化
剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
√C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
√D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催
化剂效率较高
1.下列图象中,不能表示反应A2(g)+ 3B2(g) 2AB3(g)(△Q>0)平衡体系 的是…( D )
V(逆)
V(逆)
0 ⑤增大压强
t
0
⑥减小压强
t
增大压强时,正逆反应速率都
增大,但
增大程度相同 ,减小压强时,正逆反应速率都 减小 ,但 减小程度相同 ,故平衡 不 移动。
2、压强变化对化学平衡的影响
结论: mA(g)+nB(g) pC(g)+qD(g)
对于有气体参与的反应:
(1)若m+n==p+q : 增大压强,平衡往气体分子数减少的方向移动 ;
二、速率-时间图:可用于:
பைடு நூலகம்
1) 已知引起平衡移动的因素,判断反应是
吸热或放热,反应前后气体体积的变化。
2) (已知反应)判断引起平衡移动的因素。
v v正
•引起平衡移动的因素是
v逆
t1
t2
增大反应物浓度,平衡 t 将向 正 方向移动。
v v正
•引起平衡移动的因素是 减小生成物浓度,平衡
v逆
t1
t2
t 将向 正 方向移动。
1、以mA(g)+nB(g) 为例
qC (g);
若增大压强,或升高温度,重新达到平
衡v正、v逆变化如图,则△Q_<__0, m+n__>_q
高中化化学平衡有关图像

B.若a+b=c,则t0时只能是加入了催化剂
C.若a+b≠c,则t0时只能是增大了容器的压强
D.若a+b≠c,则t0时只能是加入了催化剂
12.在一定条件下,可逆反应2X(g) 2y(g)+z(g)(正反应放热),在t1时达到平衡,然后在t2时开始加热至一定温度后停止加热并保温,到t3时又建立平衡,下图中能表示这一变化情况的是()
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
4.反应:L(固)+aG(气) bR(气)达到平衡时,温度和压强对该反应的影响图所示:图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断
A.上述反应是放热反应B.上述反应是吸热反应
3.(四川卷)一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:下列描述正确的是()
A.反应开始到10 s,用Z表示的反应速率为0.158 mol/(L·s)
B.反应开始到10 s,X的物质的量浓度减少了0.79 mol/L
C.反应开始到10 s时,Y的转化率为79.0%
勒沙特列原理适应于各种平衡体系,有着深刻的内涵,学习时要从原理入手,剖析潜在的规律,总结出操作性较强的判断标准.
专练2:可逆反应aA(g)+bB(g) pC(g),反应时间与C%(产物C的体积分数)函数关系如图所示。A图表示压强不同的曲线,B图表示的是温度不同的曲线,试比较下列大小关系:P1______P2,T1______T2,ΔH_____0,a+b______p。
[方法技巧]化学平衡经常会以图像来考查,不仅要掌握影响化学平衡的因素及勒沙特列原理,同时还要掌握识图的方法和一些规律,如“先拐先平数值大”和“定一议二”等原则。
化学平衡图像专题完整各类型图像

or personal use only in study and research; not for commercial use化学平衡图像专题解题思路:一看轴(纵、横坐标的意义),二看线(线的走向和变化趋势),三看点(起点、折点、交点、终点、零点的意义),四看要不要作辅助线(等温线、等压线、平衡线),五看量的变化(如浓度变化、温度变化等),六想规律(外界条件对反应速率的影响规律和化学平衡移动规律)1. 速率-时间图1. 对于达平衡的可逆反应X+Y W+Z,增大压强则正、逆反应速度(v)的变化如上图,分析可知X,Y,Z,W的聚集状态可能是()。
(A)Z,W为气体,X,Y中之一为气体(B)Z,W中之一为气体,X,Y为非气体(C)X,Y,Z皆为气体,W为非气体(D)X,Y为气体,Z,W中之一为气体2. 在一定条件下,反应A(g)+B(g)C(g)(正反应为放热反应)达到平衡后,根据下列图象判断A. B. C. D.E.(1)升温,达到新的平衡的是( )(2)降压,达到新的平衡的是( )(3)减少C的量,移向新平衡的是( )(4)增加A的量,移向新平衡的是( )(5)使用催化剂,达到平衡的是( ) 2. 浓度(物质的量)-时间图3. 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如右图,下列表述中正确的是()A.反应的化学方程式为:2 M NB.t2时,正逆反应速率相等,达到平衡C.t3时,正反应速率大于逆反应速率 D.t1时,N的是M浓度的2倍3. 含量-时间-温度(压强)图4. 可逆反应m A(s)+n B(g ) e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图:下列叙述正确的是()。
(A)达平衡后,加入催化剂则C%增大(B)达平衡后,若升温,平衡左移(C)化学方程式中n>e+f(D)达平衡后,增加A的量有利于平衡向右移动5. 在密闭容器中进行下列反应:M(g)+N(g )R(g)+2L此反应符合下面图像,下列叙述是正确的是()(A) 正反应吸热,L是气体(B) 正反应吸热,L是固体(C) 正反应放热,L是气体(D) 正反应放热,L是固体或液体6. 可逆反应m A(s) + n B(g) p C(g) + q D(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图(T2>T1),根据图中曲线分析,判断下列叙述中正确的是()(A)到达平衡后,若使用催化剂,C的质量分数增大(B)平衡后,若升高温度,平衡则向逆反应方向移动(C)平衡后,增大A的量,有利于平衡向正反应方向移动(D)化学方程式中一定n>p+q7. 现有可逆反应A(气)+B(气)3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:(1)若甲图中两条曲线分别表示有催化剂和无催化剂时的情况,则__ _曲线是表示有催化剂时的情况。
化学平衡移动以及图像

意义:
增大成本较低的反应物的浓度, 提高成本较高的原料的转化率。
化学平衡移动以及图像
思考:
1、在二氧化硫转化为三氧化硫的过程中, 应该怎样通过改变浓度的方法来提高该反应
的程度? 增加氧气的浓度
2、可逆反应H2O(g)+C(s) CO(g)+H2(g) 在一定条件下达平衡状态,改变下列条件, 能否引起平衡移动?CO浓度有何变化? ①增大水蒸气浓度 ②加入更多的碳
图速 率
时 间 关 系
-
升温 正反应吸热 降温
正反应放热 升温 化学平衡移动以及图像
降温
(4)催化剂的影响
催化剂同等程度改变化学反应速率,
V’正= V’逆,只改变反应到达平衡所需要的时间, 而不影响化学平衡的移动。
例:对如下平衡 A(气) + B (气)
2C (气) + D (固)
NH3%随着压强的增大而增大,即平衡 向正反应的方向移动。
解释:加压 →体积缩小 →浓度增大 →正反应速率增大
逆反应速率增大
→ V正>V逆→平衡向正反应方向移动。
说明:增大压强,正逆反应速率均增大,但增大 倍数不一样,平衡化向学平衡着移动体以及积图像缩小的方向移动
1.前提条件:
反应体系中有气体参加且反应前后总体
系和
衡
图减
的
小
影
压
响
强
a + b < c 化学平衡移动以及图像
时
aA(g)+bB(g)
cC(g) 速
压
率画
强
对
化
学
V’正 = V’逆
平
化学平衡图像
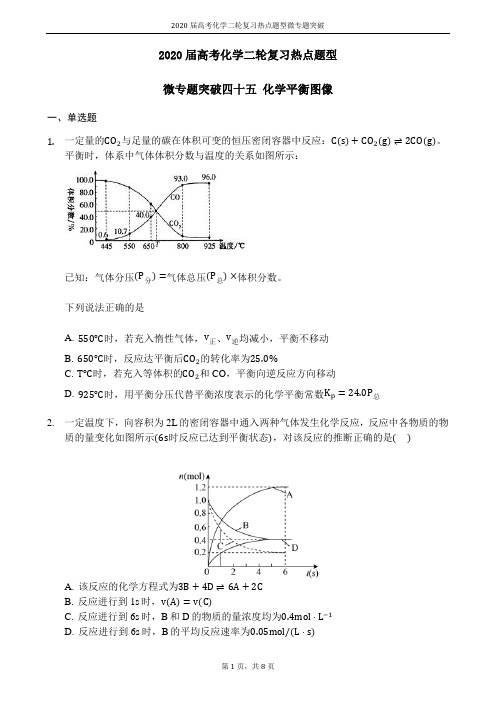
2020届高考化学二轮复习热点题型微专题突破2020届高考化学二轮复习热点题型微专题突破四十五化学平衡图像一、单选题1.一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)⇌2CO(g)。
平衡时,体系中气体体积分数与温度的关系如图所示:已知:气体分压(P分)=气体总压(P总)×体积分数。
下列说法正确的是A. 550℃时,若充入惰性气体,v正、v逆均减小,平衡不移动B. 650℃时,反应达平衡后CO2的转化率为25.0%C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数K p=24.0P总2.一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示(6s时反应已达到平衡状态),对该反应的推断正确的是()A. 该反应的化学方程式为3B+4D⇌6A+2CB. 反应进行到1s时,v(A)=v(C)C. 反应进行到6s时,B和D的物质的量浓度均为0.4mol⋅L−1D. 反应进行到6s时,B的平均反应速率为0.05mol/(L⋅s)3.在一定条件下,使10mol SO3在体积固定为2L的密闭容器中发生反应:2SO2(g)+O2(g)⇌2SO3(g),则下图中正确的是(M表示混合气体的平均相对分子质量)()A. B.C. D.4.如图所示的各图中,表示2A(g)+B(g)⇌2C(g)(△H<0)这个可逆反应的正确图象为(注:Φ(C)表示C的质量分数,P表示气体压强,C表示浓度)()A. B.C. D.5.下列叙述与图象对应符合的是()A. 对于达到平衡状态的N2(g)+3H2(g)⇌2NH3(g)在t0时刻充入了一定量的NH3,平衡逆向移动B. 对于反应2A(g)+B(g)⇌C(g)+D(g)△H<0,p2>p1,T1>T2C. 该图象表示的化学方程式为:2A=B+3CD. 对于反应2X(g)+3Y(g)⇌2Z(g)△H<0,y可以表示Y的百分含量6.在密闭容器中,反应X2(g)+Y2(g)⇌2XY(g)△H<0达到甲平衡,仅改变某一条件后,达到乙平衡.对此过程的分析正确的是()A. 可能是减小了反应物的浓度,反应物X2转化率一定减小B. 可能是加入了催化剂,反应物X2百分含量(X2%)将增大2020届高考化学二轮复习热点题型微专题突破C. 可能是缩小了容器的体积,但该反应的平衡常数保持不变D. 可能是升高了温度,该反应的平衡常数一定减小7.反应:2X (g)+Y(g)⇌2Z(g)在不同温度和压强下的产物Z的物质的量和反应时间t的关系如下图所示,下列判断正确的是()A. P1>P2T1>T2△H<0B. P1>P2T1<T2△H<0C. P1<P2T1>T2△H>0D. P1<P2T1<T2△H>08.在一个固定容积的密闭容器中,可发生以下反应:A(g)+B(g)⇌xC(g)△H=?,符合图(a)所示的关系,其中w(C)为C的质量分数,由此推断关于图(b)的说法正确的是()A. P3>P4,y轴表示A的转化率B. P3<P4,y轴表示B的体积分数C. P3<P4,y轴表示混合气体的平均相对分子质量D. P3>P4,y轴表示混合气体的密度9.图中表示2NO(g)+O2(g)⇌2NO2(g)△H<0,能正确反映该可逆反应变化的图象是()A. B.C. D.10.某化学研究小组探究外界条件对化学反应mA(g)+n(B)(g)⇌pC(g)的速率和平衡的影响图像如下,下列判断正确的是()A. 由图1可知,T1<T2,该反应正反应为吸热反应B. 由图2可知,该反应m+n<pC. 图3中,表示反应速率v(正)>v(逆)的是点3D. 图4中,若m+n=p,则a曲线一定使用了催化剂11.在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)ΔH<0下列分析中正确的是()A. 图Ⅱ研究的只是t0时使用催化剂对反应速率的影响B. 图Ⅰ研究的是t0时缩小容器体积对反应速率的影响C. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高D. 图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂12.某密闭容器中发生如下反应:2X(g)+Y(g)⇌Z(g);△H<0如图表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的用量.则下列说法中不正确的是()A. t3时降低了压强B. t5时提高了温度C. t1−t2时该反应的平衡常数小于t6时反应的平衡常数D. t6时刻后反应物的转化率最低二、填空题13.汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)⇌2NO(g)△H>0,已知该反应在240℃,平衡常数K=64×10−4.请回答:(3)将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是______(填字2020届高考化学二轮复习热点题型微专题突破母序号).14.元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4−(绿色)、Cr2O72−(橙红色)、CrO42−(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:(2)CrO42−和Cr2O72−在溶液中可相互转化。
化学选修4《化学平衡》化学平衡图像共28页

11、用道德的示范来造就一个人,显然比用法律来约束他更有价值。—— 希腊
12、法律是无私的,对谁都一视同仁。在每件事上,她都不徇私情。—— 托马斯
13、公正的法律限制不了好的自由,因为好人不会去做法律不允许的事 情。——弗劳德
14、法律是为了保护无辜而制定的。——爱略特 15、像房子一样,法律和法律都是相互依存的。——伯克
▪
26、要使整个人生都过得舒适、愉快,这是不可能的,因为人类必须具备一种能应付逆境的态度。——卢梭
▪
27、只有把抱怨环境的心情,化为上进的力量,才是成功的保证。——罗曼·罗兰
▪
28、知之者不如好之者,好之者不如乐之者。——孔子
▪
29、勇猛、大胆和坚定的决心能够抵得上武器的精良。——达·芬奇
▪
30、意志是一个强壮的盲人,倚靠在明眼的跛子肩上。——叔本华
谢谢!28Fra bibliotek
化学平衡图像及等效平衡

练习3
右图表示在密闭容器中反应:2SO2+O2 2SO3+Q达到平衡时 ,由于条件改变而引起反应 速度和化学平衡的变化情况,ab过程中改变 的条件可能是 ;bc过程中改变的条件可能 是 ; 若增大压强时,反应速度变化情况 画在c—d处.
V正
V逆
升温
减小[SO3]
三、x% – t 图
x% (或用φ(C) 表示) 可以表 示反应物、生成物在反应体系中的 物质的量百分数(体积分数)、或 表示反应物的转化率等; t表示时间;
V
V正 V逆
A t
V正
V逆 D t
V正
B t
V正
C t
说明
上述图象的特点是有一速 率改变,随后正逆反应速率再 发生变化,直至两者相等建立 新的平衡。是改变某一物质浓 度而引起化学平衡移动的特征。
二、v – t 图
练习2
练习2
在密闭容器,一定条件下进行反应, mA(g)+nB(g) pC(g)+qD(g) 若增大压强或升高温度,重新达到平衡,变化过 程均如图所示,则对该反应叙述正确的是(BD ) A.正反应是吸热反应 B.逆反应是吸热反应 C.m+n>p+q D.m+n<p+q
例3:下列图线分别有哪些含义?
V V V V
V正 V逆 A
t
V正 V逆
V逆 V正
V逆 V正
t
B
t
C
D
t
A.升温时,正、逆反应速率均增大,但吸热反应方 向的速率增得更多,正反应为吸热反应; 或气体反应时增压,正逆反应速率均增大,但气体 体积大的增大得更多,正反应为气体缩小的反应。 C与A 正、逆相反。
化学课件《化学平衡——化学平衡图像》优秀ppt 人教课标版

v
V(正)
V(正)
V(逆)
V(逆)
时间 t
练习6:
已知反应: 3A( g ) + B( g )
C( s ) + 4D( g )
下图中a、b 表示一定条件下,D的体积分数随时间t的
0.4
(2)反应的化学方程式是:
0.3
______2_A_____2_B__+_C_______
0.2 0.1
(3)8min后,若将容器的体
积缩小一半,c(A)将___增_大____
c(B)将___增_大____c(C)将__增__大___ 0
(填增大、减小、不变);
B A
C 时间(min)
平衡将向___逆_____反应方向移动;达到新的平衡时混 合气体的相对平均分子质量是_____增__大____ , A的转化率 ____减_小____。
A. N2(g) + 3H2(g)
2NH3(g) △H < 0
B. H2(g) + I2(g)
2HI(g) △H < 0
C. 2SO3(g)
2SO2(g) + O2(g) △H > 0
D. 4NH3(g) + 5O2(g) 4NO(g) + 6H2O(g) △H < 0
练习5:
对于达到平衡的可逆反应: X + Y W + Z 增大压 强则反应速率的变化图象如图所示。据此分析 X、Y、 W、Z的聚集状态是
谢谢
85.每一年,我都更加相信生命的浪费是在于:我们没有献出爱,我们没有使用力量,我们表现出自私的谨慎,不去冒险,避开痛苦,也失去了快乐。――[约翰·B·塔布] 86.微笑,昂首阔步,作深呼吸,嘴里哼着歌儿。倘使你不会唱歌,吹吹口哨或用鼻子哼一哼也可。如此一来,你想让自己烦恼都不可能。――[戴尔·卡内基]
化学平衡图像专题(超详细版)

一、浓度 - 时间图:
例:
c
0.9 0.6 0.3
可用于:
1)写出化学反应方程式:
C A B
t
A+2B 3C A的转化率=33.3% B的转化率=66.7%
2)求反应物的转化率:
使用催化剂
练习:反应N2(g)+3H2(g)
2NH3(g) △H<0 在某一时间段中
反应速率与反应过程的曲线关系如图,则图中氨的百分含量最低的
时间段是( A.t0-t1 C.t3-t4
) ,氨DB的..Att百25--分tt含63 量最高的时间D段是( )
mA(g)+nB(g)
C% C2% C1%
t2
引起平衡移动的因素是 __增__大__反__应__物__浓__度__,平衡将
t 向_____方向正移动。vΒιβλιοθήκη v正v逆t1
t2
引起平衡移动的因素是 _减__小__生__成__物__浓__度___,平衡将
t 向_____方正向移动。
已知对某一平衡改变温度时有如下图变化, 则温度的变化是________(升高或降升低高),平衡向 ______反应方向移动,正正反应是______热反应。
pC(g)+qD(g)
A%
200℃ 300℃
正反应吸热 m+n=p+q
P
判断m+n与p+q的关系?正反应是放热还是吸热?
对于2A(g)+B(g) C(g)+3D(g)(正反应吸热)有 如下图所示的变化,图中Y轴可能表示:
化学平衡图像

2.c/n-t图象
看起点和终点
浓度减小的是 反应物 ,浓度增大的是生成物 , 若反应物没有全部转化为生成物,即应该用可逆符号。
看图:写反应方程式
VA:VB:VD:VE = ΔCA: ΔCB: ΔCD: ΔCE
= ΔnA: ΔnB: ΔnD: ΔnE =a:b:d:e 2.0 1.5
n
1.0
0.5 0
首先要把握大方向,即升温使正、逆反应速率都变大,所以 B不会是答案;再看起点和终点,由于原反应是平衡的(V逆=V 正),因而起点相同,又由于再次达到平衡(V正=V逆),因而 终点相同,故A不是答案;由于正反应是放热反应,所以升温 使V正和V逆都增大,但逆反应增大得更多,故V逆更大,即V 逆的曲线斜率大,故答案为C。
C A B
t
2A+ B
3C
浓度——平衡——时间曲线
mA(g)+nB(g)
pC(g)+qD(s) △H
此图在t2时,如果是加热,那么△H值是大于0,还 是小于0?如果是减压,那么m+n与p的关系如何?
△H > 0 n
m+n < p
C
A或B
0
t1 t2 t3
t
速度-温度曲线
速度-压强曲线
百分含量
百分含量-温度曲线
pC(g)+qD(g) △H 300C m+n > p+q
200C 100C 分析图像: P1 P
△H < 0
0
物质百分含量——压强——温度曲线
3、对于2A(g)+B(g) C(g)+3D(g)(正反应吸热) 有如下图所示的变化,图中Y轴可能表示: AD
《化学反应速率和化学平衡的图像》

增大压强
v(正)、v(逆)均增大; 若Δ Vg<0,则v(正)强变, υ (逆)弱变;v(正)>v(逆),平衡 向右移动
减小压强
v(正)、v(逆)均减小; 若Δ Vg<0,则v(正)强变, υ (逆)弱变;v(正) <v(逆),平 衡向左移动
改变压强
v(正)、v(逆)均增大(或减 小); 若Δ Vg=0, 则v(正) =v(逆), 平衡不移动
[例3]
可逆反应aA(g)+bB(g) cC(g)+dD(g) △H<0 在相同温度、不同压强时,A的转化率跟反应时间 的关系如图,则P1 < P2, a+b < c+d (填>、<或=)
先拐先平, P2>P1
P1 →P2 增大压强,A的转化率减小,
则平衡逆向移动,逆向为气体系数减小的反应
[小结]
看图,分析图像特点→依据图像的拐点→比较
温度或压强的的大小→分析改变条件后,y轴的变
化情况→结合平衡移动原理 →得到相关结论
[练习3]
在密闭的容器中进行如下的反应: H2(g)+I2(g) 2HI(g),在温度T1和T2时,产物的 量与时间的关系如下图所示,符合图象的正确的判 断是( D) A.T1>T2,△H>0 B.T1>T2,△H<0 C.T1<T2,△H>0 D.T1<T2,△H<0
化学反应速率和化学 平衡的图像
考试说明要求
理解外界条件(浓度、温度、压强、催化剂等) 对反应速率及化学平衡的影响,认识其一般规 律。
1.反应速率—时间图象 2.反应速率—温度(压强)图象 3. 含量—时间-温度(压强)图象 4. 转化率—温度、压强图象
1、浓度对化学反应速率影响及平衡移动的图像
条件变化 速率变化和平衡移动方向 V—t图像
2014高考化学考点复习讲析——化学平衡的图像 (人教版).pdf

2014高考化学考点复习讲析 考点17 化学平衡的图像 考点聚焦 1.进一步掌握理解浓度、温度、压强、催化剂等条件对化学反应速率和化学平衡移动的影响。
2.能够通过对图形、图表的观察,获取有关的感性知识和印象,并对这些感性知识进行初步加工和记忆 知识梳理 1.牢固掌握有关的概念与原理,尤其要注意外界条件的改变对一个可逆反应来讲,正逆反应速率如何变化,化学平衡如何移动,在速度-时间图、转化率-时间图、反应物的含量-浓度图等上如何体现。
要能够画出有关的变化图象。
2.对于化学反应速率的有关图象问题,可按以下的方法进行分析: (1)认清坐标系,搞清纵、横坐标所代表的意义,并与有关的原理挂钩。
(2)看清起点,分清反应物、生成物,浓度减小的是反应物,浓度增大的是生成物一般生成物多数以原点为起点。
(3)抓住变化趋势,分清正、逆反应,吸、放热反应。
升高温度时,v(吸)>v(放),在速率-时间图上,要注意看清曲线是连续的还是跳跃的,分清渐变和突变,大变和小变。
例如,升高温度,v(吸)大增,v(放)小增,增大反应物浓度,v(正)突变,v(逆)渐变。
(4)注意终点。
例如在浓度-时间图上,一定要看清终点时反应物的消耗量、生成物的增加量,并结合有关原理进行推理判断。
3.对于化学平衡的有关图象问题,可按以下的方法进行分析: (1)认清坐标系,搞清纵、横坐标所代表的意义,并与勒沙特列原理挂钩。
(2)紧扣可逆反应的特征,搞清正反应方向是吸热还是放热,体积增大还是减小、不变,有无固体、纯液体物质参加或生成等。
(3)看清速率的变化及变化量的大小,在条件与变化之间搭桥。
(4)看清起点、拐点、终点,看清曲线的变化趋势。
(5)先拐先平。
例如,在转化率-时间图上,先出现拐点的曲线先达到平衡,此时逆向推理可得该变化的温度高、浓度大、压强高。
(6)定一议二。
当图象中有三个量时,先确定一个量不变再讨论另外两个量的关系。
化学平衡图像专题(超详细版)

化学平衡图像专题(超详细版)化学平衡是化学反应中一个非常重要的概念,它描述了在封闭系统中,反应物和物之间的动态平衡状态。
在化学平衡状态下,反应物和物的浓度保持不变,尽管反应仍在进行。
为了更好地理解和应用化学平衡原理,我们可以通过图像来直观地展示和解释这一概念。
一、化学平衡图像概述1. 反应物和物浓度随时间变化的曲线图2. 反应速率随时间变化的曲线图3. 平衡常数与温度、压力等条件的关系图二、反应物和物浓度随时间变化的曲线图在化学平衡图像中,反应物和物浓度随时间变化的曲线图是最常见的一种。
这种图像可以清晰地展示出反应物和物在反应过程中的浓度变化趋势,以及它们何时达到平衡状态。
1. 反应物浓度随时间变化的曲线图:在反应初期,反应物浓度较高,随着反应的进行,反应物浓度逐渐降低。
当反应达到平衡状态时,反应物浓度不再变化,形成一条水平直线。
2. 物浓度随时间变化的曲线图:在反应初期,物浓度较低,随着反应的进行,物浓度逐渐升高。
当反应达到平衡状态时,物浓度不再变化,形成一条水平直线。
3. 反应物和物浓度随时间变化的曲线图:将反应物和物浓度随时间变化的曲线图叠加在一起,可以更直观地展示它们之间的浓度关系。
在平衡状态下,两条曲线会相交,形成一个平衡点。
三、反应速率随时间变化的曲线图反应速率随时间变化的曲线图可以展示出反应速率在反应过程中的变化趋势,以及它如何受到反应物浓度、温度、压力等条件的影响。
1. 反应速率随时间变化的曲线图:在反应初期,反应速率较快,随着反应的进行,反应速率逐渐降低。
当反应达到平衡状态时,反应速率不再变化,形成一条水平直线。
2. 反应速率与反应物浓度的关系图:反应速率通常与反应物浓度成正比,即反应物浓度越高,反应速率越快。
当反应物浓度达到一定值时,反应速率达到最大值,不再随反应物浓度变化。
3. 反应速率与温度的关系图:反应速率通常与温度成正比,即温度越高,反应速率越快。
这是因为温度升高,反应物分子运动加快,碰撞频率增加,从而提高反应速率。
化学平衡移动-及常见图像分析分解

增大压强,可以加快反应速率 4、催化剂:
使用正催化剂,可以同等程度的加快正逆反应速率
一、浓度的变化对化学平衡的影响
V
V(正) V(逆)
V(正) V(逆)
0
t1
t
①增大反应物浓度
V
V(正)
V(正)
V(逆)
V(逆)
0
t1
△H <0
m+n>p+q
mA(g)+nB(g) pC(g)+qD(g);△H
m+n<p+q
m+n=p+q
mA(g)+nB(g) pC(g)+qD(g);△H
⑵含量-时间图
△H >0
△H >0
mA(g)+nB(g) pC(g)+qD(g);△H
A
C. a=b+c D. a=b=c
三、温度变化对化学平衡的影响
2NO2
红棕色
N2O4 △H<0
无色
三、温度变化对化学平衡的影响
2NO2
V
N2O4 △H < 0
V(逆) V吸热
V(正)
V(正) V放热
V(逆)
0 ①升高温度 t
结论:其他V条吸件>不V变放,平升衡高向温吸度热平方衡向向移吸动热反应方向 移动
结论:在其他条件不变时,温度升高,会 使化学平衡向吸热反应的方向移动,温度 降低会使化学平衡向放热的方向移动。
注意: 温度的变化一定会影响化学平衡,使 平衡发生移动
[总结]改变反应条件时平衡移动的方向
改变反应条件
化学平衡图像

T
•正反应吸热 T
C%
A%
450℃
•正反应放热
T
P1
P
•m+n<p+q
练习一
•对于2A(g)+B(g) C(g)+3D(g)(正反应吸热)有 如下图所示的变化,图中Y轴可能表示:
A、B物质的转化率
Y
B、正反应的速率
C、平衡体系中的A%
300℃ D、平衡体系中的C%
200℃
100℃
P
A、D
练习二
右图曲线a表示放热反应X(g)+Y(g) Z(g)+M(g)+N(s)进行过程中X的转化率 随时间变化的关系。若要改变起始条件, 使反应过程按b曲线进行,可采取的措 施是( ) A.升高温度 B.加大X的投入量 C.加催化剂 D.减小体积
A. 加入催化剂 C. 降低温度
B. 增大Y的浓度 D. 增大体系压强
三、某物质的转化率(或百分含量)-时间温度(或压强)图:
练习:对于反应mA(g)+nB(g) pC(g)+qD(g), ① 判断正反应为放热还是吸热反应; ② m+n与p+q的关系
B%
T2P2 T1P2 T1P1
t •m+n<p+q •正反应吸热
练习:对于反应
mA (g) + nB (g) pC (g) 有如
C%
1.01*106Pa 1.01*105Pa
A%
1.01*104Pa
200℃
300℃
T
P
•正反应吸热 m+n>p+q
•正反应吸热 m+n=p+q
反应
化学平衡图像1(1)

解题思路 1.看懂图
(1.)看清纵坐标与横坐标表示的意义 (2.)看线(即线的走向和变化趋势), (3.)看点(即起点、拐点、交点、终点), (4.)看是否要作辅助线(如等温线、等压线),
2.联想规律:联想外界条件的改变对化学反应速率和 化学平衡的影响规律。
3.作出判断:根据图像中表现的关系与所学规律相 对比,作出符合题目要求的判断
加入了lNO2
(4)若要达到与最后相同的化学平衡状态,在第25分钟
时还可以采取的措施是 BD
A.加入催化剂
B.缩小容器体积
C.升高温度
D、加入一定量的N2O4
600 ℃时,在一密闭容器中,将二氧化硫和氧气混合发生反应:
2SO2(g)+O2(g) 2SO3(g);ΔH<0。反应过程中SO2、O2、SO3物质 的量变化如下图,
应速率v正与逆反应速率v逆随时间变化的关系
如图,则图中阴影部分的面积可表示
.
B物质的量浓度减少量
v(B)
V正
V逆
t
小结:
v-t图: 1.改变的条件分二类:
浓度一类,温度和压强一类。
2.看渐变和突变来确定:
突变是温度和压强,有渐变是浓度。
3.条件如何改变?
正逆反应速率的相对大小
4.平衡如何移动?
增大在原平衡上方变。减小在原平衡下方变
作业:1.课堂新坐标:P140.2.3. 2.预习课堂新坐标P140-141类型3.4.5
谢谢大家的聆听!
好好学习,天天向上!
12
12
(1)反应进行至20 min时,曲线发生变化
的原因: 通入了氧气
(2)反应进行到10 min至15 min的曲线变
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
选修4第二章第三节化学平衡讲义一、可逆反应、化学平衡及其建立1、化学平衡的研究对象:可逆反应2、化学平衡的建立:一定条件下,当可逆反应进行到v正=v逆即正反应消耗的量与逆反应生成的量相等,反应物和生物的浓度不再发生变化时,可逆反应就达到了化学平衡。
3、达到化学平衡的标志:直接标志:①速率关系:正逆反应速率相等。
即V正=V逆②含量关系:反应混合物各组分的浓度、质量分数、物质的量、体积分数、分子数之比保持不变间接标志:①混合气体的总压强、总体积、总物质的量、平均相对分子质量不随时间改变而改变②混合气体的密度不随时间改变而改变(间接标志适用于研究的量本身是变化的)特殊标志:①对于有色物质参加反应,如果体系颜色不变,反应达到平衡②对于吸热或放热反应,如果体系温度不变,反应达到平衡二、化学平衡的移动1、化学平衡只有在______________时才能保持平衡,当外界条件(浓度、温度、压强)改变时,化学平衡会被______________,由于条件变化对正逆反应速率的影响不同,致使v正__________v逆,然后在新条件下建立___________。
化学平衡移动的定义:化学上把这种可逆反应中旧化学平衡的破坏、新化学平衡建立的过程叫做化学平衡的移动2、化学平衡移动的性质:⑴若外界条件变化引起v正>v逆:平衡向______方向移动⑵若外界条件变化引起v正<v逆:平衡向______方向移动⑶若外界条件变化引起v正=v逆:旧平衡未被破坏,平衡_________ 巧记:化学平衡总是向反应速率______的方向移动三、平衡移动原理(勒夏特列原理)1、原理表述:如果改变影响平衡的一个条件(浓度、温度、压强等),化学平衡就向_______这种改变的方向移动。
2、理解要点:①定性理解——平衡移动的方向,必须向能够减弱外界条件的方向移动②定量理解——平衡移动的程度,只是在一定程度上减弱外界条件的改变,不能完全抵消外界条件的变化,更不能使之“逆转”。
如2NO2(g)≒N2O4(g),压强增大二倍,在新平衡状态下,P1<P2<2P1;或者给某平衡体系升温10度,则反应体系的最终温度T1< T2<T1+10 四、化学平衡图像1.化学平衡图像题的主要特点该类题目的主要特点是通过多种图像,对化学反应速率和化学平衡的有关知识、规律进行分析考查。
题目往往是灵活性强、迷惑性大,涉及内容多,要求高,特别注重对知识综合应用能力和分析判断能力的考查。
2.解答化学平衡图像题的方法(1)化学平衡图像题的解答步骤①看图像:一看面(即纵坐标与横坐标的意义),二看线(即线的走向和变化趋势),三看点(即起点、折点、交点、终点),四看辅助线(如等温线、等压线、平衡线等),五看量的变化(如浓度变化、温度变化等)。
②想规律:联想外界条件的改变对化学反应速率和化学平衡的影响规律。
③作判断:根据图像中表现的关系与所学规律相对比,作出符合题目要求的判断。
(2)化学平衡图像题的解答原则:以可逆反应a A(g)+b B(g)c C(g)为例说明。
①“定一议二”原则在化学平衡图像中,包括纵坐标、横坐标和曲线所表示的意义三个量,确定横坐标所表示的量后,讨论纵坐标与曲线的关系或确定纵坐标所表示的量,讨论横坐标与曲线的关系。
如:反应2A(g)+B(g)2C(g)达到平衡,A的平衡转化率与压强和温度的关系如图所示:定压看温度变化,升温曲线走势降低,说明A的转化率降低,平衡向左移动,正反应是放热反应。
定温看压强变化,此反应是反应后气体体积减小的反应,压强增大,平衡向右移动,A的转化率增大,故p2>p1②“先拐先平,数值大”原则在化学平衡图像中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高(如图A)或表示的压强较大(如图B)。
A.表示T2>T1,正反应是放热反应。
B.表示p1<p2,A是反应物,正反应为气体总体积缩小的反应,即a+b>c。
练习一、基础知识排查落实(正误判断):1、可逆反应达到化学平衡时,各成分的含量不再发生变化()2、当反应速率发生改变时,化学平衡会发生移动()3、化学平衡发生移动时,反应速率发生改变()4、化学平衡发生移动时,各成分的浓度会发生改变()5、化学平衡发生移动时,各成分的百分含量会发生改变()6、各成分的浓度会发生改变时,化学平衡一定发生移动()7、当化学平衡正向移动时,反应物的转化率一定提高了()8、当化学平衡正向移动时,正反应速率一定提高了()9、当化学平衡正向移动时,生成物的含量一定提高了()10、10、当化学平衡正向移动时,生成物的产量一定提高了()11、依据勒夏特列原理,工业合成氨时,采取高温更有利于提高产率()练习二、重要方法----平衡标志的判断1、一定条件下反应2AB(g) A2(g)+B2(g)达到平衡状态的标志是 A.单位时间内生成nmolA2,同时消耗2n molAB B.容器内,3种气体AB、A2、B2共存 C.AB的消耗速率等于A2的消耗速率 D.容器中各组分的体积分数不随时间变化2、对可逆反应4NH3(g)+ 5O2(g)4NO(g)+ 6H2O(g),下列叙述正确的是A.达到化学平衡时,4υ正(O2)= 5υ逆(NO )B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大 D.化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)3、已知反应A2(g)+2B2(g)2AB2(g)△H <0,下列说法正确的A.升高温度,正向反应速率增加,逆向反应速率减小B.升高温度有利于反应速率增加,从而缩短达到平衡的时间C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动4、反应4A(g)+5B(g)4C(g)+6D(g) △H =-Q,在一定温度下达到化学平衡状态时,下列说法正确的是A.单位时间里生成n mol C,同时生成1.5n mol D B.若升高温度最终能生成更多的C和DC.单位时间里有4n mol A消耗,同时有5n mol B生成 D.容器里A、B、C、D的浓度比是4:5:4:6练习三、图像题训练(一)、速率随时间变化图(v-t图)1、在一定条件下,反应A(g) +B(g) C(g);△H<0达到平衡后,根据下列图象判断(1)升温,达到新的平衡的是( )A B C D E (2)降压,达到新的平衡的是( )(3)减少C的量,移向新平衡的是( ) (4)增加A的量,移向新平衡的是( ) (5)使用催化剂,达到平衡的是( )2、下列的平衡移动图中,其中能表示由于减少反应物浓度引起化学平衡移动的是()(二)、物质含量(或转化率)随温度、压强变化图1、某可逆反应L(g) + G(g)3R(g);△H >0,本图表示外界条件(温度、压强)的变化对上述反应的影响。
试判断图中y 轴可以表示( )(A)平衡混合气中R 的质量分数(B)达到平衡时G 的转化率(C)平衡混合气中G 的质量分数(D)达到平衡时L 的转化率2、某可逆反应mA(g) + nB(g) pC(g);△H <0,其中m 、n 、p 为配平系数,且m + n > p 。
分析下列各图,在平衡体系中A 的质量分数与温度T 、压强P 关系正确的是( )3、能正确反映出N 2(g) + 3H 2(g) 2NH 3(g);△H <0的关系的是( )(三)、物质含量(或转化率)随时间变化图1、在某恒容的密闭容器中,可逆反应A(g) + B(g)xC(g),有如图所示 的关系曲线,下列说法正确的是 ( ) A .温度:T 1 > T 2B. 压强: P 1 > P 2C. 该正反应是吸热反应D. x 的取值是: x=12、现有可逆反应A(g)+B(g)3C(g),下图中甲、乙、丙分别表示在不 同的条件下,生成物C 在反应混和物中的百分含量(C%)和反应时间的关系:(1)若甲图中两条曲线分别表示有催化剂和无催化剂时的情况,则 曲线是表示有催化剂时的情况。
(2)若乙图中的a 曲线表示200℃和b 曲线表示100℃时的情况,则此可逆反应的正反应是 热反应。
(3)若丙图中两条曲线分别表示不同压强下的情况,则 曲线是表示压强较大的情况。
练习三、化学思想------化学平衡的移动基本思路:已知 “外界条件的改变——反应方程式——平衡移动方向(平衡移动的结果)”三个变量中任意两个,利用勒沙特列原理,就可判断出第三个变量。
1、某温度下,反应 N 2O 4(g ) 2NO 2(g );△H >0,在密闭容器中达到平衡,下列说法中不正确的是( )A .加压时,体积变小,将使正、逆反应速率均增大B .保持体积不变,加入少许 NO 2,将使正反应速率减小,因此平衡向左移动。
C .保持体积不变,加入少许 N 2O 4 ,再达平衡时颜色变深D .保持体积不变,升高温度,再达平衡时颜色变深2、反应:A (气)+3B (气)2C (气);△H <0达平衡后,将气体混和物的温度降低,下列叙述中正确的是( )A .正反应速率加大,逆反应速率变小,平衡向正反应方向移动B .正反应速率变小,逆反应速率加大,平衡向逆反应方向移动C .正反应速率和逆反应速率变小,平衡向正反应方向移动D .正反应速率和逆反应速率变小,平衡向逆反应方向移动3、(辽宁综合03-28)恒温恒压下,在容积可变的器皿中,反应2NO 2(气)N2O 4(气) 达到平衡后,再向容器内通入一定量NO 2,又达到平衡时,N 2O 4的体积分数( ) A .不变 B .增大 C .减小 D .无法判断4、在相同条件下(温度500k )相同体积的甲、乙两容器中,甲中充入1克SO 2、1克 O 2,乙中充入2克SO 2、2克O 2,甲、乙两个容器均发生2SO 2 + O 22SO 3。
下列叙述不正确的是( )(A) 反应速率:乙 > 甲(B )平衡混合物SO 2中的体积分数 :乙>甲(C) SO 2 的转化率:乙 > 甲 (D) 平衡氧气的体积分数:甲 >乙5、一定温度下可逆反应:A(s)+2B(g)2C(g)+D(g);ΔH <0。
现将1 mol A 和2 mol B 加入甲容器中,将4 mol C 和2 mol D 加入乙容器中,此时控制活塞P ,使乙的容积为甲的2倍,t 1时两容器内均达到平衡状态(如图1所示,隔板K 不能移动)。
下列说法正确的是( )A .保持温度和活塞位置不变,在甲中再加入1 mol A 和2 molB ,达到新的平衡后,甲中C 的浓度是乙中C 的浓度的2倍B .保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B 的体积分数均增大C .保持温度不变,移动活塞P ,使乙的容积和甲相等,达到新的平衡后,乙中C 的体积分数是甲中C 的体积分数的2倍D .保持温度和乙中的压强不变,t 2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t 1前的反应速率变化已省略) 答案 BD解析 A 项中,温度和活塞位置不变,甲中再加入1 mol A 和2 mol B 时,甲中压强比原平衡时增大,平衡左移,甲中C 的浓度应小于乙中C 的浓度的2倍,A 错;C 项中由于甲内物质的初始加入量相当于是乙内加入量的一半,当温度不变,移动活塞使甲、乙两容器容积相等时,压强对乙的影响程度大,则乙中C 的体积分数不应是甲的2倍,C 错。
