大学有机化学第十章 羧酸和取代羧酸
大学有机化学羧酸和取代羧酸练习题

⼤学有机化学羧酸和取代羧酸练习题⼤学有机化学羧酸和取代羧酸练习题羧酸和取代羧酸练习题1、下列化合物酸性最强的是( )A. ⼄醇B. ⼄酸C. 碳酸D. 苯酚2、能与托伦试剂反应的是( )A( ⼄酸 B 甲酸 C ⼄醇 D 丙酮3、下列化合物中酸性最强的是( )A CICHCHCOOHB CHCH(CI)COOHC CHC(CI)COOHD CHCHCOOH 22332324、下列化合物加热后放出CO的有( );形成内酯的有,( ) 2 A:,-羟基丁酸 B:⼄⼆酸 C:,-羟基戊酸 D:,-羟基丙酸 5、下列物质酸性最强的是( )A、碳酸B、⼄酸C、⼄醇D、苯酚E、⽔ 6、下列物质酸性最弱的是( )、苯甲酸 B、醋酸 C、碳酸 D、苯酚 E、盐酸 A7、甲酸(HCOOH)分⼦中,含有的基团是( )A、只有醛基B、只有羧基C、没有醛基D、有羰基E、既有羧基⼜有醛基8、区别甲酸和⼄酸可⽤( )A、NaB、FeClC、Cu(OH)D、NaOHE、银氨溶液 3 29、下列化合物属于羧酸的是( )A、CH-CH-OHB、CHCH-O-CHCHC、CH-CHO 323223 3CHCCH33D、CH-COOH E、 3O10、不能发⽣银镜反应的是( )A、甲酸B、丙酮C、丙醛D、葡萄糖E、苯甲醛 11、羧酸的官能团是( )A、羟基B、羰基C、羧基D、醛基E、酮基 12、下列不能与⾦属钠反应放出氢⽓的是( )A、苯甲酸B、苯酚C、⼄醇D、⼄醚E、酒精 13、下列能与⼄酸发⽣酯化反应的是( )A、⼄醛B、丁酮C、甲醇D、苯甲酸E、⼄醚14、关于羧酸下列说法错误的是( )A、能与⾦属钠反应B、能与碱反应C、能与碳酸钠反应D、能与酸反应⽣成酯E、能与醇反应⽣成酯 15、下列属于芳⾹羧酸的是( )A、CHCOOHB、CHCOOHC、HOCHCHOHD、HOOC-COOH 6532216、下列结构式属于草酸的是 ( )A、HOOC-COOHB、CHOHC、CHCOOHD、HOCHCHOH 65652217、既能发⽣酯化反应,⼜能发⽣银镜反应的是( )A、⼄醇B、⼄醛C、⼄酸D、甲酸E、丙酮 18、下列物质酸性排列正确的是( )A、碳酸,⼄酸,苯酚,⼄醇B、⼄酸,苯酚,碳酸,⼄醇C、苯酚,⼄酸,⼄醇,碳酸D、⼄酸,碳酸,苯酚,⼄醇 19、此(CH)CH(CH) COOH 结构的正确命名是( ) 3222 A 、2,3,⼆甲基丁酸 B、4,甲基戊酸 C、2,甲基戊酸D、2,⼄基丁酸E、2,2,⼆甲基丁酸20、下列卤代酸酸性排列正确的是( )A、CHCHCHBrCOOH,CHCHBrCHCOOH,CHBrCHCHCOOH 3232222B、CHCHBrCHCOOH,CHCHCHBrCOOH,CHBrCHCHCOOH 3232222C、CHBrCHCHCOOH,CHCHBrCHCOOH,CHCHCHBrCOOH 2223232D、CHBrCHCHCOOH,CHCHCHBrCOOH,CHBrCHCHCOOH 2223222221、2-甲基丙酸分⼦中,烃基为( )A、甲基B、⼄基C、正丙基D、异丙基E、正丁基 22、⼀定条件下,羧酸分⼦中失去羧基⽣成⼆氧化碳的反应叫做( )A、消去反应B、脱羧反应C、脱⼆氧化碳D、氧化反应 23、下列不属于酮体的是( )A、丙酮B、α—羟基丁酸C、β—羟基丁酸D、β—丁酮酸 24、下列各组有机物属于同分异构体的是( )A、丙酸和乳酸B、丙酸和丙酮酸C、乳酸和丙酮酸D、氯⼄酸和丙酸 25、下列卤代酸酸性最强的是( )A、醋酸B、⼀氯醋酸C、⼆氯醋酸D、三氯醋酸 26、结构式为CHCHCOOH的有机物,其官能团是( ) 32A、羧基B、羰基C、羟基D、酮基E、烃基 27、某化合物能与⾦属钠反应放出氢⽓,能发⽣酯化反应⽣成有⾹味的液体,能与NaCO反应放出CO⽓体,该物质是( ) 232A、⼄醇B、⼄酸C、⽢油D、苯酚28、甲醛和甲酸均可发⽣银镜反应的原因是( )A、均具有羰基B、均具有羧基C、均具有羟基D、均具有醛基 29、既有较强的酸性,能与NaCO反应放出⽓体,⼜能与托伦试剂反应形成银镜3 的物质是( )A、甲醛B、甲酸C、⼄醛D、⼄酸30、下列物质中酸性最强的是( ),酸性最弱的是( )A、⼄酸B、苯酚C、⼄醇D、⽔31、下列化合物属于羟基酸的是( )A、乳酸B、草酸C、丙酸D、苯甲酸 32、⼈在剧烈活动后,感到全⾝酸痛,是因为肌⾁中( )A、柠檬酸的含量增⾼B、碳酸的含量增⾼C、苹果酸的含量增⾼D、乳酸含量增⾼33、临床上常⽤作补⾎剂的是( )A、柠檬酸铁铵B、乳酸C、柠檬酸钠D、苹果酸 34、具有防⽌⾎液凝固作⽤的是( )A、乳酸钠B、柠檬酸钠C、草酰⼄酸D、⽔杨酸钠 35、下列酸不属于羧酸的是( )A 草酸B 醋酸C ⽯炭酸D 安息⾹酸 36、最易⽔解的⼀类物质是( )A. 酰卤B. 酰胺C. 酸酐D. 酯 37、下列酸属于羟基酸的是( )A 草酸B 醋酸C ⽔杨酸D 安息⾹酸 38、γ-羟基酸脱⽔⽽⽣成的内酯是( )A. 三元环B. 四元环C. 五元环D. 六元环39、⼰⼆酸加热后所得到的产物是( )A.⼆元酸B. 环酮C. 酸酐D. 酮酸 40、下列化合物加热后放出CO的有( );形成内酯的有,( ) 2A:,-羟基丁酸 B:⼄⼆酸 C:,-羟基戊酸 D:,-羟基丙酸 41、鉴别苯酚和羧酸不要能⽤( )A. 溴⽔B. FeCl溶液C. NaHCO溶液D. NaOH 溶液 3342、β-羟基戊酸加热易⽣成( )A. α,β-不饱和酸B. 酸酐C. 交酯D. 内酯 E、β,γ-不饱和酸 43、下列化合物加热能放出⼆氧化碳的是( )A. 丁⼆酸B. 乳酸C. 草酸D. 醋酸 E、甲酸 44、下列化合物与CHCHOH酯化反应速率最快的是( ) 32A. CHCOOHB. (CH)CCOOHC. (CH)CHCOOHD. CHCHCHCOOH 3333232245、下列化合物按酸性降低顺序排列的是( )(1)甲酸 (2)⼄酸 (3)草酸 (4)苯甲酸 (5)苯酚A. (3)〉(1)〉(4)〉(2)〉(5)B. (3)〉(1)〉(2)〉(4)〉(5)C. (1)〉(2)〉(3)〉(5)〉(4)D. (1)〉(3)〉(2)〉(4)〉(5) 46、鉴别邻-甲氧基苯甲酸和邻-羟基苯甲酸时,可使⽤的试剂是( )A. NaHCOB. Ag(NH)OHC. FeClD. NaOH 3 323 47、下列化合物中碱性最⼤的是( )----COOCOOCOOCOOB.D.A.C.OCHNOCH32CHO3 48、下列羟基酸和酮酸中,加热能⽣成交酯的是( )OCOOHA.CHCHCHCOOHC. CHCHCCOOHB. CHCHCHCOOH3232D. 32OHOHOH 49、以下化合物中酸性最强的是( )A. 苯酚B. ⼄⼆酸C. 丙酸D. 苯甲酸 E、甲酸 50、下列化合物中酸性最强的是( )COOHCOOHCOOHC. B.A.NO2NO2COOHOHE.D.OCHNO3251、加FeCl试剂于下列化合物溶液中,⽣成沉淀的是( ) 3COOHCOOHOHOHOHCHOH2C.A.B.D.ch3ch2oh 1、羧酸中根据羧基的数⽬不同,可分为,和。
有机化学第10章 羧酸和取代羧酸

CH2Cl + CH3COO-Na+
O
HOAc 120oC
C2H5
CH2OCCH3
讨论
① 是SN2反应。 ② 只适用于1o RX和活泼RX。 ③ 常用的是钠盐。(有时也用Ag盐,优点:速率快。缺 点:太贵。) 体系中双键不受影响。 2013年11月8日 温州医学院药学院
对映异构体的拆分
主要方法:
COOH
COOH
CH3
环戊基甲酸
CH2COOH
间-甲基苯甲酸
HOOC
COOH
-萘乙酸
2013年11月8日
对苯二甲酸 (1,4-苯二甲酸)
温州医学院药学院
命名练习
COOH
2,4-己二烯酸 己二酸 环己烷甲羧酸 2-环丙基乙酸 2-甲基丙二酸
温州医学院药学院
HOOC(CH 2)4COOH
COOH
CH2COOH
O O O
R
C
R
C
C
R'
+ H2O
2013年11月8日
温州医学院药学院
2013年11月8日
温州医学院药学院
3.酯化反应
酸与醇脱水生成酯的反应。
O R C OH
+
H O R'
-H2O
R C
O OR'
应用:将药物转变成前药,以改变药物的生物利用度、 稳定性及克服多种不利因素。(见p346)
2013年11月8日
温州医学院药学院
2013年11月8日
实 例
O O H H
COOH OH
COOH
O
OH
邻位
诱导吸电子作用大、 共轭给电子作用大、 氢键效应吸电子作用大 pka 2.98 苯甲酸的pka 4.20
羧酸与取代羧酸

伯醇和仲醇成酯以“酰氧键断裂的机理”:
O CH3 C
-H2O
消除
OH
H+
+ OH HOC2H5
CH3 C OH
CH3
OH C OH
亲核加成 H O+C2H5
Ⅰ
Ⅱ
+ OH
-H+
CH3 C OC2H5
O CH3 C OC2H5
Ⅳ
Ⅴ
OH
+
CH3 C OH2 OC2H5
Ⅲ
11-28
伯醇和仲醇与酸成酯反应的特点: ①反应总的结果是亲核试剂醇分子中的-OR基取代了羧基中的羟基,是羧基的 亲核取代反应。 ②空间位阻对酯化反应的速度影响很大。 上述反应的中间体(Ⅱ)和 (Ⅲ)都是四面体结构,比较拥挤,如果羧酸和醇的α碳上连接的基团越多, 越大,这些中间体越不稳定,酯化反应越难进行。 酸或醇的烃基体积小、数目少,速度快。反应活性顺序如下:
11-13
问题11-2 分离苯甲酸、苯甲醇和苯酚的混合物。
COOH OH CH2OH
NaOH水溶液
水层 通CO2
溶液 H+ 晶体(苯甲酸) 晶体(苯酚)
醇层(苯甲醇)
羧酸酸性的应用: 分离、鉴别羧酸与酚
在制药工业中将羧酸制成钾盐、钠盐增加 药物的水溶性,提高药效
11-14
问题11-3 乙酸中也含有CH3CO基团,但不发生碘仿反应。为 什么?
AC
OH
性增强
O
当D为推电子基团, 酸
D C O H 性减弱
11-15
(1) 诱导效应
酸性排列顺序
HCOOH > CH3COOH >CH3CH2COOH
pKa 3.77
10羧酸和取代羧酸

酸性比较(pKa):
OH
无机酸 > RCOOH > H2CO3 >
1-2 4-5 6.4(pka1) 9-10
> H2O > ROH
15.7 16-19
影响羧酸酸性的因素:
1.脂肪酸(电子效应) 吸电子基使羧酸根负离子的负电荷得到分散而稳 定性增强,增强酸性;供电子基降低酸性。
NO2-CH2COOH CH3COOH CH3-CH2COOH
127pm
R RH HR R来自+ H+
127pm
p-π共轭的形成使羧酸根的键长完全平均化, 增 加了羧基负离子的稳定性,有助于H+的离解。 常见的一元羧酸 pKa 为3-5,酸性比碳酸 (pKa为6.5)酸性强。 可用pH试纸或石蕊试纸检验出其水溶液的酸性。 15
第十章 羧酸和取代羧酸
第一节 羧酸(三、化学性质 )
1.酰卤的生成
O CH3 C OH
O C OH
O O O COOH + SOCl2
O R C X
回流
PCl3
O CH3 C Cl
乙酰氯
H3PO3
PCl5
回流
O C Cl
苯甲酰氯
POCl3 HCl
O O O COCl + SO2 +HCl
大学有机化学羧酸

H2O
OH R-C=NH
互变异构
O R-C-NH2
-OH
O
R-C-NH2 OH
RCOOH + NH2-
RCOO- + NH3 H+
RCOOH
10.4.4 有机金属化合物的反应
1 格氏试剂和CO2的反应
Mg 无水醚
RX RMgX
CO2
RCOOMgX
H2 O
RCOOH
讨 论
(1) 1oRX、2oRX较好,3oRX需在加压条件下反应 ( 否则易消除) (2) ArI、ArBr易制成格氏试剂、ArCl较难。 (3) 产物比RX多一个碳原子。
O
C
O
H O H -H+
O C
O H O
试分析富马酸的K 大于其顺式异构体马来酸K 的原因。
2 2
H C C HOOC 富马酸
10.1.2羧酸和羧酸根的结构比较
两个碳氧键不 等长,部分离 域。
O
O H C O H
1.23Å 1.36Å
H
C O H
醇中C-O单键键长为1.43Å
两个碳氧键 等长,完全 离域。
O H C O
O H C O
-
1.27Å
羧酸的物理性质
低级脂肪酸是液体,可溶于水,具有刺鼻的气味。 中级脂肪酸也是液体,部分地溶于水,具有难闻的气味。 高级脂肪酸是蜡状固体。无味,在水中溶解度不大。
H R C X
O C .. O H
ICH2
吸电子基团的吸电子能力增强,酸性增强 Br CH2 COOH ClCH2 COOH F CH2 COOH COOH
3.12 2.90 2.86 2.59
羧酸和取代羧酸

−CH3
4.34
钝化
−CN
3.55 −OCH3 4.46
活化 基团
基团
−CHO
3.75
−OH
4.48
−Cl
4.0
−H
4.19
有机化学(第9版)
三、化学性质
(一)酸性与成盐反应
3. 二元酸:其酸性与两个羧基的相对距离和空间位置有关,低级二元酸的
pKa2 >pKa1。
二元酸
pKa1
HOOCCOOH
1.46
一、羟基酸
(三)化学性质
3. 醇酸的脱水反应:δ、γ-羟基酸加热失水生成内酯。
有机化学(第9版)
一、羟基酸
(三)化学性质
4. 酚酸的脱羧反应:邻位或对位的酚酸加热至熔点以上时,易分解脱羧形成 相应的酚。
有机化学(第9版)
二、酮酸
(一)命名
2-氧丙酸 (α-丙酮酸) 2-oxopropanoic acid
HOOCCH2COOH HOOCCH2CH2COOH HOOC(CH2)3COOH HOOC(CH2)4COOH
2.80 4.17 4.33 4.4
有机化学(第9版)
三、化学性质
(一)酸性与成盐反应
4. 成盐:羧酸可与NaOH、NaHCO3、Na2CO3等碱反应成盐。
有机化学(第9版)
三、化学性质
(malic acid)
3-羧基-3-羟基戊二酸 (柠檬酸) 2-hydroxypropane-1,2,3-
tricarboxylic acid (citric acid)
有机化学(第9版)
一、羟基酸
(二)物理性质
醇酸比相应的羧酸或醇更易溶于水,酚酸为晶体,多以盐、酯等形式存在 于植物中,大多微溶于水。羟基酸的熔点比相同碳原子数的羧酸高。
第十章取代羧酸

( 以符号 I 表示 )。
H
CH3CH2CH2Cl
H
δ+
C H
+ δ+ δ + δ δ
C H C H Cl
H
H
产生原因:成键原子的电负性不同 。
本 特 质:极性共价键产生的电场引起邻近价键电荷 的偏移。 点:沿碳链传递,随碳链增长迅速减弱或消失。 比较标准:以H原子为标准。
C
X
C
H
C
Y
吸电子诱导效应 比较标准 -I效应 I=0 诱导效应的相对强弱
γ等标明羟基的位置。一些醇酸常用俗名。
CH2 COOH HO C CH2 COOH 3-羧基-3-羟基戊二酸(柠檬酸,枸橼酸) citric acid COOH
HO
CH HC
COOH COOH 3-羧基-2-羟基戊二酸(异柠檬酸) isocitric acid
CH2 COOH
(二) 醇酸的物理性质(自学)
一、酮酸的分类和命名
根据酮基和羧基的相对位置不同,酮酸可分为α、 β、γ ……酮酸。 酮酸的命名也是以羧酸为母体,酮基作取代基。
CH3 C COOH O -丙酮酸 pyruvic acid CH3 C O -丁酮酸 -butanone acid CH2COOH HOOC C CH2COOH O 丁酮二酸(草酰乙酸) butanone diacid
二、酮酸的化学性质 (一)酸性 由于羰基氧吸电子能力强于羟基,酮酸 的酸性强于相应的醇酸,更强于相应的羧酸, 并且α-酮酸比β-酮酸的酸性强。
CH3 C COOH CH3 C CH2COOH CH3 CH COOH > > OH O O
> HOCH2CH2COOH > CH3CH2COOH
羧酸和取代羧酸

COOH CH3
邻甲基苯甲酸
14
CO2H
CO2H
O
乙二酸(草酸)
OHC CH2 C CH2 COOH 3-氧代戊醛酸
OH HOOC CH2 C CH2 COOH
COOH
3-羧基-3-羟基戊二酸(柠檬酸)
15
第二节 羧酸的物理性质及光谱性质
一、物理性质
饱和一元羧酸中: C1~C3的低分子量羧酸是具有强烈酸 味和刺激性的液体; C4~C9的羧酸是具有 腐败气味的油状液体。
R CH A
O C OH
-A=-X,-OH,-NH 2
3
羧基中的-OH被其它原子或基团取 代后生成的化合物称羧酸衍生物。
O R CL
O L = -X ,-OR , R C O , -NH2 -NHR, -NR2
4
第一节 羧酸的分类与命名
5
一、羧酸的结构 羧基是由羰基和羟基组合而成。
R——
p-p共轭体系
19
Ms:
O CH3CH2CH2CH2C OH
+.
O
+CH2CH2CH2C OH m/z 87
+
HO C O m/z 45
γ-H麦氏重排(麦克拉费蒂Mclafferty):
H3C
H
CH2
+.
O
CH2
C
CH2
γH
OH
CH3
H O+.
CH +
C
CH2 CH2 OH
m/z60(基峰) 20
第三节 羧酸的化学性质
Gd:electron-donating group
Ga:electron-attracting group
第十章 羧酸和取代羧酸

第十章羧酸和取代羧酸1.苯甲醛、苯甲醇和苯甲酸的分子量较接近,而沸点和熔点却相差很大,此现象如何解释?苯甲醛苯甲醇苯甲酸分子量106 108 122沸点/178 205 249℃熔点/℃-26 -15.3 1222.顺丁烯二酸在100克水中能溶解79克,而反丁烯二酸只能溶解0.7克,试给予解释。
3.试解释邻氯苯丙炔酸的酸性弱于其对位和间位异构体的酸性。
4.试解释为什么2,6-二羟基苯甲酸(pKa=2.32)的酸性强于邻羟基苯甲酸(pKa=2.98)的酸性。
5.在利用氧化法由伯醇制备醛或由烷基苯制备芳酸中,如何能得到纯净的醛或羧酸?6.甲酸为什么具有还原性?7.分子式为C9H8O3的一种化合物,能溶于氢氧化钠和碳酸钠溶液,与三氯化铁溶液有显色反应,能使溴的四氯化碳溶液褪色,用KMnO4氧化得到对羟基苯甲酸,试推断它的结构。
8.分子式为C4H8O3的两种同分异构体A和B,A与稀硫酸共热,得到分子式为C3H6O 的化合物C和另一化合物D,C不能发生碘仿反应,但D能与托伦试剂反应生成银镜。
B 加热脱水生成分子式为C4H6O2的化合物E,E能使溴的四氯化碳溶液褪色,并经催化氢化生成分子式为C4H8O2的直链羧酸F。
试写出A、B、C、D、E、F的结构式。
9.用化学方法区分下列各组化合物:(1)甲酸、乙酸和丙烯酸(2)苯甲醇、苯甲酸、水杨酸和苯甲醛10.阿司匹林水溶液加入FeCl3溶液能否显色?如将其水溶液加热放冷后再加入FeCl3溶液能否显色?11.用反应方程式表示丙酮酸在体内的变化过程。
12.将下列各组化合物按酸性由大到小顺序排列,简述其理由。
(1)(A)丁酸(B)顺丁烯二酸(C)丁二酸(D)丁炔二酸(E)反丁烯二酸(3)(A)α-氯代苯乙酸(B)对氯苯乙酸(C) 苯乙酸(D) β-苯丙酸13.回答下列问题:(1)为什么羧酸的沸点及在水中的溶解度相对分子质量相近的其它有机物高?(2)苯甲酸和邻氯苯甲酸都是不溶于水的固体,能用甲酸钠的水溶液将其混合物分开,为什么?14.排列出下列醇在酸催化下与丁酸发生反应的活性次序:(1)(CH3)3CCH(OH)CH3(2)CH3CH2CH2CH2OH(3)CH3OH (4)CH3CH(OH)CH2CH315.写出草酸、对苯二甲酸在酸催化下,分别与乙二醇反应的产物。
羧酸及取代羧酸

碳链作为主链,根据碳原子数称为“某二酸”,把取代基的位
置和名称写在“某二酸”之前。
HOOC COOH HOOC CH2 COOH HOOC CH2 CH2 COOH
CH3 CH COOH
乙二酸(草酸) 丙二酸
丁二酸(琥珀酸)
CH2 COOH 甲基丁二酸
(3)不饱和脂肪羧酸的系统命名:选择含有重键和羧基的最
H
C OH
(1)甲酸除具有羧酸的性质外,还具有醛的还原性。如
能发生银镜反应;可被高锰酸钾氧化;
HCOOH + 2 [Ag(NH 3)2]++ 2 OH-
O
4 NH3
+
CO
2
3
-
+
2 Ag
+
2 H2O
H COOH KMnO4 [HO C OH]
CO2 +H2O
(2)甲酸与浓硫酸在60~80℃条件下共热,可以分解为水 和一氧化碳,实验室中用此法制备纯净的一氧化碳
羟基在苯环上不同位置的酚酸酸性顺序为:
邻位> 间位>羧酸>对位。
2.氧化反应
醇酸中的羟基比醇中的羟基更容易氧化,托伦试剂或稀硝 酸不能氧化醇,却能把羟基酸氧化为酮酸。如乳酸能被托伦试 剂或稀硝酸氧化生成丙酮酸:
CH3 CH COOH Ag[(NH3)2]+CH3 C-COOH
OH
或稀硝酸
O
CH3 CH CH2 COOH稀硝酸CH3 C CH2 COOH
COOH OH
CH CH COOH
邻羟基苯甲酸 (水扬酸) 3-苯基丙烯酸(肉桂酸)
COOH 环戊基甲酸
练习:
COOH
COOH
大学有机化学第十章 取代羧酸

第十章 取代羧酸【目的要求】1、掌握取代羧酸的分类和命名(包含俗名);取代羧酸的酸性及其它特性。
2、熟悉乙酰乙酸乙酯、丙二酸二乙酯的结构和性质特点。
3、了解取代羧酸的制备方法;一些重要化合物。
【教学内容】第一节 取代羧酸的结构、分类和命名一、结构和分类卤代酸、羟基酸、羰基酸(氧代酸)和氨基酸等。
二、命名第二节 卤代酸一、卤代酸的制备 (一)、α-卤代酸的制备脂肪族羧酸在少量红磷(或卤代磷)存在下可以直接溴化或氯化,生成α-卤代酸(Hell-Volhard-Zelinsky 反应)。
RCH 2BrPBr 2Brα-溴代酸 (二)、β-卤代酸的制备β-卤代酸可用α,β-不饱和酸和卤化氢发生加成作用而制得。
加成时,卤原子总是加β-碳原子上。
(三)、 洪赛迪克尔(Hunsdiecker )反应 二、性质 (一)、酸性卤原子的存在使卤代酸的酸性比相应的羧酸强。
酸性的强弱与卤原子取代的位置、卤原子的种类和数目有关。
(二)、与碱的反应1、α-卤代酸:与水或稀碱溶液共煮,水解成羟基酸。
Cl OHH ClCH 3CHCOOHCH 32、β-卤代酸:与氢氧化钠水溶液反应,失去一分子卤化氢,而产生α,β-不饱和羧酸。
H2ClHCH 2CHCOOH 23、γ-与δ-卤代酸 (三)、达则斯(Darzens )反应 (四)、雷福尔马斯基(Reformatsky )反应α-卤代酸酯在锌粉作用下与羰基化合物(醛、酮、酯)发生反应,产物经水解后生成β-羟基酸酯的反应称雷福尔马斯基反应。
反应是通过有机锌化合物进行的。
例如:BrCH 2COOC 2H 5ZnBrZnCH 2COOC 2H5Zn BrZnCH2COOC 2HC 6H 5CHOC 6H 5CHCH 2COOC 2H 5OZnBrC 6H 5CHCH 2COOC 2H 5OZnBrOHC 6H 5CHCH 2COOC 2H OHBr OH261%~64% 三、个别化合物第三节 羟基酸一、醇酸 (一)、醇酸的制备1、卤代酸水解2、羟基腈水解3、雷福尔马斯基反应(二)、性质1、酸性。
羧酸及取代羧酸新

NO2
Cl
COOH >
CH3
COOH >
COOH >
COOH
第16页/共75页
• ②当取代基处于间位时,主要考虑诱导效应,但因间隔了3个碳,影响较小。
NO2
> COOH
OCH3
> COOH
COOH >
CH3 COOH
第17页/共75页
③当取代基处于对位时,主要考虑共轭 效应。
NO2
COOH
OCH3
(一) 羧酸的结构
羧酸分子中的羧基碳原子为sp2杂化, 三个杂化轨道分别与两个氧原子和烃 基碳原子或氢原子形成在同一平面的 三个σ键,未参与杂化的碳原子p轨道 与两个氧原子的p轨道重迭形成p-π共 轭体系.
第8页/共75页
O
(Ar)R C OH
O (Ar)R C
OH
O
C O
第9页/共75页
二 羧酸的化学性质
R CO OH+ PCl3
R CO Cl + H3PO3
R CO OH+ PCl5
R CO Cl + POCl3+ HCl
R CO OH+ SOCl 2 R CO Cl + SO2 + HCl
第24页/共75页
2. 酸酐的生成
羧酸在加热或脱水剂(如P2O5)作 用下,羧基间失水生成酸酐。
O
O
P2O5
与羧基相连的基团含不饱和键时,都具 吸电子的-I效应,其程度随不饱和度的
增加而增大。这是因为不同的杂化状态, 如SP、SP2、SP3杂化轨道中,S电子云是
球形的,S成分越多,共价键的 电子云
更趋近于杂化碳的原子核,故吸电子能
有机化学第10章 羧酸2013

K1 》 K2
HOOC(CH2)nCOO- + H+
-
OOC(CH2)nCOO- + H+
RCH2CH2 COOH O
RCH2CH2C
O L= X , O C R , OR ,
L
NH2
羧酸衍生物
取代羧酸(substituted carboxylic acids): 羧酸分子中的烃 基上的H被其他原子或原子团取代后的化合物。
RCH2CH
Y= OH, X,
COOH
NH2, -C=O。 酮酸
熔点:呈锯齿状上升,偶数碳原子的熔点比它前后相邻 两个奇数碳原子同系物的熔点高;二元酸比一元酸熔点高。 沸点:高于同分子量的烃、醚、卤代烃、醛、酮、醇。 因羧酸分子间由两个氢键缔和(二聚体或多聚体),而醇分 子间由一个氢键缔和。
与相对分子质量相近的其它类型有机物 相比, 羧酸具有特别高的沸点:
CH3CO2H CH3CHCH3 CH3-CO-CH3 CH3-C=CH2 OH CH3
R C
=
O O H 羧 酸 羧酸 R C
:
O R OH O H
:
醇 醇
共轭体系的特征
?
比醛酮羰基键长120pm有所增长
123pm
p-π 共轭
R——
O
136pm
R—— C
H
醇的C—O 键长143pm
O
· · · ·
H
羰基和羟基通过 p-π共轭 构成一个整体, 故羧基不是羰基和羟基的简单加合。
123pm
共轭大π键的形成使羧酸根的键长完全平均化, 增加了羧基负离子的稳定性,有助于H+的离解。
就电子效应而言,吸电子取代基使酸性
有机化学 羧酸和取代羧酸 思维导图

场效应:场效应的大小与距离的平方 成反比,距离越远,作用越小
成盐反应
羧酸具有酸性,能与碱(碳酸钠,氢 氧化钠、碳酸氢钠)中和成盐。
羧酸与醇在酸(硫酸、氯化氢或苯磺 酸等)催化下反应生成酯和水的反 应。
酯化反应为可逆反应
(i) 通过酰基上的亲核取代
酯化反应
酯化反应反应机理
(ii) 通过烷基碳正离子中间体
羧酸的沸点比分子量相近的醇的沸点 高很多
羧酸的酸性强弱取决于电离后所生成 的羧酸根负离子的稳定性。总的原则 是:若烃基上的取代基有利于负电荷 的分离,羧酸根负离子稳定; 反之,则 会使酸性减弱。取代基对酸性强弱的 影响与取代基的性质,数目以及相对 位置有关。
邻位效应:取代基在邻位,不论是吸 电子基团还是给电子基团(氨基除 外),都使酸性增强。
低级的饱和一元羧酸为液体(C1C3),C4-C10的羧酸都具有强烈的刺 鼻气味或恶臭。
高级的饱和一元羧酸为蜡状固体,挥 发性低,没有气味。
脂肪族二元羧酸和芳香羧酸都是结晶 固体
一.物理性质
羧酸分子间可以形成氢键,液态甚至 气态羧酸都有可能有二聚体存在
羧酸与水也能形成很强的氢键,比相 应的醇溶解度大
二分子缔合体
(iii) 酰基正离子机理
总结:伯醇、仲醇酯化经机理 (i)。叔醇酯化经机理( ii) (关键 :R+ 稳定,较易生成)
PPT扩充
羧基中羟基的取代反应 生成酰卤 羧酸和亚硫酰氯的反应机理(亲核加成-消除)
羧酸:分子中含有羧基的一类有机化合物。
羧酸和取代羧酸
二.化学性质
生成酸酐
可能机理
生成酰胺
提示:合成上一般通过羧酸衍生物制备酰胺
氧化法
三.羧酸的制备
第十章 取代酸

RCH=CHCOOH
+ H2O
第十章 取代酸—羟基酸 (3)γ,δ羟基酸发生分子内酯化,生成环内 酯
O OH C H2 O OH C H2 OH Δ O OH O Δ O
O
第十章 取代酸—羟基酸 (4)羟基和羧基相隔五个以上碳原子时,受 热发生分子内酯化脱水,生成聚酯
mHO—( CH n—COOH 2) Δ
第十章 取代酸—羰基酸
H2C
COOEt C 2 H 5 ONa COOEt
— CH(COOEt)2 Na Δ -CO 2
第十章 取代酸—羰基酸 一、乙酰乙酸乙酯 (一)性质: 1、互变异构: 几个实验事实: (1)与羰基试剂如HCN,NaHSO3, HO—NH2,C6H5NHNH2等作用。(说明 具有酮式结构) (2)与溴水作用可褪色(说明有不饱和键) (3)与金属钠作用放出氢气。(说明具有 烯醇式结构)
第十章 取代酸—羰基酸 物理和化学方法证明,乙酰乙酸乙酯存在 酮式和烯醇式两种互变异构体,并存在下 列平衡:
第十章 取代酸—羰基酸
酮式分解 O H3C C H2 O 1、C2H5ONa O C2 H 5 2、Y—X
O Y C H2 O Y C H2 OH CH 3
酸式分解
第十章 取代酸—羰基酸 二、丙二酸二乙酯 (一)丙二酸二乙酯的性质 1、亚甲基的活性 2、水解后丙二酸不稳定,易脱羧 (二)合成上的应用 主要用于合成羧酸 1、合成一元酸
第十章 取代酸—教学要求
[教学目的] 通过本章学习,掌握取代羧酸的结构和性 质,并了解有机合成的一般方法 [教学重点] 取代羧酸的结构和性质及在合成上的 应用 [教学难点] 取代羧酸在合成上的应用
第十章 取代酸—教学要求
羧酸和取代羧酸

羧酸的系统命名法与醛相似。对于简单的脂肪 酸也常用 a、b、g 等希腊字母表示取代基的位次;
CH3 CH3-CH2-CH-CH2-CO2H
54 3 2 1 gb a
3-甲基戊酸 b-甲基戊酸
CH3 Br-CH2-CH2-CH-CO2H
4321 g ba
2-甲基-4-溴丁酸 a-甲基-g-溴丁酸
6
Cl
Cl
Cl
pKa 2.84
4.06
4.52
4.82
(4) HO2C-CO2H HO2C-CH2-CO2H HO2C-CH2CH2-CO2H
Ka1 5.9×10-2
1.6×10-3
6.8×10-5
电离后的羧基负离子对第二个羧基有斥电子 诱导效应,因此第二个羧基比第一个难离解。
15
(5)
COOH
COOH
20
21
(3) 酯(ester)的生成
O C6H5-C—OH + H O-CH3
H2SO4
D
O C6H5-C—O-CH3 + H2O
85-95%
HO2C(CH2)4CO2H+C2H5OH
H2SO4
甲苯/D
OO C2H5O-C(CH2)4C-OC2H5+H2O
95%
该反应可逆,必须在催化剂及加热下才能较快进
1. 羧酸的结构 羰基与羟基通过p-p共轭构成一个整体 2. 命名 俗名; 系统命名 3. 性质 酸性;生成羧酸衍生物;二元酸脱羧 4. 羟基酸 酸性;氧化;脱水;酚酸脱羧 5. 酮酸 酸性;脱羧
29
合物称羧酸衍生物(derivatives of carboxylic acid)。
O R C OH
第十章羧酸和取代羧酸 (1)

3.沸点 :羧酸的沸点随着相对分子质量的增加而升高。羧酸的沸点比相 对分子质量相近的醇的沸点高得多。这是由于氢键使羧酸分子 间缔合成二聚体或多聚体,而且羧酸分子间的氢键又比醇中的 氢键牢固。
4. 熔点 :羧酸的熔点也随碳原子数的增加呈锯齿状上升,偶数碳原子 羧酸的熔点比它前后相邻两个奇数碳原子同系物的熔点高。 这可能是偶数碳羧酸分子比奇数碳羧酸分子有较好的对称性, 在晶体中容易排列得更紧密些。
三、羧酸的结构和化学性质
(一)羧酸的结构
羧酸的官能团羧基中碳原子为 sp2杂化,三个杂化轨道分别与羰基氧、 羟基氧和a-碳原子或氢原子形成在同一平面的三个σ-键,键角接近 为120º,未参与杂化的碳原子的p轨道与两个氧原子的p轨道重迭形成 p-π共轭体系。
了解:α-酮酸的氨基化反应以及醇酸和酮酸的体内化学反应过程。
羧酸 :分子中含有羧基(-COOH)的化合物 。
取代羧酸:羧酸分子中烃基上的氢被其它、羧酸盐或羧酸衍生物的形式广泛存在于 动植物体中;取代羧酸包括卤代酸、羟基酸、氧代酸和氨基酸等。
这些化合物有些参与动植物代谢的生命过程,有些具有显著的生物活 性,有些是有机合成、工农业生产和医药工业的原料。
酰卤是一类具有高度反应活性的化合物,广泛应用于药物和有机合成中。
(2) 酸酐(acid anhydride)的生成
羧酸在脱水剂(如P2O5)作用下或加热,羧基间失水生成酸酐。
具有五元环或六元环的酸酐,可由二元酸加热分子内失水而得。
酸酐的结构 特征是分子 中有酐键
邻苯二甲酸
邻苯二甲酸酐
大学有机化学羧酸和取代羧酸练习题

羧酸和取代羧酸练习题1、下列化合物酸性最强的是( )A. 乙醇B. 乙酸C. 碳酸D. 苯酚2、能与托伦试剂反应的是( )A . 乙酸B 甲酸C 乙醇D 丙酮3、下列化合物中酸性最强的是( )A CICH2C H2CO O HB CH3CH (CI )COOHC CH 3C (CI 2)COOHD CH3CH 2COOH 4、下列化合物加热后放出C O 2的有( );形成内酯的有?( )A :β-羟基丁酸B :乙二酸C :δ-羟基戊酸D :α-羟基丙酸5、下列物质酸性最强的是( )A 、碳酸B 、乙酸C 、乙醇D 、苯酚E 、水6、下列物质酸性最弱的是( )A 、苯甲酸B 、醋酸C 、碳酸D 、苯酚E 、盐酸7、甲酸(HCOOH )分子中,含有的基团是( )A 、只有醛基B 、只有羧基C 、没有醛基D 、有羰基E 、既有羧基又有醛基8、区别甲酸和乙酸可用( )A 、NaB 、FeCl3C 、Cu (OH )2D 、NaOHE 、银氨溶液9、下列化合物属于羧酸的是( )A 、CH 3-CH 2-OHB 、CH3CH 2-O-CH2CH 3C 、CH 3-CHOD 、CH 3-COOHE 、10、不能发生银镜反应的是( )A 、甲酸B 、丙酮C 、丙醛D 、葡萄糖E 、苯甲醛11、羧酸的官能团是( )A 、羟基B 、羰基C 、羧基D 、醛基E 、酮基12、下列不能与金属钠反应放出氢气的是( )A 、苯甲酸B 、苯酚C 、乙醇D 、乙醚E 、酒精13、下列能与乙酸发生酯化反应的是( )CH 3CCH 3OA、乙醛B、丁酮C、甲醇D、苯甲酸E、乙醚14、关于羧酸下列说法错误的是()A、能与金属钠反应B、能与碱反应C、能与碳酸钠反应D、能与酸反应生成酯E、能与醇反应生成酯15、下列属于芳香羧酸的是()A、C6H5CO OHB、CH3COO HC、HOCH2C H2OHD、HOOC-COOH16、下列结构式属于草酸的是()A、HOOC-COOHB、C6H5OHC、C6H5CO OHD、HOCH2C H2OH17、既能发生酯化反应,又能发生银镜反应的是()A、乙醇B、乙醛C、乙酸D、甲酸E、丙酮18、下列物质酸性排列正确的是()A、碳酸>乙酸>苯酚>乙醇B、乙酸>苯酚>碳酸>乙醇C、苯酚>乙酸>乙醇>碳酸D、乙酸>碳酸>苯酚>乙醇19、此(CH3)2CH(CH2)2 COOH结构的正确命名是()A 、2,3-二甲基丁酸 B、4-甲基戊酸 C、2-甲基戊酸D、2-乙基丁酸E、2,2-二甲基丁酸20、下列卤代酸酸性排列正确的是()A、CH3CH2C HBrCOOH>CH3CHB rCH2C OOH>CH2BrC H2CH2C OOHB、CH3CHB rCH2C OOH>CH3CH2C HBrCOOH>CH2BrC H2CH2C OOHC、CH2BrC H2CH2C OOH>CH3CHB rCH2C OOH>CH3CH2CHBrCOOHD、CH2BrC H2CH2C OOH>CH3CH2C HBrCOOH>CH2BrC H2CH2C OOH21、2-甲基丙酸分子中,烃基为()A、甲基B、乙基C、正丙基D、异丙基E、正丁基22、一定条件下,羧酸分子中失去羧基生成二氧化碳的反应叫做()A、消去反应B、脱羧反应C、脱二氧化碳D、氧化反应23、下列不属于酮体的是()A、丙酮B、α—羟基丁酸C、β—羟基丁酸D、β—丁酮酸24、下列各组有机物属于同分异构体的是()A、丙酸和乳酸B、丙酸和丙酮酸C、乳酸和丙酮酸D、氯乙酸和丙酸25、下列卤代酸酸性最强的是()A、醋酸B、一氯醋酸C、二氯醋酸D、三氯醋酸26、结构式为CH3CH2C OOH的有机物,其官能团是()A、羧基B、羰基C、羟基D、酮基E、烃基27、某化合物能与金属钠反应放出氢气,能发生酯化反应生成有香味的液体,能与Na2C O3反应放出CO2气体,该物质是()A、乙醇B、乙酸C、甘油D、苯酚28、甲醛和甲酸均可发生银镜反应的原因是()A、均具有羰基B、均具有羧基C、均具有羟基D、均具有醛基29、既有较强的酸性,能与NaCO3反应放出气体,又能与托伦试剂反应形成银镜的物质是()A、甲醛B、甲酸C、乙醛D、乙酸30、下列物质中酸性最强的是( ),酸性最弱的是()A、乙酸B、苯酚C、乙醇D、水31、下列化合物属于羟基酸的是()A、乳酸B、草酸C、丙酸D、苯甲酸32、人在剧烈活动后,感到全身酸痛,是因为肌肉中()A、柠檬酸的含量增高B、碳酸的含量增高C、苹果酸的含量增高D、乳酸含量增高33、临床上常用作补血剂的是()A、柠檬酸铁铵B、乳酸C、柠檬酸钠D、苹果酸34、具有防止血液凝固作用的是()A、乳酸钠B、柠檬酸钠C、草酰乙酸D、水杨酸钠35、下列酸不属于羧酸的是()A 草酸B 醋酸C 石炭酸D 安息香酸36、最易水解的一类物质是()A. 酰卤B. 酰胺C. 酸酐D. 酯37、下列酸属于羟基酸的是()A 草酸B 醋酸C 水杨酸D 安息香酸38、γ-羟基酸脱水而生成的内酯是()A. 三元环B. 四元环C. 五元环D. 六元环39、己二酸加热后所得到的产物是()A.二元酸B. 环酮C. 酸酐D. 酮酸40、下列化合物加热后放出C O2的有();形成内酯的有?()A:β-羟基丁酸 B:乙二酸 C:δ-羟基戊酸 D:α-羟基丙酸41、鉴别苯酚和羧酸不要能用()A. 溴水B. FeCl3溶液C. NaHCO3溶液D. NaOH 溶液42、β-羟基戊酸加热易生成()A. α,β-不饱和酸B. 酸酐C. 交酯D. 内酯 E、β,γ-不饱和酸43、下列化合物加热能放出二氧化碳的是()A. 丁二酸B. 乳酸C. 草酸D. 醋酸 E、甲酸44、下列化合物与C H3CH2OH酯化反应速率最快的是()A. CH3COO HB. (CH3)3CCOOHC. (CH3)2CHCOOHD. CH3CH2C H2COOH45、下列化合物按酸性降低顺序排列的是()(1)甲酸(2)乙酸(3)草酸(4)苯甲酸(5)苯酚A. (3)〉(1)〉(4)〉(2)〉(5)B. (3)〉(1)〉(2)〉(4)〉(5)C. (1)〉(2)〉(3)〉(5)〉(4)D. (1)〉(3)〉(2)〉(4)〉(5)46、鉴别邻-甲氧基苯甲酸和邻-羟基苯甲酸时,可使用的试剂是()A. NaHCO3B. Ag(NH3)2OHC. FeCl3D. NaOH47、下列化合物中碱性最大的是()48、下列羟基酸和酮酸中,加热能生成交酯的是()49、以下化合物中酸性最强的是()A. 苯酚B. 乙二酸C. 丙酸D. 苯甲酸 E、甲酸50、下列化合物中酸性最强的是( )51、加FeCl 3试剂于下列化合物溶液中,生成沉淀的是( )1、羧酸中根据羧基的数目不同,可分为 , 和 。
大学有机化学羧酸及其衍生物习题答案
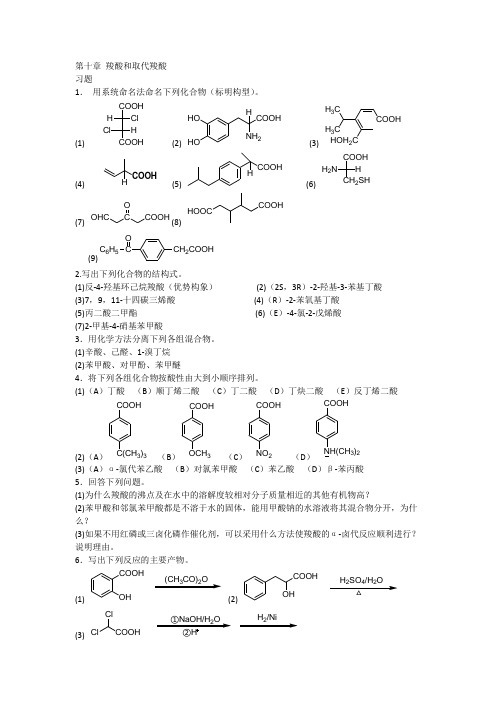
第十章 羧酸和取代羧酸 习题1. 用系统命名法命名下列化合物(标明构型)。
(1)COOHCOOH Cl H HCl (2) HO HO COOHNH 2H(3) COOHHOH 2CH 3CH 3C(4)H(5)COOH H(6)COOHCH 2SH H H 2N (7)OHC C O (8)COOHHOOC(9)CH 2COOHCC 6H 5O2.写出下列化合物的结构式。
(1)反-4-羟基环己烷羧酸(优势构象) (2)(2S ,3R )-2-羟基-3-苯基丁酸 (3)7,9,11-十四碳三烯酸 (4)(R )-2-苯氧基丁酸 (5)丙二酸二甲酯 (6)(E )-4-氯-2-戊烯酸 (7)2-甲基-4-硝基苯甲酸3.用化学方法分离下列各组混合物。
(1)辛酸、己醛、1-溴丁烷 (2)苯甲酸、对甲酚、苯甲醚4.将下列各组化合物按酸性由大到小顺序排列。
(1)(A )丁酸 (B )顺丁烯二酸 (C )丁二酸 (D )丁炔二酸 (E )反丁烯二酸(2)(A )COOH C(CH 3)3 (B )COOHOCH 3 (C )NO 2COOH (D )COOH NH(CH 3)2(3)(A )α-氯代苯乙酸 (B )对氯苯甲酸 (C )苯乙酸 (D )β-苯丙酸 5.回答下列问题。
(1)为什么羧酸的沸点及在水中的溶解度较相对分子质量相近的其他有机物高?(2)苯甲酸和邻氯苯甲酸都是不溶于水的固体,能用甲酸钠的水溶液将其混合物分开,为什么?(3)如果不用红磷或三卤化磷作催化剂,可以采用什么方法使羧酸的α-卤代反应顺利进行?说明理由。
6.写出下列反应的主要产物。
(1)COOHOH(CH 3CO)2O(2)COOHOH△242(3) ClCl2(4)ClC 6H 5NaOH/H 2O△4H(5)COOHOH OH+(6)COOH ONaBH 4(7)COOH①LiAlH 4②H 3O(8)COOH2(9) COOH25H(10) COOHSOCl 27.下列化合物在加热条件下发生什么反应?写出主要产物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
O R–C–OH + H OH R–C—O–R* H OH
HO R–C–OH + R*––OH OH R–C—O–R* OH2
–H2O
HO R–C–OR*
羧酸和醇位阻越大↑,反应速度↓,甚至不反应。
酯化的相对速度为
CH3OH > R–CH2OH > R–CHOH R
R > R–C–OH R
CH
R R
KMnO4 /H+
COOH
CH3 R
[O] HOOC
COOH
提问: + R-Cl
AlCl3 0~25 º C
无水
R
δ+ δ- AlCl3 CH2CH2CH2Cl (三)腈的水解 Ar–CH2CN H3O+ Ar–CH2COOH
(四)Grignard试剂法合成羧酸 CH3CH-CH3 CO2 CH3CH-CH3 H2SO4/H2O 低温 CH3CH-CH3 MgX COOMgX COOH
O C—OH
pka 1.46
2. HCOOH COOH COOH
3.77
(+) KMnO4 /H+
4.17
Tollens Ag(银镜) ( )
(+)
( )
CH3COOH
五、 羧酸的制备(补充) (一)伯醇和醛的氧化
RCH2OH [O] RCHO RCOOH
常用的氧化剂:K2Cr2O7、KMnO4、CrO3-冰醋酸 (二)芳烃侧链的氧化
(三)-氢的卤代
CH3COOH + P
Cl2
CH2COOH + HCl Cl CHCl2COOH Cl3CCOOH
提问:请用简便化学方法把它们鉴 别出来
CH3COOH
CH3CHO O CH3–C–CH3
(四)二元酸受热时的特殊反应
COOH
ห้องสมุดไป่ตู้
COOH CH2COOH CH2COOH
HCOOH + CO2 CH2–C O O + H2 O CH2–C O CH2CH2 C=O + CO2 CH2CH2 + H2O
+
H—O–CH–CH3
– 2H2O
CH3–HC
O
C=O CH–CH3
O=C
O
2、-羟基酸脱水(生成不饱和酸) CH3—CH—CH—COOH OH H() CH3CH=CHCOOH+H2O
-氢由于同时受羧基,羟基的共同影响而显 得比较活泼,受热时容易与-羟基脱去一分 子水而生成- 不饱和酸 (CH3)2CH—CH—CH—COOH OH H
取代羧酸——羧酸分子中烃基上的氢被其他原子 (或原子团)取代而生成的化合物 卤代酸 羟基酸
CH2-COOH Cl CH3-CH-COOH OH
OH COOH
根据取代基的 种类不同 酮酸
氨基酸
CH3-C-COOH
O
CH3 CH COOH NH2
一、 羟基酸
(一)醇酸
1、醇酸(alcoholic acid)的分类和命名 -羟基酸 R—CH—COOH OH 根据羟基和羧基的 -羟基酸 R—CH CH2COOH 相对位置 OH -羟基酸 R—CH— CH2CH2COOH OH
ONa
CH2OH
2. 酸酐的生成
O R –C OH OH R –C O
CH 2 COOH CH 2 COOH P 2O 5
O R –C O 酸酐 R –C O { ( RCO) 2 O } CH 2–C O O + H2O CH 2 –C O
3. 酯的生成
18 H+ RCOOH + HOR´ 18 RCOOR´ + H2O
B、氧化反应
CH3CHCH2COOH OH
稀HNO3
CH3CCH2COOH O
醇 + [Ag(NH3)2+]OH
CH3CHCOOH OH C、脱水反应
[Ag(NH3)2+]OH Tollens
×
CH3CCOOH O
1、-醇酸脱水(交叉脱水、 生成交酯)
CH3–CH–O—H HO—C=O
O=C—OH
2,3一二羟基丁二酸(酒石酸) COOH HOOC—CH2—C—CH2COOH OH
3—羟基-3-羧基戊二酸
(柠檬酸或枸橼酸)
2、醇酸的性质 (1)物理性质 (2)化学性质 A、酸性 CH3CH2COOH 醇酸
Pka 4.88
CH3CHCOOH OH 3.87
CH2CH2COOH OH 4.51
提问:1、为什么有了—OH 酸性增强 2、为什么羟基位置不同酸性强弱也不同
酚酸 COOH OH COOH OH
Pka 4.17
3.00
COOH
HO
4.12
COOH
4.54
为什么对-羟基苯甲酸的酸性比苯甲酸还 要弱呢? O C HO 诱导<共轭 -OH O : H (供电基) 诱导:电负性 C <O 吸电子诱应
共轭: O上P轨道中一对末成键电子与 苯环键 P共轭产生供电诱应
二元酸
COOH COOH
命名
俗名 如 醋 酸 系统命名法
命名时:1、选主链(含羧基在内的最长碳链) 2、编号(从羧基碳原子开始)
CH3-CH-CH2COOH CH2CH2CH3 CH3CH-CH2-CHCOOH
CH3
CH3
3-甲基己酸 (-甲基己酸)
CH3
COOH
2,4-二甲基戊酸 ( , -二甲基戊酸)
SOCl2
酰卤具有高度反应活性,广泛应用于药物合成中。
提问:
COOH + SOCl2 OH R-CH-CH2COOH + SOCl2 O C Cl OH O R-CH-CH2-C-Cl Cl
OH
提问:
OH
CH2OH
OH CH2OH +
+
SOCl2 NaOH
OH CH2Cl + SO2 +HCl + H2O
主讲:林连波
学习目的与要求
掌握羧酸、羟基酸、酮酸的结构、分类、命名方法;熟悉 羧酸、羟基酸、酮酸的主要化学性质;熟悉酮式—烯醇式 互变异构现象。了解α -酮酸的氨基化反应。
羧酸——分子中含有羧基(—COOH)的有机化 合物。CH3COOH 取代羧酸——羧酸分子中烃基上的氢被其它原子 或原子团取代后的化合物。 CH2COOH
CH3CH2OH HCOOH 46 46 78.5 º C 100.7 º C
水溶性
O • • • HO C R–C OH • • • O
R
三、羧酸的结构和化学性质
O O –C–OH 是由–C– 与-OH组成的。
羧基具有酸性,羧基中的羰基不容易发生亲核加成反应
O p-π 共轭效应
O
H -C
H C
O O H–C–O–
HCOOH > RCH2COOH > R2CHCOOH > R3CCOOH
例如在盐酸催化下,下列羧酸和甲醇 酯化的相对速度为
CH3COOH CH3CH2COOH (CH3)2CHCOOH(CH3)3CCOOH
1
0.84
0.33
0.027
4. 酰胺的生成
RCOOH + NH3 RCOONH4 — H2O △ RCONH2 酰胺
Cl
第一节 羧酸(Carboxylic acid)
O
羧酸的结构通式为R–C–OH R=H HCOOH 一、羧酸的分类和命名 脂肪酸 RCOOH 1、根据羧酸分子中烃基不同 脂环酸 COOH
芳香酸
COOH
2、按烃基饱和与否
饱和酸 CH3COOH 不饱和酸 CH3CH=CH-COOH 一元酸
3、按照羧酸分子中羧基数目
COOH N02 N02 Pka 2.21 3.49 3.42 COOH 02N
COOH
COOH N02 N02 Pka 2.21 3.49
COOH
02N
COOH
3.42
O
O
N
C
O 诱导<共轭
O:H
(1)氧和氮的电负性大于碳,因此产生
吸电子效应,使酸性 (2)硝基的 电子与苯环的 电子形成 - 共轭效应,使酸性
④乙酰水杨酸
如 何 鉴 别
COOH O—C—CH3(阿司匹林) O COOH OH (水杨酸)
二、 酮酸(Keto-acid)
O CH3—C—COOH O CH3—C—CH2COOH
3-丁酮酸
丙酮酸
(一)酮酸的化学性质
-丁酮酸 1、-酮酸的化学性质
a、酮酸的酸性比相应的醇酸强
O O CH3—C—COOH > CH3—C—CH2COOH > Pka 2.49 3.51 CH3—CH—COOH > CH2—CH2—COOH OH OH
H
O: H
•O H–C•• – O
C=O 122pm C–O键长都是127pm 正常 C–O 143pm 无黄色
O CH3-C-OH + 2 , 4 - 二硝基苯肼
羧酸的化学性质
; 应 反 羧 脱 . 4 氧化与还原
*3.α-H 的反应
O C H O
1. 酸 性
(Ar)R
2.亲核取代
RCO-X RCOOCOR RCO-OR RCO-NH2
酰卤 酸酐 酯 酰胺
8
(一)酸性
RCOOH + NaOH RCOONa + H2O RCOONa + CO2 + H2O COONa + CO2 + H2O
RCOOH + NaHCO3
COOH OH O C + NaHCO3
