胺化学性质
胺的分类与性质

胺的分类与性质胺是一类具有重要化学性质和广泛应用的有机化合物。
根据分子中氮原子周围的取代基不同,胺可以分为三个主要类别:一级胺、二级胺和三级胺。
本文将对这三类胺的分类、性质和应用进行详细介绍。
一、一级胺一级胺是指胺分子中氮原子周围只有一个碳原子的化合物。
一级胺通常具有较强的氨基性,可以与酸发生中和反应形成相应的盐。
此外,一级胺还具有亲核取代、缩合反应和氧化反应等多种化学性质。
1. 亲核取代反应:一级胺具有亲核性,可以与电荷正电的化合物如卤代烷、酰卤等发生亲核取代反应。
该反应可以生成新的有机化合物,具有重要的合成应用。
2. 缩合反应:一级胺可以与酸醛或酮类发生缩合反应,形成相应的亚胺或酰胺。
这种反应常用于合成具有生物活性的药物分子。
3. 氧化反应:一级胺可以通过氧化反应转化为相应的亚胺、亚胺氧化物或者酰胺。
这些产物在药物合成和有机合成领域具有重要的应用。
二、二级胺二级胺是指胺分子中氮原子周围有两个碳原子的化合物。
与一级胺相比,二级胺的氨基性较弱,但仍然可以进行许多重要的反应和应用。
1. 应用于药物合成:二级胺可以作为药物分子的结构骨架,具有调节生物活性的作用。
常见的药物分子中常含有二级胺结构。
2. 作为溶剂:由于二级胺在水中溶解度较高,因此常用作各类溶剂的组成部分,如有机合成反应中的溶剂。
三、三级胺三级胺是指胺分子中氮原子周围有三个碳原子的化合物。
与一级胺和二级胺相比,三级胺的氨基性最弱。
1. 缓冲剂:由于三级胺具有较弱的酸性或碱性,可以作为缓冲剂使用。
在许多生物学和化学实验中,三级胺常常用于调节溶液的pH值。
2. 催化剂:一些特殊的三级胺化合物可以作为催化剂参与有机合成反应,促进反应的进行。
3. 表面活性剂:一些具有特殊结构的三级胺化合物可以作为表面活性剂使用,用于调节液体表面张力和增加分散性。
结论:胺是一类重要的有机化合物,根据氮原子周围的取代基不同,可分为一级胺、二级胺和三级胺。
每类胺都具有不同的化学性质和应用。
胺的知识点总结

胺的知识点总结一、胺的性质1.1 胺的结构胺的结构通常由一个或多个氨基(-NH2)官能团以及与之相连的碳链组成。
根据氨基与碳链的连接方式不同,胺可以分为原始胺(氨基直接连接到一个碳原子上)、第一级胺(氨基连接到一个烷基基团上)、二级胺(两个烷基基团连接到氨基上)和三级胺(三个烷基基团连接到氨基上)。
1.2 胺的物理性质胺的物理性质包括外观、溶解性、沸点和熔点等。
一般来说,低分子量的胺呈无色或淡黄色液体,高分子量的胺呈固体状态。
胺通常具有挥发性和刺激性气味,易溶于水和有机溶剂。
1.3 胺的化学性质胺具有碱性,能与酸反应生成盐类。
它还具有亲核性,可以发生亲核取代、亲核加成等反应。
此外,胺还可发生取代反应、氧化反应和还原反应。
二、胺的分类根据氨基的连接方式和数量不同,胺可以分为原始胺、第一级胺、二级胺和三级胺。
根据碳链的不同,又可分为脂肪胺和芳香胺。
根据胺分子中氨基所取代的碳原子数不同,可分为氨基甲烷、氨基乙烷、氨基丙烷等不同种类。
三、胺的合成3.1 胺的直接合成胺的直接合成方法包括氨和烃或卤代烃的取代反应、氨和醛、酮的纳尔逊反应等。
3.2 胺的间接合成胺的间接合成方法包括亲核取代反应、亲电取代反应、亲核加成反应、氢解反应等。
3.3 胺的生物合成在生物体内,胺的合成通常是通过氨基酸的脱氨作用来完成的。
四、胺的应用由于胺具有碱性、亲核性等特点,因此在许多领域有广泛的应用。
4.1 化工领域胺可以用于合成染料、药物、橡胶、塑料等化合物。
4.2 农业领域胺类化合物被广泛应用于杀虫剂、除草剂等农药的合成。
4.3 医药领域许多药物中含有胺基团,胺也是很多生物活性分子的基本组成部分,如氨基酸、肽类化合物等。
4.4 日用化学品领域如洗涤剂、护肤品、香精等都包含胺类化合物。
4.5 其他领域胺还在颜料、涂料、感光材料、粘合剂等领域有着重要的应用。
五、结语胺作为一类重要的化合物,在化工、医药、农业等领域都有着重要的应用。
了解胺的性质、分类、合成方法和应用领域,对于进一步深入研究胺的化学性质和应用具有重要意义。
胺的化学性质

胺的化学性质(1)碱性 胺和氨相似,分子中氮原子上具有未共用的电子对,能接受一个质子形成铵离子,故胺具有碱性,能与大多数酸作用成盐。
胺的碱性较弱,其盐与氢氧化钠溶液作用时,释放出游离胺。
胺的碱性强弱,可用Kb 或pKb 表示:如果胺的K b 值愈大或pK b 愈小,则此胺的碱性愈强。
胺的碱性强度往往可用它的共轭酸RNH 3+的强度来表示。
胺的碱越强,它的共轭酸越弱,Ka 越小,pKa 越大。
碱性: 脂肪胺 > 氨 > 芳香胺脂肪胺:在气态时和在溶液中所显示的酸碱性不同。
在气态时碱性为: (CH 3)3N > (CH 3)2NH > CH 3NH 2 > NH 3 在水溶液中碱性为: (CH 3)2NH > CH 3NH 2 > (CH 3)3N > NH 3 气态时,仅有烷基的供电子效应,烷基越多,供电子效应越大,碱性越强。
在水溶液中,是电子效应与溶剂化共同影响的结果。
从伯胺到仲胺,增加了一个甲基,由于电子效应,使碱性增加。
但三甲胺的碱性反而比甲胺弱,这是因为一种胺在水中的碱度不仅要看取代基的电子效应,还要看它接受质子后形成正离子的溶剂化程度。
氮原子上连有氢越多(体积也越小),它与水通过氢键溶剂化的可能性就越大,胺的碱性越强。
在伯胺到叔胺之间,溶剂化效应占主导地位,使叔胺碱性比甲胺还弱。
(2)酸性 伯胺和仲胺的氮原子上还有氢,能失去一个质子而显酸性。
若碱金属的烷基氨基化合物,其烷基是叔烷基或仲烷基,如N,N-二异丙氨基锂,氮原子的空间位阻大,它只能与质子作用但不能发生其他的亲核反应,这种能夺取活泼氢而又不起亲核反应的强碱性试剂,称为不亲核碱。
这种试剂在有机合成上特别有用。
R NH 2+ HCl R NH 3ClR NH 2+ HOSO 3HR NH 3 OSO 3HR NH 3Cl + NaOHRNH 2 + Cl + H 2OR NH 2+ H 2O R NH 3 + OHK b =R NH 3 OHRNH 2pK b = lgK b(3)烷基化 和氨一样,胺与卤代烷、醇、硫酸酯、芳磺酸酯等试剂反应,氨基上的氢被烷基取代,这种反应称胺的烷基化反应。
《胺的化学性质》课件

不同的熔点
不同类型的胺具有不同的熔点,这 对于纯化和分离具有重要意义。
胺的化学性质
了解胺的酸碱特性、亲电性和亲核性,以及其在有机反应和羟基代替反应中的重要应用。
1
酸碱性
胺可以作为碱接受质子,也可以作为酸释放质子,具有多种反应的可能性。
2
亲电性
由于孤对电子对的存在,胺可以与亲电试剂发生加成和亲电取代反应。
3
亲核性
胺的氮原子可以作为亲核试剂与电子亏损的碳原子发生取代反应。
胺的制备方法
探索合成胺的几种常见方法,包括氨基化、亲电取代和还原等合成途径。
氨基化
通过反应生成胺的氮杂环化合物, 如合成胺。
亲电取代
还原
通过胺与卤代烷或烷基卤化物等亲
通过还原反应将含有氮的化合物转
电试剂发生取代反应制备胺化合物。 化为对应的胺。
《胺的化学性质》PPT课 件
在本课件中,我们将讨论胺的定义,分类,物理性质,化学性质,制备方法, 应用领域,实验案例和应用示例,以及总结和展望。通过精彩的内容和图像, 让我们一起探索胺的神奇之处。
胺的定义和分类
了解胺的基本定义和广泛的分类体系,以及各种胺化合物的特征和命名规则。
一级胺
包含一个氨基基团,例如甲胺 和乙胺。
胺的应用领域
了解胺在医药、农业、染料和涂料等行业的广泛应用,并探索其在各个领域中发挥的作用。
药物合成
许多药物合成过程中都需要胺作为重要的中间体。
农药制造
胺类化合物被广泛用于制造杀虫剂和除草剂等农药。
染料和涂料
胺可用于染料和涂料的合成和添加剂,赋予色彩和 性能。
化学反应催化剂
胺类化合物可以作为化学反应的催化剂,加速不同 反应的进行。
胺的化学性质与应用

胺的化学性质与应用胺是一类重要的有机化合物,由于其特殊的化学性质和广泛的应用领域,对其进行深入了解和研究具有很高的实际意义。
本文将介绍胺的化学性质以及在不同领域的应用。
一、胺的化学性质胺是由氨基基团(NH2)取代烃基而来,根据氨基基团的取代位置和数量,胺可以分为原胺、仲胺和叔胺。
胺具有以下几个重要的化学性质:1. 亲核性由于氨基基团的氮原子可以提供孤对电子,胺具有很强的亲核性。
它可以与电子不足的化合物发生亲核取代反应,如与酰氯反应生成胺的酰胺。
2. 碱性氨基基团的氮原子带有孤对电子,在水溶液中可以接受质子,表现出碱性。
胺可以与强酸反应生成盐,如与盐酸反应生成胺盐。
3. 缔合性胺具有良好的配位能力,可以与过渡金属形成络合物。
胺的缔合性使其在催化剂和染料等领域得到广泛应用。
二、胺的应用1. 药物合成胺在药物合成中扮演着重要的角色。
许多药物中都含有胺的结构基团,胺的亲核性和碱性使其成为合成活性药物的重要原料。
例如,抗生素、抗癌药物和神经递质等都含有胺基团。
2. 去除污染物胺可用于环境保护领域,如氨基甲酸盐可作为二氧化碳的吸收剂用于煤电厂的烟气脱硫处理。
另外,胺也可用于废水处理,通过与废水中的有机物发生化学反应,将有机污染物转化为无毒的化合物。
3. 表面活性剂由于胺具有亲油基团和亲水氨基基团,因此它可以用于表面活性剂的制备。
胺的表面活性剂应用广泛,例如用于润湿剂、去垢剂和柔软剂等。
4. 高分子材料胺也广泛应用于高分子材料的合成中。
通过与环氧树脂等反应,可以得到具有良好性能的聚胺树脂。
聚胺树脂在涂料、粘合剂和复合材料中具有重要的应用价值。
5. 植物生长调节剂某些胺类化合物具有植物生长调节剂的特性,可以促进植物的生长和发育。
例如,氮代胺类生长调节剂可以增加作物的光合作用效率,提高光合产物的积累。
结论总的来说,胺是一类具有特殊化学性质和广泛应用的有机化合物。
它的亲核性、碱性和缔合性使其在许多领域发挥着重要作用,如药物合成、环境保护、高分子材料以及植物生长调节剂等。
胺的化学性质
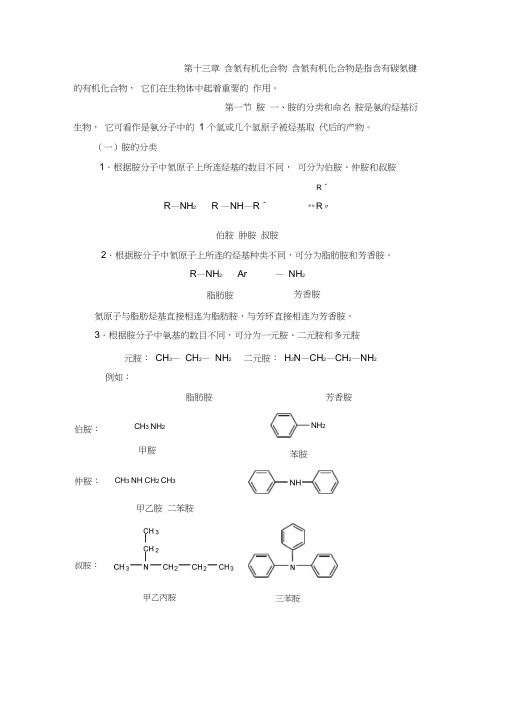
伯胺:CH3 NH2甲胺仲胺:CH3 NH CH2 CH3第十三章含氮有机化合物含氮有机化合物是指含有碳氮键的有机化合物,它们在生物体中起着重要的作用。
第一节胺一、胺的分类和命名胺是氨的烃基衍生物,它可看作是氨分子中的1 个氢或几个氢原子被烃基取代后的产物。
(一)胺的分类1.根据胺分子中氮原子上所连烃基的数目不同,可分为伯胺、仲胺和叔胺R′R—NH2 R —NH—R′R N R″伯胺肿胺叔胺2.根据胺分子中氮原子上所连的烃基种类不同,可分为脂肪胺和芳香胺。
R—NH2 Ar —NH2脂肪胺氮原子与脂肪烃基直接相连为脂肪胺,与芳环直接相连为芳香胺。
3.根据胺分子中氨基的数目不同,可分为一元胺、二元胺和多元胺芳香胺元胺:CH3—CH2—NH2二元胺:H2N—CH2—CH2—NH2例如:脂肪胺芳香胺NH2苯胺叔胺:甲乙胺二苯胺甲乙丙胺三苯胺请注意:伯胺、仲胺、叔胺与伯醇、仲醇、叔醇的区别,胺是根据氮原子上 所连烃基数目来分为伯胺、 仲胺、 叔胺,而醇则是根据羟基所连的烃基来分为伯 醇、仲醇、叔醇。
例如:(二)胺的命名1.简单的胺以胺为母体,按烃基的名称称为某胺。
例如:2.仲胺和叔胺的氮原子上连的烃基相同时,用二或三标明烃基的数目,写在烃基名称前;烃基不同时,从简单到复杂依次写出烃基的名称。
例如:甲乙丙胺3.芳香仲胺和叔胺的氮原子上连有烃基时,以芳香胺为母体,在烃基前标上“ N-”,以区别连接在芳环上的烃基。
例如:4.多元胺可参照多元醇命名,二元胺称为某二胺。
例如:H 2N —CH 2—CH 2—NH 2 H 2N —CH 2—CH 2—CH 2—CH 2—NH 25.对于结构复杂的胺,则以烃为母体,氨基用为取代基命名。
例如:CH 3CH 3 C NH 232CH 3伯胺CH 33CH3 C OH3CH 3叔醇CH 3 NH 2CH 3 CH 2 CH 2NH 2甲胺丙胺CH 3)2NHCH 3CH 2)3N二甲胺 三乙胺CH 3 NH CH 2 CH 3( C 6H 5) 3N三苯胺CH 3 CH 2CH 3 N CH 2 CH 2 CH 3甲乙胺CH 3CH 2CH 3N , N-二甲基苯胺N- 甲基 -N- 乙基苯胺乙二胺1 ,4- 丁二胺NHCH 3N-甲基苯胺N ( CH 3)2CH 3 CH 3CH 3CHCHCHCH 3H 2NCOOHNH 22,4- 二甲基 -3-氨基戊烷对胺基苯甲酸学生思考:胺和醇的结构与命名的异同点。
有机化学基础知识点整理胺的性质与应用

有机化学基础知识点整理胺的性质与应用胺是有机化合物中常见的一类化合物,其性质和应用十分广泛。
本文将从胺的定义、命名规则、物理性质、化学性质以及常见的应用等方面对有机化学中的胺进行整理和概述。
一、胺的定义和命名规则胺是由氨基(-NH2)取代有机或无机化合物中的一个或多个氢原子而得的化合物。
根据氨基取代的数量和位置,胺可以分为一级胺、二级胺和三级胺。
一级胺中一个氨基取代在氮原子上,二级胺中两个氨基取代在氮原子上,三级胺则有三个氨基取代在氮原子上。
胺类化合物的命名规则是以氨作为1个碳原子的取代物,以“-amine”结尾。
根据取代基的不同,可以在胺的名称前面加上取代基的名称,如甲胺(methylamine)、乙胺(ethylamine)等。
当有多个氨基团取代在氮原子上时,可以用前缀“di-”、“tri-”等来表示。
二、胺的物理性质1. 臭气:很多胺具有刺激性气味,如腐鱼臭味的胺。
2. 溶解性:胺可以与水混溶,一般来说,碳链较短的胺可以与水形成氢键而溶解性较好,而长碳链的胺则溶解性较差。
3. 沸点和熔点:胺的沸点和熔点一般较低,随着碳链长度的增加,沸点和熔点都会升高。
三、胺的化学性质1. 酸碱性:由于胺分子中含有孤对电子,因此它可以与酸反应,形成胺盐。
例如:甲胺和盐酸反应生成甲胺盐酸盐。
2. 同样由于孤对电子的存在,胺可以与电子不足的物质发生亲核取代反应,例如与酰氯反应生成酰胺。
3. 胺也可以发生氧化反应,形成亚胺、亚醨等化合物。
4. 胺也可通过与羧酸反应生成酰胺,从而参与酰胺的合成。
四、胺的应用1. 医药领域:胺类化合物广泛用于制药工业,例如许多药物中含有胺基结构。
胺类化合物还可用于合成抗生素、镇痛药、抗肿瘤药等。
2. 染料工业:胺类化合物是染料分子的重要组成部分,可以赋予染料颜色,并且对染料的亲水性和亲油性起着调节作用。
3. 金属萃取:胺类化合物可以用于从矿石中提取金属离子,广泛应用于冶金行业。
4. 有机合成:胺类化合物在有机合成中起着重要的作用,例如用作催化剂、溶剂和取代基等。
胺

C H 2N H 2
环己胺
2. 比较复杂的脂肪族胺是以烃作母体,氨基作为取代 基来命名。
NH2 C H 2C H 2C H C H 3
1-苯基-3-氨基丁烷
3. 当氮原子同时连有芳基和脂肪基时,命名时必 须在芳胺 名称前面加字母“N”。
N
CH3 C 2H 5
ON
N (C H 3 ) 2
(二) 烷基化反应
胺的氮原子上具有未共用电子对,易发生亲核 取代反应,例如:
N H 2( 过 量 )
+
C H 2C l
。 N a H C O 3 ,9 0 C
C H 2N H
( 88% )
(三) 酰基化
脂肪族或芳香族伯胺和仲胺与酰氯、酸酐或 羧酸等酰基化试剂反应,生成N-取代或N,N-二取 代酰胺。但羧酸的酰化能力较弱。
如果 -N=N- 基只与一个烃基相连,而 另一个基团不是烃基,这样的化合物称为 重氮化合物。
N N NH
N
N
NH
CH3
苯重氮氨基苯
N
+
苯重氮氨基对甲苯
+
N HSO4
N
NCl
氯化重氮苯
α-萘基重氮硫酸盐
苯重氮盐酸盐
重氮盐的制备----重氮化反应
芳香族伯胺在低温(一般为0~5℃)和 强酸溶液中与亚硝酸钠作用,生成重氮盐 的反应称为重氮化反应。
+
S O 2C l
R 2N S O 2
不 溶 于 N aO H
R 3N
N aO H 不反应 (可溶于酸)
该反应也称为Hinsberg 反应,可以用 来分离和鉴别伯、仲、叔胺。
(四) 与亚硝酸的反应
有机化学基础知识点整理胺与胺类化合物的性质与反应

有机化学基础知识点整理胺与胺类化合物的性质与反应胺与胺类化合物的性质与反应胺是有机化合物中常见的一类化合物,它们具有独特的性质和广泛的应用。
本文将对胺与胺类化合物的性质和反应进行整理,以加深对它们的理解。
一、胺的性质1. 物理性质:胺通常为无色气体或液体,有时也可为固体。
高级脂肪胺是无色液体;低级脂肪胺的碱性比高级脂肪胺强,常因含有游离电子对而产生氢键,导致沸点较高。
此外,胺具有恶臭味,特别是低级脂肪胺。
2. 碱性:胺是有机碱,可以和酸反应生成盐类。
由于胺的碱性较强,故能中和一定量的酸,与无水酸反应时可生成盐类。
3. 水溶性:胺类化合物具有较好的水溶性,但随着碳链长度的增加,水溶性逐渐降低。
4. 氧化性:次级胺和三级胺具有较强的氧化性,能够被氧气和氧化剂氧化,生成氧化胺。
二、胺类化合物的反应1. 胺的酸碱反应:胺能与酸发生酸碱中和反应生成盐类。
一般情况下,胺与酸的中和反应是一种比较快速的反应。
2. 胺的烷基化反应:胺能够与烷基卤化物进行烷基化反应,生成烷基胺。
此反应通常在碱的存在下进行,如在氨水溶液中加入烷基卤化物,生成烷基胺。
3. 胺的酰化反应:胺可以与酸酐或酰氯发生酰化反应,生成酰胺。
胺的氨基与酰化试剂中的羧基发生酰化反应,生成酰胺。
4. 胺的氧化反应:次级胺和三级胺能够被氧气和氧化剂氧化,生成氧化胺。
此外,胺还可以与过氧化氢反应,生成相应的氧化胺。
5. Hofmann消去反应:胺与氯代磷酰在碱存在下进行反应,生成相应的异腈。
此反应称为Hofmann消去反应,经过水解后,生成酰胺。
6. Gabriel合成:Gabriel合成是一种合成一级胺的方法。
该方法以季铵盐为起始物,通过碱处理生成季铵碱,再与卤代烷反应生成一级胺。
7. 羰基化反应:胺可以与羰基化合物发生鸟嘌呤碱咪反应,生成N-烷酰胺。
8. 烷基胺的胺化反应:烷基胺通过胺化反应能够生成胺类化合物,通常在氨的存在下进行。
9. 胺的取代反应:胺能够参与烷基、芳基等取代反应,生成相应的取代胺,这在合成中非常常见。
胺的结构和化学性质

胺的结构和化学性质胺是一类重要的有机化合物,具有多种结构和化学性质。
它们在生物体内发挥着重要的作用,也广泛应用于工业和科学研究中。
本文将从胺的结构、性质以及应用领域等方面进行探讨。
胺是由氮原子与碳原子通过共价键连接而成的化合物。
根据氮原子周围的碳原子数目,胺可以分为三类:一级胺、二级胺和三级胺。
一级胺中,氮原子与一个碳原子相连;二级胺中,氮原子与两个碳原子相连;三级胺中,氮原子与三个碳原子相连。
胺的结构决定了它们的性质和反应方式。
胺具有碱性,可以与酸反应生成盐类。
这是因为胺中的氮原子可以接受质子,形成胺盐。
胺盐在水中离解产生氨和相应的酸根离子。
这种性质使得胺在化学合成中常被用作碱催化剂。
例如,乙二胺在聚酰胺合成中起到了重要的催化作用。
另外,胺还具有亲核性和碱性氮原子的孤对电子。
这使得胺可以与电子不足的化合物发生亲核取代反应。
例如,胺可以与酰氯反应生成酰胺,与醛或酮反应生成亚胺,与卤代烃反应生成胺盐等。
这些反应为有机合成提供了重要的手段。
除了在有机合成中的应用,胺还广泛应用于生物化学和医药领域。
胺在生物体内起着重要的作用,如神经递质、荷尔蒙、维生素等的合成和传递过程中都离不开胺。
在医药领域,胺类化合物常被用作药物的活性部分。
例如,抗抑郁药物常采用胺类结构,如帕罗西汀和舍曲林等。
此外,胺还在染料、塑料、橡胶等工业中起到重要的作用。
胺类化合物可以作为染料的前体,通过取代反应或偶联反应生成具有特定颜色的染料。
胺也可以用于改性塑料和橡胶的生产过程中,通过与聚合物反应改变其性质和性能。
总之,胺是一类具有多样化结构和化学性质的有机化合物。
它们在有机合成、生物化学和工业领域中发挥着重要的作用。
对胺的结构和性质的深入理解,有助于我们更好地掌握其应用和开发新的应用领域。
第十五章胺的性质

SO2NHR NaOH
SO2NRNa 溶于碱
SO2NR2 不溶于碱,为固体 不发生磺酰化反应,无现象 成盐溶于水 滤液 OH
SO2Cl NaOH
R2 NH OH
成固体沉淀 过滤 固体 不反应,沸点低 滤液
蒸馏 残液
RNH2
得 R3N
这种分离、鉴别伯、仲、叔胺的方法称为兴斯堡(Hinsberg)法
四、与亚硝酸反应
O 再如: CH3 C CH2CH2N(CH3)2 OH CH2CH2CH2CH3 O CH3CCH CH2 + CH3(CH2)3N(CH3)2
霍夫曼消除反应可用来推测未知胺的结构。
过量 CH3I H3C N I AgOH CH3 H3 C N OH CH3 H3C N CH3
N H
CH3I
AgOH I N CH3 H3C CH3
(1)RX NH NH 3 3 RX RNH3 X RNH2 (2)NH3 (1)RX R N (1)RX R NX R2 NH (2)NH 3 4 (2)NH 3 3
此外,醇在H2SO4或Al2O3催化下,也能发生烷基化反应。
NH2 + CH3 OH
H2SO4 P
NHCH3
CH3OH H2SO4
季铵碱是一个强碱,其碱性与KOH相当,具有碱的一般通性, 如:能吸收空中的CO2,易潮解,易溶于水等。
季铵盐与季铵碱
季铵碱也不稳定,加热时也易分解,当烷基中无-H时,则分 解成叔胺和醇。
(CH3)4NOH
(CH3)3N + CH3OH
当烷基中有-H时,加热则分解成叔胺和烯烃。
(CH3)3NCH2CH3
有机化学中的胺性质和反应

有机化学中的胺性质和反应胺是有机化合物中含有氮原子的一类化合物。
它们的结构形式为R-NH2,其中R代表一个有机基团。
胺分为三类:一级胺、二级胺和三级胺,根据氮原子与有机基团的连接数量不同进行分类。
胺具有多种性质和反应,对于化学研究和应用具有重要意义。
一、胺的性质1. 氨基特性:胺分子中的氮原子可供给电子对给予亲电试剂。
由于氮原子上的空轨道与孤对电子共振,形成一个带正电的亲电中心,使胺表现出亲电性质。
2. 氢键形成:胺分子中的氢与氮之间形成氢键。
氮原子上的孤对电子可与溶剂中的质子结合形成氢键,使胺分子在溶液中形成聚集态。
3. 碱性:胺分子中的氮原子带有孤对电子,使其具有碱性。
一级胺、二级胺和三级胺的碱性依次降低。
4. 氧化性:胺分子中的氮原子可被氧气氧化为氮氧化物,如N2O、NO等。
氧化性随着胺分子中氮原子上孤对电子的减少而减弱。
二、胺的反应1. 氨基取代反应:一级胺可通过与亲电试剂发生氨基取代反应。
亲电试剂将胺分子中的氨基取代为其他基团,形成新的有机化合物。
例如,一级胺与酸酐反应生成酰胺,与卤代烷反应生成胺盐。
2. 胺氧化反应:胺分子的氮原子能够被氧气或氧化剂氧化,生成相应的氮氧化物。
例如,一级胺与氧气反应生成亚硝胺,进一步氧化可生成互作用较强的亚硝酸。
此外,一氧化氮、二氧化氮等氮氧化物也可通过胺的氧化反应制备。
3. 烷基化反应:二级胺和三级胺可发生烷基化反应。
烷基卤化物与胺反应,发生亲电取代,生成相应的烷基胺。
此反应在有机合成中常用于引入烷基基团。
4. 脱水反应:胺分子中的氢可以与酸类或醛酮类化合物中的氧发生脱水反应,生成亲水胺。
脱水反应常用于制备二胺、脲、胺酮等有机化合物。
总结:胺在有机化学中具有重要的性质和反应。
它们既可以表现出亲电性质,参与氨基取代反应,也可以通过氧化反应生成氮氧化物。
此外,胺还可发生烷基化和脱水等反应。
了解胺的性质和反应有助于理解和应用于有机化学的领域中。
通过进一步的研究和发展,有机化学家们可以利用这些性质和反应来合成新颖的化合物,推动有机化学的发展和应用。
简述胺的化学性质。

引言概述:胺是一类常见的有机化合物,具有重要的化学性质。
本文将从胺的结构、性质以及应用等方面进行详细探讨,希望能为读者提供全面的了解。
正文内容:一、胺的结构1.胺的一般结构特点2.长链胺和短链胺的结构区别3.脂肪胺与芳香胺的结构差异二、胺的物理性质1.胺的气味特征及相关反应2.胺的溶解性和蒸汽压3.胺的密度和沸点随碳链长度的变化三、胺的化学性质1.胺的碱性及其与酸的反应2.胺的酸性及其与碱的反应3.胺的氧化性反应4.胺的亲电性反应5.胺的求电子性反应四、胺的应用1.胺作为重要溶剂的应用2.胺作为表面活性剂的应用3.胺作为螯合剂的应用4.胺作为催化剂的应用5.胺作为医药及农药中的应用五、胺的特殊性质1.胺的亲核取代反应2.胺的氢键作用3.胺的配位性质4.胺的键能及其影响因素5.胺的空间构型和活性总结:胺作为一类重要的有机化合物,具有丰富的化学性质。
本文从胺的结构、物理性质、化学性质及其应用等方面进行了详细的阐述。
通过对胺的研究,我们可以更深入地了解胺在化学领域的作用以及其在其他领域的应用前景。
希望本文对读者对胺的化学性质有所帮助。
引言概述:胺是一类具有氨基基团(NH2)的有机化合物,它们是氨分子上一个或多个氢原子被有机基取代而形成的化合物。
胺分子的化学性质包括它们的酸碱性、氧化性、还原性以及它们在化学反应中的活性。
正文内容:一、胺的酸碱性1.胺是碱性物质,氨分子能够接受质子形成胺的盐酸盐。
2.胺可以与酸反应胺盐,这是因为氨基团上的孤对电子能够与酸中的质子形成离子键。
二、胺的氧化性1.一些胺具有氧化性,可以被氧化剂氧化成氧化胺。
2.例如,苯胺可以被过氧化氢氧化成苯酚。
三、胺的还原性1.胺具有还原性,它们可以将其他物质还原成较低的氧化态。
2.例如,亚硝胺可以还原成胺,同时氮氧键被还原成氮氢键。
四、胺的化学反应活性1.胺具有亲电性,可以发生亲电取代反应。
2.胺与酰氯、醛和酮等电子不足的化合物反应,酰胺、亚胺和烯胺等化合物。
胺能发生的反应

胺能发生的反应一、胺的化学性质胺是一类含有氮原子的有机化合物,具有亲核性和碱性。
它们可以与酸、酐、醛、酯等电子亏损的化合物发生取代反应,也可以与卤代烃等电子富余的化合物发生亲核取代反应。
二、胺的分类1.按照氮原子数目分类根据氮原子数目,胺可分为一级胺、二级胺和三级胺。
其中,一级胺只有一个氮原子与两个碳原子相连,二级胺则是两个氮原子分别与一个碳原子相连,三级胺则是三个氮原子分别与一个碳原子相连。
2.按照取代基分类根据取代基的不同,胺可分为芳香族胺和脂肪族胺。
芳香族胺指含有芳环结构的氨基化合物,如苯胺;脂肪族胺则指不含芳环结构的氨基化合物。
三、常见反应1.取代反应(1)酰化反应一级或二级脂肪族或芳香族胺可以与酸酐或羧酸发生缩合反应,生成相应的酰胺。
例如,乙酸酐与苯胺反应,生成N-乙酰苯胺。
(2)烷基化反应一级或二级脂肪族或芳香族胺可以与卤代烷发生亲核取代反应,生成相应的烷基胺。
例如,甲基溴与乙胺反应,生成N-甲基乙胺。
(3)芳基化反应一级或二级脂肪族或芳香族胺可以与卤代芳烃发生亲核取代反应,生成相应的芳基胺。
例如,氯苯与丁胺反应,生成N-丁基苯胺。
2.还原反应一级或二级脂肪族或芳香族亚硝酸盐可以还原为相应的氨基化合物。
例如,苯亚硝酸钠可以还原为苯胺。
3.缩合反应(1)Mannich 反应Mannich 反应是一种通过缩合制备β-氨基羰基化合物的方法。
它通常由一种醛、一种第二型脂肪族或芳香族胺和一个活性甲基化试剂组成。
例如,在甲醛存在下,乙酰丙酮和丁胺反应,生成N,N-二甲基-3-丁基-1-丙酮胺。
(2)Pictet-Spengler 反应Pictet-Spengler 反应是一种通过缩合制备杂环化合物的方法。
它通常由一种芳香族醛、一种第二型脂肪族或芳香族胺和一个酸性催化剂组成。
例如,在硫酸存在下,苯甲醛和苯乙胺反应,生成1,2,3,4-四氢β-咔啉。
4.其他反应(1)Hofmann 消去反应Hofmann 消去反应是一种将一级或二级脂肪族或芳香族胺转化为相应的烯烃的方法。
胺的化性及制备

胺的化学性质及制备Ⅰ、胺的化学性质C N H(R)N H(R)主要化性:1、胺的N 有孤对电子,具有一定的碱性;2、胺具碱性,亦具亲核性,可与卤代烃发生烃基化、与酰化剂发生酰基化反应(叔胺不可);3、季铵碱的霍夫曼消除反应,产物符合霍夫曼规则(与查氏规则的区别);4、各级胺可与HNO 2发生特殊反应;5、芳胺中存在共轭,N 的给电子作用使芳胺的碱性↓,而苯环上的亲电取代反应活性↑;6、芳胺易氧化。
一、碱性NH 3 +HOH[NH 4]+ + OH -..RNH 2 +HCl3]+ Cl -..1、注:(1)胺是弱碱,不能使酚酞显色;芳胺由于N 上孤对电子参与了共轭,碱性更弱;(2)成盐可改善其水溶性,也可用于提纯胺。
例如:+NH 2COOCH 2CH 2N(C 2H 5)2 HClNH 2COOCH 2CH 2N(C 2H 5)2H Cl普鲁卡因盐酸普鲁卡因(局麻剂)例如:乙酰苯胺中常混有未反应完的苯胺,如何提纯?解:乙酰苯胺HCl苯胺不溶溶解分离固体洗涤、干燥2、碱性影响因素(1)电子效应:N 上ρe ↑,碱性↑; (2)空间效应:N 周围位阻↑,碱性↓;(3)溶剂化效应:N +的溶剂化程度↑,碱性↑。
溶剂化效应:溶剂分子与离子相互作用而累积在离子周围,提高了离子的稳定性。
氨的盐通过氢键可与四个水分子溶剂化,伯胺盐可与三个水分子溶剂化,仲胺盐可与两个水分子溶剂化,叔胺盐可与一个水分子溶剂化,因此,在水溶液中,溶剂化程度顺序是:NH 3>伯胺>仲胺>叔胺+R 2NH H ............O HHOHH+R 3NH ......OH H(4)综合上述因素,在水溶液中,胺的碱性大小顺序为:季铵碱>脂肪胺>氨>芳胺①脂肪胺碱性与R 数目无正比关系,一般的:脂环仲胺>脂肪仲胺>脂肪伯胺、叔胺(掌握:二甲胺>甲胺>三甲胺)②芳胺碱性规律:芳伯胺>芳仲胺>芳叔胺;取代芳胺碱性与取代基性质有关。
胺的性质

第三节 胺的性质一、物理性质在常温下,低级和中级脂肪胺为无色气体或液体,高级胺为固体。
低级脂肪胺有难闻的臭味。
例如,二甲胺和三甲胺有鱼腥味,肉和尸体腐烂后产生的1,4-丁二胺(腐胺)和1,5-戊二胺(尸胺)有恶臭。
芳香胺多为高沸点的油状液体或低熔点固体,具有特殊气味,并有较大的毒性。
例如,食入0.25mL 苯胺就可能引起严重中毒。
许多芳香胺,如β-萘胺和联苯胺都具有致癌作用。
由于胺是极性分子,且伯、仲胺分子间N —H 可以通过氢键合,所以它们的沸点比相对分子质量相近的非极性化合物高,但比相对分子质量相近的醇和羧低。
由于氨基形成氢键的能力与氮上所连氢原子数成正比,所以碳原子数相同的脂肪胺中,伯胺沸点最高,仲胺次之,叔胺最低。
伯、仲、叔胺都能与水形成氢键,所以低级脂肪胺可溶于水,随着烃基在分子中的比例增大,形成氢键的能力减弱,因此中级和高级脂肪胺以及芳香胺微溶或难溶于水。
胺大都能溶于有机溶剂。
表10-1列出了一些胺的物理常数。
表10-1 一些胺的物理常数名称熔点/℃沸点/℃溶解度g ·(100g 水)‐¹p K b甲胺 二甲胺 三甲胺 乙胺 二乙胺 三乙胺 正丙胺 正丁胺 苯胺N-价基苯胺N ,N-二甲基苯胺 邻甲苯胺 间甲苯胺 对甲苯胺 二苯胺 三苯胺-92.5 -92.2 -117.1 -80.6 -50 -114.7 -83 -50 -6.1 -57 2.5 -16.4 -31.3 43.8 52.9 126.5-6.7 6.9 9.9 16.6 55.5 89.4 49~50 77.8 184.4 196.3 194.2 200.4 203.4 200.6 302 365易溶 易溶 4119℃ ∞ 易溶 ∞ ∞ ∞3.618℃ 难溶 不溶1.525℃ 微溶0.7421℃不溶 不溶3.38 3.234.20 3.37 3.07 3.28 3.29 3.23 9.38 9.15 8.93 9.56 9.28 8.92 13.1(一)官能团的反应1、碱性和成盐反应 当胺溶于水时,发生下列解离:因此,胺的水溶液显碱性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(CH3)3N
芳香族胺: 一个或几个芳基与氮原子直接相连的胺.
Nபைடு நூலகம்H
——胺的分类——
N(CH3)2
(2)命名 (A)脂肪胺
简单的脂肪胺: 是用烃基名称后面加上“胺”来命名。
NH2
(C H )2N C H C H C H 3 2 3 C H 3 二甲(基)仲丁(基)胺
CH2NH2
环己胺
H2N(CH2)6NH2
第十一章 含氮化合物
(一) 胺的分类和命名( ) (一)腈( ) (二)胺的物理性质( ) (二)异腈( ) (三)胺的化学性质( )
第一节 胺( )
第二节腈和异腈( )
第三节 重氮化合物与偶 (1)碱性和成盐( ) 氮化合物( ) (2)氮原子上氢的取代反应( ) (一)芳香伯胺的重氮化反应 (3)与亚硝酸的反应( ) (4)氧化反应( ) () (5)苯环上的取代反应( ) (二)重氮盐的反应及其在合
季铵盐: R4N+X-
C6H5N+H3Cl- (C2H5N+H3)2SO42- (CH3)3N+CH2C6H5Br氯化苯铵 硫酸二乙铵 溴化三甲苄铵 季铵碱: R4N+OH(CH3)3N+CH2CH3OH氢氧化三甲乙铵銨
——季铵化合物命名——
(二)胺的物理性质 物态:除甲胺、二甲胺、三甲胺、乙胺为气体其他均为
N (C H 3)2
4,4’-二硝基二苯胺 (2°)
N H N H
N-甲基-N乙基苯胺 (3°)
C2H5
对亚硝基N,N-二甲苯 胺(3°)
N,N’-二苯基对苯二 胺 (二元胺)
——芳香胺命名——
(C)季铵化合物 四个相同或不同的烃基与氮原子相连的化合 物称为季铵化合物. 季铵化合物命名的词尾: 铵
——胺的分类——
第一节
胺
NH3 氨
RNH2 伯胺(1º 胺)
R2NH 仲胺(2º 胺)
(B)按分子中氨基的数目 胺可分为一元胺、二元胺和三元胺等,如:
(C)按氮原子所连的烃基 氮上只连接脂肪族烃基的胺. 脂肪胺:
C H H 3N 2
NH2
CH3CH2NH2 一元胺
H2NCH2CH2NH2 二元胺
H H C H 2 3 NC
1,6-己二胺
苄胺(苯甲胺)
——脂肪胺命名——
复杂的脂肪胺: 是以烃作母体,氨基作为取代基来命名。 氨基: NH2
氨基
NHCH3
甲氨基
N(CH3) 2
二甲氨基
CH3 N CH2CH3
甲乙氨基
C H C H 3 3 C N H H 2 3 C H N H C H (C H ) C H H C H C H C H N C H C H C H C H 3 24 3 C 3 2 2 2 2 3 C H 2 5
l C H N H 2
N a O H C l N H 3
N H 2
——碱性和成盐——
(2)氮原子上氢的取代反应 (A)烷基化
+ N H ( 过 量 ) 2
。 N a H C O ,9 0 C 3 C H C l 2
C H N H 2 (8 8 %)
R N H 2
R X
R N H X 2 2
N a O H
合,因此低级胺易溶于水。
——胺的物理性质——
(三)胺的化学性质 胺的结构:
氮原子的电子结构为:1s2 2s2 2px1 2py1 2pz1,应为 三价,而实际上氨或胺的键角~109°.成键时氮原子轨 道进行sp3杂化,一对未公用电子对占据一个sp3轨 道,另外三个sp3轨道与氢的1s轨道或碳杂化轨道交 盖形成三个α 键.分子呈棱锥型结构.
R N H 2
R X ① R X R N H R N R N X (季銨盐) 2 3 4 N a O H ②
——氮原子上氢的取代反应——
(B)酰基 化 脂肪族或芳香族伯胺和仲胺与酰氯、酸酐或羧酸等
应用:
酰基化试剂反应,生成N-取代或N,N-二取代酰胺。 羧酸的酰化能力较弱,须不断除水,使反应向右进行。
(四)季铵盐和季铵碱( )
(1)季铵盐( ) (2)季铵碱( )
成中的应用( )
(1)失去氮的反应( ) (2)保留氮的反应( )
(一) 胺的分类和命名 (1)胺的分类 胺可以看作氨的烃基衍生物. (A)按氢原子被取代的数 目 可把胺分为伯胺(1º 胺)、仲胺(2º 胺)、叔胺(3º 胺):
R3N 叔胺(3º 胺) CH3 与醇不同之处: C H C O H CH CH 3 3 3 C NH 2 CH3 CH 3 叔碳 叔醇 伯胺 一个烃基
RNH2 > NH3 > ArNH2 (脂肪胺) (芳香胺)
烷基对胺碱性的影响: .. CH3 N H 2 烷基供电效应使胺的碱性加强. p-π共轭的结果, 苯环对芳胺碱性的影响:
N
H H
——碱性和成盐——
使电子对向苯环移 动,氮原子上电子 NH 2 云密度降低,碱性 减弱.
(B)成盐
l C H C H ( C H ) N H C H ( C H ) N H C l 3 2 9 2 3 2 9 3
脂肪胺:
RNH2 O R'C Cl R2NH (R'CO)2O R3N
O R 'C N H R O R 'C N R 2 不 反 应
气体或固体。 沸点:胺与醇相似,也是极性化合物。除叔胺外,伯 胺和仲胺均易生成分子间的氢键。但氮的电负 性小于氧,故胺的沸点比相对分子质量相近的 非极性化合物高,比醇或羧酸的沸点低。 CH3CH2CH2NH2>CH3NC2H5 >(CH3)3N 48.7℃ 35 ℃ 3.5 ℃
溶解度: 伯、仲和叔胺都能与水分子通过氢键发生缔
氨与甲胺的结构:
.. N
.. N
H
107.3°H
H
CH3
112.9°H
H
——胺的结构——
结构与性质
具有未公用电子对,呈碱性.
H N H
作为亲核试剂进行反应,氮 上氢被烷基或酰基取代.
苯环上的亲电取代
——结构与性质——
(1)碱性和成盐 (A)结构与碱性
甲胺 二甲胺 三甲胺 氨 苯胺 对甲苯胺 对氯苯胺 对硝基苯胺 pKb 3.38 3.27 4.21 4.76 9.37 8.92 9.85 13.0
1-苯基-3-氨基丁烷 2-甲氨基庚烷
2-甲乙氨基戊烷
——脂肪胺命名——
(B)芳香胺 母体化合物: 芳胺
当氮原子同时连有芳基和脂肪基时,命名时在烷基 名称前面加N-,以示烷基直接与氮原子相连。
NH2
CH3 NH2
N H
O 2N
N H
N O
2
α -萘胺 (1°)
N CH3
邻甲苯胺 (1°)
O N
二苯胺 (2°)
