水质 游离氯和总氯的测定HJ
水中游离氯的测定方法

水中游离氯的测定方法嘿,咱今儿个就来唠唠水中游离氯的测定方法。
你说这水啊,看着清清亮亮的,可里面到底有没有游离氯,有多少游离氯,咱肉眼可看不出来呀!这就好比那深藏不露的武林高手,不显露一手,你还真不知道他功夫有多高呢!那怎么才能知道水里的游离氯呢?这就有好几种法子啦!就说那比色法吧,就跟咱挑衣服看颜色似的。
通过特定的试剂和水里的游离氯发生反应,然后产生不同的颜色,咱就根据这颜色的深浅来判断游离氯的多少。
这多有意思啊,就像变魔术一样,一下子就把那看不见摸不着的游离氯给“揪”出来了。
还有那滴定法,这就像一场较量。
试剂就像勇敢的斗士,一点点地去和游离氯“战斗”,直到把它全部“拿下”,然后咱根据消耗的试剂多少,就能算出游离氯的量啦。
你说神奇不神奇?再说说那仪器法,哎呀呀,那可真是高科技啊!专门的仪器,就像个超级侦探,能精准地检测出水里的游离氯。
这可比咱肉眼厉害多了吧!咱为啥要这么在意水里的游离氯呢?你想想啊,要是水里的游离氯太多了,那水喝起来能放心吗?对不对?而且这对那些水里的小动物、小植物也有影响呀。
就好像咱生活的环境,如果突然多了很多不好的东西,咱也不舒服呀,它们不也一样嘛!那怎么才能保证测定的准确呢?这可得仔细着点儿啦!就像走钢丝,得小心翼翼的。
试剂得选对,操作得规范,一点儿都不能马虎。
不然得出个错的结果,那可就闹笑话啦!你说这水中游离氯的测定是不是挺重要的?咱可不能小瞧了它呀!咱得认真对待,就像对待咱自己的健康一样。
只有这样,咱才能真正了解咱身边的水,才能放心地使用呀!你说是不是这个理儿?反正我是觉得这事儿挺重要的,咱可不能掉以轻心。
所以啊,大家都要重视起来,学会这些测定方法,让咱的生活更加美好,让咱的水更加干净、安全。
这样咱才能开开心心地用水,健健康康地生活呀!这可不是开玩笑的哟!。
HZHJSZ0044 水质 游离氯和总氯的测定 分光光度法....

中 搅拌至完全溶解 冷至室温后 稀释至 1000mL 混匀
4.7 次氯酸钠 溶液(商品名 安替福民) 含 Cl2 约 0.1g/L 由浓溶液稀释而成 4.8 碘酸钾标准储备溶液 1.006g/L 称取 1.006g 碘酸钾(KIO3 经 120~140 烘干 2h) 溶 解于水(4.1) 转入 1000mL 容量瓶中 稀释至标线 混匀 4.9 碘酸钾标准使用溶液 10.06mg/L 取 10.0mL 储备液(4.8)于 1000mL 溶量瓶中 加入约
2
pH 太低 往往使总氯中一氯胺在游离氯测定时出现颜色 又如 pH 太高 会由于溶解氧产生 颜色
6.5 总氯的测定 转移第二份试料(不要淋洗)于盛有 5.0mL 缓冲液(4 2)和 5.0mL DPD 试液(4.3)的 250mL
锥形瓶中 加入约 1g 碘化钾(4.4) 混匀(见 6.3 注) 将显色液倒入比色皿内 2min 后 测量 吸光度 得到浓度 c 2
2
式中 c 2 在测定(6.5)中所得总氯浓度 m mol/L 8.2 由物质的量的浓度换算为质量浓度
以毫摩尔/升表示的氯(Cl2)浓度 乘以 70.91 换算为毫克/升 8.3 重复性
安微省环境监测中心站组织八个实验室验证了本方法 游离氯室内精密度见表 2 9 干扰
下述两种类型的干扰值得注意
2.5g/L
5.2 微量滴定管 全量 5mL 分度至 0.02mL
5.3 100mL 容量瓶
5.4 分光光度计(使用 510nm 波长) 具 10mm 方形比色皿 无需氯量玻璃器皿的准备 将玻
璃器皿在次氯酸钠溶液(4.7)中浸泡 1h 然后用水(4.1)充分漂洗 6 操作步骤
6.1 试样
采样后 立即测定 自始至终避免强光 振摇和温热
游离氯和总氯的测定 分光光度法

HZHJSZ0044 水质 游离氯和总氯的测定 分光光度法 HZ-HJ-SZ-0044水质N二乙基41985第2部分N1苯二胺比色法样品浓度较高时附件A中叙述区别化合氯中一氯胺2 定义 表1 概念名词同义词组成游离氯游离余氯次氯酸次氯酸氯胺2.1 游离氯次氯酸盐离子和溶解的单质氯形式存在的氯以氯胺和有机氯胺形式存在的总氯的一部分以化合氯或两者形式存在的氯按本法测定氨的一三氯化氮NCl3)和有机氯化合物的氯化衍生物游离氯直接与N二乙基4用分光光度法测量其吸光度然后按3.1测量其吸光度4.1 水去离子水或蒸馏水经氯化至约0.14m mol/L(10mg/L)的水平再暴露于紫外线或阳光下数小时按下述步骤检验其质量a. 第一个混匀加入5.0mL缓冲溶液(4.2)和5.0mL DPD试液(4.3)100mL待测水和2滴次氯酸钠溶液(4.8)¼ÓÈë5.0mL缓冲溶液和5.0mL DPD试液(4.3)µÚ¶þ¸öÆ¿ÖÐÓ¦ÏÔ·ÛºìÉ«pH6.5或60.5g十二水合磷酸氢二钠(Na2HPO4加入100mL浓度为8g/L的二水合EDTA二钠(C10H14N2O8Na2或0.8g固体加入0. 020g氯化汞防霉菌繁殖及试剂内痕量碘化物对游离氯检验的干扰混匀汞盐剧毒4.3 N二乙基4C6H4H2SO4] 1.1g/L将250mL水(4.1) 1.84g/mL)和25mL的8g/L二水合EDTA二钠溶液(或0.2g固体)混合或1gDPD草酸盐于此混合液中混匀于冰箱内保存如溶液变色4.4 碘化钾4.5 硫酸于800mL水(4.1)中1.84g/mL)稀释到1000mL4.6 氢氧化钠约2mol/L氯:称取80g粒状氢氧化钠搅拌至完全溶解稀释至1000mL4.7 次氯酸钠安替福民)由浓溶液稀释而成1.006g/L经120~140溶解于水(4.1)Ï¡ÊÍÖÁ±êÏß4.9 碘酸钾标准使用溶液取10.0mL储备液(4.8)于1000mL溶量瓶中加水(4.1)稀释至标线在使用的当天配制 1.00mL此标准使用溶液含10.0ìgKIO3(相当于0.141ìmolCl2)溶液或硫代乙酰胺(CH3CSNH2)溶液 5 仪器5.1 常用实验室仪器和下列仪器全量5mL5.3 100mL容量瓶具10mm方形比色皿将玻璃器皿在次氯酸钠溶液(4.7)中浸泡1h6 操作步骤6.1 试样采样后自始至终避免强光6.2 试料取试样100mL两个作为试料(V0)取较小体积试样(V1)6.3 标准曲线的绘制向一系列100mL容量瓶中0.301.0010.030.0各瓶中加入1.0mL硫酸(4.5)¸÷¼Ó1.0mL 氢氧化钠溶液(4.6)¸÷Æ¿ÖÐÂÈŨ¶ÈC(Cl2)分别为0.000.7057.0528.256.4和70.5ìmol/L(即0.000.050.50 2.004.00和5.00mg/L)¸÷¼ÓÈë5.0mL缓冲溶液(4.2)和5.0mL DPD试液(4.3)摇匀用10mm比色皿绘制标准曲线by+a注分开配制的各标准比色液呈现假红色如所用的分光光度计的单色性较差浓度范围变窄因此6.4 游离氯的测定转移试料(不要淋洗)于盛有5.0mL缓冲液(4.2)和5.0mL DPD试液(4.3)的250mL锥形瓶中测量吸光度遇偏酸性或高盐类水样使水样达到pH6.2~6.5¿ØÖÆpH十分重要产生的红色可准确地表现游离氯浓度pH 太低又如pH 太高6.5 总氯的测定转移第二份试料(不要淋洗)于盛有5.0mL 缓冲液(4¼ÓÈëÔ¼1g 碘化钾(4.4)将显色液倒入比色皿内测量吸光度 遇偏酸性或高盐类水样使水样pH 达到6.2~6.5ÏòÊÔÁÏÖÐÔ¤ÏȼÓÈëÑÇÉéËáÄÆ»òÁò´úÒÒõ£°·ÈÜÒº(4.10)ÒÔ±ãÈ·¶¨Ñõ»¯Ã̺ÍÁù¼Û¸õµÄÓ°Ïì¼ÓÈë1mL 亚砷酸钠(或硫代乙酰胺)溶液(4.10)ÔÙ¼ÓÈë5.0mL 缓冲液(4.2)和5.0mL DPD 试液(4.3)²âÁ¿Îü¹â¶È相当于氧化锰和六价铬的干扰1)()(1312……………………………………−=V V c c Cl c 式中m mol/Lm mol/LÈç²»´æÔÚÑõ»¯Ã̺ÍÁù¼Û¸õʱ0mL100mL)8.1.2 总氯的计算以毫摩尔/升表示的总氯浓度c (Cl 2)按式(2)计算c 2在测定(6.5)中所得总氯浓度 8.2 由物质的量的浓度换算为质量浓度 以毫摩尔/升表示的氯(Cl 2)浓度8.3 重复性安微省环境监测中心站组织八个实验室验证了本方法 9 干扰 下述两种类型的干扰值得注意这种干扰可由测定水中二氧化氯加以校正根据浓度和化学氧化电位因此溴溴胺臭氧铬酸盐亚硝酸盐铜离子20mg/L 的干扰可被试剂4.2和4.3中的EDTA 二钠掩蔽水样名称 水样数 游离氯浓度范围 Cl 2mg/L 标准偏差Cl 2含游离氯蒸馏水 10 9 10 0.14~0.16 0.74~0.80 1.33~1.39 0.15 0.77 1.35 0.0038 0.0046 0.0054 2.50.6 0.4 饮用水 9 0.36~0.70 0.51 0.0054 1.1 医院污水 4 0.52~0.64 0.57 0.0069 1.2 造纸废水 6 0.52~0.87 0.70 0.0059 0.8 印染废水4 7 9 0.17~0.28 0.38~0.60 0.72~1.17 0.23 0.50 0.94 0.0067 0.0057 0.0142.9 1.1 1.5注提供本法的重复性附录A一氯胺二氯胺和三氯化氮三种形式化合氯的方法A2 原理在测定游离氯和总氧后a. 当第三个试料加入盛有缓冲液和DPD 试液的锥形瓶后反应局限于游离氯和化合氯中的一氯胺先加小量碘化钾游离氯化合氯中二氯胺在以上两种情况下都不反应二氯胺和三氯化氮的浓度A3.1 碘化钾溶液临用的当天配制A4 仪器 见第5条A5.2 试料测定与6.2相同的两个试料 A5.4 游离氯和化合氯中一氯胺的测定 向250毫升锥形瓶中5.0mL DPD试液(4.3)立即用上述相同的条件(A5.3)测量溶液的吸光度A5.5 游离氯向250mL烧杯中2滴(约0.1mL)碘化钾溶液(A3)或很小一粒碘化钾晶体(约0.5mg)½«ÉÕ±-ÄÚÈÜÒºµ¹ÈëÔÚ1min内刚加入5.0mL缓冲液(4.2)和5.0mL DPD试液的250mL锥形瓶中测量吸光度A6 结果计算 A6.1 计算方法A6.1.1 一氯胺的计算以毫摩尔/升表示的化合氯中一氯胺浓度X1(Cl2)由式(A1)计算c 4在测定(A5.4)中所得氯浓度 A6.1.2 二氯胺的计算以毫摩尔/升表示的化合氯中二氯胺浓度X2(Cl2)按式(A2)计算c 5在测定(A5.5)中所得氯浓度 A6.1.3 三氯化氮的计算以毫摩尔/升表示的化合氯中三氯化氮浓度X3(Cl2)由式(A3)计算。
水质中游离氯测定方法实验条件的优化

具体操作是 MLSS大于 4000mg/L时 ,增大剩余污泥排放量 ,小 于 CASS工艺因为没有 物化段 ,在运行成本上 比曝气生物滤池具有
3000mg/L时 ,减小排泥量 ,同时 svI控制在 50~120mUg的范围内。 较 明显 的优 势 。
目前 ,二期 系统 处理水量 稳定在 (4一一4.5)×104m3/d,系统 2009
用水 加氯 以杀灭 或抑制微 生物过程 ,在消毒过程 中 ,常导致水 中
由表 5所示可知 ,当氢氧化钠溶液加入时间延后至 20 min以
存在过 量的游离氯 ,这些过量 的氯不 仅影 响水 的 口感和气味 ,破 上时 ,平行样 品之 间的吸光度值相对标准偏差 已降至 l%以下 ,其
坏水 的品质。而且能够与水 中某些有 机物反应 生成有致畸 、致癌 结果 的精密度 已可 以满 足实验 的要求 ;同时 ,将氢 氧化钠加入 时
由表 3可 知 ,和标准方法 相 比,优化后方法在 进行实 际样 品
标 准方法 HJ 586—2010中规定 ,在配制 标准 曲线及样 品测定 测定 时 ,其加标 回收率更好 ,能完全满足实际工作的需要。
过程 中,“向各容量瓶 中加入 1.0ml硫 酸溶 液。1 min后 ,向各容量 瓶 中加入 1 ml NaOH溶 液 ,用水稀释至标线”。在 日常实际应用 中 2结 论
为了验证该操作步骤的准确性 ,本研究从 绘制校准曲线 、测
法 、分光光度法 以及 电化 学余 氯传感器法为 主141。现行标准《水质 定实际样 品两方 面对优化 的方法进行试验验证 。
游离 氯和总氯的测定 N,N一二乙基 一1,4一苯二胺分 光光度法》(HJ 1.4.1绘制校准曲线
586—2010)规定 了水 中游离氯和总氯测定方 法 。N,N一二乙基 一1,
水中消毒剂游离氯、总氯不确定度评定

2 不确定度来源分析 水中消毒剂游离氯、总氯不确定度来源 [4] 主要包括计
量器具引入的不确定度、水样稀释引入的不确定度、取样时
水样体积引入的不确定度、标准曲线系列稀释过程引入的不
( ) ur= el V容1 000
0= .62 mL 1 000 mL
0.062%
3.1.2 1 mL 移液管
按矩形分布,A 级 1 mL 移液管引入的标0.0.0004400mmLL。重复性引入的标准不确定度为
0.005
mL。
作者简介:唐玉玲(1993—),女,吉林白山人,本科,助理工程师。研究方向:生活饮用水。
确定度、重复测量引入的不确定度、校准曲线拟合引入的不
确定度 6 个部分。
3 不确定度的评定
3.1 计量器具引入的不确定度
3.1.1 1 000 mL 容量瓶 根据 JJG 196—2006[5] 的规定在 20 ℃时 A 级 1 000 mL
容量瓶的容量最大允许误差为 ±0.30 mL,按三角分布,
0= .057 7 mg 1 006 mg
0.005 7%
3.4.3 氯标准使用溶液引入的不确定度
3.1.3 100 mL 容量瓶
按 三 角 分 布,A 级 100 mL 容 量 瓶 引 入 的 标 准 不 确 定 温0.度160变=化0.按04矩m形L分。布重,复则性标引准入不的确标定准度不确0.1定30度5 =为0.00.6013mmLL。。
计算。
则 1 000 mL 容 量 瓶 体 积 变 化 =±(1 000×5×2.1×10-4)=
HJ 586-2010 水质 游离氯和总氯的测定 N,N-二乙基-1,4-苯二胺分光光度法

中华人民共和国国家环境保护标准HJ 586—2010代替GB 11898-89水质 游离氯和总氯的测定N,N-二乙基-1,4-苯二胺分光光度法Water quality - Determination of free chlorine and total chlorine - Spectrophotonetric method using N, N-diethyl-1, 4-phenylenediamine本电子版为发布稿。
请以中国环境科学出版社出版的正式标准文本为准。
2010-09-20发布 2010-12-01实施环 境 保 护 部发布目次前 言 (I)1 适用范围 (1)2 规范性引用文件 (1)3 术语和定义 (1)4 方法原理 (2)5 干扰和消除 (2)6 试剂和材料 (3)7 仪器和设备 (4)8 样品 (4)9 分析步骤 (4)10 结果计算及表示 (5)11 精密度和准确度 (6)12 质量保证和质量控制 (7)13 注意事项 (7)附录A (规范性附录) 水质 游离氯和总氯的测定 N,N-二乙基-1,4-苯二胺现场测定法 (8)附录B (规范性附录) 一氯胺、二氯胺和三氯化氮三种形式化合氯的分别测定 (10)前言为贯彻《中华人民共和国环境保护法》和《中华人民共和国水污染防治法》,保护环境,保障人体健康,规范水中游离氯和总氯的监测方法,制定本标准。
本标准规定了测定地表水、工业废水、医疗废水、生活污水、中水和污水再生的景观用水中的游离氯和总氯的N,N-二乙基-1,4-苯二胺分光光度法和现场测定法。
本标准是对《水质游离氯和总氯的测定 N,N-二乙基-1,4-苯二胺分光光度法》(GB11898-89)的修订。
本标准首次发布于1989年,原标准起草单位:安徽省环境监测中心、中国预防医学科学院环境卫生监测所和安徽省芜湖环保监测中心站。
本次为第一次修订。
修订的主要内容如下:——修订了方法的适用范围;——增加了样品的保存方法,修改了缓冲溶液添加量;——调整了测定波长;——增加了低浓度校准曲线,降低了测定地表水游离氯和总氯的方法检出限;——增加了注意事项条款;——增加了游离氯和总氯的现场测定方法。
游离氯和总氯的检测方法作业指导书

游离氯和总氯的检测方法作业指导书1、方法原理及适用范围1.1游离氯的测定在pH 为6.2~6.5的条件下,游离氯与N,N-二乙基-1,4-苯二胺(DPD)生成红色化合物,用硫酸亚铁铵标准溶液滴定至红色消失。
1.2总氯的测定在pH 为6.2~6.5的条件下,存在过量碘化钾时,单质氯、次氯酸、次氯酸盐和氯胺与DPD 反应生成红色化合物,用硫酸亚铁铵标准溶液滴定至红色消失。
2、适用范围适用于工业废水、医疗废水、生活污水、中水和污水再生的景观用水中的游离氯和总氯的测定。
方法检出限(以Cl 2计)为0.02mg/L,测定范围(以Cl 2计)为0.08~5.00mg/L。
3、试剂3.1实验用水:不含氯和还原性物质的去离子水或二次蒸馏水3.2浓硫酸(ρ=1.84g/mL)3.3碘化钾:晶体3.4次氯酸钠溶液(ρ(Cl 2)≈0.1g/L):由次氯酸钠浓溶液稀释而成。
3.51.0mol/L 硫酸溶液3.62.0mol/L 氢氧化钠溶液3.7正磷酸(ρ=1.71g/mL)3.8重铬酸钾标准溶液:c(1/6K 2Cr 2O 7)=100.0mmol/L3.9硫酸亚铁铵贮备液:c[(NH 4)2Fe(SO 4)2·6H 2O]≈56mmol/L3.9.1标定:向250ml 锥形瓶中,一次加入50.0ml 硫酸亚铁铵贮备液、5.0ml 正磷酸和4滴二苯胺磺酸钡指示液。
用重铬酸钾标准溶液滴定至出现墨绿色,溶液颜色保持不变为终点。
此溶液浓度以每升含氯(Cl 2)毫摩尔数表示,按式(1)进行计算。
12212c V V c(1)式中:c1---硫酸亚铁铵贮备液的浓度,mmol/L;C2---重铬酸钾标准溶液的浓度,mmol/L;V2---滴定消耗重铬酸钾标准溶液的体积,ml;V1---硫酸亚铁铵贮备液的体积,ml;2---每摩尔硫酸亚铁铵相当于氯(Cl2)的摩尔数。
注:若V2小于22ml,应重新配置硫酸亚铁铵贮备液。
水质 游离氯和总氯的测定 分光光度法 原始记录 (2)
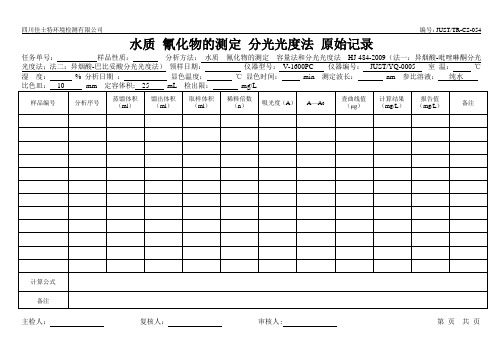
任务单号:样品性质:分析方法:水质氰化物的测定容量法和分光光度法HJ 484-2009(法一:异烟酸-吡唑啉酮分光光度法;法二:异烟酸-巴比妥酸分光光度法)领样日期:仪器型号:V-1600PC仪器编号:JUST/YQ-0005室温:℃湿度:%分析日期:显色温度:℃显色时间:min测定波长:nm参比溶液:纯水
比色皿:10mm定容体积:25mL检出限:mg/L
样品编号
分析序号
蒸馏体积
(ml)
馏出体积
(ml)
取样体积
(ml)
稀释倍数
(n)
吸光度(A)
A—A0
查曲线值
(μg)
计算结果(mg/L)
报告值
(mg/L)
备注
计算公式
备注
主检人:复核人:审核人:第页共页
水质游离氯和总氯的测定

七、注意事项
• 1、当样品在现场测定时,若样品过酸、过碱或者盐浓度很高,应增加缓冲 液的加入量,确保试样pH在6.2~6.5之间。
• 2、样品运回实验室,对于酸性很强的水样,应增加固定剂NaOH溶液,使 pH>12;若固定剂NaOH溶液加入体积大于样品体积1%,应予以校正。对 于碱性很强的水样,则不需要加入固定剂,可增加缓冲溶液的加入量,使试 样pH在6.2~6.5之间;对于加入固定剂的高盐样品,测定时也需要调整缓冲 溶液的量,试样pH在6.2~6.5之间。
物和有机氮化合物的氯化衍生物。
• 游离氯和总氯的组成表
三、方法和原理
• 1、游离氯的测定 • 在pH为6.2~6.5条件下,游离氯与N,N-二乙基-1,4-苯二胺(DPD)生
成红色化合物,用硫酸亚铁铵标准溶液滴定至红色消失。
• 2、总氯的测定 • 在pH为6.2~6.5条件下,存在过量碘化钾时,单质氯、次氯酸、次
一、适用范围 二、术语和定义 三、方法和原理 四、干扰和消除 五、样品 六、分析步骤及结果计算 七、注意事项
前言
一、适用范围
• 本标准规定了测定游离氯、总氯的滴定法。
• 适用:工业废水、医疗废水、生活废水、中水和污水再生的景观 用水中的游离氯和总氯的测定。
• 不适用:测定较浑浊或色度较高的水样。 • 检出限(以Cl2计):0.02mg/L。测定范围(以Cl2计):0.08 mg/L。
ρ(Cl2)
C
3(V 3 V
0
V
5)
70.91
式中:ρ—游离氯的质量浓度; C3—硫酸亚铁铵标准滴定液的浓度(以Cl2计)mmol/L; V0—实际水样体积,mL; V3—测定中消耗硫酸亚铁铵标准滴定液的体积,mL; V5—校正氧化锰和六价铬干扰时消耗硫酸亚铁铵标准滴定液 的体积,mL,若均不存在,V5=0 mL; 70.91—Cl2的分子量 。
水质 游离氯和总氯的测定 N, N-二乙基-1, 4-苯二胺滴定法 HJ 585-2010

中华人民共和国国家环境保护标准HJ 585—2010代替GB 11897-89水质 游离氯和总氯的测定 N, N-二乙基-1, 4-苯二胺滴定法Water quality - Determination of free chlorine and total chlorine - Titrimetric method using N, N-diethyl-1, 4-phenylenediamine本电子版为发布稿。
请以中国环境科学出版社出版的正式标准文本为准。
发布环 境 保 护 部目次前言 (I)1 适用范围 (1)2 规范性引用文件 (1)3 术语和定义 (1)4 方法原理 (2)5 干扰和消除 (2)6 试剂和材料 (2)7 仪器和设备 (4)8 样品 (5)9 分析步骤 (5)10 结果计算及表示 (6)11 精密度和准确度 (6)12 注意事项 (7)附录A(规范性附录)一氯胺、二氯胺和三氯化氮三种形式化合氯的分别测定 (8)前言为贯彻《中华人民共和国环境保护法》和《中华人民共和国水污染防治法》,保护环境,保障人体健康,规范水中游离氯和总氯的监测方法,制定本标准。
本标准规定了测定工业废水、医疗废水、生活污水、中水和污水再生的景观用水中游离氯和总氯的N,N-二乙基-1,4-苯二胺滴定法。
本标准是对《水质 游离氯和总氯的测定 N,N-二乙基-1,4-苯二胺滴定法》(GB11897-89)的修订。
本标准首次发布于1989年,原标准起草单位:安徽省环境监测中心、中国预防医学科学院环境卫生监测所和安徽省芜湖环保监测中心站。
本次为第一次修订。
修订的主要内容如下:——修改了标准的适用范围;——增加了样品的保存方法;——增加了干扰和消除条款;——修改了缓冲溶液添加量;——增加了注意事项条款。
自本标准实施之日起,原国家环境保护局1989年12月25日批准、发布的国家环境保护标准《水质游离氯和总氯的测定 N,N-二乙基-1,4-苯二胺滴定法》(GB 11897-89)废止。
水质游离氯和总氯的测定分光光度法原始记录(2)

水质游离氯和总氯的测定分光光度法原始记录(2)
四川佳士特环境检测有限公司编号:JUST/TR-CS-054水质氰化物的测定分光光度法原始记录
任务单号:样品性质:分析方法:水质氰化物的测定容量法和分光光度法HJ 484-2009(法一:异烟酸-吡唑啉酮分光光度法;法二:异烟酸-巴比妥酸分光光度法)领样日期:仪器型号:V-1600PC 仪器编号:JUST/YQ-0005室温:℃湿度:% 分析日期:显色温度:℃显色时间:min 测定波长:nm 参比溶液:纯水
比色皿:10 mm 定容体积: 25 mL 检出限:mg/L
样品编号分析序号蒸馏体积
(ml)
馏出体积
(ml)
取样体积
(ml)
稀释倍数
(n)
吸光度(A)A—A0
查曲线值
(μg)
计算结果
(mg/L)
报告值
(mg/L)
备注
计算公式
备注
主检人:复核人:审核人:第页共页。
游离性总余氯的测定

游离性总余氯的测定 一、邻联甲苯胺比色法编号:QW-ZJ-HG-025A 1、主题本文件规定了水中余氯测定的操作方法 2、适用范围适用于不含亚硝酸根离子的水样中游离性余氯测定。
测定范围0.01~15mg/L 。
3、依据本规程依据GB/T5750.5-2006 4、流程 5、内容 5.1方法提要水样中游离性余氯与邻联甲苯胺作用,生成黄色(或桔黄色)的二盐酸醌式邻联甲苯胺。
根据颜色的深浅与标准色比较,测出水样中游离性余氯含量。
EDTMP 在10ppm 以下不影响测定,正常情况下循环水中的Fe 3+不影响测定。
NO 2-干扰测定。
5.2 仪器与试剂 5.2.1 仪器100毫升具塞比色管一套。
5.2.2 试剂(1)无水磷酸氢二钠、(2)磷酸二氢钾、(3)重铬酸钾、(4)铬酸钾、(5)盐酸、(6)邻联甲苯胺、 5.3 准备工作4.1标准色阶的准备→4.2吸取水样100mL 于具塞比色管中,加入5mL 邻联甲苯胺溶液。
→4.3 30秒钟内与标准余氯色阶比较求得水样中游离性余氯含量。
5.3.1 磷酸盐缓冲液(1)磷酸盐缓冲储备液配制:将无水磷酸氢二钠放在105~110℃烘箱内,2小时后取出置于干燥器内冷却至室温,称取22.86g,另将磷酸二氢钾放在105~110℃烘箱内同样处理,并称取46.14g。
将上述两试剂共同溶于水中,稀释至1000mL,静置4天后过滤。
滤液称为贮备液。
(2)磷酸盐缓冲使用液配制(pH=6.45):将上述磷酸盐贮备液200mL加水稀释至1000mL。
5.3.2 重铬酸钾—铬酸钾溶液配制方法:称取0.1550g于105~110℃烘箱内干燥处理过的重铬酸钾及0.4650g同样处理的铬酸钾放在400mL烧杯中加磷酸盐缓冲使用液使其溶解,转移到1000mL容量瓶中,用磷酸缓冲使用液稀释至刻度,此有色溶液的颜色相当于1mg/L余氯与邻联甲苯胺所产生的颜色。
5.3.3邻联甲苯胺溶液配制方法:称取1g纯邻联甲苯胺加于5mL20%盐酸中,在研钵中研成糊状,加入150~200mL水,使其完全溶解,放在1升量筒中补加到505mL,最后加入20%盐酸至1升,储于棕色瓶中。
工业循环冷却水中游离氯和总氯的测定

工业循环冷却水中游离氯和总氯的测定HG/T 2023—91 N,N-二乙基-1,4-苯二胺分光光度法本标准参照采用国际标准ISO7393/2:85《水质��游离氯和总氯的测定��第2部分:N,N-二乙基-1,4苯二胺比色法》。
1 主题内容与适用范围本标准规定了循环冷却水中游离氯和总氯的测定方法与测定范围。
本标准适用于含量为0.1~1.5mg/L(以Cl计)循环冷却水中总氯的测定。
2 术语2.1 游离氯:包括次氯酸,次氯酸根离子和溶解的元素氯。
2.2 总氯:包括游离氯和氯胺。
2.3 氯胺:包括一氯胺、二氯胺、三氯化氮和有机氮化物的所有氯化衍生物。
3 方法提要3.1游离氯的测定当pH为6.2~6.5时,试样中的游离氯与N,N-二乙基-1,4-苯二胺(以下简称DPD)直接反应,生成红色化合物,于510nm波长处,用分光光度法测定。
3.2总氯的测定当pH为6.2~6.5时,在过量的碘化钾存在下,试样中总氯与DPD反应,生成红色化合物,于510nm波长处,用分光光度法测定。
4 试剂和材料分析方法中,除特殊规定外,只应使用分析纯试剂和符合4.2规定的水。
4.1 次氯酸钠溶液:活性氯浓度为5.2%(m/m)的溶液。
4.2水(不应含有氧化性和还原性物质的水):蒸馏水必须按下述方法检验:取两只250mL锥形瓶,在第一个瓶内放置100mL被检验的水和1g碘化钾(4.5)混合,1min后,加入5.0mL缓冲溶液(4.3)和5.0mLDPD 溶液(4.4)混合。
在第二个瓶内,放置100mL被检验的水和两滴水氯酸钠溶液(4.6)混合,2min后,加入5.0mL缓冲溶液(4.3)和5.0mLDPD溶液(4.4)混合。
若在第一个瓶中无色,而在第二个瓶中出现淡粉红色,则水(4.2)符合质量要求。
若蒸馏水不符合质量要求,必须按下述方法处理;将3000mL蒸馏水置于烧杯中,加入0.50mL次氯酸钠溶液(4.1),混匀,盖上玻璃盖,放置至少20h,然后去盖用H型紫外灯(9W)插入水中,或在强日光下照射10h以上,脱氯,再按上述方法检验,如不合格,仍需重新处理。
42 水质 游离氯

光度法分析水中(游离(余)氯)原始记录
任务单号:
检测项目
游离(余)氯
检测依据 HJ 586-2010 GB/T 5750.11-2006(1.1)
到样日期
检测日期
仪器设备及 编号
仪器条件
标液名称
口紫外可见分光光度计
口其他:
测定用波长
nm
比色皿厚度
mm
编号/
标准值及不确定度:
回收率(%): 相对误差(%): 结果判定:
实验过程: 地表水、工业废水、医疗废水、生活污水:于 250ml 锥形瓶中,依次加入 15.0ml 磷酸盐缓冲溶液,5.0mlDPD 溶 液和 100ml 水样(或稀释后的水样),于 515nm 波长处用比色皿测定吸光度。 地下水、生活饮用水、水源水:吸取 10ml 水样于 10ml 比色管中,加入 0.5ml 磷酸盐缓冲溶液,5.0mlDPD 溶液 混匀,立即于 515nm 波长处用 1cm 比色皿。以纯水为参比,测定吸光度。
计算公式
1. 相对含量:c (A A0 a) b
2. 检测结果:
3. 回收率:%=(测定值-本底值)/加标量×100
4. 相对误差:%= |测定值-标液浓度值|/标液浓度值×100
样品名称及编号
取样量 V(mL)
稀释 定容体积
相对含量 结果值
报出值
倍数 f
(mL)
吸光度 A C(
) X(
)(
)
批号
分取标液体积(mL)
工 作
口浓度口含量 x(
)
曲
吸光度值(A-A0)
线 (空白值A0=
)
回归方程
y=a+bx a=
余氯方法验证报告

水质游离氯和总氯的测定N,N-二乙基-1,4-苯二胺现场测定法方法验证报告一、方法与材料1 主题内容本标准规定了测定水中游离氯和总氯的现场测定法。
本方法适用于工业废水、医疗废水、生活污水和中水中游离氯和总氯的测定。
2 方法原理游离氯测定:在pH为6.2-6.5 条件下,游离氯直接与N,N-二乙基-1,4-苯二胺(DPD)发生反应,生成红色化合物,在515 nm 波长下,采用分光光度法测定其吸光度。
由于游离氯标准溶液不稳定且不易获得,本标准以碘分子或[I3]-代替游离氯做校准曲线。
以碘酸钾为基准,在酸性条件下与碘化钾发生如下反应:IO3-+5I-+6H+=3I2+3H2O,I2+I-=[I3]-,生成的碘分子或[I3]-与DPD发生显色反应,碘分子与氯分子的物质的量的比例关系为1:1 。
总氯测定:在pH为6.2-6.5条件下,存在过量碘化钾时,单质氯、次氯酸、次氯酸盐和氯胺与DPD反应生成红色化合物,在515 nm波长下,采用分光光度法测定其吸光度,测定总氯。
3 试剂表1 使用试剂及溶液登记表3.1碘化钾:晶体3.2次氯酸钠溶液ρ≈0.1g/L3.3硫酸溶液(c=1.0mol/L):于800mL水中,在不断搅拌下小心加入54.0mL 浓硫酸,冷却后将溶液移入1000mL容量瓶中,加水至标线,混匀。
3.4磷酸盐缓冲溶液(pH=6.5):称取24.0g无水磷酸氢二钠,以及46.0g 磷酸二氢钾,依次溶于水中,加入0.8gEDTA二钠固体,转移至1000mL容量瓶中,加水至标线,混匀。
3.5 N,N-二乙基-1,4-苯二胺硫酸盐溶液(DPD ρ=1.1g/L):将2.0g硫酸和0.2gEDTA二钠固体,加入250mL水中配制成混合液。
将1.1g无水DPD硫酸盐加入上述混合液中,转移至1000mL棕色容量瓶中,加水至标线,混匀。
3.6碘酸钾标准使用液1:吸取10.0mL碘酸钾标准溶液于1000mL棕色容量瓶中,加入1g碘化钾,混匀。
水质游离氯和总氯检测原始记录

1
2
3
4
5
6
7
标 □高浓度 CS(mg/L)
0.00
0.10
0.20
0.30
0.50
1.00
1.50
准 □低浓度 CS(mg/L)
0.00
0.02
0.04
0.08
0.12
0.16
0.20
曲
线
吸光度 AS
标准曲线 检出限 样品编号
曲线方程:
相关系数:
高浓度样品:0.03 mg/L 低浓度样品:0.004mg/L
仪器条件
波长 515 nm 比色皿: □10mm □50mm
实验过程 顺序号
游离氯和总氯:于 250mL 锥形瓶中,依次加入 15.0mL 磷酸盐缓冲溶液、5.0mL DPD 溶液和 (□游离氯ρ1:100mL 水样,□总氯ρ2:100mL 水样和 1.0g 碘化钾),混匀,测定吸光度。 氧化锰和六价铬的干扰ρ3:取 100mL 试样,加 1.0mL 硫代乙酰胺,混匀。再加入 15.0mL 磷 酸盐缓冲溶液、5.0mL DPD 溶液,混匀,测定吸光度。
结果 表示
0.01mg/L 时,保留到小数点后三位;
样品空白 A0
≥0.01mg/L 且小于10mg/L 时,保留到小数
点后两位;≥10mg/L 时,保留三位 浓度ρ1 A1 (mg/L)
总氯
吸光度 浓度ρ2 A2 (mg/L)
干扰当量氯
游离氯
吸光度 浓度ρ3 (mg/L)
委托单号: 样品名称
水质游离氯和总氯检测原始记录
样品状态
检测日期 检测依据 标准物质
检测环境 温度: ℃,湿度: %RH
《水质 游离氯和总氯的测定 N,N-二乙基-1,4 苯二胺分光光度法》HJ 586-2010
水质__游离氯和总氯的测定HJ

水质__游离氯和总氯的测定HJ水质游离氯和总氯的测定N,N-二乙基-1,4-苯二胺分光光度法警告;汞盐属剧毒化学品,操作时应按规定要求佩带防护器具,避免接触皮肤和衣物。
检测后的废液应妥善的安全处理。
1、适用范围本标准规定了测定水中游离氯和总氯的分光光度法。
本标准适用于地表水、工业废水、医疗废水、生活废水、中水和污水再生的景观用水中的游离氯和总氯的测定。
本标准不适用于测定较浑浊或色度较高的水样。
对于高浓度样品,采用10mm比色皿,本方法的检出限(以Cl2计)为0.03mg/L,测定范围(以Cl2计)为0.12mg/l~1.50mg/l。
对于低浓度样品,采用50mm比色皿,本方法的检出限(以Cl2计)为0.004mg/l,测定范围(以Cl2计)为0.016mg/l~0.20mg/l。
对于游离氯或总氯浓度高于方法测定上限的样品,可适当稀释后进行测定。
现场测定水中游离氯和总氯按照附录A执行。
2、规范性引用文件本标准内容引用了下列文件中的条款。
凡是不注日期的引用文件,其有效版本适用于本标准。
GB/T5750.10 生活饮用水标准检验法亚氯酸盐GB/T5750.11 生活饮用水标准检验法二氧化氯3、术语和定义下列术语和定义适用于本标准。
3.1 游离氯指以次氯酸、次氯酸盐离子和溶解的单质氯形式存在的氯。
3.2 化合氯指以氯胺和有机氯胺形式存在的氯。
3.3 总氯指以“游离氯”或“化合氯”,或两者共存形式存在的氯。
3.4 氯胺指按本方法测定的氨的一、二或三个氢原子被氯原子取代的衍生物(如:一氯胺、二氯胺,三氯化氮)和有机氮化合物的氯化衍生物。
游离氯和总氯的组成见表14、方法原理4.1 游离氯测定在PH为6.2~6.5条件下,游离氯直接与N,N-二乙基-1,4-苯二胺(DPD)发生反应,生成红色化合物,在515nm波长下,采用分光光度法测定其吸光度。
由于游离氯标准溶液不稳定且不易获得,本标准以碘分子或(I3)-代替游离氯做校准曲线。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
水质游离氯和总氯的测定N,N-二乙基-1,4-苯二胺分光光度法警告;汞盐属剧毒化学品,操作时应按规定要求佩带防护器具,避免接触皮肤和衣物。
检测后的废液应妥善的安全处理。
1、适用范围本标准规定了测定水中游离氯和总氯的分光光度法。
本标准适用于地表水、工业废水、医疗废水、生活废水、中水和污水再生的景观用水中的游离氯和总氯的测定。
本标准不适用于测定较浑浊或色度较高的水样。
对于高浓度样品,采用10mm比色皿,本方法的检出限(以Cl2计)为0.03mg/L,测定范围(以Cl2计)为0.12mg/l~1.50mg/l。
对于低浓度样品,采用50mm比色皿,本方法的检出限(以Cl2计)为0.004mg/l,测定范围(以Cl2计)为0.016mg/l~0.20mg/l。
对于游离氯或总氯浓度高于方法测定上限的样品,可适当稀释后进行测定。
现场测定水中游离氯和总氯按照附录A执行。
2、规范性引用文件本标准内容引用了下列文件中的条款。
凡是不注日期的引用文件,其有效版本适用于本标准。
GB/T5750.10 生活饮用水标准检验法亚氯酸盐GB/T5750.11 生活饮用水标准检验法二氧化氯3、术语和定义下列术语和定义适用于本标准。
3.1 游离氯指以次氯酸、次氯酸盐离子和溶解的单质氯形式存在的氯。
3.2 化合氯指以氯胺和有机氯胺形式存在的氯。
3.3 总氯指以“游离氯”或“化合氯”,或两者共存形式存在的氯。
3.4 氯胺指按本方法测定的氨的一、二或三个氢原子被氯原子取代的衍生物(如:一氯胺、二氯胺,三氯化氮)和有机氮化合物的氯化衍生物。
游离氯和总氯的组成见表14、方法原理4.1 游离氯测定在PH为6.2~6.5条件下,游离氯直接与N,N-二乙基-1,4-苯二胺(DPD)发生反应,生成红色化合物,在515nm波长下,采用分光光度法测定其吸光度。
由于游离氯标准溶液不稳定且不易获得,本标准以碘分子或(I3)-代替游离氯做校准曲线。
以碘酸钾为基准,在酸性条件下与碘化钾发生如下反应;IO3-+5I-+6H+=3I2+3H2O,I2+I-=【I3】-,生成的碘分子或【I3】-与DPD发生显色反应,碘分子与氯分子的物质的量的比例关系为1:1.5、干扰和消除5.1 其他氯化合物的干扰二氧化氯对游离氯和总氯的测定产生干扰,亚氯酸盐对总氯的测定产生干扰。
二氧化氯和亚氯酸盐可通过测定其浓度加以矫正,其测定方法参见GB/5750.11和GB/T5750.10.高浓度的一氯胺对游离氯的测定产生干扰。
可以通过加亚砷酸钠溶液(6.13)或硫代乙酰胺溶液(6.13)消除一氯胺的干扰,一氯胺的测定按照附录B执行。
5.2 氧化锰和六价铬的干扰氧化锰和六价铬对测定产生干扰。
通过测定氧化锰和六价铬的浓度可消除干扰,其测定方法见9.2.5.3其他氧化物的干扰本方法在以下氧化剂存在的情况下有干扰:溴、碘、溴胺、碘胺、臭氧、过氧化氢、铬酸盐、氧化锰、六价铬、亚硝酸根、铜离子(Cu2+)和铁离子(Fe3+)。
其中Cu2+(<8mg/L 和Fe3+(<20mg/l的干扰可通过缓冲溶液和DPD溶液中的Na2-EDTA掩蔽,其他氧化物干扰为亚砷酸钠溶液(6.13)或硫代乙酰胺溶液(6.13)消除。
铬酸盐的干扰可通过加入氯化钡消除。
6试剂和材料除非另有说明,分析时均使用符合国家标准的分析纯试剂。
6.1 实验用水为不含氯和还原性物质的去离子水或二次蒸馏水,实验用水需通过检验方能使用。
检验方法:向第一个250ml锥形瓶中加入100ml待测水和1.0g碘化钾(6,.3)混匀。
1min 后,加入5.0ml缓冲溶液(6.11)和5.0mlDPD试液(6.12);再向第二个250ml锥形瓶中加入100ml待测水和2地次氯酸钠溶液(6.4)。
2min后,加入5.0ml缓冲溶液(6.11)和5.0mlDPD 试液(6.12)。
第一个瓶中不显色,第二个瓶中应显粉红色。
否则需将实验用水经活性炭柱处理使之脱氯,并按照上述步骤检验其质量,直至合格后方能使用。
6.2 浓硫酸:p=1.84g/ml。
6.3 碘化钾(KI):晶体。
6.4 次氯酸钠溶液:ρ(Cl2)≈0.1g/L由次氯酸钠浓溶液(商品名,安替福民)稀释而成。
6.5 硫酸溶液:c(H2SO4)=1.0mol/l于800ml水(6.1)中,在不断搅拌下小心加入54.0ml浓硫酸(6.2),冷却后将溶液移入1000ml容量瓶中,加水(6.1)至标线,混匀。
6.6 氢氧化钠溶液:c(NaOH)=2.0mol/l称取80.0g氢氧化钠,溶解于800ml水(6.1)中,待溶液冷却后移入1000ml容量瓶,加水(6.1)至标线,混匀。
6.7 氢氧化钠溶液:c(NaOH)=1.0mol/l称取40.0g氢氧化钠,溶解于500ml水(6.1)中,待溶液冷却后移入1000ml容量瓶,加水(6.1)至标线,混匀。
6.8 碘酸钾标准贮备液:ρ(KIO3)=1.006g/l称取优级碘酸钾(预先在120℃~140℃下烘干2h)1.006g,溶于水(6.1)中,移入1000ml 容量瓶中,加水(6.1)至标线,混匀。
6.9碘酸钾标准使用液I:ρ(KIO3)=10.06mg/l吸取10.0ml碘酸钾标准贮备液(6.8)于1000ml棕色容量瓶中,加入约1g碘化钾(6.3),加水(6.1)至标线,混匀。
临用现配。
1.00ml标准使用液中含10.06μg KIO3,相当于0.141μmol(10.0μg)Cl2.6.10碘酸钾标准使用液II:ρ(KIO3)=1.006mg/l吸取10.00ml碘酸钾标准使用液I(6.9)于100ml棕色容量瓶中,加水(6.1)至标线,混匀。
临用现配。
1.00ml标准使用液中含1.006μg KIO3,相当于0.014μmol(1.0μg)Cl2.。
6.11磷酸盐缓冲溶液:PH=6.5称取24.0g无水磷酸氢二钠(Na2HPO4)或60.5g十二水合磷酸氢二钠(Na2HPO4.12H2O),以及46.0g磷酸二氢钠(KH2PO4),依次溶于水中,加入100ml浓度为8.0g/l的二水合EDTA 二钠(C10H14N2O8Na2.2H2O)溶液或0.8gEDTA二钠固体,转移至1000ml容量瓶中,加水(6.1)至标线,混匀。
必要时,可加入0.020g氯化汞以防止霉菌繁殖及试剂内痕量碘化物对游离氯检验的干扰。
6.12N,N-二乙基-1,4-苯二胺硫酸盐溶液(DPD):ρ「NH2-C6H4-N(C2H5)2.H2SO4」=1.1g/l 将2.0ml硫酸(6.2)和25ml浓度为8.0g/l的二水合EDTA二钠溶液或0.2gEDTA二钠固体,加入250ml水(6.1)中配制成混合溶液。
将1.1g无水DPD硫酸盐或1.5g五水合物,加入上述混合溶液中,转移至1000ml棕色容量瓶中,加水(6.1)至标线,混匀。
溶液装在棕色试剂瓶中,4℃保存。
若溶液长时间放置后变色,应重新配制。
注1:也可用1.1g DPD草酸盐或1.0gDPD盐酸盐代替DPD硫酸盐。
6.13亚砷酸钠溶液或硫代乙酰胺溶液;ρ(NaAsO2)=2.0g/l,ρ(CH3CSNH2)=2.5g/l。
7仪器和设备7.1 可见分光光度计:并配有10mm和50mm比色皿。
7.2 天平:精度分别为0.1g和0.1mg。
7.3 一般实验室常用仪器设备。
注2:实验中的玻璃器皿需在次氯酸钠溶液(6.4)中浸泡1h,然后用水(6.1)充分漂洗。
8、样品8.1 样品采集游离氯和总氯不稳定,样品应尽量现场测定,现场测定方法见附录A。
如样品中不能现场测定,则需对样品加入固定剂保存。
可预先加入采样体积1%的NaOH溶液(6.6)到棕色玻璃瓶中,采集水样使其充满采样瓶,立即加盖塞紧并密封,避免水样接触空气。
若样品呈酸性,应加大NaOH溶液的加入量,确保水样PH大于12.8.2样品保存水样用冷藏箱运送,在实验室内4℃、避光条件下保存,5d内测定。
9分析步骤9.1 校准曲线的绘制9.1.1 高浓度样品的校准曲线绘制分别吸取0.00、1.00、2.00、3.00、5.00、10.0和15.0ml碘酸钾标准使用液I(6.9)于100ml 容量瓶中,加适量(约50ml)水(6.1)。
向各容量瓶中加入1.0ml硫酸溶液(6.5)。
1min后,向各容量瓶中加入1mlNaOH溶液(6.7),用水(6.1)稀释至标线。
各容量瓶中氯质量浓度ρ(Cl2)分别为0.00、0.10、0.20、0.30、0.50、1.00和1.50mg/l。
在250ml锥形瓶中各加入15.0ml缓冲溶液(6.11)和5.0mlDPD(6.12),于1min内将上述标准系列溶液加入锥形瓶中,混匀后,在波长515nm处,用10mm比色皿测定各溶液的吸光度,于60min内完成比色分析。
以空白矫正后的吸光度值为纵坐标,以其对应的氯质量浓度ρ(Cl2)为横坐标,绘制校准曲线。
9.1.2低浓度样品的校准曲线绘制分别吸取0.00、2.00、4.00、8.00、12.00、16.00和20.00ml碘酸钾标准使用液II(6.10)于100ml容量瓶中,加适量(约50ml)水(6.1)。
向各容量瓶总加入1.0ml硫酸溶液(6.5)。
1min后,向各容量瓶中加入1mlNaOH溶液(6.7),用水(6.1)稀释至标线。
各容量瓶中氯质量浓度ρ(Cl2)分别为0.00、0.02、0.04、0.08、0.12、0.16和0.20mg/l。
在250ml锥形瓶中各加入15.0ml缓冲溶液(6.11)和1.0mlDPD(6.12),于1min内将上述标准系列溶液加入锥形瓶中,混匀后,在波长515nm处,用50mm比色皿测定各溶液的吸光度,于60min内完成比色分析。
以空白校正后的吸光度值为纵坐标,以其对应的氯质量浓度ρ(Cl2)为横坐标,绘制校准曲线。
9.2游离氯测定于250ml锥形瓶中,依次加入15.0ml磷酸盐缓冲溶液(6.11)、5.0mlDPD溶液(6.12)和100ml水样(或稀释后的水样),在与绘制校准曲线相同条件下测定吸光度。
用空白矫正后的吸光度值计算质量浓度ρ1.对于含有氧化锰和六价铬的试样可通过测定两者含量消除其干扰。
取100ml试样于250ml 锥形瓶中,加1.0ml亚砷酸钠溶液(6.13)或硫代乙酰胺溶液(6.13),混匀。
再加入15.0ml 缓冲液(6.11)和5.0mlDPD溶液(6.12),测定吸光度,记录质量浓度ρ3,相当于氧化锰和六价铬的干扰。
若水样需稀释,应测定稀释后样品的氧化锰和六价铬干扰。
注3:进行低浓度样品游离氯测定时,应加入1.0mlDPD试剂(6.12).9.3总氯测定在250ml锥形瓶中,依次加入15.0ml磷酸盐缓冲溶液(6.11)、5.0mlDPD溶液(6.12)、100ml水样(或稀释后的水样)和1.0g碘化钾(6.3),混匀。
