第二章 烃化反应
合集下载
药物合成反应-3烃化反应

《药物合成反应》
第二章 烃化反应
(Hydrocarbylation Reaction,Alkylation)
一、概念
《药物合成反应》
用烃基取代有机物分子中的氢原子,包括某些 官能团或碳架上的氢原子,均称为烃化反应。
引入的烃基包括: 饱和的、不饱和的烃基 脂肪的、芳香的烃基 含有各种取代基的烃基 举例 NaOH
O CH2OCOC17H33
O
O
/KOH /H2 O
CH2OCOC17H33 O(CH2CH2O)p H
HO OH
OH (75.5%)
H(OCH2CH2)mO (13 )
(m、n、p均约为20)
O(CH2CH2O)nH
四、烯烃为烃化剂
《药物合成反应》
醇可与烯烃双键进行加成反应生成醚, 也可理解为烯对醇的O-烃化。但对烯烃双 键旁没有吸电子基团存在时,反应不易进 行。只有当双键的α-位有羰基、氰基、酯 基、羧基等存在时,才较易发生烃化反应。 例如醇在碱存在下对丙烯腈的加成反应。
HOOC NH
HX
CuSO4/NaOH,pH5~6
F3C NH2
HOOC Cl
Cu/无水K2CO3 HCl
F3C
HOOC NH
pH4
二、酯类为烃化剂
《药物合成反应》
1.硫酸酯为烃化剂
OH COOCH3 S O NH O
(CH3)2SO4/NaOH 25 ,10h
OH COOCH3 S O N CH3 O
ห้องสมุดไป่ตู้
七、溶剂对烃化位置有较大影响:
《药物合成反应》
酚类在DMSO、DMF、醚类、醇类中烃化时,主要 得酚醚(O-烃化产物),而在水、酚或三氟乙醇中 烃化时,则主要得到C-烃化产物。
第二章 烃化反应
(Hydrocarbylation Reaction,Alkylation)
一、概念
《药物合成反应》
用烃基取代有机物分子中的氢原子,包括某些 官能团或碳架上的氢原子,均称为烃化反应。
引入的烃基包括: 饱和的、不饱和的烃基 脂肪的、芳香的烃基 含有各种取代基的烃基 举例 NaOH
O CH2OCOC17H33
O
O
/KOH /H2 O
CH2OCOC17H33 O(CH2CH2O)p H
HO OH
OH (75.5%)
H(OCH2CH2)mO (13 )
(m、n、p均约为20)
O(CH2CH2O)nH
四、烯烃为烃化剂
《药物合成反应》
醇可与烯烃双键进行加成反应生成醚, 也可理解为烯对醇的O-烃化。但对烯烃双 键旁没有吸电子基团存在时,反应不易进 行。只有当双键的α-位有羰基、氰基、酯 基、羧基等存在时,才较易发生烃化反应。 例如醇在碱存在下对丙烯腈的加成反应。
HOOC NH
HX
CuSO4/NaOH,pH5~6
F3C NH2
HOOC Cl
Cu/无水K2CO3 HCl
F3C
HOOC NH
pH4
二、酯类为烃化剂
《药物合成反应》
1.硫酸酯为烃化剂
OH COOCH3 S O NH O
(CH3)2SO4/NaOH 25 ,10h
OH COOCH3 S O N CH3 O
ห้องสมุดไป่ตู้
七、溶剂对烃化位置有较大影响:
《药物合成反应》
酚类在DMSO、DMF、醚类、醇类中烃化时,主要 得酚醚(O-烃化产物),而在水、酚或三氟乙醇中 烃化时,则主要得到C-烃化产物。
第二章 烃化反应

N
N
扑尔敏
烃基的异构化
n-Pr i-Pr
+ CH3CH2CH2Br
AlCl3
or
i-Pr
+
(CH3)2CHBr
AlCl3
烃基的异构化
烃基的异构化
试 解 释 之
烃基的异构化
所以傅-克反应时间不宜过长,AlCl3用量不宜过大。
Why? ??? ???
烃基的定位
用 BF3、H2SO4、FeCl3 得到对二烃基苯。
烯及醇用AlCl3催化易得树脂状副产物,产物有颜色, 用HF或BF3可以避免。但正醇用AlCl3不发生烃基异 构化,而H2SO4或BF3则发生异构化。
芳香族化合物:
影响因素
当环上存在释电子取代基时,反应较易进 行。故当苯环上连有一个烃基后,有利于 反应的进一步进行而得到多烃基衍生物。
??
影响因素
混合物
芳香胺的N-芳基化-Ullmann反应:
后二者均为非甾体抗炎药
杂环胺的N-烃化: 抗组胺
曲吡那敏
咖啡因
黄嘌呤
可可碱
注意选择性
COOH Cl
OMgBr C2H5OH H2SO 4 CO 2C2H5 Cl C6H5MgBr C Cl H2O H2SO 4
OH Cl C Cl SOCl2 C Cl N H N N C
第一节
氧原子上的烃化反应
醚
一、醇的O-烃化
1、卤代烃为烃化剂 Williamson合成--醇在碱存在下与卤代 烃反应生成醚的反应--是制备混合醚的 有效方法。
卤代烃的结构不同,反应可以是单 分子亲核取代反应SN1,也可以是双 分子取代反应SN2。 通常伯卤代烃发生SN2反应
第二章 烃化反应

6
苄基卤化物,烯丙基卤化物活性较大,只要在 较弱的碱碳酸钾催化下与酚反应即得苄醚或烯 丙醚:
OH
K CO , KI 2 3 K K CO CO ,, KI KI K CO , KI 2 2 3 3 2 3 + ClCH CH=CH + 2CH=CH 2 2CH=CH + ClCH ClCH 2 Me CO 2 2 2 Me2CO Me Me CO CO 2 2 2 OH OH OH OH
NO 22 NO NO 2
OH OH OH OH
NO2
NO2
OCH3 OCH3OH OCH 3 OH NaOH OH NaOH NaOH
OCH3 OCH3ONa OCH 3 ONa ClCH2CHOHCH2OH ONa ClCH2CHOHCH CHOHCH2OH OH ClCH
2 2
OCH3 OCH OCH3 OCH2CHCH2OH 3 OCH 2OH OCH22CHCH CHCH OH 2OH OH OH 6 6
伯卤代烃:SN2机理 苄卤和烯丙卤:SN1或SN2的反应活性都很高; 不同卤素对反应活性有影响: R-I > R-Br > R-Cl。 亲核试剂对反应活性有影响,强亲核试剂对SN2反 应有利,但强碱对于易按SN1机理反应的叔卤烷影 响不大,却可引起它发生消除反应生成烯烃。
叔卤代烃作烷基化试剂:会发生消除反应,得不 到相应的醚; 要合成叔烷基混合醚时,需用叔醇与相应的卤代 烷进行反应;
OH + + R'X R-OH R'X
OH OH
R-O-R' R-O-R'
该反应为亲核取代反应(SN) 根据烃基的结构,可按SN1或SN2机理进行。
第二章+烃化反应

第二章 烃化反应
用烃基取代有机分子中的氢原子,包括在某些 官能团(如羟基、氨基、巯基等)或碳架上的 氢原子,称为烃化反应。 醇和酚氧原子上的烃化反应
胺类化合物氮原子上的烃化反应 活性亚甲基和芳基碳原子上的烃化反应
第一节 氧原子上的烃化反应
一、醇的O-烃化
1. 卤代烃为烃化剂
Williamson Synthesis ROH R'X B OR RO R'OR HB X
3. 杂环胺的N-烃化
NHCH2Ph N PhH2C N (CH2)2NMe2 N
ClCH2CH2NMe2.HCl
NaNH2/Tol. , 6h
(80%)
O O H N O N H N NH
Me2SO4/NaOH, pH 9~10 35oC
Me N O N Me N
NMe
黄嘌呤
Me2SO4/NaOH, pH 4~8
(CH2)6N4, C6H5Cl 33~38oC, 1h
O 2N
O 2N
COCH2N4(CH3)6.Br
C2H5OH. HCl 33~35oC, 1h
COCH2NH3Cl
(CF3SO2)2O
PhCH2NH2
Et3N/CH2Cl2 -78oC
PhCH2NHSO2CF3
SO2CF3
3
H R C O
CH2
R'O-
H R C O
CH2
OR'
H R C O
CH2OR'
R'OH
H R C OH
CH2OR'
R'O
环氧乙烷酸催化开环,亲核试剂优先接近取代较多的 环碳原子。
用烃基取代有机分子中的氢原子,包括在某些 官能团(如羟基、氨基、巯基等)或碳架上的 氢原子,称为烃化反应。 醇和酚氧原子上的烃化反应
胺类化合物氮原子上的烃化反应 活性亚甲基和芳基碳原子上的烃化反应
第一节 氧原子上的烃化反应
一、醇的O-烃化
1. 卤代烃为烃化剂
Williamson Synthesis ROH R'X B OR RO R'OR HB X
3. 杂环胺的N-烃化
NHCH2Ph N PhH2C N (CH2)2NMe2 N
ClCH2CH2NMe2.HCl
NaNH2/Tol. , 6h
(80%)
O O H N O N H N NH
Me2SO4/NaOH, pH 9~10 35oC
Me N O N Me N
NMe
黄嘌呤
Me2SO4/NaOH, pH 4~8
(CH2)6N4, C6H5Cl 33~38oC, 1h
O 2N
O 2N
COCH2N4(CH3)6.Br
C2H5OH. HCl 33~35oC, 1h
COCH2NH3Cl
(CF3SO2)2O
PhCH2NH2
Et3N/CH2Cl2 -78oC
PhCH2NHSO2CF3
SO2CF3
3
H R C O
CH2
R'O-
H R C O
CH2
OR'
H R C O
CH2OR'
R'OH
H R C OH
CH2OR'
R'O
环氧乙烷酸催化开环,亲核试剂优先接近取代较多的 环碳原子。
第二章 烃化反应

2.芳磺酸酯类为烃化剂
应用范围广,常用于引入分子量较大的烃基
(CH3)2SO4 ,
R O R O S
(C2H5)2SO4,
O O
SO3R ,
OH 3CSO3R来自很好的离去基团R O S
O
: TsO
制备方法: 1 2CH3OH+H2SO4 SO2Cl 2 CH3 + CH3OH
(CH3)2SO4+2H2O SO3CH3
大多数的烃化反应是通过亲核取代反应完
成的。根据亲核试剂结构的不同,可分为
杂原子的亲核取代反应和碳负离子的亲核
取代反应。
烃化反应的类型
单分子的SN1亲核取代反应; 双分子的SN2亲核取代反应;
带负电荷或未共用电子对的氧、氮、碳原子向
烃化剂带正电荷的碳原子做亲核进攻;
催化剂存在下,芳环上引入烃基的亲电性取 代反应及芳环自由基进攻的取代反应机理。
NaOH
+ NaCl + H2O CH3
例如:鲨肝醇的合成 :促进白细胞增生药
以甘油为原料,异亚丙基保护两个羟基后;
用对甲苯磺酸十八烷酯对未保护的羟基进行
O-烃化反应;
再脱去异亚丙基保护基,可得鲨肝醇。
3. 环氧乙烷类作烃化剂
非常活泼,开环是环氧乙烷的主要反应。
环氧乙烷可作为烃化剂与醇反应,在氧原子上
②
酚的O-烃化反应 由于酚的酸性比醇强,所以反应更容易 进行,需要的碱相对醇的反应也较弱。 反应通常是通过SN2机理完成
2.碳负离子的亲核取代反应
碳负离子带有负电荷,具有很强的碱性
和亲核能力,可以和卤代烃等烃化试剂
发生取代反应,延长碳链。
第二章 烃化反应

④原酸酯及四烷氧基甲烷的制备 多卤代物与醇钠的反应,可以制备原酸酯或四烷氧基甲烷。
CHCl3 + 3RONa CCl3NO2 + 4RONa CH(OR)3 原酸酯 C(OR)4 四烷氧基甲烷
5)环醚的制备 卤代醇在碱性条件下可发生分子内Williamson反应,合成环醚。
HO X
2016年1月10日星期日
O2N Cl
EtOH NaOH
O2N
OEt
3)反应溶剂
非纳西丁中间体
醚类(Et2O,THF) ,芳烃(Toluene,C6H6),极性非质子溶剂(DMSO, DMF,HMPT)或液氨。质子溶剂可使RO-溶剂化,降低其亲核活性.
(4)应用特点 ①二苯甲醚制备
醇羟基氢原子的活性不同,进行烃化反应的条件就不同。
(Williamson 1850)
(2)反应机理
该反应为亲核取代反应,可以是单分子,也可以是双分子。 • 伯卤代烷按SN2历程,叔卤代烷按SN1历程,容易得烯烃。 仲卤代烷按SN1和SN2历程; 当烷基相同时,卤代烃活性: RI>RBr>RCl (活性) • 采用RO-、OH-试剂.溶剂:ROH、DMSO、DMF、HMPT等; SN2机理
the order of reactivity is also influenced by the nature of the leaving group: OTs~I>OMs>Br>Cl.
The preparation of diaryl ethers from phenoxides and unactivated aryl halides is not possible under the reaction conditions of the Williamson ether synthesis, but in the presence of copper metal or Cu(I)-salt catalysts, diaryl ethers are obtained (see Ullmann biaryl ether synthesis).
第二章烃化反应 - 药物合成反应

醇钠、 Na、 NaH、 NaOH、 KOH 有机碱 : 六甲基磷酰胺(HMPA)、(i-Pr )2NEt N,N-二甲基苯胺(DMA)
影响因素d 溶剂影响
过量醇: 即是溶质又是溶剂 非质子溶剂: 苯、 甲苯(Tol)、 二甲苯(xylene)、 DMF 、 DMSO 无水条件下 质子性溶剂: ROX有助于R-CH2X 解离, 但是RO-易发生溶剂化, 因此通常不用质子性溶剂
R1 R2
第一节 氧原子上 的烃化反应
一 醇的O-烃化
1 卤代烷为烃化剂 2 磺酸酯 3 环氧乙烷类作烃化剂 4 烯烃作为烃化剂 5 醇作为烃化剂 6 其它烃化剂
二 酚的O-烃化
1 烃化剂 2 多元酚的选择性烃化
三 羟基保护
2.1.1 醇的O-烃化
2.1.1.1卤代烷为烃化剂:
• 通式
O RO S OR O Ar O S OR O
O
甲酸
应 用
O NH2 C-O-CH-CH2N(C2H5)2
普鲁卡因
O n-C4H9-HN C-O-CH-CH2 N(C2H5)2
丁卡因
丁卡因药效为普鲁卡因的10倍
O HN O HN O
R1=R2=H, 巴比妥酸 R1=Et, R2=C6H5,苯巴比妥
Cl
CN C C C2H5
甲苯
回流
C2H5
OC4H9
乙胺嘧啶中间体
2.1.1.6 其它烃化剂:
CF3SO2OR -SO3R R3OBF4 用来烃化位阻醇
OH C16H33O OTs
TfOBn DMC C16H33O
OBn OTs 96%
Tetrahedron Lett. 1988, 29, 4393
重氮甲烷是一种重要的甲基化试剂, 主要用于酚、羧酸、烯醇的羟基引入甲基 Ar—OH + CH2N2 R—COOH + CH2N2 ArOMe + N2 RCO2Me + N2 R—C(OMe)=CHCO2Et + N2
影响因素d 溶剂影响
过量醇: 即是溶质又是溶剂 非质子溶剂: 苯、 甲苯(Tol)、 二甲苯(xylene)、 DMF 、 DMSO 无水条件下 质子性溶剂: ROX有助于R-CH2X 解离, 但是RO-易发生溶剂化, 因此通常不用质子性溶剂
R1 R2
第一节 氧原子上 的烃化反应
一 醇的O-烃化
1 卤代烷为烃化剂 2 磺酸酯 3 环氧乙烷类作烃化剂 4 烯烃作为烃化剂 5 醇作为烃化剂 6 其它烃化剂
二 酚的O-烃化
1 烃化剂 2 多元酚的选择性烃化
三 羟基保护
2.1.1 醇的O-烃化
2.1.1.1卤代烷为烃化剂:
• 通式
O RO S OR O Ar O S OR O
O
甲酸
应 用
O NH2 C-O-CH-CH2N(C2H5)2
普鲁卡因
O n-C4H9-HN C-O-CH-CH2 N(C2H5)2
丁卡因
丁卡因药效为普鲁卡因的10倍
O HN O HN O
R1=R2=H, 巴比妥酸 R1=Et, R2=C6H5,苯巴比妥
Cl
CN C C C2H5
甲苯
回流
C2H5
OC4H9
乙胺嘧啶中间体
2.1.1.6 其它烃化剂:
CF3SO2OR -SO3R R3OBF4 用来烃化位阻醇
OH C16H33O OTs
TfOBn DMC C16H33O
OBn OTs 96%
Tetrahedron Lett. 1988, 29, 4393
重氮甲烷是一种重要的甲基化试剂, 主要用于酚、羧酸、烯醇的羟基引入甲基 Ar—OH + CH2N2 R—COOH + CH2N2 ArOMe + N2 RCO2Me + N2 R—C(OMe)=CHCO2Et + N2
颜范勇-第二章烃化反应-全

2017/7/11
4、分类
1)按形成键的形式分类
被 烃 化 物 +烃 化 剂
C-OH(醇或酚羟基) 变为-OR醚
C-N(NH3) 变为伯、仲、叔胺 C-C
产物
O RCH2 C OC2 H5
2017/7/11
其它如在硫原子、金属元素上的烃化
2)按反应历程分类 亲核反应(较多),如氧、氮以及活性 亚甲基、炔烃上的碳等原子的烃化
H O
O
X
X
O
+X
2017/7/11
副反应 : a.消除反应
CH3 CH3 C CH3 Cl CH3 CH3 H+ C CH3 CH2 C CH3 CH3
2017/7/11
选用哪组原料合适
H3C 欲制备: H3C C H3C A: (CH3)3CX+C2H5OH A O B B: C2H5
(CH3)3COH + C2H5X
2017/7/11
OEt
NaOH
NO2
当卤代烃为叔卤代烃时,不能在强碱下反 应,易消除HX,可在中性或弱碱性下反应。
CH3 CH3 C CH3
C2H5-ph (CH3)3CBr + C2H5ONa 90% CH2
B
CH2 CH3-C CH3
C CH3 CH3 + 10%产 物
2017/7/11
Me2SO4/NaOH 回流,2h
MeO MeO (8)
Me2SO4/NaOH
CHO (85%)
(86%) MeO (9)
HO
2017/7/11
75~80
,1h
注意事项
硫酸酯只用于甲基化和乙基化,且只有R基 参与反应,磺酸酯应用广,但磺酸为强酸, 三废污染 pH=8~9,遇到酸或碱会分解, 滴加方式加料
4、分类
1)按形成键的形式分类
被 烃 化 物 +烃 化 剂
C-OH(醇或酚羟基) 变为-OR醚
C-N(NH3) 变为伯、仲、叔胺 C-C
产物
O RCH2 C OC2 H5
2017/7/11
其它如在硫原子、金属元素上的烃化
2)按反应历程分类 亲核反应(较多),如氧、氮以及活性 亚甲基、炔烃上的碳等原子的烃化
H O
O
X
X
O
+X
2017/7/11
副反应 : a.消除反应
CH3 CH3 C CH3 Cl CH3 CH3 H+ C CH3 CH2 C CH3 CH3
2017/7/11
选用哪组原料合适
H3C 欲制备: H3C C H3C A: (CH3)3CX+C2H5OH A O B B: C2H5
(CH3)3COH + C2H5X
2017/7/11
OEt
NaOH
NO2
当卤代烃为叔卤代烃时,不能在强碱下反 应,易消除HX,可在中性或弱碱性下反应。
CH3 CH3 C CH3
C2H5-ph (CH3)3CBr + C2H5ONa 90% CH2
B
CH2 CH3-C CH3
C CH3 CH3 + 10%产 物
2017/7/11
Me2SO4/NaOH 回流,2h
MeO MeO (8)
Me2SO4/NaOH
CHO (85%)
(86%) MeO (9)
HO
2017/7/11
75~80
,1h
注意事项
硫酸酯只用于甲基化和乙基化,且只有R基 参与反应,磺酸酯应用广,但磺酸为强酸, 三废污染 pH=8~9,遇到酸或碱会分解, 滴加方式加料
第二章 烃化反应(药物合成)

N CHMe H2/Raney Ni
NHCH2Me (88%)
• (6)芳胺的N-芳烃化
U11mann反应
COOH + Cl CuSO4/NaOH,PH=5-6
• 6. 碱性越弱越易离去,卤素、磺酸酯、硫酸酯 都是好的离去基团; • 7. 离去能力越强越利于SN1; • 8. 极性溶剂利于SN1,不利于SN2; • 9. 亲核性越强越利于SN2;亲核性-碱性 • (1)同周期的元素形成的负离子,碱性和亲 核性一致,随电负性增大而减, NH2->HO->F• (2)亲核原子相同时,碱性和亲核性一致, RO->HO->ArO->RCOO->ROH>H2O; • (3)同一族中,碱性随体积增加而减小,亲 核性则相反;
MeONa + ClCH2COOMe MeOH/Ph=8~9 64~66 C,3h
0
MeOCH2COOMe + NaCl
(88.4%)
• • • • •
(3)影响因素 ①卤代烃的结构 如果活性不够,可加入适当的KI; 芳香卤化物-邻对位有吸电子基团存在; ②反应溶剂
• 醚类、极性非质子溶剂
Cl EtOH / NaOH
Raney Ni
PhCHO + NH3
PhCH2NH2 + (PhCH2)2NH (90%) ( 7%)
• (6)重排制胺 Curtius Rearrangement
Example
Schmidt Rearrangement
Lossen rearrangement.
ห้องสมุดไป่ตู้
Example
二、亲电取代反应
• Friedel-Crafts反应
药物合成反应_第二章_烃化反应

3
由右侧实例可知,即便是胺的位
H3C O H3C CH3 HN CH3 CH3 H3C H3C H N H3C H3C CH3 CH3 O CH2 73% N CH3 21% 0.02% O
CH3 CH3 H3C H3C NH CH3
阻较大,但只要醛位阻小(酮几 乎可以直接淘汰,而醛最好也是 甲醛!),反应也能顺利迚行。
反应机理:炔钠中的炔基负离子迚攻带正电的碳核。
1
掌握烃化反应总的知识结构 熟悉典型大类反应的机理
熟悉各反应的条件、影响因素、主产物
2
3
卤代烷烃化 磺酸/硫酸酯烃化
氧原子的烃化
环氧乙烷烃化
重氮甲烷烃化 DCC缩合 氨/胺直接烃化 伯胺制备三法 还原烃化
烃化反应
氮原子的烃化
兴斯堡反应法 芳胺的原甲酸酯烃化 芳胺的芳烃化
芳烃的傅克反应
碳原子的烃化
O
O
O
O
1
反应条件
芳基磺酸酯及类似的硫酸二某酯应用也比较广,前者可以引入较大的烷基;
SO3R O R O S O (对甲)苯磺酸酯 很好的离去基团 H3C SO3R
(CH3)2SO4
(C2H5)2SO4
R O O S O R O 硫酸二某酯
TsO
2
反应条件
环氧乙烷可以在氧原子上引入羟乙基,所有又称羟乙基化反应; 环氧乙烷衍生物在酸和碱性条件下,开环的机理不同:Βιβλιοθήκη Delepine德尔宾反应:
环六亚甲基四胺(乌洛托品)提供氮原子
N RX N N N N N N R X N HCl/EtOH H2N R
O
例如
O2N
(CH2)6N4 C6H5Cl 33~38C,1h Br O2N
第二章 烃化反应
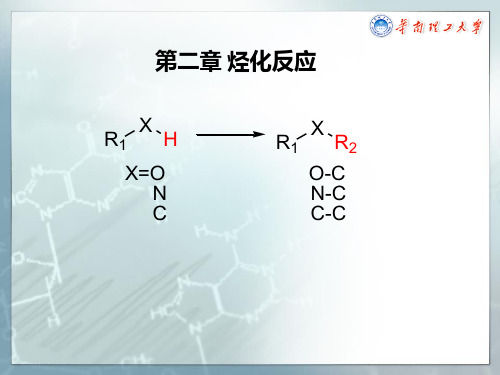
• 吸电子基团(多卤代、硝基、、酯基、羧基、腈基)取代
的芳烃,不发生付-克反应,如硝基苯)可作为反应溶剂,
但连有供电子基后可发生F-C反应
(二)芳烃结构
OCH3 可被烃化
NO2
α β (α位优先烃化)
OH
81
6 54
AlCl3 80oC
BF3 25oC
3、催化剂
a 活 性 顺 序 AlCl3>FeCl3>SnCl4>BF3>ZnCl2
二、羰基化合物的α位C-烃化
FG1 O
BaG2
R3
(一)活性亚甲基化合物的C-烃化
X H2C
Y
(X, Y均为吸电子基)
常见吸电子基团的强弱: -NO2>-COR>-SO2R>-CN>-COOR>-SOR>-Ph
CN
X H2C Y
X, Y为 吸 电 子 基 O
吸 电 子 能 力 : -NO2 > -CR> RSO2-> - CN> -COOR> Ph
➢溶剂的选择(以不足以烯醇盐或碱发生质子化为准)
•高活性亚甲基化合物:醇钠-醇 •低活性亚甲基化合物: NaH或金属钠为碱,苯、甲苯、二甲苯等油溶剂为溶剂 甲醇钠/甲醇/石油醚(先蒸出甲醇再烃化)
• 有供电基取代的芳烃>无供电基取代的芳烃 引入一个烃基后更易发生烃化反应,但要考虑立体位阻
傅位-产克物反) 应时间不宜过长,AlCl3用量不H3宜C 过C大H(3 多取代、间 CH3Cl/AlCl3
0℃
CH3
△ 重排
CH3Cl/AlCl3
100℃
CH3
H3C
CH3
取代基为-OH, -OR, -NH2, O,N易与催化剂络合,催化活性 降低,取代基供电子能力降低/丧失。
药物合成反应-3烃化反应

抗过敏药
酚活性对反应的影响
《药物合成反应》
酚 酚酸性比醇强 在碱性条件下,容易得到高收率的酚醚。 操作时,可用NaOH形成酚氧负离子,或用碳酸钠(钾 )做去酸剂。例:
CONH2
ArOH
RX
OH
CONH2
EtBr/NaOH 80~100
Ar
O R
O Na
X
H2O
OH
(75%)
OEt
Cl(CH2)3N(CH3)2/Xyl
RNSO2CF3
LiAlH4
RR'NH
RNH2 (EtO)2POH/CCl RNHPO(OEt)2 R'X/NaOH RNPO(OEt)2 HCl
RR'NH
3.叔胺的制备
《药物合成反应》
卤代烃与仲胺反应
CH2NHCH3
HC
是制备叔胺常用的方法
CH2NCH3
CCH2Cl
CH2C CH
Cl CHOCH2CH2 Cl
三、环氧乙烷类为烃化剂
《药物合成反应》
环氧乙烷可以作为烃化剂与醇反应,在氧原子于上引入羟 乙基,亦称羟乙基化反应。此反应一般用酸或碱催化,反 应条件温和,速度快。酸催化属单分子亲核取代反应,而 碱催化则属双分子亲核取代反应。
2.副反应及其利用
《药物合成反应》
副反应 易与环氧乙烷继续反应生成聚醚衍生物 副反应的避免办法 使用大大过量的醇 副反应的应用 制备相应的聚醚类产物。
O CH2OCOC17H33
O
O
/KOH /H2 O
CH2OCOC17H33 O(CH2CH2O)p H
HO OH
OH (75.5%)
H(OCH2CH2)mO (13 )
第二章 烃化反应

第二章
烃化反应
(Hydrocarbylation Reaction, Alkylation)
烃化反应
1.在有机分子中的碳、氮、氧原子上引入烃基的反应 • 碳烃化反应 • 氧烃化反应 • 氮烃化反应 2.烃基化试剂 • 卤代烃 • 磺酸酯 • 硫酸酯 • 环氧化合物
§1 氧原子上的烃化反应
§1.1 醇的O-烃化 §1.1.1 卤代烃为烃化剂 §1.1.2 芳基磺酸酯为烃化剂 §1.1.3 环氧乙烷为烃化剂 §1.2 酚的O-烃化 §1.2.1 烃化剂 §1.2.2 O-烃化与C-烃化
H2SO4
OPh C H D
OMe H2SO4 MeOH PhCHCH2OH (90%) +
OH PhCHCH2OMe (10%)
PhCH O
CH2
OMe CH3ONa PhCHCH2OH (25%) +
OH PhCHCH2OMe (75%)
与格氏试剂反应
CH2 O
1.RMgX CH 2 + 2.H / H2O
抗菌药氯霉素的一个中间体的合成
O2N
COCH 2Br
1. (CH 2)6N4 2. HCl/EtOH
O2N
COCH 2NH 3 Cl
+
-
§2.1.3 醛和酮的还原胺化反应
PhCHO
+
NH 3
H2/Raney Ni
PhCH 2NH 2 + (PhCH 2)2NH (90%) (7%)
Me NH 3 + n-Pr C=O H2/Raney Ni
§1.1.1卤代烃为烃化剂
• 醇在碱(钠、氢氧化钠、氢氧化钾等)存在下 与卤代烃反应生成醚的反应称为Williamson 醚合成,是制备混合醚的有效方法。 • 亲核取代反应存在单分子(SN1)或双分子 (SN2)两种极限机理,这取决于卤代烃的结 构。通常伯卤代烃发生双分子亲核取代反 应。
烃化反应
(Hydrocarbylation Reaction, Alkylation)
烃化反应
1.在有机分子中的碳、氮、氧原子上引入烃基的反应 • 碳烃化反应 • 氧烃化反应 • 氮烃化反应 2.烃基化试剂 • 卤代烃 • 磺酸酯 • 硫酸酯 • 环氧化合物
§1 氧原子上的烃化反应
§1.1 醇的O-烃化 §1.1.1 卤代烃为烃化剂 §1.1.2 芳基磺酸酯为烃化剂 §1.1.3 环氧乙烷为烃化剂 §1.2 酚的O-烃化 §1.2.1 烃化剂 §1.2.2 O-烃化与C-烃化
H2SO4
OPh C H D
OMe H2SO4 MeOH PhCHCH2OH (90%) +
OH PhCHCH2OMe (10%)
PhCH O
CH2
OMe CH3ONa PhCHCH2OH (25%) +
OH PhCHCH2OMe (75%)
与格氏试剂反应
CH2 O
1.RMgX CH 2 + 2.H / H2O
抗菌药氯霉素的一个中间体的合成
O2N
COCH 2Br
1. (CH 2)6N4 2. HCl/EtOH
O2N
COCH 2NH 3 Cl
+
-
§2.1.3 醛和酮的还原胺化反应
PhCHO
+
NH 3
H2/Raney Ni
PhCH 2NH 2 + (PhCH 2)2NH (90%) (7%)
Me NH 3 + n-Pr C=O H2/Raney Ni
§1.1.1卤代烃为烃化剂
• 醇在碱(钠、氢氧化钠、氢氧化钾等)存在下 与卤代烃反应生成醚的反应称为Williamson 醚合成,是制备混合醚的有效方法。 • 亲核取代反应存在单分子(SN1)或双分子 (SN2)两种极限机理,这取决于卤代烃的结 构。通常伯卤代烃发生双分子亲核取代反 应。
第二章 烃化反应

(H3C)3 CX
欲制备:
B-
(H3C)3 C+
CH3
H3C C
O
H3C A B
CH3 C CH2 CH3
C2H5
A: (CH3)3CX+C2H5OH
B: (CH3)3COH + C2H5X
一 、醇的O-烃化
1 卤代烷为烃化剂 2 磺酸酯作烃化剂 3 环氧乙烷类作烃化剂 4 烯烃作为烃化剂 5 醇作为烃化剂 6 其它烃化剂
1.卤代烃为烃化剂 (1)反应通式
ArOH RX OH Ar O R X H2O
(3)应用
① 芳香脂肪醚的制备 镇痛药邻乙氧基苯甲酰胺的合成
CONH2 OH
EtBr/NaOH 80~100
CONH2 (75%)
OEt
镇痛药苄达明的合成
O Na
N N
Cl(CH2)3N(CH3)2/Xyl 125~128 ,7h
温-80。
(m、n、p均约为20)
一 、醇的O-烃化
1 卤代烷为烃化剂 2 磺酸酯作烃化剂 3 环氧乙烷类作烃化剂 4 烯烃作为烃化剂 5 醇作为烃化剂 6 其它烃化剂
4. 烯烃为烃化剂
醇可与烯烃双键进行加成反应生成醚, 但对烯烃双键旁边没有吸电子基团存在时,反应
不易进行。 只有当双键的位有羰基、氰基、酯基、羧基等存
② 酚的O-烃化反应
由于酚的酸性比醇强,所以反应更容易 进行,需要的碱相对醇的反应也较弱。
反应通常是通过SN2机理完成
2.碳负离子的亲核取代反应
碳负离子带有负电荷,具有很强的碱性 和亲核能力,可以和卤代烃等烃化试剂 发生取代反应,延长碳链。
其中碳负离子可以是炔基负离子,格氏 试剂中的烷基负离子及活泼亚甲基在碱 作用形成次甲基负离子。
烃化

第一节 氧原子上的烃化反应
二、酚的O-烃化
由于酚的酸性比醇强,所以反应更容易进行 1. 卤代烃为烃化剂
第一节 氧原子上的烃化反应
位阻及螯合对酚O-烃化的影响
第一节 氧原子上的烃化反应
2. 硫酸二甲酯为烃化剂
第一节 氧原子上的烃化反应
3 重氮甲烷为烃化剂
第一节 氧原子上的烃化反应
第二节 氧原子上的烃化反应
一、醇的O-烃化
1.卤化烃为烃化剂 Williamson醚合成:
ROH + B
RO + R'X
ROHROR' NhomakorabeaRO
+ HB
ROR' + X
增加底物浓度提高反应速度;
第二节 氧原子上的烃化反应
(1)影响因素 醇的活性较低,加入强碱利于反应;
不能用叔卤代烷作为烷化试剂;如反应的卤代 烷活性不够可加碘化钾催化。 使用极性非质子溶剂(DMSO,DMF等)有利于 反应。
应,是制备环氧乙烷、环氧丙烷及高环醚类化合物的方法。
第一节 氧原子上的烃化反应
2、芳基磺酸酯作为烃化剂 OTs是很好的离去基,常用于引入分子量较大的 烃基。
ROH + TsCl ROTs
第一节 氧原子上的烃化反应
3、环氧乙烷为烃化剂 环氧乙烷由于环张力很大,很活泼,开环可以与 醇反应引入羟乙基。 在碱催化条件下,环氧乙烷取代少的一端与醇相 连。
第二节 氧原子上的烃化反应
(2)应用
①药物苯海拉明的合成:醇(RO-)活性不同,反应条件的选择
也不同
第二节 氧原子上的烃化反应
② 改进的Willamson反应用于醚的制备
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
仲卤代烷按SN1和SN2历程;
RI>RBr>RCl (活性)
(2) 采用RO-、OH-试剂。溶剂:ROH、DMSO、DMF、
HMPT等;
MeONa + ClCH2COOMe MeOH/Ph=8~9 64~66 C,3h
0
MeOCH2COOMe + NaCl
(88.4%)
Ph Ph CHOH + ClCH2CH2NMe2
Cl EtOH / NaOH OEt
芳环上的亲核取代
NO2
NO2
OMe Na H2N SO2 N
N Cl
N
MeONa MeOH
OMe OMe Na H2N SO2 N
N
N
OMe HOAc H2N SO2 NH
OMe
N
(周效磺胺)
N
2
环氧乙烷为烃化剂
碱催化机理:
δ
O
δ
R CH CH2
OR'
R CH CH2 OR' O
O H N O N H
Me
N MeO N
N O Me
Br
Br
O HN O N H Br
(90%)
O MeO O HO Py/HCl 180 0C,2h HO HO
O O
OMe OH OH
OH
缺点:温度高时结构发生改变
Me OMe O
C
O OMe BCl3 Cl MeO
BCl2 O OMe COOMe
.
NaOH/XYL HCl △
Ph Ph CHOCH2CH2NMe2
Ph吸电子作用,使O更稳定
(3) 用ROTl作试剂(改进的 williamson合成法)
EtOT ROH C6H6
COOEt H C OH HO C H COOEt EtOTl COOEt H C OTl TlO C H COOEt R'I/CH3CN 60 C,20h
+ O C
+O C
CH3 C2H5
C2H5 CHNHCH C2H5
+ HCHO
73%
H2N C O
NH
HCHO/MeOH/H2/Ni r.t.4h
H2N C O
N CH3
(88%)
二
1
芳香胺及杂环胺的N-烃化
N-烷基及N,N-双烷基芳香胺的制备 (1) 苯胺与卤代烃反应
(2) 芳胺与脂肪伯醇反应
(3) 酰胺法 (4) 伯胺与羰基化合物反应
R'OH
R CH CH2 OR' + R'O OH
酸催化机理:
R
H
O H C C H
H
+
R
H
H O H C C H
Nu
R
H O C C
H
H Nu
H
a
R CH CH2 OH Nu
R
Nu
H O C H Nu C
H
b
R CH CH2Nu OH
H
H2SO4
△ .5h
Ph CH CH2 + MeOH O CH3ONa △ .6h
0
ROT
R'X CH3CN
ROR'
COOEt H C OR' R'O C H COOEt (>79%)
R'=Me- , n-C6H13-
(4)用NaH作试剂,可得立体 专一性的甲醚
CH3 OH CH3I / NaH / THF 500C,1h CH3 OCH3 (100%)
OH CH3
CH3 OCH3
2
芳胺的N-芳烃化
U11mann反应
Cl
NH2 + Cl
COOH CuSO4/NaOH,PH=5-6
Cl
COOH NH (56%)
△
氯灭酸
3
O 7 1 65 NH HN 2 4 8 O N3 N 9 H (A)
杂环胺N-烃化
Me2SO4 / NaOH,PH=9-10 350C Me N O O Me2SO4 / NaOH,PH=4-8 HN O N
二
R C
炔烃的烃化
CH NaNH2 R C CNa R'X R C C R'
1
RI>RBr>RCl>RF 中等分子量的卤化物好,仲、叔及β 位
有侧链时易消除(强碱作用下)。
X
不易反应
2 需要无水操作,否则生成醇及醚等. 例如:
Br(CH2)5Br HC CNa HC C(CH2)5C CH (84%)
第二章
烃化反应
有机物分子中氢原子(包括-OH、-NH2、 -SH、-C上的氢原子)被烃基取代的反应
第一节 氧原子上的烃化反应
一 醇的O—烃化 1 卤代烃为烃化剂
ROH + B R' X + OR RO + HB R' OR + X (Williamson 1850)
(1) 伯卤代烷按SN2历程,叔卤代烷按SN1历程, 得烯烃。
MeO
COOMe
BCl2 O OMe
O
OH COOMe COOMe MeO (87%)
MeO
COOMe
缺点:只脱COOMe邻位-OMe
2
OH N HO Br N
叔丁醚保护基
Cl POCl3/PCl5 Cl Br N N t—BuOH/NaH 83% t—BuO Br N OBu—t N
OBu—t n—BuLi t—BuO Li N N
(1) 苯胺与卤代烃反应
NH2 + MeI NHMe MeI NMe2
Et NH2 CH(OEt)3/H2SO4 1200C, 80~86% Cl Cl N
CHO NHEt
65~79% Cl
(2) 芳胺与脂肪伯醇反应
NH2 MeOH / H2 / SiO2—Al2O3 1800C,压力,3h NMe2 (98%)
(2) H2/PdCl2 80% HO
O
RO
O
N
O
HO
OH
抗肿瘤药阿糖胞苷
4
ROH + O
四氢吡喃醚保护基
δ δ
H+ O OR
(相当于对双键加成) 对碱、格氏试剂、烷基锂、氢化铝锂、烃
化、酰化稳定;用酸处理,可脱除。
O OH O H+ O cat: BF3 Et2O TsOH O O Py HOTs Y% 67 71 100
第二节
一
氮原子上的烃化反应
氨及脂肪胺的N-烃化 1 伯胺(RCH2NH2)的制备
(1)
CH3
CH COOH Br
NH3 (70当量)
CH3
CHCOOH NH2
(70%)
NH3大过量
(2) Gabriel合成法
O NH O
O NH2 NH2 O HCl / H2O COOH COOH NH NH + R NH2
试剂:R-X、Me2SO4、CH2N2
CONH2
EtBr / NaOH 80-100 0C
CONH2 (75%)
OH
OEt
镇痛药
CH3O HO CHO Me2SO4/NaOH CH3O CH3O CHO
降压药甲基多巴中间体
OMe CH2N2(过量 )
OH
OMe
OH
COOMe OMe
COOH
2mol CH2N2
0
CH3CH(CH2)3 Br
N O
MeO
CH3CH(CH2)3NH2 NH NH2NH2 H2O (80%) NaOH,(30%) TOL MeO N
△ ,6h
(3)环六亚甲基四胺(NH3+HCHO)法
N RX N N N N N N RX N HCl/EtOH RNH2
乌洛托品
(4) C数>5的醛与NH3与在Raney镍存在下还 原烃化法
O KOH / EtOH NK O RX / DMF
O N O R
(多采用肼解)
+ R NH2
(条件苛刻)
O NH + Br (CH2)3CHCH3 Br O
NH2 N + MeO Na2CO3 140-150 0C,8h,93% CH3CH(CH2)3 NH N O N O
O Na2CO3 145-150 C,2h,(75%)
PhCHO + NH3 Raney Ni PhCH2NH2 + (PhCH2)2NH (90%) ( 7%)
2
仲胺的制备
(1) 由仲卤代烃制备
CH3 CH3 CH Br CH3NH2 110 C,18h
0
CH3 NH CH (78%)
CH3 CH3 + CH3 N CH
CH3 CH3
2
(2)
RNH2
HN
O NH HO
O
O (A) 40%
OHOH (B) 27%
HN
NH O
O
12%
76%
3
O
RO RO RO Cl +
苄基醚保护基
OMe N OMe N N CH2Cl2 r.t. 3day RO O
N
OMe (1) NH3/MeOH 1000C,68%
O
RO
NH2 N O RO RO
N
RO
NH2 N
Hinsberg反应
R'X RNHSO2Ar NaOH R' RNSO2Ar 酸or碱 H 2O R R' NH
