每周一测试题君之每日一题君高考化学二轮复习 1
2018年4月29日 每周一测-试题君之每日一题君2018年高考语文三轮复习 含解析 精品

2018年4月29日每周一测一、阅读下面的文言文,完成文后题目。
祭义伶文【明】张岱崇祯辛未,义伶夏汝开死,葬于越之敬亭山。
明年寒食,其旧主张长公属其同侪王畹生、李生持酒一瓯,割羽牲一,至其陇,招其魂而祭之,并招其同葬之父凤川同食,谕之曰:夏汝开,汝尚能辨余说话否耶?汝在越四年,汝以余为可倚,故携其父母、幼弟、幼妹共五人来。
半年而父死,汝来泣,余典衣一袭以葬汝父。
又一年,余从山东归,汝病剧,卧外厢不得见,阅七日而汝又死。
汝苏人,父若子,不一年而皆死于兹土,皆我殓之,我葬之,亦奇矣,亦参矣!汝为人跋扈而戆直,今死后,忘其为跋扈,而仅存其戆直。
余安得不思之,不惜之?汝未死前,以弱妹质余四十金,汝死后,余念汝,旧所逋俱不问,仍备粮糈,买舟航,送汝母与汝弟若妹归故乡,使汝妹适良人,汝知耶,不知耶?汝母临别,言汝妹得所,当来收汝父子骸骨。
今竟杳然,何耶?余忆天下有无心之言,遂为奇谶。
余四年前,纠集众优,选其尤者十人,各制小词。
夏汝开曰:“羁人寒起,秋坟鬼语,阴壑鸣泉,孤舟泣嫠。
重重土绣声难发,钟出峡惊雷触石。
石初裂,声崩决,狂风送怒涛,千层万叠,直到樯颠柁折方才歇。
”见者可谓酷肖。
今试读之,语语皆成谶矣,异哉!今汝同侪十人,逃者逃,叛者叛,强半不在。
汝不幸而早死,亦幸而早死,反使汝为始终如一之人,岂天玉成汝为好人耶?汝生前傅粉登场,弩眼张舌,喜笑鬼诨,观者绝倒,听者喷饭,无不交口赞夏汝开妙者,绮席华筵,至不得不以为乐。
死之日,市人行道,儿童妇女无不叹惜,可谓荣矣。
吾想越中多有名公巨卿,不死则人祈其速死,既死则人庆其已死,更有奄奄如泉下、未死常若其已死、既死反若其不死者,比比矣。
夏汝开未死,越之人喜之赞之;既死,越之人叹之惜之,又有旧主且思之祭之。
汝亦可以瞑目于地下矣。
汝其收泪开怀,招若父同饮酒食肉,颓然醉焉。
(有删改) 1.对下列句子中画线词的解释,不正确的一项是()A.其旧主张长公属其同侪侪:同辈、同类的人B.阅七日而汝又死阅:经历C.旧所逋俱不问逋:逃亡D.使汝妹适良人适:女子出嫁2.下列对原文有关内容的概括和分析,不正确的一项是()A.张岱称夏汝开为“义伶”,可见张岱对伶人夏汝开评价很高,这与他人惯常轻视伶人的态度明显不同。
铝与氢氧化钠溶液的反应-学易试题君之每日一题君2019学年上学期高一化学人教版(课堂同步系列一)

1 10月11日
铝与氢氧化钠溶液的反应
高考频度:★★★★☆
难易程度:★★★☆☆
典例在线
等质量的两份铝分别与足量稀硫酸和足量NaOH 溶液反应,若消耗的两溶液的体积相等,则两溶液的物质的量浓度之比为
A .3∶2
B .2∶3
C .1∶1
D .1∶2
【答案】A
解题必备
铝与氢氧化钠溶液的反应
1.铝片与盐酸和氧氧化钠溶液反应的对比 实验操作 实验现象
反应的化学方程式 试管中有气泡冒出,铝片逐渐溶解,且刚
开始反应较慢,后来渐渐加快。
点燃的木
条放在试管口时气体燃烧
2Al+6HCl===2AlCl 3+3H 2↑
试管中有气泡冒出,铝片逐渐溶解,且刚
开始反应较慢,后来渐渐加快。
点燃的木
条放在试管口时气体燃烧 2Al+2NaOH+2H 2O===2NaAlO 2+3H 2↑。
同位素的相关判断-学易试题君之每日一题君2018学年下学期高一化学人教版(课堂同步系列一)

13月6日同位素的相关判断高考频度:★★★☆☆难易程度:★★☆☆☆典例在线我国科学家成功地研制出长期依赖进口、价格昂贵的物质1882O ,下列说法正确的是A .它与1682O 的物理性质完全相同B .它是O 3的一种同素异形体C .1882O 与1682O 互为同位素D .1 mol 1882O 分子中含有20 mol 电子 【答案】B【解析】A .物质1882O 、1682O由于原子的质量不同,在相同的条件下它们的密度也不同,故二者的物理性质不完全相同,错误;B .无论是哪种同位素原子形成的氧气都是氧元素的单质,与O 3的存在形式不同,二者是同素异形体,正确;C .1882O 与1682O 形成的原子互为同位素,它们是分子,不是原子,不能互称同位素,错误;D .1 mol 1882O 分子中含有的电子的物质的量是16 mol ,错误。
学科&网解题必备一、核素和同位素1.核素具有一定数目质子和一定数目中子的一种原子称为核素。
氕、氘、氚这三种氢原子是氢元素的三种中子数不同的原子:11H (H)、21H (D)、31H (T),它们质子数相同(1个),核外电子数相同(1个),核内中子数不同。
11H (H)核内无中子,21H (D)核内有1个中子,31H (T)核内有2个中子。
11H 、21H 、31H 核内质子数相同,所以它们属于同一种元素。
(1)每一种核素都是一种原子,不同的核素是不同的原子。
由于许多元素有多种原子,所以原子种数远远大于元素种数。
(2)在天然元素中,有许多元素有多种核素,也有部分元素只有一种核素。
影响溶液导电能力的因素-学易试题君之每日一题君2019学年上学期高二化学人教版(课堂同步系列一)

1
高考频度:★★★☆☆ 难易程度:★★☆☆☆
下列溶液中导电性最强的是
A .1 L 0.1 mol·L -1醋酸
B .0.1 L 0.1 mol·L -
1 H 2SO 4溶液 C .0.5 L 0.1 mol·L
-1盐酸 D .2 L 0.1 mol·L -1 H 2SO 3溶液
【参考答案】
B
影响溶液导电能力的因素
溶液的导电能力与溶液中离子的浓度和离子所带电荷数有关:溶液中离子的浓度越大,离子所带电荷数越多,溶液的导电能力越强。
注意:强电解质溶液的导电能力不一定强,弱电解质溶液的导电能力不一定弱。
1.某100 mL 溶液中含H 2SO 4 0.50 mol ,加入下列物质,溶液导电性增强的是
A .0.50 mol K 2SO 4
B .100 mL 水
C .0.50 mol 酒精
D .0.50 mol BaCO
3
2.在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是。
2024届高三化学一轮复习+化学每日一题
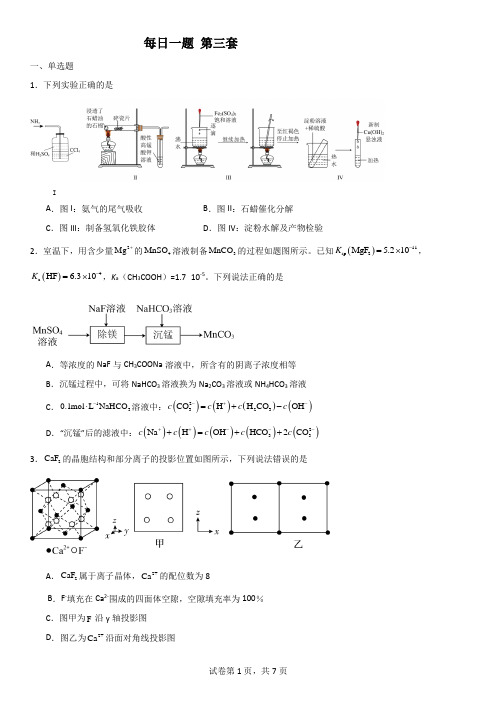
每日一题 第三套一、单选题1.下列实验正确的是IA .图I :氨气的尾气吸收B .图II :石蜡催化分解C .图III :制备氢氧化铁胶体D .图IV :淀粉水解及产物检验2.室温下,用含少量2Mg +的4MnSO 溶液制备3MnCO 的过程如题图所示。
已知()11sp 2MgF 5.210K -=⨯,()4a HF 6.310K -=⨯,K a (CH 3COOH )=1.7×10-5。
下列说法正确的是A .等浓度的NaF 与CH 3COONa 溶液中,所含有的阴离子浓度相等B .沉锰过程中,可将NaHCO 3溶液换为Na 2CO 3溶液或NH 4HCO 3溶液C .130.1mol L NaHCO -⋅溶液中:()()()()2323CO H H CO OH c c c c -+-=+-D .“沉锰”后的滤液中:()()()()()233Na H OH HCO 2CO c c c c c ++---+=++3.2CaF 的晶胞结构和部分离子的投影位置如图所示,下列说法错误的是A .2CaF 属于离子晶体,2+Ca 的配位数为8B .F -填充在Ca 2-围成的四面体空隙,空隙填充率为100%C .图甲为-F 沿y 轴投影图D .图乙为2+Ca 沿面对角线投影图4.已知Ph代表苯基,Me代表甲基,环戊二烯阴离子()中有6个π电子,是很好的三齿配体,下列说法正确的是A.反应前后钒元素的化合价未发生变化B.反应前后钒元素的配位数未发生变化C.生成物中氮氮三键的键长大于氮气的键长D.中所有原子一定共平面5.根据实验目的、操作及现象,得出的结论都正确的是选项实验目的操作及现象结论A 比较CH3COOH、HClO酸性强弱用pH试纸测定等浓度的CH3COONa溶液和NaClO溶液的pH,NaClO溶液pH大于CH3COONa溶液酸性:CH3COOH>HClOB 测定某有机物是否含有氯元素将某有机物与NaOH醇溶液共热,充分反应后,向溶液中先加入3HNO,再加入再加入3AgNO,未见白色沉淀该有机物不含氯元素C 比较Ksp大小在0.1mol/LZnSO4溶液中滴加少量等浓度的K2S溶液,再加入少量等浓度的CuSO4溶液先产生白色沉淀,产生黑色沉淀K sp(ZnS)>K sp(CuS)D测定草酸是否为二元弱酸以酚酞为指示剂,用0.1mol/LNaOH溶液滴定0.1mol/L草酸溶液溶液由无色变浅红色,且30s内不恢复原色;V(NaOH)=2V(草酸)草酸为二元弱酸A.A B.B C.C D.D6.钴酸锂电池结构稳定,容量比高。
2021年高三下学期第二次周测化学试题含答案

2021年高三下学期第二次周测化学试题 含答案本试巻共12页,共36小题,满分300分。
考试用时150分钟。
第一部分选择题(共118分)一、单项选择题:本大题共16小题,每小题4分,共64分。
在每小题给出的四个选项 9. 设6为阿伏伽德罗常数的值,下列说法正确的是(原子量:C12 H1)A. 2.24L N02含有氣原子数为0・2”B. 常温帘压下,C2H4和0缶组成的28g 混合气体中含氢原子4〃C. 1 molCzHie 分子中含有极性键为7n AD. pH=13的NaOH 溶液中含有的OH _0.110. 下列有关海水综合利用的说法不正确是• • •A.可用蒸馅或离子交换等方法淡化海水B.海水提漠只涉及物理变化C.利用海水可以制取金属MgD.开发海洋资源不能以牺牲环境为代价□・关于下列各图的说法,正确的是A. ①中阴极处能产生使湿润淀粉KI 试纸变蓝的气体B. ②中待镀铁制品应与电源正极相连C. ③中电子由b 极流向a 极D. ④中的离子交换膜可以避免生成的CL 与NaOH 溶液反应12.室温时,0.1 mol ・L 的HA 溶液的pH=3,向该溶液中逐滴加入NaOH,在滴加过程 中,有关叙述正确的是A. 原 HA 溶液中,c(H*)=c(oH-)+c(A")B. 当滴入少量的NaOH,促进了 HA 的电离,溶液的pH 降低C. 当恰好完全中和时,溶液呈中性D. 当NaOH 溶液过量时,可能出现:c(A —)>c(Na°c(OH-)>c (屮)中只有一个选项符合题目要求,选对的得4分, 7. 下列说法正确的是A.水晶、玻璃、水泥都属于硅酸盐 C. 8. A. C.选错或不答的得0分。
铝盐、活性碳、険都常用作净水剂 下列离子能在溶液中大量共存的是 Na\ NH 4\ CO 32"^ Br_ Al 3*. Ca 2\ HCO3-、SO?-B. D. 乙烯、苯、甲苯都能使高猛酸钾溶液褪色 SO 2> H2O2. Os 都可大就用作食品的漂白剂B ・ Fe 2\ H\ CIO x Cl D. Fe 3\ Cu 2\ NO 厂、OH -二.双项选择题:本大题共9小题,每小题6分,共54分。
序言类文言文阅读(二)-学易试题君之每日一题君2018年高考语文二轮复习

2018年2月15日序言类文言文阅读(二)高考频度:★★★★☆┇难易程度:★★★☆☆【2014年高考浙江卷】阅读下面的文言文,完成文后各题。
欧阳行周文集序(唐)李贻孙欧阳君生于闽之里。
幼为儿孩时,即不与众童亲狎,行止多自处。
年十许岁,里中无爱者。
每见河滨山畔有片景可采,心独娱之,常执卷一编,忘归于其间。
逮风月清晖,或暮而尚留,窅①不能释,不自知所由,盖其性所多.也。
未甚识文字,随人而.问章句,忽有一言契于心,移日自得,长吟高啸,不知其所止也。
父母不识其志,每尝谓里人曰:“此男子未知其指何如,要恐不为汩没②之饥氓也。
未知为吉凶邪?”乡人有览事多而熟于闻见者.,皆贺之曰:“此若家之宝也,奈何虑之过欤!”自此遂日日知书,伏圣人之教,慕恺悌之化,达君臣父子之节,忠孝之际,唯恐不及。
操笔属词,其言秀而多思,率人所未言者,君道之容易,由是振.发于乡里之间。
建中、贞元时,文词崛兴,遂大振耀,欧③闽之乡不知有他人也。
会故相常衮来为福之观察使,有文章高名,又性颇嗜诱进后生,推拔于寒素中,唯恐不及。
至之日,比君为芝英。
每有一作,屡加赏进。
游娱燕飨,必召同席。
君加以谦德动不逾节常公之知日又加深矣君之声渐腾于江淮且达于京师矣时人谓常公能识真。
寻而陆相贽知贡举,搜罗天下文章,得士之盛,前无伦比,故君名在榜中。
常与君同道而相上下者,有韩侍郎愈、李校书观,洎君并数百岁杰出,人到于今伏之。
君之文新无所袭,才未尝困。
精于理,故言多周详;切于情,故叙事重复:宜其司.当代文柄,以变风雅。
一命而卒,天其绝邪!君于.贻孙言旧故之分,于外氏为一家。
故其属文之内名为予伯舅所著者,有《南阳孝子传》,有《韩城县尉厅壁记》,有《与郑居方书》,皆可征.于集。
故予冲幼之岁,即拜君于外家之门。
大和中,予为福建团练副使日,其子价自南安抵福州,进君之旧文共十编,首尾凡若干首,泣拜请序。
予诺其命矣,而词竟未就。
价微有文,又早死。
大中六年,予又为观察使,令访其裔,因获其孙曰澥。
2018年3月25日 每周一测-试题君之每日一题君2018年高考化学二轮复习 含解析 精品

3月25日 每周一测高考频度:★★★★★ 难易程度:★★★☆☆1.由下列实验及现象不能推出相应结论的是2.用如图装置来分离CO 2和CO 混合气体并干燥,图中a 、c 、d 为止水夹,b 为分液漏斗活塞,通过Y 形管和止水夹分别接两个球胆,现装置内空气已排尽,为使实验成功,甲、乙、丙分别盛放的试剂为3.下列实验探究设计和实验结论均正确的是A .已知NH 4F 溶液呈酸性。
现取0.1 mol·L -1的AlCl 3溶液10 mL ,滴加过量10%NH 4F 溶液,产生沉淀,取沉淀分别与过量浓盐酸、烧碱溶液、氨水反应,只有与氨水反应生成的沉淀不溶解,说明生成的是Al(OH)3沉淀B .取0.1 mol·L -1 KI 溶液5 mL ,滴加1 mol·L -1 FeCl 3溶液1 mL ,充分反应后滴加CCl 4 3 mL ,振荡、静置,CCl 4层呈紫色;然后取上层清液,向其中滴加KSCN 溶液,观察到溶液变成血红色。
实验证明Fe 3+与I -的反应是可逆反应C .已知,H 2O 2具有弱酸性,也具有强氧化性和漂白作用。
要证明H 2O 2使红色的酚酞溶液褪色的原因,只需要在滴加H2O2已经褪色的“红色的酚酞溶液”中继续滴加烧碱溶液或酚酞试液,若重现红色,则是由于H2O2的酸性作用,若不能变红色,则是其氧化漂白作用D.取50 mL浓度为0.1 mol/L AgNO3溶液置于一只洁净烧杯中,称0.2 g铜粉加入烧杯中,用玻璃棒不断搅拌,充分反应5 min后静置,并取上层清液1.0 mL于小试管中,然后滴加1.0 mol/L KBr溶液,观察到有淡黄色沉淀析出。
说明AgNO3与Cu的反应是可逆反应4.碱式碳酸镍[Ni x(OH)y(CO3)z·n H2O]是一种绿色粉末晶体,常用作催化剂和陶瓷着色剂,300℃以上时分解生成3种氧化物。
为确定其组成,某同学在实验室中进行了有关的实验探究。
2024_2025学年高中化学期末复习备考每日一题每周一测3含解析新人教版选修4

每周一测高考频度:★★★★☆难易程度:★★★☆☆1.下列说法正确的是A.催化剂是影响化学反应速率的本质因素B.当反应体系容积不变时,减小反应物的量确定能降低反应速率C.可逆反应达到反应限度时,化学反应速率为0D.化学反应速率可用单位时间内反应物的浓度变更量来表示2.将NO2装入带有活塞的密闭容器中,当反应2NO2(g)N2O4(g)达到平衡后,变更某个条件,下列叙述正确的是A.上升温度,气体颜色加深,则正反应为吸热反应B.渐渐压缩气体体积,平衡向正反应方向移动,混合气体的颜色变浅C.渐渐压缩气体体积,若体积减小一半,压强增大,但小于原来压强的两倍D.恒温恒容时,充入惰性气体,压强增大,平衡向正反应方向移动,混合气体的颜色变浅3.相同温度下,下列各组的反应中,前者速率确定大于后者的是A.10 mL 4 mol·L-1的NaHCO3溶液+10 mL 2 mol·L-1盐酸+20 mL水与20 mL 3 mol·L-1盐酸+10 mL水-1的NaHCO3溶液+10 mL 2 mol·LB.同品质等质量的两份Al(OH)3分别与2 mol·L-1硫酸、2 mol·L-1盐酸反应C.表面积完全相同的两块钠分别与200 mL、100 mL水反应D.0.5 mol·L-1的NaHCO3溶液分别与1 mol·L-1盐酸和0.5 mol·L-1硫酸混合4.在确定温度下,可逆反应X(g)+3Y(g) 2Z(g)达到反应限度的标记是A.Z的生成速率和X的分解速率相等B.单位时间内生成n mol X,同时生成了3n mol YC.X、Y、Z的浓度不再变更D.X、Y、Z的分子个数之比为1∶3∶25.等物质的量的X、Y气体充入一个密闭容器中,在确定条件下发生如下反应并达平衡:X(g)+Y(g)2Z(g) ΔH<0。
当变更某个条件并达到新平衡后,下列叙述正确的是A.上升温度,X的体积分数减小B.增大压强,Z的浓度不变C.保持容器体积不变,充入确定量的惰性气体,Y的浓度不变D.保持容器体积不变,充入确定量的Z,X的体积分数增大6.某化学科研小组探讨在其他条件不变时,变更某一条件对化学平衡的影响,得到如图所示变更规律(p表示压强,T表示温度,n表示物质的量):依据以上规律推断,下列结论正确的是A.反应Ⅰ:ΔH>0,p2>p1B.反应Ⅱ:ΔH<0,T1>T2C.反应Ⅲ:ΔH>0,T2<T1或ΔH<0,T2<T1D.反应Ⅳ:ΔH<0,T2>T17.已知:CO(g)+H2O(g)CO2(g)+H2(g) ΔH=-41 kJ·mol-1。
每周一测-学易试题君之每日一题君2018学年下学期高二化学人教版(期末复习) (2)

1
6月24日 每周一测
高考频度:★★★★☆ 难易程度:★★★☆☆
1.甲苯是由苯环和甲基结合而成的,甲苯能使酸性高锰酸钾溶液褪色,这是因为
A .烷烃能使酸性高锰酸钾溶液褪色
B .苯环能使酸性高锰酸钾溶液褪色
C .苯环使甲基的活性增强
D .甲基使苯环的活性增强
2.下列关于蛋白质的叙述中,不正确的是
A .向蛋白质溶液中加入饱和硫酸铵溶液,蛋白质析出,再加蒸馏水,蛋白质又会溶解
B .蛋白质溶液里的蛋白质能透过半透膜
C .误食硫酸钡不会使人中毒
D .浓硝酸溅在皮肤上使皮肤呈黄色,是由于浓硝酸和蛋白质发生了颜色反应 3.下列有关糖类的说法中,正确的是
①在糖类中有高分子化合物,也有小分子化合物
②有甜味的物质不一定是糖,糖类也不一定都有甜味
③糖类分子组成不一定都符合通式C n (H 2O)m ,符合C n (H 2O)m 的物质不一定都是糖类 ④能发生银镜反应的糖类,结构中不一定都有醛基
⑤淀粉、纤维素有相同的分子通式(C 6H 10O 5)n ,但它们不是同分异构体
⑥淀粉、纤维素都属于混合物
⑦淀粉与纤维素通式相同,蔗糖与麦芽糖分子式相同,但单糖的分子式不完全相同 A .①② B .③④ C .⑤⑥⑦ D .全部
4.烷烃A 只可能有三种一氯取代产物B 、C 、D ,C 的结构简式是
,B 和D 分别与强碱的醇溶液共热,都只能得到有机化合物E 。
以上反应及B 的进一步反应如图所示:。
每周一测-学易试题君之每日一题君2018学年下学期高二化学人教版(期中复习)

4月22日每周一测
高考频度:★★★★☆难易程度:★★★☆☆
1.研究人员最近开发出被称为第五形态的固体碳,这种新的碳结构被称作“纳米泡沫”,纳米泡沫碳与金刚石的关系是
A.同素异形体B.同位素C.同系物D.同分异构体
2.如图所示有机物具有抗肿瘤等作用,分子结构如图所示,分子中含有的含氧官能团有
A.2种B.3种C.6种D.5种
3.的正确名称是
A.2,5-二甲基-4-乙基己烷
B.2,5-二甲基-3-乙基己烷
C.3-异丙基-5-甲基己烷
D.2-甲基-4-异丙基己烷
4.下列气体的检验方法中,正确的是
A.用澄清石灰水鉴别SO2和CO2
B.用酸性高锰酸钾溶液鉴别乙烯和乙炔
C.用湿润的淀粉-KI 试纸检验Cl2
D.用湿润的蓝色石蕊试纸检验氨气
5.石油能加工成各种化工产品,对国际经济影响极大。
下图是以石油为原料的转化流程。
下列说法正确的是
1。
2021年高三化学上学期第二次周考试题新人教版

2021年高三化学上学期第二次周考试题新人教版一.选择题(25题,共50分)1.根据下列物质的化学性质,判断其应用错误的是A .酒精能使蛋白质变性,可用于杀菌消毒B .CaO 能与SO2反应,可作工业废气的脱硫剂C .明矾水解时产生具有吸附性的胶体粒子,可作漂白剂D .镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料2.下列各溶液中,一定能大量共存的是A .Fe3+、Na+、SO42-、H2O2B .C2H5OH 、MnO4-、H+ 、K+C .Pb2+、K+ 、SO42-、Cl -D .Na+、SO32- 、CH3COO-、S2-3.下列离子方程式正确的是A .由氢氧化钠溶液吸收二氧化氮:2OH -+2NO2===NO -3+NO↑+H2OB .碳酸氢钠溶液与过量澄清石灰水:2HCO -3+Ca2++2OH -===CaCO3↓+CO2-3+2H2OC .浓盐酸酸化的KMnO4溶液与H2O2反应:2MnO -4+6H ++5H2O2===2Mn2++5O2↑+8H2OD .硫酸氢钠溶液与过量氢氧化钡溶液混合:H ++SO2-4+Ba2++OH -===BaSO4↓+H2O4.已知NH4CuSO3与足量的10 mol/L 硫酸混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体 ③溶液呈现蓝色。
据此判断下列说法正确的是A .反应中硫酸作氧化剂B .NH4CuSO3中硫元素被氧化C .刺激性气味的气体是氨气D .1 mol NH4CuSO3完全反应转移0.5 mol 电子5.氧化还原反应中,水可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。
下列反应与Cl2+SO2+2H2O===H2SO4+2HCl 相比较,水的作用不相同的是A .3NO2+H2O===2HNO3+NOB .2Na2O2+2H2O===4NaOH +O2↑C .4Fe(OH)2+2H2O +O2===4Fe(OH)3D .3Fe +4H2O(g)=====高温Fe3O4+4H26.根据原子结构及元素周期律的知识,下列推断正确的是A .同主族元素含氧酸的酸性随核电荷数的增加而减弱B .核外电子排布相同的微粒化学性质也相同C .Cl ‾、S2‾、Ca2+、K+半径逐渐减小D .与得电子能力相同7.以下对粒子结构或性质的叙述正确的是A .两种微粒,若核外电子排布完全相同,则化学性质一定相同B .由单原子形成的离子,一定具有稀有气体元素原子核外电子排布C .阴离子的核外电子排布一定与上一周期稀有气体原子核外排布相同D .两原子,如果核外电子排布相同,则一定属于同一种元素8.短周期主族元素X 、Y 、Z 、W 的原子序数依次增大。
每周一测-试题君之每日一题君2019年高考化学一轮复习

高考频度:★★★★★难易程度:★★★☆☆1.用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。
下列图示对应的操作规范的是2.下列说法中正确的是A.2 mol CH4的质量和O2的摩尔质量都是32 gB.1 mol任何气体中都含有相同的原子数C.0.5 mol NaCl约含有6.02×1023个离子D.1 mol·L-1KCl溶液中含有溶质1 mol3.设N A为阿伏加德罗常数的值,下列说法正确的是A.1 mol苯含有6N A个C—H键B.常温常压下,22.4 L H2O含有3N A个原子C.1 L 0.1 mol·L−1 NaHCO3溶液中含有0.1N A个D.23 g Na与足量H2O完全反应共转移2N A个电子4.某气体的摩尔质量为M g·mol−1,N A表示阿伏加德罗常数,在一定的温度和压强下,体积为V L的该气体所含有的分子数为x。
则表示的是A.V L该气体的质量(以g为单位)B.1 L该气体的质量(以g为单位)C.1 mol该气体的体积(以L为单位)D.1 L该气体中所含的分子数5.下列有关溶液配制的说法正确的是A.在50 mL量筒中配制0.100 0 mol·L-1碳酸钠溶液B.仅用烧杯、量筒、玻璃棒就可配制100 mL 0.100 0 mol·L-1K2Cr2O7溶液C .用100 mL 容量瓶、烧杯、玻璃棒、量筒、胶头滴管和pH =1的盐酸配制100 mL pH =2的盐酸D .配制一定物质的量浓度的溶液时,定容时仰视刻度线会导致所配溶液浓度偏高 6.若20 g 密度为ρ g·mL -1的Ca(NO 3)2溶液中含有2 g Ca(NO 3)2,则溶液中NO 3-的物质的量浓度为A.400ρmol·L -1B.ρ20mol·L -1C.4150ρmol·L -1D.4125ρmol·L -1 7.下列关于氧化物的各项叙述正确的是 ①酸性氧化物不一定是非金属氧化物 ②非金属氧化物肯定是酸性氧化物 ③碱性氧化物肯定是金属氧化物 ④金属氧化物肯定是碱性氧化物 ⑤酸性氧化物均可与水反应生成相应的酸⑥与水反应生成酸的氧化物不一定是酸酐,与水反应生成碱的氧化物不一定是碱性氧化物⑦不能跟酸反应的氧化物一定能跟碱反应A .①③⑥B .①②⑤⑦C .③④⑤D .①②⑤ 8.N A 代表阿伏加德罗常数,下列有关叙述正确的是A .精炼铜过程中阴极增重6.4 g 时,电路中转移电子数大于0.2N AB .标准状况下,11.2 L 氨溶于水配制成500 mL 溶液,溶液中数目为0.5N AC .1 molD 318O +中含有的中子数为10N AD .7.8 g Na 2S 和Na 2O 2的混合物中含有的阴离子总数等于0.1N A9.在反应容器中充入1 mol A 气体和n mol B 气体,在一定条件下发生反应:A (气)+n B (气)m C (气),达平衡时,测得A 的转化率为50%,在相同温度和相同压强下,平衡时混合气体的体积是反应前的,则n 和m 的数值可能是A .n =1 m =1B .n =2 m =2C .n =3 m =3D .n =2 m =3 10.设N A 为阿伏加德罗常数,下列叙述中正确的是A .14 g 乙烯和环丙烷的混合物中总原子数为3N AB .常温下,11.2 L 甲烷气体含有甲烷分子数为0.5N AC .5.6 g 铁与足量的稀硫酸反应失去电子数为0.3N AD .0.1 mol·L -1的氢氧化钠溶液中含钠离子数为0.1N A 11.N A 为阿伏加德罗常数的值。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1月21日每周一测高考频度:★★★★★难易程度:★★★☆☆1.下列各种说法正确的是①铝用于软包装是利用了铝密度小的物理性质②在加热条件下,FeO可以迅速变成Fe2O3③合金材料可能含有非金属元素④合成纤维和光导纤维都是新型无机非金属材料⑤高纯度的硅广泛用于制作计算机芯片⑥不能用自来水直接配制AgNO3溶液⑦粗铜精炼时,纯铜与外电源的正极相连⑧在金属元素和非金属元素的分界线附近可以寻找制备半导体材料的元素A.仅②③④⑤⑥⑧B.仅③⑤⑥⑧C.仅①②④⑦D.除①外2.下列除去杂质的方法正确的是A.镁粉中混有少量铝粉:加入过量浓硫酸,充分反应,过滤、洗涤、干燥B.含Mg2+的溶液中混有少量Al3+:加入过量氨水充分反应,过滤C.Mg(OH)2中混有少量Al(OH)3:加入过量NaOH溶液充分反应,过滤、洗涤、干燥D.MgO中混有少量Al2O3:加入足量盐酸,充分反应,过滤、洗涤、干燥3.某干燥粉末可能由Na2O、Na2O2、Na2CO3、NaHCO3、NaCl中的一种或几种组成。
将该粉末与足量的盐酸反应有气体X逸出,将X通过足量的NaOH溶液后体积缩小(同温、同压下测定)且有气体剩余。
若将原混合粉末在空气中用酒精灯加热,也有气体放出,且剩余固体的质量大于原混合粉末的质量。
下列判断正确的是①粉末中一定有Na2O、Na2O2、NaHCO3②粉末中一定不含有Na2CO3和NaCl③粉末中一定不含有Na2O和NaCl ④无法肯定粉末中是否含有Na2CO3和NaClA.①②B.②③C.③④D.①④4.将金属铁、铜投入FeCl3溶液中充分反应,下列对反应情况设想的评价正确的是5.已知硫酸铝铵晶体的化学式可表示为Al 2(NH 4)2(SO 4)4·24H 2O ,其受热易分解,400 ℃时硫酸铝铵能够稳定存在。
取4.53 g 硫酸铝铵晶体,加热过程中所得固体质量与温度的变化关系如图所示。
根据图中数据的变化,推断下列说法中不正确的是A .硫酸铝铵晶体在50 ℃下不易分解B .硫酸铝铵晶体加热到400 ℃时会分解生成Al 2(NH 4)2(SO 4)4C .物质C 的化学式为Al 2(SO 4)3D .物质D 的化学式为Al 2O 36.高铁酸钾是一种重要的绿色净水剂,具有净水和消毒双重功能。
某课外学习小组设计如图所示方案制备高铁酸钾。
下列说法不正确的是A .高铁酸钾中铁元素的化合价为+6,具有强氧化性B .反应2Fe 3++3ClO −+10OH −224FeO -+3Cl −+5H 2O 中,生成2 mol 24FeO -时,转移6 mol 电子C .制备高铁酸钾的化学方程式为2KOH+Na 2FeO 4K 2FeO 4+2NaOH ,根据复分解反应原理,高铁酸钠的溶解度大于高铁酸钾的溶解度D .明矾、硫酸铁、高铁酸钾都能净水,其净水原理完全相同7.[双选]实验室将9 g 铝粉跟一定量的金属氧化物粉末混合形成铝热剂,发生铝热反应之后,所得固体中含金属单质18 g ,则该氧化物粉末可能是A.Fe2O3和MnO2B.MnO2和V2O5C.Cr2O3和V2O5D.Fe3O4和FeO8.Ni2O3主要用作陶瓷、搪瓷和玻璃的着色颜料,也可用于制备镍粉。
以废镍料为原料提取Ni2O3的工艺流程如图所示。
请回答下列问题:(1)Ni2O3中Ni的化合价为。
(2)提高“酸浸”“酸溶”速率时,温度不宜过高,其原因是。
(3)加入双氧水“氧化”的离子方程式为;滤渣A的主要成分是(填化学式)。
(4)上述流程分两次加入Na2CO3的目的是;为了控制“氧化”效率,加入NaClO和NaOH的最佳物质的量之比为。
(5)工业上,镍作阳极,电解0.1 mol·L−1 NiCl2溶液与一定量NH4Cl溶液组成的混合溶液,可得高纯度、球形的超细镍粉。
当其他条件一定时,NH4Cl的浓度对阴极电流效率及Ni的成粉率的影响如图所示。
①NH4Cl溶液的浓度最好控制为mol·L−1(保留一位小数)。
②当NH4Cl溶液的浓度大于15 g·L−1时,阴极有H2生成,导致阴极电流效率降低,用化学平衡移动原理解释其原因: 。
9.以炼锌厂的烟道灰(主要成分为ZnO,另含少量Fe2O3、CuO、SiO2、MnO等)为原料可生产草酸锌晶体(ZnC2O4·2H2O)。
有关氢氧化物开始沉淀和沉淀完全的pH如表所示:请问答下列问题:(1)滤渣A的主要成分为。
为了提高浸出速率,除将烟道灰处理得更细外,还可采取的措施有(写出两条)。
(2)除锰过程中产生MnO(OH)2沉淀的离子方程式为。
(3)①除铁(部分Cu2+可能被除去)时加入的物质D最好是。
②上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会降低,其原因是。
(4)若沉淀过程采用Na2C2O4代替(NH4)2C2O4生产草酸锌晶体,合理的加料方式是。
(5)将草酸锌晶体加热分解可得到一种纳米材料。
加热过程中固体残留率随温度的变化情况如图所示,300~460 ℃范围内,发生反应的化学方程式为。
1.【答案】B硅具有强的半导体的性能,广泛用于制作计算机芯片,正确;⑥自来水是用氯气消毒的,含有Cl−,所以不能用自来水直接配制AgNO3溶液,否则会发生反应,形成AgCl沉淀,正确;⑦粗铜精炼时,纯铜与外电源的负极相连,作阴极,错误;⑧在金属元素和非金属元素的分界线的元素导电性介于导体和绝缘体之间,可以寻找制备半导体材料的元素,正确。
正确的说法是③⑤⑥⑧,选项B符合题意。
2.【答案】C【解析】铝遇浓硫酸钝化,生成氧化铝,仍然混在镁粉中,不能被除去,A项错误;氨水与Mg2+、Al3+均会发生反应生成沉淀,且Al(OH)3不溶于弱碱,故用氨水不能除去Mg2+溶液中的Al3+,B项错误;Mg(OH)2与NaOH不反应,而Al(OH)3与NaOH反应生成可溶于水的NaAlO2,C项正确; MgO和Al2O3均与盐酸反应,用盐酸无法除去MgO中混有的Al2O3,D项错误。
3.【答案】D合粉末在空气中用酒精灯加热,也有气体放出,说明粉末中一定含有NaHCO3,不能确定Na2CO3是否存在。
在空气中加热粉末,由于固体质量最终大于原粉末的质量,说明原粉末中含有Na2O。
由题述信息无法判断NaCl是否存在。
4.【答案】D【解析】因离子的氧化性强弱顺序为Fe3+>Cu2+>Fe2+,如果Fe3+足量,Fe3+可将铁和铜全部氧化且可能还有剩余,A错误;当铁剩余时,溶液中不会存在Cu2+,B错误;因还原性:Fe>Cu,故当铜剩余时,溶液中肯定无Fe3+,可能有Cu2+,C错误。
5.【答案】B【解析】根据图示可知,约100 ℃时硫酸铝铵晶体开始分解,所以在50 ℃下硫酸铝铵晶体可以稳定存在,选项A说法正确。
4.53 g硫酸铝铵晶体的物质的量n[Al2(NH4)2(SO4)4·24H2O]=4.53 g÷906 g·mol−1=0.005 mol,该晶体中含有结晶水的物质的量为0.005 mol×24=0.12 mol;受热分解过程中,固体中一定含有铝元素,根据信息,400 ℃时硫酸铝铵未分解,所以A转化为B的过程中,固体质量的减少量是结晶水的质量,减少的结晶水的物质的量为(4.53 g−2.46 g)÷18 g·mol−1=0.115 mol;固体中剩余结晶水的物质的量为0.12 mol−0.115 mol=0.005 mol,所以物质B的化学式为Al2(NH4)2(SO4)4·H2O,选项B说法错误。
根据Al元素质量守恒,可以推出物质C为Al2(SO4)3,物质D为Al2O3,选项C、选项D 正确。
6.【答案】D【解析】高铁酸钾中铁为+6价,为铁的最高价态,高铁酸钾具有强氧化性,A项说法正确;铁由+3价升高到+6价,生成2 mol 24FeO 时,转移6 mol电子,B项说法正确;复分解反应向生成溶解度较小物质的方向进行,高铁酸钾的溶解度小于高铁酸钠的溶解度,C项说法正确;从两个方面分析高铁酸钾的净水过程:①高铁酸钾具有强氧化性,能杀菌消毒,本身被还原成Fe3+,②Fe3+与水反应生成氢氧化铁胶体,能净水,而明矾、硫酸铁都是由于电离出的阳离子在水溶液中发生水解反应产生胶体粒子吸附水中杂质而净水的,原理与高铁酸钾不完全相同,D项说法错误。
7.【答案】ADMn的摩尔电子质量为13.75 g/mol·e−,生成V的摩尔电子质量为10.2 g/mol·e−,根据平均值规律,B 项不可能生成18 g 金属单质;同理,C项也不可能生成18 g金属单质;D项,铝完全反应时生成铁的质量大于18 g,当氧化物粉末不足量时,生成的金属可能为18 g,D项正确。
8.【答案】(1)+3(2)温度过高,HCl挥发加快(3)2Fe2++2H++H 2O22Fe3++2H2O Fe(OH)3(4)将Fe3+和Ni2+分别沉淀出来1∶4(5)①0.2 ②随着NH 4Cl溶液浓度的增大,+4NH+H2O NH3·H2O+H+水解平衡向右移动,H+浓度增大,导致阴极放出氢气【解析】(2)盐酸易挥发,控制温度可减少盐酸挥发。
(3)加入盐酸必须过量,确保废料完全溶解。
双氧水在酸性条件下可氧化亚铁离子。
铁离子水解生成Fe(OH)3,滤渣A为Fe(OH)3。
(4)分批加入Na2CO3的目的是将Fe3+和Ni2+分别沉淀出来。
次氯酸钠的还原产物为氯离子,反应的离子方程式为2Ni2++ClO−+4OH−Ni 2O3↓+Cl−+2H2O,按次氯酸钠、氢氧化钠的物质的量之比1∶4投料,“氧化”效率最高。
(5)①由题给图像可以看出,当NH4Cl溶液浓度为10 g·L−1时,阴极电流效率和Ni的成粉率都较高,则c(NH4Cl)=1053.5错误!未找到引用源。
mol·L−1≈0.2 mol·L−1。
②随着NH4Cl溶液浓度的增大,的水解平衡正向移动,H+浓度增大,导致阴极放出氢气。
9.【答案】(1)SiO2适当增加盐酸的浓度、提高反应温度、搅拌(任写两条即可) (2)Mn2++H 2O2+H2O MnO(OH)2↓+2H+(3)①ZnO[或ZnCO3或Zn(OH)2或其他合理答案]②先加入ZnS会将Fe3+还原为Fe2+,使铁元素难以除去(4)将Na2C2O4缓慢加入ZnCl2溶液中,边加边搅拌(5)ZnC2O4ZnO+CO↑+CO2↑(2)本问考查氧化还原反应离子方程式的书写。
MnO溶于盐酸时变成Mn2+,加入的H2O2作氧化剂,将Mn2+氧化为MnO(OH)2(其中Mn显+4价),根据得失电子守恒、原子守恒和电荷守恒可写出对应的离子方程式,注意之前加入的盐酸使得溶液呈酸性。
