高三化学生产生活中的含氮化合物
高三化学知识点之氮及其化合物

精品小班课程辅导讲义讲义编号2014暑假12HX01辅导科目:化学年级:新高三课题氮及其化合物教学目标NH3、NO、NO2的性质。
理解硝酸与硝酸盐的性质。
教学重点、难点NH3、NO、NO2的性质。
理解硝酸与硝酸盐的性质。
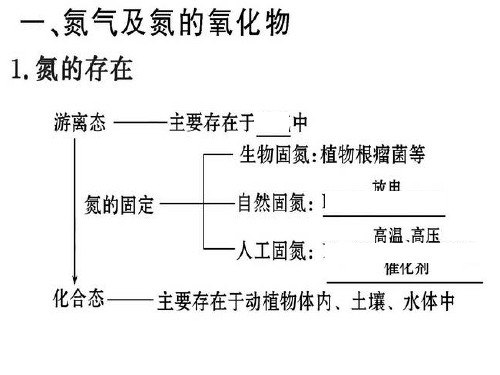
教学内容一、考纲要求主题学习内容学习水平说明一些元素的单质和化合物氮氨 B(1)氨的物理性质和化学性质(2)工业合成氨的原理铵盐 B(1)铵根离子与碱溶液的反应(2)铵盐的不稳定性氮肥 A(1)常见氮肥:铵盐(NH4Cl、NH4NO3、NH4HCO3)二、知识梳理(一)氮气(1)氮元素在自然界中的存在形式:既有游离态又有化合态.空气中含N2 78%(体积分数)或75%(质量分数);化合态氮存在于多种无机物和有机物中,氮元素是构成蛋白质和核酸不可缺少的元素.(2)氮气的物理性质:纯净的氮气是无色气体,密度比空气略小.氮气在水中的溶解度很小.在常压下,经降温后,氮气变成无色液体,再变成雪花状固体.(3)氮气的分子结构:氮分子(N2)的电子式为,结构式为N≡N.由于N2分子中的N≡N键很牢固,所以通常情况下,氮气的化学性质稳定、不活泼.(4)氮气的化学性质:①N2与H2化合生成NH3N2 +3H22NH3说明该反应是一个可逆反应,是工业合成氨的原理.②N2与O2化合生成NO:N2 + O2放电2NO说明在闪电或行驶的汽车引擎中会发生以上反应.(5)氮气的用途:①合成氨,制硝酸;②代替稀有气体作焊接金属时的保护气,以防止金属被空气氧化;⑧在灯泡中填充氮气以防止钨丝被氧化或挥发;④保存粮食、水果等食品,以防止腐烂;⑤医学上用液氮作冷冻剂,以便在冷冻麻醉下进行手术;⑥利用液氮制造低温环境,使某些超导材料获得超导性能.(二)一氧化氮和二氧化氮1、一氧化氮:无色无味气体,难溶于水,有很大毒性,在常温下极易被氧化成二氧化氮。
2NO+O2→2NO22、二氧化氮:红棕色有刺激性气味气体,溶于水生成硝酸和一氧化氮。
高三第一轮复习氮及其重要化合物

氨气的结构和性质
请写出氨气的电子式: 请说出氨气分子的立体构型:
孤对电子
H
三角锥型
···N·H····H
氨气是极性分子还是非极性分子? 极性分子
氨气的熔沸点比PH3高还是低,为什么? 比PH3高,氨气分子之间能形成氢键。
氨气在水中的溶解度如何?在CCl4或苯中呢? 氨气极易溶于水,难溶于CCl4或苯。
科学家在液氨中加入金属钠或金属锂制备NaNH2 和LiNH2。工业上, NaNH2用于制取靛青染料; LiNH2主要用于有机合成和药物制造,是具有良好前 景的储氢材料。
氨气具有氧化性(氢元素体现)。
氨气的结构和性质
氨气有没有还原性?与哪些物质反应可以体现出氨气 的还原性?
(工业制硝酸 )
氧化产物为什么不是NO2?
*HNO3的强氧化性
1、与金属反应产生最高价金属盐类
浓硝酸产生NO2、稀硝酸产生NO(掌握) 金属越活泼,浓度越低,产物中N的化合价越低(了解)
N2O、N2甚至NH4+
2、与非金属单质反应(浓硝酸) 产物一般是氧化物或含氧酸
如C、S、P等
CO2、H2SO4、H3PO4
3、与还原性化合物
Fe2+、S2-、I-、 SO32-等
氨气的结构和性质
铵盐 (化肥)
催化
氧化 NO(工业制硝酸)
O2 N2 (燃料电池) NH3 还原性 F2 NF3 (激光材料)
液氨 (致冷剂)
氧
NaClO N2H4 (火箭燃料)
化 性
NOx N2 (尾气处理)
LiNH2 (储氢材料)
NaNH2(药物合成)
拓展应用: 请写出联氨(N2H4)的电子式,并预测其性质
2023版高三一轮总复习化学(苏教版)第2部分专题4第18讲氮及其化合物(基础课)

第18讲 氮及其化合物(基础课)1.掌握氮元素单质及其重要化合物的主要性质和应用。
2.掌握氨气的实验室制法(包括所用试剂、仪器、反应原理和收集方法)。
3.了解铵盐(NH +4)的检验方法。
氮及其氧化物 硝酸1.氮及其氧化物(1)自然界中氮的存在和氮的固定(2)N 2的性质及应用N 2是一种无色、无味的气体,密度比空气略小,难溶于水,熔点、沸点比O 2的低。
N 2的电子式为,结构式为N ≡N 。
分子结构稳定,化学性质稳定,可用作保护气。
①与Mg 反应的化学方程式:N 2+3Mg=====点燃Mg 3N 2,N 2表现氧化性。
②与H 2反应的化学方程式:,N 2表现氧化性。
③与O 2反应的化学方程式:N 2+O 2============放电或高温2NO ,N 2表现还原性。
(3)氮的氧化物①氮有多种价态氧化物,氮元素从+1价至+5价都有相应的氧化物,依次为N 2O 、NO 、N 2O 3、NO 2(或N 2O 4)、N 2O 5,其中属于酸性氧化物的有N 2O 3和N 2O 5。
②NO 、NO 2的性质比较NO NO 2 颜色 无色 红棕色毒性有毒 有毒 溶解性不溶于水 易溶于水 与O 2或与H 2O 反应2NO +O 2===2NO 2 3NO 2+H 2O===2HNO 3+NO 收集方法排水法 向上排空气法 对环境的影响 NO 与血红蛋白结合使人中毒,NO 、NO 2导致光化学烟雾、形成酸雨及破坏臭氧层(1)NO 2可以被NaOH 溶液吸收,其反应为2NO 2+2NaOH===NaNO 3+NaNO 2+H 2O 。
(2)NO 2与NO 按物质的量比1∶1混合与NaOH 反应:NO 2+NO +2NaOH===2NaNO 2+H 2O 。
(3)在催化剂、加热条件下,NO x 与NH 3反应生成N 2与H 2O ,此方法可用于处理汽车尾气中的NO x 。
2.硝酸的性质纯净的硝酸是无色、易挥发、有刺激性气味的液体,与H 2O 以任意比互溶。
2021高三化学人教版:氮及其化合物含答案

1.自然界中氮的存在和氮的固定2.N2的性质及应用(1)物理性质:无色无味的气体、密度比空气略小、难溶于水、熔点、沸点比O2的低。
(2)化学性质N2的电子式为N⋮⋮N、结构式为N≡N。
①与Mg 反应的化学方程式:N 2+3Mg =====点燃Mg 3N 2、N 2表现氧化性。
②与H 2反应的化学方程式:N 2+3H 2高温、高压催化剂2NH 3、N 2表现氧化性。
③与O 2反应的化学方程式:N 2+O 2==========放电或高温2NO 、N 2表现还原性。
3.氮的氧化物(1)氮有多种价态的氧化物、如N 2O 、NO 、NO 2、N 2O 4、N 2O 3、N 2O 5等、其中属于酸性氧化物的是N 2O 3、N 2O 5;NO 2与N 2O 4能相互转化2NO 2N 2O 4(写化学方程式)。
(2)NO 、NO 2的比较NO NO 2 颜色 无色 红棕色 毒性 有毒 有毒 溶解性 难溶于水 易溶于水 与O 2或 与H 2O 反应 2NO +O 2===2NO 23NO 2+H 2O===2HN O 3+NO 收集方法 排水法向上排空气法与人体、环境的关系①与血红蛋白结合、使人中毒; ②转化成NO 2、形成酸雨、光化学烟雾形成酸雨、光化学烟雾(3)常见NO x 的尾气处理方法①碱液吸收法2NO2+2NaOH===NaNO3+NaNO2+H2O;NO2+NO+2NaOH===2NaNO2+H2O。
注意:NO不能被碱液吸收。
②催化转化:在催化剂、加热条件下、氨将氮氧化物转化为无毒气体(N2)或NO x与CO在一定温度下催化转化为无毒气体(N2和CO2)。
一般适用于汽车尾气的处理。
[基础判断](1)NH3的催化氧化和合成氨均为氮的固定。
( )(2)NO、NO2均可用排空气法收集。
( )(3)NO2与H2O反应可以生成HNO3、故NO2为酸性氧化物。
( )(4)NO2与H2O反应中、H2O为还原剂。
高三化学知识点之氮及其化合物

精品小班课程辅导讲义讲义编号2014暑假12HX01二、知识梳理(一)氮气⑴氮元素在自然界中的存在形式:既有游离态又有化合态.空气中含N2 78%(体积分数)或75%(质量分数);化合态氮存在于多种无机物和有机物中,氮元素是构成蛋白质和核酸不可缺少的元素.(2)氮气的物理性质:纯净的氮气是无色气体,密度比空气略小.氮气在水中的溶解度很小.在常压下,经降温后,氮气变成无色液体,再变成雪花状固体.■ ■■ I(3)氮气的分子结构:氮分子(N2)的电子式为,结构式为N三N.由于N2分子中的N三N键很牢固,所以通常情况下,氮气的化学性质稳定、不活泼.(4)氮气的化学性质:高压_①N2与凡化合生成NH3 N2 +3H2 r催亚》—2NH3说明该反应是一个可逆反应,是工业合成氨的原理.②N2与02化合生成NO: N2+ O2放电> 2NO说明在闪电或行驶的汽车引擎中会发生以上反应.(5)氮气的用途:①合成氨,制硝酸;②代替稀有气体作焊接金属时的保护气,以防止金属被空气氧化;⑧在灯泡中填充氮气以防止钨丝被氧化或挥发;④保存粮食、水果等食品,以防止腐烂;⑤医学上用液氮作冷冻剂,以便在冷冻麻醉下进行手术;⑥利用液氮制造低温环境,使某些超导材料获得超导性能.(二)一氧化氮和二氧化氮1、一氧化氮:无色无味气体,难溶于水,有很大毒性,在常温下极易被氧化成二氧化氮。
2NO+O2T2NO22、二氧化氮:红棕色有刺激性气味气体,溶于水生成硝酸和一氧化氮。
3NO2+H2OHHNO3+NO 2NO2 、N2O4 (无色)【光化学烟雾】NO、NO2有毒,是大气的污染物.空气中的NO、NO2污染物主要来自于石油产品和煤燃烧的产物、汽车尾气以及制硝酸工厂的废气.NO2在紫外线照射下,发生一系列光化学反应,产生一种有毒的烟雾一一光化学烟雾.因此,NO2是造成光化学烟雾的主要因素.光化学烟雾刺激呼吸器官,使人生病甚至死亡.注意:关于氮的氧化物溶于水的几种情况的计算方法。
徐州市王杰中学2013化学一轮复习单元导学案专题四:生活中的含氮化合物 第6讲 第2课时

徐州市王杰中学导学案 (高三化学组) 章节与课题专题四 第6讲 生活中的含氮化合物(二)——氨和铵盐 第2课时 课时安排 4课时 主备人审核人 总第 6 课 使用人使用日期或周 2013.2.27 第2周 考试说明1.了解氨气、铵盐的性质,掌握氨气的实验室制法和NH +4的检验。
2.初步了解常见化肥的基本性质。
重点 难点 了解氨气、铵盐的性质,掌握氨气的实验室制法和NH +4的检验教学资源使用 PPT 自主学习 合作探究 导学案【规律方法 解题指导】高考热点专题突破【思维训练】喷泉实验的形成原理1.形成喷泉的原理:形成喷泉最根本的原因是瓶内外存在压强差。
当烧瓶内气体溶于液体或与之反应时,瓶内气体大量减少,压强降低,外界的大气压将液体压入烧瓶内,如此持续,最后液体将充满烧瓶。
2.常见喷泉的形成主要有以下两类:(1)极易溶于水的气体( 、 、 等)与水可形成喷泉。
(2)酸性气体(HCl 、SO 2、NO 2、CO 2、H 2S 等)与 也能形成喷泉。
【例1】 喷泉是一种常见的自然现象,其产生原因是存在压强差。
(1) 图甲中,为化学教学中所用的喷泉实验装置。
在烧瓶中充满干燥气体,胶头滴管及烧杯中盛有液体。
①下列组合中不可能形成喷泉的是 ( )A .HCl 和H 2OB .O 2和H 2OC .NH 3和H 2OD .CO 2和NaOH 溶液E .NO 2和H 2O②设若用D 组合做喷泉实验,烧杯中的液体一定是NaOH 溶液吗?_________________。
③用A 组合做喷泉实验时,若烧瓶中充满HCl 气体,则在标准状况下,做完实验后烧瓶中c (HCl)=________mol·L -1(设溶质不扩散)。
④若用E 组合做喷泉实验时,则标准状况下,做完实验后烧瓶中溶质的物质的量浓度是________mol·L -1。
(2)某学生积极思考产生喷泉的其他办法,并设计了如图乙所示的装置。
化学高三关于氮的知识点

化学高三关于氮的知识点氮是化学元素周期表中的第七个元素,原子序数为7,符号为N。
它是非金属元素,位于周期表的p区。
氮在自然界中广泛存在于大气、水中、土壤中等地方。
在化学领域,氮具有广泛的应用和重要的地位。
下面将介绍一些关于氮的知识点。
1. 氮的基本性质氮是一种无色、无味、无臭的气体,密度比空气稍大,几乎不溶于水。
在室温下,氮常常以双原子形式存在,即N₂。
它具有高活性,在高温高压下与其他元素形成化合物。
氮是一种稳定的元素,不易与其他元素发生反应。
由于氮分子中的氮氮三键非常强大,使得氮气的生成和分解都需要较高的能量。
2. 氮的生产和利用氮气广泛应用于工业生产和实验室中。
目前主要的氮气生产方法是通过空分设备,利用空气中的氧气和氮气的差异,经过压缩、冷却和分离等步骤,将氮气从空气中提取出来。
氮气的主要应用领域包括化肥制造、金属冶炼、食品保鲜、制冷、火箭推进剂等。
3. 氮的化合物氮是化合物中的重要成分之一,在自然界和工业上形成各种氮化物。
其中最常见的化合物包括氨气(NH₃)、硝酸(HNO₃)、硝酸盐等。
氮化物对植物生长和发育具有重要影响,可以作为农业肥料使用。
此外,氮化物还用于制备爆炸物、防腐剂、胶粘剂等。
4. 氮的环境和生态影响氮是地球上最常见的元素之一,但过多的氮排放对环境和生态系统产生负面影响。
过量的氮排放可能导致酸雨、水体富营养化、土壤酸化、温室效应等问题。
因此,控制氮的排放和利用,以减少对环境的影响,是当前亟待解决的问题之一。
5. 氮的相关理论和研究领域氮的相关理论和研究领域主要包括氮循环、氮转化和氮的储存等。
氮循环研究了氮在大气、地表水、土壤和生物体之间的迁移与转化过程。
氮转化则研究了氮化合物的合成、分解和转变等反应。
氮的储存研究了如何高效地储存氮气或氮化合物,以满足不同行业的需求。
综上所述,氮作为重要的化学元素,在工业生产、农业生产、环境保护等方面都具有广泛的应用和重要的意义。
研究氮的性质、化合物和相关理论,有助于我们更好地理解和利用这一元素。
氮及其化合物--2024年新高考化学一轮复习必刷题(解析版)

专题17氮及其化合物(建议完成时间:45分钟实际完成时间:_______分钟)目录考点一氮及其化合物的结构、性质及应用考点二氮及其化合物制备的工艺流程考点三氮及其化合物的有关计算考点一氮及其化合物的结构、性质及应用1(2023·江苏盐城·盐城中学校考二模)下列有关物质的性质与用途的对应关系正确的是A.N2性质不活泼,可作为粮食保护气B.NH3具有还原性,可用作制冷剂C.N2H4的熔沸点较低,可用作火箭推进剂D.NH4Cl受热易分解,可用作铁的除锈剂【答案】A【解析】A.氮气含有氮氮三键,化学性质稳定,一般不与物质发生反应,可用作保护气,A正确;B.液氨汽化吸收大量的热,具有制冷作用,可用作制冷剂,与其还原性无关,B不正确;C.N2H4在空气中燃烧或与过氧化氢H2O2反应时,能生成大量气体(N2和水蒸气),因此可用作火箭燃料,与其熔沸点较低无关,C 不正确;D.因为NH4Cl在水中电离出的NH+4,NH+4水解使溶液显酸性,因此可作为铁的除锈剂,与其受热易分解无关,D不正确。
答案选A。
2(2023秋·云南昆明·高三昆明市官渡区第二中学校考开学考试)用以下三种途径来制取等质量的硝酸铜。
①铜与稀硝酸反应;②铜与浓硝酸反应;③铜先与氧气反应生成氧化铜,氧化铜再跟硝酸反应。
以下叙述不正确的是A.三种途径所消耗铜的质量相等B.三种途径所消耗硝酸的物质的量是①>②>③C.途径③的制备方法最符合“绿色化学”理念D.途径①中被氧化的铜与被还原的硝酸的物质的量之比是3:2【答案】B【解析】三种方法制取硝酸铜的有关反应原理用方程式表示分别为:①铜与稀硝酸反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;②铜与浓硝酸反应:Cu+4HNO3 (浓)=Cu(NO3)2+2NO2↑+2H2O;③铜先与氧气反应生成氧化铜,氧化铜再跟硝酸反应:2Cu+O22CuO,CuO+2HNO3=Cu(NO3)2;A. 根据Cu元素守恒,铜元素都反应生成了硝酸铜,所以制取等量的硝酸铜消耗铜的质量相等,A正确;B. 假设反应制取3mol Cu(NO3)2,三种方法消耗的硝酸的物质的量分别是8mol、14mol、6mol,可见三种途径所消耗硝酸的物质的量大小关系为:②>①>③,B错误;C. 途径③的制备方法中硝酸中的N元素全部转化为硝酸铜,原子利用率最高,且没有污染环境的气体NO、NO2等的产生,最符合“绿色化学”理念,C正确;D. 途径①中3mol Cu作还原剂,被氧化;而参加反应的硝酸,8mol HNO3中只有2mol被还原,所以被氧化的铜与被还原的硝酸的物质的量之比是3:2,D 正确;故合理选项是B。
氮及其化合物的转化关系-高考化学复习

二、氮及其化合物的转化与物质推断
3.下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是 强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱 时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
下列说法不正确的是 A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4 B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
关键能力
一、氮在自然界中的循环
1.自然界中氮的循环如图所示。下列说法不正确的是 A.工业合成氨属于人工固氮 B.雷电作用下N2与O2发生了化学反应
√C.在氮的循环中不涉及氧化还原反应
D.含氮无机物与含氮有机化合物可相互转化
工业合成氨是氮气和氢气在高温、高压和催 化剂条件下生成氨气,属于人工固氮,故A 正确; 雷电作用下N2与O2发生反应生成NO,故B 正确; 在氮的循环中,工业合成氨、雷电作用过程
B.用装置乙作为反应过程的安全瓶 C.制备水合肼时从装置丙的a口通入NH3 D.用装置丁吸收反应中过量的NH3
浓氨水需受热或加入碱性物质才能分解产生NH3,CaCl2不能使浓氨水分解,A 项错误; 化学实验装置中的安全瓶的进气管和出气管均较短,B项正确; 氨气密度比空气小,为了利于氨气与NaClO溶液反应,应从装置丙的a口通入 氨气,C项正确; 氨气会污染环境,用装置丁可吸收过量的NH3,并能防倒吸,D项正确。
C.装置D使用冰水浴 D.装置F中所用试剂可为NH4Cl与熟石灰
A装置为碳酸钙与盐酸反应制备CO2的简易装置,该装置的优点是能够随时控 制反应的发生和停止,A正确; 氨基甲酸铵易水解,进入装置D的气体必须是干燥纯净气体,左侧装置B、C试 剂 可 分 别 为 饱 和 碳 酸 氢 钠 溶 液 、 浓 硫 酸 , 制 备 纯 净 干 燥 的 CO2 , 装 置 F 可 用 NH4Cl与熟石灰制备氨气,E中试剂需干燥氨气,可以选用碱石灰,但不能选 用P2O5固体,B错误、D正确; 制备氨基甲酸铵的反应为放热反应,制得的物质易分解,所以装置D需降温, 使用冰水浴,C正确。
高三化学(苏教版)总复习 1-4-2生产生活中的含氮化合物

[答案]C
江 苏 教 育 版
必修部分
专题4 第二单元
高考化学总复习
5.13.8 g 63%的HNO3溶液(密度为1.38 g· 3)和100 cm mL 13.8 mol/L的HNO3溶液相比,正确的是( A.都应用棕色广口瓶存储 B.浓度不同的两种HNO3溶液 C.溶液的体积不同但浓度相同 D.均可与Au反应而发生钝化现象 )
江 苏 教 育 版
必修部分
专题4 第二单元
高考化学总复习
CO2↑
Fe+4HNO3===Fe(NO3)3+NO↑+2H2O
3Fe+
8HNO3===3Fe(NO3)2+2NO↑+4H2O
江 苏 教 育 版
必修部分
专题4 第二单元
高考化学总复习
江 苏 教 育 版
必修部分
专题4 第二单元
高考化学总复习
江 苏 教 育 版
必修部分
专题4 第二单元
高考化学总复习
在放电作用下与O2化合:____________; 在点燃条件下与Mg化合:______________; 在催化作用下合成NH3:______________。
江 苏 教 育 版
必修部分
专题4 第二单元
高考化学总复习
2.NO和NO2 (1)一氧化氮在常温下很容易与空气中的氧气反应,化学 方程式为____________。 (2)比较NO与NO2的性质: NO 颜色 气味 水溶性 与H2O反应的方程式: NO2
江 苏 教 育 版
必修部分
专题4 第二单元
高考化学总复习
(5)检验:①用____________置于试管口,若试纸变 ________色,说明氨已收集满了;②将蘸有________的玻 璃棒置于试管口,若有白烟产生,说明已收集满了。 (6)环保措施:用稀硫酸吸收多余的氨(棉花用稀硫酸 浸湿)。
化学氮及其化合物笔记

化学氮及其化合物笔记
以下是化学氮及其化合物的笔记:
1. 氮气的化学性质:氮气是一种无色、无味的气体,占空气的78%。
它的化学性质不活泼,但在高温或放电条件下,氮气可以与其他元素反应。
2. 氮的氧化物:一氧化氮和二氧化氮是氮的常见氧化物。
一氧化氮是无色气体,二氧化氮是红棕色气体。
3. 硝酸和硝酸盐:硝酸(HNO3)是强酸之一,可用于制备硝酸盐,如硝酸钠、硝酸钾等。
4. 铵盐和尿素:铵盐是铵离子和酸根离子组成的化合物,如氯化铵、硝酸铵等。
尿素是动物和植物体内蛋白质代谢的主要终产物,也是目前含氮量最高的氮肥。
5. 氮循环:氮循环是指自然界中氮单质、含氮化合物之间相互转化和循环的过程。
主要涉及固氮、硝化和反硝化等过程。
希望以上信息可以帮到您。
高考化学氮及其化合物1一轮复习1(解析版)

氮及其化合物完卷时间:50分钟可能用到的相对原子质量:H1 C12 O16 Na23一、选择题(每小题只有一个正确选项,共12*5分)1.(2021·北京高三一模)“封管实验”具有简易、方便、节约、绿色等优点,关于如图所示三个“封管实验”(夹持装置未画出)的说法正确的是A .加热时,①中上部汇集了固体B .加热时,②中溶液变红,冷却后又变为无色C .加热时,③中溶液红色褪去,冷却后溶液变红D .三个“封管实验”中所发生的化学反应都是可逆反应【答案】A【解析】A .加热氯化铵分解,在上方HCl 与氨气化合生成氯化铵,则①中封管内固体由下方转移到上方,A 正确;B .氨气的水溶液显碱性,加热时氨气逸出,酚酞溶液褪色,冷却时氨气溶于酚酞溶液,溶液显红色,B 错误;C .二氧化硫可使品红褪色,化合生成无色物质,加热可分解,则加热时,③中溶液变红,冷却后红色褪去,C 错误;D .可逆反应应在同一条件下进行,题中实验分别在加热条件下和冷却后进行,不是可逆反应,D 错误;综上所述答案为A 。
2.(2021·河北唐山市·高三三模)工业上利用3NH 对烟道气进行脱硝(除氮氧化物)的SCR 技术具有效率高、性能可靠的优势。
SCR 技术的原理为3NH 和NO 在催化剂(2MnO )表面转化为2N 和2H O ,反应进程中的相对能量变化如图所示。
下列说法正确的是A .总反应方程式为()22326NO+4NH 5MnO N +6H O ΔH<0B .2NH NO 是脱硝反应的催化剂C .升高温度,脱硝反应的正反应速率的增大程度大于其逆反应速率的增大程度D .决定反应速率的步骤是“2NH NO 的转化”【答案】A【解析】A .由已知SCR 技术的原理为NH 3和NO 在催化剂(MnO 2)表面转化为N 2和H 2O ,可知总反应的方程式为6NO+4NH 32MnO 5N 2+6H 2O ,A 正确; B .观察相对能量-反应进程曲线知,NH 3吸附在催化剂表面后,经过一定的反应形成了NH 2NO ,NH 2NO 又经过反应得到N 2和H 2O ,所以NH 2NO 是脱硝反应的活性中间体,B 错误;C .起始相对能量高于终态,说明这是一个放热反应,升高温度平衡会逆向移动,所以升高温度后,脱硝反应的正反应速率的增大程度小于其逆反应速率的增大程度,C 错误;D .相对能量-反应进程曲线表明,全过程只有H 的移除过程势能升高,这是一个需要吸收能量越过能垒的反应,其速率是全过程几个反应中最慢的,决定了反应的速率,是总反应的速控步骤,D 错误;故答案为:D 。
高三化学一轮复习 氮及其化合物复习
4HNO3
△ 或光照
2 H2O + 4 NO2 ↑ + O2 ↑
浓硝酸变黄原因?
分解产生的NO2(红棕色)溶于浓硝酸中而变 黄。
浓硝酸如何保存?
棕色细口试剂瓶中,避光、低温保存。 HNO3 (不能用橡皮塞)
二)硝酸的化学性质
3、硝酸的强氧化性 3CCuu++H8NHON3O(稀3(稀)→)=3Cu(NO3)2+2NO↑+4H2O CCuu++4HHNNOO33((浓浓))→=Cu(NO3)2+2NO2↑+2H2O CC++4HHNNOO33((浓浓))→=CO2↑+4NO2↑+2H2O
浓硫酸
△
颜OH色-NH反O应3:NO2
-NO2 硝+基H苯 2O CH3CH2ONO2 +H硝2酸O乙酯
与含有苯环结构的蛋白质作用,呈黄色。
一、氨气的物理性质:
颜色状态气味无:色有刺激性气味的气体
密度: 水溶性:
密度比空气小,
ρ(NH3)∶ ρ(空气)=17∶29
极易溶于水,体积比1∶700
例1、喷泉是一种常见的自然现象,其产生原因是存在压 强差。
二、氮的氧化物
氮有多种价态的氧化物,如N2O、NO、 N2O3 、NO2、N2O4、N2O5等,
问题:实验室怎么制取NO和NO2的?
制法: 原理:HNO3+Cu--Cu(NO3)2+NOx↑+H2O 药品: 浓稀硝酸、铜 装置: 固液(加热) 收集:排水法 向上排空气法 尾气吸收: NaOH
NO
3FFeeOO++H1N0HON3(O稀3()稀→)=3Fe(NO3)3+NO↑+5H2O
徐州市王杰中学2013化学一轮复习单元导学案专题四:生活中的含氮化合物 第5讲 第2课时

徐州市王杰中学导学案(高三化学组)章节与课题专题四第5讲生活中的含氮化合物(一)——氮的氧化物和硝酸第2课时课时安排 4课时主备人审核人总第 2 课使用人使用日期或周2013.2.21 第1周考试说明1.知道氮气稳定的原因及用途。
2.了解常见的氮的氧化物(NO、NO2)的性质及对环境的影响。
3.会用硝酸的氧化性解释硝酸与金属、非金属及其他具有还原性物质反应的特点。
重点难点从化合价的角度认识氮及其化合物的氧化性和还原性;有关计算教学资源使用PPT 自主学习合作探究导学案【规律方法解题指导】硝酸与金属、非金属反应的一般规律1.硝酸与金属反应的一般规律(1)金属与HNO3反应一般不生成,浓HNO3一般被还原为,稀HNO3一般被还原为。
(2)足量金属与一定量浓硝酸反应时,随着硝酸浓度的降低,产物也。
(3)金属与HNO3反应的一般通式为①金属+浓硝酸―→金属硝酸盐+NO2↑+H2O②金属+稀硝酸―→金属硝酸盐+NO↑+H2O2.硝酸与非金属反应的规律(1)浓硝酸能与碳、硫、磷等非金属单质反应,一般生成最高价或最高价、和水。
(2)与非金属反应,HNO3表现性,不表现性。
【例1】在浓硝酸中放入铜片:开始反应的化学方程式为_____________________________________________________,实验现象为_________________________________________________________。
(1)若铜有剩余,则反应将要结束时的化学方程式为___________________________________________________________________________________________________________。
(3)待反应停止后,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,原因是_________________________________________________________________________。
高三化学:《氮的相关知识》教案

氮的相关知识[序言]我们已经学习了碱金属元素、碳族元素、氧族元素、卤族元素等主族元素。
在周期表中,位于ⅣA和ⅥA族之间的是ⅤA族元素也是主族元素,包括氮、磷、砷、锑、铋五种元素,我们称它们为氮族元素。
一、原子结构元素名称:氮磷砷锑铋元素符号:N P As Sb Bi电子排布: 2 5 2 8 5 2 8 18 5 2 8 18 18 5 2 8 18 32 18 5相同:最外层均是5个电子不同:核电荷数↑,电子层数↑。
二、元素性质1、元素N P As Sb Bi与氢气化合由易到难,稳定性↓2、最高价含氧酸:HNO3 H3PO4 H3AsO4 酸性↓3、主要化合价:氮:-3、+1、+2、+3、+4、+5磷和砷:-3、+3、+5锑和铋:+3、+54、单质的物理性质:(1)颜色:无色→白(黄或红棕色)→灰色→银白色→银白色(微红)(2)状态:气→固(3)密度:↑(4)熔沸点:先升高后降低(晶体类型不同)三、与同周期碳族、氧族、卤族元素比较碳族氮族氧族卤族(同周期)原子半径↓,元素非金属性↑气态氢化物稳定性↑,最高价含氧酸酸性↑氮气[引入]我们知道,如果土壤里缺乏氮、磷、钾三种元素,会影响农作物的生长。
所以,农业上主要施用含氮、磷、钾元素的化肥。
氮和磷是重要的非金属元素,都位于元素周期表的第V A族,它们在化学性质上有一些相似之处,下面我们来学习有关氮和磷的一些性质。
一、氮气氮元素主要以游离态存在于空气中,约占78%(体积比)或75%(质量比)。
同时,也有以化合态形式存在于无机物中及有机物中,是生命所不能缺少的一种元素,因此,讨论氮是很有必要的。
那么,为什么氮主要以N2形式存在呢?这主要是由它的结构所决定的。
(一)、氮气分子的结构N2 电子式:..........N N 结构式:N N氮氮叁键很牢固,所以氮元素主要以N2分子(游离态)存在。
(二)、氮气的物理性质无色、无味、比空气密度略小,难溶于水(1:0.02),可发生三态变化。
含氮化合物的性质和应用

课题 含氮化合物的性质及其应用学情分析 复习巩固所学的知识教学目标与 考点分析 1. 了解氮气及其重要含氮化合物的主要性质及应用 2. 了解某些含氮化合物对环境质量的影响 3. 能综合应用氮及氮的化合物知识教学重点难点 含氮的化合物的性质教学方法根据重难点给学生讲解例题,辅导学生完成课后练习教学过程1、本考点知识结构:L 氮在自然畀中的jg 环—人类活动对自然界氮循环和环境的影响氨气] ----- 由氧气辰血]—常稳定性||与靦的反应 |实脸室制氟12、氮的循环:3、氮及其化合物的衍变关系:N|H J N 2 T NOf> N(3^HN4N^NdNH NH HONk f 、OH 4、 氮氧化物:123 4 5氮及的 化 •訂I 瓯汽I -|氮的固定| -自然固氮与人工固氮氮氧化物——与水前酸的艮应雷电固氮化合物—I 液化INO丈气污染强氧化性旳电(1)氨催化氧化的化学方程式为_____________________ .(2)加热玻璃管2 一段时间后,挤压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应是__________ 反应(填"吸热”或"放热”)(3)为保证在装置4中观察到红棕色气体,装置3应装入____________ ;若取消3,在4中仅观察到大量白烟,原因是_____________________ .(4)为实现氨催化氧化,也可用装置5替换装置____________ (填装置代号);化合物X为 __________ (只写一种),N Q Q的作用是____________________ .【解析】本题考查氨的催化氧化。
(1)NH和O氧化生成NQ (2)该反应为放热,故不加热后仍能保持红热状态。
(3)产物中有NO和NH, NO会被02氧化生成N02在于空气中的水蒸气反应生成HNQ而HNO与NH会产生白烟。
(4)装置5与1均产生科产生NH。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
+2
0
得2×2e- +4 -2
2.二氧化氮(NO2)
(1)物理性质: 常温下为红棕色、有刺激性气味的气体, 与水反应。ቤተ መጻሕፍቲ ባይዱ大气中达到一定浓度时有毒。 (2)化学性质
得1×2e-
3NO2 H 2O 2HNO3 NO
失2×1e-
+4
+5
+2
(二)氮氧化物对环境的污染与防治
1.氮氧化物对环境的污染
N 2O 5
石器时代私服 http://www.shiqishidai.online/ 石器时代私服
vgd81wjw
儿这般古怪的情况,孟婆还是第一次看到,如今听她提起,如何会不兴趣浓浓?“想知道吗?”陆娉儿白他一眼,丝毫不为他的热情所感动。 “想。”孟婆毫不犹豫的点着头。“有多想?”“非常想。”“那就拿出点诚意来,去厨房给姑娘做一顿丰盛的晚宴。”上当,绝对的上当了, 活了几千年的孟婆却被一个年纪不过二十岁的小毛丫头给忽悠了,那是件绝对不能为外人道也的悲惨事情。孟婆心里苦,但孟婆不说„„第003 章 孟婆的阴谋“不过我就觉得有些想不开了,你们那个时代也就是那啥很时髦吗?”吃着碗里的味道还算不错的菜肴,陆娉儿心情极佳,突然 问出了这个一直闷在她心里上百年的疑问。她就一直想不明白,孟婆明明是个男人,并且听说还是某个朝代的状元还做过三品朝官,据说当时 也是妻妾成群儿女绕膝,可从自己认识他以来,他就一直是这么个男不男女不女的东西。难道传说都是假的?“唉!唉!唉!往事不堪回首, 都道是红颜薄命啊!如果奴家也生在这个时代,老娘早就去做变性手术了,然后再和心仪的郎君成双成对,时不我待,命运啊„„”正当陆婉 娉支起耳朵想听一听这些明显与民间传说不相附的关于孟婆的故事的时候,谁知道这孟婆只开了个头,就突然转换了话题。“还是这个时代好, 男的和男的女的和女的都可以结婚了,猫还可以跨种族和狗结婚,狐狸可以娶只狼,哪象我们那个时代啊!不提了,不提了,烦人!小娉儿一 直没回答你那茶水的味道可远不如你在奈何桥前给老娘泡的茶水香醇啊,到底是何种原因?”晃动着一张涂满了胭脂香料的老脸,极其讲究茶 道的孟婆显然还一直在纠结着这个茶水的问题。“还能因为什么?”陆娉儿放下筷子,约略有些郁闷地说道:“还不是环境影响的水质,说一 滴是夸张了,不过现在若想弄些可以够格泡香茶的水,那却是极难寻得的!”“可也是了,这个未来社会虽然给人类提供了极大的方便,却也 让人类生存的环境损毁过半,长此下去可怎么得了啊!比如,这个人类自己不想繁衍后代给自己添累赘,却又怕死,想长生不老吧,一个不小 心把自己弄成了丧尸,还说是什么生化人类,其实这些人即便你的肉/体不死不灭,生寿时间到了,阎王照样来勾了你的魂走,如此留下倒真是 一具行尸走肉了,不过徒老而已,其它还有何意义!”想起这些人类给阴间造成的诸多麻烦,孟婆这位公务员也是长叹了一声,人也跟着严肃 了起来。“谁说不是嘛?顺带着连这些个饭啊菜啊的也都是有色无味的,还是咱们熟悉的古代好!”虽然在说话,做为一个顶级美食家,陆娉 儿却从来不肯让自己的老肠老胃吃亏,即便是有所报怨,却也在不停的给嘴里塞着青菜——不得不说,做为一流美食家,孟婆的手艺确实不容 小觑。“知音啊
第二单元
生产生活中的含氮化合物
一、学习目标 1.认识氮氧化物、氨和铵盐、硝酸等含氮 化合物的性质和用途,知道含氮化合物的应 用对社会生产的作用和对自然环境的影响。 2.知道氮肥的性能和使用氮肥的注意事项, 认识到科学使用化肥的意义。 3.知道工业上生产硝酸的基本原理,了解 硝酸的特性和应用。
空气中氮气的体积分数78%,氧气的体积分 数22%,还有少量的CO2及稀有气体。氮气 是空气的主要成分,氮元素是组成蛋白质的 必需元素,是生命的重要组成元素。但空气 中氮元素的化学性质稳定,只有少数豆科植 物能够直接吸收转化加以利用。直到1919 年,德国化学家哈伯在实验室中首次人工合 成了NH3,才使大规模合成化肥成为现实。 但含氮化合物的使用也给人类生活带来了巨 大的危害!
东京展出富士重工电动汽车概念车R1e
NO2与Br2蒸汽的鉴别:
小结:
N 2O5 H 2O 2HNO3
1。氮气(N2)的化学性质:
N2 O2 放电 2NO
N2 3Mg 点燃 Mg3N2
2。氮的氧化物的化学性质:
2NO O2 2NO2
3NO2 H 2O 2HNO3 NO 4NO2 O 2 2H 2O 4HNO3 4NO 3O 2 2H 2O 4HNO3
3NO2 H 2O 2HNO3 NO
从而使农作物的产量和产品质量得以提高。 大部分氮元素以游离态存在于空气中。一般 情况下,仅有少数植物能将游离态的氮转化为可 吸收的化合态的氮。俗话说“雷雨发庄稼”,那 么,在电闪雷鸣的条件下,游离态的氮是如何转 变为化合态的氮的呢?
在新疆和青海交界处有一狭长山谷,每当牧民和牲畜进入后, 风和日丽的晴天顷刻间电闪雷鸣,狂风大作,人畜往往遭雷击 倒下。奇怪的是这里的牧草茂盛,四季常青,被当地牧民称为 “魔鬼谷”。你能用化学方程式及必要的文字叙述解释“魔鬼 谷”牧草茂盛、四季常青的原因吗?
1.一氧化氮(NO)
(1)物理性质 常温下为无色、无味的气味,不溶于水。在大气中达 到一定浓度时有毒,NO使人体中毒的原理与CO相似,都是 与血红蛋白结合,使其失去输送氧气的功能。 (2)化学性质
2NO O2 2NO2
失2×2e-
(3)用途: 在生物学方面有独特作用,人体中极少量的NO 会促进血管扩张,防止血栓塞等。
(1)酸雨
3NO2 H 2O 2HNO3 NO
(2)光化学烟雾
3O2 NO 2O3 2O3 NO 3O2
(3)对臭氧层的破坏
笼罩曼哈顿的光化学烟雾
洛杉矶光化学烟雾
2.氮氧化物对环境污染的防治 (1)来源: 氮氧化物主要来源于化石燃料的 燃烧,汽车尾气、工厂废气的排 放,其中,汽车尾气是城市大气 中氮氧化物的主要来源之一。 ①开发使用洁净能源; (2)防治:②对工厂排放的废气进行处理 ③对汽车尾气进行净化处理。
一、氮氧化物的产生及转化
(一)氮元素的重要作用
1.生命物质的重要组成元素 2.在生产、科学研究领域的广泛应用
一、氮氧化物的产生及转化
(二)氮氧化物的产生及转化
氮元素是植物生长的必需元素之一。充足的 N O 放电 2NO 氮使植物枝叶茂盛,叶片增大,光合作用增强, 2 2
2NO O2 2NO2
