---铝三角
人教版高中化学必修1课件 “铝三角”的转化关系

“铝三角”的转化关系
(2 ) 沉淀Al(OH)3物质的量为: 3.12g/78g/mol=0.04mol Al3+为0.05mol 1)若Al3+过量,耗NaOH 0.04×3=0.12mol a=2.4mol.l-1 2)若Al3+完全沉淀, Al(OH)3为0.05mol ;耗NaOH 0.15mol, 溶解0.01mol Al(OH)3需NaOH 0.01mol, 共需NaOH 0.16mol ∴a=3.2mol.l-1 从上面的解题过程可以看出,关键是明确化学原理,掌握Al3+ 与OH- 、AlO2-与H+量的相互关系,再进行综合分析。 可见Al3+、Al(OH)3 、AlO2-之间的应用非常广泛,但无论题型 怎样变化,只要掌握了它们之间的相互关系讲就能迎仞而解。
“铝三角”的转化关系 2、 Al(OH)3的制取问题
从“铝三角”可知,制取Al(OH)3的较好途径有:
Al3++3NH3· H2O = Al(OH)3↓+3NH4+
注:不能用强碱
AlO2- +CO2(过量) +2H2O = Al(OH)3↓+HCO3-
注:不能用强酸
“铝三角”的转化关系
例:某无色溶液可能由Ba(NO3)2、MgCl2、KOH、 KHS、Al2(SO4)3中的一种或几种混合而成,在此溶液中 逐滴加入稀HNO3,先产生白色沉淀,而后白色沉淀又会溶 解,则该溶液中所含的溶质是上述物质中的 溶于水得到的。其相互反应的离子方程式 是 。 【解析】由“溶液中逐滴加入稀HNO3,先产生白色沉淀, 而后白色沉淀又会溶解”可得溶液中含AlO2-,并由Al3+和过 量OH-反应得到,因此溶液中所含的溶质为KOH(过量) Al2(SO4) 反应的离子方程式是Al3++4OH-= AlO2-+2H2O
铝三角和铁三角

请讨论以下问题,并给出正确答案。
(1)写出过滤所用仪器名称。 (2)C3+可能是Al3+、Fe3+离子吗?为什么? (3)B2+离子可能是Fe2+离子吗?为什么?
铝三角(sānjiǎo)
例4
(2)在偏铝酸钠溶液中加入盐酸;
(2)当加碱时,OH-立即跟溶液里少量的H+起反应而生成水,平衡向左移
(3)在氢氧化钠溶液中加入氯化铝溶液;
动,同样氢氧化铝也不断溶解。
(4)在等物质的量的氯化镁和氯化铝混合溶液中加入氢氧化钠溶液;
(5)在明矾溶液中加入氢氧化钡溶液。
例1
例2 第八页,共二十四页。
例3
例5 第二十一页,共二十四页。
例6
例7
例8
《几种重要的金属(jīnshǔ)》专题
答案 1.铁架台、铁圈、烧杯、漏斗、玻璃棒。 2.C3+可能是Al3+,因为在酸性条件下,Al3+不与H2S反应,但与过量的氨水反应生 成Al(OH)3沉淀。C3+不可能为Fe3+,因为会发生如下反应: 2Fe3++H2S=2Fe2++S+2H+ 3.B2+不可能是亚铁离子,因为在酸性条件下,Fe2+不能转化成硫化亚铁沉淀
《几种重要(zhòngyào)的金属》专题
例1、Al(OH)3、Al3+、AlO2-之间的相互(xiānghù)关系,用离子方程式正确表示其关系
例1
例2 第三页,共二十四页。
例3
铁三角
铝三角专题

2)向AlCl3溶液中逐滴加入氨水至过量 ) 现象:出现白色沉淀, 现象:出现白色沉淀,且沉淀不消失 Al 方程式: 方程式: 3++3NH3·H2O = Al(OH)3↓+3NH4+
Al(OH)3/mol
0
NH3·H2O/mol
3)向NaOH溶液中滴加 ) 溶液中滴加AlCl3溶液至过量 溶液中滴加 现象:先无现象,后出现沉淀, 现象:先无现象,后出现沉淀,且沉淀不消失 方程式: 方程式: Al3++4OH- = AlO2- +2H2O Al3++3Al02- +6H2O=4Al(OH)3↓
3).Na2CO3溶液和盐酸溶液的鉴别 将其中一种溶液a逐滴加入另一种溶液 中 将其中一种溶液 逐滴加入另一种溶液b中, 逐滴加入另一种溶液 若立即有气泡,则 溶液、 为 若立即有气泡 则a Na2CO3溶液、b为盐酸 溶液; 若开始没有现象,后有气泡 则 为盐酸溶液、 若开始没有现象,后有气泡,则a为盐酸溶液、 b为Na2CO3溶液; 溶液; 为
9)向含有物质的量相等的MgCl2 、AlCl3、 )向含有物质的量相等的 滴加入NaOH至过量 混合溶液中逐 滴加入 至过量
4.互滴法鉴别的物质举例 互滴法鉴别的物质举例 1)AlCl3 溶液和 ) 溶液和NaOH溶液的鉴别 溶液的鉴别: 溶液的鉴别 将其中一种溶液a逐滴加入另一种溶液 中, 将其中一种溶液 逐滴加入另一种溶液b中 逐滴加入另一种溶液 若立即产生沉淀,后来沉淀溶解 则 若立即产生沉淀 后来沉淀溶解,则aNaOH 后来沉淀溶解 溶液、 为 溶液、b为AlCl3溶液; 若开始没有沉淀,后来有沉淀 则 为 若开始没有沉淀 后来有沉淀,则a为AlCl3溶 后来有沉淀 溶液; 液、b为NaOH溶液; 为 溶液
第二讲“铝三角”及其图像
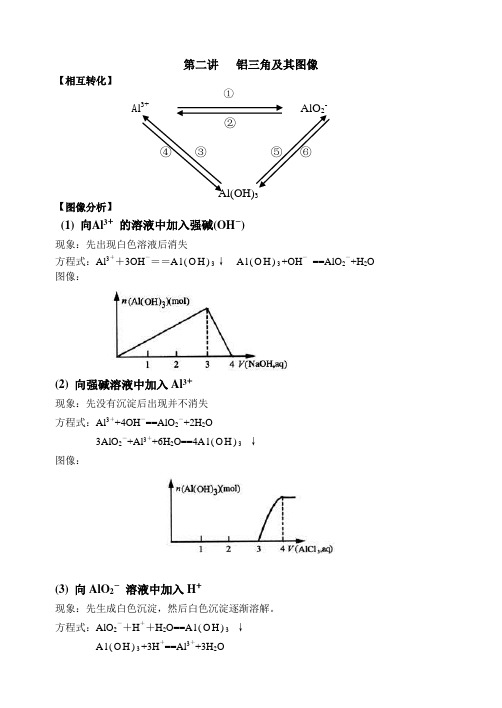
第二讲铝三角及其图像【相互转化】①A l3+AlO2-②④③⑤⑥Al(OH)3【图像分析】(1) 向Al3+的溶液中加入强碱(OH―)现象:先出现白色溶液后消失方程式:Al3++3OH―==A l(O H)3↓A l(O H)3+OH―==AlO2―+H2O 图像:(2) 向强碱溶液中加入Al3+现象:先没有沉淀后出现并不消失方程式:Al3++4OH―==AlO2―+2H2O3AlO2―+Al3++6H2O==4A l(O H)3↓图像:(3) 向AlO2―溶液中加入H+现象:先生成白色沉淀,然后白色沉淀逐渐溶解。
方程式:AlO2―+H++H2O==A l(O H)3↓A l(O H)3+3H+==Al3++3H2O图像:(4) 向H+溶液中加入AlO2―现象:开始生成的白色沉淀振荡后消失,随后生成的白色沉淀不溶解方程式:AlO2―+4H+==Al3++2H2O3AlO2―+Al3++6H2O==4A l(O H)3↓图像:作业:例1、有一定质量的Mg、Al 合金投入100 mL一定物质的量浓度的盐酸溶液中,合金全部溶液,向所得溶液中滴加5 mol/L NaOH溶液到过量,生成沉淀的质量与加入NaOH 溶液的体积关系如图所示,求(1) 原合金中Mg、Al的质量各是多少?(2) HCl的浓度是多少?解:(1) 设原合金中Mg的质量为X,Al的质量为yMg -----M g(O H)2Al-----A l(O H)324 58 27 78x 11.6 y 19.4-11.6==7.8x=4.8 g y == 2.7 g(2) 当沉淀达到最大值时,则n(HCl)==n(NaOH)则c(HCl)== 5*160/100= 8 mol/L[点击试题]1、0.1molAl2(SO4)3跟2mol/L NaOH溶液350mL混合,所得沉淀的质量为( )A.78gB.15.6gC.7.8gD.3.9g2.向10mL 0.2mol/L的AlCl3溶液中,逐滴加入未知浓度的Ba(OH)2溶液,测得滴加15mL 和45mL时,所得沉淀同样多,求Ba(OH)2溶液的物质的量浓度。
高三化学一轮复习 铝三角

证对市爱幕阳光实验学校市惠第一高三化学一轮复习铝三角【学习目标】1、记住铝三角转化的条件与用量。
2、建立数形结合的思维【难点】:铝三角转化的条件与用量。
难点:建立数形结合的思维【使用说明及学法指导】1、完成预习案,形成铝三角完整的知识体系。
2、熟记铝三角转化的条件与用量。
3、建立数形结合的思维预习案知识梳理1. Al3+、Al(OH)3、AlO-2之间的转化关系写出上述转化的离子方程式。
2.与Al(OH)3沉淀生成有关的计算及图像分析(1)把强碱溶液逐滴参加到铝盐(Al3+)溶液中至过量①现象:先有白色沉淀产生,然后沉淀逐渐溶解。
②有关反:A→B:Al3++3OH-===Al(OH)3↓B→D:Al(OH)3+OH-===AlO-2+2H2O③图像④有关计算a.根据AlCl3和NaOH的量计算生成Al(OH)3的量b.根据AlCl3和Al(OH)3的量计算需要NaOH的量(2)把铝盐(Al3+)溶液逐滴参加到强碱溶液中至过量①现象:先无明显现象,然后逐渐产生大量的白色沉淀。
②有关反:A→B:Al3++4OH-===AlO-2+2H2OB→C:Al3++3AlO-2+6H2O===4Al(OH)3↓③图像(3)把强酸溶液逐滴参加到AlO-2溶液中至过量①现象:先生成白色沉淀,随后沉淀逐渐溶解。
②有关反:A→B:AlO-2+H++H2O===Al(OH)3↓B→D:Al(OH)3+3H+===Al3++3H2O③图像④有关计算a.根据NaAlO2和HCl计算生成Al(OH)3的量b.根据Al(OH)3和NaAlO2的量计算需要参加HCl的量(4)向强酸溶液中逐滴参加AlO-2溶液至过量①现象:先无明显现象,反一段时间后逐渐产生白色沉淀。
②有关反:A→B:4H++AlO-2===Al3++2H2OB→C:Al3++3AlO-2+6H2O===4Al(OH)3↓③图像(5)矾溶液中逐滴参加Ba(OH)2溶液至过量①现象:先有白色沉淀生成,然后沉淀溶解。
铝三角

“铝三角”转换关系与其图象问题
1. “铝三角”中相互转化关系
为两性氢氧化物,它在水溶液中存在酸式或碱式两种电离平衡:
同时又可相互转化,其转化关系可用“铝三角”表示为:
2. “铝三角”转化关系中的图象问题
①向溶液中滴加NaOH溶液直到过量
②向NaOH溶液中滴加溶液直至过量
③向溶液中滴加稀氨水直至过量
④向溶液中滴加稀盐酸直至过量
⑤向稀盐酸中滴加溶液直至过量
⑥向溶液中通入气体直至过量
不能用强碱,因为生成的氢氧化铝会继续和强碱反应生成四羟基合铝酸盐。
这样沉淀又溶解了。
离子反应方程式是:Al(OH)3+ OH- = [Al(OH)4]- (四羟基合铝酸根离子,该离子是以配位键形成的。
)
为了防止生成该离子。
所以要用弱碱。
另外,有的教材会说生成偏铝酸根离子(AlO2-)。
反应式是Al(OH)3+ OH- = AlO2- + 2H2O。
但是偏铝酸根是不存在的。
弱酸不能与弱碱反应,在有水存在的条件下,即使发生反应生成盐也会瞬间水解成原来的弱
酸和弱碱。
,。
,基本视为不能反应。
铝三角

元素化合物知识作为其他化学知识的载体,在中学化学中占有举足轻重的地位。
纵观近几年的高考试题,铝、氧化铝、氢氧化铝、常见的铝盐(如氯化铝、明矾等)一直是命题的热点。
Al3+、Al(OH)3、AlO2-的相互转化,应用在离子分离(如Mg2+、Al3+的分离)、共存及推断中的试题屡屡出现。
2001年开始高中化学教学采用了新教材。
不难发现铝这一节的内容与原教材相比,有了较大幅度的调整——将其改编在平衡章节之后,要求学生用平衡的理念来分析。
这势必对学生这一节的学习,提出了更高的要求。
而同为金属的镁、铁的章节却做了大幅度的删减。
因此,大胆假设今后几年试题仍将在Al与酸反应、Al3+与碱反应,AlO2-与酸反应的离子方程式书写以及计算、图象分析等方向作文章。
传统的教学方式中,往往习惯于采用“铝三角”来教学。
铝三角可以表明Al3+、Al(OH)3、AlO2-之间存在一定关联,三者之间可以通过加入酸或者碱相互转化。
然而关键的定量关系(Al3+与OH-相互滴加产物的讨论等)不能通过“铝三角”得以体现。
因为,铝三角忽略了最为关键的一点:AlO2-是Al(OH)3在OH-过量时产生的。
为了解决这一问题,笔者大胆提出“线型”学铝策略。
一.线型学铝概念的提出“线型学铝”策略中所谓的“铝线”,其实就是由H+ Al3+ Al(OH)3 AlO2- OH-五个粒子所构成的一条关系线。
出于H+、OH-与Al3+、Al(OH)3、AlO2-的紧密关系考虑,与“铝三角”不同,“铝线”中加入了H+、OH-这两种离子。
感觉上,粒子数的增加,使问题变的更为复杂;而实际上,只是将原本转换关系中隐藏的粒子更直观、更清晰表现出来。
二.线型学铝概念的剖析“线型学铝”基本内容可以由四句话来概括——相邻粒子不反应,相隔粒子聚中间,隔之越远越易行,所带电荷是关键。
(一)相邻粒子不反应——解决粒子间共存问题有铝元素参加的粒子间共存问题的讨论一直是会考、高考的热点,2004年的浙江省会考试卷中就有两题(第4题、第23题)涉及这一内容。
“铝三角”及其应用

见步步高P42 深度思考11题
- CO2 ② AlO2 适量
途径3:铝盐与偏铝酸盐反应
Al3+
AlO2-
Al(OH)3
3.图像问题 试写出各阶段离子方程式,并作出下列反应图像。
【以所加溶液的物质的量为横坐标,n【 Al(OH)3】为纵坐标)】
①向AlCl3溶液中滴加NaOH溶液直至过量
n[Al(OH)3]
y
y
y
0
a
x
b
0
c
x 0
d
x
实验与图像对应关系正确的是 ( C D )
A. ①和c B. ②和a C. ③和b D. ④和d
点击高考
1.有MgCl2和Al2(SO4)3的混合溶液,向其中 不断加入NaOH溶液得到沉淀的物质的量与 加入NaOH溶液体积的关系如图所示,则溶 液中Mg2+与Al3+的物质的量浓度之________ 1:2
1.离子共存问题
知识归纳: Al3+ 与 OH-、CO32-、HCO3-、AlO2-、S2-、HS-、ClO-、SiO32等不能大量共存 AlO2-与 H+、Al3+、Fe3+、NH4+、 HCO3-等不能大量共存
例:在某化工厂生产中要用到一种无色、可溶于水的晶体——铝 铵矾。该晶体是一种复盐,其主要化学成分为十二水合硫酸铝铵。 向该复盐的浓溶液中逐滴加入浓NaOH溶液,将发生一系列变化。 已知 NH4+与AlO2-在水溶液中不能大量共存,会发生如下反应: NH4++AlO2-+H2O=Al(OH)3↓+NH3↑ 试回答:(1)在硫酸铝铵水溶液中滴入石蕊试液,观察到的现 象______________,其原因是___________________________。 溶液变红 NH4+和Al3+水解使溶液呈酸性 (2)在逐滴加入浓NaOH溶液的过程中,产生的现象有: ①溶液中出现白色沉淀;②有刺激性气味的气体逸出; ③白色沉淀量逐渐增多;④白色沉淀完全消失; ⑤白色沉淀量逐渐减少。 请答出各种现象由先到后出现的顺序(用序号回答): _____→_____→_____→______→______。 ① ③ ② ⑤ ④ (3)写出滴入NaOH溶液的过程中,有关反应的离子方程式:
铝三角”的图像分析及计算高一化学必修第一册精品讲义

“铝三角”的图像分析及计算一、氢氧化铝沉淀的图象分析1、可溶性铝盐溶液与NaOH溶液反应的图像操作可溶性铝盐溶液中逐滴加入NaOH溶液至过量NaOH溶液中逐滴加入可溶性铝盐溶液至过量现象立即产生白色沉淀→渐多→最多→渐少→消失无沉淀(有但即溶)→出现沉淀→渐多→最多→沉淀不消失图像离子方程式A→B:Al3++3OH-===Al(OH)3↓B→D:Al(OH)3+OH-===AlO-2+2H2OA→B:Al3++4OH-===AlO-2+2H2OB→C:Al3++3AlO-2+6H2O===4Al(OH)3↓2、偏铝酸盐溶液与盐酸反应的图像操作偏铝酸盐溶液中逐滴加稀盐酸至过量稀盐酸中逐滴加偏铝酸盐溶液至过量现象立即产生白色沉淀→渐多→最多→渐少→消失无沉淀→出现沉淀→渐多→最多→沉淀不消失图像离子方程式A→B:AlO-2+H++H2O===Al(OH)3↓B→D:Al(OH)3+3H+===Al3++3H2OA→B:4H++AlO-2===Al3++2H2OB→C:Al3++3AlO-2+6H2O===4Al(OH)3↓3、可溶性铝盐溶液与弱碱(氨水)溶液反应的图像、偏铝酸盐溶液与弱酸(CO2)反应的图像操作向AlCl3溶液中逐滴滴入氨水或NaAlO2溶液至过量向NaAlO2溶液中通入CO2至过量现象立即产生白色沉淀→渐多→最多→沉淀不消失立即产生白色沉淀→渐多→最多→沉淀不消失图像离子方程式Al3++3NH3·H2O===Al(OH)3↓+3NH+4Al3++3AlO-2+6H2O===4Al(OH)3↓AlO-2+CO2+2H2O===Al(OH)3↓+HCO-34、可溶性铝盐、镁盐混合液与NaOH溶液反应的图像操作往等物质的量的AlCl3、MgCl2混合溶液中加入NaOH溶液至过量向MgCl2、AlCl3和盐酸的混合溶液(即将Mg、Al溶于过量盐酸所得的溶液)中逐滴滴入NaOH溶液至过量现象开始出现白色沉淀,后沉淀量增多,最后沉淀部分溶解先无沉淀,后出现白色沉淀,然后沉淀量增多,最后沉淀部分溶解图像离子方程式O→A:Al3++3OH-===Al(OH)3↓Mg2++2OH-===Mg(OH)2↓A→B:Al(OH)3+OH-===AlO-2+2H2OO→A:H++OH-===H2OA→B:Al3++3OH-===Al(OH)3↓Mg2++2OH-===Mg(OH)2↓A→B:Al(OH)3+OH-===AlO-2+2H2O5、含不同阳离子的混合盐(或复盐)与碱的反应(1)向含MgCl2、AlCl3、盐酸、NH4Cl的混合溶液中,逐滴加入NaOH溶液至过量图像离子方程式O→A:H++OH-===H2OA→B:Al3++3OH-===Al(OH)3↓,Mg2++2OH-===Mg(OH)2↓B→C:NH+4+OH-===NH3·H2OC→D:Al(OH)3+OH-===AlO-2+2H2O(2)把Ba(OH)2溶液逐滴加入到明矾溶液中至过量图像离子方程式O→A:2KAl(SO4)2+3Ba(OH)2===2Al(OH)3↓+3BaSO4↓+K2SO4 A→B:2Al(OH)3+K2SO4+Ba(OH)2===BaSO4↓+2KAlO2+4H2O二、常见题型类型一图像认识1、向含有盐酸的AlCl3 溶液中慢慢滴入NaOH 溶液,生成沉淀W(g)与所加NaOH 溶液体积V的关系如下图,其中正确的是( )2、如图表示AlCl3溶液与NaOH溶液相互滴加过程中微粒的量的关系曲线,下列判断错误的是()A.①线表示Al3+的物质的量的变化B.x表示AlCl3的物质的量C.③线表示Al(OH)3的物质的量的变化D.④线表示AlO-2的物质的量的变化3、下列实验操作对应的图像不正确的是()选项实验操作图像A 向MgCl2、AlCl3溶液中(各1 mol),逐滴加入NaOH溶液B 向HCl、MgCl2、AlCl3、NH4Cl溶液中(各1 mol),逐滴加入NaOH溶液C 向NaOH、NaAlO2溶液中(各1 mol),逐滴加入HCl溶液D 向NaOH、Na2CO3混合溶液中(各1 mol)滴加稀盐酸类型二有关图像的计算1、向30mL1mol·L-1的AlCl3溶液中逐渐加入浓度为4mol·L-1的NaOH溶液,若产生0.78g白色沉淀,则加入的NaOH溶液的体积可能为()A.3mL B.7.5mL C.15mL D.17.5mL2、现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如下图所示,原溶液中Cl-与SO2-4的物质的量之比为()A.1∶3 B.2∶3 C.6∶1 D.3∶13、向混有一定量盐酸的硫酸铝和硫酸镁混合溶液中,逐滴加入2mol/L的NaOH 溶液,所生成沉淀W g 与加入NaOH 溶液的体积V( mL)如图所示,则原混合溶液中c(Cl-)、c(Al3+)、c(Mg2+)之比为 ()A.1:3:1 B.1:2:1 C.1:1:2 D.1:1 :14、某溶液中可能含有H+、NH+4、Mg2+、Al3+、Fe3+、CO2-3、SO2-4、NO-3中的几种。
金属及其 化合物 铝三角及图像

第三章 金属元素及其化合物 第6课时 “铝三角” 和铝的图像
复习重点: 1、铝三角。 2、有关铝的图像问题。 复习难点:有关铝的图像问题。
华美实验学校
曾维玲
一、铝三角的相互转化 Al
12
13
Al2O3
⑦
Al(OH)3
Al3+
⑥ ⑤
AlO2—
写出上图铝三角中转化的离子反应方程式:
13
F2>O2>Cl2 > Br2 >Fe3+> I2 > S
AlO2-、Al(OH)3、OH-、 CO32- OH-、AlO2-、CO32- 、HCO3- 、 Al(OH)3 B.在含等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:
I-、Br-、Fe2+ I-、Fe2+ 、Br-
C.在含等物质的量的Ba(OH)2、KOH的溶液中缓慢通入CO2:
KOH、Ba(OH)2、BaCO3 Ba(OH)2、KOH、 K2CO3、 BaCO3
D.在含等物质的量的Fe2+、Ag+、Cu2+、H+的溶液中加入锌粉: Ag+、Cu2+、H+、Fe2+
K Ca Na Mg Al Zn Fe SnPb(H)Cu Hg Ag Pt Au 单质还原性越来越弱
K +Ca2+ Na +Mg2+ Al3+ Zn2+ Fe2+ Sn2+Pb2+(H+)Cu 2+ Fe3+ Hg2+ Ag+ 离子氧化性越来越强
当堂训练
1.向AlCl3溶液中滴加NaOH溶液,加入的NaOH溶液的体积与沉 淀的质量之间的关系如右图所示: (1)图中A点表示的意义是
高中化学铝三角图像相关计算专项突破

1.向含有a mol AlCl3的溶液中加入含b mol NaOH的溶液,生成沉 淀的物质的量可能是( )
①a mol ②b mol ③a/3 mol ④b/3 mol
⑤0 mol
⑥(4a-b)mol
A.①③④⑤⑥ B.①②④⑥
C.①②③⑤⑥ D.①③⑤
a mol AlCl3完全转化为Al(OH)3时需要NaOH的物质的量 为3a mol,且沉淀最大值为a mol,故①、③、⑤有可能;
(1)等量铝分别与足量盐酸和氢氧化钠溶液反应,产生氢气体积
比
VH2HCl VH2NaOH
=11
。
(2)足量的铝分别与等物质的量的盐酸和氢氧化钠溶液反应,产生氢气的
体积比 VH2HCl =1 。 VH2NaOH 3
(3)一定量的铝分别与一定量的盐酸和氢氧化钠溶液反应,产生氢气的体
积比
1 3
< VH2HCl VH2NaOH
二、向 NaOH溶液中滴加AlCl3溶液至过量
1、实验现象:
3、图像
⑴ NaOH溶液中出现白色 n沉淀 沉淀后迅速溶解,
B
⑵继续滴加AlCl3溶液沉 淀突然增多后保持不变。 2、反应离子方程式
0
1
2
3 A
4 VAlCl3
⑴Al3++4OH-= AlO2-+2H2O ⑵Al3++ 3AlO2-+6H2O =4Al(OH)3↓
答案:
2.⑤表示滴入NaOH溶液产生沉淀质量最大点
⑥表示滴入NaOH溶液沉淀恰好完全溶解点
⑦7.5 mL或17.5 mL
3.现有 AlCl3 和 MgSO4 混合溶液,向其中
不断加入 NaOH 溶液,得到沉淀的量与
铝三角及其图像

铝三角的未来展望
铝三角在汽车、航空、建筑等领域的应用将更加广泛 铝三角的回收利用技术将得到进一步发展提高资源利用率 铝三角的加工技术将不断进步提高产品质量和生产效率 铝三角的价格将受到全球经济形势和供需关系的影响波动较大
感谢您的耐心观看
汇报人:
反应原理:铝与水 反应生成氢氧化铝 氢氧化铝与酸反应 生成铝盐和水
动力学:反应速率 与反应物浓度、温 度、催化剂等因素 有关
应用:铝三角的化 学反应动力学在冶 金、化工等领域有 广泛应用
铝三角的应用
铝三角在工业上的应用
铝三角在汽车工业中的应用:用于 制造汽车车身、发动机、底盘等部 件
铝三角在航空航天工业中的应用: 用于制造飞机、火箭、卫星等航空 航天器
铝三角的应用: 广泛应用于建筑、 汽车、电子等领 域
铝三角的图像: 三角形其中两个 顶点是铝原子另 一个顶点是氧原 子
铝三角的组成元素
铝元素:铝是 铝三角的主要 元素具有轻质、 导电性好、耐
腐蚀等优点
氧元素:氧是 铝三角的重要 组成部分与铝 元素结合形成
氧化铝
碳元素:碳元素 在铝三角中起到 稳定和增强的作 用与铝元素结合
铝三角的研究现状
铝三角的概念和 定义
铝三角的组成和 结构
铝三角的应用领 域和前景
铝三角的研究方 法和技术
铝三角的研究成 果和进展
铝三角的发展趋 势和展望
铝三角的发展趋势
铝三角在汽车、航空、建筑等领域的应用将更加广泛 铝三角的加工技术将更加先进提高生产效率和产品质量 铝三角的环保性能将得到进一步改善减少对环境的影响 铝三角的价格将更加稳定降低企业的生产成本
添加副标题
铝三角及其图像
汇报人:
目录
高一化学必修一知识点:铝三角

高一化学必修一知识点:铝三角高一化学必修一知识点:铝三角铝是高中化学重要的金属,主要有铝、氧化铝、氢氧化铝。
高考化学中铝的考点主要集中的铝及其化合物的两性,即既可以与酸反应,也可以与碱反应。
点击图片可在新窗口打开铝三角主要体现了铝及其化合物的两性一、单质铝(Al)铝是一种活泼金属,具有金属的共性,能够与非金属、酸、某些盐反应,同时具有自己特有的性质,可以与碱反应。
铝极易失去最外层3个电子形成铝离子:Al-3e-=Al3+。
1.铝与非金属反应铝可以与大多数非金属单质反应,如氧气、氯气、硫、溴等,生成相应的氧化物或盐。
4Al+3O2点击图片可在新窗口打开2Al2O3;2Al+3S点击图片可在新窗口打开Al2S3;2Al+3Cl2点击图片可在新窗口打开2AlCl3;2.铝与酸反应这里所说的酸,主要指稀硫酸和稀盐酸,常温常压下,铝遇浓硫酸或浓硝酸会发生钝化,所以可用铝制容器盛装浓硫酸或浓硝酸。
注意钝化也属于化学变化。
2Al+6HCl=2AlCl3+3H2↑;2Al+3H2SO4=Al2(SO4)3+3H2↑;3.铝与强碱反应大多数金属不与碱反应,与强碱反应,是铝特有的性质,(锌也可以发生类似的反应,了解即可)2Al+2NaOH+2H2O==2NaAlO2+3H2↑;对应离子方程式:2Al+2OH-+2H2O==2AlO2-+3H2↑;该反应的本质是铝首先与水反应,生成氢氧化铝与氢气,2Al+6H2O=2Al(OH)3+3H2↑;然后,氢氧化铝与氢氧化钠反应,2Al(OH)3+2NaOH=2NaAlO2+4H2O。
在整个过程中,水是氧化剂,而氢氧化钠不是氧化剂。
在解答电子转移和电线桥双线桥法的题目中要注意。
4.铝热反应铝热反应是指铝在高温条件下还原金属氧化物,置换金属单质的一种反应,不是特指与铝与氧化铁的反应。
2Al+Fe2O3点击图片可在新窗口打开2Fe+Al2O3,铝具有较强的还原性,可以还原一些金属氧化物,如氧化钨,二氧化锰等等。
高一化学_必修1_铝三角图象问题分解

n[沉淀]
2 1
Al(OH)3 + OH- = AlO2- + 2H2O
n(NaOH)
1 2 3 4 5 6 7
12.往OH- 、AlO2- 、 Mg(OH)2各 1mol的 混合溶液中加入盐酸至过量
铝的化合物之间转化关系
铝“三角” AlO2-
Al
3+
4OH-
4H+
Al(OH)3
双水解
按以上关系写出离子方程式
1. Al3+ + 3OH- = Al(OH)3↓
2. Al(OH)3 + OH- = AlO2- + 2H2O 3. Al3+ + 4OH- = AlO2- + 2H2O
4. AlO2- + H+ + H2O =Al(OH)3↓ 5. Al(OH)3 + 3H+ = Al3+ + 3H2O 6. AlO2- + 4H+ = Al3+ + 2H2O 7. Al3+ + 3AlO2- + 6H2O= 4Al(OH)3↓
6.往AlCl3溶液中滴加入氨水至过量
Al3+ +3NH3.H2O = Al(OH)3↓+3NH4+
1
n[Al(OH) ] ↓
3
1
2
3
4
n( NH3.H2O
)
7.往AlCl3溶液中加入NaAlO2溶液
高一化学-必修1-铝三角图象问题

02
添加标题
Al3+ ---- 4OH- ---AlO2-
04
添加标题
AlO2- ---- 4H+ ---Al3+
1.往AlCl3溶液逐滴加入NaOH溶液至过量
1
添加标题
Al3+ + 3OH- = Al(OH)3↓
4
添加标题
有关铝化合物的图像问题
2
添加标题
1
5
添加标题
n(NaOH)
3
添加标题
Al(OH)3 + OH- = AlO2- + 2H2O
=2Al(OH)3↓+CO32-
5
或AlO2-+CO2 +2H2O
=Al(OH)3↓+HCO3-
01
Al3+ + 3OH- = Al(OH)3 ↓
OH-+H+ = H2O
02
Al(OH)3 + OH- = AlO2- + 2H2O
n[Al(OH)3] ↓源自10.往AlCl3 HCl混 合溶液中加NaOH至 过量
5.往NaAlO2和NaOH混合溶液中加入 HCl溶液至过量
OH-+H+ = H2O AlO2- + H+ + H2O =Al(OH)3↓ Al(OH)3 + 3H+ = Al3+ + 3H2O
n[Al(OH)3] ↓
1
3 4 5 n(HCl)
添加标题
往AlCl3溶液中滴加入氨水至过量
添加标题
1
点击添加副标题
【练】《创新方案》P33实 验, P34课堂反馈
高中化学铝三角转换关系与其图象问题

“铝三角”转换关系与其图象问题1. “铝三角”中相互转化关系为两性氢氧化物,它在水溶液中存在酸式或碱式两种电离平衡:,同时又可相互转化,其转化关系可用“铝三角”表示为:应用:判断离子共存及Al(OH)3的制备Al3+只存在于强酸性溶液中,-2AlO只存在于强碱性溶液中,Al3+与-2AlO不能共存。
制备Al(OH)3一般用Al3++NH3·H2O或-2AlO+CO2+H2O。
铝盐和强碱溶液反应的计算:铝盐和强碱溶液作用生成Al(OH)3的计算反应关系:①Al3++3OH-====Al(OH)3↓(生成沉淀)②Al(OH)3+OH-====-2AlO+2H2O(沉淀溶解)③Al3++4OH-====-2AlO+2H2O(沉淀生成,又恰好全溶解)分析上述三个反应关系,可以建立如下计算Al(OH)3沉淀量生成的关系式:当n(Al3+)/n(OH-)≥1/3时,m〔Al(OH)3〕=78 g·mol-1·n(OH-)/3;当n(Al3+)/n(OH-)≤1/4时,m〔Al(OH)3〕=0;当1/4<n(Al3+)/n(OH-)<1/3时,m〔Al(OH)3〕=78 g·mol-1·[4n(Al3+)-n(OH)-]。
例1:有镁、铝混合粉末10.2 g,将它溶于500 mL 4 mol·L-1的盐酸中,若要使沉淀质量达到最大值,则需加入2 mol·L-1的氢氧化钠溶液的体积为()A.1 000 mLB.500 mLC.100 mLD.1 500 mL解析:依题意,先写出有关反应的化学方程式:Mg+2HCl====MgCl2+H2↑2Al+6HCl====2AlCl3+3H2↑MgCl2+2NaOH====Mg(OH)2↓+2NaClAlCl3+3NaOH====Al(OH)3↓+3NaCl依化学方程式,仅当镁、铝全部以Mg(OH)2、Al(OH)3沉淀,即沉淀质量达到最大值时,溶液中只存在NaCl,故当沉淀的量最多时n(NaOH)=n(HCl)。
