s区ds区d区重要元素及其化合物测验题与答案
第11章s、ds、d区常见元素及其主要化合物

稳定性: O2- > O2- > O22-
(4)性质:
与 H2O 的作用: M2ⅠO + H2O →2MOH(Li→Cs 剧烈程度↑) (MⅡO + H2O →2M(OH)2(BeO 除外) Na2O2 + 2H2O →2NaOH + H2O2 2KO2 + 2H2O →2KOH + H2O2 + O2 与 CO2 的反应: Li2O + CO2 →LiCO3 2Na2O2 + 2CO2 →2Na2CO3 + O2 4KO2 + 2CO2 →2K2CO3 + 3O2 熔点及硬度:
第 11 章 s、ds、d 区常见元素及其主要化合物
CHAP.11 s,ds,d BLOCK ELEMENTS AND THEIR MAIN COMPOUNDS
11.1 s 区常见元素及其主要化合物
s BLOCK MAIN ELEMENTS THEIR MAIN COMPOUNDS
11.1.1 s 区元素的通性
较典型的是碱土金属氧化物.
BeO MgO CaO SrO BaO
熔点/℃
2530 2852 2614 2430 1918
硬度(金刚石=10) 9 5.5 4.5 3.5 3.3
M-O 核间距/pm 165 210 240 257 277
另外要注意, Na2O2 在熔融时几乎不分解,但遇棉花,木炭以及其它有机物或铝粉等还原性物质时易发生爆 炸.
2.氢氧化物:
LiOH
NaOH
KOH
RbOH
CsOH
中强 强
强
强
强
Be(OH)2 Mg(OH)2 Ca(OH)2 Sr(OH)2 Ba(OH)2
ds区元素答案

ds 元素 答案一、选择题:1. (1588) (C)2. (4372) (C)3. (4588) (D)4. (4532) (C)5. (1570) (D)6. (1562) (A)7. (3683) (B)8. (4599) (C)9. (4513) (A) 10. (4422) (A)11.(4548) (B) 12. (1516) (D)二、填空题:13. (4512) Hg 2Cl 2见光分解为有毒物Hg 和HgCl 2:Hg 2Cl 2−−→−νh Hg + HgCl 214. (7645) >,<,<,>15. (1687) 从上至下容易出现较稳定的低氧化态(或从上到下高氧化态稳定性下降) 从上至下容易出现较稳定的高氧化态 IB IIB16. (4589)先有蓝色沉淀生成,H 2SO 4过量则沉淀溶解得蓝色溶液。
2[Cu(NH 3)4]SO 4 + 3H 2SO 4 + 2H 2O = Cu(OH)2·CuSO 4↓ + 4(NH 4)2SO 4Cu(OH)2·CuSO 4 + H 2SO 4 = 2CuSO 4 + 2H 2O17. (4585) Cu + 2CN - + H 2O =Cu(CN)2- +1H 2 + OH - ;4Cu + 8CN - + O 2 + 2H 2O = 4Cu(CN)2- + 4OH -18. (1502) Cu(OH)2和Ga(OH)319. (1551) 4+23)Cu(NH + O 2 + 8NH 3 + 2H 2O = 4+243)Cu(NH + 4OH -深蓝色20. (4580) Hg 2Cl 2,HgNH 2Cl ,Hg ,灰黑21. (4503) Hg 2(NO 3)2 + 4KCN = K 2[Hg(CN)4] + Hg ↓+ 2KNO 3无色溶液,同时试管底部有灰黑色Hg ↓。
22. (1553) +22Hg + 4I - = [HgI 4]2- + Hg(灰黑)↓23. (1596) Ag 2O ,HgO 和Hg ,-24Zn(OH),Cd(OH)2三、计算题:24. (4539) (1) ϕ(Hg 2Cl 2/Hg) = ϕ(+22Hg /Hg) +20591.0 lg K sp (Hg 2Cl 2)所以 ϕ(+22Hg /Hg) = ϕH g 2Cl 2/Hg) - 20591.0 lg 4.0 ⨯ 10-18= 0.2829 - 20591.0⨯ (-17.40) = 0.797 (V)Hg 2+ ──────── +22Hg ──────── Hg0.905 V 0.797 V│ │?所以 ϕ(Hg 2+/Hg) =2/Hg)(Hg )/Hg (Hg 22222++++ ϕϕ= 0.851 (V) lg K 稳 =0591.0)370.0851.0(2059.0/Hg))(Hg(CN)-/Hg)(Hg (-242+=+ ϕϕz = 41.3 K 稳 = 2 ⨯ 1041(2) K = [Hg]][Hg 22+ Hg 2+ + Hg =Hg E = 0.108 V lg K =0591.0108.010591.0⨯=⨯ E z = 1.83 K = 67.2 (3) 四面体形。
无机化学题库14-ds区元素

H2S,全部沉淀的一组离子是……………………………………………………………( )
(A) Mn2+,Cd2+,Cu2+
(B) Cd2+,Mn2+
(C) Pb2+,Mn2+,Cu2+
(D) Cd2+,Cu2+,Pb2+
5. 1 分 (1518)
下述有关银的性质的正确论述是………………………………………………………( )
⑤
Hg
2+ 2
+
NH3·H2O
⎯⎯→
金属离子氧化态发生变化的是………………………………………………………………( )
(A) ①②③④
(B) ①②③⑤
(C) ①②④⑤
(D) ②③④⑤
4. 2 分 (1516)
在含有 0.1 mol·dm-3 的 Pb2+、Cd2+、Mn2+ 和 Cu2+ 的 0.3 mol·dm-3 HCl 溶液中通入
把阳离子按 H2S 系统分组时,属于同一组的是………………………………………( )
(A) Cu2+,Ag+
(B) Au3+,Cd2+
(C) Cu2+,Zn2+
(D) Cu2+,Cd2+
34. 2 分 (4543)
因 Ag 中常含有少量的铜,在制备 AgNO3 时必须除去 Cu,可用的方法是……………( ) (A) 控制温度热分解含 Cu(NO3)2 的 AgNO3 (B) 向 AgNO3 溶液中加新制备的 Ag2O (C) 电解 AgNO3 溶液 (D) (A) (B) (C)均可
20. 2 分 (1588) 下列的阳离子中,能与 Cl− 离子在溶液中生成白色沉淀,加氨水时又将转成黑色的
无机化学s区元素测试题及答案

无机化学s区元素测试题及答案一、选择题(每题2分,共10分)1. 以下哪种元素属于s区元素?A. 锂(Li)B. 钠(Na)C. 氧(O)D. 氯(Cl)答案:B2. s区元素的价电子排布是什么?A. ns^2B. ns^2np^xC. nd^xns^2D. (n-1)d^xns^2答案:A3. s区元素中,哪个元素的原子半径最大?A. 锂(Li)B. 钠(Na)C. 钾(K)D. 铯(Cs)答案:D4. s区元素中,哪个元素的电负性最高?A. 锂(Li)B. 钠(Na)C. 钾(K)D. 铯(Cs)答案:A5. 下列化合物中,哪一个是s区元素形成的?A. NaClB. MgOC. SO2D. CO2答案:A二、填空题(每题2分,共10分)1. s区元素包括碱金属元素和______元素。
答案:碱土金属2. 碱金属元素的原子序数从______到______。
答案:3 到 113. 碱土金属元素的原子序数从______到______。
答案:12 到 184. s区元素的电子亲和能通常______。
答案:较低5. s区元素的电负性通常______。
答案:较低三、简答题(每题5分,共20分)1. 描述s区元素的一般化学性质。
答案:s区元素通常具有较低的电负性,容易失去最外层的电子形成阳离子,表现出强碱性,与水反应生成氢气和相应的碱。
2. 解释为什么碱金属元素的原子半径随着原子序数的增加而增大。
答案:碱金属元素的原子半径随着原子序数的增加而增大,是因为随着核电荷的增加,电子云的屏蔽效应增强,使得外层电子受到的吸引力减弱,从而导致原子半径增加。
3. 碱土金属元素与碱金属元素相比,其化学性质有何不同?答案:碱土金属元素的电负性比碱金属元素高,因此它们更容易形成化合物,并且它们的金属性比碱金属元素弱。
4. 举例说明s区元素在日常生活和工业中的应用。
答案:s区元素在日常生活和工业中有广泛的应用,例如钠(Na)用于制造食盐,钾(K)用于农业肥料,钙(Ca)用于建筑材料和骨骼强化,铯(Cs)用于原子钟等。
s区、d区、ds区重要元素及其化合物
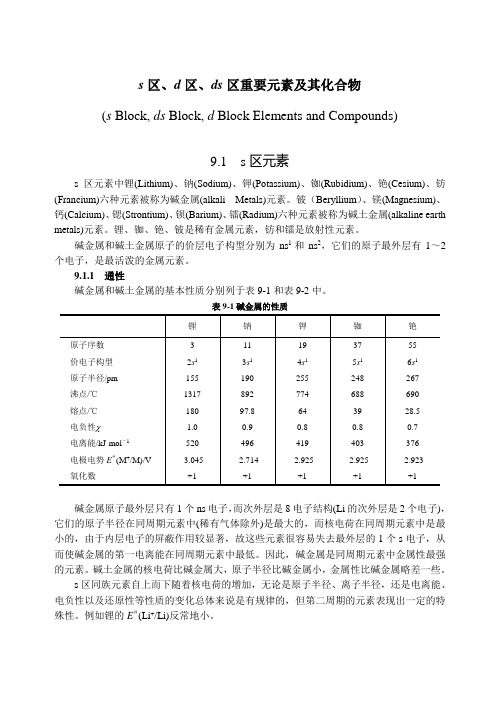
s区、d区、ds区重要元素及其化合物(s Block, ds Block, d Block Elements and Compounds)9.1 s区元素s区元素中锂(Lithium)、钠(Sodium)、钾(Potassium)、铷(Rubidium)、铯(Cesium)、钫(Francium)六种元素被称为碱金属(alkali Metals)元素。
铍(Beryllium)、镁(Magnesium)、钙(Calcium)、锶(Strontium)、钡(Barium)、镭(Radium)六种元素被称为碱土金属(alkaline earth metals)元素。
锂、铷、铯、铍是稀有金属元素,钫和镭是放射性元素。
碱金属和碱土金属原子的价层电子构型分别为ns1和ns2,它们的原子最外层有1~2个电子,是最活泼的金属元素。
9.1.1 通性碱金属和碱土金属的基本性质分别列于表9-1和表9-2中。
表9-1碱金属的性质碱金属原子最外层只有1个ns电子,而次外层是8电子结构(Li的次外层是2个电子),它们的原子半径在同周期元素中(稀有气体除外)是最大的,而核电荷在同周期元素中是最小的,由于内层电子的屏蔽作用较显著,故这些元素很容易失去最外层的1个s电子,从而使碱金属的第一电离能在同周期元素中最低。
因此,碱金属是同周期元素中金属性最强的元素。
碱土金属的核电荷比碱金属大,原子半径比碱金属小,金属性比碱金属略差一些。
s区同族元素自上而下随着核电荷的增加,无论是原子半径、离子半径,还是电离能、电负性以及还原性等性质的变化总体来说是有规律的,但第二周期的元素表现出一定的特殊性。
例如锂的EΘ(Li+/Li)反常地小。
表9-2碱土金属的性质s区元素的一个重要特点是各族元素通常只有一种稳定的氧化态。
碱金属的第一电离能较小,很容易失去一个电子,故氧化数为+1。
碱土金属的第一、第二电离能较小,容易失去2个电子,因此氧化数为+2。
在物理性质方面,s区元素单质的主要特点是:轻、软、低熔点。
元素化学—s区、d区、ds区元素及其重要化合物

锌盐
与S2-的作用 Zn2+ + H2S → ZnS(s,白) ,氨碱性条件下沉淀完全,溶于0.3 mol-1的HCl ZnSO4(aq) BaS(aq) ZnSBaSO4(s,白) 锌钡白(立德粉)
汞盐
为什么氯化亚汞分子式要写成 Hg2Cl2而不能写成 HgCl ?
汞除了形成氧化数为+2的化合物外,还有氧化数为+1的化合物。在氧 化数为+1的汞的化合物中,汞以(—Hg—Hg—)形式存在。Hg(Ⅰ) 的化合物叫亚汞化合物。试验证明其中的汞离子是{Hg-Hg}2+,而不是 Hg+。
2Cd O2 2CdO(s,红棕色)
2Hg O2
360 2HgO(s,红、黄)
470
ห้องสมุดไป่ตู้
潮湿
4Zn 2O2 CO2 3H2O ZnCO3 3Zn(OH)2 碱式碳酸锌
单质的化学性质
(2) 与S的 作用
溶
ZnS(白)
解
度
M+S
MS
CdS(黄)
依 次
HgS (红、黑)
减 小
氧化物与氢氧化物
铜盐
CuSO4·5H2O称为胆矾,呈蓝色
CuSO 4 5H 2O 102C CuSO 4 3H 2O 113C CuSO 4 H 2O 258C CuSO 4
无水CuSO4为白色粉末,易溶于水,吸水性强,吸水后呈蓝色, 可检验有机液体中的微量水分
铜盐
CuSO4溶液中加入氨水,先生成浅蓝色的碱式硫酸铜沉淀: 2Cu2+ + SO42-+ 2NH3∙H2O = Cu2(OH)2SO4(s) + 2NH4+
基 础 化 学
ds区元素
ch09 s,d,ds元素题解

Ch9 s 区、ds 区、d 区元素及其重要化合物P261-1,2,14,15*,16,18*,26,27,28,29,[9-1] 与同族元素相比,锂、铍有哪些特殊性?答:Li :因为锂半径特别小,晶格能大,特殊性如下: ①熔点、沸点和硬度高于其他碱金属,而导电性差; ②Li+水合热特别大,故Li 比Na 更易水合; ③Li 难生成过氧化物,能形成稳定的配合物; ④LiOH 溶解度极小,受热易分解不稳定;⑤Li 化合物有共价性,故能溶于有机溶剂中。
Be :① 熔点、沸点、硬度高于其他碱土金属,但都有脆性。
② Be 的氯化物有共价性,热稳定性较差易升华,易聚合, 易溶于有机溶剂(与Al 相似);③ Be 的氧化物熔点高、硬度大 (与Al 相似),具有两性,难溶于水; ④ Be(OH)2为两性,难溶于水(与Al 相似)。
[9-2] 现有五种白色固体粉末,它们可能分别是:MgCO 3、BaCO 3、无水Na 2CO 3、无水CaCl 2及无水Na 2SO 4。
试设法加以鉴别,并写出反应式。
解:有关反应式 :BaCO 3 + 2HCl BaCl 2 + H 2O + CO 2↑ MgCO 3 + 2HCl MgCl 2 + H 2O + CO 2↑ Na 2CO 3 + 2HCl 2NaCl + H 2O + CO 2↑ BaCl 2 + H 2SO 4BaSO 4↓+ 2HCl MgCl 2 + 2NaOH Mg(OH)2↓+ 2NaCl Na 2SO 4 + BaCl 2BaSO 4↓+ 2NaCl[9-14] 溶液中含有Fe 3+、Co 2+和Ni 2+,如何把它们分别鉴定?解:(s)Fe][KFe(CN)xK ]x[Fe(CN)xFe x 6463−→−+++-+蓝色(普鲁士蓝,示有Fe 3+)或Fe 3+6NC S -→Fe(NCS)63-血红色(示有Fe 3+)Co 2+ +4NC S -(过量)−→−乙醚Co(NCS)42-有机层蓝色(示有Co 2+)Ni 2+ + 2DMG (丁二肟)NH 32NH 4++Ni(DMG)2↓鲜红色(示有Ni 2+)[9-15]* 写出下列有关反应式,并说明反应现象。
第12章 s区和ds区元素吉林大学无机化学
原 子 半 径 增 大 , 金 属 性 增 强
IA
Li Na K Rb Cs
IIA
Be Mg Ca Sr Ba
原子半径减小,金属性减弱
特殊性:Li 的 E 值负值最大
硫脲
HCl
③ Cu,Ag,Au可溶于氧化性酸
Cu 4HNO 3 (浓) Cu(NO 3 ) 2 2NO 2 2H 2 O Ag 2HNO 3 (浓) AgNO 3 NO 2 H 2 O Cu 2H 2 SO 4 (浓) CuSO 4 SO 2 2H 2 O 2Ag 2H 2 SO 4 (浓) Ag 2 SO 4 (s) SO 2 2H 2 O Au 4HCl( 浓) HNO 3 (浓) H[AuCl 4 ] NO(g) H 2 O
第12章
s区和ds区元素
1.金属单质的物理性质
s区和ds区元素通常仅以s电子参与成键,故熔点、 沸点、气化热等低于其他d区元素。特别是Hg,由 于6s电子的“惰性电子对效应”形成的金属键更弱, 故在温室下为液体。
2. 化学性质-s区元素
s区金属原子半径大、核电荷数小,单质 易失去最外层电子而表现很强的还原性
(4) 锌与OH-,NH3反应
Zn 2OH 2H 2 O Zn(OH) 2 4 H2
Zn 4NH 3 2H 2 O Zn(NH )
2 3 4
H 2 2OH
3.重要化合物
(1 ) 铜的化合物
常见氧化数:+1 (3d10), +2 (3d9)
ds区元素.习题

ds 区元素1、试从原子结构方面说明铜族元素和碱金属元素在化学性质上的差异。
解:铜族元素价电子层结构为(n -1)d 10ns 1,与碱金属元素相比,最外层电子数相同,都是ns 1,而次外层电子数目不同,铜族元素次外层为18电子,而碱金属次外层8个电子,18电子的屏蔽比8电子要小得多,铜族的有效核电荷多,最外层s 电子受核的引力强,不易失去,相应的电离势高,原子半径小。
故与碱金属元素在化学性质上有很大的差异。
2、简述:(1)怎样从闪锌矿冶炼金属锌?(2)怎样从辰砂制金属汞?解:(1)闪锌矿通过浮选法得到含有ZnS 40—60%的精矿后,加以焙烧使它转化为氧化锌再把氧化锌和焦碳混合,在鼓风机中加热至1473—1573K ,使锌蒸馏出来,主要反应为:2ZnS + 3O 2 == 2ZnO + 2SO 22C + O 2 == 2COZnO + CO == Zn(g) + CO 2(2)辰砂在空气中焙烧与铁或氧化钙共热都可以得到汞:HgS + O 2 Hg + SO 2↑HgS + Fe == FeS + Hg4HgS + 4CaO == 4Hg + 3CaS + CaSO 44、利用金属的电极电势值,说明铜、银、金在碱性氰化物水溶液中被溶解的原因,空气中的氧对溶解过程有何影响,CN -离子在溶解液中的作用是什么?答: θϕCu/Cu 2+= 0.3402V θϕCu /Cu += 0.522V θϕAg /Ag + = 0.799V θϕA u /A u +=1.68V O 2 + 4H +(10-7mol ·L -1) + 4e == 2H 2OθϕO H /O 22= 0.814V 当溶解液中存在NaCN 时,CN -能与Cu +、Ag +、Au +形成稳定的配离子,Cu +、Ag +、Au +浓度大大降低,使它们的电势也降低很多,它们的还原能力大为提高,这时空气中的氧就能将它们氧化为配离子而溶解:[Cu(CN)2]-+ e == Cu + + 2CN - θE = -0.43V [Ag(CN)2]- + e == Ag + 2CN -θE = -0.31V [Au(CN)2]- + e == Au + 2CN - θE = -0.6VO 2 + 2H 2O + 4e == 4OH -θE = 0.401V溶液中[H +]应根据CN -水解计算,当[CN -]=1mol ·L -1时,水解得到溶液中的[H +]=10-12 mol ·L -1,故下面的溶解反应能进行。
元素周期表,元素周期律练习题

元素周期表,元素周期律练习题【知识框架】【基础回顾】一、元素周期表1、元素周期表的编排原则(1)横行:把电子层数相同的元素按原子序数递增的顺序从左至右排成横行。
(2)纵行:把不同横行中最外层电子数相等的元素,按电子层数递增的顺序,由上而下排成纵行。
2、元素周期表的结构(1)周期(七个横行,七个周期)(2)族(18个纵行,16个族)3.元素周期表的分区(★选修)按构造原理最后填入电子的能级的符号可把周期表里的元素划分为5个区,分别为s区、d区、ds、p区、f区,各区分别包括ⅠA、Ⅱ族元素、ⅢB~Ⅷ族元素、ⅠB、ⅡB族元素、ⅢA~ⅦA族和0族元素、镧系和锕系元素,其中s区(H除外)d 区、ds区和f区的元素都为金属。
二、元素周期律1、概念元素的性质随核电荷数递增发生周期性的递变。
2、实质元素周期律的实质是元素原子结构的周期性变化必然引起元素性质的周期性变化。
3、对角线规则在元素周期表中,某些主族元素与右下方的主族元素的某些性质相似,如Li和Mg,Be和Al。
4、元素周期表中同周期、同主族元素性质的递变规律5、电离能(★选修)(1)第一电离能:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量。
(2)元素第一电离能的意义:元素的第一电离能可以衡量元素的原子失去一个电子的难易程度。
第一电离能数值越小,原子越易失去一个电子,该元素的金属性越强;反之,第一电离能数值越大,原子越难失去一个电子。
(3)变化规律:①同一周期从左到右元素的第一电离能呈增大的趋势,但某些地方出现曲折变化,如Be>B,N>O, Mg>Al,P>S。
②同一族从上到下元素的第一电离能变小。
6.电负性(★选修)(1)键合电子:原子中用于形成化学键的电子。
(2)电负性:用来描述不同元素的原子对键合电子吸引力的大小。
(3)意义:电负性越大的原子,对键合电子的吸引力越大,非金属性越强。
故电负性的大小可用来衡量元素非金属性和金属性的大小。
区、d区、ds区重要元素及其化合物

s区、d区、ds区重要元素及其化合物(s Block, ds Block, d Block Elements and Compounds)9.1 s区元素s区元素中锂(Lithium)、钠(Sodium)、钾(Potassium)、铷(Rubidium)、铯(Cesium)、钫(Francium)六种元素被称为碱金属(alkali Metals)元素。
铍(Beryllium)、镁(Magnesium)、钙(Calcium)、锶(Strontium)、钡(Barium)、镭(Radium)六种元素被称为碱土金属(alkaline earth metals)元素。
锂、铷、铯、铍是稀有金属元素,钫和镭是放射性元素。
碱金属和碱土金属原子的价层电子构型分别为ns1和ns2,它们的原子最外层有1~2个电子,是最活泼的金属元素。
9.1.1 通性碱金属和碱土金属的基本性质分别列于表9-1和表9-2中。
表9-1碱金属的性质碱金属原子最外层只有1个ns电子,而次外层是8电子结构(Li的次外层是2个电子),它们的原子半径在同周期元素中(稀有气体除外)是最大的,而核电荷在同周期元素中是最小的,由于内层电子的屏蔽作用较显著,故这些元素很容易失去最外层的1个s电子,从而使碱金属的第一电离能在同周期元素中最低。
因此,碱金属是同周期元素中金属性最强的元素。
碱土金属的核电荷比碱金属大,原子半径比碱金属小,金属性比碱金属略差一些。
s区同族元素自上而下随着核电荷的增加,无论是原子半径、离子半径,还是电离能、电负性以及还原性等性质的变化总体来说是有规律的,但第二周期的元素表现出一定的特殊性。
例如锂的EΘ(Li+/Li)反常地小。
表9-2碱土金属的性质s区元素的一个重要特点是各族元素通常只有一种稳定的氧化态。
碱金属的第一电离能较小,很容易失去一个电子,故氧化数为+1。
碱土金属的第一、第二电离能较小,容易失去2个电子,因此氧化数为+2。
在物理性质方面,s区元素单质的主要特点是:轻、软、低熔点。
ds 区元素试题及答案

习题一、选择题1.下列金属中,最不活泼的是()(吉林大学《无机化学例题与习题》)A.CuB. AgC. ZnD.Hg2.与银反应能置换出氢气的的稀酸是()(吉林大学《无机化学例题与习题》)A. 硫酸B. 盐酸C. 硝酸D.氢碘酸3.为除去铜粉中少量氧化铜,应采取的操作是()(吉林大学《无机化学例题与习题》) A. 浓盐酸洗 B. KCN溶液洗C. 稀硝酸洗D. 稀硫酸洗4.下列化合物,在硝酸和氨水中都能溶解的是()(吉林大学《无机化学例题与习题》)A. AgClB. Ag2CrO4C.HgCl2D. CuS5.下列化合物中颜色最浅的是()(吉林大学《无机化学例题与习题》)A. Ag3PO4B.CuIC.AuClD. HgO6.下列化合物中,在氨水、盐酸、氢氧化钠溶液中均不溶解的好是( ) (吉林大学《无机化学例题与习题》)A. ZnCl2B. CuCl2C. Hg2Cl2D. AgCl7.关于CuCl2性质的叙述,错误的是()(吴成鉴《无机化学学习指导》) A.是离子型化合物 B.是链状结构C. 与HCl反应可生成配合物D. 不论晶体还是水溶液均有颜色8.向CuSO4入氨水的过程中,可能得到()(吴成鉴《无机化学学习指导》)A. Cu(OH)2.B.Cu2(OH)2SO4C. [Cu(NH3)4]2+D.[Cu(H2O)4]2+9.下列物质不能产生黑色物质的是( ) (吴成鉴《无机化学学习指导》)A.Cu在干燥的空气中加热至773KB. Ag与含H2S的空气接触C. AgBr见光D. ZnO在H2S气流中加热10.往含有Ag+、Cd2+、Al3+、Hg22+的溶液中滴加稀盐酸能析出沉淀的是()(吴成鉴《无机化学学习指导》)A.Al3+和Cd2+B.Ag+和Hg22+C.Ag+和Cd2+D只有.Ag+11. 能区分Zn2+和Al3+的下列试剂是()(吴成鉴《无机化学学习指导》)A. NaOHB. HClC. Na2CO3D. NH3.H2O12.AgX的颜色随卤素原子序数的增大而加深,可解释这一现象的理论是()黑龙江A. 杂化轨道B. 分子间作用力.C.溶剂化D. 离子极化13.下列氢氧化物最不稳定的是()(吴成鉴《无机化学学习指导》)A.Cu(OH)2B.Zn(OH)2C.Cd(OH)2D.AgOH14.锌比铜化学活泼性强,从能量变化角度分析是因为()(吴成鉴《无机化学学习指导》)A. 锌的电离势比铜的电离势小B.锌的升华热比铜的升华热较小C. 锌的升华热比铜的升华热大D. 锌的水合热比铜的水合热大15.下列分子中,具有顺磁性的是()(吉林大学《无机化学例题与习题》)A. CuClB. CuCl2C. Hg2Cl2D. HgCl216.除去ZnSO4溶液中所含的少量CuSO4,最好选用下列试剂中的()(大连理工大学《无机化学习题详解》)B.NaOHC.ZnD.H2S17.下列离子与过量的KI溶液反应只得到澄清的无色溶液的是()(大连理工大学《无机化学习题详解》)A.Cu2+B.Ag+C.Hg2+D.Hg22+18.下列离子在水溶液中最不稳定的是()(大连理工大学《无机化学习题详解》)A.Cu2+B.Cu+C.Hg2+D.Hg22+19.下列电对的标准电极电势最大的是()(大连理工大学《无机化学习题详解》)A.Cu2+/Cu+B.Cu+/CuC.CuCl2/CuD.CuI/Cu20.下列金属与相应的盐可以发生反应的是()(大连理工大学《无机化学习题详解》)A.Fe与Fe3+B.Cu与Cu2+C.Hg与Hg2+D.Zn与Zn2+21.下列配离子空间构型为正四面体的是()(大连理工大学《无机化学习题详解》)A.Zn(NH3)42+B.Cu(NH3)42+C.Ni(CN)42-D.Hg(NH3)42+22.下列配合物属于反磁性的有()(大连理工大学《无机化学习题详解》)A.Mn(CN)64-B.Cd(NH3)42+C.Fe(CN)63-D.Co(CN)63-二、填空题1.铜副族和锌副族金属中,密度最小的是,密度最大的是. (吉林大学《无机化学例题与习题》)2.给出组成合金的金属:黄铜,青铜,康铜,(吉林大学《无机化学例题与习题》)3.向CuSO4溶液中加入适量氨水,生成的沉淀组成为,沉淀的颜色是,Hg2Cl2分子构型为,中心原子采取的杂化类型为,用氨水处理Hg2Cl2得到的沉淀是.4. 欲将Ag+从Pb2+,Sn2+,Al3+,Hg2+混合溶液中分离出来,可加入的试剂为,(吉林大学《无机化学例题与习题》)5. Hg2Cl2是利尿剂。
第十三章 d区、ds区元素元素及其重要化合物

5、某棕黑色粉末,加热情况下和浓硫酸作用会放出助燃 性气体,所得溶液与PbO2作用(稍加热)时会出现紫红色。 若再加入3%的H2O2溶液,颜色能褪去,并有白色沉淀出 现。问此棕黑色粉末为何物? 6、分析:⑴ 水溶液中,碳酸钠分别与硫酸亚铁和硫酸铁 作用产物。⑵Fe分别与氯气和盐酸作用产物 7、金属M溶于稀盐酸生成MCl2,其磁矩为5.0 B.M..在无 氧条件下操作,MCl2遇NaOH溶液产生白色沉淀A。A接 触空气就逐渐变绿,最后变成棕色沉淀B。灼烧时,B变 成红棕色粉末C。C经不彻底还原,生成黑色的磁性物质 D。B溶于稀盐酸生成溶液E。E能使碘化钾溶液氧化出I2, 但如在加入碘化钾之前先加入氟化钠,则不会析出I2。若 向B的浓NaOH悬浮液中通入氯气,可得紫红色溶液F,加 入BaCl2时就析出红棕色固体G。G是一种很强的氧化剂。 试确定M及A~G代表的物质。
8、某一无色溶液,加入氨水时生成白色沉淀;加 入稀NaOH时生成黄色沉淀;若逐滴KI加入,先析 出红色沉淀而后溶解;若加少量汞,振荡可溶解。 此无色溶液中含有何物? 9、分离并鉴定各组离子 ① Cu2+,Ag+,Hg2+ ②Cu2+,Zn2+,Cd2+
③盐类 ④配合物 三、ds区元素 ㈠ 概述 1、氧化数 2、离子极化的影响 3、化合物颜色 4、金属单质特性 ㈡ 重要化合物(铜、银、锌、镉、汞) 1、氧化物和氢氧化物 ①颜色 ②溶解性 ③酸碱性 2、卤化物、硫化物的颜色和溶解性 3、配合物 NH3、CN—、S2O32—、SCN—
4、Cu(Ⅰ)与Cu(Ⅱ)、Hg(Ⅰ)与Hg(Ⅱ) 的相互转化关系
(1) ①+3价化合物 Ⅰ、氧化物和氢氧化物性质特征 Ⅱ、盐类
a、存在形态 b、氧化还原性
第20、21章d区元素习题

第20、21章d区元素习题目录一判断题;二选择题;三填空题;四完成反应方程式;五计算和回答问题一判断题返回目录1 所谓内过渡元素指的是d区元素。
()2 第一过渡系元素是指第四周期的过渡元素。
()3 第二过渡系元素是指第五周期的过渡元素。
()4 第三过渡系元素是指第六周期的过渡元素。
()5 第Ⅷ族过渡元素属于内过渡元素。
()6 Zr与Hf性质相似是由惰性电子对效应造成的。
()7 钼是我国的丰产元素之一。
()8 钨是我国的丰产元素,储量为世界首位。
()9 Fe3+和Cr3+的硫酸盐都可形成矾。
()10 d区元素全都是重金属。
()11 一般说来,同一族过渡元素的原子半径随原子序数的增加而增大。
()12 同一周期副族元素的原子半径随着原子序数的增加而依次减小。
()13 过渡元素都是金属元素,也称作过渡金属。
()14 在过渡元素中化学性质最活泼的是钪副族。
()15 多数过渡元素都可以形成多种氧化值的化合物。
()16 第一过渡系元素的第一电离能随原子序数的增大而依次减小。
()17 MnO4-具有颜色是由于发生电荷迁移而造成的。
()18 CrO42-具有颜色是由于产生d-d跃迁而造成的。
()19 中心离子电子构型为d1~d9的配离子大多具有颜色。
()20 中心离子电子构型为d0或d10的配离子大多是无色的。
()21 过渡元素的许多水合离子和配合物呈现颜色,其原因多是发生d-d跃迁而造成的。
()22 在所有金属羰合物中,金属元素的氧化值都是零。
()23 金属羰基配合物受热易分解为金属和一氧化碳。
()24 ds区元素原子的次外层都有10个d电子。
()25 在d区元素中以ⅢB族元素最活泼。
()26 许多过渡元素的化合物因具有未成对电子而呈现顺磁性。
()27 许多过渡金属及其化合物具有催化性能。
()28 第一过渡系元素比相应的第二、三过渡系元素活泼。
()29 第一过渡系元素中,从Sc到Mn,元素的最高氧化值等于其族序数。
d区ds区重要化合物的性质

d区ds区重要化合物的性质化合物是由不同元素组成的物质,其性质在科学研究和工业应用中具有重要的意义。
在d区和ds区,许多化合物由过渡金属元素和其他元素组成,具有特殊的性质和应用。
本文将探讨d区和ds区重要化合物的性质。
一、配合物的性质配合物是由一个或多个中心金属离子与配体(通常是有机分子或无机阴离子)形成的化合物。
在d区和ds区,配合物具有许多重要的性质。
1. 水合作用许多金属离子在溶液中结合水分子形成水合物。
这种水合作用使得配合物具有溶解度和溶解度的变化,因此在溶液中具有良好的稳定性。
2. 配合物的颜色由于d电子的存在和转移,许多配合物具有明显的颜色。
这是由于d电子的跃迁引起的电子的吸收和发射,从而产生可见光谱。
3. 配合物的磁性许多配合物具有不同的磁性。
在配合物中,d电子的自旋和轨道运动导致了不同的磁性行为,如顺磁性和反磁性。
4. 配合物的光谱性质配合物的d电子在吸收或发射光时,产生特定的吸收光谱或发射光谱。
这些光谱可以被用来研究配合物的结构和性质。
二、过渡金属氧化物的性质过渡金属氧化物是由过渡金属元素和氧元素组成的化合物。
它们在许多重要领域具有广泛的应用。
1. 磁性过渡金属氧化物中的过渡金属离子具有未成对的d电子,因此具有磁性。
这使得它们在磁性材料和磁性存储器中具有重要作用。
2. 催化性能由于过渡金属氧化物表面具有特殊的化学性质,因此它们在催化剂中起着重要作用。
它们能够促进化学反应,提高反应速率。
3. 电子导电性过渡金属氧化物具有良好的电子导电性,因此它们在电池和电子器件中被广泛应用。
4. 光催化性能一些过渡金属氧化物具有光催化性能,能够吸收光能,催化光化学反应。
这对于环境保护和能源开发具有重要意义。
三、金属盐的性质金属盐是由金属离子和阴离子组成的化合物,其性质在生活和工业中具有重要意义。
1. 溶解度金属盐在溶液中具有不同的溶解度。
这是由于金属的化合价和盐的晶体结构等因素所决定的。
2. 导电性金属盐在溶液中能够电离成金属离子和阴离子,从而具有良好的电导性。
高中化学 ds 区元素竞赛练习

高中化学 ds 区元素竞赛练习2005第1题(9分)用α粒子撞击铋-209合成了砹-211。
所得样品中砹-211的浓度<10-8mol/L ,砹-211同位素半衰期较长,足以用它来研究砹的化学性质。
1-1 写出合成砹的核反应方程式。
n 102118542209832At He Bi +=+ (2分) 1-2 已知室温下用CCl 4萃取I 2的分配系数为c I 2(CCl 4)/c I 2(H 2O)=84,预计用CCl 4萃取AtI 的分配系数c AtI (CCl 4)/c AtI (H 2(填 >, < 或 =);1-3 已知I 2 + I - ⇌ I 3- 的平衡常数K = 800,可推断AtI + I - ⇌ AtI 2-的平衡常数K 800(填 >, < 或=); 依据是: (1.5分)1-4 在AtI 中加入I 2和I -的混合溶液,滴加AgNO 3溶液,发现所得沉淀中只有AgI 而没有共沉淀的AgAt (如果有AgAt ,必然会被共沉淀),然而在上述产物中加入Pb(IO 3)2却发现有砹的共沉淀。
写出有关化学方程式,解释上述实验现象。
AtI + 2I 2 + 5Ag + + 3H 2O = 5AgI + AtO 3- + 6H + (把I 2改为I 3-也可,但仍应配平)AtO 3- 与Pb(IO 3)2共沉淀。
(写出方程式2分) (总3分)1-5 已知室温下ICH 2COOH 的p K a =3.12,由此可推断AtCH 2COOH 的p K 3.12(填>, < 或 =);理(1分)2005第10题(10分)据世界卫生组织统计,全球约有8000万妇女使用避孕环。
常用避孕环都是含金属铜的。
据认为,金属铜的避孕机理之一是,铜与子宫分泌物中的盐酸以及子宫内的空气反应,生成两种产物,一种是白色难溶物S ,另一种是酸A 。
酸A 含未成对电子,是一种自由基,具有极高的活性,能杀死精子。
s区元素和稀有元素习题解答

(A)碱土金属的外层电子数较多;
(B)碱土金属电子所受有效核电荷的作用较强;
(C)碱土金属的原子半径较大;
(D)碱土金属的原子量较大。 解:B第11章(03590)对元素周期表Ⅰ
解:A
第11章(03558)下列氢化物中为共价型的是.( )。
(A)SrH2;(B)NaH;(C)B2H6;(D)CaH2。
解:C
第11章(03559)下列物质溶于水后显碱性的是.()。
(A)H2Se;(B)KH;(C)AsH3;(D)H2Te。
解:B
第11章(03560)碱金属氢化物可作为.( )。
第11章习题解答第11章(03525)重水是由H和18O组成的水。.( ) 解:错
第11章(03526)氢在自然界中主要以单质形式存在。 ( ) 解:错
第11章(03527)由于H2是双原子分子,所以H2比He的扩散速率小。.()
解:错
第11章(03528)氢气是最轻的单质,所以它的熔点和沸点在所有单质中最低。.(
第11章(03535)下列氢气制法中,工业上不常采用的是.( )。
(A)电解法;(B)水煤气法;(C)甲烷转化法;(D)碱金属氢化物与水反应。解:D
第11章(03536)下列分子或离子不能存在的是.()。(A)H2;(B)H2+;(C)H22+;(D)H-。
解:C
第11章(03537)下列原子、离子和分子中属于反磁性的是.( )。
解:NH3;LiH。
第11章(03544) Fe3O4+H2
解:Fe3O4+4H23Fe+4H2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第九章. s区、ds区、d区重要元素及其化合物测验题
一、选择题
1、向含有Ag+、Pb2+、Al3+、Cu2+、Sr2+、Cd2+的混合溶液中加稀HCl后可以被沉淀的离子是()。
A.Ag+
B. Cd2+
C. Ag+和Pb2+
D. Pb2+和Sr2+
2、性质相似的两个元素是( )。
A.Mg和Al
B. Zr和Hf
C. Ag和Au
D.Fe和Co
3、在下列氢氧化物中,哪一种既能溶于过量的NaOH溶液,又能溶于氨
水中?( )。
A.Ni(OH)2
B. Zn(OH)2
C. Fe(OH)3
D.Al(OH)3
4、下列5种未知溶液是:Na2S、Na2S2O3、 Na2SO4、 Na2SO3 、Na2SiO3,分别加入同一中试剂就可使它们得到初步鉴别,这种试剂是()。
A.AgNO3 溶液
B. BaCl2 溶液
C. 稀HCl溶液
D.稀HNO3溶液
5、 +3价铬在过量强碱溶液中的存在形式是( )。
A.Cr(OH)3
B. CrO2-
C. Cr3+
D. CrO42-
6、下列硫化物中,不能溶于浓硫化钠的是( )。
A. SnS2
B. HgS
C. Sb2S3
D. Bi2S3
7、.向MgCl2 溶液中加入Na2CO3 溶液,生成的产物之一为:
A.MgCO3
B. Mg(OH)2
C. Mg2 (OH)2 CO3
D. Mg(HCO3)2
8、下列各组离子中,通入H2S气体不产生黑色沉淀的是( )
A.Cu2+ , Zn2+
B. As3+, Cd2+
C.Fe2+, Pb2+
D. Ni2+ , Bi3+
9、下列物质在空气中燃烧,生成正常氧化物的单质是( )。
A. Li
B. Na
C. K
D. Cs
10、能共存于溶液中的一对离子是( )。
A .Fe3+和I- B. Pb2+和Sn2+ C. Ag+和PO43- D. .Fe3+和SCN-
11、在HNO3介质中,欲使Mn2+氧化成MnO4-,可加哪种氧化剂?( )
A. KClO3
B. H2O2
C. 王水
D.(NH4)2S2O8
12、下列硫化物中,不能溶于浓硫化钠的是( )。
A. SnS2
B. HgS
C. Sb2S3
D. Bi2S3
13、K2Cr2O7溶液与下列物质反应没有沉淀生成的是( )。
A. H2S
B. KI
C. H2O2
D. AgNO3
14、下列离子在水溶液中最不稳定的是( )。
A. Cu2+
B. Cu+
C. Hg2+
D. Hg22+
15、定性分析中鉴定Co2+,是利用Co2+和一种配位剂形成一种兰色物质该物质在
有机溶剂中较稳定,这种配合剂是( )。
A. KCN
B.丁二酮肟
C.NH4SCN
D. KNO2
二、填空题
1、 SiCl4 在潮湿空气中由于_________而产生浓雾,其反应式为____
______。
2、Na2O2 为___________粉末,它与水或稀酸作用放出_____,它在
潮湿空气里能吸收_________,放出__________,有关反应式为____,
_________,____________,______________.
3、既可用来鉴定Fe3+ ,也可用来鉴别Co2+的试剂是_________,既可用来鉴别 Fe3+ ,也可用来鉴别Cu2+试剂是__________.
4、为什么在酸性K2Cr2O7 溶液中加入BaCl2 得到的是BaCrO4沉淀?
三、完成(或写出)下列反应方程式:
1. Na2S2O3 + I2 ==
2. Ag2S + HNO3(浓)==
3. PbO2 + Mn2+H+ ==
4.漂白粉加盐酸
5.HgCl2溶液中加适量SnCl2溶液后,再加过量的SnCl2溶液。
6. KI + CuCl2→
7. Cr3++ S2-+ H2O →
8. Ag2S + HNO3→
9. Hg2Cl2+ NH3→
10. Mg2++ CO32-+ H2O →
四、鉴定题
1、(1)向含有Fe2+的溶液中加入NaOH溶液后生成白色沉淀A,逐渐变红棕色B;
(2)过滤后沉淀用HCl溶解,溶液呈黄色C;
(3)向黄色溶液中加几滴KNCS溶液,立即变成血红色D,再通入SO2,则红色消失;
(4)向红色消失溶液中,滴加KMnO4溶液,其紫色退去;
(5)最后加入黄血盐溶液时,生成兰色沉淀E。
用反应式说明上述实验现象,并说明A、B、C、D、E为何物?
2、某一化合物溶于水得一浅兰色溶液,在A溶液中加入NaOH得兰色沉淀B。
B能溶于HCl 溶液,也能溶于氨水。
A溶液中通入H2S,有黑色沉淀C生成。
C难溶于HCl溶液而溶于热HNO3中。
在A溶液中加入Ba(NO3)2溶液,无沉淀产生,而加入
AgNO3溶液时有白色沉淀D生成。
D溶于氨水。
试判断A、B、C、D为何物?并写出反应方程式。
3、今有一混合溶液,内有Ag+、Cu2+、Al3+和Ba2+等离子,如何分离鉴定?写出有关反应式。
第九章. s区、ds区、d区重要元素及其化合物测验题答案
一、选择题
1、C
2、B
3、B
4、C
5、B
6、D
7、C
8、B、 19.A 10.B 11.D 12.D 13.C
14.B 15.C
二、填空题
1、水解;SiCl4 +3H2O =H2SiO3 +4HCl
2、黄色; O2; CO2; O2;
Na2O2 +2H2O ==2NaOH +H2O2 H2O2 →1/2 O2 ↑+ H2O
2Na2O2 +2CO2==2Na2CO3 +O2↑
3、KNCS; K4[Fe(CN)6].
4、答:在酸性K2Cr2O7 溶液中存在:
Cr2O7 2-+ H2O == 2 CrO42-+ H+
由于BaCrO4的K sp值很小,因此在酸性K2Cr2O7 溶液中加入BaCl2
得到的是BaCrO4沉淀,使上述平衡向生成CrO42-离子的方向移动.
三、完成(或写出)下列反应方程式:
1. 2Na2S2O3 + I2 == Na2S4O6 + 2NaI
2. Ag2S + 4 HNO3(浓)== 2AgNO3 +2NO2 + S +2H2O
3. 5PbO2 + 2Mn2+ +4 H+ == 5Pb2+ +2MnO4— +2H2O
4.Ca(ClO)2 + 4HCl ==CaCl2 +Cl2↑ +2H2O
5.2HgCl2 +SnCl2 == SnCl4 + Hg2Cl2(s)(白)
Hg2Cl2 + SnCl2 == SnCl4 + 2Hg
6.4KI + 2CuCl2→2CuI↓+I2 +4KCl
7. 2Cr3++ 3S2- + 6 H2O →2Cr(OH)3↓+ 3H2S
8. Ag2S + 4 HNO3→2AgNO3 +2NO2 + S +2H2O
9. Hg2Cl2 + 2 NH3→HgNH2Cl↓+ Hg↓+ NH4Cl
10. 2Mg2++ 2CO32-+ H2O → Mg2(OH)2CO3 ↓+ CO2↑
四、鉴定题
1、(1)Fe2+ +2OH- == Fe(OH)2↓(A,白色)
4 Fe(OH)2 +O2 + 2H2O == 4 Fe(OH)3↓(B,红棕色)
(2) Fe(OH)3 +3H+ == Fe3+(C,黄色) +3H2O
(3)Fe3+ +6NCS— == [Fe(NCS)6]3- (D,血红色)
2[Fe(NCS)6]3- + SO2 +2H2O ==2Fe2+ +SO42- +4H+ +12NCS—
(4)2MnO4—(紫色) + 5Fe2+ + 16H+ == 5Fe3+ +2Mn2+ (无色)+ 8H2O
(5) Fe3+ +K+ + [Fe(CS)6]4-== KFe[Fe(CS)6]↓(E,兰色)
2、解:A— CuCl2,B—Cu(OH)2,C—CuS ,D—AgCl
反应如下:
CuCl2 +NaOH ==2 NaCl + Cu(OH)2
Cu(OH)2 +2 HCl == CuCl2 + 2H2O
Cu(OH)2 + 4NH3 ==Cu(NH3)42+ +2OH—
CuCl2 + H2S == CuS↓ + 2HCl
CuS + 4HNO3 (浓)== Cu(NO3)2 + S↓+2NO2↑+2H2O
CuCl2 + 2AgNO3 ==2AgCl + Cu(NO3)2
3、各步鉴定反应如下:
(1) Ag++Cl- == AgCl↓(白)
AgCl + 2NH3 ==[Ag(NH3 )2]+ +Cl- [Ag(NH3 )2]+ + 2H+ +Cl- == AgCl↓ +2NH4+
(2) Cu2+ + H2S ==CuS↓(黑) +2 H+
3 CuS +2NO3- +8H+ == 3 Cu2+ +2NO +3S +4H2O
Cu2+ + 4 NH3 == [Cu(NH3)4]2+
(浅蓝) (深蓝)
(3) 焰色反应为绿色的是Ba2+,
Ba2+ + SO42- ==BaSO4↓(白) BaSO4不溶于HNO3
(4) 用铝试剂(茜素磺酸钠)在氨水中与Al3+ 生成鲜红色沉淀。
