中国药典(2010年版)纯化水标准
2010版《中国药典》纯化水标准及检测项目
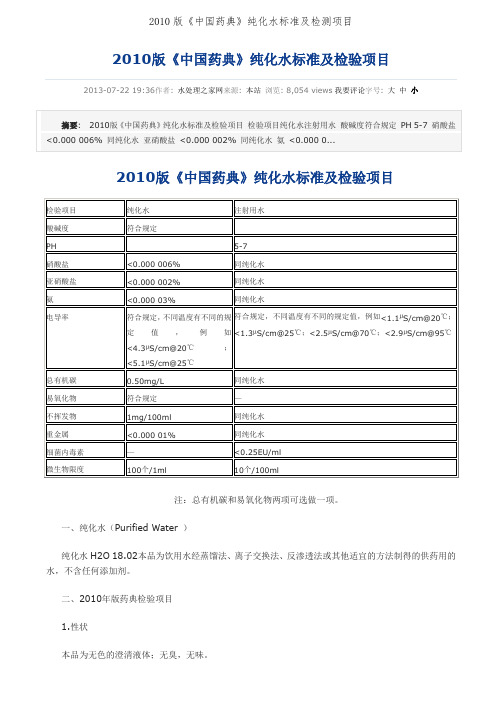
2010版《中国药典》纯化水标准及检验项目2013-07-22 19:36作者: 水处理之家网来源: 本站浏览: 8,054 views我要评论字号: 大中小注:总有机碳和易氧化物两项可选做一项。
一、纯化水(Purified Water )纯化水H2O 18.02本品为饮用水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的供药用的水,不含任何添加剂。
二、2010年版药典检验项目1.性状本品为无色的澄清液体;无臭,无味。
取本品10ml,加甲基红指示液2滴,不得显红色;另取10ml,加溴麝香草酚蓝指示液5滴,不得显蓝色。
3.硝酸盐取本品5ml置试管中,于冰浴中冷却,加10%氯化钾溶液0.4ml与0.1%二苯胺硫酸溶液0.1ml,摇匀,缓缓滴加硫酸5ml,摇匀,将试管于50℃水浴中放置15分钟,溶液产生的蓝色与标准硝酸盐溶液[取硝酸钾0.163g,加水溶解并稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,再精密量取10ml,加水稀释成100ml,摇匀,即得(每1ml相当于1μgNO3)]0.3ml,加无硝酸盐的水4.7ml,用同一方法处理后的颜色比较,不得更深(0.000 006%)。
4.亚硝酸盐取本品10ml,置纳氏管中,加对氨基苯磺酰胺的稀盐酸溶液(1→100)1ml及盐酸萘乙二胺溶液(0.1→100)1ml,产生的粉红色,与标准亚硝酸盐溶液[取亚硝酸钠0.750g(按干燥品计算),加水溶解,稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,摇匀,再精密量取1ml,加水稀释成50ml,摇匀,即得(每1ml相当于1μgNO2))0.2ml,加无亚硝酸盐的水9.8ml,用同一方法处理后的颜色比较,不得更深(.0000 02%)。
5.氨取本品50ml,加碱性碘化汞钾试液2ml,放置15分钟;如显色,与氯化铵溶液(取氯化铵31.5mg,加无氨水适量使溶解并稀释成1000ml)1.5ml,加无氨水48ml与碱性碘化汞钾试液2ml制成的对照液比较,不得更深(0.000 03%)。
中外水质(纯化水、注射用水)标准比较

纯化水水质标准
注射用水水质标准
解读2010年版《中国药典》(八)新版药典对纯化水、注射用水和灭菌注射用水检验新增电导率和总有机碳两个检查项目
制药企业的生产工艺用水,涉及到制剂生产过程当中容器清洗、配液及原料药精制纯化等所需要使用的水,此类用水一般分成纯化水和注射用水两大类。
2010年版《中国药典》对纯化水、注射用水和灭菌注射用水的检验项目作了修订。
特别值得关注的是新增了电导率和总有机碳两个检查项目。
电导率和总有机碳的指标在一定意义上说明的是对水污染的监控。
当水中含有无机酸、碱、盐或有机带电胶体时,电导率就增加。
检查制药用水的电导率可在一定程度上控制水中电解质总量。
而各种有机污染物,微生物及细菌内毒素经过催化氧化后变成二氧化碳,进而改变水的电导,电导的数据又转换成总有机碳的量。
如果总有机碳控制在一个较低的水平上,意味着水中有机物、微生物及细菌内毒素的污染处于较好的受控状态。
没有检测电导率和总有机碳可能会有什么后果?1, 不知道药品已受污染,以及不知道什么原因和什么时候受到污染;2, 纯水系统的过滤装置需要更换而不知道;3, 管路设计上存在死角滋长微生物而不知道;4,引入新杂质不能通过验证。
这也是将这两项指标作为检查项目的重要原因。
这两项指标的增订使得我国药品标准进一步与国际接轨,对制药企业和监督检验部门都提出了更高的要求。
制药用水有哪些分类和水质标准

制药用水分类和水质标准:制药用水(加工用水:药品制造过程中使用的水,如饮用水,纯净水和注射用水)分类1.饮用水:自来水或深井水,通常由自来水公司提供,也称为原水,其水质必须符合国家标准GB5749-85“饮用水卫生标准”。
有。
根据《2010年中国药典》,饮用水不能直接用于制备或测试。
2.纯化水(Purified Water):制药用水,由原水通过蒸馏,离子交换,反渗透或任何其他合适的方法制成,无任何添加剂。
纯化水可用作制备普通药物制剂的溶剂或测试水。
它不能用于准备注射剂。
通过非热处理(例如离子交换,反渗透和超滤)制备的纯净水通常也称为去离子水。
通过使用特殊设计的蒸馏器蒸馏制备的纯净水通常称为蒸馏水。
3. 注射用水:通过将水纯化为原水,再用专门设计的蒸馏水蒸馏,冷凝和冷却后通过膜过滤得到的水。
注射用水可以用作注射溶剂。
4. 无菌注射用水:根据注射液的生产工艺准备注射用水。
注射用无菌水是用于粉末消毒的溶剂或稀释剂。
制药用水的水质标准:1.饮用水:应符合中华人民共和国国家标准《生活饮用水卫生标准》(GB5749-85)2.纯化水:应符合《2010中国药典》所收载的纯化水标准。
在制水工艺中通常采用在线检测纯化水的电阻率值的大小,来反映水中各种离子的浓度。
制药行业的纯化水的电阻率通常应≥0.5MΩ.CM/25℃,对于注射剂、滴眼液容器冲洗用的纯化水的电阻率应≥1MΩ.CM/25℃。
3.注射用水:应符合2010中国药典所收载的注射用水标准二:2010年中国药典对纯水、注射用水、灭菌注射用水的pH、电导率、总有机碳(TOC)的检测提出如下要求:1. 药典对pH检测的新要求:pH值应处在5.0~7.0。
2.药典对电导率检测的新要求:调节待测样品的温度至25℃。
标示装量为10ml或10ml以下时,电导率限度为25μS/cm;标示装量为10ml以上时,电导率限度为5μS/cm。
测定的电导率值不大于限度值,则判为符合规定;如电导率值大于限度值,则判为不符合规定。
2010版药典注射用水标准

注射用水
Zhushe Yong Shui
Water for Injection
[修订]
【检查】pH值取本品100ml,加饱和氯化钾溶液0.3ml,依法测定(附录ⅥH),pH 值应为5.0~7.0。
氨取本品50ml,加碱性碘化汞钾溶液2ml,放置15分钟,如显色,与标准氯化铵溶液(取氯化铵31.5mg,加无氨水适量使溶解并稀释至1000ml)1.0ml,加无氨水48ml与碱性碘化汞钾溶液2ml制成的对照液比较,不得更深(0.00002%)。
重金属照纯化水项下的方法检查,应符合规定。
[增订]
【检查】电导率应符合规定(附录)。
总有机碳、铝盐照纯化水项下的方法检查,应符合规定。
[删除]
【检查】氯化物、硫酸盐与钙盐、二氧化碳、易氧化物、照纯化水项下的方法检查,应符合规定。
中国药典纯化水制药用水标准

中国药典纯化水(制药用水)标准本品为饮用水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的制药用水,不含任何添加剂。
【总有机碳】不得过0.50mg/L。
【易氧化物】取本品100ml,加稀硫酸10ml,煮沸后,加高锰酸钾滴定液(0.02mol/L)0.10ml,再煮沸10分钟,粉红色不得完全消失。
以上总有机碳和易氧化物两项可选做一项。
【重金属】取本品100ml,加水19ml,蒸发至20ml,放冷,加醋酸盐缓冲液(pH3.5)2ml与水适量使成25ml,加硫代乙酰胺试液2ml,摇匀,放置2分钟,与标准铅溶液1.0ml加水19ml用同一方法处理后的颜色比较,不得更深(0.000 01%)。
【电导率】应符合规定(附录)【铝盐】(供透析液生产用水需检查)取本品400ml,置分液漏斗中,加醋酸盐缓冲液(pH 6.0)10ml和水100ml ,用0.5% 8-羟基喹啉三氯甲烷溶液提取3次(20ml,20ml,10ml),合并三氯甲烷提取液于50ml量瓶中,加三氯甲烷至刻度,摇匀,即得供试品溶液;另取标准铝盐溶液[称取硫酸铝钾0.352g,置100ml量瓶中,加1mol/L硫酸溶液10ml溶解后,用水稀释至刻度,摇匀,作为贮备液。
临用前,精密量取贮备液1ml,置100ml量瓶中,用水稀释至刻度,摇匀,即得(每1ml相当于2μg的Al)]2.0ml,置分液漏斗中,加醋酸盐缓冲液(pH 6.0)10ml和水98ml,同法操作,即得标准溶液;取醋酸盐缓冲液(pH 6.0)10ml和水100ml,置分液漏斗中,同法操作,作为空白溶液。
取上述溶液,照荧光分析法(附录ⅣE),在激发光波长392nm与发射光波长518nm处分别测定荧光强度。
供试品溶液的荧光强度不得大于标准溶液的荧光强度(0.000 001%)。
2010版药典纯化水质量标准

上海贝灵生物科技有限公司GMP管理文件一、目的:建立一个纯化水的质量标准。
二、适用范围:纯化水的质量标准。
三、责任者:质量保证部。
四、正文:1 检验依据《中国兽药典》2010年版一部本品为蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的供药用的水,不含任何附加剂。
2. 性状本品为无色的澄清液体;无臭,无味。
3. 检查3.1. 酸碱度取本品10ml,加甲基红指示液2滴,不得显红色;另取10ml,加溴麝香草酚蓝指示液5滴,不得县蓝色。
3.2. 硝酸盐取本品5ml置试管中,于冰浴中放冷,加10%氯化钾溶液0.4ml与0.1%二苯胺硫酸溶液0.1ml,摇匀,缓缓滴加硫酸5ml,摇匀,将试管于50℃水浴中放置15分钟,溶液产生的蓝色与标准硝酸盐溶液[取硝酸钾0.163g,加水溶解并稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,再精密量取10ml,加水稀释成100ml,摇匀,即得(每1ml相当于1μgNO3)] 0.3ml,加无硝酸盐的水4.7ml,用同一方法处理后的颜色比较,不得更深(0.000006%)。
3.3 亚硝酸盐取本品10ml,置纳氏管中,加对氨基苯磺酰胺的稀盐酸溶液(1→100)1ml及盐酸萘乙二胺溶液(0.1→100)1ml,产生的粉红色,与标准亚硝酸盐溶液[取亚硝酸钠0.750g(按干燥品计算),加水溶解,并稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,摇匀,再精密量取1ml,加水稀释成50ml,摇匀,即得(每1ml相当于1μg NO2)] 0.2ml,加无亚硝酸盐的水9.8ml,用同一方法处理后的颜色比较,不得更深(0.000002%)。
3.4 氨取本品50ml,加碱性碘化汞钾试液2ml,放置15分钟;如显色,与氯化铵溶液(取氯化铵31.5mg,加无氨水适量使溶解并稀释成1000ml)1.5ml,加无氨水48ml与碱性碘化汞钾试液2ml制成的对照液比较,不得更深(0.00003%)3.5 电导率应符合规定(附录89页)。
中国药典 纯化水标准

中国药典纯化水标准中国药典规定了纯化水的标准,纯化水是制药工业中常用的一种水质。
它是通过多种工艺方法处理而成的,具有一定的纯净度和稳定性,可以用于制药生产中的各个环节,如药物生产、药物溶液配制、药物稀释等。
纯化水的标准对于保证药品的质量和安全具有重要意义。
首先,中国药典规定了纯化水的外观要求。
纯化水应该是透明无色的,不应该有悬浮物和沉淀物。
这是因为在制药过程中,如果纯化水出现浑浊或有杂质,就会对药品的制备和质量产生影响,甚至可能引起药品的变质。
其次,纯化水的化学成分也受到了严格的控制。
中国药典规定了纯化水的PH值范围,一般在5.0-7.0之间。
PH值的过高或者过低都会影响药品的稳定性和安全性。
此外,纯化水中的有机物、无机物、细菌总数、重金属离子等也都有详细的要求,这些指标的合格与否直接关系到纯化水是否符合药品生产的要求。
最后,中国药典还规定了纯化水的微生物指标。
微生物的存在会导致纯化水的污染,从而影响药品的质量。
因此,纯化水中的细菌总数、大肠菌群、霉菌和酵母菌等微生物指标也都有具体的要求。
这些要求的制定,旨在保证制药过程中使用的纯化水符合一定的卫生标准,不会对药品的安全性和有效性造成影响。
总的来说,中国药典对纯化水的标准制定得非常严格,这是为了保证药品的质量和安全。
制药企业在生产过程中,应该严格按照这些标准要求来生产和使用纯化水,确保药品的质量符合国家的相关标准,为人们的健康提供保障。
同时,相关部门也应该加强对纯化水质量的监督和检测,确保纯化水的质量符合规定标准。
只有这样,才能保证纯化水在药品生产中的作用得到充分发挥,为人们的健康保驾护航。
水 分 测 定 法(中国药典2010第一部)

水分测定法测定用的供试品,一般先破碎成直径不超过3mm的颗粒或碎片;直径和长度在3mm以下的可不破碎;减压干燥法需通过二号筛。
第一法(烘干法)本法适用于不含或少含挥发性成分的药品。
测定法取供试品2 ~ 5 g , 平铺于干燥至恒重的扁形称量瓶中,厚度不超过5mm,疏松供试品不超过l0mm,精密称定,打开瓶盖在100~105t干燥5小时,将瓶盖盖好,移置干燥器中,冷却30分钟,精密称定,再在上述温度干燥1小时,冷却,称重,至连续两次称重的差异不超过5mg为止。
根据减失的重量,计算供试品中含水量(%)。
第二法(甲苯法)本法适用于含挥发性成分的药品。
仪器装置如图。
A为5 0 0 m l的短颈圆底烧瓶;B为水分测定管;C为直形冷凝管,外管长40cm。
使用前,全部仪器应清洁,并置烘箱中烘干。
图甲苯法仪器装置测定法取供试品适量(约相当于含水量l~4ml),精密称定,置A瓶中,加甲苯约200ml,必要时加人干燥、洁净的沸石或玻璃珠数粒,将仪器各部分连接,自冷凝管顶端加人甲苯,至充满B管的狭细部分。
将A瓶置电热套中或用其他适宜方法缓缓加热,待甲苯开始沸腾时,调节温度,使每秒钟馏出2滴。
待水分完全馏出,即测定管刻度部分的水量不再增加时,将冷凝管内部先用甲苯冲洗,再用饱蘸甲苯的长刷或其他适宜的方法,将管壁上附着的甲苯推下,继续蒸馏5分钟,放冷至室温,拆卸装置,如有水黏附在B管的管壁上,可用蘸甲苯的铜丝推下,放置,使水分与甲苯完全分离(可加亚甲蓝粉末少量,使水染成蓝色,以便分离观察)。
检读水量,并计算供试品中的含水量(%)。
【附注】用化学纯甲苯直接测定,必要时甲苯可先加水少量,充分振摇后放置,将水层分离弃去,经蒸馏后使用。
第三法(减压干燥法)本法适用于含有挥发性成分的贵重药品。
减压干燥器取直径12cm左右的培养皿,加入五氧化二磷干燥剂适量,使铺成0. 5~lcm的厚度,放人直径30cm的减压干燥器中。
测定法取供试品2~4g,混合均匀,分取约0. 5~lg,置已在供试品同样条件下干燥并称重的称量瓶中,精密称定,打开瓶盖,放人上述减压干燥器中,减压至 2. 67kPa(20mmHg)以下持续半小时,室温放置24小时。
纯化水标准(版中国药典)

纯化水【1】【试剂】10%氯化钾:取10g氯化钾溶加100ml水使溶解,即得。
稀硫酸:取硫酸57ml,加水稀释至1000ml,即得。
应含H2SO4 9.5%~10.5%甲基红指示剂:取甲基红0.1g,加0.05mol/L氢氧化钠溶液 5.3ml使溶解,再加水稀释至100ml,即得。
溴麝香草酚蓝指示剂:取溴麝香草酚蓝0.1g,加0.05mol/L氢氧化钠溶液3.2,ml使溶解,再加水稀释至200ml,即得。
0.1%二苯胺硫酸溶液:取0.1g二苯胺,加入100ml硫酸(98%)使之溶解,即得。
稀盐酸:取盐酸243ml,加水稀释至1000ml,即得。
应含HCl9.5%~10.5%高锰酸钾滴定液(0.02mol/L):取高锰酸钾3.2g,加水1000ml,煮沸15分钟,密塞,静置2天以上,用垂熔玻璃滤器过滤,摇匀。
高锰酸钾滴定液标定:准确称取于摄氏110度烘过两小时的草酸钠0.2g,置于烧杯中,加5%硫酸120ml,加热至80-90摄氏度,用高锰酸钾标准溶液滴至微红色(在1分钟内不消失)即为终点。
c=5m/v*0.0670式中c-高锰酸钾标准溶液的浓度(mol/L); m-称取草酸钠重量(g); v-滴定时消耗高锰酸钾溶液体积(ml);0.0670-Na2C2O4(草酸分子量)/2*1/1000。
本品为饮用水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的制药用水,不含任何添加剂。
【性状】本品为无色的澄清液体;无臭。
【检査】酸碱度取本品10ml,加甲基红指示液2滴,不得显红色;另取10ml,加溴麝香草酚蓝指示液5滴,不得显蓝色。
硝酸盐取本品5ml置试管中,于冰浴中冷却,加10%氯化钾溶液0.4ml与0.1%二苯胺硫酸溶液0.1ml,摇匀,缓缓滴加硫酸5ml,摇匀,将试管于50°C水浴中放置15分钟,溶液产生的蓝色与标准硝酸盐溶液[取硝酸钾0.163g,加水溶解并稀释至100ml,摇匀,精密量取1ml ,加水稀释成100ml,再精密量取10ml,加水稀释成100ml,摇匀,即得(每lml相当于1μg NO 3)]0.3ml,加无硝酸盐的水4.7ml,用同一方法处理后纯化水的颜色比较,不得更深(0.000006%)。
中国药典纯化水制药用水标准

中国药典纯化水(制药用水)标准本品为饮用水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的制药用水,不含任何添加剂。
【总有机碳】不得过0.50mg/L。
【易氧化物】取本品100ml,加稀硫酸10ml,煮沸后,加高锰酸钾滴定液(0.02mol/L)0.10ml,再煮沸10分钟,粉红色不得完全消失。
以上总有机碳和易氧化物两项可选做一项。
【重金属】取本品100ml,加水19ml,蒸发至20ml,放冷,加醋酸盐缓冲液(pH3.5)2ml与水适量使成25ml,加硫代乙酰胺试液2ml,摇匀,放置2分钟,与标准铅溶液1.0ml加水19ml用同一方法处理后的颜色比较,不得更深(0.000 01%)。
【电导率】应符合规定(附录)【铝盐】(供透析液生产用水需检查)取本品400ml,置分液漏斗中,加醋酸盐缓冲液(pH 6.0)10ml和水100ml ,用0.5% 8-羟基喹啉三氯甲烷溶液提取3次(20ml,20ml,10ml),合并三氯甲烷提取液于50ml量瓶中,加三氯甲烷至刻度,摇匀,即得供试品溶液;另取标准铝盐溶液[称取硫酸铝钾0.352g,置100ml量瓶中,加1mol/L硫酸溶液10ml溶解后,用水稀释至刻度,摇匀,作为贮备液。
临用前,精密量取贮备液1ml,置100ml量瓶中,用水稀释至刻度,摇匀,即得(每1ml相当于2μg的Al)]2.0ml,置分液漏斗中,加醋酸盐缓冲液(pH 6.0)10ml和水98ml,同法操作,即得标准溶液;取醋酸盐缓冲液(pH 6.0)10ml和水100ml,置分液漏斗中,同法操作,作为空白溶液。
取上述溶液,照荧光分析法(附录ⅣE),在激发光波长392nm与发射光波长518nm处分别测定荧光强度。
供试品溶液的荧光强度不得大于标准溶液的荧光强度(0.000 001%)。
纯化水质量标准及检验操作规程

及检验操作规程1.目的:建立纯化水质量标准及检验操作规程,规范检验操作。
2.范围:纯化水质量标准及检验操作3.责任:纯化水检验员4.质量标准及检验操作规程:本品为饮用水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的制药用水,不含任何添加剂。
5检验操作规程5.1 性状5.1.1.标准要求:无色的澄清液体;无臭,无味。
5.1.2.操作方法:目测观察。
5.1.3.原理\检验方法:目测观察与鼻子闻味。
5.2酸碱度5.2.1.标准要求:不得显红色、不得显蓝色5.2.2.操作方法:取本品10ml,加甲基红指示液2滴,不得显红色;取10ml,加溴麝香草酚蓝指示液5滴,不得显蓝色。
5.2.3.原理:甲基红指示液变色范围pH4.2~6.3(红→黄)溴麝香草酚蓝指示液变色范围pH6.0 ~7.6 (黄→蓝)所以pH检测值在 4.2 ~7.6为合格,超出此范围颜色(红\蓝)为不合格。
5.2.4.试剂配制:(1)溴麝香草酚蓝指示液—取溴麝香草酚蓝0.1g,加0.05mol/L氢氧化钠溶液3.2ml使溶解,再加水稀释至200ml,即得。
(2)甲基红指示液—取甲基红0.1g,加0.05mol/L氢氧化钠溶液7.4ml使溶解,再加水稀释至200ml,即得。
(3)0.05mol/L氢氧化钠溶液—取氢氧化钠0.2g,加水使溶解成100ml,即得。
5.3硝酸盐5.3.1.标准要求:不得更深(0.000006%)5.3.2.操作方法:取本品5ml置试管中,于冰浴中冷却,加10%氯化钾溶液0.4ml与0.1%二苯胺硫酸溶液0.1ml,摇匀,缓缓滴加硫酸5ml,摇匀,将试管于50℃水浴中放置15分钟,溶液产生的蓝色与标准硝酸盐溶液0.3ml,加无硝酸盐的水 4. 7ml,用同一方法处理后的颜色比较,不得更深。
5.3.3.原理:5.3.3.1 硝酸盐与二苯胺硫酸在酸性的条件下生成有色(蓝色)物质。
(硝烟反应:苯胺被氧化,得到的是一个醌式结构,醌式物质为蓝色)5.3.3.2 标准硝酸盐溶液(每 1 ml 相当于1μg 的NO3)0.3 ml ,无硝酸盐的水4.7ml 。
2010版《中国药典》纯化水标准及检测项目
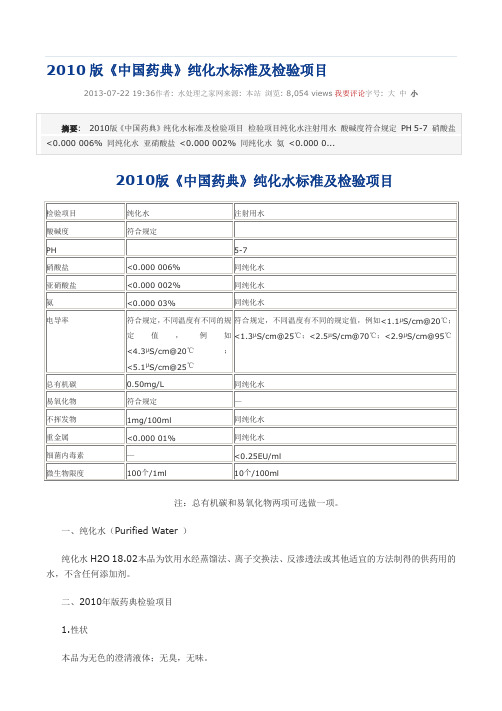
2010版《中国药典》纯化水标准及检验项目2013-07-22 19:36作者: 水处理之家网来源: 本站浏览: 8,054 views我要评论字号: 大中小注:总有机碳和易氧化物两项可选做一项。
一、纯化水(Purified Water )纯化水H2O 18.02本品为饮用水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的供药用的水,不含任何添加剂。
二、2010年版药典检验项目1.性状本品为无色的澄清液体;无臭,无味。
取本品10ml,加甲基红指示液2滴,不得显红色;另取10ml,加溴麝香草酚蓝指示液5滴,不得显蓝色。
3.硝酸盐取本品5ml置试管中,于冰浴中冷却,加10%氯化钾溶液0.4ml与0.1%二苯胺硫酸溶液0.1ml,摇匀,缓缓滴加硫酸5ml,摇匀,将试管于50℃水浴中放置15分钟,溶液产生的蓝色与标准硝酸盐溶液[取硝酸钾0.163g,加水溶解并稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,再精密量取10ml,加水稀释成100ml,摇匀,即得(每1ml相当于1μgNO3)]0.3ml,加无硝酸盐的水4.7ml,用同一方法处理后的颜色比较,不得更深(0.000 006%)。
4.亚硝酸盐取本品10ml,置纳氏管中,加对氨基苯磺酰胺的稀盐酸溶液(1→100)1ml及盐酸萘乙二胺溶液(0.1→100)1ml,产生的粉红色,与标准亚硝酸盐溶液[取亚硝酸钠0.750g(按干燥品计算),加水溶解,稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,摇匀,再精密量取1ml,加水稀释成50ml,摇匀,即得(每1ml相当于1μgNO2))0.2ml,加无亚硝酸盐的水9.8ml,用同一方法处理后的颜色比较,不得更深(.0000 02%)。
5.氨取本品50ml,加碱性碘化汞钾试液2ml,放置15分钟;如显色,与氯化铵溶液(取氯化铵31.5mg,加无氨水适量使溶解并稀释成1000ml)1.5ml,加无氨水48ml与碱性碘化汞钾试液2ml制成的对照液比较,不得更深(0.000 03%)。
中国药典纯化水标准

中国药典纯化水标准
中国药典纯化水,是指符合中国药典规定的水质标准,用于药品生产中的洁净
生产环境和药品生产中的洗涤、溶解、稀释等工艺过程。
中国药典纯化水标准的制定,旨在保障药品生产过程中水质的安全、纯净、稳定,确保药品质量的稳定和安全。
中国药典纯化水标准主要包括外观、物理性质、化学性质、微生物限度等多个
方面的指标。
在外观方面,要求水质清澈透明,无悬浮物和沉淀物。
在物理性质方面,要求水质无色无味,不含有害物质,电导率低,矿化度低。
在化学性质方面,要求水质无重金属、无机盐、有机物质等有害成分。
在微生物限度方面,要求水质无细菌、霉菌和其他微生物。
中国药典纯化水标准的制定,是为了保障药品生产过程中水质的安全和稳定。
水作为药品生产过程中的重要原料,其质量直接影响药品的质量和安全,因此,严格执行中国药典纯化水标准,对于保障药品质量和安全具有重要意义。
在实际生产中,要严格按照中国药典纯化水标准执行,建立健全水质管理体系,加强水质监测和检验,确保生产用水符合标准要求。
同时,加强设备维护和清洁,确保生产设备和管道不会对水质造成污染。
加强员工培训,提高操作技能,做好生产过程中的水质控制和管理。
总之,中国药典纯化水标准的制定和执行,对于保障药品生产过程中水质的安
全和稳定具有重要意义。
只有严格执行标准要求,加强水质管理,才能确保药品质量和安全,保障人民群众的用药安全。
希望各药品生产企业能够重视中国药典纯化水标准,切实加强水质管理,提高药品质量,为人民群众的健康保驾护航。
纯化水检验微生物限度记录

(cfu/ml)
平均(cfu/ml)
阴性对照
结论
平皿1
(cfu)
平
平皿2
(cfu)
检验人:复核人:
纯化水检验记录
启用日期:2011年3月20日编号:REC-SOP.QC-ZL-054a-02
检验项目
微生物限度检查
检验日期
年月日
检验依据
《中国药典》2010年版二部
报告日期
年月日
检查方法:
薄膜过滤法:先用少量0.9%无菌氯化钠溶液将滤膜润湿,然后将供试品液经薄膜过滤,过滤后取出滤膜,菌面朝上贴于培养基上培养。细菌、霉菌和酵母菌总数不超过100cfu/ml为合格。
细菌总数检查:营养琼脂培养基。培养温度:℃培养时间(3天):月日时至月日时
霉菌和酵母菌总数检查:玫瑰红钠琼脂培养基。培养温度:℃培养时间(5天):月日时至月日时
细菌总数检查设备编号:
霉菌和酵母菌总数检查设备编号:
取样点
平皿1
(cfu/ml)
平皿2
(cfu/ml)
平均(cfu/ml)
阴性对照
平皿1
(cfu/ml)
版药典纯化水设备制作要求及标准

2010版药典纯化水设备制作要求及标准1purpose目的本URS文件规定了纯化水系统的用户需求,总括了用户对该设备的功能、性能、制造及标准等方面的要求。
本URS文件是构建起项目和系统的文件体系的基础,同时也是验收的主要依据。
2scope范围本URS文件的范围自原水进水阀开始至纯水灭菌后输出的整个纯水制备系统。
包括设备配电控制柜、电仪系统、原水进水自动阀、纯化水泵、臭氧灭菌器等。
3responsibility职责质量部质量工程师负责编写和发行本URS文件。
设备部厂务工程师负责按本URS文件确认和验收纯化水系统。
4referencedocuments参考文件《中华人民共和国药典》2010年版《中华人民共和国药品质量管理规范(2010年版)》《钢制件焊接常压容器》JB/T4735-95GB/T19249-2003反渗透水处理设备GB/T《机械产品电气安全要求通用要求》5Procedure程序使用要求URSNo: 需求编号Requirements需求Require/Expect必须/期望URS001 纯化储罐水量:吨必须URS002 制水机产水量:吨/小时必须URS003 纯化水指标:符合中国药典(2010版)纯化水指标必须URS004 生产出水点:5个(生产洁净区3个,实验室2个)必须技术要求工艺技术总要求URSNo: 需求编号Requirements需求Require/Expect必须/期望URS005 纯化水质符合《中华人民共和国药典》2010年版要求电导率小于2μS/cm(25℃,在线控制),TOC控制在L内(离线控制),不挥发物小于1mg/100ml,微生物限度100个/1ml,pH5-7,硝酸盐<006%,亚硝酸盐<002%,氨<03%,重金属<01%必须URS006 纯化水制备系统的设计基于如下原水数据:按城市饮用水供水水质进行设计必须URS007 系统设计应最大限度地减少微生物生长的可能,应最大限度地减少系统死点必须URS008 任何与纯化水接触的材料必须满足GMP的要求,所用钢材必须是304L以上不锈钢必须/304卫生级管件URS009 整个系统必须具备可靠的消毒功能必须URS010 为了控制纯化水产品的质量,必须控制总送水、原水储罐和总回水。
《中国药典》2010版纯化水和注射用水检验项目
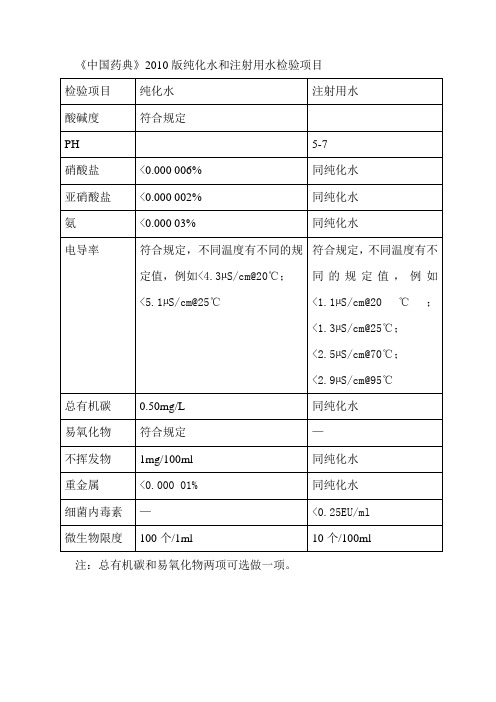
检验项目
纯化水
注射用水
酸碱度
符合规定
PH
5-7
硝酸盐
<0.000 006%
同纯化水
亚硝酸盐
<0.000 002%
同纯化水
氨
<0.000 03%
同纯化水
电导率
符合规定,不同温度有不同的规定值,例如<4.3µS/cm@20℃;
<5.1µS/cm@25℃
符合规定,不同温度有不同的规定值,例如<1.1µS/cm@20℃;<1.3µS/cm@25℃;
电导率(µS/cm)
温度(℃)
电导率(µS/cm)
0
0.6
55
2.1
5
0.8
60
2.2
10
0.9
65
2.4
15
1.0
70
2.5
20
1.1
75
2.7
25
1.3
80
2.7
30
1.4
85
2.7
35
1.5
90
2.7
40
1.7
95
2.9
45
1.8
100
3.1
50
1.9
温度(℃)
电导率(µS/cm)
温度(℃)
电导率(µS/cm)
0
2.4
60
8.1
10
3.6
70
9.1
20
4.3
75
9.7
25
5.1
80
9.7
30
5.4
90
9.7
40
2010年版中国药典纯化水标准

纯化水质量标准1.本品为饮用水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的制药用水,不含任何添加剂。
纯化水质量标准性状无色的澄清液体;无臭,无味。
酸碱度取本品10ml,加甲基红指示液2滴,不得显红色;加溴麝香草酚蓝指示液5滴,不得显蓝色。
硝酸盐取本品5ml置试管中,于冰浴中冷却,加10%氯化钾溶液0.4ml与0.1%二苯胺硫酸溶液0.1ml,摇匀,缓缓滴加硫酸5ml,摇匀,将试管于50℃水浴中放置15分钟,溶液产生的蓝色与标准硝酸盐溶液[取硝酸钾0.163g,加水溶解并稀释至100ml,摇匀,精密量取1ml,加水稀释至100ml,再精密量取10ml,加水稀释至100ml,摇匀,即得(每1ml相当)]0.3ml,加无硝酸盐的水4.7ml,用同一方法处理后的颜色比较,不得更深(0.000 于1ugNO3006%)。
亚硝酸盐取本品10ml,置纳氏管中,加对氨基苯磺酰胺的稀盐酸溶液(1→100)1ml与盐酸萘乙二胺溶液(0.1→100)1ml,产生的粉红色,与标准亚硝酸盐溶液[取亚硝酸钠0.750g (按干燥品计算),加水溶解,稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,摇)]0.2ml,加无匀,再精密量取1ml,加水稀释成50ml,摇匀,即得(每1ml相当于1ug NO2亚硝酸盐的水9.8ml,用同一方法处理后的颜色比较,不得更深(0.000 002%)。
氨取本品50ml,加碱性碘化汞钾试液2ml,放置15分钟;如显色,与氯化铵溶液(取氯化铵31.5mg,加无氨水适量使溶解并稀释成1000ml)1.5ml,加无氨水48ml与碱性碘化汞钾试液2ml制成的对照液比较,不得更深(0.000 003%)。
电导率应符合规定(中国药典2010年版附录Ⅶ S)总有机碳不得过0.5mg/L(中国药典2010年版附录Ⅶ R)易氧化物取本品100ml,加稀硫酸10ml,煮沸后,加高锰酸钾滴定液(0.02mol/L)0.10ml,再煮沸10分钟,粉红色不得完全消失。
中国药典2010

《中国药典》(2010年版)规定:“纯化水为采用蒸馏法、离子交换法、反渗透法,EDI法或其他适宜的方法制得供药用的水。
”而不再仅局限于“蒸馏”这一种工艺。
药典这一改变是我国制药用水生产发展史上的一大进步,与世界先进国家的药典实现了接轨。
药典将注射用水规定为“纯化水经蒸馏所得的水”。
而USP已连续在7个版本中明确规定反渗透(reverse osmosis,RO)法可以作为制取注射用水的法定方法,显示了人们对采用膜技术生产制药用水的信心。
膜分离法生产制药用水是制药用水技术发展的必然趋势。
目前,国内、外多数制药企业采用离子交换及反渗透、离子交换联合等方法制得纯化水,再经蒸馏的方法制取注射用水。
上述制药用水生产工艺中,离子交换技术作为深度除盐手段仍被普遍采用。
但离子交换树脂再生时会产生大量废酸、废碱,严重污染环境,发展受到制约。
反渗透膜对水中的细菌、热原、病毒及有机物的去除率达到100%。
二级反渗透虽可以免除使用离子交换树脂,但对原水的含盐量要求极高,因为目前反渗透装置的系统脱盐率为98%左右,如果原水含盐量高,则产水电导率就会超过控制指标。
医药用纯水对水质要求相对来说更加严格,更加高。
常要求超纯水的电阻值应高于15兆以上。
为保证医药用超纯水的用水安全,超纯水的处理设备整个系统也都由全不锈钢材质组合而成,而且在用水点之前都必须装备杀菌装置。
我们公司从整个医药行业用超纯水的特点出发,针对不同用户对高纯水的不同要求,采用反渗透,EDI等最新工艺,比较有针对性地设计出成套高纯水处理工艺,以满足药厂、医院的纯化水制取、大输液制取的用水要求。
[编辑本段]分类制药用水(工艺用水:药品生产工艺中使用的水,包括饮用水、纯化水、注射用水)分类1)饮用水(Potable-Water):通常为自来水公司供应的自来水或深井水,又称原水,其质量必须符合国家标准GB 5749 -2006《生活饮用水卫生标准》。
按2010中国药典规定,饮用水不能直接用作制剂的制备或试验用水。
水质检验操作规程

水质检验操作规程1 目的有效控制生产、实验室用水制定本规范。
2 范围质量部3 内容本规程依据《中华人民共和国药典》2010版、GB5750-2006《生活饮用水标准检验法》、GB5749—2006《生活饮用水卫生标准》制定,适用于纯化水的检验。
纯化水的检验参照〈中华人民共和国药典〉2010版中的纯化水检验法。
纯化水应为用蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的水,不含任何附加剂。
1、标准控制指标检验项目标准要求1、性状无色透明、无臭、无味2、酸碱度加指示剂应不显红或蓝3、氯化物不得发生浑浊4、硫酸盐不得发生浑浊5、钙盐不得发生浑浊6、硝酸盐≤0。
000006%7、亚硝酸盐≤0。
000002%8、氨≤0。
00003%9、二氧化碳一小时内不得发生浑浊10、易氧化物应不褪色11、不挥发物≤1mg/100ml12、重金属≤0.00005%2、检验2。
1性状将水置入干净透明的玻璃瓶中,静置后仔细观察,应为无色澄明液体,无臭、无味。
2。
2酸碱度取待测水样10ml于比色管中,加0。
05%甲基红指示剂2滴,不得显红色;另取10ml 待测水样于比色管中,加0.05%溴麝香草酚蓝指示剂5滴,不得显蓝色。
2。
3氯化物、硫酸盐、钙盐取本样品分装于三支100ml比色管中,每支比色管各加50ml。
第一管中用滴管和1ml 吸管分别加浓硝酸5滴与0.1mol/l硝酸银试液1ml,第二管中用2ml吸管加5%氯化钡试液2ml,第三管中用2ml吸管加入3。
5%草酸铵试液2 ml ,均不得发生浑浊。
2.4硝酸盐2.4。
1标准硝酸盐溶液的制备:在万分之一天平上称取分析纯硝酸钾0.163克,加水溶解并稀释至100ml,摇匀,用1ml吸管精密量取1ml,加水稀释至1000ml,此标准溶液每ml相当于1μg的NO3。
用1ml吸管精密量取0.3 ml该标准液于100 ml比色管中,加无硝酸盐的水4.7ml,于冰浴中冷却,用1ml吸管加10%氯化钾0.4ml和0。
2010版药典纯化水标准

2010版药典纯化水标准
2010版药典中对纯化水的标准有详细规定。
纯化水是一种用于制药工艺和实验室分析的特殊水质,要求在物理、化学和微生物方面达到一定的纯度标准。
以下是2010版药典对纯化水的一些重要标准:
1. 外观:纯化水应该是透明的,没有悬浮物或沉淀物。
2. pH 值:纯化水的 pH 值应在5.0-7.0之间,以确保其适合药物制剂的使用。
3. 电导率:纯化水的电导率应低于1.3微西门子/厘米,以确保水中的离子浓度较低。
4. 溶解氧:纯化水中的溶解氧应低于0.5毫克/升,以避免氧气对药物的氧化影响。
5. 有机杂质:纯化水中的有机杂质应控制在一定范围内,以避免对药物质量的影响。
6. 无机杂质:纯化水中的无机杂质应控制在一定范围内,以避免对药物质量的影响。
7. 微生物限度:纯化水中的微生物限度应符合一定的标准,以确保水的微生物质量达到要求。
这些标准是为了确保纯化水在制药过程中的质量和安全性,以保证药物的质量和有效性。
药品生产过程中使用符合药典标准的纯化水,可以减少对药品的污染和不良反应的风险。
