2蛋白质的结构与功能
蛋白质的结构与功能2

COOC +NH3
H
L-氨基酸的丙甘通氨氨式酸酸
第八页,编辑于星期三:一点 二十三分。
(一)氨基酸的分类
1. 非极性脂肪族氨基酸 2. 极性中性氨基酸 3. 芳香族氨基酸
4. 酸性氨基酸
5. 碱性氨基酸
第九页,编辑于星期三:一点 二十三分。
1. 非极性脂肪族氨基酸
第十页,编辑于星期三:一点 二十三分。
第四十二页,编辑于星期三:一点 二十三分。
(2)β-折叠
β-折叠呈折纸状
多肽链充分伸展,各个肽单元以Cα 为旋转点,依次折叠成锯齿状结构,氨
基酸残基侧链交替地位于锯齿状结构的上 下方。
第四十三页,编辑于星期三:一点 二十三分。
第四十四页,编辑于星期三:一点 二十三分。
β-折叠
第四十五页,编辑于星期三:一点 二十三分。
2. 蛋白质二级结构的主要构象形式
n α-螺旋(α-helix) n β-折叠(β-pleated sheet) n β-转角(β-turn) n 无规卷曲(random coil)
第三十八页,编辑于星期三:一点 二十三分。
(1)α-螺旋
多肽链中的主链围绕中心轴有规律的 螺旋式上升,螺旋的走向为顺时针方向, 称右手螺旋。
第四页,编辑于星期三:一点 二十三分。
蛋白质的元素组成
主要含有碳、氢、氧、氮及硫。 有些蛋白质还含有磷、铁、铜、锌、
锰、钴及钼等。
第五页,编辑于星期三:一点 二十三分。
蛋白质元素组成的特点
蛋白质的含氮量接近,平均为16%。 测定生物样品含氮量可推算出蛋白质
大致含量。
100克样品中蛋白质的含量(g%) =
三级结构 (tertiary structure) 四级结构 (quaternary structure)
第二章蛋白质的结构和生理功能

二、氨基酸的性质和生理特点 (一)性质 1.物理性质 无味、无色晶体物质; 熔点200-300oC之间,会分解成胺和CO2; 具有较高的介电常数; 一般可溶于水,其水溶液为无色透明液体, 溶解度各不相同; 一般不溶于有机溶剂; 均溶于稀酸或稀碱。
2.氨基酸的晶体存在形式
氨基酸晶体是以离子晶格组成的,维系晶 格中质点的作用力是较强的静电吸引力,因而 熔点高,而一般的有机化合物晶体是由分子晶 格组成,其维系力为较弱的范德华力,此类物 质熔点较低。
蛋白质功能的多样性
• 具有储藏氨基酸的功能。用作有机体及其胚胎 或幼体生长发育的原料。如蛋类中的卵清蛋白、 乳中的酪蛋白、小麦种子中的麦醇蛋白。 • 运输功能。脊椎动物红细胞里的血红蛋白、无 脊椎动物中的血蓝蛋白在呼吸过程中起着输送 氧气的作用;血液中的脂蛋白随血流输送脂质; 生物氧化过程中的某些色素蛋白如细胞色素C 等起电子传递体的作用。
• • • • 氨基酸排列随机性 周期性的重复未发现 二硫键的数目和位置也没有明显的规律 每种蛋白质化学结构的独特性 在同源蛋白质氨基酸顺序中有许多位置的氨基 酸对所有种属来说是相同的(不变残基),但 其他位置的氨基酸却不同(可变残基)。这种 相似性被称为顺序同源现象。
蛋白质一级结构的重要性
氨基酸组成及顺序不同会导致蛋 白质生物功能的改变(病态现象)。如 镰刀形细胞贫血病就是血红蛋白(4个 亚基,582个氨基酸组成)中的一个谷 氨酸变为缬氨酸导致的。 一级结构是立体结构的基础。
在研究蛋白质氨基酸组成时一般先用完全 水解的方法,将蛋白质水解成各种氨基酸的 混合物,然后采用高效液相色谱等方法进行 定量测定。通常采用的水解方法有酸水解、 碱水解和酶水解。
酸水解
用硫酸(6 mol/L)或盐酸(4 mol/L)煮沸回流20小时。
高一生物必修知识点:2.2.2蛋白质的结构和功能

高一生物必修知识点:2.2.2蛋白质的结构和功能【必修一】高中生物必备知识点:2.2.2蛋白质的结构和功能1、组成及特点:(1) 蛋白质是由C(碳)、H(氢)、O(氧)、N(氮)组成,一般蛋白质可能还会含有P(磷)、S(硫)、Fe(铁)、Zn(锌)、Cu(铜)、B(硼)、Mn(锰)、I(碘)、Mo(钼)等。
这些元素在蛋白质中的组成百分比约为:碳50% 氢7% 氧23% 氮16% 硫0~3% 其他微量。
(2) 一切蛋白质都含N元素,且各种蛋白质的含氮量很接近,平均为16%。
(3) 氨基酸分子相互结合的方式是:一个氨基酸分子的羧基(-COOH)和另一个氨基酸分子的氨基(—NH 2 )相连接,同时脱去一分子水,这种结合方式叫做脱水缩合。
连接两个氨基酸分子的化学键(-NH-CO-)叫做肽键。
有两个氨基酸分子缩合而成的化合物,叫做二肽。
肽链能盘曲、折叠、形成有一定空间结构的蛋白质分子。
2、蛋白质的性质:(1) 两性:蛋白质是由α-氨基酸通过肽键构成的高分子化合物,在蛋白质分子中存在着氨基和羧基,因此跟氨基酸相似,蛋白质也是两性物质。
(2) 水解反应:蛋白质在酸、碱或酶的作用下发生水解反应,经过多肽,最后得到多种α-氨基酸。
(3) 胶体性质:有些蛋白质能够溶解在水里(例如鸡蛋白能溶解在水里)形成溶液。
蛋白质的分子直径达到了胶体微粒的大小(10-9~10-7m)时,所以蛋白质具有胶体的性质。
(4) 盐析:少量的盐(如硫酸铵、硫酸钠等)能促进蛋白质的溶解。
如果向蛋白质水溶液中加入浓的无机盐溶液,可使蛋白质的溶解度降低,而从溶液中析出。
这样盐析出的蛋白质仍旧可以溶解在水中,而不影响原来蛋白质的性质,因此盐析是个可逆过程.利用这个性质,采用分段盐析方法可以分离提纯蛋白质。
(5) 变性:在热、酸、碱、重金属盐、紫外线等作作用下,蛋白质会发生性质上的改变而凝结起来.这种凝结是不可逆的,不能再使它们恢复成原来的蛋白质.蛋白质的这种变化叫做变性。
第2章蛋白质的结构与功能

O
O
NH2-CH-C-N-CH-C
H H H OH
肽键
甘氨酰甘氨酸
* 肽是由氨基酸通过肽键缩合而形成的化 合物。
* 两分子氨基酸缩合形成二肽,三分子氨 基酸缩合则形成三肽……
* 由十个以内氨基酸相连而成的肽称为寡 肽(oligopeptide),由更多的氨基酸相连 形成的肽称多肽(polypeptide)。(分界..)
亮氨酸 leucine Leu L 5.98
异亮氨酸 isoleucine Ile I 6.02
苯丙氨酸 phenylalanine Phe F 5.48
脯氨酸 proline
Pro P 6.30
目录
2. 极性中性氨基酸
色氨酸 tryptophan Trp W 5.89
丝氨酸 serine
Ser S 5.68
高级 结构
一、蛋白质的一级结构
★定义(primary structure) 蛋白质的一级结构指在蛋白质分子中,从N端
至C端的氨基酸的排列顺序。
主要的化学键 肽键,有些蛋白质还包括二硫键。
氨基酸与多肽
(一)肽(peptide)
* 肽键(peptide bond)是由一个氨基酸的羧基与另一个氨基酸的-氨基脱水缩合 而形成的化学键。
细胞的各个部分都含有蛋白质。 含量高:蛋白质是细胞内最丰富的有机
分子,占人体干重的45%,某些组织含量更 高,例如脾、肺及横纹肌等高达80%。
2. 蛋白质具有重要的生物学功能
1)作为生物催化剂(酶) 2)代谢调节作用(TRH) 3)免疫保护作用:IgA,IgM, IgM, IgG; 4)物质的转运和存储(Hb) 5)运动与支持作用 6)参与细胞间信息传递
第二节蛋白质的结构与功能

第二章蛋白质的结构与功能蛋白质(protein)是生命的物质基础。
种类繁多,人体含蛋白质种类在10万种以上。
是生物体含量最丰硕的生物大分子,约占人体固体成份的45%,细胞干重的70%。
几乎所有的器官都含有蛋白质,并各自具有其特殊的结构,因此决定了蛋白质功能的多样性。
第一节蛋白质的分子组成(protein composition and construction )一、蛋白质的元素组成蛋白质的元素要紧有碳(50%~55%)、氢(6%~7%)、氧(19%~24%)、氮(13%~19%)。
大部份蛋白质还含有硫,有的还含有少量的磷或铁、锰、锌、铜、钴、钼,个别还含有碘。
蛋白质元素组成特点:含氮量很接近,平均为16%。
1g氮相当于6.25g蛋白质。
测定诞生物样品的含氮量可按下式计算出其蛋白质大致含量:100g样品中蛋白质含量(g%)=每克样品中含氮克数××100二、蛋白质的大体组成单位——氨基酸(the basic unit of protein composition——amino acid)氨基酸(amino acid)是组成蛋白质的大体单位。
(一)氨基酸的命名(略)(二)氨基酸的结构特点自然界中的氨基酸有300余种,组成人体蛋白质的氨基酸仅有20种。
都有相应的遗传密码,故又称为编码氨基酸。
氨基酸的结构通式可用下式表示(R为氨基酸侧链):尽管各类氨基酸结构各不相同,但都具有如下特点:1.组成蛋白质的氨基酸都是α-氨基酸。
即氨基均连在α-碳原子上。
脯氨酸为α-亚氨基酸。
2.除甘氨酸外,其余氨基酸的α-碳原子是不对称碳原子,有两种不同的构型,即L型和D型。
组成人体蛋白质的氨基酸都是L型,即L-α-氨基酸。
L-α-氨基酸 D-α-氨基酸(三)氨基酸的分类氨基酸的按侧链的结构和理化性质可分为4类:非极性侧链氨基酸:甘氨酸(Gly),丙氨酸(Ala),缬氨酸,亮氨酸,异亮氨酸,丙氨酸,脯氨酸(Pro);侧链为烃基、吲哚环或甲硫基等非极性疏水集团。
蛋白质的结构与功能的关系

蛋白质的结构与功能的关系
答:蛋白质的结构与功能的关系是:
1.蛋白质的结构决定了其功能。
蛋白质的特定构象和结构决定了其特定的生物学功能。
例如,蛋白质的催化作用、运输作用、免疫作用等,都是由其特定的结构决定的。
2.蛋白质的一级结构决定其高级结构,因此,最终决定了蛋白质的功能。
一级结构相
似的蛋白质具有相似的功能。
3.蛋白质的进化。
类似物指具有相同的功能,但起源于不同的祖先基因的蛋白质,是
基因趋同进化的产物。
同源蛋白质的氨基酸序列具有明显的相似性,这种相似性称为序列同源。
蛋白质的结构与功能-2

成
人工合成具有生物活性的牛胰岛素
牛胰岛素(insulin)由51个氨基酸残基组成, 分为A、B两条链。A链21个氨基酸残基,B链30 个氨基酸残基。A、B两条链之间通过两个二硫 键联结在一起,A链另有一个链内二硫键。
牛 胰 岛 素 一 级 结 构
测定蛋白质的一级结构的主要意义:
一级结构是研究高级结构的基础。 可以从分子水平阐明蛋白质的结构与功能 的关系。 为生物进化理论提供依据。 为人工合成蛋白质提供参考顺序。
D.—CNOHCNOHCNOH—
E.—CHNOCHNOCHNO—
蛋白质的α螺旋 (C) A. 由二硫键形成周期性结构
B. 与β片层的构象相同
C. 由主链骨架NH与CO之间的氢键维持稳定
D. 是一种无规则卷曲
E. 可被β巯基乙醇破坏
蛋白质分子中α螺旋构象的特点是(E)
A. 靠盐键维持稳定
B. 肽键平面充分伸展
一、蛋白质的一级结构
蛋白质的一级结构(primary structure)是指蛋 白质多肽链中从N-端至C-端的氨基酸排列顺序及
二硫键的连接方式,即多肽链的线状结构。
维系蛋白质一级结构的主要化学键为肽键,还有
二硫键的位置。
牛胰岛素
第一个被测定一级
结构的蛋白质分子;
由英国化学家
F.Sanger于1953年完
(三) -转角
( β turn/bend/hairpin structure)
肽链主链骨架180°的回折结构 由4个连续的AA残基组成 第一个残基C=O 第四个残基NH 形成氢键
特点:
第二个残基常为脯氨酸
比较稳定的环状结构
最经典总结-蛋白质的结构和功能

考点二 蛋白质的结构和功能(5年6考)I 考点自主航理I ,夯基国本提,精华1.蛋白质的结构及其多样性(1)氨基酸的脱水缩合①过程:一个氨基酸分子中的 氨基(一NH 2)和另一个氨基酸分子中的 羧基 2 (—COOH)相连接,同时脱去一分子水。
②二肽形成示例③肽键:连接两个氨基酸分子的化学键可表示为一CO —NH —。
⑵蛋白质的结构层次①肽的名称确定:一条多肽链由几个氨基酸分子构成就称为几肽。
②H 2O 中各元素的来源:H 来自一COOH 和一NH 2,O 来自一COOH 。
③一条肽链上氨基数或羧基数的确定:一条肽链上至少有一个游离的氨基和一个 游离的羧基,分别位于肽链的两端;其余的氨基(或羧基)在R 基上。
(3)蛋白质的结构多样性与功能多样性0-H+11场所:核桃体H-N-C4C-N4C-C-O-H + 氏0 । r II । । II—H H 0 H H 0 fl -M T C近白质 游离段基游离就基 \ 7个,……毕的 瞬 H.N-C-COb CJH+H三HN ・匚一CCDJK +H N-C-CGOH - - H …够…lih- - - ®■助学巧记 巧用“一、二、三、四、五”助记蛋白质的结构与功能(小,忘汗氨底顿的结枸通式.标r 期成全白质的泉舟豉曲随同时具作的标泄有两Vy "个;-星数量祚准,二是位置标准.白、, .蛋白质分子小成过程的鼻色装蚩关系;.脱盅水分 系 子数=肽被蛾=氢.霖酸缴-肽鞋数.原 理白质分子制构多样性的原因有明个:敏魅威相 1小J 看 '种.不同•缸在般的救量不同,氨基酸排列喧 工 序不同,蛋告盾的空间结构不同.八八!期.蛋白质弁子主要有5个功能:细胞的如成物质•■傕 ⑦ 能一化作用,免疫作用.运输作用和调节作用. 2.氨基酸脱水缩合与相关计算(1)蛋白质相对分子质量、氨基酸数、肽链数、肽键数和失去水分子数的关系 ①肽键数=失去水分子数=氨基酸数一肽链数;②蛋白质相对分子质量=氨基酸数目义氨基酸平均相对分子质量一脱去水分子 数又18。
蛋白质的结构与功能
酰胺平面对肽链结构的限制
酰胺平面的存在,使得肽链中的任何一个氨基酸残基只 有2个角度可以旋转。由C-N单键旋转的角度被称为 (phi),C-C单键旋转的角度被称为 (psi)。当一条肽链 上所有氨基酸残基的和确定以后,该肽链主链骨架的 基本走向也就确定了。
(, )为正值对应于从C观察时单键向顺时针旋转。如果 值为零意味着 C=O 或 N-H 键平分R-C -H角。
前四种二级结构具有规律,反映在拉氏图 上具有相对固定的二面角
α螺旋的主要内容
① 肽链骨架围绕一个轴以螺旋的方式伸展;
② 螺旋形成是自发的,肽链骨架上由n位氨基酸残基上 的-C=O与n+4位残基上的-NH之间形成的氢键起着稳 定的作用。被氢键封闭的环含有13个原子,因此α螺 旋也称为3.613-螺旋;
His的R基团中接近生理pH下的解离性质
氨基酸的功能
肽包括蛋白质的组成单位 氧化分解供能 合成其他生物分子的原料 本身具有特殊的生物功能,如G、D和E作为神经
递质
肽的定义
肽就是氨基酸之间通过α-氨基和α-羧基缩合以酰 胺键或肽键相连的聚合物,它包括寡肽、多肽和 蛋白质。
构成肽的每一个氨基酸单位被称为氨基酸残基。 各氨基酸残基以肽键相连形成的链状结构被称为 肽链。
③ 侧链基团垂直于相邻两个肽平面的交线,并交替分布 在折叠片层的两侧;
④ 肽段平行的走向有平行和反平行两种,前者指两个肽 段的N-端位于同侧,较为少见,后者正好相反。由于 反平行折叠所形成的氢键N-H-O三个原子几乎位于同 一直线上,因此,反平行β-折叠更稳定。
⑤ 反平行β-折叠的每一个氨基酸残基上升0.347nm,正平 行的每一个氨基酸残基上升0.325nm。β-折叠的二面角 (ф,ψ)等于(-119º,+113º)。
蛋白质的结构与功能

蛋白质的结构与功能蛋白质是生命体中一类重要的生物大分子,它不仅在细胞中发挥着结构支持的作用,在身体健康、免疫系统、酶催化等方面也扮演着重要的角色。
蛋白质的结构非常复杂,由由氨基酸组成的多肽链所构成。
氨基酸是蛋白质的基本构建单元,每个氨基酸分子由一个中心碳原子与一个氨基基团、一个羧基基团和一个侧链基团组成。
侧链基团的特性决定了氨基酸的属性,如极性、疏水性等。
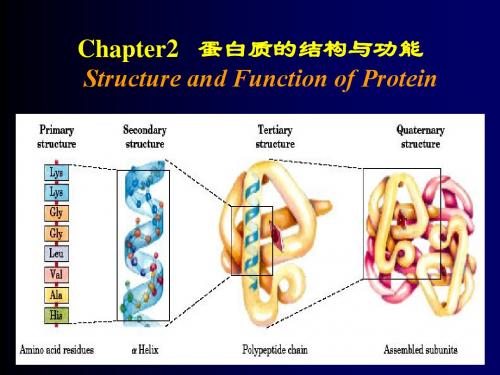
一般而言,蛋白质的主要级别包括了四个层次,即一级结构、二级结构、三级结构和四级结构。
一级结构是指蛋白质中氨基酸的线性顺序,即多肽链的序列。
二级结构是指具有规则重复模式的局部折叠,其中最常见的是α-螺旋和β-折叠。
三级结构则是指多肽链在空间上的折叠方式,由氨基酸之间的相互作用所决定。
最后,四级结构是指由多个多肽链相互作用而形成的复合体。
蛋白质的结构对其功能起到了至关重要的作用。
首先,蛋白质的结构决定了其拥有多种功能。
例如,一些蛋白质具有酶活性,可以催化化学反应。
这是由于蛋白质的结构所提供的理想的活性中心,使其与底物结合形成复合物,从而降低反应能垒,加速化学反应的进行。
此外,蛋白质的结构也决定了它们的能力来与其他分子相互作用,如激素和受体之间的相互作用,或抗体与抗原之间的特异性结合。
其次,蛋白质的结构对其稳定性和折叠性起到了重要作用。
蛋白质的折叠状态是由其氨基酸序列和相互作用所决定的。
在正常情况下,蛋白质的结构是稳定的,但当蛋白质结构发生改变时,如突变,可能导致蛋白质失去原有的功能,甚至突变蛋白质可能会引起一些疾病。
此外,蛋白质的折叠性也影响着其在细胞中的定位和定向输送,因为只有正确折叠的蛋白质才能被正确地定位到细胞中的特定位置。
最后,蛋白质的结构还决定了其与其他分子的相互作用,并影响其在细胞内外的生理功能。
蛋白质通过与其他分子的结合来实现这些功能。
例如,血红蛋白是一种运输氧气的蛋白质,其结构使其能够与氧气结合,并在肺和组织之间进行运输。
另一个例子是抗体,它是一种免疫系统中的蛋白质,能够与抗原结合以中和病原体,从而保护机体免受疾病的侵害。
2 蛋白质的结构与功能
但氢键的键能较低(~12kJ/mol),易被破坏。
蛋白质分子中氢键的形成源自2. 疏水键:非极性物质在含水的极性环境中存在时,会产生一种相
互聚集的力,这种力称为疏水键或疏水作用力
(hydrophobic interaction)。
蛋白质分子中的许多氨基酸残基侧链也是非极性的,这 些非极性的基团在水中也可相互聚集,形成疏水键,从 而在蛋白质分子内部形成疏水核心。如Leu,Ile,Val, Phe,Ala等的侧链基团。
• 例如毛发的纤维是由多个原纤维平行排列,并 由氢键和二硫键作为交联键聚集成不溶性的蛋 白质。 • -角蛋白的伸缩性能很好,当-角蛋白被过度 拉伸时,则氢键被破坏而不能复原。此时-角 蛋白转变成-折叠结构,称为-角蛋白。
角 蛋 白 分 子 中 的 二 硫 键
•角蛋白富含半胱氨酸,不溶性、抗伸展
象角。
α-碳原子
非键合原子 接触半径
侧链
Φ=1800,ψ=1800
完全伸展的肽主链构象
Φ=00,ψ=00的多肽主链构象
• 然而 和 同时等于0°时的构象实际上并不能存在, 因为两个相邻平面上的酰胺基H原子和羰基O原子的 接触距离比其范德华半径之和小,因此将发生空间重 叠(steric overlap)。这样的构象是立体化学所不允许的 。 • 二面角(, )所决定的构象否存在,主要取决于两个 相邻肽单位中,非键合原子之间的接近有无阻碍。
3. 离子键: 离子键(salt bond)是由带正电荷基团与带负电 荷基团之间相互吸引而形成的化学键。 在近中性环境中,蛋白质分子中的酸性氨基酸 残基侧链电离后带负电荷,而碱性氨基酸残基 侧链电离后带正电荷,二者之间可形成离子键。
蛋白质分子中离子键的形成
4.范德华力(vander Waals forces): 两个相邻的不带电荷的原子之间存在的相 互作用力。 是一种比较弱的、非特异性的作用力。 主要在蛋白质的三级结构的形成中发挥作
蛋白质的一二三四级结构与功能的关系

蛋白质的一二三四级结构与功能的关系
蛋白质的结构与功能之间存在密切的关系。
蛋白质的一、二、三、四级结构决定了其功能和性质。
一级结构是指蛋白质的氨基酸序列,不同的氨基酸序列决定了不同的功能和结构。
例如,胰岛素的氨基酸序列决定了其能够调节血糖水平的功能。
二级结构是指蛋白质中氨基酸的局部空间排列方式。
常见的二级结构包括α-螺旋和β-折叠。
这些二级结构的形成由氢键作用力驱动,能够使蛋白质具有稳定的结构,从而实现其特定的功能。
例如,α-螺旋结构有助于蛋白质在细胞膜中的嵌入,而β-折叠结构则有助于蛋白质的稳定和形成复杂的三维结构。
三级结构是指蛋白质的整体空间结构,包括各个二级结构之间的空间排列和折叠方式。
蛋白质的三级结构决定了其特定的功能和催化活性。
例如,酶的活性部位通常位于蛋白质的特定空间位置,只有正确的三级结构才能发挥催化作用。
四级结构是指由多个蛋白质亚基组合而成的复合物的结构。
这些亚基之间通过非共价相互作用力(如电荷作用力、范德华力等)和共价键(如二硫键)相互连接,形成较大的功能单位。
四级结构决定了蛋白质复合物的特定功能和稳定性。
例如,血红蛋白就是一个四级结构蛋白质,它由四个亚单位组成,每个亚单位含有一个铁原子,起到运输氧气的功能。
综上所述,蛋白质的一、二、三、四级结构与其功能之间有着紧密的联系,不同结构的蛋白质具有不同的功能和性质。
蛋白质的结构与功能-2

---蛋白质二级结构的基础是肽键平面。
肽键平面/肽单元(peptide unit)
由于C=O双键中的π电子云与N原子上
的未共用电子对发生“电子共振”,使
肽键具有部分双键的性质,不能自由旋
转。
O C
O
C N
¨ N
+
共振形式
肽键中C-N键具有部分双键性质 ——组成酰胺的原子处于同一平面
肽单元——由于肽键具有部分双键的性
含有四级结构的蛋白质,单独的亚基一般没有 生物学活性,只有完整的四级结构寡聚体才有生 物学活性
血红蛋白(hemoglobin)分子中亚基的空间排布
牛 胰 岛 素 一 级 结 构
胰岛素分子 的三级结构
胰岛素是两条链通过二硫键 链接起来的,并没有亚基, 也就不存在四级结构了
总结:蛋白质结构的层次
空间位阻的意义
游离在溶液中的铁卟啉结合CO的能力比O2大25000倍,但 在肌红蛋白中,仅比O2大250倍。原因是由于空间位阻 造成的。这样可以防止代谢过程中产生的CO占据O2的结 合部位。 疏水环境的意义 通常O2与Fe(Ⅱ)接触会使Fe(Ⅱ)氧化为Fe(Ⅲ),血红素也 是一样。但在肌红蛋白内部,由于疏水的环境, Fe(Ⅱ)不易被氧化。 微环境的作用:固定血红素基,保护血红素铁免遭氧化; 为O2提供一个合适的结合部位.
胰岛素分子的三级结构
溶菌酶分子的三级结构
• 肌红蛋白 (Mb)
C 端 N端
(二)结构域
大分子蛋白质的三级结构常可分割成一个或 数个球状或纤维状的区域,折叠得较为紧密,各 行使其功能,称为结构域(domain) 。 结构域是三级结构层次上的局部折叠区。
蛋白质的结构与功能(2)

NH3+
+H+
R CH COO - +OH- R CH COO-
NH3 +
+H+
NH2
pH<pI
阳离子
pH=pI
氨基酸的兼性离子
pH>pI
阴离子
38
总结
a、各种aa的pI不同; b、同一pH下,各种aa所带电荷不同;用
离子交换、电泳将aa分开。 pH<pI :aa+ pH>pI:aac、处于pI时,aa溶解度最小,易沉淀; 可分离aa。
26
半胱氨酸
-OOC-CH-CH2-SH + HS -CH 2-CH -COO -
+NH3
-HH
+ NH3
-OOC -CH -CH 2-S S -CH 2-CH -COO -
+ NH 3
+ NH 3
二硫键
胱氨酸
27
28
三、稀有氨基酸(也称修饰氨基酸)
是在蛋白质合成后,由基本氨基酸修饰而来。 (1)4-羟脯氨酸 (2)5-羟赖氨酸 这两种氨基酸主要存在于结缔组织的纤维状蛋白中。 (3)6-N-甲基赖氨酸(存在于肌球蛋白中) (4)г-羧基谷氨酸 存在于凝血酶原及某些具有结合Ca2+离子功能的蛋白质中。 (5)Tyr的衍生物: 3.5 -二碘酪氨酸、甲状腺素 (甲状腺蛋
第二章 蛋白质的结构与功能 Chapter 2 Structure and Function of
Protein
1
第一节 蛋白质的一般概念
生命是蛋白体 的存在方式,这种 存在方式本质上就 在于这些蛋白体的 化学组成部分的不 断自我更新。
恩格斯《反杜林 论》1878
高中生物苏教版必修1课件:2.2.2 蛋白质的结构和功能

【跟踪训练】
1.已知苯丙氨酸的分子式是C9H11O2N,那么该氨基酸的R基 是
()
A.—C7H7O
B.—C7H7
C.—C7H7N
D.—C7H7NO
解析 氨基酸的通用分子式为C2H11O2NR,所以去除共同
部分即是苯丙氨酸的R基。
答案 B
探究点二 脱水缩合及相关计算 1.结合“氨基酸脱水缩合示意图”,思考并探讨:
第二课时 蛋白质的结构和功能
学习目标 1.简述氨基酸的结构特点(重点)。 2.说出脱水缩合过程(重难点)。 3.阐述蛋白质结构多样性的原因,认同蛋白质是生命活动的主
要承担者。
|基础知识|
一、蛋白质的组成和基本单位 1.组成元素 除含有_C__、__H_、__O__、__N_外,大多数蛋白质还含有
__1__
3
__2__
__2__
(2)当参与上述过程的氨基酸数为n,形成3条肽链时: ①3条肽链中所含的肽键数=_n_-__3__。 ②该过程脱去的水分子数=_n_-__3__。
③若氨基酸的平均相对分子质量为a,则该3条肽链的总相 对分子质量=_n__a_-__1_8_(n_-__3_)__。
1.蛋白质的结构层次
________________________________________________ ________________________________________________
★双缩脲试剂先加 A 液,后加 B 液,不需加热 ________________________________________________ ________________________________________________
第二章蛋白质的结构与功能

50
毛细血管的p(O2)约 为30 torr,肌红蛋白
Mb很快被饱和,代
谢活跃的细胞线粒体
80
p(O2)约1 torr(此 氧压下Mb约为25%
饱和),当肌肉收缩
引起线粒体氧压下降
23
24
蛋白质空间结构稳定的因素
主要是一些弱的相互作用或称非共价键, 包括静电相互作用(主要是盐键和范德 华力)、氢键、疏水作用。 共价二硫键在稳定某些蛋白质的构象方 面也起着重要作用。
25
26
蛋白质的变性与复性
天然蛋白质分子受到某些物理因素(如热、紫 外线照射、高压和表面张力等)或化学因素 (如有机溶剂、脲素、盐酸胍、酸、碱等)的 影响时,生物活性丧失,一些侧链基团暴露溶 解度降低,粘度增加,旋光和紫外吸收变化以 及其它的物理化学常数发生改变,这种过程称 为蛋白质变性。其实质为蛋白质分子中的次级 键被破坏,天然构象解体。变性不涉及共价键 的破裂,一级结构保持完好。
16
纤维状蛋白质可分为不溶性(硬蛋白)和可 溶性二类,前者有角蛋白、胶原蛋白和弹 性蛋白等; 后者有肌球蛋白和纤维蛋白原等,但不包 括微管(microtubule)、肌动蛋白细丝 (actin filament)或鞭毛( flagella),它 们是球状蛋白质的长向聚集体。
17
3、球状蛋白质与三级结构
氧通过血红蛋白从肺部转运到组织毛细 血管,然后从毛细血管扩散到组织中并 被肌红蛋白结合,肌红蛋白刺激O2迅速 扩散,氧化过程产生的CO2通过该转运 系统从肺部排出。
34
肌红蛋白和血红蛋白的结构
肌红蛋白的分子十分致密结实,含亲水 侧链的氨基酸残基几乎全分布于分子外 表面,而含疏水侧链的氨基酸残基几乎 都被埋在分子内部。 肌红蛋白由一条含153个氨基酸残基的多 肽链和一个辅基血红素构成。肌红蛋白 分子中多肽主链由长短不等的8段α螺旋 组成。分子中80%的残基处于α螺旋区 内。8段螺旋分别命名为A、B、C、D、 E、F、G、H。
蛋白质的结构与功能教案

蛋白质的结构与功能教案一、教学目标1. 让学生了解蛋白质的基本概念,知道蛋白质在生物体中的重要作用。
2. 使学生掌握蛋白质的结构特点,能够描述蛋白质的空间结构。
3. 培养学生理解蛋白质功能多样性与结构多样性的关系。
4. 引导学生运用所学的蛋白质知识解决实际问题,提高学生的科学素养。
二、教学内容1. 蛋白质的基本概念2. 蛋白质的结构特点3. 蛋白质的功能多样性4. 蛋白质结构与功能的关系5. 蛋白质在生物体中的重要作用三、教学方法1. 采用问题驱动的教学方法,引导学生主动探究蛋白质的结构与功能。
2. 利用多媒体课件,帮助学生直观地理解蛋白质的结构特点。
3. 结合实例,让学生了解蛋白质在生物体中的具体作用。
4. 开展小组讨论,培养学生合作学习的能力。
四、教学步骤1. 引入:通过提问方式引导学生回顾细胞中的有机化合物,为新课的学习做好铺垫。
2. 讲述:讲解蛋白质的基本概念,介绍蛋白质的结构特点。
3. 展示:利用多媒体课件展示蛋白质的结构模型,帮助学生直观地理解。
4. 分析:讲解蛋白质的功能多样性,引导学生认识蛋白质结构与功能的关系。
5. 实例:介绍蛋白质在生物体中的重要作用,如酶、抗体等。
6. 讨论:分组讨论蛋白质结构与功能的关系,鼓励学生提出自己的观点。
7. 总结:对本节课的内容进行归纳总结,强调蛋白质在生物体中的重要性。
8. 作业:布置相关练习题,巩固所学知识。
五、教学评价1. 观察学生在课堂上的参与程度,了解学生对蛋白质结构与功能的掌握情况。
2. 分析学生的作业完成情况,评估学生对课堂所学知识的掌握程度。
3. 通过课后访谈或小组讨论,了解学生对蛋白质知识在实际生活中的应用能力。
4. 综合评价学生的学习效果,为后续教学提供参考。
六、教学内容1. 蛋白质的组成元素2. 蛋白质的基本单位——氨基酸3. 氨基酸的分类及特点4. 氨基酸的脱水缩合反应5. 蛋白质的合成——翻译过程七、教学方法1. 采用问题驱动的教学方法,引导学生主动探究蛋白质的组成元素。
《蛋白质的结构和功能》说课稿

《蛋白质的结构和功能》说课稿《蛋白质的结构和功能》说课稿一、说教材《蛋白质的结构和功能》是必修1第2章第2节的内容,属于“课程标准”必修部分——生物1:分子与细胞的相关内容。
《蛋白质的结构和功能》一课的内容主要包括了蛋白质的元素组成,基本组成单位氨基酸、氨基酸的结构通式、脱水缩合方式、蛋白质的功能等内容。
在本节课之前,学习了糖类和脂质,以及元素的相关知识,为本节课的学习打下了基础。
另外,本节课的学习又为后面学习核酸、酶的相关知识做铺垫。
因此本节课起到了承上启下的作用。
二、说学情高中学生已具备了一定的观察和认知能力,分析思维的目的性,连续性和逻辑性也已初步建立,但还很不完善,对事物的探索好奇,又往往具有盲目性,缺乏目的性,并对探索科学的过程与方法及结论的形成缺乏理性的思考。
因此,对于本节课抽象的知识的学习有一定难度。
在教学过程中应采用一些图片等直观的教学方式,帮助学生对本节课知识的理解和掌握。
三、说教学目标1.理解DNA半保留复制实验,概述DNA分子的复制。
2.通过讨论交流DNA半保留复制的实验和DNA复制过程,提高语言表达能力和逻辑思维能力。
3.探讨DNA复制的生物学意义;体会证明半保留复制的实验的巧妙之处。
四、说教学重难点基于以上对教材、学情的分析和教学目标的设立,我将本节课的教学重点确定为说出氨基酸的结构特点;概述蛋白质的结构与功能。
其中说明氨基酸的脱水缩合方式是本节课的难点。
五、说教法学法为了突出重点,突破难点,顺利达成教学目标,我将采用直观教学法、讨论法、讲授法相结合的教学方式来激发学生对新知的学习兴趣。
在学法上,我贯彻的指导思想是“教师为主导,学生为主体”,把“学习的主动权还给学生”。
所以我采用的学习方法是:自主探究法、合作交流法、观察归纳法。
六、说教学过程1.导入新课首先是导入环节,采用复习导入的方式导入。
引导学生思考以下问题:1.前面学过的糖类由哪些元素组成?可分为几类?有什么功能?2.脂质有哪些种类和功能?学生通过思考得出答案。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
结构单位:20种L-α氨基酸(芳香族、含硫、酸性、碱性氨基酸等)
一级结构:肽键;多肽链;N端C端 二级结构:稳定力(氢键);类型(螺旋,折叠,转角,无规卷曲) 三级结构特点 四级结构特点
肽链
:
多肽
一条多肽链盘曲折叠形成蛋白质 多条多肽链盘曲折叠形成蛋白质
四、氨基酸在蛋白质分子中的连接方式
1、肽键
肽键(peptide
bond):一个氨基酸
的羧基与另一氨基酸
的氨基缩水而成的酰
胺键称为肽键。
(…CONH…)
氨基酸的连接
H H N
H O C C OH H R´
H H O N C C OH R ´´
长度缩短:球形、椭球形、杆状,等 多数同时含有α-螺旋和β-折叠 次级键维系:疏水键、盐键、氢键、范德华力、二硫键 功能区:表面或特定部位
(三)四级结构(quarternary structure)
具有二条或二条以上独立三级结构的多肽链 组成的蛋白质,其多肽链间通过次级键相互组 合而形成的空间结构称为蛋白质的四级结构
3、紫外吸收: Trp、Tyr和 Phe在280nm波 长附近具有最大 吸收峰,其中 Trp的最大吸收 最接近280nm
4、显色反应: 茚三酮反应
最大吸收峰在 570nm波长处, 其大小与氨基 酸的含量成正 比,因此可作 为氨基酸定量 分析方法
氨基酸如何一步步组成蛋白质? 氨基酸 二肽
三肽
()结絮:变性蛋白质的絮状沉淀,沉淀可溶于强酸、
强碱
(3)凝固:沉淀结块,凝块不溶于强酸、强碱
5、呈色反应:
Folin-酚试剂反应 蛋白质分子中含有一定量的酪氨酸残基,其中的酚 基在碱性条件下与酚试剂的磷钼酸及磷钨酸还原成蓝色 化合物。
6、紫外吸收
• 蛋白质分子中含有色氨酸、酪氨酸和苯 丙氨酸残基,这些氨基酸的侧链基团具 有紫外光吸收能力,最大吸收峰在在 280nm 处,故通过对280nm 波长的紫外 吸光度的测量可对蛋白质溶液进行定量 分析。
氨基酸的数目不同,构成的肽链不同
氨基酸的排列次序不同,构成的肽链不同
肽链的数目和空间结构不同,构成的蛋白质不同
第二节 蛋白质的分子结构
一、蛋白质的一级结构(primary structure)
一级结构是指蛋白质的多肽链中氨基酸的排列顺
序;主要靠肽键维系。
二~四级结构称为蛋白质的空间结构,或空间构
3、氧化供能
第一节 蛋白质的分子组成
一、元素组成
1、主要元素:碳、氢、氧、氮和硫,有些蛋白
质还含有少量磷和金属元素。
2、特点:各种蛋白质的含氮量很接近,平均含
氮量为16%。
3、定氮法测定蛋白质含量:
蛋白质含量=6.25×样品含氮量
我们吃富含蛋白质的食物,食物中的蛋白质能被直接吸收到
人体作为人体内的蛋白质来行使生活活动的功能吗?
n H2O
多肽:由多个氨基酸分子缩合而成的,含有多个肽键的化合物
根据下面图解,回答问题:
三 肽化合物;含_____ 两 个肽键。 (1)该图示_____
(2)填写虚线框内结构的名称:A._____ B.____C._____
氨基
肽键
羧基
(3)生成此化合物的反应叫________。
缩合
2、肽与多肽
每个肽分子都有一 个游离的α-NH2末 端称氨基末端或N端, 和一个游离α-COOH 末端称羧基末端或C 端
3、生物活性肽:
谷胱甘肽(GSH)
神经肽:脑啡肽、内啡肽、强啡肽、P物质、Y肽
肽类激素:催产素、加压素等
其他:生长因子;短杆菌S;甜味肽等
蛋白质结构的多样性
氨基酸的种类不同,构成的肽链不同
二级结构的主要形式
1、α-螺旋(α-helix)
右手螺旋:3.6个AA/
圈,螺距0.54nm;
氢键维系:链内氢键,
平行长轴;
侧链伸出螺旋
C
N
0.54nm 3.6残基
-螺旋模型图
2、β-折叠(β-pleated sheet)
多肽链充分伸展,肽平面折叠成锯齿状; 侧链交错位于锯齿状结构的上下方; 氢键维系:氢键的方向垂直长轴; 可有顺平行片层和反平行片层结构。
②极性、中性氨基酸(不带电荷的极性R基氨基酸) : Ser, Thr(含羟基);Tyr, Trp(芳香族); Cys(含硫);Gln, Asn(含酰氨) ③酸性氨基酸(含有两个羧基):
Glu(含γ羧基)、Asp(含β羧基)
④碱性氨基酸(含有两个以上氨基):
三、氨基酸的理化性质
1、物理性质 2、两性解离 等电点(isoelectric point, pI):在某一pH环 境中,氨基酸解离成阳性离子及阴性离子的趋势 相等,所带净电荷为零,在电场中不泳动。此时, 氨基酸所处环境的pH值称为该种氨基酸的等电点 (pI)。
①利用变性:
酒精消毒
高压灭菌
②防止变性:低温保存生物制品
③取代变性:乳品解毒(用于急救重金属中毒)
4、蛋白质的沉淀(precipitation) 蛋白质分子凝聚从溶液中析出的现象称为蛋 白质沉淀
蛋白质在溶液中维持稳定的因素: 表面电荷、水化层(溶剂化层) 变性蛋白不一定沉淀,沉淀蛋白也不一定变性 (1)沉淀:不稳定蛋白质从溶液中析出
头大, 嘴小, 浮肿, 低烧。
我们非常缺蛋白
蛋白质-英文为“Protein”——第一重要.
生老病死,万物轮回(蛋白质层次)
• 生(诞生、生长):在蛋白质(酶)控制(催化)下 的老细胞计划性凋亡和新细胞的再生(细胞新陈代谢 )、活细胞物质的代谢。 • 老? • 蛋白质功能的普遍衰退(?)。 • 病——个别蛋白质的功能障碍。 • 死? • 蛋白质功能的全部停止。 • 蛋白质是生命的物质基础,没有蛋白质就没有生命。
• 技能要求:
• 通过蛋白质理化性质的学习加深对一些生活和临床、科研现象的理解 。
• 素质要求:
• 通过蛋白质结构与功能关系的理论,解释一些临床疾病现象(如镰刀 状红细胞贫血、疯牛病、老年痴呆症等)。
知识体系
• 任务一 蛋白质的分子组成 • 任务二 蛋白质的分子结构 • 任务三 蛋白质的理化性质
我们体内有丰富 的蛋白质
变性的本质: 分子中各种次级键断裂,使其空间构象从紧密有 序的状态变成松散无序的状态,一级结构不破坏。 蛋白质变性后的表现: (1)生物学活性消失 (2)理化性质改变:溶解度下降,粘度增加,紫外 吸收增加,侧链反应增强,对酶的作用敏感,易被水 解。
(2)复性:去除变性因素回复原来结构与功能
(3)应用
H H O H N C C R OH H
H H O N C C OH R
脱水缩合反应
肽键
H O C C R
二肽
H
H N
H H O N C C OH R
OH H
H2O
三肽
H
H
O
H
H
N
C C R1
N
H C R2
O H H C OH H N C COOH R3 H 2O
多肽
O H H R1 O H H R2 O H H R3 O H H R4 O H C-N- C- C- N- C- C-N- C- C-N- C- C-N
(一)一级结构与功能的关系
1、一级结构中的保守序列决定空间结构
(1)不同蛋白质之间的比较:相似结构相似功能、不同结 构不同功能 (2)同一蛋白质不同状态的比较:一级结构决定空间结构 【经典举例】酶原激活、分子病、蛋白变性与复性 (3)保守序列、保守氨基酸改变,功能改变;保守氨基酸 不变,功能不变 【经典举例】分子病
食物中蛋白质
消 化
氨基酸
吸收
组织细胞中氨基酸
蛋白质的基本单位 ---氨基酸。
人体内蛋白质
合 成
二、结构单位——氨基酸(amino acid)
(一)蛋白质的结构单位
H O ︱ ‖ H2N —C— C—OH ︱ H 甘氨酸
H O ︱ ‖ H2N —C— C—OH ︱ CH
3
缬氨酸
H O ︱ ‖ H2N —C— C—OH ︱ CH
亚基(subunit):寡聚蛋白中的单条独立的多肽链,具有独 立的一、二、三级结构,单独存在时一般无生物学活性。亚 基之间以非共价键联系,亚基可以相同或不同。
亚基之间以非共价键联系,包括疏水键(主要)、盐键、
氢键、范德华力。 亚基可以相同或不同。
三、蛋白质结构与功能的关系 蛋白质一级结构是空间结构和生物 功能的基础,一级结构决定空间结 构;但一级结构并非决定空间结构 的唯一因素。空间结构是生物活性 的直接体现。
任务四、蛋白质的分类
1、按照组成分类:单纯蛋白、结合蛋白 单纯蛋白:只有氨基酸组分 结合蛋白:氨基酸组分+其他组分(辅基) 2、按照生物功能分类:酶、调节蛋白、转运蛋白、
运动蛋白、防御蛋白、营养蛋白、储存蛋白、结构蛋白、 毒蛋白,等
3、根据形状分类 纤维蛋白 球状蛋白
小结:
1、重要名词:等电点;一级结构;空间结构; 亚基;蛋白质变性; 2、结构层次
蛋白质溶液有胶体溶液的性质,如:扩散 慢、易沉降、 粘度大、不能透过半透膜,在 + ++ + ++ + + + 水溶液中可形成亲水的胶体。 + + + + + + + + + 蛋白质胶体溶液的稳定因素:水化膜、带 + ++ + 电荷。当破坏这两个因素时,蛋白质中从溶液+ + + + + 中析出而产生沉淀。
“氨基酸”代表了氨基酸分子结构中主要的部分-----氨基和羧基. 氨基酸分 子通式 羧基
